2. 中国科学院南京土壤研究所, 南京 211135;
3. 南京大学环境学院, 南京 210023;
4. 生态环境部南京环境科学研究所, 南京 210042
自然过程和工业生产活动产生大量含As的废气、废水、废渣,它们通过干湿沉降、污水排放等方式进入土壤,引起As污染问题。根据2014年《全国土壤污染状况调查公报》[1],我国土壤As点位超标率为2.7%[2]。高As地下水的灌溉以及含As农药化肥的使用进一步加剧了农田土壤As污染,其中稻田土壤As含量远高于旱地土壤[3]。有研究报道,As在稻田中以溶解态、吸附态、有机质结合态、铁锰铝矿物结合态、硫化物结合态和残渣态等形式存在,其生物有效性取决于其赋存形态。一般认为溶解态和吸附态的As具有较高的生物有效性,容易被植物吸收,有机质结合态和弱结晶型矿物结合态As在一定条件下也可转化成为有效态As;而强结晶型矿物结合态和残渣态As的生物有效性最低,难以发生转化,不易进入土壤溶液[4]。高浓度As会降低土壤肥力,影响作物生长,并会随着植物吸收累积和食物链传递而危害人体健康[5]。因此,探明As在土壤中的赋存形态和转化规律,对于As的环境风险控制具有重要环境意义。
Fe是土壤中重要的活性元素,其氧化还原循环对As的赋存形态变化有重要影响。由于As与Fe之间有较强的亲和力,土壤中大部分As都被吸附在铁矿物表面或者生成Fe、As共沉淀矿物[6-7]。在含Fe矿物还原溶解过程中吸附和共沉淀的As则被释放到土壤溶液中;同时还原态铁矿物被氧化后能促进活性铁物种或活性氧物种(ROS)生成,这些活性物质能显著促进As(Ⅲ) 的氧化和固定[8-9]。稻田土壤发生频繁的氧化还原变化(淹水和排干交替过程),导致Fe和As的赋存形态发生转化。在淹水阶段,稻田土壤中氧气逐渐耗尽,部分微生物只能以土壤无机组分作为呼吸链末端电子受体,分解有机质完成生命代谢过程,其中异化铁还原菌和硫酸盐还原菌较为常见[10-11]。异化铁还原菌还原溶解铁矿物的过程中,释放出大量与铁矿物结合的As;硫酸盐还原菌还原硫酸盐生成S2–,反而使As、Fe硫化物的生成量增加。在排干阶段,氧气浓度逐渐增加,导致还原态Fe被氧化,这个过程将促进As的氧化和固定[7]。
畜禽和水产养殖业大量使用抗生素,用于疾病预防和提高品质,但进入生物体的抗生素只有少量能吸收利用,大部分会随排泄物进入环境,进而通过有机肥的施用进入土壤。四环素类抗生素(TCs)分子结构中有多个羟基官能团,能够与土壤组分形成氢键,易于被土壤颗粒吸附,以较高的浓度残留在土壤中[12]。因此在施用有机肥或者调理剂的土壤中,TCs和As是最常见的两类复合污染物。例如上海某养殖场周边稻田土壤中TCs和As检出浓度分别为4.54 ~ 24.66 mg/kg和2.6 ~ 617.2 mg/kg[13];北京等三地区36个土壤样本中TCs和As检出浓度分别为0.78 ~ 15.20 mg/kg和未检出~ 10.0 mg/kg[14];浙江省部分养殖场周边稻田土壤中TCs和As检出浓度分别为0.52 ~ 16.28 mg/kg和0.8 ~ 200.0 mg/kg[15]。
TCs对常见的革兰氏阳性菌、革兰氏阴性菌、支原体和衣原体之类的微生物等有较强的抑制效果,能影响土壤中微生物群落分布[16]。由于微生物在稻田土壤淹水过程中对Fe、As的形态转化具有重要作用,因此TCs作为抑菌剂或者杀菌剂,能够通过改变铁还原菌、硫酸盐还原菌等微生物的种类或者丰度,影响铁矿物或者硫酸盐的还原,进而影响Fe、As的形态转化。另外根据本课题组前期的研究结果,TCs具有还原性,它们能够还原游离态Fe(Ⅲ)、无定形铁氧化物,并生成的ROS显著促进As(Ⅲ) 的氧化和固定[17-18]。基于TCs的多重作用,研究其在实际土壤中对铁矿物还原和As转化的影响有重要的环境意义。
本研究选取湖南省湘潭市某稻田土壤作为供试土壤,进行微宇宙培养试验,模拟水稻生长阶段的淹水–排干过程,探究TCs在此过程中对Fe、As氧化还原转化的影响。测定培养过程中土壤pH,氧化还原电位(Eh),溶解态Fe(Ⅱ)、Fe(Ⅲ) 和As(Ⅲ)、As(Ⅴ) 的变化;采用连续提取的方式,提取并测定培养前后土壤固相中不同形态Fe和As的转化。使用灭菌后的土壤进行相同的淹水培养,确定氧四环素(OTC) 对土壤铁矿物的化学还原作用;测定未灭菌土壤淹水培养后微生物群落多样性变化,分析OTC对微生物群落分布的影响,以期从化学还原作用和对微生物过程的影响两个方面阐明OTC在稻田土壤淹水–排干过程中对Fe、As形态转化的影响机制。
1 材料与方法 1.1 供试材料供试土壤采集于湖南省湘潭市(27°44′25″N、112°52′6″E)某水稻田表层土(0 ~ 20 cm)。将土壤自然风干、剔除异物、碾碎和研磨、过筛,其基本理化性质为pH 5.72,阳离子交换量11.75 cmol/kg,有机质含量24.90 g/kg,总Fe含量24.02 g/kg,总As含量56.40 mg/kg。试验中氯化钙、乙二胺四乙酸二钠、柠檬酸、柠檬酸钠、磷酸氢二钠、焦磷酸钠、盐酸羟胺、氢氟酸、乙酸、草酸铵和苯甲酸等均为分析纯,购自国药集团化学试剂有限公司;甲醇和乙腈为色谱纯,购自上海阿拉丁生化科技股份有限公司;盐酸、硫酸和硝酸均为优级纯,购自南京化学试剂股份有限公司。
1.2 试验设置称取4 g土壤样品于40 mL棕色西林瓶中,分别加入10 mL不同浓度OTC溶液,使其在土壤中的浓度分别为0、10、25和50 mg/kg,记作OTC-0、OTC-10、OTC-25和OTC-50。使用PTFE垫片和铝盖对西林瓶进行密封处理,避光放置在振荡箱中培养21 d(150 r/min,25℃ ± 1℃,厌氧培养阶段)。土壤厌氧培养结束后,将西林瓶开盖,使用多孔透气膜(< 0.2 μm)封口,在保证与外界气体交换的同时可避免微生物污染,继续避光放置在振荡箱中培养9 d(好氧培养阶段)。采用破坏性取样的方式,在第0、3、6、9、15、21天和第24、27和30天,每一组处理取出3个样品瓶,开盖后立即测定土壤Eh和pH。随后将土壤离心过0.22 μm滤膜,测定上清液中Fe(Ⅱ)、Fe(Ⅲ) 和As(Ⅲ)、As(Ⅴ) 浓度,记作溶解态Fe和As。将第0、21和30天的土壤悬液离心后的固体冷冻干燥,提取土壤中不同形态Fe(Ⅱ)、Fe(Ⅲ)、As(Ⅲ)、As(Ⅴ) 以及残留的OTC,并进行测定。
1.3 提取方法 1.3.1 土壤OTC提取准确称取1.0 g土壤样品于20 mL玻璃离心管中,加入2.5 mL纯甲醇和2.5 mL EDTA-Mcllvaine缓冲溶液(0.1 mmol/L Na2EDTA + 0.2 mmol/L磷酸氢二钠+ 0.06 mmol/L柠檬酸,pH = 4.0);涡旋1 min使土壤与提取剂混合均匀,然后超声15 min,使用4 000 r/min离心,收集上清液过0.22 μm水系滤膜;重复以上提取步骤3次,将收集的上清液定容至100 mL。使用Poly-sery HLB色谱柱(2.CA3154.0001,500 mg,6 mL)对收集液体进行纯化和富集[19]。
1.3.2 土壤中不同形态Fe提取使用分级提取的方法提取土壤中不同形态Fe[20]。为去除溶解氧,所有提取剂在实验前均使用99.99% 的氮气吹扫1 h以上,以保证提取过程中Fe(Ⅱ) 不被氧化。具体步骤如下:准确称取0.200 0 ± 0.000 2 g土壤,加入5 mL氯化钙溶液(1 mol/L)振荡提取2 h(200 r/min),4 000 r/min离心,过0.22 μm滤膜,加入0.1 mol/L的HCl溶液后保存,记作可交换态Fe;上一步离心所得固体使用5 mL盐酸溶液(0.5 mol/L)分散,振荡提取2 h,离心过滤,记作吸附态/弱结晶型矿物态Fe;上一步离心固体使用5 mL盐酸溶液(5 mol/L)分散,振荡提取24 h,离心过滤,记作强结晶型矿物态Fe;上一步离心固体使用1.3 mol/L氢氟酸和1.8 mol/L硫酸溶液分散,振荡提取24 h,离心过滤,记作硅酸盐矿物态Fe。
1.3.3 土壤中不同形态As提取使用分级提取的方法连续提取土壤中不同形态As。相应的提取剂和提取条件如表 1。该方法中所用的提取剂可以保证提取过程中As的形态不发生改变,并且提取率大于90%[21]。
|
|
表 1 土壤中As的连续提取 Table 1 Sequential fractionation procedures for As speciation in soil |
将1 mL厌氧培养21 d后的土壤悬液离心(4 ℃,14 000 r/min, 1 min)后冷冻干燥处理。使用OMEGA Soil DNA Kit试剂盒(OMEGA,美国),按照说明书要求和具体步骤提取土壤微生物总DNA,使用引物515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和907R(5’-CCGTCAATTCMTTTRAGTTT-3’)扩增微生物16S rRNA基因的V4 ~ V5区。使用Illumina平台对群落DNA片段进行双端(Paired-end)测序,使用QIIME2 (2019.4) 分析软件进行质控、去噪、拼接、去嵌合体,选用Greengenes数据库进行物种注释。测序工作在南京派诺森基因科技有限公司进行。每个OTC浓度处理设置4个平行样品。
1.4 分析方法采用氢化物发生–原子荧光分光光度法(HG-AFS,BAF-2000,北京宝德仪器有限公司,中国)分析样品中As的浓度。对样品中的As(Ⅲ) 测定前,首先使用0.4 mol/L柠檬酸缓冲溶液(pH = 4.5)稀释样品。柠檬酸盐可以屏蔽测定过程中As(Ⅴ) 对As(Ⅲ) 信号的干扰。使用质量分数为2% 的KBH4溶液(配制在0.5% NaOH溶液中)作为还原剂、0.1 mol/L柠檬酸缓冲溶液(pH = 4.5)作为载流剂将体系中的As转化为AsH3,并使用氩气(99.99%)作为载气,将AsH3送入石英炉芯原子化器,被火焰原子化后进行后续检测。对样品中总As测定前,首先使用体积分数为5% 的盐酸溶液稀释样品,并加入硫脲–抗坏血酸溶液(质量分数0.5%)作为还原剂,将样品中的As(Ⅴ) 还原为As(Ⅲ)。将载流剂替换为5% 的盐酸溶液,其他测定步骤同As(Ⅲ)。
采用Agilent 1200高效液相色谱(HPLC)分析样品中OTC浓度,配备二极管阵列检测器(DAD)和反相LC-18色谱柱(25 cm × 4.6 mm,5 μm)。流动相为20% 乙腈溶液和80% 草酸溶液(10 mmol/L),流速为0.8 mL/min,检测波长为365 nm[22]。
采用邻菲罗啉–紫外分光光度法(UV-2700,Shimazu Co. Ltd,日本)分析样品中Fe的浓度。将0.35 mL的样品溶液与0.05 mL醋酸–醋酸盐缓冲液(pH = 4.6)、0.05 mL邻菲罗啉溶液(PHE)、0.05 mL NaF溶液混合,显色15 min后,在510 nm的波长下测定紫外吸收光度的变化。NaF溶液中的F-能够与Fe(Ⅲ) 形成强络合物,这可以减少测定过程中邻菲罗啉对Fe(Ⅲ) 的还原和对Fe(Ⅱ) 测定的干扰。总Fe的测定与Fe(Ⅱ)相似,将NaF溶液替换为质量分数为10% 的盐酸羟胺溶液,还原Fe(Ⅲ) 为Fe(Ⅱ) 后测定。Fe(Ⅲ) 的浓度为总Fe和Fe(Ⅱ) 浓度的差值[23]。
1.5 数据处理所有数据采用Orgin 94 (2017)处理与作图。采用SPSS 20.0对数据进行单因素方差分析(one-way ANOVA model),以P < 0.05(Duncan test)为统计显著性标准。
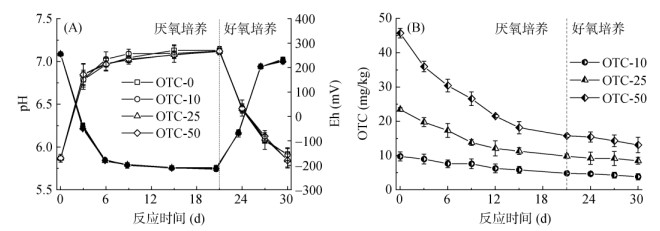
2 结果与讨论 2.1 稻田土壤培养过程中pH、Eh变化及OTC转化土壤在培养过程中pH和Eh随时间的动态变化如图 1A所示。在厌氧培养的第3天,土壤pH升高至近中性条件(6.78 ~ 6.84),之后缓慢升高至中性偏碱性(7.12 ~ 7.13);土壤Eh则迅速降低至-200 mV左右。氧气条件恢复后,土壤pH和Eh恢复至初始状态。这与稻田土壤淹水–排干过程中pH和Eh随时间的动态变化是一致的[24]。其中不同浓度OTC处理的土壤与对照土壤相比,pH和Eh的变化趋势相同。
|
(图 1A中空白图标为pH变化,实心图标为Eh变化) 图 1 土壤培养过程中pH、Eh(A)和OTC(B)动态变化 Fig. 1 Temporal changes of soil pH, Eh (A) and OTC (B) during incubation |
对土壤中残留的OTC进行提取,测定其转化情况。结果表明,经过21天的厌氧培养,在OTC-10、OTC-25和OTC-50土壤中其转化率分别为51.8%、60.7% 和68.5%(图 1B);好氧培养期间,OTC也有一定的转化;培养结束后,其转化率分别增加至61.9%、68.3% 和73.9 %。
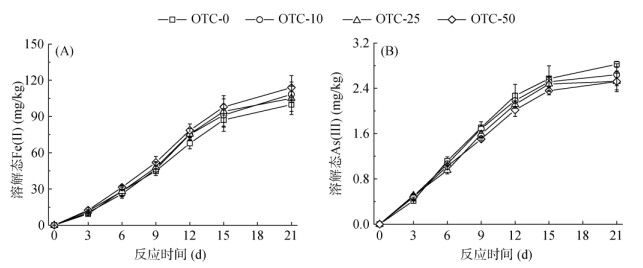
2.2 OTC对稻田土壤Fe、As形态转化的影响 2.2.1 OTC对稻田土壤厌氧过程中Fe、As形态转化的影响随着土壤Eh下降,铁矿物中Fe(Ⅲ) 被还原为Fe(Ⅱ),部分以Fe2+的形式释放到土壤溶液中。由图 2A可知,溶解态Fe(Ⅱ) 含量随着厌氧培养时间的延长逐渐增加,第3天时对照土壤中Fe(Ⅱ) 含量为9.5 mg/kg;厌氧培养21天后,溶解态Fe(Ⅱ) 含量可达99.9 mg/kg。OTC的加入显著促进了土壤中溶解态Fe(Ⅱ) 的增加,OTC-10、OTC-25和OTC-50土壤中溶解态Fe(Ⅱ) 含量相比对照土壤分别提高了8.4%、5.4%、14.1%。
|
图 2 土壤厌氧培养过程中溶解态Fe(Ⅱ) 和As(Ⅲ) 变化 Fig. 2 Changes of aqueous Fe(Ⅱ) and As(Ⅲ) during anoxic soil incubation |
对照土壤厌氧培养21 d后,可交换态、吸附态/弱结晶型矿物态、强结晶型矿物态和硅酸盐矿物态Fe(Ⅱ) 的含量为34.7、1 443.1、2 494.7和1 953.0 mg/kg (表 2),分别占相应形态总Fe含量的81.4%、40.4%、18.2% 和25.1%,这说明土壤中可交换态和吸附态/弱结晶型矿物态Fe被大量还原。OTC存在的情况下,土壤中可交换态Fe(Ⅱ) 含量显著增加,其中OTC-10、OTC-25和OTC-50土壤中Fe(Ⅱ) 相比于对照土壤分别提高了19.8%、26.5% 和32.3%;吸附态/弱结晶型矿物态Fe(Ⅱ) 也显著增加,OTC-25和OTC-50土壤中Fe(Ⅱ) 相比于对照土壤分别提高了13.3% 和25.9%。对于强结晶型矿物态Fe和硅酸盐矿物态Fe,OTC对其形态转化没有显著影响。
|
|
表 2 土壤培养期间不同形态Fe含量的变化 Table 2 Concentration changes of different Fe forms during incubation |
铁矿物的还原溶解通常伴随着吸附态或者共沉淀态As的释放,并且在微生物作用下大多数As(Ⅴ) 被还原为As(Ⅲ)。第21天时,其溶解态As(Ⅲ) 在对照土壤的含量为2.82 mg/kg,占总溶解态As含量的71.9%(图 2B)。因为OTC能够促进土壤铁矿物的还原,因此在有OTC存在的土壤中,溶解态As的含量应高于对照土壤,但是OTC-25和OTC-50土壤中溶解态As(Ⅲ) 含量反而低于对照土壤(图 2B)。可能是因为OTC处理土壤后,促进了土壤中溶解态As向固相As的转化。因此进一步对土壤进行连续提取,测定固相As的形态转化。
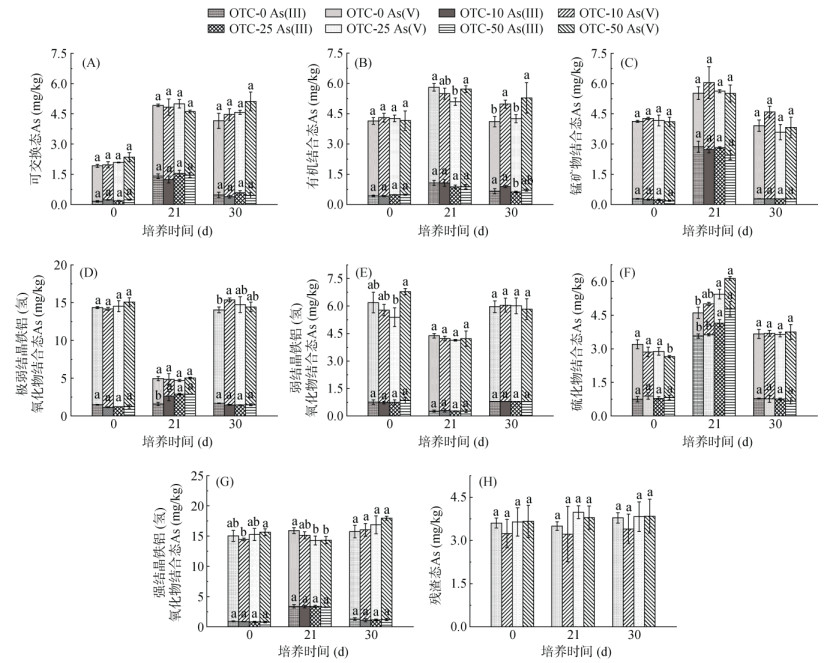
如图 3所示,厌氧培养期间不同浓度OTC处理的土壤中,可交换态(图 3A)、有机质结合态(图 3B)和锰矿物结合态(图 3C)As(Ⅲ) 和As(Ⅴ) 含量均有不同程度的增加。这是不同晶态铁矿物还原溶解释放的As(Ⅴ) 和其还原生成的As(Ⅲ) 在土壤不同组分间重新分配的结果,但是不同浓度OTC处理土壤与对照土壤相比,没有显著差异。极弱结晶型铁铝(氢)氧化物结合态和弱结晶型铁铝(氢)氧化物结合态总As含量分别降低了64.2% 和21.8% 以上,这与弱结晶铁矿物的减少是一致的。此外,极弱结晶型铁铝(氢)氧化物结合态As(Ⅴ) 的含量大大降低,而As(Ⅲ) 的含量显著提高(图 3D)。这说明在稻田淹水厌氧的过程中,主要是这种形态的As(Ⅴ) 首先被还原为As(Ⅲ)。强结晶型铁铝(氢)氧化物结合态总As含量基本不变,部分As(Ⅴ)(15.5% ~ 17.5%)被还原为As(Ⅲ)(图 3G)。残渣态As与土壤结合力强,在土壤中活性最低,因此在厌氧培养前后变化不显著(图 3H)。
|
(图中小写字母不同表示同一培养时间同一价态As在不同处理间差异达P < 0.05显著水平) 图 3 土壤培养期间不同形态As含量的变化 Fig. 3 Concentration changes of different As forms during incubation |
硫化物结合态As含量的变化与以上几种固相As不同,OTC的加入显著促进As硫化物的增加(图 3F)。厌氧培养结束后,对照土壤中硫化物结合态As(Ⅲ) 和总As的含量分别为3.57 mg/kg和4.60 mg/kg,而OTC-50土壤中,硫化物结合态As(Ⅲ) 和总As含量为4.79 mg/kg和6.14 mg/kg,分别提高了34.2% 和33.5%。
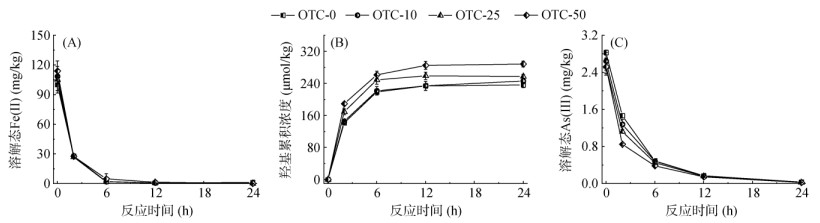
2.2.2 OTC对稻田好氧过程中Fe、As形态转化的影响在好氧培养阶段,土壤中溶解态Fe(Ⅱ) 被迅速氧化为Fe(Ⅲ),因此在氧气恢复后的第6 h,土壤中已几乎测不到溶解态Fe(Ⅱ) 和Fe(Ⅲ) 存在(图 4A)。可交换态和吸附态/弱结晶型矿物态Fe(Ⅱ) 也被大量氧化,好氧培养结束时,其含量相较于厌氧培养阶段分别降低了87.8% ~ 90.8% 和57.6% ~ 66.9%,强结晶型矿物态和硅酸盐矿物态Fe(Ⅱ) 也分别有19.1% ~ 27.3% 和10.1% ~ 17.4% 被氧化(表 2)。溶解态和可交换态Fe(Ⅱ) 被氧化后生成Fe(Ⅲ) 会吸附在土壤矿物表面,或者水解老化,向弱结晶型矿物态Fe转化。因此在好氧培养结束时,溶解态和可交换态总Fe含量大大减少,而吸附态/弱结晶型矿物态总Fe含量增加,强结晶型矿物态和硅酸盐矿物态总Fe含量在整个培养期间没有明显变化。在好氧培养结束后,不同形态的Fe(Ⅱ) 和总Fe含量在4个处理土壤中均没有显著性差异,说明OTC对Fe(Ⅱ) 的氧化过程无显著性的影响。
|
图 4 土壤好氧培养过程中溶解态Fe(Ⅱ) 变化(A)、·OH的生成(B) 和溶解态As(Ⅲ) 变化(C) Fig. 4 Changes of aqueousFe(Ⅱ) (A), formation of ·OH (B) and aqueous As(Ⅲ) (C) during aerobic incubation |
在沿河海岸带和稻田土壤等氧化还原条件波动比较大的环境中,淹水阶段产生的还原态Fe(Ⅱ) 在氧气条件恢复后,会与O2反应生成·OH,促进有机质分解或者污染物转化[25]。使用苯甲酸作为分子探针,测定土壤好氧培养过程中·OH生成情况。如图 4B所示,在好氧阶段的前2 h,即有148.1 ~ 182.5 μmol/kg的·OH生成,24 h后·OH累积浓度分别为235.9、245.8、257.1和288.1 μmol/kg。其中,OTC-25和OTC-50土壤中·OH含量显著高于对照土壤,分别提高了9.4% 和22.6%。由2.2.1可知,OTC处理土壤中溶液态、可交换态、吸附态/弱结晶型矿物态Fe(Ⅱ) 含量要显著高于对照土壤。因此,在好氧阶段,Fe(Ⅱ) 氧化产生的·OH含量也高于对照土壤。
如图 4C所示,在好氧培养阶段,土壤中溶解态As(Ⅲ) 在前6 h内被快速氧化,24 h后土壤中已无溶解态As(Ⅲ) 检出。由于OTC处理的土壤在好氧阶段生成更多的·OH,能够促进As(Ⅲ) 的氧化,因此溶解态As(Ⅲ)的氧化速率在OTC-25土壤(0.278 h–1)和OTC-50土壤(0.298 h–1)中显著高于对照土壤(0.260 h-1)。固相各形态As(Ⅲ) 的氧化受OTC影响较小,在好氧培养结束后4个处理土壤中As(Ⅲ) 和As(Ⅴ)含量无显著差异(图 3)。
2.3 OTC对稻田土壤Fe、As形态转化的影响机制 2.3.1 OTC对稻田土壤铁矿物的化学还原使用灭菌后的土壤进行相同的厌氧培养,以排除微生物对铁矿物还原的影响,探究TCs对土壤铁矿物的化学还原作用。如表 3所示,厌氧培养21d后对照土壤中溶解态Fe(Ⅱ)含量为2.8 mg/kg,占总溶出Fe含量的93.2%。OTC的加入显著促进了Fe的还原溶出,OTC-50土壤中溶解态Fe(Ⅱ) 含量为3.2 mg/kg,相较于对照土壤提高了13.4%。虽然土壤淹水过程中铁矿物的还原主要是微生物作用,但是土壤中某些多酚、硫醇和小分子有机酸等,具有氧化还原活性,能够与铁矿物发生相互作用,诱导铁矿物的还原溶解[26]。TCs作为外源污染物具有与小分子有机质相似的作用[17-18],因此能够显著促进土壤铁矿物的还原。此外根据已有研究,其他多种抗生素或者有机污染物等也能够促进铁矿物的氧化还原转化[27]。在微生物活动较弱的土壤中,这些有机质和外源有机污染物在土壤Fe循环过程中可能发挥重要作用。
|
|
表 3 灭菌土壤厌氧培养后不同形态Fe(Ⅱ) 生成情况 Table 3 Formation of Fe (Ⅱ) with different forms after anoxic incubation |
TCs能够影响多种微生物生长,测定OTC加入后土壤微生物群落多样性的变化。16个土壤样本共得到1 140 739对高质量16S rRNA基因序列,样品序列数量范围为58 843 ~ 81 191。其中大多数序列长度集中在370 ~ 379 bp。以97% 的相似度划分,共得到68 901个OTU,每个样品平均有4 306个OUT。
主坐标分析(Principal coordinates analysis, PCoA)的结果表明,不同浓度OTC处理土壤中微生物群落组成明显聚集,其中,OTC-10土壤与对照土壤无显著性差异,OTC-25和OTC-50土壤与对照土壤距离相对较远(图 5A)。这说明低浓度OTC的加入对土壤微生物群落没有显著影响,较高浓度OTC可能会改变土壤微生物β-多样性。为了进一步探究不同处理土壤微生物群落β-多样性的差异来源,在属的水平上分析了每种土壤样品中丰度最高的10种微生物相对丰度的变化。如图 5B所示,随着OTC浓度的增加,其中有6种微生物相对丰度没有显著性变化,SC-I-84的相对丰度显著减少,而Candidatus_Koribacter、Candidatus_ Solibacter和Geobacter相对丰度则显著增加。
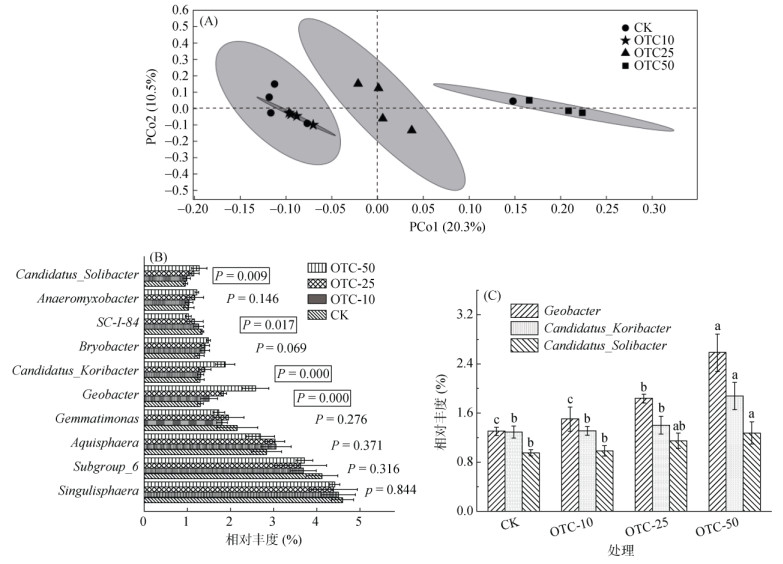
|
(图C中小写字母不同表示同一菌属不同处理间差异达P < 0.05显著水平) 图 5 不同浓度OTC处理土壤中微生物群落组成主坐标分析(A)、排名前十的微生物属组成(B)和异化铁还原菌和硫酸盐还原菌相对丰度含量(C) Fig. 5 Principal coordinates analysis of microbial compositions(A), top 10 microbial genus compositions of different soils(B) and relative abundance of dissimilatory Fe reducing bacteria and sulfate reducing bacteria (C) of soils treated by OTC |
SC-I-84是一种厌氧氨氧化菌,能够利用CO2作为碳源,将NH4+-NO3–转化为N2。Geobacter是典型的异化铁还原菌,属于δ变形菌纲,是严格厌氧菌[28]。它在缺氧或者厌氧的条件下,能够以简单有机物作为电子供体,以铁矿物中Fe(Ⅲ) 为电子受体,将Fe(Ⅲ) 还原为Fe(Ⅱ)。由图 5C可知,在OTC-10土壤中Geobacter的相对丰度提高了15.4%,而在OTC-25和OTC-50土壤中,Geobacter的相对丰度分别提高了40.8% 和121.5%。这说明OTC有助于异化铁还原菌的生长,从而通过微生物过程促进土壤铁矿物的还原。Candidatus_Koribacter和Candidatus_Solibacter都属于酸杆菌门,是酸性土壤中常见微生物,对抗生素有一定的抗性。Uddin等[29]的研究表明,克拉霉素处理之后的土壤中这两种菌的相对丰度都有增加。有研究发现,这两种菌属能够促进硫酸盐的还原[30]。稻田土壤淹水过程中硫酸盐还原菌能够将硫酸盐还原为S2-,然后与多种金属离子生成硫化物沉淀,如As2S2、As2S3和AsFeS等。如图 5C所示,在OTC-50土壤中,两种硫酸盐还原菌相对丰度相较于对照土壤分别提高了44.9% 和33.7%,这能够显著促进硫酸盐还原生成S2–,因而添加OTC的土壤在厌氧培养结束后,其硫化物结合态的As含量显著高于对照土壤。
3 结论本文通过水稻土微宇宙培养试验,探究了稻田土壤淹水–排干过程中,OTC对土壤中Fe、As氧化还原转化的影响,从化学过程和对微生物过程的影响两个方面揭示了OTC对铁矿物还原和As形态转化的影响机制。在淹水过程中,OTC可显著促进溶解态、可交换态和吸附态/弱结晶型矿物态Fe(Ⅱ) 的产生。一方面OTC可通过化学过程,直接络合和还原土壤铁矿物中Fe(Ⅲ) 为Fe(Ⅱ),另一方面OTC也能提高土壤异化铁还原菌相对丰度,促进微生物介导的异化铁还原过程。淹水阶段Fe(Ⅱ) 生成量的增加使得O2条件恢复后Fe(Ⅱ) 氧化生成更多·OH,显著加速溶解态As(Ⅲ) 的氧化。此外OTC有助于硫酸盐还原菌的生长,使得淹水阶段As的硫化物生成量增加,因而As的溶出减少。总之,稻田土壤中残留的抗生素在水稻淹水阶段能够促进铁矿物的还原,但是不会造成溶解态As(Ⅲ) 的显著增加,并且在好氧阶段能够促进溶解态As(Ⅲ) 的快速氧化,因此将能够降低水稻吸收和转运As的风险。
| [1] |
环境保护部, 国土资源部. 全国土壤污染状况调査公报[EB/0L]. [2014-04-17]. http://www.zhb.gov.cn/gkmlhbb/qt201404/t20140417_270670.
(  0) 0) |
| [2] |
钟松雄, 尹光彩, 陈志良, 等. 水稻土中砷的环境化学行为及铁对砷形态影响研究进展[J]. 土壤, 2016, 48(5): 854-862 DOI:10.13758/j.cnki.tr.2016.05.003 (  0) 0) |
| [3] |
曾希柏, 徐建明, 黄巧云, 等. 中国农田重金属问题的若干思考[J]. 土壤学报, 2013, 50(1): 186-194 (  0) 0) |
| [4] |
Ackermann J, Vetterlein D, Kuehn T, et al. Minerals controlling arsenic distribution in floodplain soils[J]. European Journal of Soil Science, 2010, 61(4): 588-598 DOI:10.1111/j.1365-2389.2010.01260.x (  0) 0) |
| [5] |
安礼航, 刘敏超, 张建强, 等. 土壤中砷的来源及迁移释放影响因素研究进展[J]. 土壤, 2020, 52(2): 234-246 DOI:10.13758/j.cnki.tr.2020.02.003 (  0) 0) |
| [6] |
Aredes S, Klein B, Pawlik M. The removal of arsenic from water using natural iron oxide minerals[J]. Journal of Cleaner Production, 2013, 60: 71-76 DOI:10.1016/j.jclepro.2012.10.035 (  0) 0) |
| [7] |
邱丽娟. 硫酸盐对土壤中砷环境行为的影响[D]. 贵阳: 贵州大学, 2019.
(  0) 0) |
| [8] |
Hua J, Fei Y H, Feng C H, et al. Anoxic oxidation of As(Ⅲ) during Fe(Ⅱ)-induced goethite recrystallization: Evidence and importance of Fe(Ⅳ) intermediate[J]. Journal of Hazardous Materials, 2022, 421: 126806 DOI:10.1016/j.jhazmat.2021.126806 (  0) 0) |
| [9] |
Liu K, Li F B, Pang Y, et al. Electron shuttle-induced oxidative transformation of arsenite on the surface of goethite and underlying mechanisms[J]. Journal of Hazardous Materials, 2022, 425: 127780 DOI:10.1016/j.jhazmat.2021.127780 (  0) 0) |
| [10] |
冯曦. 厌氧条件下土壤典型氧化还原过程对五氯酚还原转化的影响[D]. 杭州: 浙江大学, 2017.
(  0) 0) |
| [11] |
余丹. 铁氧化物异化还原驱动下的纤铁矿晶型转变及污染物降解特征与机制[D]. 西安: 西安建筑科技大学, 2016.
(  0) 0) |
| [12] |
Jia W L, Song C, He L Y, et al. Antibiotics in soil and water: Occurrence, fate, and risk[J]. Current Opinion in Environmental Science & Health, 2023, 32: 100437 (  0) 0) |
| [13] |
Ji X L, Shen Q H, Liu F, et al. Antibiotic resistance gene abundances associated with antibiotics and heavy metals in animal manures and agricultural soils adjacent to feedlots in Shanghai; China[J]. Journal of Hazardous Materials, 2012, 235/236: 178-185 DOI:10.1016/j.jhazmat.2012.07.040 (  0) 0) |
| [14] |
Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. PNAS, 2013, 110(9): 3435-3440 DOI:10.1073/pnas.1222743110 (  0) 0) |
| [15] |
Qian M R, Wu H Z, Wang J M, et al. Occurrence of trace elements and antibiotics in manure-based fertilizers from the Zhejiang Province of China[J]. The Science of the Total Environment, 2016, 559: 174-181 DOI:10.1016/j.scitotenv.2016.03.123 (  0) 0) |
| [16] |
Thiele-Bruhn S, Beck I C. Effects of sulfonamide and tetracycline antibiotics on soil microbial activity and microbial biomass[J]. Chemosphere, 2005, 59(4): 457-465 DOI:10.1016/j.chemosphere.2005.01.023 (  0) 0) |
| [17] |
Tong Y P, Wang X L, Wang X H, et al. Oxytetracycline induced the redox of iron and promoted the oxidation of As(Ⅲ)[J]. Science of the Total Environment, 2022, 828: 154381 DOI:10.1016/j.scitotenv.2022.154381 (  0) 0) |
| [18] |
Tong Y P, Wang X L, Wang X H, et al. The oxidation and immobilization of As(Ⅲ) by colloidal ferric hydroxide in the concomitant pollution of oxytetracycline[J]. ACS ES & T Engineering, 2023, 3(5): 627-637 (  0) 0) |
| [19] |
Zhan L, Xia Z W, Xu Z M, et al. Study on the remediation of tetracycline antibiotics and roxarsone contaminated soil[J]. Environmental Pollution, 2021, 271: 116312 DOI:10.1016/j.envpol.2020.116312 (  0) 0) |
| [20] |
Chen N, Huang D Y, Liu G X, et al. Active iron species driven hydroxyl radicals formation in oxygenation of different paddy soils: Implications to polycyclic aromatic hydrocarbons degradation[J]. Water Research, 2021, 203: 117484 DOI:10.1016/j.watres.2021.117484 (  0) 0) |
| [21] |
Huang J H, Kretzschmar R. Sequential extraction method for speciation of arsenate and arsenite in mineral soils[J]. Analytical Chemistry, 2010, 82(13): 5534-5540 DOI:10.1021/ac100415b (  0) 0) |
| [22] |
Chen N, Huang M Y, Liu C, et al. Transformation of tetracyclines induced by Fe(Ⅲ)-bearing smectite clays under anoxic dark conditions[J]. Water Research, 2019, 165: 114997 DOI:10.1016/j.watres.2019.114997 (  0) 0) |
| [23] |
Yang Z C, Yan Y, Yu A Q, et al. Revisiting the phenanthroline and ferrozine colorimetric methods for quantification of Fe(Ⅱ) in Fenton reactions[J]. Chemical Engineering Journal, 2020, 391: 123592 DOI:10.1016/j.cej.2019.123592 (  0) 0) |
| [24] |
Huang H, Ji X B, Cheng L Y, et al. Free radicals produced from the oxidation of ferrous sulfides promote the remobilization of cadmium in paddy soils during drainage[J]. Environmental Science & Technology, 2021, 55(14): 9845-9853 (  0) 0) |
| [25] |
Page S E, Kling G W, Sander M, et al. Dark formation of hydroxyl radical in Arctic soil and surface waters[J]. Environmental Science & Technology, 2013, 47(22): 12860-12867 (  0) 0) |
| [26] |
Chen J, Gu B H, Royer R A, et al. The roles of natural organic matter in chemical and microbial reduction of ferric iron[J]. The Science of the Total Environment, 2003, 307(1/2/3): 167-178 (  0) 0) |
| [27] |
Yin R L, Chen Y X, Hu J Y, et al. Complexes of Fe(Ⅲ)-organic pollutants that directly activate Fenton-like processes under visible light[J]. Applied Catalysis B: Environmental, 2021, 283: 119663 DOI:10.1016/j.apcatb.2020.119663 (  0) 0) |
| [28] |
Song M K, Peng K, Jiang L F, et al. Alleviated antibiotic-resistant genes in the rhizosphere of agricultural soils with low antibiotic concentration[J]. Journal of Agricultural and Food Chemistry, 2020, 68(8): 2457-2466 DOI:10.1021/acs.jafc.9b06634 (  0) 0) |
| [29] |
Uddin M, Chen J W, Qiao X L, et al. Bacterial community variations in paddy soils induced by application of veterinary antibiotics in plant-soil systems[J]. Ecotoxicology and Environmental Safety, 2019, 167: 44-53 DOI:10.1016/j.ecoenv.2018.09.101 (  0) 0) |
| [30] |
Kirk M F, Roden E E, Crossey L J, et al. Experimental analysis of arsenic precipitation during microbial sulfate and iron reduction in model aquifer sediment reactors[J]. Geochimica et Cosmochimica Acta, 2010, 74(9): 2538-2555 DOI:10.1016/j.gca.2010.02.002 (  0) 0) |
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China;
3. School of Environment, Nanjing University, Nanjing 210023, China;
4. Nanjing Institute of Environmental Sciences, MEE, Nanjing 210042, China
 2024, Vol. 56
2024, Vol. 56


