2. 福建师范大学地理科学学院, 福州 350007;
3. 自然资源部东南生态脆弱区监测修复工程技术创新中心, 福州 350001
氧化亚氮(N2O)是重要的温室气体,其百年尺度上的增温潜势是二氧化碳(CO2)的298倍,是造成全球变暖和臭氧层破坏的重要因素[1]。其中,硝化作用、反硝化作用对于全球N2O排放的贡献占70% 左右[2]。反硝化过程主要由土壤中各类氮转化微生物介导,将硝酸盐(NO3−)依次还原为亚硝酸盐(NO2−)、一氧化氮(NO)、N2O,最终还原为氮气(N2)的生物化学过程。N2O还原酶将N2O还原成N2是自然界氮循环过程中已知的唯一去除N2O的生物路径。N2O还原酶主要由nosZ基因编码[3],包括早期发现的nosZ Ⅰ和近年来新发现的nosZ Ⅱ[4],二者在土壤中的相对重要性一直备受争议。
大量研究表明,土壤反硝化过程主要受温度、水分和通气状况等因素影响[5-6]。福建省地处湿润亚热带地区,年均温一般在20 ℃左右,降水充沛,雨量集中。亚热带地区较高的土壤含水量通过调控土壤孔隙度、氧气利用率和土壤微生物活性等,影响微生物反硝化过程[7],是反硝化过程发生的热点区域[8]。Müller等[9]发现,不同海拔的热带和亚热带森林土壤N2O排放主要来源于反硝化。亚热带森林土壤是反硝化过程发生的重要场所。研究表明,全球陆地排放N2O的38% 来自森林土壤[10],其中热带和亚热带森林是最主要的排放源[11],且人工林的N2O排放量高于天然林[12]。亚热带森林土壤根系发达,植物根系可以为反硝化微生物提供有机碳源,是影响森林土壤N2O排放的重要因子。因此,研究亚热带森林根际土壤N2O还原菌丰度对于森林土壤N2O减排具有重要意义。
杉木(Cunninghamia lanceolata) 是我国南方人工林的代表性树种,分布广、面积大。根际是植物–土壤相互作用的“热点”,根际微域会受到植物根系及其分泌物的影响,可能使得根际的土壤性质有别于非根际,进而导致两个部位的土壤微生物群落存在差异[13]。因此,杉木人工林根际土壤性质的差异会使微生物群落存在不同,从而对根际N2O还原菌丰度造成影响。迄今,森林土壤N2O还原菌的研究大多只关注nosZ Ⅰ,对nosZ Ⅱ的研究非常有限。Jones等[14]研究发现,与传统认为的nosZ Ⅰ型N2O还原菌相比,nosZ Ⅱ型N2O还原菌可能在土壤N2O还原中扮演更重要的角色。然而,nosZ Ⅱ比nosZ Ⅰ对土壤pH变化更加敏感,nosZ Ⅱ受pH降低的影响可能更大。因此,在酸性的亚热带森林土壤中,nosZ Ⅰ型N2O还原菌基因丰度可能高于nosZ Ⅱ型。然而,这一假设仍需进一步研究和验证。
本研究选取福建省3个典型的杉木人工林根际土壤为研究对象,采用实时荧光PCR测定土壤N2O还原菌功能基因nosZ Ⅰ和nosZ Ⅱ丰度,研究福建省典型杉木人工林根际土壤中N2O还原菌的丰度特征及其环境驱动因子,可为杉木林土壤的N2O减排提供理论依据和数据支撑。
1 材料与方法 1.1 研究区概况研究样地位于福建省三明国家野外科学观测研究站(26°09′47.36"N,117°28′14.98"E)、武夷山国家森林公园(27°45′39.49"N,117°51′11.22"E)和上杭白砂国有林场(25°5'41.39"N,116°22'27.21"E)(图 1),后文简称为三明、武夷山和白砂。3个长期试验样地均属于亚热带季风气候,年平均气温分别为20.1、19.1和19.8 ℃,年平均降水量分别为1 378、1 551和1 600 mm,植被类型以杉木人工林为主。3个样地地形均以丘陵和山地为主,土壤类型主要为酸性的红壤和黄红壤,森林覆盖率分别为78.88%、96.72% 和95.3%。
|
图 1 研究区域位置 Fig. 1 Location of study sites |
土壤样品采集于2022年夏季。在样地坡面较均一的地段分别选取4块20 m × 20 m样地,利用抖落法采集0 ~ 20 cm杉木人工林根际土壤样品,每个林场采集获得12份(3份× 4点)土壤样品,3个林场总计36份根际土壤样品。所有样品均置于无菌密封袋,保存于冷藏箱,尽快转移至实验室。将新鲜的土壤样品去除肉眼可见的根系及石头等细小杂质残留物,过2 mm筛后,充分混匀。将过筛的土壤样品分成2份,一部分保存于–80 ℃冰箱用于DNA提取和微生物学分析;一部分室温风干,用于测定土壤基本理化性质。
1.3 土壤理化性质测定土壤理化性质的测定主要参考鲁如坤[15]的方法。pH:取5 g风干土样,加入25 mL无CO2去离子水,置于磁力搅拌器上搅拌10 min,静置30 min后,用pH计(FE20-FiveEasyTM pH,Mettler Toledo,German)测定。全碳(TC)和全氮(TN):土壤自然风干后,使用球磨仪磨碎,过100目筛后用碳氮元素分析仪(VarioEL Ⅲ,Germany)测定。有效磷(AP):取5 g风干土样,加入50 mL 0.05 mol/L盐酸和0.025 mol/L硫酸混合液,振荡、过滤,钼蓝比色法测定。土壤速效钾(AK):取5 g风干土样,加入50 mL 1 mol/L醋酸铵溶液,振荡、过滤,火焰光度计(FP640,INASA,China)测定。土壤可溶性有机碳(DOC):取10 g(烘干重计)新鲜土样,加入50 mL去离子水,25 ℃恒温振荡30 min,然后在10 000 r/min下离心10 min,上清液过0.45 μm聚醚砜滤膜(Whatman,Clifton,NJ,USA),用岛津碳氮分析仪(TOC Vcph,Shimadzu,Kyoto,Japan)测定。铵态氮(NH4+-N)和硝态氮(NO3–-N):称取相当于10 g干土的新鲜土样,加入100 mL 2 mol/L的KCl溶液浸提,流动分析仪(Skalar+ Analytical,Breda,The Netherlands)测定。将风干土和鲜土在105 ℃烘至恒重,得到土壤含水率(WC)。
1.4 土壤总DNA提取和实时荧光定量PCR称取0.5 g(以烘干重计)土壤样品,使用FastDNATM SPIN Kit for Soil(MP Biomedicals,Santa Ana,CA,USA)试剂盒,依照说明书的操作步骤提取土壤总DNA。提取的DNA利用NanoDrop分光光度计(ND-2000,Thermo Fisher Scientific,Waltham,USA)于260 nm波长处测定浓度。用0.8% 琼脂糖凝胶电泳检测提取DNA的质量和完整性,之后置于–80 ℃冰箱保存备用。
采用实时荧光定量PCR,利用CFX96定量PCR仪(Bio-Rad Laboratories Inc., Hercules,CA,USA)测定N2O还原菌nosZ Ⅰ和nosZ Ⅱ基因拷贝数。荧光定量PCR的引物序列、反应体系、反应条件和标准曲线制作参照宛颂等[16]所述方法进行。每个样品和标准曲线模板各重复3次,并设置3个空白对照,根据标准曲线计算基因拷贝数。同时,将样品DNA模板进行梯度稀释,评估PCR扩增过程是否受到抑制。根据标准曲线计算nosZ Ⅰ和nosZ Ⅱ基因的丰度,通过琼脂糖凝胶电泳检测扩增后的产物是否存在非特异性扩增,并观察溶解曲线出峰情况。
1.5 数据处理与分析来用SPSS 22.0软件进行数据分析,利用单因素方差分析(one-way ANOVA)比较3个样地的土壤基本理化性质差异,不同处理之间的差异显著性利用最小显著差法(LSD)(P < 0.05) 进行分析。利用Pearson相关性分析研究土壤反硝化功能基因丰度与理化性质之间的关系。利用Origin 2021作图。
2 结果与分析 2.1 不同区域杉木人工林土壤理化性质不同研究区域杉木人工林土壤理化性质如图 2所示。三明土壤pH为4.02,与三明相比,白砂和武夷山的pH升高,分别为4.93和4.95。同样,3个研究区域的TC、NH4+-N和AP含量均表现为白砂和武夷山高于三明。此外,白砂的土壤含水率为29%,显著高于三明(19%)和武夷山(22%),而三明和武夷山之间无显著性差异。三明的NO3–-N含量为6.87 mg/kg,显著高于白砂(1.10 mg/kg)和武夷山(0.27 mg/kg)。3个研究区域的DOC和TN含量均无显著差异。
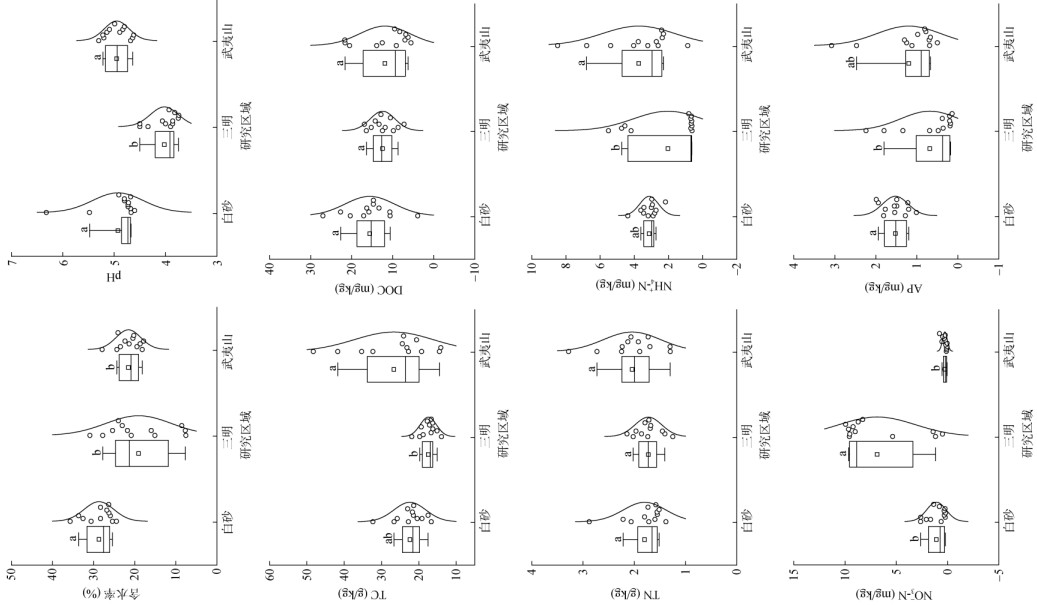
|
(白砂:龙岩市上杭白砂国有林场;三明:三明市森林生态系统与全球变化研究站;武夷山:南平市武夷山国家森林公园。箱式图中的横线表示中位数,小正方形表示平均值,其底部和顶部分别代表下四分位数和上四分位数,而箱式图上方和下方延伸的线与点表示异常值。图中小写字母不同表示区域间差异显著(P < 0.05)。下图同) 图 2 研究区域土壤基本理化性质 Fig. 2 Soil physicochemical properties in study sites |
从图 3可以看出,白砂、三明和武夷山中nosZ Ⅰ基因丰度为2.85×106 ~ 5.41×107copies/g,而nosZ Ⅱ基因丰度为1.97×105 ~ 7.41×106 copies/g。其中,武夷山的nosZ Ⅰ基因丰度平均值为2.53×107 copies/g,显著高于白砂(8.90×106 copies/g)和三明(9.27×106 copies/g);但不同研究区域nosZ Ⅱ的基因拷贝数均无显著差异。此外,3个区域的nosZ Ⅰ基因丰度均显著高于nosZ Ⅱ。
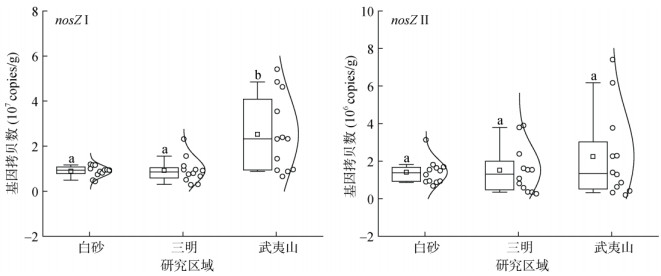
|
图 3 N2O还原菌功能基因丰度 Fig. 3 Abundance of functional genes of N2O reducers |
从图 4可以看出,土壤pH和DOC是nosZ Ⅰ基因丰度的主要影响因素,而含水率对nosZ Ⅰ基因丰度也有显著影响。同样,影响nosZ Ⅱ基因丰度的最关键环境因子是土壤pH,而AP、NH4+-N和DOC对nosZ Ⅱ基因丰度也有显著影响。相关性分析(表 1)表明,nosZ Ⅰ基因丰度与土壤pH呈显著正相关,但与DOC呈显著负相关,而nosZ Ⅱ基因丰度与土壤基本理化性质均无显著相关关系。
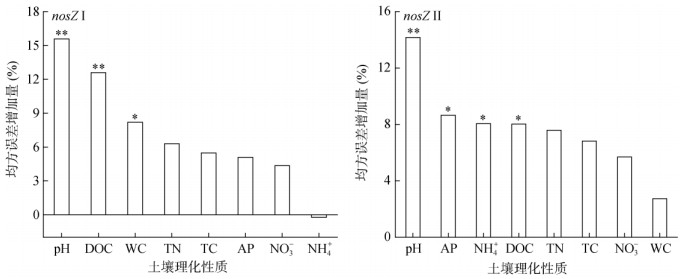
|
(*、**分别表示P < 0.05、P < 0.01显著水平) 图 4 N2O还原菌与土壤理化性质的随机森林分析 Fig. 4 Random forest analysis of N2O reducer abundance and soil physicochemical properties |
|
|
表 1 土壤N2O还原菌功能基因丰度与土壤理化性质之间的相关性 Table 1 Correlation of abundance of N2O reducers and soil physicochemical properties |
土壤理化性质是影响反硝化微生物功能基因丰度的重要因素,例如,土壤含水率、pH、TC含量等均可显著影响反硝化微生物功能基因丰度[17]。本研究发现,三明杉木人工林土壤的pH要显著低于武夷山和白砂,这可能是由于地形和气候等因素不同所导致。再者,三明的NO3–-N含量显著高于武夷山和白砂,表明三明杉木人工林土壤可能有着更强的硝化作用,强烈的硝化作用会促进H+的释放,从而加快土壤的酸化,使其pH降低[18]。此外,有机碳的功能团可以螯合Al3+和H+[19],从而减缓土壤的酸化过程,但三明的土壤有机碳含量低于武夷山和白砂,这也可能是其pH低的另外一个重要因素。
本研究发现,尽管不同地区的nosZ Ⅰ和nosZ Ⅱ丰度存在显著差异,但武夷山、三明和白砂3个研究区域的nosZ Ⅰ基因丰度均显著高于nosZ Ⅱ,表明nosZ Ⅰ型NO2还原菌可能在酸性的杉木人工林土壤中占主导。该结果与宛颂等[16]和段春健等[20]在酸性旱地农田红壤的发现一致。与之相反,Jones等[14]发现,在农田土壤中,nosZ Ⅱ基因丰度高于nosZ Ⅰ,且nosZ Ⅱ基因丰度和多样性显著影响土壤N2O还原能力。Assémien等[21]在西非的农田土壤中也同样发现,nosZ Ⅱ基因丰度远高于nosZ Ⅰ。段春健等[20]认为,nosZ Ⅰ和nosZ Ⅱ基因丰度主要受pH控制,提高土壤pH会降低强酸对nosZ Ⅰ和nosZ Ⅱ基因表达的抑制作用,有利于N2O还原菌生长,导致nosZ Ⅰ和nosZ Ⅱ基因丰度上升。本研究也发现,pH是影响nosZ Ⅰ和nosZ Ⅱ基因丰度最主要的环境因子(图 4),进一步验证了这一观点。本研究的土壤类型主要为杉木人工林下的酸性红壤和黄红壤[22],即使是pH最高的武夷山研究区土壤也仅有4.95,因此,供试土壤可能都不利于nosZ Ⅰ和nosZ Ⅱ型N2O还原菌生长。然而,邓米林等[23]在模拟氮沉降的森林土壤研究中发现,nosZ Ⅱ比nosZ Ⅰ对低pH更敏感,酸性土壤更不利于nosZ Ⅱ型N2O还原菌生长,这可能是武夷山、三明和白砂3个地区nosZ Ⅰ基因丰度均显著高于nosZ Ⅱ的重要因素。
不同区域的nosZ Ⅰ基因丰度存在显著性差异,而nosZ Ⅱ基因丰度则没有显著性差异,这可能是由于nosZ Ⅱ基因丰度较低所致,但具体原因仍有待进一步探究。武夷山的nosZ Ⅰ基因丰度显著高于三明和白砂,其原因可能是,武夷山的NH4+高于白砂和三明,土壤NH4+是氨氧化主要底物[24],氨氧化产生的中间产物可能为nosZ Ⅰ型N2O还原菌提供部分氮源。此外,Beven等[25]发现调控反硝化作用的关键因子是土壤pH,nosZ Ⅰ基因丰度与土壤pH呈显著正相关。武夷山土壤pH为4.95,显著高于三明(4.02),虽然白砂的土壤pH达到4.93,但其水分含量显著高于武夷山,过多的水分含量不利于根系呼吸和分泌有机物质,从而不利于杉木人工林根际土壤nosZ Ⅰ型N2O还原菌生长。Van Kessel等[26]研究表明,nosZ功能基因丰度与根际土的TC含量呈显著正相关,而武夷山的TC含量也要高于三明和白砂,这可能是影响武夷山的nosZ Ⅰ基因丰度的另外一个重要因素。由于nosZ Ⅰ型N2O还原菌可能是亚热带森林土壤N2O还原的关键微生物[27],武夷山的nosZ Ⅰ基因丰度显著高于三明和白砂可能使其具有较高的N2O还原能力。
4 结论1) 在杉木人工林根际土壤中,nosZ Ⅰ型N2O还原菌基因丰度高于nosZⅡ型,表明nosZ Ⅰ型N2O还原菌在杉木人工林土壤中占主导。
2) 不同区域杉木林根际土壤的nosZ Ⅰ基因丰度存在显著差异,武夷山的nosZ Ⅰ基因丰度显著高于三明和白砂。
3) 土壤pH是调控nosZ Ⅰ和nosZ Ⅱ基因丰度变化的关键环境因子。
| [1] |
Ravishankara A R, Daniel J S, Portmann R W. Nitrous oxide (N2O): The dominant ozone-depleting substance emitted in the 21st century[J]. Science, 2009, 326(5949): 123-125 DOI:10.1126/science.1176985 (  0) 0) |
| [2] |
Conrad R. Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)[J]. Microbiological Reviews, 1996, 60(4): 609-640 DOI:10.1128/mr.60.4.609-640.1996 (  0) 0) |
| [3] |
Nogales B, Timmis K N, Nedwell D B, et al. Detection and diversity of expressed denitrification genes in estuarine sediments after reverse transcription-PCR amplification from mRNA[J]. Applied and Environmental Microbiology, 2002, 68(10): 5017-5025 DOI:10.1128/AEM.68.10.5017-5025.2002 (  0) 0) |
| [4] |
Sanford R A, Wagner D D, Wu Q Z, et al. Unexpected nondenitrifier nitrous oxide reductase gene diversity and abundance in soils[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(48): 19709-19714 (  0) 0) |
| [5] |
Heinen M. Simplified denitrification models: Overview and properties[J]. Geoderma, 2006, 133(3/4): 444-463 (  0) 0) |
| [6] |
冯蒙蒙, 林永新, 樊剑波, 等. 温度和氮添加对旱地红壤反硝化功能基因丰度的影响[J]. 土壤, 2023, 55(3): 562-568 (  0) 0) |
| [7] |
郑翔, 刘琦, 曹敏敏, 等. 森林土壤氧化亚氮排放对氮输入的响应研究进展[J]. 土壤学报, 2022, 59(5): 1190-1203 (  0) 0) |
| [8] |
Zheng X, Liu Q, Ji X F, et al. How do natural soil NH4+, NO3− and N2O interact in response to nitrogen input in different climatic zones? A global meta-analysis[J]. European Journal of Soil Science, 2021, 72(5): 2231-2245 DOI:10.1111/ejss.13131 (  0) 0) |
| [9] |
Müller A K, Matson A L, Corre M D, et al. Soil N2O fluxes along an elevation gradient of tropical montane forests under experimental nitrogen and phosphorus addition[J]. Frontiers in Earth Science, 2015, 3: 66 (  0) 0) |
| [10] |
Bouwman A F, Van der Hoek K W, Olivier J G J. Uncertainties in the global source distribution of nitrous oxide[J]. Journal of Geophysical Research: Atmospheres, 1995, 100(D2): 2785-2800 DOI:10.1029/94JD02946 (  0) 0) |
| [11] |
Kesik M, Ambus P, Baritz R, et al. Inventories of N2O and NO emissions from European forest soils[J]. Biogeosciences, 2005, 2(4): 353-375 DOI:10.5194/bg-2-353-2005 (  0) 0) |
| [12] |
Konda R, Ohta S, Ishizuka S, et al. Spatial structures of N2O, CO2, and CH4 fluxes from Acacia mangium plantation soils during a relatively dry season in Indonesia[J]. Soil Biology and Biochemistry, 2008, 40(12): 3021-3030 DOI:10.1016/j.soilbio.2008.08.022 (  0) 0) |
| [13] |
刘钊, 魏天兴, 朱清科, 等. 黄土丘陵沟壑区典型林地土壤微生物、酶活性和养分特征[J]. 土壤, 2016, 48(4): 705-713 (  0) 0) |
| [14] |
Jones C M, Spor A, Brennan F P, et al. Recently identified microbial guild mediates soil N2O sink capacity[J]. Nature Climate Change, 2014, 4: 801-805 DOI:10.1038/nclimate2301 (  0) 0) |
| [15] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科学技术出版社, 北京, 2000
(  0) 0) |
| [16] |
宛颂, 段春健, 樊剑波, 等. 旱地红壤反硝化功能基因丰度对长期施肥的响应[J]. 应用生态学报, 2020, 31(11): 3729-3736 (  0) 0) |
| [17] |
徐军山, 苏雪, 贾志鹏, 等. 增温对结皮土壤系统氮转化速率及微生物生物量碳氮与酶活性的影响[J]. 土壤学报, 2021, 58(3): 788-797 (  0) 0) |
| [18] |
Zhu W X, Carreiro M M. Chemoautotrophic nitrification in acidic forest soils along an urban-to-rural transect[J]. Soil Biology and Biochemistry, 1999, 31(8): 1091-1100 DOI:10.1016/S0038-0717(99)00025-5 (  0) 0) |
| [19] |
Ma J Y, Cao C Y, Zheng C L, et al. Effect of long-term application of chemical fertilizers and organic manure on soil organic carbon and bulk density[J]. Soil and Fertilizer Sciences in China, 2010, 6: 38-42 (  0) 0) |
| [20] |
段春健, 宛颂, 叶桂萍, 等. 长期缺素施肥及石灰石膏施用对江西鹰潭红壤反硝化微生物功能基因丰度的影响[J]. 应用生态学报, 2021, 32(6): 2209-2216 (  0) 0) |
| [21] |
Assémien F L, Cantarel A A M, Florio A, et al. Different groups of nitrite-reducers and N2O-reducers have distinct ecological niches and functional roles in West African cultivated soils[J]. Soil Biology and Biochemistry, 2019, 129: 39-47 DOI:10.1016/j.soilbio.2018.11.003 (  0) 0) |
| [22] |
陈春林, 周国英, 闫法领, 等. 南方杉木人工林土壤健康评价研究[J]. 土壤通报, 2012, 43(6): 1318-1324 (  0) 0) |
| [23] |
邓米林, 冯蒙蒙, 刘小飞, 等. 模拟氮沉降降低亚热带米槠天然林土壤氧化亚氮排放潜势[J]. 应用生态学报, 2022, 33(10): 2705-2710 (  0) 0) |
| [24] |
Zhu T B, Zeng S M, Qin H L, et al. Low nitrate retention capacity in calcareous soil under woodland in the Karst region of southwestern China[J]. Soil Biology and Biochemistry, 2016, 97: 99-101 (  0) 0) |
| [25] |
Beven K J, Kirkby M J. A physically based, variable contributing area model of basin hydrology[J]. Hydrological Sciences Bulletin, 1979, 24(1): 43-69 (  0) 0) |
| [26] |
Van Kessel J S, Reeves J B. On-farm quick tests for estimating nitrogen in dairy manure[J]. Journal of Dairy Science, 2000, 83(8): 1837-1844 (  0) 0) |
| [27] |
Shan J, Sanford R A, Chee-Sanford J, et al. Beyond denitrification: The role of microbial diversity in controlling nitrous oxide reduction and soil nitrous oxide emissions[J]. Global Change Biology, 2021, 27(12): 2669-2683 (  0) 0) |
2. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007, China;
3. Technology Innovation Center for Monitoring and Restoration Engineering of Ecological Fragile Zone in Southeast China, Ministry of Natural Resources, Fuzhou 350001, China
 2024, Vol. 56
2024, Vol. 56


