2. 中国科学院大学, 北京 100049;
3. 南京农业大学资源与环境科学学院, 南京 210095;
4. 农业农村部环境保护科研监测所, 天津 300191
纤维素是地球上最丰富的生物聚合物[1],主要来自植物细胞壁,还可以由一些海洋物种,即被膜动物产生[2]。纤维素来源广泛,在自然界中普遍存在,其中棉花、木材以及作物秸秆是其产生的主要来源。作为自然界中储量最丰富的可再生生物质资源,纤维素的再利用对于缓解能源危机、环境保护等影响深远。然而纤维素本身复杂的结构限制了其高效利用,因此对纤维素进行预处理是一项非常重要的技术关卡。目前物理法、化学法及生物法是处理纤维素的主要方法,其中生物法主要是利用微生物产纤维素酶进行水解,实质上是一种复杂的酶过程,多种酶协同参与,进而破坏纤维素的结构,将其降解为可利用的单糖。该方法反应条件温和,无需添加化学试剂,降解效率高,在环境保护、经济成本、节约能耗等方面具有明显优势,因此备受瞩目。
土壤微生物是秸秆降解的主要驱动者,前者通过分泌纤维素酶等促进后者的降解[3]。自然界中存在丰富的纤维素降解菌株资源,但现阶段对于产纤维素酶微生物的研究大多集中在常温及高温条件下,往往也只能在较高温度下才可以达到更好的降解效果,一旦环境温度降低,它们的酶活性会降低甚至失去活性,从而在一些低温的特殊生境中就难以发挥作用。因此,开发耐低温纤维素降解微生物具有巨大的潜在价值和意义,比如我国寒冷地区,由于低温的影响,每年产生数亿吨的农作物秸秆在短时间内不能被轻易腐解,造成大量的资源浪费,然而施用耐低温纤维素降解微生物可以大大提高它们的利用效率,提高土壤肥力;在工业及其他领域中,该类微生物可降低纤维素处理的成本及能耗,还可缩短发酵时间。
1 纤维素生物降解研究进展 1.1 纤维素基本性质纤维素被认为是生物圈中最重要的有机化合物之一,是一种可再生的天然生物聚合物,并且有可能成为几乎无限的可再生生物燃料来源[4]。纤维素是绿色植物细胞壁的结构成分,它可以从植物、木材、细菌等中获得和生物合成[5]。一般而言,所有植物物质的纤维素浓度平均约为33%,是提取纤维素的优秀生物质原料。
纤维素是一种高分子有机化合物,由无数个葡萄糖单体组成,主要通过β-1, 4糖苷键共价连接在一起。纤维素分子链上存在的羟基形成了分子内及分子间的氢键[6],从而构成了庞大的氢键网络,纤维素链平行排列形成的结晶区以及不规则排列产生的无定型区[7]交替出现组成高度结晶的晶体结构,这使得纤维素不溶于水和大多数有机溶剂。
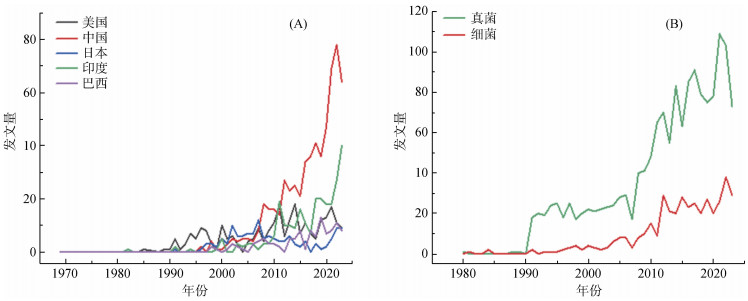
1.2 纤维素降解微生物在Web of Science核心数据库中,以“纤维素生物降解”为关键词进行了文献检索(图 1A),共检索到3 003篇文献。数据表明,该领域研究大致在20世纪90年代开始引起关注,美国最先开始了研究,我国相对起步较晚,但随着时间的推移,我国在近十年内取得了巨大的研究进展。此外,以“真菌”和“细菌”为分类标准对纤维素降解微生物进行文献计量分析(图 1B),其中真菌占据绝对优势,在一定程度上反映了真菌在纤维素降解方面受到了极高的关注。
|
图 1 纤维素生物降解年发文量 Fig. 1 Literature number annually published in cellulose biodegradation |
在早期研究中,真菌就因降解效果显著而得到较多的关注。真菌的菌丝先穿透次生壁进入胞腔内,分泌大量的胞外纤维素酶,由里向外逐渐破坏纤维素的紧密结构[8],并且真菌所产生的纤维素酶种类也较为丰富,主要来自于曲霉属(Aspergillus)、木霉属(Trichoderma)、青霉属(Penicillium)等。例如,王洪媛和范丙全[9]筛选出的扩张青霉(Penicillium expansum)W4,10 d后纤维素的降解率高达59.06%,为纤维素生物降解提供了优势菌株资源。宁琪等[10]从长期施用有机肥的土壤中分离出两株被孢霉(Mortierella),在砂浆黑土中接种35 d后,两株菌对小麦秸秆的降解率均达到30% 以上,有效促进了秸秆降解。
真菌在纤维素降解中起到主要作用,它能分泌较高活性的胞外纤维素酶,并且其本身具有的多酶系分泌能力使其产生的胞外酶种类更为齐全,再加上可以快速延伸以及协同效应等优势使得真菌在纤维素降解过程中表现突出。然而由于真菌对生长环境的敏感性,如在降解过程中对温度较为敏感以及pH范围受限等问题的出现,导致纤维素降解真菌未能被大规模地开发和利用。
1.2.2 细菌与真菌相比,细菌发育更快,数量庞大,分布广泛,且具有更多的遗传多样性[11]。尤其在一些极端的环境条件下,细菌表现出很强的适应性。细菌在降解纤维素时分泌纤维素酶,以纤维素酶小体的形式并利用酶结构中的纤维素结合域(CBD)吸附在纤维素表面[12],随后利用其生长代谢快的优势大量繁殖,逐渐分解纤维素。迄今为止已筛选出的纤维素降解细菌大多分布在芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、梭菌属(Clostridium)、链霉菌属(Streptomyces)等。孙玲等[13]从腐烂秸秆及邻近土壤中筛选出一株CMC-red菌,被鉴定为Massilia arvi菌属,10 d内可将秸秆降解24.14%;邹芳等[14]从烟稻轮作田土壤中分理出一株芽孢杆菌(Bacillus)YC-2, 7 d内对烟草秸秆的降解率为10.14%,约为自然状态下的4.5倍。
在该领域的多数综述性文献中将放线菌单独作为一类,主要因其是独特的原核生物,拥有细菌和真菌的双重性质[15]。可降解纤维素的菌株大部分归类为链霉菌属(Streptomyces),该类菌株大多能在高温强碱的条件下保持很高的活性[16],被认为具有巨大的实用价值。放线菌在降解过程中,不仅可以提高纤维素的水溶性,其菌丝对纤维素也具有较强的穿透能力[17],从而破坏结构坚硬的纤维素。Riddech等[18]从土壤中筛选出一株链霉菌(Streptomyces)CDF2L1D13,实验结果表明该菌株可以以米糠为底物产生β -葡萄糖苷酶,酶活值可达0.401 U/mL。
迄今为止,纤维素降解细菌的研究已经取得了一定进展,筛选得到了许多具有较强降解能力的菌株,一些好氧细菌可分泌游离的胞外纤维素酶,厌氧情况下,有的纤维素降解细菌中会以一种特殊的纤维素酶复合体结构——纤维小体(Cellulosome)[19]的形式将纤维素酶整合到细胞膜上,从而有效彻底地降解纤维素。纤维素降解细菌也因其本身结构简单、生长快等优势易于大规模应用生产,但其产生的纤维素酶稳定性不强,酶活性相对较低,因此降解效果较真菌没有那么理想。
综上,纤维素生物降解研究已经取得了显著的进步,特别是在高效降解菌株的筛选与微生物降解酶的开发等方面。许多研究人员已经从不同生境中分离鉴定出大量具有高效纤维素降解能力的新菌种,通过对自然界的纤维素降解微生物进行筛选,发现了一系列具有多功能酶系的菌株,这些菌株能够协同作用,更有效地分解复杂的纤维素结构。但在实际应用和理论探索中仍存在不少挑战与问题:例如纤维素酶(包括真菌和细菌来源)在某些条件下可能表现出较低的活性或稳定性,如对温度、pH、抑制剂等条件敏感,提高纤维素酶在工业生产过程中的稳定性和活性是关键问题之一;虽然已知多种微生物能够产生纤维素降解酶,但如何优化这些酶的组合以实现高效协同降解纤维素还需深入研究。除此之外,在自然环境或工业发酵体系中,纤维素降解微生物可能受到其他微生物的竞争,其生长速度、生存能力和纤维素利用效率有待提高,以确保在复杂生态系统中的竞争优势。
1.3 纤维素生物降解机理众所周知,纤维素是地球上含量最多的生物质,具备多个良好特性,并且被越来越广泛地认为是可再生资源的燃料或来源,因此被大量用于设计新型生物复合材料等。纤维素的降解早就引起了极大的关注,它可在热、氧化、水解或酶促条件下被降解[20]。为了实现纤维素资源的高效、环保利用,减少有害副产物的产生并降低成本,利用纤维素的可生物降解性通过纤维素酶水解受到了更广泛的关注。
目前关于天然纤维素酶解或水解机理的研究主要有3种理论:C1-CX假说、协同理论和原初反应假说[21]。C1-CX假说在19世纪50年代被Reese等人提出,该假说认为C1酶先作用在纤维素酶的结晶区,使纤维素膨胀变成无定型纤维素,然后分别通过内切β-葡萄糖苷酶、纤维二糖水解酶和β-葡萄糖苷酶的作用产生寡糖、纤维二糖和葡萄糖[22]。协同理论是接受最为广泛的理论,该理论中纤维素的降解过程是由内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶3种纤维素酶协同作用完成的,内切葡聚糖酶在纤维素的非结晶区先发挥作用,外切葡聚糖酶从上一步骤所产生的游离末端切下纤维二糖单位,最后β-葡萄糖苷酶将其水解成葡萄糖[23]。原初反应最早是在褐腐菌降解纤维素的过程中发现的,褐腐真菌在降解结晶纤维素的初始阶段会导致纤维素的机械强度显著降低,但只有极少量的质量减轻,并生成少量的还原糖[24]。Coughlan[25]提出原初反应可以破坏纤维素的结晶结构,从而使可溶性糖被释放出来,使纤维素水解反应更顺利地进行。
针对以上所提出的理论,发现纤维素的酶解是一个极其复杂的过程,纤维素分子构造牢固,目前普遍认为是多种酶组分(主要为内切葡聚糖酶、外切葡聚糖酶以及β-葡萄糖苷酶)协同作用完成纤维素的水解过程。然而这种协同作用不仅顺序不是绝对的,而且每个酶的功能也不是单一和固定的[26]。纤维素的酶解对于生物降解纤维素的机理研究至关重要,除已知的纤维素降解模式,即大多数好氧细菌、丝状真菌分泌大量的胞外酶,一些厌氧细菌以纤维小体(Cellulosome)附着在细胞膜上来实现纤维素的高效降解以外,杨腾腾等[27]在Cytophaga hutchinsonii中发现一种新型的纤维素降解模式。依据Wilson[28]提出的细胞结合型非复合体纤维素降解酶系,通过基因组信息学分析推测以该菌株为代表的好氧菌可能存在独特的纤维素降解策略,即细胞外膜上有一种蛋白质复合体,可以将纤维素链与纤维素纤维分离。在这种复合物和外膜通道蛋白的协同作用下,纤维素链被运输到周质空间,最终被内切酶降解。
1.4 应用纤维素降解微生物因其绿色高效等特点已广泛应用于多个领域,在农业上大多体现于通过纤维素降解微生物来提高农作物秸秆利用率,增加土壤有机质含量,提升土壤肥力,从而减少资源浪费、污染环境等不利影响。Han和He[29]利用外源纤维素酶降解水稻秸秆和小麦秸秆,在昼夜平均温度分别为29 ℃和25 ℃的温室中进行为期45 d的降解试验后,秸秆降解率分别提高了6.30% ~ 26.00% 和6.80% ~ 28.00%。该结果表明在秸秆掺入过程中施用纤维素酶可能是一种新的策略,它将帮助农民管理田间植物残留物并提高土壤肥力,此外,研究还考虑到成本问题,提出了更经济的纤维素酶浓度选择(50 U/g)。
在工业中,降解微生物所产生的纤维素酶常用于食品发酵、纺织和洗涤剂等领域。在酿酒时,可加入纤维素酶使原料中的纤维素转化为还原性糖来提升酒的品质及口感,这样可以省去很多繁琐的工艺步骤,从而节约一定的资源和成本。阳刚等[30]筛选出一株酒糟纤维素降解菌(枯草芽孢杆菌Bacillus subtilis)B2,并将其应用到酒糟降解工艺的研究,在经过工艺优化后,其酒糟降解率为15.23%。在纺织行业,使用纤维素酶处理织物可以水解并减少留在织物表面的微纤维数量,酶在纤维表面形成凹槽,形成多孔纤维,纤维素纤维经过改性后,可改善织物的外观和手感[31]。例如,周向东和刘亚亮[32]通过研究发现,酶处理后的棉织物的吸湿性、悬垂性和白度有了很大的提高,断裂强度略有下降。一些产纤维素酶的纤维素降解菌在医药行业大多应用于中药发酵或成分提取。在中药发酵过程中,纤维素降解菌在代谢时释放出纤维素酶,可以降解药物细胞壁中的纤维素,显著提高有效成分的提取效率。张圣燕和张成[33]采用纤维素酶提取冬枣叶中的总黄酮,在最佳工艺条件下,提取率达到了2.45%。此外,微生物在代谢过程中产生的一些次生代谢产物也可能具有药理作用,且药物中的一些有毒成分则通过生物转化被降解[34]。
2 耐低温纤维素降解微生物地球生物圈约80% 是寒冷的,平均温度为5 ℃,并且包含多种微生物资源,这些微生物是具有高生物技术潜力的宝贵来源[35]。现有的研究中已从北极、南极、深海等寒冷生态系统中发现大量低温微生物,它们可根据最适生长温度分为嗜冷和耐冷微生物两大类,区别在于耐冷微生物生长温度范围宽,分布更为广泛,而嗜冷微生物对温度较为敏感,只能从长期保持低温的环境中获得。
2.1 来源及种类低温微生物中同样包含具有纤维素降解能力的菌株,它们所产生的纤维素酶可以在低温环境中发挥作用,实现低温环境下纤维素的充分降解利用。目前已从极地、土壤、海洋等生境中筛选出一些耐低温纤维素降解微生物(表 1、表 2)。比如冯欣欣等[36]从寒区腐木中分离出了4株真菌,经鉴定为产黄青霉(Penicillium chrysogenum)、桔绿木霉(Trichoderma citrinoviride)2株、脉纹孢菌(Neurospora sitophila),结果表明这4株真菌在4 ℃可以正常生长,为典型的耐低温菌,在最适温度(20 ℃)下,15 d后对玉米秸秆的降解率均达到40% 以上;单建荣等[37]以冷冻牛粪为样本源,从中获得一株假单胞菌(Pseudomonas) YSX-3,在9 ℃、pH 6.5、培养71 h的条件下,测得实际低温纤维素酶活性高达130.21 U/mL,这些低温纤维素降解微生物的发现将大大提高寒区纤维素的利用率,对于寒区资源利用以及环境保护具有重要意义。
|
|
表 1 耐低温纤维素降解真菌资源 Table 1 Low temperature resistant cellulose degrading fungi |
|
|
表 2 耐低温纤维素降解细菌资源 Table 2 Low temperature resistant cellulose degrading bacteria |
纤维素往往会和半纤维素、木质素共同组成结构复杂的木质纤维素而存在,因此需要多种微生物相互配合将降解效果达到最佳。大量的研究也已表明单个菌株作用的效果低于复合微生物,Guevara和Zambrano[66]利用筛选出的4株具有纤维素降解能力的单菌组成功能微生物群,发现通过微生物的特定组合可以观察到比单个菌株预期更高的活性。魏蔚等[67]将纤维素降解菌株进行复配制成固体菌剂,15 d内对小麦秸秆纤维素的降解率可达28.79%,对土壤中秸秆降解具有明显的促进作用。除此之外,研究人员发现,由多种耐低温纤维素降解菌组成的复合菌系能够发挥协同作用,提高对纤维素的降解效率。通过试验设计和优化组合,可以创建出在低温环境下稳定且高效的复合菌群,用于处理生物质废弃物或开发低温生物能源转化技术,在寒区生物质资源利用方面具有广阔的应用前景。耐低温纤维素降解复合菌系低温耐受性强,能够在较低温度环境下保持较高的活性,特别适合在寒冷季节或北方低温地区进行生物质资源的高效利用。同时复合菌系中的不同菌种可以产生多种纤维素酶,并且这些酶可能具有互补作用,从而提高整体纤维素的降解效率,不同菌株间的代谢产物交换也可能促进彼此生长和纤维素分解。此外,如果能在低温下有效降解纤维素,则有可能减少对高温高压等苛刻预处理方法的依赖,这将有助于降低生物质能源生产过程中的预处理成本和能耗。利用天然存在的低温降解菌构建复合体系,与高温发酵相比,低温发酵工艺在一定程度上减少了温室气体排放和能源消耗。因此,基于以上优势,构建耐低温纤维素降解复合菌系逐渐得到关注(表 3)。
|
|
表 3 耐低温纤维素降解复合菌系资源 Table 3 Low temperature resistant cellulose degrading composite strains |
在低温环境中,纤维素降解微生物通过低温纤维素酶发挥作用,该类酶结构与常温纤维素酶类似,均依赖于纤维素结合域(CBD)与纤维素分子链之间的结合,通过连接区域的灵活性为催化结构域(CD)提供与纤维素链相互作用的机会[74]。低温纤维素酶可以适应寒冷环境并保持相对较高的活性,通过比较不同来源的低温酶,分析其氨基酸序列、三级结构以及催化区域的特点,发现这些酶通常具有独特的分子构象和更稳定的疏水相互作用,有助于它们在低温环境下保持结构稳定性和功能活性。刘秀华等[75]对纤维弧菌的低温纤维素酶进行了研究,经过试验结果推测出该酶与其他类型的低温酶相似,具有低温反应特性,通过削弱蛋白质分子内的相互作用和增强蛋白质分子与溶剂之间的相互作用,从而使蛋白质的稳定性降低,导致整体结构或特定区域的柔韧性增加,以此来适应低温环境。Violot等[76]探究了嗜冷细菌Pseudoalteromonas haloplanktis所产内切葡聚糖酶Cel5G的结构特性,通过互补方法、X射线晶体学和小角X射线散射对催化结构域和纤维素结合域之间的连接区(LR)进行分析后发现,该连接区是非结构化的,并且异常长和具有柔韧性,这是将其与嗜温对应物区分开来的特点,因此连接区在这种嗜冷酶的冷适应过程中发挥着重要作用。利用现代分子生物学手段,目前也已经成功克隆并表达了多个具有低温活性的纤维素酶基因,并将其在不同的宿主系统中进行异源表达,以进一步研究其功能和潜在应用价值。Dhar等[77]克隆了Paenibacillus sp. IHB B 3084内编码冷活性内切葡聚糖酶EG5C的基因,并在大肠杆菌BL21(DE3)中表达,结果显示EG5C的天然信号肽能够有效地分泌该酶,在细胞质和细胞外组分中具有几乎相等的活性,并且与糖基水解酶家族5(GH5)的其他冷活性酶相比,该重组酶连接区较短,但低温活性表明该酶具有一种新的冷适应机制。Kim等[78]对一种新型的胞外内切-β-1, 4-D葡聚糖酶(GluL)的相关性质进行了探索,通过将其基因编码一种由单个催化糖基水解酶家族8(GH8)结构域组成的非模块化多肽,发现该重组内切-β-1, 4-葡聚糖酶(rGluL)在3 ℃下可保持最大活性的23%,并且可优先分解由3 ~ 6个D-葡萄糖、CMC和大麦β -葡聚糖组成的D-纤维寡糖。Iyo和Forsberg[79]对琥珀酸纤维杆菌S85(一种嗜温厌氧菌)的两种内切葡聚糖酶CelG和EGD进行了表征,CelG的催化性能远远优于其他类似的冷活性酶,后者在0 ℃时保持其最大活性的70% 左右,而EGD在0 ℃时显示其最大活性的18%。
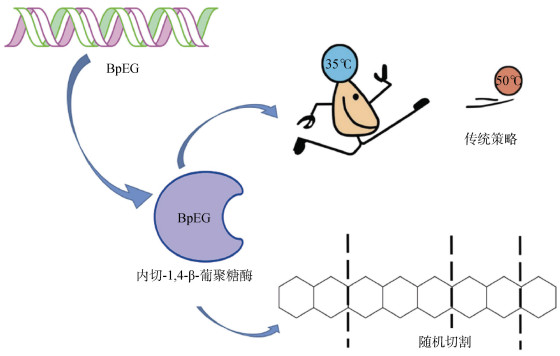
近年来随着对低温纤维素降解微生物研究的开展,一些低温纤维素酶也逐渐被研究人员挖掘出来,但关于该酶的降解作用机理研究非常少。Chen等[80]研究了Burkholderia pyrrocinia JK-SH007新型冷适应性内切-1, 4-β-葡聚糖酶(BpEG)的作用方式,将对不同长度的1, 4-β连接生物聚合物解聚获得的酶产物通过高性能阴离子交换色谱脉冲安培检测器(HPAEC- PAD)进行分析,揭示了内切葡聚糖酶采用的切割机制(图 2),即内切-1, 4-β-葡聚糖酶对纤维素聚合物进行随机切割,并可以将纤维寡糖降解为聚合度较低的低聚糖。Sun等[54]研究了嗜冷细菌LKR-1对纤维素的生物降解,并通过分析代谢产物推测了该菌株在低温下降解纤维素的途径,其中聚合物链中单体之间纤维素的β-1, 4-糖苷键被裂解,产生纤维二糖和葡萄糖等产物,这一步是纤维素生物降解的主要步骤。在降解过程中,丙酮酸通过三羧酸循环(TCA)经糖酵解(EMP)形成,EMP途径将反应物转化为3-羟基-2-丁酮、2, 3-丁二醇、丙酸、丁酸、乙酸和乙醇。在这一途径中会产生大量的三磷酸腺苷(ATP),从而促进LKR-1的生长和代谢。
|
图 2 内切-1, 4-β-葡聚糖酶在低温下对纤维素聚合物的随机切割方式[80] Fig. 2 Endo-1, 4-β-glucanase BpEG randomly cleaves cellulose polymers at low temperature |
耐低温纤维素降解微生物在多个领域具有重要应用价值,它们能够在较低温度下生存并保持活性,对于处理富含纤维素的生物质废弃物、促进寒冷地区土壤有机质分解以及生物能源生产等方面具有特殊的应用价值。在较为寒冷的地区,土壤微生物活动受到温度的极大限制,耐低温纤维素降解微生物可以参与到低温季节的有机物质循环中,提高土壤肥力,促进植物生长。利用耐低温纤维素降解菌进行冬季堆肥处理,有助于加速农业废弃物等纤维素基质的分解,减少堆肥周期,提高堆肥质量和稳定性。Chang等[81]探究了不同微生物制剂对玉米秸秆堆肥的影响,结果表明在加入低温菌后,堆肥的高温期快速启动,不仅缩短了成熟周期,还提高了堆肥质量。一些耐低温的纤维素降解菌可在低温下生长并分泌纤维素酶,这些酶可以应用于纺织品处理、造纸工业、食品工业和其他需要纤维素分解的过程。例如在食品加工过程中,低温纤维素酶除了具备降低能源消耗的优势外,还可在保持食品原有品质的前提下,减少一些必需风味的损失以及其他不良反应的发生[82]。
3 展望在当今能源短缺的时代,可再生资源的挖掘与利用刻不容缓。纤维素降解微生物和低温纤维素降解微生物的挖掘虽然已经取得了一定成果,但仍存在一些问题。为此,综合提出了纤维素降解微生物研究今后可能需要深入挖掘的方向:
1) 低温纤维素降解菌的选育与新菌株资源的开发。目前关于低温纤维素降解菌的研究依然相对较少,虽然已在自然界中不断筛选出许多纤维素降解菌株,但是在寒冷环境中的应用并不广泛,因此通过对筛选和培养条件的优化,不断开发新的微生物资源,同时加强低温环境纤维素降解菌的机理研究,为提高低温纤维素降解菌的降解效率提供理论支持和技术支撑。
2) 低温纤维素降解机制研究。目前在分子生物学方面,已有基因克隆技术、细胞融合、酶活性中心分析测定等方法来深入研究纤维素的降解机制,但是关于在降解过程中酶与底物之间如何反应、纤维素降解反应动力学、纤维素酶之间的作用机理有何差异等问题仍待解决。此外,针对寒冷条件下的纤维素降解,一些低温降解菌株的作用机理尚不明确,比如低温纤维素酶对冷环境的具体适应机理,在低温条件下如何发挥作用等。未来需要将研究及测定方法进行改善和创新,才能进一步解决这些疑难问题,从而为实际生产中的应用提供理论科学依据。
3) 低温纤维素酶生产条件的优化及应用。低温纤维素酶有巨大的应用潜力,虽然它已经在多个领域中应用,但仍受到生产成本高、酶产量低和酶活性不稳定等问题的限制,未来随着科技的发展和新型理论的支撑,可以研发出更多的功能优势,通过优化酶生产各个环节的工艺流程,从而应用到更多领域中,为可再生资源利用作出贡献,这将对缓解能源危机具有重要意义。
| [1] |
Kumari P, Sayas T, Bucki P, et al. Real-time visualization of cellulase activity by microorganisms on surface[J]. International Journal of Molecular Sciences, 2020, 21(18): 6593 DOI:10.3390/ijms21186593 (  0) 0) |
| [2] |
Coseri S. Insights on cellulose research in the last two decades in Romania[J]. Polymers, 2021, 13(5): 689 DOI:10.3390/polym13050689 (  0) 0) |
| [3] |
荣楠, 张建伟, 包远远, 等. 基于磁性纳米颗粒分选的土壤活性纤维素降解微生物富集研究[J]. 土壤学报, 2022, 59(5): 1457-1467 (  0) 0) |
| [4] |
Aziz T, Farid A, Haq F, et al. A review on the modification of cellulose and its applications[J]. Polymers, 2022, 14(15): 3206 DOI:10.3390/polym14153206 (  0) 0) |
| [5] |
Zihare L, Blumberga D. Market opportunities for cellulose products from combined renewable resources[J]. Environmental and Climate Technologies, 2017, 19(1): 33-38 DOI:10.1515/rtuect-2017-0003 (  0) 0) |
| [6] |
洪康进, 王倩, 陈俊柳, 等. 纤维素改性及其应用研究进展[J]. 食品工业科技, 2020, 41(10): 332-338 (  0) 0) |
| [7] |
Smuga-Kogut M, Zgórska K, Szymanowska-Powałowska D. Influence of the crystalline structure of cellulose on the production of ethanol from lignocellulose biomass[J]. International Agrophysics, 2016, 30(1): 83-88 DOI:10.1515/intag-2015-0072 (  0) 0) |
| [8] |
谢占玲, 吴润. 纤维素酶的研究进展[J]. 草业科学, 2004, 21(4): 72-76 DOI:10.3969/j.issn.1001-0629.2004.04.020 (  0) 0) |
| [9] |
王洪媛, 范丙全. 三株高效秸秆纤维素降解真菌的筛选及其降解效果[J]. 微生物学报, 2010, 50(7): 870-875 (  0) 0) |
| [10] |
宁琪, 陈林, 李芳, 等. 被孢霉对土壤养分有效性和秸秆降解的影响[J]. 土壤学报, 2022, 59(1): 206-217 (  0) 0) |
| [11] |
Ilić N, Milić M, Beluhan S, et al. Cellulases: From lignocellulosic biomass to improved production[J]. Energies, 2023, 16(8): 3598 DOI:10.3390/en16083598 (  0) 0) |
| [12] |
王士强, 顾春梅, 赵海红. 木质纤维素生物降解机理及其降解菌筛选方法研究进展[J]. 华北农学报, 2010, 25(S1): 313-317 DOI:10.7668/hbnxb.2010.S1.071 (  0) 0) |
| [13] |
孙玲, 吴景贵, 李建明, 等. 纤维素降解细菌对玉米秸秆的降解效果[J]. 吉林农业大学学报, 2019, 41(4): 402-407 (  0) 0) |
| [14] |
邹芳, 赵娟, 雷燕萍, 等. 一株烟草秸秆降解菌的分离、鉴定及酶学性质研究[J]. 土壤, 2016, 48(5): 939-945 (  0) 0) |
| [15] |
Budihal S R, Agsar D, Patil S R. Enhanced production and application of acidothermophilic Streptomyces cellulase[J]. Bioresource Technology, 2016, 200: 706-712 DOI:10.1016/j.biortech.2015.10.098 (  0) 0) |
| [16] |
章沙沙, 徐健峰, 柳增善. 纤维素降解菌的研究与应用进展[J]. 工业微生物, 2021, 51(2): 46-52 (  0) 0) |
| [17] |
宋洁. 寒地黑土中降解纤维素放线菌的筛选及对放线菌HUCO-GS316新种的鉴定[D]. 哈尔滨: 哈尔滨商业大学, 2020.
(  0) 0) |
| [18] |
Riddech N, Saharm N, Chaisawang C, et al. Multifunctional cellulolytic activities from Streptomyces osmaniensis for agricultural and enzyme industry[J]. Malaysian Journal of Microbiology, 2016, 12(1): 85-90 (  0) 0) |
| [19] |
Bayer E A, Belaich J P, Shoham Y, et al. The cellulosomes: Multienzyme machines for degradation of plant cell wall polysaccharides[J]. Annual Review of Microbiology, 2004, 58: 521-554 DOI:10.1146/annurev.micro.57.030502.091022 (  0) 0) |
| [20] |
Sánchez-Jiménez P E, Pérez-Maqueda L A, Perejón A, et al. An improved model for the kinetic description of the thermal degradation of cellulose[J]. Cellulose, 2011, 18(6): 1487-1498 DOI:10.1007/s10570-011-9602-3 (  0) 0) |
| [21] |
陈昕, 姜成浩, 罗安程. 秸秆微生物降解机理研究[J]. 安徽农业科学, 2013, 41(23): 9728–9731, 9740 DOI:10.3969/j.issn.0517-6611.2013.23.070 (  0) 0) |
| [22] |
周建, 罗学刚, 苏林. 纤维素酶法水解的研究现状及展望[J]. 化工科技, 2006, 14(2): 51-56 (  0) 0) |
| [23] |
文少白, 李勤奋, 侯宪文, 等. 微生物降解纤维素的研究概况[J]. 中国农学通报, 2010, 26(1): 231-236 (  0) 0) |
| [24] |
Sugano J, Linnakoski R, Huhtinen S, et al. Cellulolytic activity of brown-rot Antrodia sinuosa at the initial stage of cellulose degradation[J]. Holzforschung, 2019, 73(7): 673-680 DOI:10.1515/hf-2018-0145 (  0) 0) |
| [25] |
Coughlan M P. The properties of fungal and bacterial cellulases with comment on their production and application[J]. Biotechnology and Genetic Engineering Reviews, 1985, 3(1): 39-110 DOI:10.1080/02648725.1985.10647809 (  0) 0) |
| [26] |
张俊, 许超, 张宇, 等. 纤维素酶降解机理的研究进展[J]. 华南理工大学学报(自然科学版), 2019, 47(9): 121-130 (  0) 0) |
| [27] |
杨腾腾, 周宏, 王霞, 等. 微生物降解纤维素的新机制[J]. 微生物学通报, 2015, 42(5): 928-935 (  0) 0) |
| [28] |
Wilson D B. The first evidence that a single cellulase can be essential for cellulose degradation in a cellulolytic microorganism[J]. Molecular Microbiology, 2009, 74(6): 1287-1288 DOI:10.1111/j.1365-2958.2009.06889.x (  0) 0) |
| [29] |
Han W, He M. The application of exogenous cellulase to improve soil fertility and plant growth due to acceleration of straw decomposition[J]. Bioresource Technology, 2010, 101(10): 3724-3731 DOI:10.1016/j.biortech.2009.12.104 (  0) 0) |
| [30] |
阳刚, 杨第芹, 曹文涛, 等. 白酒糟纤维素降解菌的优选及酒糟降解工艺[J]. 农业工程学报, 2020, 36(13): 212-221 DOI:10.11975/j.issn.1002-6819.2020.13.025 (  0) 0) |
| [31] |
杨新莉. 纤维素酶在纺织中的应用[J]. 甘肃轻纺科技, 1994(1): 18-19 (  0) 0) |
| [32] |
周向东, 刘亚亮. 纤维素酶整理棉织物的性能与工艺[J]. 丝绸, 2002, 39(4): 16-17 (  0) 0) |
| [33] |
张圣燕, 张成. 纤维素酶提取冬枣叶中总黄酮工艺的研究[J]. 食品工业科技, 2013, 34(1): 188-190 (  0) 0) |
| [34] |
苏贵龙, 李建喜. 纤维素酶及其在中药发酵中的运用[J]. 黑龙江畜牧兽医, 2016(17): 65–67, 72 (  0) 0) |
| [35] |
Perfumo A, Banat I M, Marchant R. Going green and cold: Biosurfactants from low-temperature environments to biotechnology applications[J]. Trends in Biotechnology, 2018, 36(3): 277-289 DOI:10.1016/j.tibtech.2017.10.016 (  0) 0) |
| [36] |
冯欣欣, 李凤兰, 徐永清, 等. 新疆寒冷地区腐木中产纤维素酶菌株的筛选与低温产酶特性[J]. 浙江农业学报, 2021, 33(8): 1468-1476 DOI:10.3969/j.issn.1004-1524.2021.08.14 (  0) 0) |
| [37] |
单建荣, 全鑫, 朱用哲, 等. 一株低温纤维素降解菌的筛选与产酶条件优化[J]. 生态学杂志, 2021, 40(4): 1128-1136 (  0) 0) |
| [38] |
杨涛, 贾晓君, 秦晓萌, 等. 一株烟曲霉菌株F7的筛选及其纤维素降解与温度适应相关机制[J]. 应用与环境生物学报, 2022, 28(1): 190-200 (  0) 0) |
| [39] |
Zheng G X, Lu Z X, Li J, et al. Screening and performance of L-14, a novel, highly efficient and low temperature- resistant cellulose-degrading strain[J]. International Journal of Agricultural and Biological Engineering, 2020, 13(1): 247-254 DOI:10.25165/j.ijabe.20201301.5128 (  0) 0) |
| [40] |
Jiang G F, Chen P J, Bao Y Z, et al. Isolation of a novel psychrotrophic fungus for efficient low-temperature composting[J]. Bioresource Technology, 2021, 331: 125049 DOI:10.1016/j.biortech.2021.125049 (  0) 0) |
| [41] |
Wang R X, Tao D X, Li J, et al. Screening and characterization of a low-temperature-resistant cellulose- degrading strain, Trichoderma harzianum L-8, from a primitive forest[J]. BioResources, 2022, 17(2): 3303-3319 DOI:10.15376/biores.17.2.3303-3319 (  0) 0) |
| [42] |
Dong X L, Ji J, Zhang S H, et al. Study on a low-temperature cellulose-degrading strain: Fermentation optimization, straw degradation, and the effect of fermentation broth on seed growth[J]. Biotechnology and Bioprocess Engineering, 2022, 27(4): 652-667 DOI:10.1007/s12257-021-0265-0 (  0) 0) |
| [43] |
Zhang S, Shan D X, Liu X, et al. Cellulose-degrading strains: Their screening and application to corn straw in low-temperature environments[J]. Polish Journal of Environmental Studies, 2018, 27(5): 2349-2355 DOI:10.15244/pjoes/79272 (  0) 0) |
| [44] |
台少华. 低温秸秆降解木霉筛选及对秸秆降解中微生物群落的影响[D]. 济南: 山东建筑大学, 2023.
(  0) 0) |
| [45] |
李娜, 韩永武, 金勋, 等. 一株低温秸秆纤维素降解菌的分离、鉴定及降解特性[J]. 玉米科学, 2019, 27(1): 159-163 (  0) 0) |
| [46] |
徐丽萍, 姜喆, 葛英亮, 等. 利用Illumina高通量测序技术筛选低温降解玉米秸秆真菌[J]. 食品工业科技, 2020, 41(20): 99-103 (  0) 0) |
| [47] |
亢宗静, 袁楠, 王蓥燕, 等. 若尔盖高原湿地的真菌群落结构及低温纤维素降解真菌特征[J]. 土壤通报, 2017, 48(4): 830-836 (  0) 0) |
| [48] |
勾长龙, 王雨琼, 王巍, 等. 两株长白山地区低温纤维素降解真菌的筛选鉴定及其产酶条件优化[J]. 中山大学学报(自然科学版), 2015, 54(5): 115–121, 129 (  0) 0) |
| [49] |
郑国香, 艾爽, 尹婷, 等. 耐低温降解纤维素菌株筛选、鉴定及产酶条件优化[J]. 东北农业大学学报, 2019, 50(2): 79-89 (  0) 0) |
| [50] |
邢慧珍, 宋水山, 黄媛媛, 等. 一株低温玉米秸秆降解真菌的筛选、鉴定及降解特性[J]. 微生物学通报, 2020, 47(9): 2923-2933 (  0) 0) |
| [51] |
穆春雷, 武晓森, 李术娜, 等. 低温产纤维素酶菌株的筛选、鉴定及纤维素酶学性质[J]. 微生物学通报, 2013, 40(7): 1193-1201 (  0) 0) |
| [52] |
路伟明, 李淑芹, 曹知平, 等. 一株低温牛粪降解真菌的筛选及生长条件的确定[J]. 东北农业大学学报, 2008, 39(11): 36-38 (  0) 0) |
| [53] |
He Z G, Ding B P, Ali Q, et al. Screening and isolation of cold-adapted cellulose degrading bacterium: A candidate for straw degradation and De novo genome sequencing analysis[J]. Frontiers in Microbiology, 2023, 13: 1098723 (  0) 0) |
| [54] |
Sun S S, Zhang Y T, Liu K R, et al. Insight into biodegradation of cellulose by psychrotrophic bacterium Pseudomonas sp. LKR-1 from the cold region of China: Optimization of cold-active cellulase production and the associated degradation pathways[J]. Cellulose, 2020, 27(1): 315-333 (  0) 0) |
| [55] |
Wang Y, Cai J L, Li D M. Efficient degradation of rice straw through a novel psychrotolerant Bacillus cereus at low temperature[J]. Journal of the Science of Food and Agriculture, 2023, 103(3): 1394-1403 (  0) 0) |
| [56] |
樊兆阳, 陈晗. 低温降解纤维素细菌的分离、鉴定及其酶活特性分析[J]. 内蒙古石油化工, 2015, 41(7): 11-13 (  0) 0) |
| [57] |
李春艳, 于琦, 冯露, 等. 低温纤维素降解菌分离鉴定及产酶条件优化[J]. 东北农业大学学报, 2015, 46(10): 74-81 (  0) 0) |
| [58] |
侯会利. 牛粪固体物堆肥制作卧床垫料的效果及其低温纤维素降解菌的筛选[D]. 呼和浩特: 内蒙古农业大学, 2015.
(  0) 0) |
| [59] |
尚晓瑛, 程旭艳, 霍培书, 等. 1株堆肥耐低温纤维素降解菌的筛选、鉴定及生长特性的初步研究[J]. 华中农业大学学报, 2012, 31(5): 558-562 (  0) 0) |
| [60] |
于素素. 低温玉米秸秆降解菌的筛选及其复合菌系产酶条件优化[D]. 沈阳: 沈阳农业大学, 2019.
(  0) 0) |
| [61] |
Du Y, Yuan B, Zeng Y H, et al. Draft genome sequence of the cellulolytic bacterium Clavibacter sp. CF11, a strain producing cold-active cellulase[J]. Genome Announcements, 2015, 3(1): e01304-14 (  0) 0) |
| [62] |
王靖然, 董珊珊, 侯雨昕, 等. 一株秸秆降解耐冷细菌的分离及其主要生物活性[J]. 安徽农业科学, 2022, 50(8): 85-89 (  0) 0) |
| [63] |
张恒芳, 李林, 史喜林, 等. 玉米秸秆低温纤维素分解菌的筛选及分解效果测定[J]. 玉米科学, 2013, 21(5): 147-150 (  0) 0) |
| [64] |
孟建宇, 李蘅, 樊兆阳, 等. 低温纤维素降解菌的分离与鉴定[J]. 应用与环境生物学报, 2014, 20(1): 152-156 (  0) 0) |
| [65] |
曹慧, 任世威, 张腾月, 等. 青藏高原低温纤维素降解菌的筛选与酶学特性[J]. 饲料工业, 2021, 42(8): 36-41 (  0) 0) |
| [66] |
Guevara C, Zambrano M M. Sugarcane cellulose utilization by a defined microbial consortium[J]. FEMS Microbiology Letters, 2006, 255(1): 52-58 (  0) 0) |
| [67] |
魏蔚, 吴昊, 宋时丽, 等. 复合菌剂对小麦秸秆降解速率、土壤酶和土壤微生物类群的影响[J]. 土壤, 2019, 51(5): 955-963 (  0) 0) |
| [68] |
颜淑慧, 孟庆俊, 许瑞, 等. 耐低温纤维素降解复合菌系的筛选[J]. 环境科学研究, 2023, 36(7): 1404-1415 (  0) 0) |
| [69] |
路垚, 刘雅辉, 孙建平, 等. 耐低温降解纤维素菌株的筛选及复合菌系构建[J]. 安徽农业科学, 2022, 50(10): 6–10, 27 (  0) 0) |
| [70] |
孟建宇, 冀锦华, 贾丽娟, 等. 基于三种碳源筛选低温纤维素降解菌及其复合系的降解能力分析[J]. 生物技术通报, 2019, 35(8): 77-84 (  0) 0) |
| [71] |
盛铭浩, 徐凤花, 代欢, 等. 低温纤维素降解复合菌系的选育及性能分析[J]. 湖北农业科学, 2013, 52(8): 1814–1816, 1828 (  0) 0) |
| [72] |
杜俊杰, 徐凤花, 赵忠宝, 等. 低温兼性厌氧纤维素降解菌系的选育[J]. 东北农业大学学报, 2012, 43(2): 83-87 (  0) 0) |
| [73] |
萨如拉, 高聚林, 于晓芳, 等. 玉米秸秆低温降解复合菌系的筛选[J]. 中国农业科学, 2013, 46(19): 4082-4090 (  0) 0) |
| [74] |
董硕, 迟乃玉, 王鑫, 等. 低温纤维素酶的研究进展[J]. 生物技术通报, 2011, 27(2): 37-41 (  0) 0) |
| [75] |
刘秀华, 刘建凤, 卢雪梅. 纤维弧菌的低温纤维素酶研究[J]. 安徽农业科学, 2012, 40(3): 1281-1282 (  0) 0) |
| [76] |
Violot S, Aghajari N, Czjzek M, et al. Structure of a full length psychrophilic cellulase from Pseudoalteromonas haloplanktis revealed by X-ray diffraction and small angle X-ray scattering[J]. Journal of Molecular Biology, 2005, 348(5): 1211-1224 (  0) 0) |
| [77] |
Dhar H, Kasana R C, Dutt S, et al. Cloning and expression of low temperature active endoglucanase EG5C from Paenibacillus sp. IHB B3084[J]. International Journal of Biological Macromolecules, 2015, 81: 259-266 (  0) 0) |
| [78] |
Kim D Y, Kim J, Lee Y M, et al. Novel, acidic, and cold-adapted glycoside hydrolase family 8 endo-β-1, 4-glucanase from an Antarctic lichen-associated bacterium, Lichenicola cladoniae PAMC 26568[J]. Frontiers in Microbiology, 2022, 13: 935497 (  0) 0) |
| [79] |
Iyo A H, Forsberg C W. A cold-active glucanase from the ruminal bacterium Fibrobacter succinogenes S85[J]. Applied and Environmental Microbiology, 1999, 65(3): 995-998 (  0) 0) |
| [80] |
Chen F F, Ye J R, Sista Kameshwar A K, et al. A novel cold-adaptive endo-1, 4-β-glucanase from Burkholderia pyrrocinia JK-SH007 Gene expression and characterization of the enzyme and mode of action[J]. Frontiers in Microbiology, 2020, 10: 3137 (  0) 0) |
| [81] |
Chang H Y, Lu S F, Huang Z Y, et al. Effect of different microbial agents on corn stalk composting[J]. Applied Ecology and Environmental Research, 2020, 18(3): 4743-4758 (  0) 0) |
| [82] |
Ueda M, Maruyama T, Kawasaki K, et al. Purification, Characterization, and Gene Cloning of a Cold-Adapted Endo-1, 4-β-glucanase from Bellamya chinensis Laeta[J]. Molecular Biotechnology, 2016, 58(4): 241-250 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China;
4. Agro-Environmental Protection Institute, Ministry of Agriculture and Rural Affairs, Tianjin 300191, China
 2024, Vol. 56
2024, Vol. 56


