2. 福建师范大学地理研究所, 福州 350117;
3. 中国农业科学院农业经济与发展研究所, 北京 100081;
4. 福建省南平国家农业气象试验站, 福建南平 354200
土壤是植物生长发育的主要养分来源,其中,有机质、氮(N)、磷(P)、钾(K)是植物生长所需的必要养分元素,其含量和生态化学计量比能够反映土壤质量与养分限制状况[1-2]。土壤生态化学计量比在调节生态系统功能中起着重要作用[3]。此前,针对土壤C、N、P元素含量及其生态化学计量比的研究相对较多。Zhang等[4]针对喀斯特原始森林C、N、P化学计量特征及其影响因素的研究发现,喀斯特森林平均土壤C∶N低于我国和全球平均水平。Müller等[5]研究表明,随着海拔升高,土壤N和P的有效性及土壤C∶P和N∶P显著降低。周志等[6]对武夷山不同茶区土壤养分状况及其对茶叶品质成分影响的研究表明,茶园中土壤养分状况对茶叶的品质具有较大影响,合理的土壤养分状况有利于茶叶品质的提高。土壤K是重要的营养元素之一[7-8],Gudadhe等[9]研究发现,虽然植物能够从土壤矿物中获取一定量的K以保证正常生长所需,但是从长远来看,种植作物时需要向土壤中合理施加钾肥以平衡土壤养分,提高土壤的可持续生产力。在陆地生态系统的生态化学计量研究中,涉及K的生态化学计量比的探究相对于N、P更是鲜见报道[10]。实际上,K与其他元素之间的生态化学计量特征具有重要意义,如相关研究表明,土壤N∶K的增加会造成物种丰富度的减少,土壤N∶K和P∶K的动态变化可以指示植物对水分胁迫的耐受性[11]。鉴于此,针对当前研究不足,更为全面系统地开展包括K在内的元素生态化学计量学相关研究十分必要。
真菌不仅是地球上最多样化的生物群体之一,也是控制土壤C循环、植物营养和病理不可或缺的生态因子,在维持生态系统平衡方面起着重要作用[12]。相关研究表明,土壤真菌群落可以与外界进行复杂的相互作用,进而调节生态系统在养分储量方面的能力,提高植物根际土壤中的C和养分含量[13-14]。同时,土壤中的养分含量及其计量比特征对真菌群落结构也具有调节作用,如刘明慧等[15]对土壤真菌的影响因素研究中发现,土壤全N是影响真菌群落OTU的主要因素。此外,土壤真菌群落具有显著的功能分化特征,如植物病原菌会限制植物群落的丰度,对生态系统多样性产生较大影响;土壤中菌根真菌与植物共生形成菌根,可以为植物提供必要的养分元素;腐生真菌可以有效地分解土壤有机质,促进土壤养分元素的循环利用效率[16-17]。不过由于真菌环境调控的复杂性导致其分布特征和功能存在诸多不确定性,进一步开展真菌群落功能特征及其对土壤碳动态的影响研究具有重要意义。
茶树(Camellia sinensis)作为一种多年生常绿木本植物,是我国重要的经济作物之一[18]。我国茶叶种植面积和产量均居世界首位,茶叶出口量居世界第二[19]。福建是我国最大的产茶省份,武夷山是闽北地区乌龙茶及红茶的发源地和主产区,其产量在福建省茶叶产量中占比较大[9]。武夷山岩茶产区按照传统划分方式可以分为正岩茶、半岩茶和洲茶产区,正岩茶产自武夷山景区内部,以“三坑两涧”茶园为代表的区域;半岩茶来自“三坑两涧”等核心茶园以外、九曲溪之内的区域;洲茶则产于景区以外的武夷茶园[20-21]。武夷山不同岩茶产区土壤性质不同,正岩茶产区、半岩茶产区、洲茶产区代表性土壤分别为紫色砂砾岩、红色硅铝质土及河流冲积沙质土[22]。目前,关于武夷山岩茶产区的研究主要集中在土壤养分状况、生态地质背景、品质形成、种植模式等。实际上在调节茶树生长中,养分的平衡比绝对量更为重要[23],特别是过去忽视了K营养元素在养分平衡中的作用。姚月明[20]研究发现,K在正岩茶产区土壤中含量最高,茶园土壤K含量对改善茶叶香气、提升茶叶品质具有明显效果。鉴于当前针对不同岩茶产区土壤C、N、P、K计量比及其与真菌多样性耦合特征的研究十分有限[7-8]。本文通过原位样品采集和室内分析,借助高通量测序技术等方法,解析武夷山不同岩茶产区土壤C、N、P、K含量及其生态化学计量比对真菌群落组成和功能的影响。本研究的开展对基于养分管理和微生物调控的茶园健康土壤培育和可持续生产具有重要价值。
1 材料与方法 1.1 研究区与采样点概况福建省武夷山市属亚热带季风湿润气候,年平均气温为18.5 ℃,年均降水量为1 485 ~ 2 100 mm,无霜期93 ~ 112 d[24]。正岩茶、半岩茶和洲茶产区分别位于武夷山市武夷街道天心村牛栏坑(117°58′21″E,27°40′37″N)、星村镇朝阳村乌岩垄茶园(117°49′25″E,27°37′34″N)和兴田镇程家洲农场(118°01′24″E,27°33′18″N)。不同岩茶产区所种植的茶树品种均为肉桂,种植年限均大于20年;灌溉模式均为自然降水与人工灌溉相结合,在干旱季以人工灌溉为主;不同岩茶产区均施用茶叶专用肥(N∶P2O5∶K2O=15∶15∶15),施肥量为600 ~ 750 kg/hm2。
1.2 样品采集野外土壤样品采集时间为2023年7月,土壤样品采集遵循典型性与代表性原则,分别采集正岩茶、半岩茶、洲茶产区0 ~ 15 cm和15 ~ 30 cm土层土壤。土壤样品采集后,装入已灭菌的自封袋中带回实验室,每个样地采集4个重复土样,共计24个土壤样品。将土壤样品中的植物残体、根系及其他杂质去除后分为两份,一份通过晾晒自然风干,研磨、过筛后装入自封袋待用;另一份土样保存在–20 ℃冰箱用于微生物及其他指标的测定。鉴于0 ~ 15 cm土层土壤对自然环境及人为活动等的响应更为敏感,此次真菌群落测定主要选择该层土壤。
1.3 土壤样品测定与分析 1.3.1 土壤理化性质测定土壤全碳(TC)、全氮(TN)采用碳氮元素分析仪(Elementar Vario MAX CN, Germany)测定;土壤全磷(TP)采用钼锑抗比色法测定[25];土壤全钾(TK)采用原子吸收分光光度法测定[25]。
1.3.2 土壤真菌群落多样性及结构分析采用E.Z.N.A. Soil DNA Kit (Omega Bio-tek, Inc., USA)试剂盒提取土壤微生物DNA,使用Nanodrop 2000 (ThermoFisher Scientific, Inc., USA)检测DNA质量和浓度,DNA样本储存在–20 ℃以备后续实验使用。对ITS1 (ITS1F-ITS2R)进行PCR扩增,扩增引物序列为ITS1F (CTTGGTCATTTAGAGGAAGTAA)和ITS2R (GCTGCGTTCTTCATCGATGC)。PCR扩增反应程序参数为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸60 s,循环34次;72 ℃终延伸7 min,4 ℃保存直至反应结束。扩增目的条带大小检测使用1% 琼脂糖凝胶电泳30 min,电压控制在170 V。PCR产物使用Agencourt AMPure XP (Beckman Coulter, Inc., USA)核酸纯化试剂盒进行自动化纯化。PCR产物使用NEB Next Ultra Ⅱ DNA Library Prep Kit (New England Biolabs, Inc., USA)建库试剂盒进行文库构建,构建完成的文库使用Agencourt AMPure XP (Beckman Coulter, Inc., USA)核酸纯化试剂盒进行纯化。分别使用Nanodrop 2000 (ThermoFisher Scientific, Inc., USA)粗检文库浓度,Agilent 2100 Bioanalyzer (Agilent Technologies, Inc., USA)检测文库片段大小,ABI StepOnePlus Real-Time PCR System (Applied Biosystems, Inc., USA)精确定量文库浓度。最后文库在Illumina Miseq (Illumina, Inc., USA)平台进行测序,测序策略为PE300。测序工作由北京奥维森基因科技有限公司完成。
1.4 数据分析与图形绘制采用Excel 2019软件对土壤养分原始数据进行整理,原始数据的平均值和标准误差采用SPSS 27.0软件进行分析;土壤各养分生态化学计量比均采用质量比,并运用SPSS 27.0软件中的单因素方差分析(ANOVA)及独立样本t检验进行差异性检验,显著性水平为α=0.05;采用Origin 2022 Pro软件进行相关图形绘制。
土壤微生物数据分析在奥维森云计算平台完成(http://218.2.224.234:8888/,北京奥维森基因科技有限公司)。利用FUNGuild数据库分析不同岩茶产区土壤真菌群落营养类型及功能分组情况,获得相关功能预测信息。运用奥维森云计算平台绘制不同岩茶产区土壤真菌PCoA图并进行置换多元方差分析(PERMANOVA);土壤真菌群落组成及相关性分析图使用Origin 2022 Pro软件绘制;岩茶产区土壤养分及其计量比与真菌群落Mantel检验分析及图形绘制利用R语言(4.3.0)中的“linkET”包、“ggplot2”包、“dplyr”包实现。
2 结果与分析 2.1 不同岩茶产区土壤C、N、P、K含量特征正岩茶、半岩茶和洲茶产区土壤C、N、P、K含量特征如图 1所示。总体来看,除正岩茶产区土壤K含量在0 ~ 15 cm与15 ~ 30 cm土层间有显著差异(P < 0.05)外,各岩茶产区C、N、P含量及半岩茶和洲茶产区K含量在0 ~ 15 cm与15 ~ 30 cm土层间均无显著差异。相对于15 ~ 30 cm土层,0 ~ 15 cm土层土壤C、N、P平均含量分别提高4.42%、8.15%、4.83%。正岩茶产区土壤K元素含量显著(P < 0.05)高于其他产区茶园,而半岩茶产区土壤P元素含量显著(P < 0.05)高于其他产区茶园。
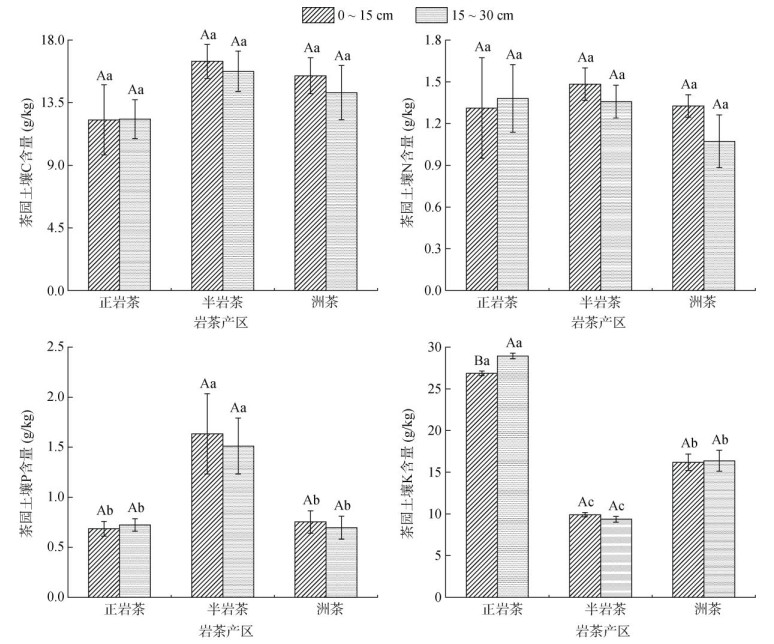
|
(图中大写字母不同表示同一岩茶产区不同土层深度差异显著(P < 0.05),小写字母不同表示同一土层深度不同岩茶产区间差异显著(P < 0.05),下图同) 图 1 不同岩茶产区土壤C、N、P、K含量特征 Fig. 1 Soil C, N, P and K contents in different producing areas of rock tea |
正岩茶、半岩茶、洲茶产区土壤C、N、P、K生态化学计量比特征如图 2所示。由图 2可知,同一岩茶产区0 ~ 15 cm与15 ~ 30 cm土层间土壤C、N、P、K生态化学计量比差异均不显著。0 ~ 15 cm土层土壤中,正岩茶产区C∶K、N∶K、P∶K与半岩茶产区具有显著差异(P < 0.05),与洲茶产区C∶N、C∶K呈现显著差异;半岩茶产区C∶K、N∶K、P∶K与洲茶产区具有显著差异。15 ~ 30 cm土层土壤中,正岩茶产区C∶K、N∶P、N∶K、P∶K与半岩茶产区具有显著差异(P < 0.05),与洲茶产区C: N呈现显著差异;半岩茶产区C∶P、C∶K、N∶K、P∶K与洲茶产区具有显著差异。单因素方差检验分析结果表明,正岩茶产区土壤,C∶P、N∶P分别比半岩茶产区显著(P < 0.05)提高了44.67%、79.87%,C∶K、N∶K、P∶K则分别显著降低了280.95%、205.85%、538.44%;正岩茶产区土壤C∶N、C∶K、N∶K分别比洲茶产区显著降低了30.59%、114.04%、57.92%;半岩茶产区土壤C∶K、N∶K、P∶K分别比洲茶产区显著提高了77.98%、93.67%、251.21%,C∶P、N∶P则分别显著降低了79.81%、67.05%。
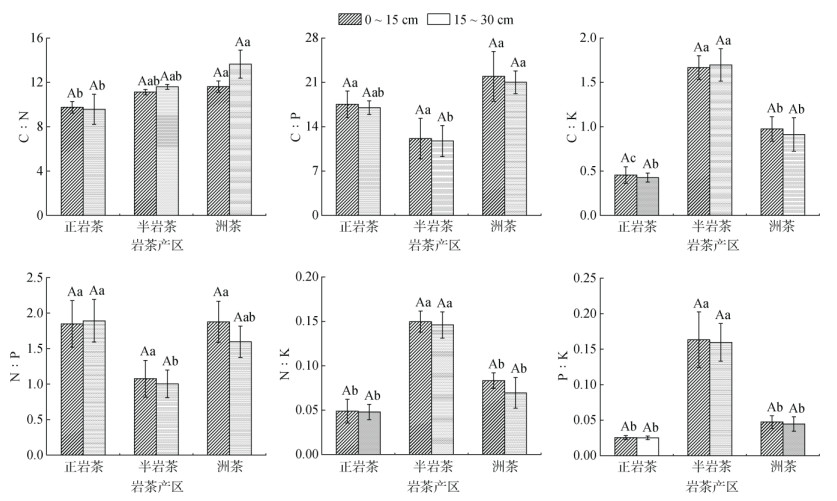
|
图 2 不同岩茶产区土壤C、N、P、K化学计量比特征 Fig. 2 Stoichiometric ratios of soil C, N, P and K in different producing areas of rock tea |
茶园土壤真菌α多样性指数分析结果如表 1所示。结果表明,半岩茶产区土壤真菌OTUs个数与洲茶产区土壤OTUs个数具有显著差异(P < 0.05)。总体而言,洲茶产区Chao1指数、PD_whole_tree和Shannon指数均高于其他两个产区,半岩茶产区Shannon指数及Simpson指数与其他两地具有显著差异(P < 0.05)。
|
|
表 1 不同岩茶产区土壤OTUs及α多样性指数 Table 1 Soil OTUs and α diversity indices in different producing areas of rock tea |
为明晰不同岩茶产区土壤真菌群落结构间的差异,采用基于Bray-Curtis距离算法对各岩茶产区土壤真菌OTU进行主坐标分析(Principal co-ordinates analysis, PCoA),结果如图 3所示。由图可知,第一轴和第二轴累积解释量为60.38%,能够有效解释土壤样本真菌群落分布特征、差异性及相似性。图中正岩茶产区与半岩茶和洲茶产区之间点的距离较远,表明正岩茶产区土壤真菌群落结构与半岩茶和洲茶产区土壤真菌群落结构之间的差异显著。基于Bray-Curtis距离算法在OTU水平上进行Permanova分析,结果显示F=4.348 4,P=0.001,进一步说明了不同岩茶产区土壤真菌群落差异具有显著性。
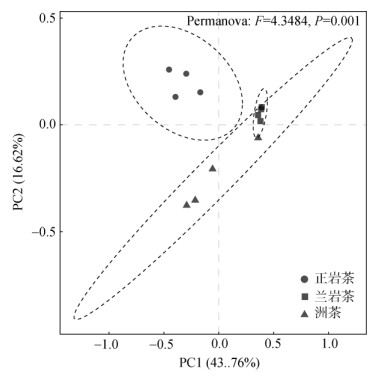
|
图 3 不同岩茶产区土壤真菌群落主坐标分析 Fig. 3 Principal co-ordinates analysis of soil fungal communities in different producing areas of rock tea |
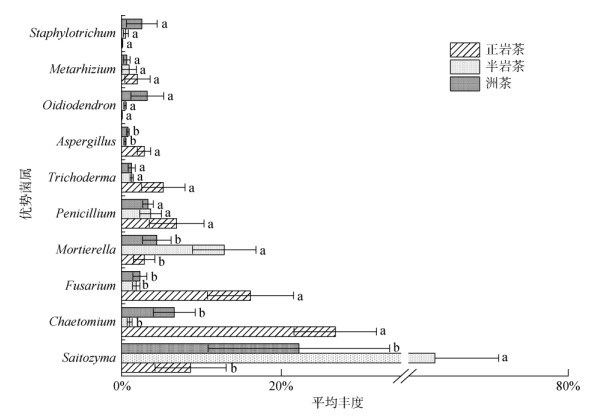
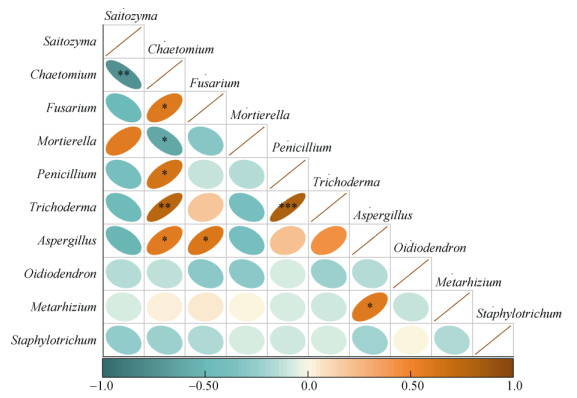
岩茶产区土壤真菌门水平上的群落组成如图 4所示。岩茶产区土壤真菌优势菌门为:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉菌门(Mortierellomycota),分别占真菌群落的50.1%、37.2%、6.8%,三者占到总丰度的94.1%。不同岩茶产区土壤真菌群落优势菌属相对丰度及差异特征分析如图 5所示。岩茶产区土壤优势菌群属为:沙蜥属(Saitozyma)、毛壳菌属(Chaetomium)和镰刀菌属(Fusarium),分别占真菌群落的31.4%、11.5%、6.8%,三者占到总丰度的49.7%。由图 5可知,半岩茶产区土壤真菌群落中,沙蜥属和被孢霉属(Mortierella)与正岩茶和洲茶产区土壤真菌属具有显著差异(P < 0.05),正岩茶产区土壤真菌属中毛壳菌属、镰刀菌属和曲霉菌属(Aspergillus)与半岩茶和洲茶产区土壤真菌属具有显著差异(P < 0.05)。茶园土壤真菌群落优势菌属相关性分析结果如图 6所示,毛壳菌属与木霉属(Trichoderma),青霉菌属(Penicillium)与木霉属呈极显著正相关(P < 0.01);毛壳菌属与镰刀菌属、青霉菌属和曲霉菌属,镰刀菌属与曲霉菌属,曲霉菌属与绿僵菌属(Metarhizium)呈显著正相关(P < 0.05);沙蜥属与毛壳菌属呈极显著负相关(P < 0.01);毛壳菌属与被孢霉属呈显著负相关(P < 0.05)。
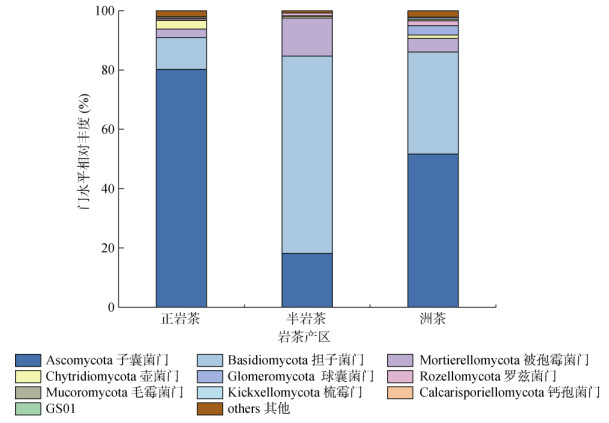
|
图 4 不同岩茶产区土壤真菌群落门水平相对丰度 Fig. 4 Relative abundance of soil fungi at phylum level in different producing areas of rock tea |
|
(Saitozyma: 沙蜥属;Chaetomium: 毛壳菌属;Fusarium: 镰刀菌属;Mortierella: 被孢霉属;Penicillium: 青霉素属;Trichoderma: 木霉属;Aspergillus: 曲霉素属;Oidiodendron: 树粉孢属;Metarhizium: 绿僵菌属;Staphylotrichum: 圆孢霉属;下同。同一优势菌属内不同小写字母表示不同岩茶产区之间差异显著(P < 0.05)) 图 5 不同岩茶产区土壤真菌群落优势菌属相对丰度及差异特征 Fig. 5 Relative abundance and difference characteristics of soil fungal community genera in different producing areas of rock tea |
|
(*、**、***分别表示相关性达P < 0.05、P < 0.01,P < 0.001显著性水平,下同) 图 6 茶园土壤真菌群落优势菌属间的相关性分析 Fig. 6 Correlation analysis of dominant genera in soil fungal community in tea garden |
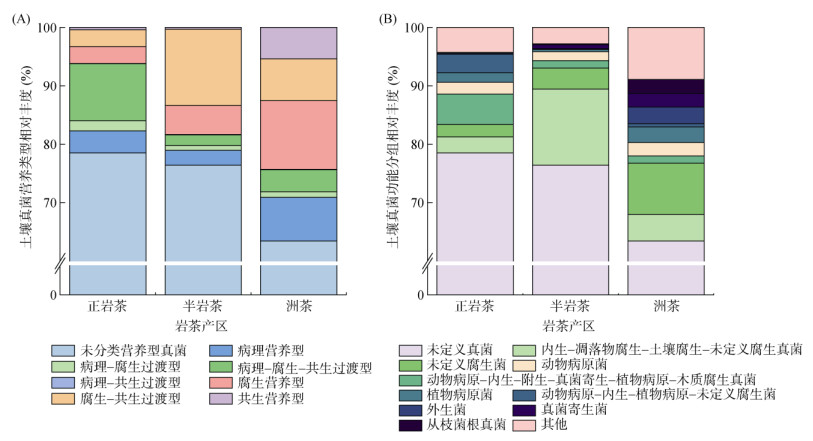
基于FUNGuild数据库对岩茶产区茶园土壤真菌群落进行功能预测分析。武夷山不同岩茶产区茶园土壤真菌营养类型如图 7A所示,正岩茶、半岩茶和洲茶产区土壤真菌群落营养类型丰度占比最高的分别为病理-腐生-共生过渡型、腐生-共生过渡型和腐生营养型。
|
图 7 不同岩茶产区土壤真菌营养类型(A)和功能分组(B)相对丰度 Fig. 7 Relative abundance of soil fungi nutrient types (A) and functional groups (B) in different producing areas of rock tea |
根据样本中所划分的营养方式,又可以进一步划分若干功能分组,不同岩茶产区茶园土壤真菌群落功能分组相对丰度如图 7B所示。正岩茶、半岩茶和洲茶产区土壤真菌群落功能分组丰度占比最高的分别为动物病原-内生-附生-真菌寄生-植物病原-木质腐生真菌、内生-凋落物腐生-土壤腐生-未定义腐生真菌和未定义腐生真菌。
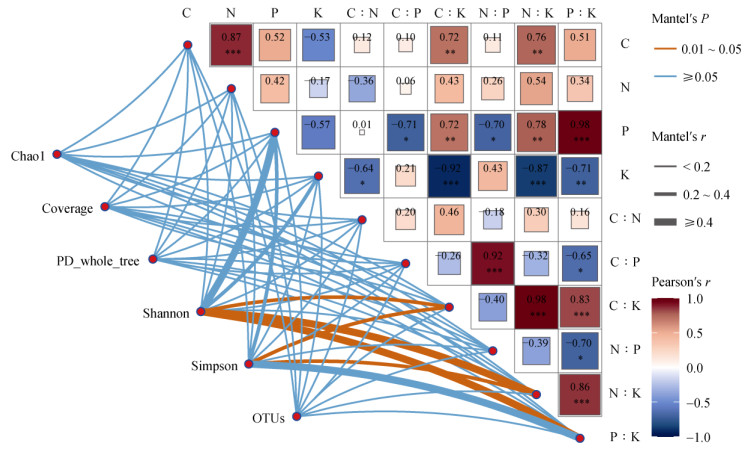
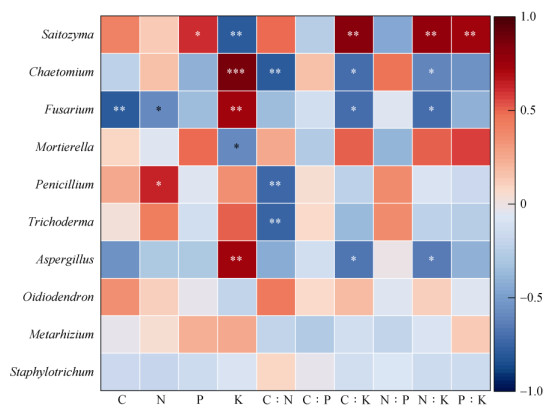
2.5 岩茶产区土壤养分及其计量比与真菌群落的相关性岩茶产区土壤理化性质与土壤真菌群落Mantel检验结果如图 8所示。Mantel检验结果显示,土壤C∶K、N∶K和P∶K是影响岩茶产区土壤真菌群落的关键因子,而各养分元素的绝对含量对土壤真菌群落的影响并不显著。进一步分析茶园土壤真菌群落优势菌属与土壤养分及其计量比相关性,结果如图 9所示。由图可知,K与毛壳菌属、镰刀菌属和曲霉菌属,C∶K、N∶K、P∶K与沙蜥属呈极显著正相关(P < 0.01);N与青霉菌属,P与沙蜥属呈显著正相关(P < 0.05);C与镰刀菌属,K与沙蜥属,C∶N与毛壳菌属、青霉菌属和木霉属呈极显著负相关(P < 0.01);N与镰刀菌属,K与被孢霉属,C∶K、N∶K与毛壳菌属、镰刀菌属和曲霉菌属呈显著负相关(P < 0.05)。
|
图 8 岩茶产区土壤养分及其计量比与土壤真菌群落Mantel检验分析 Fig. 8 Mantel test of soil nutrients and their stoichiometric ratios with soil fungi community in producing area of rock tea |
|
图 9 茶园土壤真菌群落优势菌属与土壤养分及其计量比的相关性分析 Fig. 9 Correlation analysis of dominant bacterial genera of soil fungi community with soil nutrients and their stoichiometric ratios in tea garden |
茶园土壤C、N、P、K含量的高低,将对茶树的生长发育及茶叶品质起到直接影响作用。NY/T853—2004《茶叶产地环境技术条件》[26]将茶园土壤肥力分为Ⅰ级、Ⅱ级和Ⅲ级,分别表示茶园土壤肥力状况良好、尚可和较差。研究结果表明,不同岩茶产区土壤C、N、P、K均达到或接近Ⅰ级指标,说明不同岩茶产区土壤肥力条件适合种植茶树。本研究中,不同岩茶产区之间土壤C、N、P含量及其生态化学计量比差异并不显著,这与周志等[21]的研究结果大体一致。姚月明[20]研究发现,K在正岩茶产区土壤中含量最高,本研究结果与此一致。茶园土壤K含量对改善茶叶香气、提升茶叶品质具有明显效果,正岩茶产区土壤K含量最高,这可能是由于该地土壤为紫色砂砾岩风化的土壤,含K量高[6]。姚月明[20]研究表明,P在正岩茶产区土壤中含量最高、半岩茶产区土壤含量最低。本研究结果有所不同,可能是因为农户在茶树种植管理过程中为提高茶叶产量,增加了半岩茶产区茶园施肥量所致。此外,受地形、水文等因素的影响,半岩茶产区人工修剪的茶树枝叶等凋落物更容易覆盖在土壤表层,由于土壤中的P元素难以从岩石风化中直接获取,主要是凋落物分解而成,因此导致半岩茶产区土壤P含量最高[27-28]。
茶园土壤C、N、P、K生态化学计量比是反映茶园土壤质量高低和平衡的重要指标。Tian等[29]对全国土壤养分计量比的研究表明,全国土壤C∶N、C∶P、N∶P比值分别为11.9、61、5.2。土壤C∶N是反映土壤有机质分解情况、土壤N素矿化能力及土壤C、N养分平衡状况的重要指标[30]。C∶N较低时,表明土壤具有较高的微生物分解能力和N素矿化能力;C∶N较高时,表明其微生物分解能力受限,有机质积累量增加。本研究中,正岩茶及半岩茶产区C∶N低于全国平均水平,表明其在全国平均水平上土壤有机质分解速度快,具有较高的分解能力,有利于促进土壤N素的维持;洲茶产区C∶N高于全国平均水平,其土壤有机质分解速度较正岩茶及半岩茶慢,表明其微生物分解能力受限,有利于土壤有机质的积累。茶园土壤P会影响茶树体内的各种营养元素含量及其计量比,本研究发现,各岩茶产区土壤C∶P、N∶P均低于全国平均水平,较低的C∶P和N∶P有利于土壤有机质的分解,P元素可以得到有效释放,从而补充土壤P库和植物的P素需求。唐丽等[31]研究发现,N∶K、P∶K比值与植株受病害侵扰的可能性呈正相关,N∶K、P∶K比值越高,植株受病害侵扰的可能性越高,从而导致茶树生长发育受限和茶叶产量及品质下降。本研究结果表明,正岩茶产区土壤N∶K、P∶K比值相对较低,表现出良好的自然抗逆属性。
3.2 不同岩茶产区土壤真菌群落组成及功能特征植株健康与否和作物品质高低与土壤中的真菌群落组成及其功能息息相关[32]。本研究中,正岩茶产区优势真菌属为毛壳菌属,半岩茶和洲茶产区优势真菌属为沙蜥属。毛壳菌属是一种有益真菌,其具有提高植株抵抗病害和促进植株生长的能力,并且能有效地抑制镰刀菌属等致病真菌的丰度[33]。同时,毛壳菌属也能产生大量的纤维素分解酶,使凋落物组分快速分解,为土壤提供丰富的有机质[34]。沙蜥属同样作为一种有益真菌,可以有效地提高土壤中有效磷的含量[35]。本研究中,半岩茶产区土壤P含量最高,这可能是由于沙蜥属在半岩茶产区丰度最高从而提高了土壤有效磷含量所致。此外,本研究发现,在正岩茶产区土壤镰刀菌属丰度显著高于半岩茶和洲茶产区,半岩茶中存在较高比例的被孢霉属。因此,正岩茶和半岩茶产区应注重加强茶树真菌功能的管理和调控。从图 6可知,毛壳菌属与被孢霉属呈显著负相关,且毛壳菌属丰度可以有效降低镰刀菌属丰度,因此可以通过提高毛壳菌属丰度改良茶园土壤。邢存芳等[36]和郭晓雯等[37]研究发现,施加生物质炭和秸秆可以有效提高土壤毛壳菌属丰度。因此,在茶园种植期间,适当施加生物质炭和秸秆,有利于优化茶园土壤真菌群落,促进茶树生长发育和提高茶叶品质。
本研究中,茶园土壤真菌功能菌群中腐生营养型真菌丰度较高,腐生营养型真菌可对植物致病菌产生拮抗作用,减少病理营养型的定殖以保护植物免受病害[38]。通过FUNGuild功能预测可知,正岩茶、半岩茶和洲茶产区丰度最高的功能真菌分别是病理–腐生–共生过渡型、腐生–共生过渡型和腐生营养型真菌。每年的3—9月,正岩茶产区每月均进行一次除草,该农事活动会对土壤造成不同程度的人为翻动,进而改变茶园土壤真菌的生存环境,使得兼有3种营养型的真菌群落成为该产区的优势真菌功能类群[39]。但是,本研究也发现在不同岩茶产区具有较高比例的未分类菌群群落,进一步明确未知菌群及其功能分组有赖于未来生物科学技术水平的提高和发展。
3.3 岩茶产区土壤养分及其计量比对真菌群落的影响土壤中的真菌群落组成及其结构与土壤养分及其计量比密切相关[40]。根据土壤养分及其计量比与茶园土壤真菌优势属的相关性分析,可以了解茶园土壤养分及其计量比对有益真菌与致病真菌的影响关系及影响程度,进而通过人为调控(如施加生物质炭、添加秸秆等提高土壤有机质等)降低土壤中的致病真菌丰度,起到改善茶园土壤质量、优化土壤真菌群落结构、提高茶叶品质的效果[36-37, 41]。本研究中,Mantel检验揭示了土壤C∶K、N∶K和P∶K是影响岩茶产区土壤真菌群落的关键因子,而各养分元素的绝对含量对土壤真菌群落的影响并不显著,这与陈雅君等[23]的研究结果相一致。土壤养分失衡会造成土壤微生物特别是真菌受某种失衡养分元素限制,导致微生物活性减弱甚至是死亡,从而改变土壤真菌群落的组成与结构[42]。相关性分析显示(图 9),岩茶产区土壤优势真菌属中有近一半真菌类型与土壤K呈显著相关,由此可见,在属水平上土壤K对茶园土壤真菌群落组成与结构具有较大的影响作用。本研究结果表明,正岩茶产区土壤镰刀菌属丰度显著高于半岩茶和洲茶产区,且镰刀菌属丰度与C含量呈极显著负相关,说明提高土壤有机质含量可以有效降低土壤镰刀菌属丰度。因此,正岩茶产区在茶园管理中应监测茶树根系健康状况,适当提高该产区土壤有机质含量。
4 结论1) 不同岩茶产区土壤C、N含量差异不显著,半岩茶产区土壤P含量显著高于正岩茶及洲茶产区(P < 0.05),正岩茶产区K含量最高,3个产区之间K含量均呈现显著差异(P < 0.05)。
2) 在正岩茶、半岩茶和洲茶产区,土壤真菌优势菌门分别为子囊菌门、担子菌门和被孢霉菌门;正岩茶产区真菌优势属为毛壳菌属,半岩茶和洲茶产区的真菌优势属为沙蜥属。
3) FUNGuild功能预测结果表明,在正岩茶产区,动物病原-内生-附生-真菌寄生-植物病原-木质腐生真菌相对丰度最高;在半岩茶产区,内生-凋落物腐生-土壤腐生-未定义腐生真菌丰度最高;而未定义腐生真菌在洲茶产区丰度最高。
4) Mantel检验结果显示,岩茶产区土壤真菌群落主要受C∶K、N∶K和P∶K的影响,各养分元素含量对土壤真菌群落影响不显著。
致谢: 本研究野外采样和室内分析过程中得到了福建师范大学地理科学学院、碳中和未来技术学院葛茂泉、许宏达和杨发峻等同学的支持和帮助,在此表示感谢。
| [1] |
Bai X J, Wang B, An S S, et al. Response of forest species to C: N: P in the plant-litter-soil system and stoichiometric homeostasis of plant tissues during afforestation on the Loess Plateau, China[J]. Catena, 2019, 183: 104186 DOI:10.1016/j.catena.2019.104186 (  0) 0) |
| [2] |
王传盈, 王凯月, 王浩然, 等. 黄河下游典型湿地土壤养分及其生态化学计量特征[J]. 环境科学, 2024, 45(3): 1674-1683 (  0) 0) |
| [3] |
Ren C J, Zhao F Z, Kang D, et al. Linkages of C: N: P stoichiometry and bacterial community in soil following afforestation of former farmland[J]. Forest Ecology and Management, 2016, 376: 59-66 DOI:10.1016/j.foreco.2016.06.004 (  0) 0) |
| [4] |
Zhang C, Zeng F, Zeng Z X, et al. Carbon, nitrogen and phosphorus stoichiometry and its influencing factors in Karst primary forest[J]. Forests, 2022, 13(12): 1990 DOI:10.3390/f13121990 (  0) 0) |
| [5] |
Müller M, Oelmann Y, Schickhoff U, et al. Himalayan treeline soil and foliar C: N: P stoichiometry indicate nutrient shortage with elevation[J]. Geoderma, 2017, 291: 21-32 DOI:10.1016/j.geoderma.2016.12.015 (  0) 0) |
| [6] |
周志, 刘扬, 张黎明, 等. 武夷茶区茶园土壤养分状况及其对茶叶品质成分的影响[J]. 中国农业科学, 2019, 52(8): 1425-1434 (  0) 0) |
| [7] |
宋振, 纪巧凤, 付卫东, 等. 黄顶菊入侵对土壤中主要功能细菌的影响[J]. 应用生态学报, 2016, 27(8): 2636-2644 (  0) 0) |
| [8] |
刘会玲, 崔江慧, 许皞. 小麦–玉米轮作周期内土壤钾素与作物吸收钾动态变化研究[J]. 土壤通报, 2010, 41(6): 1440-1443 (  0) 0) |
| [9] |
Gudadhe Nitin N, Amaresh D, Thanki J D, et al. Twenty—Eight years long chemical fertilization effects on soil potassium status under rice-wheat-green gram cropping sequence[J]. Archives of Agronomy and Soil Science, 2023, 69(11): 2121-2137 DOI:10.1080/03650340.2022.2140143 (  0) 0) |
| [10] |
Sardans J, Rivas-Ubach A, Peñuelas J. Factors affecting nutrient concentration and stoichiometry of forest trees in Catalonia (NE Spain)[J]. Forest Ecology and Management, 2011, 262(11): 2024-2034 DOI:10.1016/j.foreco.2011.08.019 (  0) 0) |
| [11] |
Huang S, Pan X H, Sun Y N, et al. Effects of long‐term fertilization on the weed growth and community composition in a double‐rice ecosystem during the fallow period[J]. Weed Biology and Management, 2013, 13(1): 10-18 DOI:10.1111/wbm.12004 (  0) 0) |
| [12] |
杨凯, 杜延全, 张西兴, 等. 不同有机物料与化肥配施对土壤真菌群落结构和生态功能的影响[J]. 土壤, 2024, 56(1): 222-228 (  0) 0) |
| [13] |
Cheng B H, Liu H Y, Bai J, et al. Soil fungal composition drives ecosystem multifunctionality after long-term field nitrogen and phosphorus addition in alpine meadows on the Tibetan Plateau[J]. Plants, 2022, 11(21): 2893 DOI:10.3390/plants11212893 (  0) 0) |
| [14] |
周恒, 周会程, 肖海龙, 等. 三江源不同海拔高寒草原表层土壤酶活性特征[J]. 草原与草坪, 2019, 39(5): 20-30 (  0) 0) |
| [15] |
刘明慧, 柳叶, 任悦, 等. 科尔沁沙地樟子松人工林土壤真菌共现网络及其与土壤因子的关系[J]. 生态学报, 2023, 43(23): 9912-9924 (  0) 0) |
| [16] |
Frąc M, Hannula S E, Bełka M, et al. Fungal biodiversity and their role in soil health[J]. Frontiers in Microbiology, 2018, 9: 707 DOI:10.3389/fmicb.2018.00707 (  0) 0) |
| [17] |
于天赫, 张乃莉, 于爽, 等. 北京城市公园常见乔木土壤真菌群落特征及影响因素[J]. 生态学报, 2021, 41(5): 1835-1845 (  0) 0) |
| [18] |
吴志丹, 尤志明, 江福英, 等. 配施有机肥对茶园土壤性状及茶叶产质量的影响[J]. 土壤, 2015, 47(5): 874-879 DOI:10.13758/j.cnki.tr.2015.05.010 (  0) 0) |
| [19] |
宁亚婷, 王新茹, 罗逢健, 等. 茶叶和土壤中cis-联苯菊酯、高效氯氟氰菊酯手性对映体残留分析[J]. 核农学报, 2023, 37(11): 2243-2251 DOI:10.11869/j.issn.1000-8551.2023.11.2243 (  0) 0) |
| [20] |
姚月明. 形成武夷岩茶品质特征的相关因子[J]. 福建茶叶, 1997, 19(3): 25-26 (  0) 0) |
| [21] |
周志, 薛俊鹏, 卓座品, 等. 一方水土养一方茶: 产地影响武夷岩茶品质的代谢组基础[J]. 中国科学: 生命科学, 2019, 49(8): 1013-1023 (  0) 0) |
| [22] |
黄绍斌, 吴成建. 浅谈武夷岩茶产地与岩韵[J]. 中国茶叶, 2018, 40(11): 21-25 (  0) 0) |
| [23] |
陈雅君, 刘学敏, 崔国文, 等. 紫花苜蓿根腐病的研究进展[J]. 中国草地, 2000, 22(1): 52-57 (  0) 0) |
| [24] |
丁晖, 杨云方, 徐海根, 等. 武夷山典型常绿阔叶林物种组成与群落结构[J]. 生态学报, 2015, 35(4): 1142-1154 (  0) 0) |
| [25] |
鲍士旦. 土壤农化分析[M].
中国农业出版社, 北京, 2000: 72-75
(  0) 0) |
| [26] |
中华人民共和国农业部. 茶叶产地环境技术条件: NY/T 853—2004[S]. 北京: 中国农业出版社, 2005.
(  0) 0) |
| [27] |
Zhang W, Liu W C, Xu M P, et al. Response of forest growth to C: N: P stoichiometry in plants and soils during Robinia pseudoacacia afforestation on the Loess Plateau, China[J]. Geoderma, 2019, 337: 280-289 (  0) 0) |
| [28] |
Franklin O, Ågren G I. Leaf senescence and resorption as mechanisms of maximizing photosynthetic production during canopy development at N limitation[J]. Functional Ecology, 2002, 16(6): 727-733 (  0) 0) |
| [29] |
Tian H Q, Chen G S, Zhang C, et al. Pattern and variation of C: N: P ratios in China's soils: A synthesis of observational data[J]. Biogeochemistry, 2010, 98(1): 139-151 (  0) 0) |
| [30] |
江西省茶叶主产地茶园土壤生态化学计量特征[J]. 科学技术与工程, 2022, 22(23): 9976-9981 (  0) 0) |
| [31] |
无机元素N、P、K含量与库尔勒香梨腐烂病严重度间的关联分析[J]. 北方园艺, 2023(18): 27-34 (  0) 0) |
| [32] |
不同轮作模式的土壤真菌群落结构及功能特征分析[J]. 环境科学学报, 2022, 42(4): 432-442 (  0) 0) |
| [33] |
大豆玉米间作提高红壤团聚体中真菌群落结构和多样性[J]. 植物营养与肥料学报, 2023, 29(5): 889-899 (  0) 0) |
| [34] |
秸秆生物质炭对根际土壤细菌–真菌群落分子生态网络的影响[J]. 土壤学报, 2019, 56(4): 964-974 (  0) 0) |
| [35] |
绿肥间作对茶树根际土壤真菌群落的影响[J]. 茶叶通讯, 2020, 47(3): 406-415 (  0) 0) |
| [36] |
生物质炭对花椒根际土壤真菌群落的影响[J]. 土壤通报, 2023, 54(5): 1098-1106 (  0) 0) |
| [37] |
生物炭和秸秆还田对微咸水滴灌棉田土壤真菌群落结构多样性的影响[J]. 环境科学, 2022, 43(9): 4625-4635 (  0) 0) |
| [38] |
科尔沁沙地樟子松根内真菌群落结构和功能群特征[J]. 林业科学, 2020, 56(9): 87-96 (  0) 0) |
| [39] |
土地利用方式对会仙岩溶湿地土壤真菌群落和功能类群的影响[J]. 环境科学, 2020, 41(9): 4294-4304 (  0) 0) |
| [40] |
人工植被重建对沙化高寒草地土壤真菌群落特征的影响[J]. 土壤学报, 2023, 60(1): 280-291 (  0) 0) |
| [41] |
改性生物炭特征及其对盐碱化土壤改良的研究进展[J]. 华中农业大学学报, 2023, 42(5): 12-19 (  0) 0) |
| [42] |
秸秆还田对植烟土壤养分及真菌群落多样性的影响[J]. 土壤通报, 2016, 47(1): 137-142 (  0) 0) |
2. Institute of Geography, Fujian Normal University, Fuzhou 350117, China;
3. Institute of Agricultural Economics and Development, Chinese Academy of Agricultural Sciences, Beijing 100081, China;
4. Fujian Nanping National Agrometeorological Experimental Station, Nanping, Fujian 354200, China
 2024, Vol. 56
2024, Vol. 56


