竹具有生长快、成林快、生产周期短、生产力高等特点,有助于减少贫困,改善人类生计,并有助于减缓气候变化[1],具有较高的经济、生态和社会价值。中国有竹类39属857种,是世界上竹资源最丰富的国家[2],竹产业为竹主产区的社会经济发展赋能,是中国许多农民家庭的主要收入来源[3]。甜龙竹(Dendrocalamus brandisii),其鲜笋品质优良、秆型高大、秆材用途广泛,是一种典型的大型丛生竹,更是世界一流的优质笋竹[4]。甜龙竹喜温暖湿润气候,属于竹亚科牡竹属大型丛生竹的热性竹种,一般适宜生长在低山、缓坡和河谷地带,适应能力较强,国内主产于云南,包括保山、德宏、临沧、普洱、红河和玉溪等州、市[5]。
土壤是植物生长的基础,良好的土壤环境可以促进植物生长[6]。竹生长发育所需要的绝大多数营养物质、水分都来源于土壤,土壤是竹生长和竹笋品质形成的基础[7]。同时,土壤为微生物的生长提供物质和能量[8],而微生物通过改良土壤、形成腐殖酸、提高植物抗逆性等途径对植物生长发挥间接的促进作用[9]。土壤真菌作为土壤微生物环境的核心成员之一,对保持陆地生态平衡发展发挥着至关重要的作用[10]。真菌随着植被的生长逐渐形成独特的群落结构和分布规律,对维持土壤微生物区系的平衡具有重要作用[11]。目前,对土壤真菌群落结构与功能进行解析已经成为深入理解生态系统功能和评价土壤生态系统健康的重要基础。在复杂的生境中,了解驱动和维持微生物多样性的关键因素,才能预测生态系统对未来环境变化的响应策略。有研究发现,影响土壤微生物群落分布的环境因子包括土壤理化性质和气候因子两方面,影响土壤真菌群落分布的环境因子包括土壤有机碳、全氮、全磷以及年降水量,而国内外对于土壤真菌群落对环境因子的响应研究主要集中在土壤因子方面[12]。杨凯等[13]研究发现,土壤pH是影响真菌群落的主要环境因子,其次为有机质、电导率和速效钾。徐祎萌等[14]的研究发现,土壤有效磷含量(其次是pH、速效钾和全氮)是影响土壤真菌群落丰度和结构变化的主导因子。然而,不同地理种源地甜龙竹的土壤性质与真菌群落之间的相互作用仍知之甚少。
近年来,关于不同地理种源甜龙竹的研究主要集中在竹笋营养品质方面[15],土壤微生物与植物的生长及健康密切相关[16],与水果果实品质具有一定的相关性[17],而对于竹笋品质与土壤微生物群落组成和功能特征的相关性研究尚未见报道。因此,本研究以云南省7个具有代表性的甜龙竹种源地土壤为研究对象,通过研究不同地理种源甜龙竹土壤真菌群落结构特征及多样性差异,探讨了不同种源甜龙竹土壤因子与真菌群落结构之间的关系,进而对不同地理种源甜龙竹土壤的真菌功能进行了预测,以期为丰富甜龙竹林地土壤微生物的研究以及甜龙竹的可持续高效经营和提高土壤质量提供科学依据和理论支持。
1 材料与方法 1.1 研究区概况本研究选取云南省7个具有代表性的甜龙竹种源地进行土样采集,分别为保山昌宁、德宏芒市、临沧沧源、临翔马台、普洱思茅、红河石屏、玉溪新平甜龙竹种植基地,各采样地基本情况如表 1所示。7个采样地均为人工纯林群落,管理方式为粗放管理,采集时间为2022年8月16日至9月8日。
|
|
表 1 采样地基本情况表 Table 1 Basic information of sampling sites |
在样区内选择生长状况和种植年限相近、生长健康的甜龙竹竹丛作为采样点,每个研究区选择3个样丛作为生物学重复进行土壤样品的采集,共计采集21个样品。土样采集具体过程为:先去除土壤表层的凋落物和腐殖质,采用5点取样法采集0 ~ 20 cm土层样品,除去土壤中的植物根系及石块,混合均匀后过2 mm筛,一份约500 g用无菌自封袋装好带回,并做好标记,后续风干研磨后用于土壤因子的测定;另一份约5 g新鲜土壤用无菌离心管装好置于液氮中,带回实验室后保存在−80 ℃冰箱中,用于土壤DNA的提取。
1.3 土壤因子测定土壤因子的测定均参照中华人民共和国农业行业标准执行。其中,pH测定参照NY/T 1377—2007[18];有机质(SOM)测定参照NY/T 1121.6—2006[19];有效磷(AP)测定参照NY/T 1121.7—2014[20];速效钾(AK)测定参照NY/T 889—2004[21];全氮(TN)测定参照NY/T 1121.24—2012)[22];全磷(TP)测定参照NY/T 88—1988[23];全钾(TK)测定参照NY/T 87—1988[24]。
1.4 土壤DNA提取、高通量测序及生物信息学分析根据MagAttract PowerSoil Pro DNA Kit (QIAGEN)说明书进行土壤微生物群落总基因组DNA抽提,使用1% 的琼脂糖凝胶电泳检测抽提的DNA质量,使用NanoDrop 2000(美国Thermo Scientific公司)测定DNA浓度和纯度。使用ITS1F/ITS2R引物对扩增rRNA基因ITS1F区(ITS1F,CTTGGTCATTTAGAGGAAGTAA;ITS2R,GCTG CGTTCTTCATCGATGC) 进行扩增。PCR反应体系(20 μL)为:10×Buffer 2μL,2.5 mmol/L dNTPs 2 μL,正向引物(5 μmol/L)0.8 μL,反向引物(5 μmol/L) 0.8 μL,rTaq聚合酶0.2 μL,BSA 0.2 μL,模板DNA 10 ng,ddH2O补足至20 μL。反应条件:95 ℃预变性3 min,30个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),72 ℃稳定延伸10 min,10℃直至停止。产物4℃保存,每样本3次重复。使用NEXTFLEX Rapid DNA-Seq Kit对纯化后的PCR产物进行建库,利用Illumina公司的Miseq PE300/NovaSeq PE250平台进行测序(上海美吉生物医药科技有限公司)。
测序得到原始数据后,用FASTP 0.19.6和FLASH1.2.11进行质控和拼接,使用UPARSE7.1根据97% 的相似度对质控拼接后的序列进行操作分类单元(OTU,operational taxonomic unit)聚类并剔除嵌合体。比对数据库UNITE,使用RDP注释软件的朴素贝叶斯模型进行真菌物种分类注释,置信阈值设为0.7,并在不同物种分类水平下统计每个样本的群落组成。原始序列已上传至NCBI SRA数据库(序列号:PRJNA1060609)。
1.5 数据统计与分析基础数据通过Excel 2019、SPSS 25.0进行统计分析,采用Mothur软件计算α多样性指数Chao1、Shannon指数等,并采用Kruskal-Wallis秩和检验进行α多样性的组间差异分析;β多样性分析使用基于Bray-Curtis距离算法的主坐标分析(PCoA),检验样本间微生物群落结构的相似性,并结合ANOSIM非参数检验分析样本组间微生物群落结构差异是否显著;使用冗余分析(RDA)考察土壤化学指标对土壤真菌群落结构的影响;使用FUNGuild推断真菌的功能组,进行功能分类预测。
2 结果与分析 2.1 不同地理种源甜龙竹土壤性质由表 2数据可知,不同地理种源地甜龙竹土壤性质存在显著差异(P < 0.05),7个地区的土壤pH均低于7,属于酸性土壤,其中思茅的pH最低,土壤酸性最强,石屏的pH最高,土壤酸性较其他6个地区更弱。沧源的SOM含量显著高于芒市、马台和思茅(P < 0.05),和昌宁、石屏、新平差异不显著。马台的土壤AP含量显著高于其他6个地区(P < 0.05),其中石屏的AP含量最低。石屏的土壤AK含量显著高于昌宁、芒市、沧源和思茅(P < 0.05),其中昌宁的含量最低。新平的土壤TN含量显著高于芒市、马台和思茅(P < 0.05),和昌宁、沧源、石屏差异不显著。马台的土壤TP含量显著高于昌宁、芒市、思茅、石屏和新平(P < 0.05),和沧源差异较小,其中思茅的含量最低。新平的土壤TK含量显著高于其他6个地区(P < 0.05),其中石屏的含量最低。
|
|
表 2 不同地理种源甜龙竹土壤性质 Table 2 Soil Characteristics of different geographical provenances of Dendrocalamus brandisii |
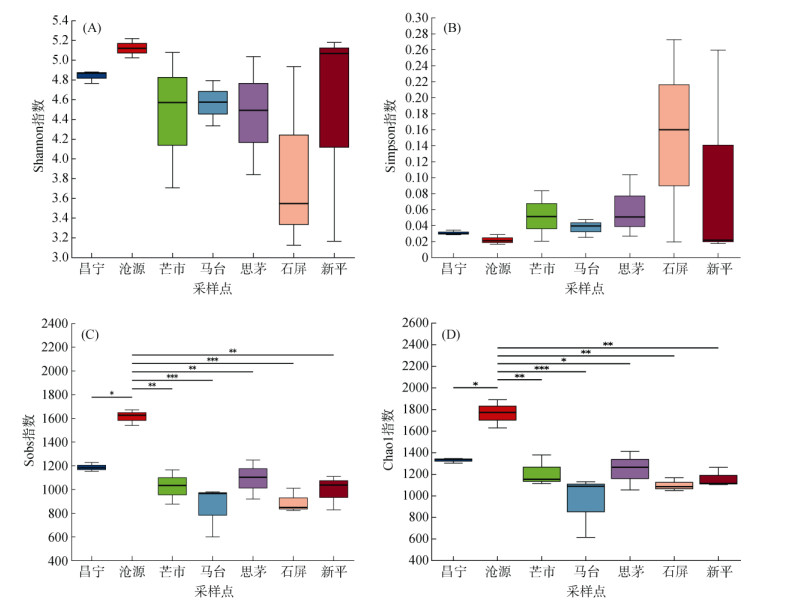
对7个地理种源甜龙竹土壤真菌α多样性进行单因素方差分析及Tukey-Kramer检验,结果如图 1所示。各地理种源甜龙竹土壤真菌Shannon多样性指数和Simpson均匀度指数无显著差异,但各地区土壤真菌Sobs指数、Chao 1指数呈现显著差异(P < 0.05),其中沧源的土壤真菌α多样性最高。
|
(图中*、**、***分别表示在不同地理种源地间差异在P < 0.05、P < 0.01、P < 0.001水平显著;下同) 图 1 土壤真菌群落α多样性指数 Fig. 1 Alpha diversity index of soil fungal community |
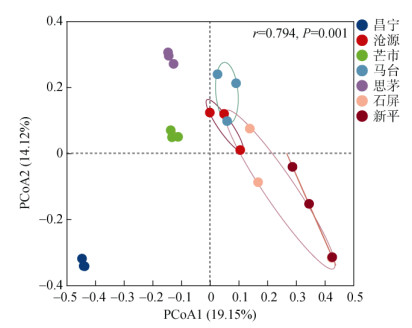
对真菌群落进行PCoA分析(图 2),并对组间群落结构差异进行ANOSIM显著性检验,排序结果显示,昌宁、芒市和思茅3个地区的土壤真菌群落较聚集,沧源、马台、石屏、新平4个地区的土壤真菌群落较分离,且昌宁离其他6个地区距离较远,说明昌宁的土壤真菌群落与其他6个地区存在较大的差异,而沧源和马台、石屏和新平之间有群落聚集的现象,说明沧源和马台、石屏和新平的真菌群落结构具有相似性。总体来说,7个地区的甜龙竹土壤真菌群落结构有显著差异(r=0.794,P=0.001)。
|
图 2 土壤真菌群落PCoA分析 Fig. 2 Principal co-ordinates analysis of soil fungal community |
原始的fastq文件过滤掉低质量的读码、嵌合体和附着序列后,7个地区的土壤样品共获得真菌序列903 506条,根据97% 的相似性,进一步将其划分为2 409个真菌OTU。置信度阈值设为0.7,7个地区的Shannon稀疏曲线均趋于平坦,即本次试验测序数据量足够大,可以反映样本中绝大多数的微生物多样性信息。将所有样本序列数抽平后,昌宁、沧源、芒市、马台、思茅、石屏、新平土壤分别获得真菌序列121 967、219 188、110 868、116 749、116 914、110 221和107 599条。
对获得的OTU序列进行分类注释,7个地区的土壤真菌隶属于16门63纲156目375科901属。土壤真菌群落在门水平上的物种组成如图 3A所示,不同地理种源甜龙竹土壤真菌在门水平上的主要优势菌群有子囊菌门(Ascomycota,41.72% ~ 62.44%)、担子菌门(Basidiomycota,18.72% ~ 45.23%)、未分类真菌(unclassified_k_Fungi,2.55% ~ 17.55%)和被孢霉门(Mortierellomycota,0.86% ~ 7.54%),这4类优势菌门占比高达90%以上。7个地区中除了石屏以担子菌门为第一优势菌门,其他6个地区均以子囊菌门为第一优势菌门,担子菌门为第二优势菌门。未分类真菌、被孢霉门、接合菌门(Rozellomycota)和球囊菌门(Glomeromycota)的平均相对丰度在7个地区呈显著差异(P < 0.05),昌宁的未分类真菌、沧源的被孢霉门、新平的接合菌门、芒市的球囊菌门的平均相对丰度高于其他地区(图 3B)。

|
图 3 土壤真菌群落门水平的物种组成(A)和差异物种(B) Fig. 3 Species composition (A) and differential species (B) of soil fungal community at phylum level |
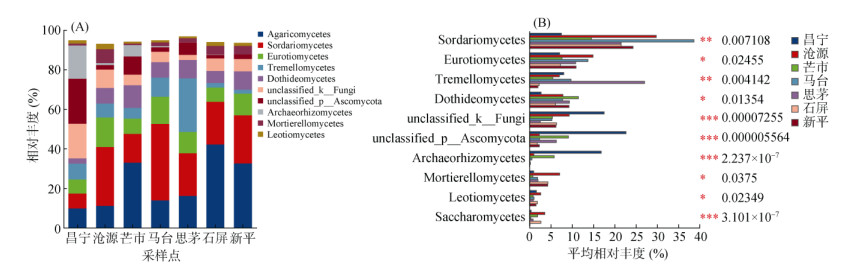
在纲水平上,不同地理种源甜龙竹土壤真菌以伞菌纲(Agaricomycetes,9.85% ~ 42.14%)、粪壳菌纲(Sordariomycetes,7.50% ~ 38.66%)、散囊菌纲(Eurotiomycetes,7.07% ~ 14.93%)、银耳纲(Tremellomycetes,2.55% ~ 17.55%)为优势菌纲(图 4A)。且在丰度前10位的菌纲中,除了伞菌纲,其他9个菌纲在不同地理种源地的土壤间均存在显著差异(P < 0.05),其中马台的粪壳菌纲、思茅的银耳纲、昌宁的unclassified_k_Fungi、unclassified_P_ Ascomycota和古根菌纲(Archaeorhizomycetes)、新平的Mortierellomycetes高于其他6个地区(图 4B)。
|
图 4 土壤真菌纲水平的物种组成(A)和差异物种(B) Fig. 4 Species composition and differential species of soil fungal community at class level |
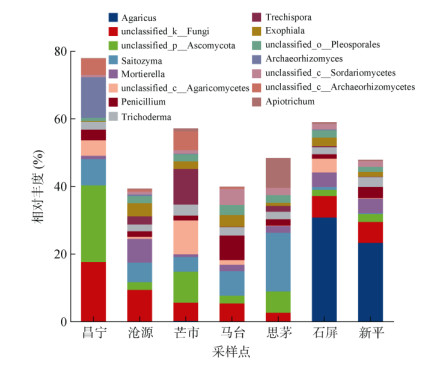
在属水平上(图 5),7个不同地理种源甜龙竹土壤真菌均有各自相对丰度最高的菌属,其中昌宁的unclassified_p_Ascomycota、unclassified_k_Fungi和古根菌属(Archaeorhizomyces)相对丰度最高;沧源的被孢霉属(Mortierella)和外瓶霉属(Exophiala)相对丰度最高;芒市的unclassified_c_Agaricomycetes、粗糙孔属(Trechispora)和unclassified_c_Archaeorhizomycetes相对丰度最高;马台的青霉属(Penicillium)和unclassified_c_Sordariomycetes相对丰度最高;思茅的Saitozyma和Apiotrichum相对丰度最高;石屏和新平的伞菌属(Agaricus)相对丰度最高。
|
图 5 土壤真菌属水平的物种组成 Fig. 5 Species composition of soil fungal community at genus level |
对不同地理种源甜龙竹土壤真菌进行dR-RDA分析(图 6),研究土壤因子与样点、微生物群落间的关系,结果显示,第一排序轴的解释量为11.79%,第二排序轴的解释量为9.16%。pH、有机质(SOM)、速效钾(AK)、全氮(TN)对土壤真菌的贡献度较高,影响真菌群落结构的主要因子(pH的R2=0.775,P=0.001;SOM的R2=0.627,P=0.001;AK的R2=0.548,P=0.002;TN的R2=0.542,P=0.003)(表 3)。
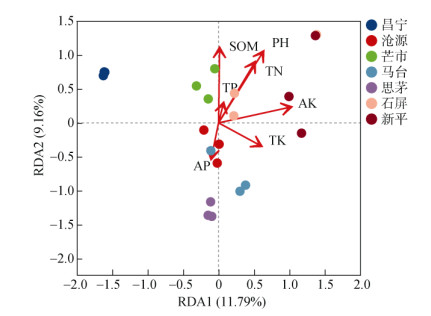
|
图 6 土壤真菌的dR-RDA分析 Fig. 6 dR-RDA analysis of soil fungi |
|
|
表 3 Envfit环境因子 Table 3 Envfit environment factors |
在此基础上,进一步筛选对真菌群落影响较大的土壤因子,利用Pearson相关系数进行分析。相关性热图(图 7)表明,pH、SOM与梳霉门(Kickxellomycota)呈极显著正相关(P < 0.01),与被孢霉门(Mortierellomycota)呈显著正相关(P < 0.05);TN与梳霉门呈显著正相关(P < 0.05),与被孢霉门呈极显著正相关(P < 0.01);AP与壶菌门(Chytridiomycota)呈极显著正相关(P < 0.01);AK与毛霉门(Mucoromycota)呈显著负相关(P < 0.05),与球囊菌门(Glomeromycota)呈极显著负相关(P < 0.01)。在属水平上,SOM、pH和TN与被孢霉属(Mortierella)呈显著正相关(P < 0.05);AK、pH和TN与伞菌属(Agaricus)呈显著正相关(P < 0.05);AK则表现出更多的负相关关系,与Archaeorhizomyces、unclassified_o_Agaricales、unclassified_ p_Ascomycota、unclassified_c_Archaeorhizomycetes均呈显著负相关性(P < 0.05)。
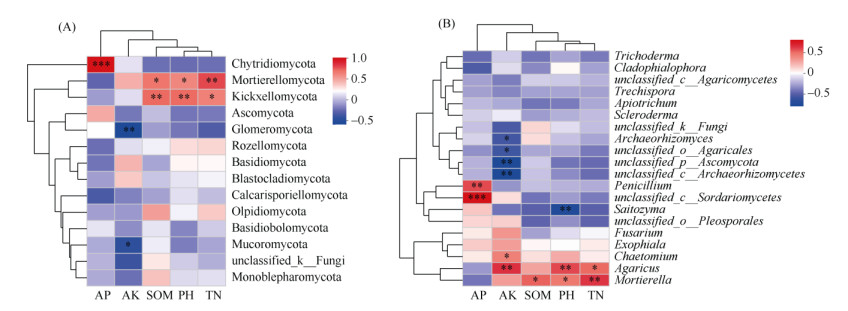
|
(图中*、**、***分别表示相关性在P < 0.05、P < 0.01、P < 0.001水平显著) 图 7 土壤因子与真菌门(A)、真菌属(B)相关性热图 Fig. 7 Correlation heatmaps between soil factors with fungal phylum (A) and fungal genus (B) |
利用FUNGuild功能预测工具对不同地理种源甜龙竹土壤真菌群落进行分析(图 8),按照营养方式将其功能划分为3种营养型,分别为病理营养型(pathotroph)、共生营养型(symbiotroph)和腐生营养型(saprotroph)。在此基础上,通过它们对于环境资源的吸收利用采取的相似方式进行划分,包括12个,分别为动物病原菌(animal pathogens)、丛枝菌根真菌(arbuscular mycorrhizal fungi)、外生菌根真菌(ectomycorrhizal fungi)、杜鹃花类菌根真菌(ericoid mycorrhizal fungi)、叶内生真菌(foliar endophytes)、地衣寄生真菌(lichenicolous fungi)、地衣共生真菌(lichenized fungi)、菌寄生真菌(mycoparasites)、植物病原菌(plantpathogens)、未定义根内生真菌(undefined root endophytes)、未定义腐生真菌(undefined saprotrophs)和木质腐生真菌(wood saprotrophs)。其中,昌宁未鉴定真菌的丰度占比最高(58.6%),其次是石屏和新平未定义的腐生真菌占比较高,分别为51.1% 和40.6%,其他4个地区除未鉴定和未定义真菌外,思茅的寄生–未定义腐生真菌(Fungal parasite-undefned saprotroph,18.21%)、芒市的木质腐生真菌(wood saprotroph,11.32%)、沧源的内生–凋落物腐生–土壤腐生–未定义腐生真菌(endophyte-litter saprotroph-soil sapioto-undefined saprotroph)占比高于较其他地区。
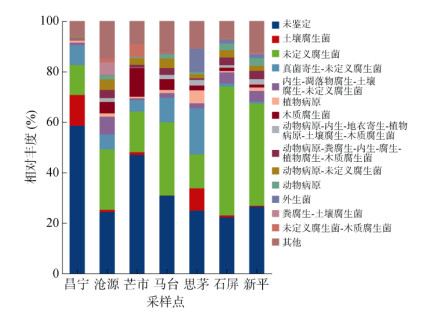
|
图 8 土壤真菌群落功能预测 Fig. 8 Functional prediction of soil fungal community |
本研究21个土壤样品中共检测到真菌16门63纲156目375科901属,在门水平上,子囊菌门(Ascomycota)和担子菌门(Basidiomycota)是甜龙竹土壤中的两大优势菌门,这与之前对甜龙竹土壤真菌的研究结果一致[25]。这两类菌门不仅在甜龙竹土壤样本研究中经常观察到,而且在蒙古栎根系和根区土壤中[26],在桂西北石漠化区不同植被恢复类型(落叶阔叶林、落叶常绿阔叶混交林、常绿阔叶林和自然封育林)中[27]也被检出。说明子囊菌与担子菌这两类真菌不是甜龙竹的特有菌群,而是较普遍和典型的陆生型真菌。子囊菌与担子菌均属于腐生营养型真菌,在植物纤维和木质素等难以降解的有机质周转方面承担主要分解角色,更适应土壤含水量较低及通气条件好的环境[28],而且其组成动态变化通常为早期贫瘠土壤中一般以子囊菌为主,而在后期演替的土壤环境中则以担子菌为主[29]。
本研究中,虽然7个地区的优势菌群基本相同,但各地区优势菌群的组成结构差异明显,其中思茅的子囊菌和担子菌两类菌门总的相对丰度,石屏的芽枝霉门(Blastocladiomycota)、昌宁的unclassified_k_Fungi、沧源的Mortierellomycota、新平的接合菌门(Rozellomycota)、马台的壶菌门(Chytridiomycota)和芒市的球囊菌门(Glomeromycota)的相对丰度高于其他地区,说明各地区除了广泛存在的子囊菌门和担子菌门,都有各自占比较高的菌群。子囊菌被认为是土壤有机质分解的关键参与者[30],并且通过参与根系渗出、同化和有机质降解,在很大程度上主导了活跃的真菌群落[31]。此外,子囊菌门、芽枝霉门、Mortierellomycota、Olpidiomycota和壶菌门可以在植物和动物的残肢上腐生并分解其残骸[32]。球囊菌门能与植物形成丛枝菌根,并能直接吸收养分[33]。接合菌门和Zoopagomycotan从入侵植物中获取营养[34]。这些表明生态位中的真菌执行着各种任务。
在纲水平上,各地区的真菌构成比例差异显著,本研究发现,沧源、芒市、马台、思茅、石屏和新平6个地区的粪壳菌纲(Sordariomycetes)和伞菌纲(Agaricomycetes)的丰度占比均高于其他菌群,只有昌宁地区是古根菌纲(Archaeorhizomycetes)、unclassified_k_Fungi和unclassified_p_Ascomycota的相对丰度较高。古根菌在系统发育上是位于子囊菌门类下的真菌,由数百种隐秘繁殖的丝状物种组成,这些物种不形成可识别的菌根结构并具有腐生潜力,但在根和根际土壤中无处不在,并显示出生态系统和宿主根系栖息地的特异性[35]。值得关注的是,昌宁地区还有两种未鉴定的菌群占比较高,这也说明了在真菌群落的组成上昌宁地区有其特殊性,其还需进一步研究。
在属水平上,思茅的Saitozyma,芒市的unclassified_c__Agaricomycetes、粗糙孔属(Trechispora)、石屏和新平的伞菌属(Agaricus)都属于担子菌门,在甜龙竹的生长发育方面,担子菌门常与植物共生形成菌根,促进甜龙竹的养分吸收。昌宁的unclassified_p__Ascomycota、古根菌属(Archaeorhizomyces),沧源的外瓶霉属(Exophiala)和芒市的unclassified_c__Archaeorhizomycetes都属于子囊菌门,在土壤稳定性、植物生物质分解和与植物的内生相互作用中发挥作用[36]。有研究表明,被孢霉属(Mortierella)是一类潜在的生物防治真菌,可以抑制一些病原菌[37],一些被孢霉真菌能促进植物的生长,是植物生长促生菌,这也说明沧源和马台土壤中的有益真菌数量较多。
3.2 不同地理种源甜龙竹土壤因子对真菌群落的影响任何环境因素包括植被类型、海拔、气候、土壤理化性质等的改变都可能使土壤微生物群落结构在一定程度上发生变化[38]。而土壤微生物又是提高土壤肥力、改善土壤健康的关键[39]。土壤因素已被证实对区域和大陆尺度的微生物群落组成土壤中的微环境及对土壤微生物的组成具有刺激作用[40]。本研究中,通过筛选对土壤真菌群落影响较大的土壤环境因子,并对其与真菌群落在门水平上进行相关分析发现,土壤pH、SOM、AK是影响真菌群落的主要因子。而相关性热图分析表明,pH、SOM、TN与梳霉门(Kickxellomycota)和被孢霉门(Mortierellomycota)有显著的正相关关系(P < 0.05),AK与毛霉门(Mucoromycota)呈显著负相关(P < 0.05),且在属水平水平上,SOM、pH和TN与土壤真菌群落表现出较多的正相关性,而AK则表现出更多的负相关性。有研究发现,接合菌门的被孢霉科能分解土壤中的糖类和简单多糖物质,有利于改善酸性土壤中的养分状况,保护植物根系,促进植物生长,是土壤有机质和养分含量丰富的标志[41]。可见,土壤pH、SOM、TN和AK是影响接合菌门数量的关键因子,各地理种源地可以通过施加肥料来增加土壤中的SOM和TN含量,改善土壤条件,促进甜龙竹的生长。壶菌门是一类寄生真菌,会传染多种植物病毒并且有很强的感染能力[42]。本研究发现,AP与壶菌门呈极显著正相关(P < 0.01),说明土壤中AP的含量可能会增加真菌壶菌门的感染性。球囊菌门促进植物吸收和利用土壤中的速效养分并促进植物适应盐分胁迫环境[43-44]。本研究中,AK与球囊菌门呈极显著负相关(P < 0.01),说明AK含量越多越不利于球囊菌门的合成,从而对土壤中有机物质的分解和作物利用土壤中的养分产生影响。接合菌门、球囊菌门和壶菌门真菌对环境的适应能力强,能够在盐碱地及贫瘠环境中生存;而担子菌门和子囊菌门真菌的环境适应能力差,适合在土壤肥力好、养分充足的土壤中生存[45]。这一结果与本研究中子囊菌门和担子菌门真菌与大部分土壤营养元素呈正相关,而接合菌门和球囊菌门真菌与营养元素呈负相关的结果相似。由此可知,这些优势菌群会受到土壤化学性质的影响。因此,了解非生物因子与微生物之间的相互关系,对于揭示植物与微生物之间的相互作用及机制,以及理解微生物在这一生态位中的作用具有重要意义。
3.3 不同地理种源甜龙竹土壤真菌群落功能的差异不同地理种源甜龙竹土壤真菌群落结构的变化也使得土壤真菌在功能特征上产生了差异。本研究中,通过FUNGuild对不同地理种源甜龙竹土壤真菌功能进行预测,不同地理种源甜龙竹土壤真菌营养型主要分为病理营养型、共生营养型和腐生营养型3种。其中,共生营养型真菌可减少病原菌的定殖,对植物致病菌产生拮抗作用,致使病理型真菌生长受阻以保护植物免受病害侵害[46];而腐生营养型真菌主要有分解有机物、增加养分可利用率等作用[47],两者都在生态系统中发挥各自重要的作用。在这3种真菌营养型中,7个地区土壤真菌群落中腐生营养型的相对丰度最高,由于腐生真菌是土壤与凋落物之间养分循环的重要参与者,与碳循环和养分的分解密切相关[48],所以这可能与甜龙竹林地表堆积大量凋落物,增加土壤中碳的输入有关,这不仅为腐生真菌提供了底物,又能促进甜龙竹自身的生长。7个地区中除未鉴定和未定义的真菌功能外,思茅的寄生–未定义腐生菌、芒市的木质腐生菌、沧源的内生–凋落物腐生–土壤腐生–未定义腐生菌的相对丰度较高。木质腐生真菌能起到传导水分和增强植物吸水能力的功能[49],各地区存在的木质腐生菌有利于甜龙竹林在无管理措施下,保持土壤水分的传输,维持竹子的生长需求。此外,内生真菌与甜龙竹能形成共生关系,甜龙竹为内生真菌提供生长所需的营养,内生真菌则通过调节甜龙竹体内植物激素水平,促进甜龙竹的生长[50]。本研究中昌宁地区存在一半多的真菌功能未能注释,这些复杂的土壤真菌功能还有待进一步的深入研究。
4 结论在7个地理种源甜龙竹土壤中,沧源的土壤真菌多样性高于其他6个地区,昌宁的土壤真菌群落结构较其他地区差异大,且不同地理种源甜龙竹土壤真菌群落物种组成在门、纲和属水平上均存在差异物种,优势菌群的构成比例差异明显。pH、有机质、速效钾和全氮是引起各地理种源地土壤真菌群落变化的主要土壤因子。7个地区的土壤真菌功能也具有显著差异,其中,昌宁地区具有大量未鉴定的真菌和未注释的功能,具有特殊性。综上可知,不同地理种源甜龙竹土壤真菌群落组成和真菌功能在空间尺度上具有显著差异,而这些微生物差异可能与各地理种源甜龙竹笋品质差异有关。
| [1] |
Du H Q, Mao F J, Zhou G M, et al. Estimating and analyzing the spatiotemporal pattern of aboveground carbon in bamboo forest by combining remote sensing data and improved BIOME-BGC model[J]. IEEE Journal of Selected Topics in Applied Earth Observations and Remote Sensing, 2018, 11(7): 2282-2295 DOI:10.1109/JSTARS.2018.2817344 (  0) 0) |
| [2] |
郑世慧, 刘广路, 岳祥华, 等. 中国竹资源培育现状与增产潜力[J]. 世界竹藤通讯, 2022, 20(5): 75-80 (  0) 0) |
| [3] |
Li X J, Du H Q, Mao F J, et al. Mapping spatiotemporal decisions for sustainable productivity of bamboo forest land[J]. Land Degradation & Development, 2020, 31(8): 939-958 (  0) 0) |
| [4] |
辉朝茂, 刘蔚漪, 张国学, 等. 甜龙竹优良种质资源发掘和选育研究[J]. 竹子学报, 2019, 38(4): 26-30 (  0) 0) |
| [5] |
辉朝茂, 何霞红, 刘蔚漪, 等. 推进甜龙竹资源产业化开发助推乡村振兴[J]. 世界竹藤通讯, 2022, 20(1): 66-69 (  0) 0) |
| [6] |
夏群, 刘宇松, 李诚勇, 等. 两种改良剂对酸化苹果园土壤环境及果树生长的影响[J]. 土壤, 2024, 56(1): 112-119 (  0) 0) |
| [7] |
Hütsch B W, Augustin J, Merbach W. Plant rhizodeposition—An important source for carbon turnover in soils[J]. Journal of Plant Nutrition and Soil Science, 2002, 165(4): 397-407 DOI:10.1002/1522-2624(200208)165:4<397::AID-JPLN397>3.0.CO;2-C (  0) 0) |
| [8] |
徐万里, 唐光木, 葛春辉, 等. 长期施肥对新疆灰漠土土壤微生物群落结构与功能多样性的影响[J]. 生态学报, 2015, 35(2): 468-477 (  0) 0) |
| [9] |
Pantigoso H A, Newberger D, Vivanco J M. The rhizosphere microbiome: Plant–microbial interactions for resource acquisition[J]. Journal of Applied Microbiology, 2022, 133(5): 2864-2876 (  0) 0) |
| [10] |
郭雄飞. 刨花润楠根系和根际土壤真菌群落多样性分析[J]. 西华师范大学学报(自然科学版), 2020, 41(1): 11-16 (  0) 0) |
| [11] |
冉堃, 王泽锦, 李品. 典型城市绿化树种根际土壤细菌和真菌群落组成和多样性沿城乡环境梯度的响应差异[J]. 生态学报, 2023, 43(23): 9758-9769 (  0) 0) |
| [12] |
李丹丹, 李佳文, 高广磊, 等. 科尔沁沙地樟子松(Pinus sylvestris var. mongolia)人工林土壤真菌群落结构和功能特征[J]. 中国沙漠, 2023, 43(4): 241-251 (  0) 0) |
| [13] |
杨凯, 杜延全, 张西兴, 等. 不同有机物料与化肥配施对土壤真菌群落结构和生态功能的影响[J]. 土壤, 2024, 56(1): 222-228 (  0) 0) |
| [14] |
徐祎萌, 章磊, 白美霞, 等. 有机物料单施及与生物质炭配施对红壤微生物群落组成的影响[J/OL]. 土壤学报, 2024 (2024-03-04). https://kns.cnki.net/kcms/detail/32.1119.P.20240229.0908.004.html.
(  0) 0) |
| [15] |
裴佳龙, 李鹏程, 王茜, 等. 云南不同地理种源勃氏甜龙竹竹笋营养成分比较[J]. 西北林学院学报, 2018, 33(1): 156-161 (  0) 0) |
| [16] |
Trivedi P, Leach J E, Tringe S G, et al. Plant-microbiome interactions: From community assembly to plant health[J]. Nature Reviews Microbiology, 2020, 18(11): 607-621 (  0) 0) |
| [17] |
Chai X, Yang Y, Wang X, et al. Spatial variation of the soil bacterial community in major apple producing regions of China[J]. Journal of Applied Microbiology, 2021, 130(4): 1294-1306 (  0) 0) |
| [18] |
中华人民共和国农业部. 土壤pH的测定: NY/T 1377—2007 [S]. 北京: 中国标准出版社, 2007.
(  0) 0) |
| [19] |
中华人民共和国农业部. 土壤检测第6部分: 土壤有机质的测定: NY/T 1121.6—2006[S]. 北京: 中国标准出版社, 2006.
(  0) 0) |
| [20] |
中华人民共和国农业部. 土壤检测第7部分: 土壤有效磷的测定: NY/T 1121.7—2014[S]. 北京: 中国标准出版社, 2015.
(  0) 0) |
| [21] |
中华人民共和国农业部. 土壤速效钾和缓效钾含量的测定: NY/T 889—2004[S]. 北京: 中国标准出版社, 2005.
(  0) 0) |
| [22] |
中华人民共和国农业部. 土壤检测第24部分: 土壤全氮的测定自动定氮仪法: NY/T 1121.24—2012[S]. 北京: 中国标准出版社, 2012.
(  0) 0) |
| [23] |
中华人民共和国农业部. 土壤全磷测定法: NY/T 88—1988[S]. 北京: 中国标准出版社, 1988.
(  0) 0) |
| [24] |
中华人民共和国农业部. 土壤全钾测定法: NY/T 87—1988[S]. 北京: 中国标准出版社, 1988.
(  0) 0) |
| [25] |
朱书红, 辉朝茂, 赵秀婷, 等. 甜龙竹不同种植年限对土壤真菌群落的影响[J]. 环境科学, 2023, 44(6): 3408-3417 (  0) 0) |
| [26] |
郭璞, 邢鹏杰, 宋佳, 等. 蒙古栎根系与根区土壤真菌群落组成及与环境因子的关系[J]. 菌物研究, 2022, 20(3): 173-182 (  0) 0) |
| [27] |
高风, 文仕知, 韦铄星, 等. 桂西北石漠化区不同植被恢复类型对土壤理化性质、酶活与真菌群落多样性的影响[J]. 浙江农业学报, 2023, 35(10): 2425-2435 (  0) 0) |
| [28] |
徐慧芳, 万子维, 盛荣, 等. 不同耕作模式对稻田土壤真菌丰度及群落结构的影响[J]. 华中农业大学学报, 2022, 41(6): 35-41 (  0) 0) |
| [29] |
王玖程, 王兴明, 董思奇, 等. 吉林省中部地区退耕还林对黑土土壤细菌和真菌群落结构的影响[J]. 农业资源与环境学报, 2023, 40(4): 917-926 (  0) 0) |
| [30] |
Osono T, Takeda H. Organic chemical and nutrient dynamics in decomposing beech leaf litter in relation to fungal ingrowth and succession during 3-year decomposition processes in a cool temperate deciduous forest in Japan[J]. Ecological Research, 2001, 16(4): 649-670 (  0) 0) |
| [31] |
Hugoni M, Luis P, Guyonnet J, et al. Plant host habitat and root exudates shape fungal diversity[J]. Mycorrhiza, 2018, 28(5/6): 451-463 (  0) 0) |
| [32] |
Thuiller W, Maiorano L, Mazel F, et al. Conserving the functional and phylogenetic trees of life of European tetrapods[J]. Philosophical Transactions of the Royal Society of London Series B, Biological Sciences, 2015, 370(1662): 20140005 (  0) 0) |
| [33] |
Haug I, Lempe J, Homeier J, et al. Graffenrieda emarginata (Melastomataceae) forms mycorrhizas with Glomeromycota and with a member of the Hymenoscyphus ericae aggregate in the organic soil of a neotropical mountain rain forest[J]. Canadian Journal of Botany, 2004, 82(3): 340-356 (  0) 0) |
| [34] |
Cai L, Giraud T, Zhang N, et al. The evolution of species concepts and species recognition criteria in plant pathogenic fungi[J]. Fungal Diversity, 2011, 50(1): 121-133 (  0) 0) |
| [35] |
Rosling A, Cox F, Cruz-Martinez K, et al. Archaeorhizomycetes: Unearthing an ancient class of ubiquitous soil fungi[J]. Science, 2011, 333(6044): 876-879 (  0) 0) |
| [36] |
Challacombe J F, Hesse C N, Bramer L M, et al. Genomes and secretomes of Ascomycota fungi reveal diverse functions in plant biomass decomposition and pathogenesis[J]. BMC Genomics, 2019, 20(1): 976 (  0) 0) |
| [37] |
尹鹏, 胡霞, 廖金花, 等. 高山地区土壤微生物生物量和土壤酶活性对雪被变化的响应[J]. 生态科学, 2015, 34(1): 91-96 (  0) 0) |
| [38] |
方圆, 王娓, 姚晓东, 等. 我国北方温带草地土壤微生物群落组成及其环境影响因素[J]. 北京大学学报(自然科学版), 2017, 53(1): 142-150 (  0) 0) |
| [39] |
杨青松, 杨伟, 彭珏, 等. 典型黑土区坡耕地土壤微生物多样性及群落结构对侵蚀-沉积的响应[J/OL]. 土壤学报, 2024 (2024-02-08). https://kns.cnki.net/kcms/detail/32.1119.P.20240205.1429.002.html.
(  0) 0) |
| [40] |
彭玉娇, 崔学宇, 邵元元, 等. 不同树龄沙田柚果园土壤肥力、叶片养分和土壤细菌群落的特征[J]. 江苏农业学报, 2021, 37(2): 348-354 (  0) 0) |
| [41] |
Puget P, Angers D A, Chenu C. Nature of carbohydrates associated with water-stable aggregates of two cultivated soils[J]. Soil Biology and Biochemistry, 1998, 31(1): 55-63 (  0) 0) |
| [42] |
竹兰萍, 徐飞, 王佳颖, 等. 嘉陵江滨岸带不同土地利用类型土壤真菌群落结构与功能多样性[J]. 环境科学, 2022, 43(12): 5808-5818 (  0) 0) |
| [43] |
任春光, 苏文文, 潘丽珊, 等. 基于高通量测序研究猕猴桃苗不同生育期根际真菌群落结构及多样性[J]. 土壤, 2021, 53(3): 545-554 (  0) 0) |
| [44] |
李文彬, 宁楚涵, 郭绍霞. AM真菌对百合调节激素平衡与细胞渗透性以及改善耐盐性的研究[J]. 西北植物学报, 2018, 38(8): 1498-1506 (  0) 0) |
| [45] |
李海云, 姚拓, 高亚敏, 等. 退化高寒草地土壤真菌群落与土壤环境因子间相互关系[J]. 微生物学报, 2019, 59(04): 678-688 (  0) 0) |
| [46] |
Frew A, Powell J R, Glauser G, et al. Mycorrhizal fungi enhance nutrient uptake but disarm defences in plant roots, promoting plant-parasitic nematode populations[J]. Soil Biology and Biochemistry, 2018, 126: 123-132 (  0) 0) |
| [47] |
Paungfoo-Lonhienne C, Yeoh Y K, Kasinadhuni N R P, et al. Nitrogen fertilizer dose alters fungal communities in sugarcane soil and rhizosphere[J]. Scientific Reports, 2015, 5: 8678 (  0) 0) |
| [48] |
Schmidt R, Mitchell J, Scow K. Cover cropping and no-till increase diversity and symbiotroph: Saprotroph ratios of soil fungal communities[J]. Soil Biology and Biochemistry, 2019, 129: 99-109 (  0) 0) |
| [49] |
Gilmartin E C, Jusino M A, Pyne E J, et al. Fungal endophytes and origins of decay in beech (Fagus sylvatica) sapwood[J]. Fungal Ecology, 2022, 59: 101161 (  0) 0) |
| [50] |
刘圣越, 王跃飞, 何永志, 等. 内生真菌对宿主植物生长和次级代谢产物影响研究进展[J]. 天津中医药大学学报, 2021, 40(1): 128-136 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56


