土壤是陆地生态系统提供多种服务的基本单位。土壤在提供生态系统服务方面的作用时依赖于土壤微生物——它们参与生物地球化学循环的各种关键过程[1]。作物多样化和绿肥填闲种植等农业管理措施能够通过不同方式改善土壤环境,对土壤生态系统和微生物产生深远影响,导致土壤过程发生一系列变化[2]。绿肥填闲种植是在粮食作物收获至播种的休闲期间种植绿肥作物并在生长一定时间后翻耕入土的耕作措施,常见于温带气候地区。研究表明,绿肥填闲种植可通过影响土壤性质和资源有效性,改变土壤微生物群落的组成和结构[3]。在现代集约化农业系统中,绿肥常被纳入轮作系统,以改善土壤功能和提高作物生产力[4]。因此,了解绿肥填闲种植对农业土壤及其微生物生态系统的影响,对改进农业管理措施和提高农业生产的可持续性具有重大意义[5]。
众多的研究表明,土壤微生物在同时维持土壤生态系统的多种功能和服务(以下简称“土壤多功能性”)方面发挥着关键作用,包括有机质分解、养分循环和初级生产[6]。土壤多功能性主要反映土壤生态系统多种功能的系统整体表现,以及由此产生的生态系统服务,而不是仅仅考虑单个或若干个土壤功能[7]。有研究表明,即使是土壤微生物群落的细微变化,也可能对土壤多功能性产生重大影响。例如,微生物生物量的增加可以促进多功能性[5],而微生物多样性的任何损失都可能降低多功能性[8]。此外,微生物之间的相互作用复杂性——微生物网络复杂度,在调节多种土壤功能的过程中也发挥着重要作用[9]。Wagg等[10]通过模拟试验发现,地下微生物网络复杂度的降低会对多种土壤功能产生负面影响。最近的研究还表明,微生物群落组成(物种丰度)是多功能性的重要预测因子[11]。此外,这些微生物特性对农业管理措施也很敏感,例如,绿肥填闲种植已被证实可以增加土壤微生物多样性和网络复杂度[12];而绿肥填闲种植诱导的土壤微生物生物量的增加已被证明可以改善土壤质量[13]。尽管有这些最近的研究进展,但这些微生物特性在绿肥填闲种植后能够在多大程度上调节土壤多功能性仍不清楚。
旱地红壤是我国南方重要的土壤资源,但普遍具有有机质含量低、水土流失严重的特点[14]。在旱地红壤种植绿肥不仅可以缓解这些负面影响,且会诱导旱地红壤微生物组发生定向变化[3]。我国红壤区绿肥种质资源丰富,功能性状多样,种植不同绿肥为旱地农业生态系统的可持续发展提供了多种方案,可提高多种生态系统功能,而不仅仅是作物产量[15]。然而,种植绿肥对旱地红壤功能的影响具有物种依赖性。例如,Li等[16]发现,毛叶苕子与花生轮作会降低花生的结瘤能力;而Leng等[17]的研究表明,种植肥田萝卜可明显提升花生的结瘤能力。这些结果强调了在旱地红壤中仔细选择绿肥作物的必要性。基于此,本研究选择4种功能性状不同的冬绿肥,利用旱地红壤红薯与冬绿肥轮作试验,研究种植特定绿肥如何影响土壤微生物、土壤多功能性及其在土壤中的相互作用,以期为绿肥的利用与推广提供理论依据。
1 材料与方法 1.1 试验地概况试验设置于江西省南昌市进贤县前坊镇桂花村大纺山示范基地(116°35'11″E、28°10'59″N),属亚热带湿润气候区,年均降水量1 750 mm,降水主要集中在4—6月。试验地土壤类型为第四纪红黏土母质发育而来的红壤,表层(0 ~ 20 cm) 土壤的基础特性为:pH 4.68,有机质12.31 g/kg,全氮1.11 g/kg,全磷0.55 g/kg,碱解氮92.5 mg/kg,有效磷31.8 mg/kg。
1.2 试验设计与样品采集试验于2022年10月下旬收获红薯后开始实施,设5个处理,包括1个冬闲处理(对照)和4个不同冬绿肥品种种植处理:①冬闲,CK;②毛叶苕子(hairy vetch,Vicia villosa Roth),HV;③黑麦草(rye,Secale cereale L.),RY;④肥田萝卜(radish,Raphanus sativus L.),RD;⑤油菜(rapeseed,Brassica napus L.),RP。试验设6次重复,随机区组排列,小区面积为30 m2 (6 m × 5 m)。不同绿肥于2022年10月25日播种,播种方式为撒播。参照前期研究和当地生产实践,毛叶苕子、黑麦草、肥田萝卜和油菜的播种量分别为40、20、30和10 kg/hm2。冬闲处理不进行任何操作,绿肥处理在绿肥生长期不灌溉、不施肥。
2023年4月初,将冬绿肥全部机械翻压还田,翻压深度20 cm,冬闲处理同样操作。红薯于5月上旬进行移栽,垄距1 m,株距20 cm,种植密度为5万株/hm2。红薯施肥方式参照当地习惯进行,肥料年施用量为N 180 kg/hm2,P2O5 90 kg/hm2以及K2O 270 kg/hm2,并于移栽前全部作基肥施用。氮肥使用尿素(含N 460 g/kg),磷肥使用钙镁磷肥(含P2O5 120 g/kg),钾肥使用氯化钾(K2O,600 g/kg)。
于2023年5月下旬红薯苗期采集土壤样品。在每个小区采用5点法采集深度为0 ~ 20 cm的土样,彻底混匀后作为1个重复样品,共收集30份样品(5个处理× 6个重复)。土样采集后尽快带回室内,拣除杂质后过2 mm筛,而后将每个土壤样品分为两部分,一部分用于测定土壤性质,另一部分用于分析细菌群落。另外,在红薯成熟期时进行全小区测产。
1.3 土壤性质分析土壤化学性质的测定依照鲁如坤[18]的方法进行:采用电位法测定土壤pH(V水︰m土 = 2.5︰1),采用重铬酸钾氧化-容量法测定土壤有机碳(SOC),采用凯氏定氮法测土壤全氮(TN),采用碳酸钠熔融法测定土壤全磷(TP),采用碱解扩散法测定碱解氮(AN),采用碳酸氢钠浸提-钼锑抗比色法测定有效磷(AP)。
根据Marinari等[19]的方法,采用荧光法测定与碳、氮和磷循环相关的土壤酶活性。碳循环相关酶为β-1, 4-葡萄糖苷酶(β-1, 4-glucosidase,BG)、β-木糖苷酶(β-xylosidase,XYL)和β-D-纤维素生物水解酶(β-D-cellobiohydrolase,CB);氮循环相关酶为β-1, 4-N-乙酰氨基葡萄糖苷酶(β-1, 4-N-acetylglucosaminidase,NAG)和亮氨酸氨基肽酶(leucine aminopeptidase,LAP);磷循环相关酶为酸性磷酸酶(acid phosphatase,ACP)。
参照Fanin等[20]的方法,使用均值法计算土壤多功能性(Soil multifunctionality,SMF)。简而言之,将各指标(SOC、TN、TP、AN、AP、BG、XYL、CB、NAG、LAP、ACP和红薯产量)的原始值通过Z-score转换归一化,然后通过对归一化值取均值获得多功能性指数。土壤多功能性指数计算公式为:
| $ {\rm{SMF}} = \frac{1}{n}\sum\limits_i^n {{{\rm{StP}}_i}} $ | (1) |
式中:stPi为指标i归一化后的值;n为所选指标的数量。
1.4 土壤DNA提取、PCR扩增、16S rRNA基因高通量测序及测序数据分析称取500 mg土壤样品用FastDNA ® SPIN Kit for Soil试剂盒(MP Biomedicals,美国)提取DNA,具体方法和步骤依据试剂盒说明书进行。采用NanoDrop™2000分光光度计(Thermo Scientific,美国)测定提取DNA的浓度和质量。依据Lymperopoulou等[21]的方法,利用Applied biosystems onestep plus实时荧光定量PCR仪(Life Technologies Holdings Pte Ltd,新加坡)进行定量PCR分析,结果以基因拷贝数表征,并用于反映细菌生物量。
采用通用引物341F(5′-CCTAYGG GRBGCA SCAG-3′)和806R (5′-GGACTACNNG GGTATCTAA T-3′)扩增细菌16S rRNA基因片段。16S的PCR反应程序如下:在95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,循环27次;72 ℃延伸10 min。PCR产物在Illumina MiSeq PE250平台上进行双向高通量测序(上海凌恩)。基于QIIME2分析流程对扩增后的序列进行分析。使用“cutadapt”去除引物序列,然后利用“Demux”插件对原始序列进行质控,即将平均质量评分低于25、序列长度小于50 bp的序列去除。使用DADA2算法对质控后的序列进行双端序列合并,序列去冗余后在99% 相似性水平划分扩增子序列变体(Amplicon sequence variant,ASV)。最后依据Silva 138.1数据库比较确定细菌序列的系统学分类。
1.5 数据统计分析所有统计分析均在R Studio(version 4.2.1)中进行。利用方差分析确定显著差异,然后使用“stats”包中的TukeyHSD()函数进行Tukey HSD检验。采用“vegan”包中的pcoa()函数进行主坐标轴分析(Principal coordinate analysis,PCoA),以探究种植绿肥对细菌群落结构的影响。基于Spearman相关性矩阵的共现网络分析利用“WGCNA”包中的corAndPvalue()函数计算相关性系数。首先,剔除出现频次少的ASV(保留在1/2及以上的样品中出现的ASV)。P值经过BH矫正,之后保留|r| > 0.65且P < 0.05的值。通过“igraph”包中的subgraph()函数,根据各样本的代表性节点,从“全局网络”划分“子网络”(视为各样本的网络),来比较不同处理间网络性质差异。网络参数节点数、连接数、平均聚类系数分别利用“igraph”包中的diversity()、gsize()、transitivity()函数进行计算。使用连接密度评估网络复杂度[10]。使用“stats”包中的lm()函数对细菌生物量、群落多样性及组成、网络复杂度与土壤多功能性之间的关系进行普通最小二乘线性回归分析,采用“piecewiseSEM”包进行分段结构方程模型分析,评估细菌特性和绿肥填闲种植对土壤多功能性的直接和间接影响。模型拟合采用Fisher’s C检验,当P < 0.05时,可认为模型稳健。网络图使用plot()函数完成,其他图均使用“ggplot2”包绘制完成。
2 结果与分析 2.1 绿肥填闲种植对土壤化学性质及酶活性的影响绿肥填闲种植对土壤化学性质及酶活性产生了显著影响(表 1)。与其他处理相比(毛叶苕子处理除外),油菜处理下土壤pH较高,但差异未达显著水平(P > 0.05)。与冬闲处理相比,肥田萝卜和油菜处理下土壤SOC含量显著增加,分别较冬闲处理提高了14.02% 和19.13%(P < 0.05)。不同绿肥处理对土壤TN、AN和AP的影响均未达到显著性水平(P > 0.05)。对比冬闲处理,肥田萝卜和油菜处理下土壤TP含量分别显著提高18.84% 和20.29%(P < 0.05)。与冬闲处理相比,肥田萝卜和油菜处理显著地提高了土壤CB、LAP和ACP活性(P < 0.05)。不同处理土壤BG、XYL和NAG活性范围分别为11.20 ~ 13.57 nmol/(h·g)、5.56 ~ 6.61 μmol/(h·g)和6.40 ~ 7.17 μmol/(h·g),各处理间土壤BG、XYL和NAG活性均无显著性差异(P > 0.05)。
|
|
表 1 绿肥填闲种植对土壤化学性质及酶活性的影响 Table 1 Soil properties and enzyme activities affected by green manure cover cropping |
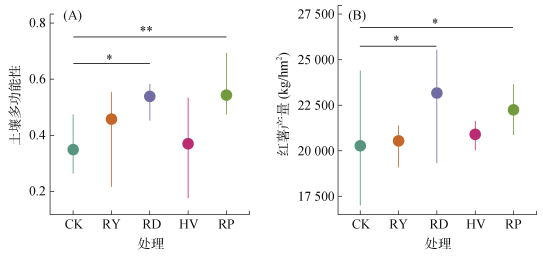
绿肥填闲种植可以提升土壤多功能性。肥田萝卜和油菜可显著提升土壤多功能性,较冬闲处理分别提高了54.36%(P < 0.05)和55.65%(P < 0.01);与冬闲处理相比,其他绿肥虽提升了土壤多功能性,但差异未达到显著水平(P > 0.05,图 1A)。不同绿肥翻压还田后对主作物红薯产量的影响表现为肥田萝卜 > 油菜 > 毛叶苕子 > 黑麦草,其中肥田萝卜翻压还田后的红薯产量最高,达23 168 kg/hm2,与冬闲处理相比增幅为14.26%(P < 0.05,图 1B)。
|
(图A、B中点代表平均值,线的上端和下端分别代表最大值和最小值;图中*、**、***分别表示在P < 0.05、P < 0.01、P < 0.001水平上差异显著;下同) 图 1 不同绿肥处理下土壤多功能性(A)和红薯产量(B) Fig. 1 Soil multifunctionality (A) and sweet potato yields (B) under different green manure treatments |
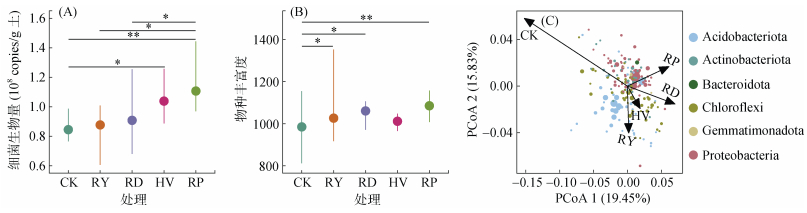
不同绿肥填闲种植处理土壤细菌生物量表现为油菜 > 毛叶苕子 > 肥田萝卜 > 黑麦草 > 冬闲,以油菜处理最高,较冬闲处理增加了31%(P < 0.01,图 2A)。对比冬闲处理,毛叶苕子处理对土壤细菌群落物种丰富度影响不显著(P > 0.05),而黑麦草、肥田萝卜和油菜处理下物种丰富度显著提高4.27% (P < 0.05)、7.72% (P < 0.05)和10.26%(P < 0.01)(图 2B)。PCoA分析表明,绿肥填闲种植对土壤细菌群落结构产生了显著影响:沿X轴冬闲处理与绿肥处理分离明显;沿Y轴肥田萝卜、油菜处理与黑麦草、毛叶苕子处理分离明显。变形杆菌门(Proteobacteria)的相对丰度在很大程度上解释了冬闲和绿肥处理之间细菌群落的差异。肥田萝卜和油菜处理下变形杆菌门丰度增加,且与冬闲处理形成显著差异。芽单胞菌门(Gemmatimonadota)的相对丰度在很大程度上解释了肥田萝卜(或油菜)和其他处理之间细菌群落的差异(图 2C)。
|
(图C中每一个点代表一个ASV,点的大小代表每个ASV在所有样品中的平均相对丰度,点的颜色代表ASV在门水平上的分类组成,箭头指向各变量的质心) 图 2 不同绿肥处理下细菌群落生物量(A)、物种丰富度(B)及结构(C) Fig. 2 Biomass (A), species richness (B), and structures (C) of bacterial communities under different green manure treatments |
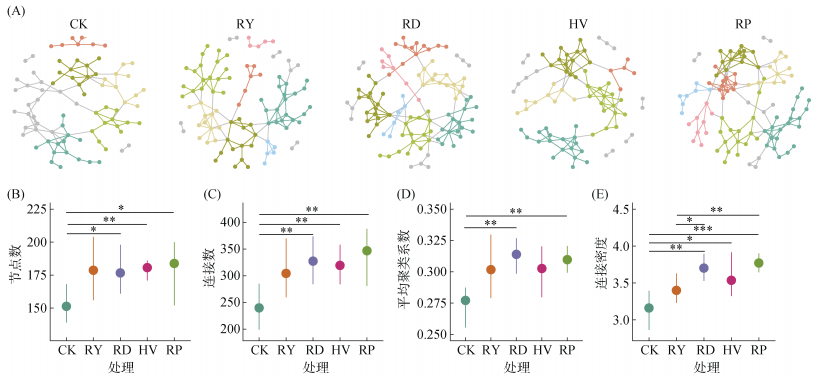
共现网络分析表明,绿肥填闲种植改变了土壤细菌群落的共现模式(图 3A)。与冬闲处理相比,绿肥处理增加了网络的节点和连接数,以油菜处理最高(图 3B、3C)。肥田萝卜和油菜处理下网络的平均聚类系数最高,且与冬闲处理形成显著性差异(图 3D)。所有绿肥处理均能够显著增加网络的连接密度,以肥田萝卜和油菜处理最高(图 3E)。综上,绿肥填闲种植提升了土壤细菌的网络复杂度。
|
(图A中每个节点代表一个ASV,节点根据网络模块着色,为了方便展示,仅显示在所有6个重复中检测到的ASV) 图 3 不同绿肥处理下土壤细菌共现网络结构(A)及网络特征,包括节点数(B)、连接数(C)、平均聚类系数(D)和连接密度(E) Fig. 3 Co-occurrence networks of soil bacteria (A) and network characteristics, including nodes (B), links (C), average clustering coefficients (D) and linkage densities (E) under different green manure treatments |
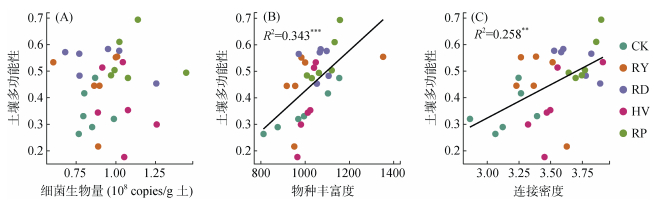
回归分析发现,细菌生物量与土壤多功能性之间无显著相关性(图 4A),而细菌群落物种丰富度、网络复杂度与土壤多功能性呈显著正相关(图 4B、4C)。值得注意的是,细菌群落物种丰富度对土壤多功能性的贡献高于细菌网络复杂度。
|
图 4 土壤多功能性与细菌生物量(A)、物种丰富度(B)和网络复杂度(C)的关系 Fig. 4 Relationships of soil multifunctionality with bacterial biomass (A), species richness (B), and network complexity (C) |
另一方面,优势菌门的相对丰度也是土壤多功能性的重要预测因子。具体而言,变形杆菌门(Proteobacteria)、芽单胞菌门(Gemmatimonadota)的相对丰度与土壤多功能性呈显著正相关,而其他优势菌门与土壤多功能性皆不显著相关(图 5)。
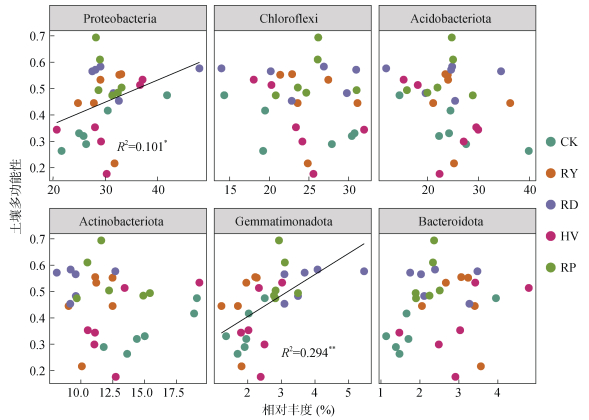
|
图 5 土壤多功能性与细菌群落组成的关系 Fig. 5 Relationships of soil multifunctionality with bacterial community composition |
在考虑不同绿肥处理的影响后,利用分段结构方程模型进一步评估细菌群落特性对土壤多功能性的直接与间接效应(图 6)。模型对土壤多功能性的总解释率为72%。即使在同时考虑多个变量的情况下,细菌群落组成、物种丰富度及网络复杂度和土壤多功能性之间仍然存在直接且显著的关联。此外,细菌群落物种丰富度可通过调控网络复杂度间接影响土壤多功能性。细菌群落物种丰富度对土壤多功能性的总效应(直接加间接)要大于细菌群落组成与网络复杂度。
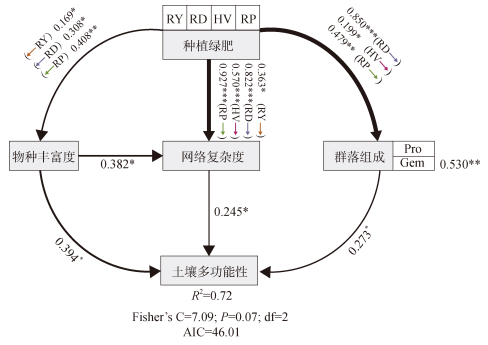
|
(箭头旁边的数字表示关系的效应大小,箭头粗细表示关系的强度,R2是方差解释的比例;Pro代表变形杆菌门(Proteobacteria),Gem代表芽单胞菌门(Gemmatimonadota)) 图 6 土壤细菌特性对土壤多功能性的影响 Fig. 6 Effects of soil bacterial properties on soil multifunctionality |
本研究发现,绿肥填闲种植能够提升土壤多功能性(图 1),这与之前的研究结果一致,即将绿肥纳入轮作系统可以改善土壤的生物性状和生态功能[12-13]。这一现象可用绿肥填闲种植后土壤养分的增加来解释。例如,绿肥填闲种植措施下土壤中SOC和TP的含量明显高于冬闲处理。土壤养分的增加对土壤功能有正反馈效应,因为资源利用率的增加有利于土壤微生物的代谢和共生[22]。此外,绿肥填闲种植后土壤多功能性的提升还可归因于轮作制度的遗留效应,因为作物物种多样性的增加提升了生物多样性以支持多种土壤功能[23]。不同的绿肥品种对土壤多功能性的提升效果存在着明显的差异。本研究中,肥田萝卜和油菜对土壤多功能性的提升效果要明显优于黑麦草和毛叶苕子。这可能是因为肥田萝卜和油菜属于资源保守型绿肥[4],能够增加基础资源的数量以促进农业土壤的生物多样性,从而促进多种土壤功能[24]。
3.2 土壤细菌群落物种丰富度、组成及网络复杂度驱动土壤多功能性土壤微生物量在维持土壤质地、改善土壤肥力和促进养分循环等农业生态过程中的重要作用已被广泛报道[25]。本研究未发现细菌生物量与土壤多功能性之间存在显著的正相关关系(图 4)。这可能是因为活性微生物而不是总的微生物生物量与土壤多功能性呈正相关[26],且活性微生物仅占总微生物生物量的0.1% ~ 2%[27]。与之相反,本研究发现在旱地红壤生态系统中,土壤微生物物种丰富度与土壤多功能性之间存在明显的正相关性(图 4)。这与之前在其他生态系统中得到的结果一致[8-9],即更高的土壤微生物多样性可以确保更高的多生态系统功能性。绿肥凋落物可为土壤微生物提供食物、养分和栖息地,从而增加微生物群落多样性[28],这可最大限度地提高土壤发挥基本生态系统功能和服务的能力。
网络复杂度是微生物群落影响土壤多功能性的另一个重要特性。本研究发现,与冬闲处理相比,绿肥填闲种植增加了微生物网络的复杂度(图 3)。绿肥可通过根系作用和生态位开发策略为特定微生物类群提供有利的生态位,从而增强微生物类群之间的相互作用[29]。与先前的研究结果一致,微生物群落网络复杂度与土壤多功能性之间保持着显著的正相关性[9-10]。土壤微生物网络复杂度的增加可确保多种土壤功能的高效实施,如土壤养分循环和对逆境的抵抗力[10]。这可能归因于物种间更复杂的相互作用在资源利用和信息传递方面能够提供更多优势,以支持多种土壤功能[9]。
以往的大范围调查证实了细菌群落组成作为土壤多功能性预测因子的重要性[6]。本研究发现,在这些细菌分类群中,芽单胞菌门(Gemmatimonadota)在调节土壤多功能性方面起主要作用,芽单胞菌门相对丰度与土壤多功能性呈显著正相关关系(图 5)。先前的研究支持这一结果,芽单胞菌作为K策略微生物,在水和营养有限的环境中更具竞争力[6]。此外,芽单胞菌具有多种功能特性,包括通过释放胞外酶分解和利用土壤复杂有机质,产生不同类型的生物活性化合物促进植物生长[30],这进一步解释了其为何是土壤多功能性的重要预测因子。同样,变形杆菌门相对丰度也与旱地红壤生态系统中土壤多功能性呈显著正相关(图 5)。变形杆菌倾向于表现出r策略生活史,可在相对营养丰富的土壤中进行不稳定和复杂有机质的分解和构建等关键过程[31],有助于土壤多功能性的提升。以上结果表明,主要细菌类群在调节土壤多功能性方面发挥着至关重要的作用,而这些类群因种植绿肥导致的变化可能会改变土壤的重要功能。
3.3 细菌群落物种丰富度在增强土壤多功能性方面的作用大于网络复杂度和群落组成值得注意的是,本研究发现,细菌群落物种丰富度对土壤多功能性的贡献要大于网络复杂度(图 4)。结构方程模型的结果(图 6)也表明,细菌群落物种丰富度可通过调控网络复杂度来影响土壤多功能性。这与之前的观察结果一致,即更高的微生物物种丰富度可以通过确保微生物之间更复杂的相互作用来支持土壤多功能性[9-10]。此外,细菌群落物种丰富度对土壤多功能性的影响也强于优势类群。以往的研究表明,当种群物种丰富度降低到较低水平时,生态系统功能的变化将取决于某些关键种群的丰度,而与生物物种丰富度水平无关[32]。本研究中,细菌群落物种丰富度维持在相对较高的水平。因此,土壤功能可能对细菌分类群总数的变化更为敏感。综上,绿肥填闲种植主要通过增加细菌群落物种丰富度来提升土壤多功能性。尽管如此,网络复杂性和优势类群对土壤多功能性的重要性也不应被低估,因为土壤微生物之间的复杂关联及关键类群的丧失也可能危及土壤的基本功能[14-15]。
4 结论绿肥填闲种植增加了细菌生物量、物种丰富度及网络复杂度,并提升了土壤多功能性。土壤多功能性随着细菌群落物种丰富度、网络复杂度及优势类群丰度的增加而增加。其中,细菌群落物种丰富度对土壤多功能性的贡献更大,表明维持细菌群落物种丰富度对于支持旱地红壤的多种功能至关重要。这些发现有助于加深对于绿肥填闲种植如何介导土壤微生物和土壤多功能性之间相互作用的理解,并可为红壤区冬绿肥的选择利用提供科学依据。
| [1] |
焦硕, 戚杰军, 刘纪爱, 等. 旱区土壤微生物组与土壤健康评价[J]. 土壤学报, 2023, 60(5): 1350-1362 (  0) 0) |
| [2] |
Galindo-Castañeda T, Lynch J P, Six J, et al. Improving soil resource uptake by plants through capitalizing on synergies between root architecture and anatomy and root-associated microorganisms[J]. Frontiers in Plant Science, 2022, 13: 827369 DOI:10.3389/fpls.2022.827369 (  0) 0) |
| [3] |
Xiang X J, Adams J M, Qiu C F, et al. Nutrient improvement and soil acidification inducing contrary effects on bacterial community structure following application of hairy vetch (Vicia villosa Roth L.) in Ultisol[J]. Agriculture, Ecosystems & Environment, 2021, 312: 107348 (  0) 0) |
| [4] |
Zhang C Z, Xue W F, Xue J R, et al. Leveraging functional traits of cover crops to coordinate crop productivity and soil health[J]. Journal of Applied Ecology, 2022, 59(10): 2627-2641 DOI:10.1111/1365-2664.14264 (  0) 0) |
| [5] |
Garland G, Edlinger A, Banerjee S, et al. Crop cover is more important than rotational diversity for soil multifunctionality and cereal yields in European cropping systems[J]. Nature Food, 2021, 2(1): 28-37 DOI:10.1038/s43016-020-00210-8 (  0) 0) |
| [6] |
Delgado-Baquerizo M, Trivedi P, Trivedi C, et al. Microbial richness and composition independently drive soil multifunctionality[J]. Functional Ecology, 2017, 31(12): 2330-2343 DOI:10.1111/1365-2435.12924 (  0) 0) |
| [7] |
李奕赞, 张江周, 贾吉玉, 等. 农田土壤生态系统多功能性研究进展[J]. 土壤学报, 2022, 59(5): 1177-1189 (  0) 0) |
| [8] |
Fan K K, Chu H Y, Eldridge D J, et al. Soil biodiversity supports the delivery of multiple ecosystem functions in urban greenspaces[J]. Nature Ecology & Evolution, 2023, 7(1): 113-126 (  0) 0) |
| [9] |
Chen W Q, Wang J Y, Chen X, et al. Soil microbial network complexity predicts ecosystem function along elevation gradients on the Tibetan Plateau[J]. Soil Biology and Biochemistry, 2022, 172: 108766 DOI:10.1016/j.soilbio.2022.108766 (  0) 0) |
| [10] |
Wagg C, Schlaeppi K, Banerjee S, et al. Fungal-bacterial diversity and microbiome complexity predict ecosystem functioning[J]. Nature Communications, 2019, 10: 4841 DOI:10.1038/s41467-019-12798-y (  0) 0) |
| [11] |
Ma L N, Zhang C X, Xu X F, et al. Different facets of bacterial and fungal communities drive soil multifunctionality in grasslands spanning a 3500 km transect[J]. Functional Ecology, 2022, 36(12): 3120-3133 DOI:10.1111/1365-2435.14220 (  0) 0) |
| [12] |
Yan H L, Gu S S, Li S Z, et al. Grass-legume mixtures enhance forage production via the bacterial community[J]. Agriculture, Ecosystems & Environment, 2022, 338: 108087 (  0) 0) |
| [13] |
Muhammad I, Wang J, Sainju U M, et al. Cover cropping enhances soil microbial biomass and affects microbial community structure: A meta-analysis[J]. Geoderma, 2021, 381: 114696 DOI:10.1016/j.geoderma.2020.114696 (  0) 0) |
| [14] |
董攀月, 陈禹竹, 曾军, 等. 不同施肥处理下旱地红壤中阿特拉津的环境归趋及其调控研究[J]. 土壤, 2022, 54(6): 1201-1209 DOI:10.13758/j.cnki.tr.2022.06.014 (  0) 0) |
| [15] |
王强盛, 薄雨心, 余坤龙, 等. 绿肥还田在稻作生态系统的效应分析及研究展望[J]. 土壤, 2021, 53(2): 243-249 DOI:10.13758/j.cnki.tr.2021.02.004 (  0) 0) |
| [16] |
Li G L, Li P F, Wu M, et al. Variation in rhizosphere microbial communities and its association with the nodulation ability of peanut[J]. Archives of Agronomy and Soil Science, 2023, 69(5): 759-770 DOI:10.1080/03650340.2022.2033734 (  0) 0) |
| [17] |
Leng K, Liu J, Li G L, et al. The relationship between core rhizosphere taxa and peanut nodulation capacity under different cover crop amendments[J]. Agronomy, 2023, 13(2): 311 DOI:10.3390/agronomy13020311 (  0) 0) |
| [18] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科学技术出版社, 北京, 2000
(  0) 0) |
| [19] |
Marinari S, Bonifacio E, Moscatelli M C, et al. Soil development and microbial functional diversity: Proposal for a methodological approach[J]. Geoderma, 2013, 192: 437-445 DOI:10.1016/j.geoderma.2012.08.023 (  0) 0) |
| [20] |
Fanin N, Gundale M J, Farrell M, et al. Consistent effects of biodiversity loss on multifunctionality across contrasting ecosystems[J]. Nature Ecology & Evolution, 2018, 2(2): 269-278 (  0) 0) |
| [21] |
Lymperopoulou D S, Adams R I, Lindow S E. Contribution of vegetation to the microbial composition of nearby outdoor air[J]. Applied and Environmental Microbiology, 2016, 82(13): 3822-3833 DOI:10.1128/AEM.00610-16 (  0) 0) |
| [22] |
Tiemann L K, Billings S A. Changes in variability of soil moisture alter microbial community C and N resource use[J]. Soil Biology and Biochemistry, 2011, 43(9): 1837-1847 DOI:10.1016/j.soilbio.2011.04.020 (  0) 0) |
| [23] |
Yang X, Hu H W, Yang G W, et al. Crop rotational diversity enhances soil microbiome network complexity and multifunctionality[J]. Geoderma, 2023, 436: 116562 DOI:10.1016/j.geoderma.2023.116562 (  0) 0) |
| [24] |
Wan B B, Liu T, Gong X, et al. Energy flux across multitrophic levels drives ecosystem multifunctionality: Evidence from nematode food webs[J]. Soil Biology and Biochemistry, 2022, 169: 108656 DOI:10.1016/j.soilbio.2022.108656 (  0) 0) |
| [25] |
Wang D Y, Lin J Y, Sayre J M, et al. Compost amendment maintains soil structure and carbon storage by increasing available carbon and microbial biomass in agricultural soil–A six-year field study[J]. Geoderma, 2022, 427: 116117 DOI:10.1016/j.geoderma.2022.116117 (  0) 0) |
| [26] |
Bastida F, Torres I F, Moreno J L, et al. The active microbial diversity drives ecosystem multifunctionality and is physiologically related to carbon availability in Mediterranean semi-arid soils[J]. Molecular Ecology, 2016, 25(18): 4660-4673 DOI:10.1111/mec.13783 (  0) 0) |
| [27] |
Blagodatskaya E, Kuzyakov Y. Active microorganisms in soil: Critical review of estimation criteria and approaches[J]. Soil Biology and Biochemistry, 2013, 67: 192-211 DOI:10.1016/j.soilbio.2013.08.024 (  0) 0) |
| [28] |
Fujii S, Berg M P, Cornelissen J H C. Living litter: Dynamic trait spectra predict fauna composition[J]. Trends in Ecology & Evolution, 2020, 35(10): 886-896 (  0) 0) |
| [29] |
Zhang K L, Maltais-Landry G, Liao H L. How soil biota regulate C cycling and soil C pools in diversified crop rotations[J]. Soil Biology and Biochemistry, 2021, 156: 108219 DOI:10.1016/j.soilbio.2021.108219 (  0) 0) |
| [30] |
Gu S H, Wei Z, Shao Z Y, et al. Competition for iron drives phytopathogen control by natural rhizosphere microbiomes[J]. Nature Microbiology, 2020, 5(8): 1002-1010 DOI:10.1038/s41564-020-0719-8 (  0) 0) |
| [31] |
Pascault N, Ranjard L, Kaisermann A, et al. Stimulation of different functional groups of bacteria by various plant residues as a driver of soil priming effect[J]. Ecosystems, 2013, 16(5): 810-822 DOI:10.1007/s10021-013-9650-7 (  0) 0) |
| [32] |
Hong P B, Schmid B, De Laender F, et al. Biodiversity promotes ecosystem functioning despite environmental change[J]. Ecology Letters, 2022, 25(2): 555-569 DOI:10.1111/ele.13936 (  0) 0) |
 2024, Vol. 56
2024, Vol. 56


