2. 中国科学院大学, 北京 100049;
3. 养分资源高效利用全国重点实验室(山东省农业科学院农业资源与环境研究所), 济南 250100
铁是植物正常生长发育必需的微量元素,参与了呼吸作用、光合作用等各类重要生理代谢过程[1-3]。土壤铁的活性受到环境pH和氧化还原电位的影响,在氧化还原电位低的淹水稻田或酸性土壤中,铁元素往往以还原性的Fe2+形态大量存在,使水稻易受到铁毒胁迫[3-7]。全世界大约有7.5×106 hm2含有过量活性铁的强还原性土壤,广泛分布于中国、南亚、东南亚、非洲和南美[4, 8]。我国有4×106 hm2以上的潜育性稻田易形成铁毒胁迫[4, 8-11]。铁毒胁迫会导致水稻减产15% ~ 30%,严重时甚至造成绝收[8, 12-13]。
已有研究表明,当水稻吸收过量铁时,株高、根系长度、分蘖数、根系和地上部干物质量均受到显著抑制,产量构成要素如穗数、每穗籽粒数、千粒重也受到影响。蔡妙珍等[5, 9]利用水培试验的研究表明,当Fe2+浓度为50 mg/L时,即可产生水稻铁毒胁迫,水稻株高和地上部生物量显著下降;当Fe2+浓度超过150 mg/L时,会更严重地抑制水稻地上部和根系生长。赵燕等[14]的研究发现,Fe2+浓度为200 mg/L时,水稻株高、根系长度、分蘖数、根系和地上部干物质量均受到显著抑制。冯双华等[15]的研究也表明,40 mg/L Fe2+胁迫会抑制水稻根系生长量、株高、叶片生长、穗数和单株产量,但尚未影响每穗总粒数、千粒重等指标;当Fe2+浓度增至80 mg/L及以上时,各生长指标均受到抑制且进一步加剧,达到160 mg/L时植株未抽穗即枯萎死亡。我国各水稻种植区域东北、长江中下游、西南、华南的稻田有效铁含量均超过105 mg/kg,多数地区超过145 mg/kg[16]。而淹水则会导致不同类型土壤的活性铁含量大幅增加,达到铁毒胁迫水平[17]。总之,铁毒胁迫能明显造成水稻生长的抑制,从而导致产量降低[2, 18-19]。
据世界卫生组织估计,全球约1/4的人口患有贫血,大多数贫血由铁缺乏引起[20-24]。而稻米是全世界50% 以上人口的主粮,提高稻米中的铁含量有助于改善人类缺铁性贫血[20-22]。因此,水稻响应铁毒胁迫时,如何调控株高、叶片、分蘖、穗数和籽粒生长从而加强对铁毒胁迫的耐性,维持或提高产量的同时增加籽粒铁含量、提高稻米品质,是探明水稻耐铁毒胁迫机制和选育耐铁毒胁迫水稻品种的重要研究方向。目前,虽然对水稻铁毒胁迫的生长表型及生理反应已有不少研究,但对铁毒胁迫影响水稻产量性状的研究仍较少。因此,本文研究了铁毒胁迫对水稻叶长、叶宽、株高、分蘖数、穗数、籽粒大小、千粒重和各部位铁含量等产量性状的影响特征,以为推进对水稻铁毒胁迫的认知提供理论依据。
1 材料与方法 1.1 水稻水培试验水稻水培试验在中国科学院南京土壤研究所玻璃温室进行。选择饱满一致的水稻(日本晴)种子,首先用10% H2O2浸泡消毒30 min,随后用去离子水冲洗至少3次,保证冲洗干净,再在28 ℃避光环境下用去离子水浸种24 h;露白后,将其放置在漂浮于0.5 mmol/L CaCl2溶液上的塑料网上,继续避光培养48 h;之后开始照光,24 h后使用营养液培养育秧。培养液采用Kimura B改良营养液[25],其主要成分为:0.5 mmol/L MgSO4·7H2O,0.36 mmol/L CaCl2·2H2O,0.25 mmol/L KCl,0.2 mmol/L NaH2PO4,1 mmol/L NaNO3,0.5 mmol/L NH4Cl,50 μmol/L H3BO3,9 μmol/L MnCl2·4H2O,0.7 μmol/L ZnSO4·7H2O,0.5 μmol/L Na2MoO4·2H2O,0.3 μmol/L CuSO4·5H2O。试验的重复株数至少10株,生长培养20周。在育秧阶段,营养液中的铁以Fe(Ⅱ)-EDTA (FeSO4·7H2O与EDTA-2Na溶解混合后加热配制而成)形态供应,浓度为0.1 mmol/L,每2 d更换1次营养液,并使用2 mol/L的NaOH和HCl将营养液pH调至5.5。育秧培养15 d后开始进行铁毒胁迫水培试验,每3 d更换1次营养液,并把上述营养液中的Fe(Ⅱ)-EDTA替换为FeSO4·7H2O形态以供应Fe,对照组的Fe为5.6 mg/L(CK),不同铁毒胁迫的Fe处理浓度分别为:60 mg/L (+Fe)和100 mg/L (++Fe)。
1.2 水稻表型指标测定株高、叶长、叶宽的测定使用带有刻度的直尺测量,重复数至少为10个。其中,株高量取所有重复植株的根茎结合部至植株捋直后最高点的距离,从育秧培养第6周开始每周测量1次;第14周时,选取所有重复植株的剑叶测量叶长、叶宽,叶宽为所测叶片的最宽处,叶长为该叶片与叶枕连接处至叶尖的距离。分蘖数和穗数为对所有成熟后的植株直接计数。收集成熟后的稻穗脱粒,并对粒长和粒宽进行测定,每组10个籽粒紧密排列,使用游标卡尺测量多组数据后,计算单个籽粒的长宽。千粒重的测定使用十万分之一天平称重,每次抽取100个籽粒,随机多次称重后,计算千粒重。试验期间,记录水稻抽穗时间,即每个植株出现第一个穗的时间。
1.3 水稻铁元素含量测定剪取成熟期(20周)多个重复植株的组织样品,如根、叶片、穗(后又将穗机械分解为穗柄、着粒枝梗、种壳、去壳后的糙米),用去离子水清洗并擦干,分别装入塑料离心管中,在烘箱中以烘干24 h。取烘干样品,加入氧化锆研磨珠在组织研磨仪中研磨成细小粉末或碎片,取出部分样品称重后置于洗净烘干的玻璃消煮管中,加入1 mL HNO3静置1 h,于消煮炉中以200 ℃消煮至完全澄清,用蒸馏水定容至10 mL,用电感耦合等离子体质谱(ICP-MS)测定铁含量(mg/kg)。
1.4 数据统计与分析使用Excel 2016程序进行试验数据统计分析,采用t检验法对每两组数据显著性进行检验。采用GraphPad Prism 8软件绘图。植物的表型照片使用相机CANON EOS X7i拍摄。
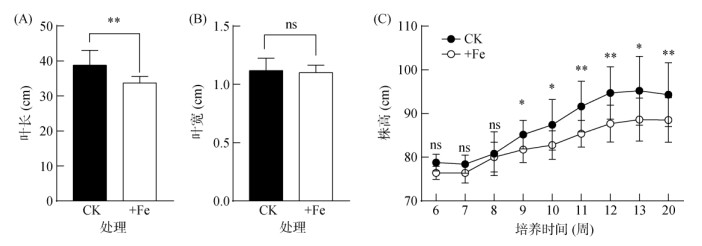
2 结果与分析 2.1 铁毒胁迫对水稻叶长、叶宽和株高的影响铁毒胁迫(+Fe)显著抑制水稻剑叶叶长,从对照(CK)条件的39 cm下降至34 cm,下降比例13%(图 1A)。而剑叶叶宽在对照和铁毒胁迫条件下均为1.1 cm,无明显差异(图 1B)。水稻生长8周内,铁毒胁迫(+Fe)尚未对株高产生显著抑制,从第9周开始对株高产生抑制作用,并随着处理时间延长而逐渐增大,最终使株高降低了6%(图 1C)。
|
(图中ns表示两组比较无显著性差异,*、**、***分别表示两组比较差异在P < 0.05、P < 0.01、P < 0.001水平显著;下同) 图 1 铁毒胁迫对水稻叶宽、叶长和株高的影响 Fig. 1 Effects of iron toxicity on leaf width, leaf length and plant height of rice |
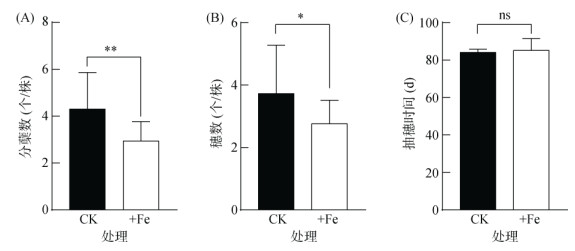
分析铁毒胁迫(+Fe)对分蘖数和穗数的影响,数据显示,铁毒胁迫降低分蘖数32%,由每株4.3个减少至2.9个(图 2A)。与对照相比,铁毒胁迫使穗数减少26%,由每株的3.7个减少至2.8个(图 2B)。但是,铁毒胁迫对抽穗时间未见显著影响(图 2C)。
|
图 2 铁毒胁迫对水稻分蘖数、穗数和抽穗时间的影响 Fig. 2 Effects of iron toxicity on tillering number, panicle number and heading time of rice |
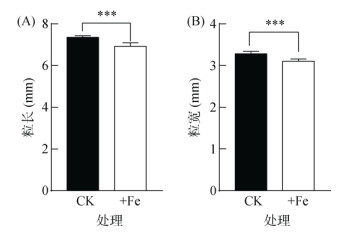
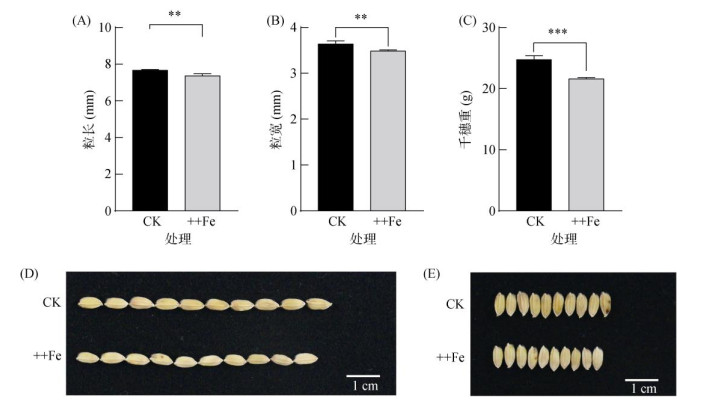
铁毒胁迫(+Fe和++Fe)显著影响水稻籽粒形态,平均粒长减少0.30 mm,粒宽减少0.15 mm,均下降5%(图 3、图 4A、图 4B、图 4D和图 4E)。+Fe和++Fe条件下籽粒长、宽减小幅度接近,进一步测定++Fe条件下的千粒重和铁含量指标,发现由于籽粒大小的变化,千粒重也受到明显影响(图 4C)。铁毒胁迫(++Fe)使水稻千粒重由25 g降至22 g,下降比例13% (图 4C)。
|
图 3 铁毒胁迫(+Fe)对水稻籽粒长宽的影响 Fig. 3 Effects of iron toxicity (+Fe) on grain length and width of rice |
|
图 4 铁毒胁迫(++Fe)对水稻籽粒长、宽和千粒重的影响 Fig. 4 Effects of iron toxicity (++Fe) on grain length, width and 1000-grain weight of rice |
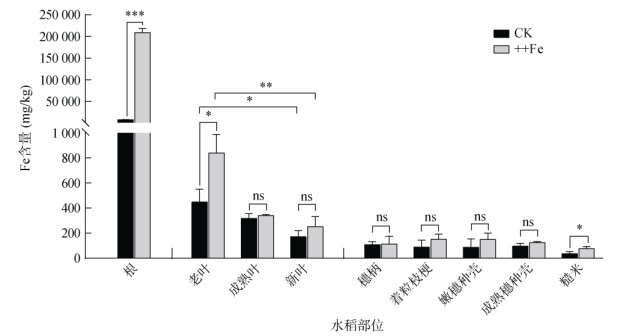
水稻根部是直接接触铁毒胁迫的部位,由图 5可知,根部铁含量在各部位中最高;在铁毒胁迫(++Fe)下,根部的铁含量为老叶铁含量的260倍,为对照条件下根部铁含量的27倍。地上部不同老化程度的叶片铁含量有明显差异。新叶和成熟叶的铁含量在铁毒胁迫和对照条件下没有显著差异,而老叶铁含量在铁毒胁迫条件下增幅近1倍,由对照的450 mg/kg增至840 mg/kg。在穗和籽粒构成的各部位,穗柄、着粒枝梗、嫩穗种壳、成熟穗种壳的铁含量在铁毒胁迫条件下与对照未见显著差异,而糙米铁含量在铁毒胁迫条件下显著增加近1倍,由对照的36 mg/kg增加至77 mg/kg。
|
图 5 铁毒胁迫对水稻各组织部位铁含量的影响 Fig. 5 Effect of iron toxicity on Fe contents in different tissue parts of rice |
铁毒胁迫广泛分布于各水稻生长区域,尤其是在潜育性或酸性土壤中,其严重影响了水稻产量[4-5]。在以往水稻响应铁毒胁迫的研究中,更多的发现叶片、株高、分蘖等易受到抑制,但对影响产量的性状,从对分蘖到穗数、粒型、千粒重的关注较少[5, 9, 11, 14-15, 26]。因此,本研究进一步探讨了铁毒胁迫对产量相关性状的影响。
本研究发现,铁毒胁迫条件(+Fe)下,剑叶叶长已经受到显著抑制,这可能会进一步减小光合面积,从而对产量造成风险(图 1A)。这与冯双华等[15]和蔡妙珍等[9]的研究结果相一致,其研究显示,铁毒胁迫会减少绿叶数和叶面积。
本研究中,铁毒胁迫(+Fe)抑制水稻株高、分蘖数和穗数(图 1C和图 2)。而前人研究也显示,株高和分蘖数在轻度铁毒胁迫下或铁毒胁迫临界浓度附近已明显下降,进而导致穗数下降,并随着铁毒胁迫浓度升高而加剧下降 [5, 9, 11, 14, 26]。冯双华等[15]的研究发现,铁浓度达到160 mg/L时水稻尚未抽穗即枯萎死亡。另外,在铁毒胁迫条件下,敏感水稻品种的分蘖数和穗数比耐性品种下降更为明显,因此,分蘖数和穗数可能是水稻应答铁毒胁迫的重要敏感指标[27]。
本研究显示,+Fe和++Fe铁毒胁迫条件下水稻籽粒的粒长、粒宽减小,使得籽粒体积减小,但二者减小幅度相近,进一步测量++Fe条件下千粒重,千粒重也明显下降(图 3和图 4)。籽粒的形态和千粒重变化可能是由于籽粒增加的铁积累导致。与Unoki等[28]的研究一致,本研究也发现,铁毒胁迫条件下水稻籽粒中显著积累了更多的铁(图 5)。程金平等[29]和Zhang等[30]利用禾本科种子数量性状遗传模型研究发现,粒形与铁含量存在较明显相关性。另外一项以635份云南水稻种质资源开展的研究也表明,水稻籽粒铁含量与千粒重、粒长、粒宽呈现负相关[31]。王辉等[32]的研究也认为,水稻籽粒铁含量与粒宽负相关。陈秀晨等[33]也研究了水稻籽粒铁含量与其他农艺性状的相关性,发现铁含量与株高负相关,与结实率显著负相关。玉米籽粒铁含量调控基因变化后,能调控籽粒铁含量变化,对籽粒长宽也产生了影响[34]。这些研究均证明籽粒铁含量与籽粒形态及千粒重有密切相关性。
水稻叶部和籽粒分别作为源和库,能进行多种营养物质的转运交流。剑叶是植株进行物质生产和输出的主要功能叶片[35]。有研究发现,OsVIT1和OsVIT2分别在剑叶叶片和叶鞘中高表达,并影响了铁在剑叶和籽粒之间的转运和分配[36-37]。水稻osvit1和osvit2突变体籽粒中铁积累增加,而源器官剑叶中铁积累相应减少,表明源向库器官的铁转运可能得到了增强[37-38]。另外,也有研究表明,铁毒胁迫条件下,叶片铁含量与产量负相关[39]。铁毒胁迫耐性的水稻品种会在根部积累更多的铁,在茎和叶中积累更少的铁[39]。dos Santos等[27]的研究也表明,铁毒敏感水稻品种的叶部铁含量明显高于耐性品种。本研究中,已知铁毒胁迫条件(++Fe)下籽粒大小、千粒重受到抑制,进一步测量老叶铁含量发现其增加显著,而新叶和成熟叶铁含量未产生显著增加(图 5),这与以往研究显示的铁毒胁迫条件下老叶更容易积累铁的结果一致[40-42]。铁毒胁迫强度越高,越多的铁会优先转运至老叶中,老叶比新叶更早呈现棕褐色的铁毒胁迫症状[40-41, 43-44]。可见,除了根部的阻隔作用在水稻耐受铁毒胁迫过程中发挥关键作用外,水稻地上部可能通过调控铁毒胁迫发生时的铁元素分配并牺牲老叶来分隔、存储铁元素,降低地上部铁元素的转运活性,发挥抵御地上部铁毒胁迫的重要作用[40-41, 43-44]。
4 结论水稻叶片、株高、分蘖数和穗数会明显受铁毒胁迫抑制。铁毒胁迫也会影响水稻籽粒形态,降低粒长、粒宽和千粒重。铁毒胁迫条件下,水稻根部积累了绝大多数的铁,老叶在地上各部位中铁含量最高,其铁含量大于新叶和成熟叶。水稻籽粒中的铁含量受铁毒胁迫影响显著上升。
| [1] |
邱园园, 刘昆, 卓鑫鑫, 等. 铁的生理功能及其对水稻产量和品质影响的研究综述[J]. 中国稻米, 2022, 28(1): 43-47 (  0) 0) |
| [2] |
张琳, 李光杰, 施卫明. 供铁水平对不同氮源条件下水稻生长和元素吸收积累的影响及种间差异[J]. 土壤, 2019, 51(4): 635-640 (  0) 0) |
| [3] |
Li G, Kronzucker H J, Shi W. The response of the root apex in plant adaptation to iron heterogeneity in soil[J]. Frontiers in Plant Science, 2016, 7: 344 (  0) 0) |
| [4] |
Onaga G, Dramé K N, Ismail A M. Understanding the regulation of iron nutrition: Can it contribute to improving iron toxicity tolerance in rice?[J]. Functional Plant Biology, 2016, 43(8): 709-726 DOI:10.1071/FP15305 (  0) 0) |
| [5] |
蔡妙珍, 罗安程, 林咸永, 等. 过量Fe2+胁迫下水稻的养分吸收和分配[J]. 浙江大学学报(农业与生命科学版), 2003, 29(3): 305-310 (  0) 0) |
| [6] |
赵学强, 潘贤章, 马海艺, 等. 中国酸性土壤利用的科学问题与策略[J]. 土壤学报, 2023, 60(5): 1248-1263 (  0) 0) |
| [7] |
Li B H, Sun L, Huang J Y, et al. GSNOR provides plant tolerance to iron toxicity via preventing iron-dependent nitrosative and oxidative cytotoxicity[J]. Nature Communications, 2019, 10(1): 3896 DOI:10.1038/s41467-019-11892-5 (  0) 0) |
| [8] |
Becker M, Asch F. Iron toxicity in rice—Conditions and management concepts[J]. Journal of Plant Nutrition and Soil Science, 2005, 168(4): 558-573 DOI:10.1002/jpln.200520504 (  0) 0) |
| [9] |
蔡妙珍, 林咸永, 罗安程, 等. 过量Fe2+对水稻生长和某些生理性状的影响[J]. 植物营养与肥料学报, 2002, 8(1): 96-99 (  0) 0) |
| [10] |
龚子同, 张效朴, 韦启璠. 我国潜育性水稻土的形成、特性及增产潜力[J]. 中国农业科学, 1990, 23(1): 45-52 (  0) 0) |
| [11] |
陈娜. 冷浸田亚铁和还原态硫障碍因子致毒机理及治理初探[D]. 杭州: 浙江大学, 2014.
(  0) 0) |
| [12] |
Sahrawat K L. Iron toxicity in wetland rice and the role of other nutrients[J]. Journal of Plant Nutrition, 2005, 27(8): 1471-1504 DOI:10.1081/PLN-200025869 (  0) 0) |
| [13] |
Li G J, Xu W F, Kronzucker H J, et al. Ethylene is critical to the maintenance of primary root growth and Fe homeostasis under Fe stress in Arabidopsis[J]. Journal of Experimental Botany, 2015, 66(7): 2041-2054 DOI:10.1093/jxb/erv005 (  0) 0) |
| [14] |
赵燕, 项华, 熊娜, 等. 亚铁胁迫对水稻生长及矿质元素积累的影响[J]. 中国稻米, 2018, 24(3): 30-38 (  0) 0) |
| [15] |
冯双华, 贾凌辉, 苏以荣. 不同浓度亚铁培养液对水稻生长发育及产量构成的影响[J]. 农业现代化研究, 1992, 13(6): 361-365 (  0) 0) |
| [16] |
张璐, 蔡泽江, 王慧颖, 等. 中国稻田土壤有效态中量和微量元素含量分布特征[J]. 农业工程学报, 2020, 36(16): 62-70 (  0) 0) |
| [17] |
朱丹妹, 刘岩, 张丽, 等. 不同类型土壤淹水对pH、Eh、Fe及有效态Cd含量的影响[J]. 农业环境科学学报, 2017, 36(8): 1508-1517 (  0) 0) |
| [18] |
Zhang L, Li G J, Wang M, et al. Excess iron stress reduces root tip zone growth through nitric oxide-mediated repression of potassium homeostasis in Arabidopsis[J]. New Phytologist, 2018, 219(1): 259-274 DOI:10.1111/nph.15157 (  0) 0) |
| [19] |
Li G J, Song H Y, Li B H, et al. Auxin Resistant1 and PIN-FORMED2 protect lateral root formation in Arabidopsis under iron stress[J]. Plant Physiology, 2015, 169(4): 2608-2623 (  0) 0) |
| [20] |
中华医学会血液学分会红细胞疾病(贫血)学组. 铁缺乏症和缺铁性贫血诊治和预防的多学科专家共识(2022年版)[J]. 中华医学杂志, 2022, 102(41): 3246-3256 (  0) 0) |
| [21] |
World Health Organization. Accelerating anaemia reduction: a comprehensive framework for action[N]. Geneva, Switzerland: World Health Organization, 2023.
(  0) 0) |
| [22] |
GBD 2021 Anaemia Collaborators. Prevalence, years lived with disability, and trends in anaemia burden by severity and cause, 1990-2021: Findings from the global burden of disease study 2021[J]. The Lancet Haematology, 2023, 10(9): e713-e734 DOI:10.1016/S2352-3026(23)00160-6 (  0) 0) |
| [23] |
Che J, Yokosho K, Yamaji N, et al. A vacuolar phytosiderophore transporter alters iron and zinc accumulation in polished rice grains[J]. Plant Physiology, 2019, 181(1): 276-288 DOI:10.1104/pp.19.00598 (  0) 0) |
| [24] |
Liu Q, Kawai T, Inukai Y, et al. A lignin-derived material improves plant nutrient bioavailability and growth through its metal chelating capacity[J]. Nature Communications, 2023, 14(1): 4866 DOI:10.1038/s41467-023-40497-2 (  0) 0) |
| [25] |
Ma J F, Shen R F, Zhao Z Q, et al. Response of rice to Al stress and identification of quantitative trait Loci for Al tolerance[J]. Plant & Cell Physiology, 2002, 43(6): 652-659 (  0) 0) |
| [26] |
陈娜, 廖敏, 张楠, 等. Fe2+对水稻生长及土壤微生物活性的影响[J]. 植物营养与肥料学报, 2014, 20(3): 651-660 (  0) 0) |
| [27] |
dos Santos M S, Sanglard L M V P, Barbosa M L, et al. Silicon nutrition mitigates the negative impacts of iron toxicity on rice photosynthesis and grain yield[J]. Ecotoxicology and Environmental Safety, 2020, 189: 110008 (  0) 0) |
| [28] |
Unoki S, Sitaresmi T, Ehara H, et al. Experiment of potassium fertilizer under iron toxicity stress of ex-situ conditions and its effect to Fe content in the grain[J]. Penelitian Pertanian Tanaman Pangan, 2020, 4(2): 81-88 (  0) 0) |
| [29] |
程金平, 刘晓刚, 于学然, 等. 水稻铁元素的研究进展[J]. 河南农业科学, 2021, 50(6): 1-8 (  0) 0) |
| [30] |
Zhang M W, Guo B J, Peng Z M. Genetic effects on Fe, Zn, Mn and P contents in Indica black pericarp rice and their genetic correlations with grain characteristics[J]. Euphytica, 2004, 135(3): 315-323 (  0) 0) |
| [31] |
曾亚文, 申时全, 汪禄祥, 等. 云南稻种矿质元素含量与形态及品质性状的关系[J]. 中国水稻科学, 2005, 19(2): 127-131 (  0) 0) |
| [32] |
王辉, 张得雯, 王瑞智, 等. 宁夏富铁水稻种质资源筛选及籽粒铁的质量分数与粒形相关性分析[J]. 西北农业学报, 2014, 23(9): 50-55 (  0) 0) |
| [33] |
陈秀晨, 王士梅, 王海娟, 等. 水稻子粒矿质元素含量遗传及主要农艺性状相关性分析[J]. 植物遗传资源学报, 2015, 16(3): 460-466 (  0) 0) |
| [34] |
Yan P S, Du Q G, Chen H, et al. Biofortification of iron content by regulating a NAC transcription factor in maize[J]. Science, 2023, 382(6675): 1159-1165 (  0) 0) |
| [35] |
陈天祥, 杨顺瑛, 苏彦华. 基于高氮投入和基因型差异的水稻氮素营养特征[J]. 土壤, 2023, 55(5): 954-963 (  0) 0) |
| [36] |
Che J, Yamaji N, Ma J F. Role of a vacuolar iron transporter OsVIT2 in the distribution of iron to rice grains[J]. New Phytologist, 2021, 230(3): 1049-1062 (  0) 0) |
| [37] |
Zhang Y, Xu Y H, Yi H Y, et al. Vacuolar membrane transporters OsVIT1 and OsVIT2 modulate iron translocation between flag leaves and seeds in rice[J]. The Plant Journal, 2012, 72(3): 400-410 (  0) 0) |
| [38] |
钟松雄, 李晓敏, 潘丹丹, 等. 水稻吸收转运铁的生物地球化学机制研究进展[J]. 土壤学报, 2023, 60(5): 1339-1349 (  0) 0) |
| [39] |
Onaga G, Edema R, Asea G. Tolerance of rice germplasm to iron toxicity stress and the relationship between tolerance, Fe2+, P and K content in the leaves and roots[J]. Archives of Agronomy and Soil Science, 2013, 59(2): 213-229 (  0) 0) |
| [40] |
Aung M S, Masuda H. How does rice defend against excess iron?: Physiological and molecular mechanisms[J]. Frontiers in Plant Science, 2020, 11: 1102 (  0) 0) |
| [41] |
Aung M S, Masuda H, Kobayashi T, et al. Physiological and transcriptomic analysis of responses to different levels of iron excess stress in various rice tissues[J]. Soil Science and Plant Nutrition, 2018, 64(3): 370-385 (  0) 0) |
| [42] |
夏越, 沈仁芳, 马建锋, 等. 苗期水稻和小麦对缺锰胁迫的响应差异及机理[J]. 土壤, 2023, 55(6): 1207-1215 (  0) 0) |
| [43] |
Wu L B, Ueda Y, Lai S K, et al. Shoot tolerance mechanisms to iron toxicity in rice (Oryza sativa L.)[J]. Plant, Cell & Environment, 2017, 40(4): 570-584 (  0) 0) |
| [44] |
Li L, Ye L X, Kong Q H, et al. A vacuolar membrane ferric-chelate reductase, OsFRO1, alleviates Fe toxicity in rice (Oryza sativa L.)[J]. Frontiers in Plant Science, 2019, 10: 700 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. State Key Laboratory of Nutrient Use and Management, Institute of Agricultural Resources and Environment, Shandong Academy of Agricultural Sciences, Jinan 250100, China
 2024, Vol. 56
2024, Vol. 56


