2. 上海市农业科学院生物技术研究所, 上海市农业遗传育种重点实验室, 上海 201106;
3. 上海市农业生物基因中心, 上海 201106
根系是植物与土壤进行物质交换的主要器官[1],也是植物生理和生态功能的基础。根系微生物类群丰富,并与植物之间存在密切的相互作用和共生关系[2],是植物微生态系统的重要组成部分。根系微生物主要包括根际微生物和根内生微生物[3],根际微生物主要生活在外界的土壤环境中,将土壤中的无机物转化为有机物,为植物生长提供养料。根系内生菌主要生活在根系内部,它主要通过产生促进植物生长的物质来调节植物的生长发育[4]。研究表明,植物的抗逆性与植物根际微生物之间有密切的关系。根际微生物分泌的代谢物具有促进植物成长、增强植物抗逆性的作用[5]。根系内生菌也会分泌一些促生、抗菌、生长素等代谢物,促进植物生长发育,提高植物对生物及非生物逆境胁迫的能力[6]。Pang等[7]对水稻17个根系内生菌和10个根际细菌的促生能力进行评价,结果表明根系微生物可以提高水稻幼苗抗氧化能力以及脯氨酸和可溶性糖含量,有效缓解干旱胁迫。Santos-Medellín等[8]研究表明干旱胁迫下水稻根系微生物的群落组成发生变化,且根系内生菌对干旱胁迫的响应更敏感。
水稻是世界上主要的粮食作物之一,更是全球一半以上人口的主要粮食,其中我国水稻产量和消费量位居世界第一[9-10]。但随着全球气候变化的不断加剧,干旱事件的频发,干旱胁迫成为导致全球作物减产的主要原因之一[11]。因此,提高水稻抵御干旱胁迫的研究越来越受到重视。目前,更多的研究主要集中在水稻的功能基因和遗传多样性上,而对敏感型水稻和耐旱型水稻根系微生物群落组成和潜在功能的差异研究却鲜有报道。
本研究以干旱敏感型籼稻和耐旱型籼稻为研究对象,采用盆栽控水模拟土壤干旱条件进行试验,在水稻苗期进行干旱胁迫处理,观察水稻植株形态,运用高通量测序技术对根际土壤细菌和根系内生细菌进行16S rRNA扩增,通过比较抗旱型水稻和干旱敏感型水稻根系相关细菌群落的多样性、组成和潜在功能,揭示不同抗旱性水稻根系相关细菌群落对干旱胁迫响应的差异,为后续有效利用微生物资源提高水稻抗旱能力进而提高农作物的产量和品质提供理论依据。
1 材料与方法 1.1 试验材料供试土壤采集于上海市农业科学院(31°13’ 18’’N,121°19’10’’E)大田,经粉碎搅拌均匀后备用。供试水稻种子由上海市农业生物基因中心提供,E000038和E000039是旱优73自交系,分别为干旱敏感型水稻和耐旱型水稻。试验灌溉用水为自来水。土壤基本理化指标如下:土壤pH 7.34,有机质含量20.9 g/kg,全氮0.63 g/kg,有效磷10 mg/kg,铵态氮4.51 mg/kg,硝态氮31.13 mg/kg,亚硝酸盐0.60 mg/kg。
1.2 试验设计采用盆栽控水模拟土壤干旱条件进行水稻干旱胁迫试验。将水稻种子用75% 酒精浸泡5 min进行杀菌处理,再用无菌水冲洗3遍,置于铺有滤纸的发芽盒中黑暗培养12 h进行催芽,发芽后将其转移至装有供试土壤的小桶(长0.17 m,宽0.17 m,高0.20 m)中进行培养。每个小桶内均分别种植E000038和E000039 (图 1),每个水稻品种均按照3行× 8株进行移栽,两个品种中间由一块聚酰胺纤维网板隔开,以保持生长环境一致而将两个品种水稻植株的根系隔开。小桶置于室外大棚,自然光照。

|
(A:正常灌溉;B:干旱胁迫) 图 1 水稻E000038和E000039盆栽试验 Fig. 1 Rice E000038 and E000039 pot experiments |
自移栽后,每隔2 d浇水1次,土壤含水量保持在100%。从移栽后4周(苗期)开始设置正常灌溉组(每隔2 d浇水1次)和干旱胁迫组(停止浇水),每个处理设置9个重复,共计18个小桶。
水稻E000038和E000039正常灌溉组根际土壤样品分别记作S38CK和S39CK,根系内生菌样品分别记作E38CK和E39CK;干旱胁迫组根际土壤样品分别记作S38D和S39D,根系内生菌样品分别记作E38D和E39D。当两种水稻表型出现显著差异时(图 1),即E000038出现叶片卷曲干枯而E000039正常生长时进行取样。
1.3 样品采集根际土壤样品采集:采集水稻植株,去除根部大块土壤,轻轻抖动根部,去掉根部松散的土壤后,用无菌镊子轻轻刮取根系表面土壤,距离根系组织2 mm以内的土壤被视为根际土壤[12]。采集的土样过筛除去杂物,同一小桶的土样等量混合均匀后,置于–20℃冰箱保存[13],用于根际土壤细菌基因组DNA提取及高通量测序。根际土壤样品每个处理3个重复。
水稻根系样品采集:采集水稻根系,用无菌水洗涤30 s,75% 乙醇洗涤1 min,2% NaOCl洗涤3 min,75% 无菌乙醇洗涤1 min,无菌水洗涤根系组织30 s。根系组织样品置于–20 ℃保存,用于根系内生细菌基因组DNA提取及高通量测序。根系组织样品每个处理5个重复。
1.4 DNA提取和高通量测序根际土壤和根系内生细菌基因组DNA提取参照Beckers等[14]研究方法进行,并委托上海美吉生物医药科技有限公司基于Illumina Miseq PE300平台,分别对32个样本的细菌16S rRNA扩增测序。细菌16S rRNA的V5 ~ V7高变区采用引物799F (5´-AACMGGATTAGATACCCKG-3′)和1193R (5´-ACGTCATCCCCACCTTCC-3´)扩增,具体测序步骤参见李玉洁等[15]。细菌原始序列提交至NCBI SRA (https://www.ncbi.nlm.nih.gov/sra/),登录号为SRP47 3855。Illumina测序得到的PE reads进行样本拆分后,根据测序质量对双端Reads进行质控和过滤,同时根据双端Reads之间的overlap关系进行拼接,获得质控拼接之后的优化数据。然后使用序列降噪方法(DADA2)处理优化数据,获得ASV (amplicon sequence variant)代表序列和丰度信息。
1.5 数据处理与统计分析首先,本研究将得到的序列按照97% 相似度对非重复序列进行ASV聚类,用于不同样品中微生物的多样性分析。α多样性指数采用SPSS 26进行单因素方差分析及多重比较,评估微生物群落中物种的丰富度和多样性。基于Bray-Curtis距离算法和相似性分析(Analysis of similarities, ANOSIM)组间差异检验进行主坐标(PCoA)分析,明确干旱对E000038和E000039根际土壤和根系内生细菌群落组成的影响。利用Python (version 2.7)软件绘制群落条形图,展示不同样本在目、属水平上的群落结构组成情况。通过R语言,采用Pearson方法计算各个物种之间的相关系数,利用Gephi软件对物种之间的相互关联性绘制相关性网络图。对水稻根际土壤细菌群落进行物种相关性网络分析时,本研究在属分类水平上选取总丰度排名前100位的物种,通过计算物种之间的Pearson相关系数,反映物种之间的相关性。本研究选取相关系数|r|≥0.6、P < 0.01的物种构建相关性网络。通过PICRUSt2软件对16S扩增子测序结果进行KEGG酶功能和代谢通路预测,获得每个样品对应的酶功能和代谢通路信息,并采取t检验分析水稻根内生细菌酶和代谢通路的差异性。
2 结果与分析 2.1 干旱胁迫对根际土壤细菌和根系内生细菌α多样性的影响α多样性是评价指定生境内物种群落多样性的指标。本研究通过在属水平对一系列α多样性指数进行评估,获得了环境群落中物种的丰富度、多样性等信息。由表 1可知,样品S38D和S39D的α多样性指数(Sobs指数、ACE指数、Chao指数、Shannon指数和Simpson指数)较样品S38CK和S39CK均无显著差异(P > 0.05)。表明干旱胁迫下水稻根际土壤(S38D和S39D)的细菌群落丰富度和多样性无显著变化。
|
|
表 1 干旱胁迫对根际土壤细菌群落α多样性的影响 Table 1 Effects of drought stress on α diversity of rhizosphere soil bacterial community |
由表 2可知,样品E38D的Sobs指数、ACE指数、Chao指数、Shannon指数显著高于样品E38CK (P < 0.05),而Simpson指数显著低于样品E38CK (P < 0.05)。样品E39D与E39CK细菌群落α多样性指数无显著差异(P > 0.05)。表明正常灌溉下水稻E000038根系内生细菌群落的丰富度和多样性低于干旱胁迫下,而干旱胁迫下与正常灌溉下水稻E000039根系内生细菌群落的丰富度和多样性无显著变化。
|
|
表 2 干旱胁迫对根系内生细菌群落α多样性的影响 Table 2 Effects of drought stress on α diversity of root endophytic bacterial community |
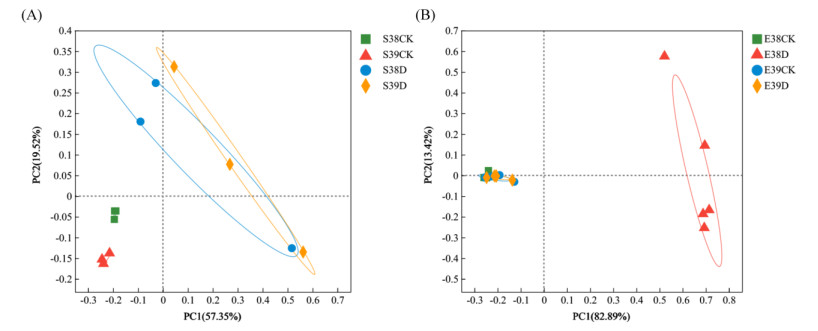
基于属水平,采用主坐标分析(PCoA)评估了水稻根际土壤细菌群落和根系内生细菌群落的相似性。水稻根际土壤细菌PCoA结果(图 2A)表明,第一和第二主坐标轴贡献率分别为57.35% 和19.52%,S38CK和S39CK分别聚为一类,干旱胁迫组S38D和S39D均与正常灌溉组S38CK、S39CK显著分离(P= 0.006,r=0.509 3),且S38D和S39D发生部分重叠。表明干旱胁迫下水稻根际土壤(S38D和S39D)细菌群落组成均产生了显著变化,且细菌群落组成相似。
|
(A:根际土壤细菌;B:根系内生细菌) 图 2 属水平上细菌群落结构主坐标分析 Fig. 2 Primary coordinate analysis of bacterial community structure at genus level |
水稻根系内生细菌PCoA结果(图 2B)表明,第一和第二主坐标轴贡献率分别是82.89% 和13.42%,E38CK、E39CK和E39D均发生重叠,并与E38D显著分离。表明正常灌溉组E38CK、E39CK与干旱胁迫组E39D细菌群落组成相似,但与E38D细菌群落组成有显著差异。说明干旱胁迫导致水稻E000038根系内生细菌群落组成发生显著改变,而水稻E000039根系内生细菌群落组成未受干旱胁迫的影响。
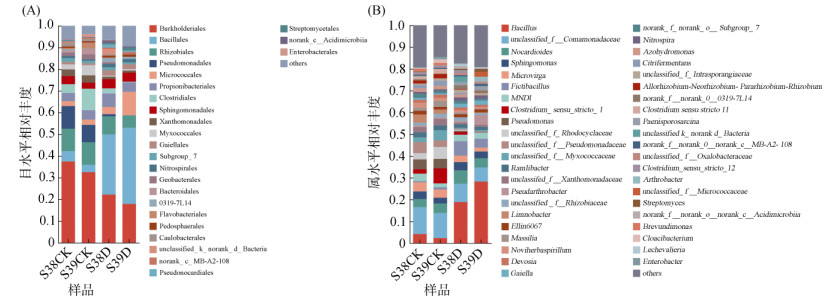
2.3 干旱胁迫对根际土壤细菌和根系内生细菌群落组成及差异的影响水稻E000038和E000039根际土壤细菌群落组成如图 3所示。在所有根际土壤样品中共检测到细菌27个门、65个纲、144个目、214个科、373属以及486个种。
|
(A:目水平;B:属水平) 图 3 水稻根际土壤细菌群落组成 Fig. 3 Bacterial community composition in rice rhizosphere soil |
在目水平上,E000038和E000039根际土壤细菌相对丰度前10位分别为伯克氏菌目(Burkholderiales),占比17.89% ~ 37.45%;芽孢杆菌目(Bacillales),占比3.35% ~ 35.08%;根瘤菌目(Rhizobiales),占比5.75% ~ 10.40%;假单胞菌目(Pseudomonadales),占比1.01% ~ 10.43%;微球菌目(Micrococcales),占比2.28% ~ 10.83%;丙酸杆菌目(Propionibacteriales),占比3.74% ~ 6.19%;梭菌目(Clostridiales),占比0.31% ~ 9.93%;鞘脂单胞菌目(Sphingomonadales),占比2.83% ~ 4.22%;黄单胞菌目(Xanthomonadales),占比1.01% ~ 3.31%;黏球菌目(Myxococcales),占比0.46% ~ 4.68%(图 3A)。伯克氏菌目在样品S38CK和S39CK中均为优势类群,相对丰度分别为37.45% 和32.54%;在干旱胁迫下芽孢杆菌为S38D和S39D样品中的优势类群,相对丰度分别为27.72% 和35.08%,与正常灌溉组相比分别增长了483.57% 和950.23%。
在属水平上,水稻根际土壤细菌相对丰度较高的细菌属主要为芽孢杆菌属(Bacillus),占比2.33% ~ 28.26%;unclassified_f__Comamonadaceae,占比6.45% ~ 12.31%;类诺卡氏属(Nocarioides),占比3.74% ~ 6.19%;鞘氨醇单胞菌属(Sphingomonas),占比2.64% ~ 3.74%;微枝形杆菌属(Microvirga),占比1.77% ~ 4.17%;假芽胞杆菌(Fictibacillus),占比0.58% ~ 6.65%;MND1,占比1.78% ~ 3.41%;梭菌属(Clostridium_sensu_ stricto_1),占比0.22% ~ 6.86%;假单胞菌属(Pseudomonas),占比0.50% ~ 4.55% (图 3B)。正常灌溉组样品S38CK和S39CK的优势菌群为unclassified_f__Comamonadaceae,相对丰度分别为12.32% 和11.51%;干旱胁迫组中芽孢杆菌属为S38D和S39D样品中的优势类群,相对丰度分别为18.85% 和28.26%,与正常灌溉组相比分别增长了352.04% 和1112.88%。
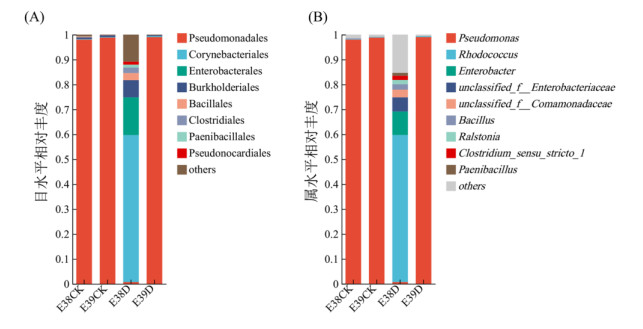
E000038和E000039根系内生细菌群落组成如图 4所示。在所有根系组织样品中共检测到根系内生细菌9个门、16个纲、42个目、65个科、86个属以及91个种。
|
(A:目水平;B:属水平) 图 4 水稻根系内生细菌群落组成 Fig. 4 Community composition of endophytic bacteria in rice roots |
在目水平上,水稻根内生细菌相对丰度较高的细菌目主要为假单胞菌目(Pseudomonadales),占比0.70% ~ 99.00%;棒杆菌目(Corynebacteriales),占比0.12% ~ 59.00%;肠杆菌目(Enterobacterales),占比15.12%;伯克氏菌目(Burkholderiales),占比0.40% ~ 6.87%;芽孢杆菌目(Bacillales),占比0.1% ~ 2.89% (图 4A)。正常灌溉组E38CK和E39CK样品中的优势菌群均为假单胞菌目,相对丰度分别高达98.00% 和98.80% 干旱胁迫组E38D样品的主要优势菌群为棒杆菌目和肠杆菌目,相对丰度分别为59.00% 和15.12%,而假单胞菌目的相对丰度仅为0.70%;E39D样品的细菌群落结构未发生变化,优势菌群仍为假单胞菌目,相对丰度为99.00%。
在属水平上,水稻根内生细菌相对丰度较高的细菌属主要为假单胞菌属(Pseudomonas),占比0.70% ~ 99.00%;红球菌属(Rhodococcus),占比0.20% ~ 59.00%;肠杆菌属(Enterobacter),占比9.45%;unclassified_f__Enterobacteriaceae,占比5.67%;unclassified_f__Comamonadaceae,占比3.08%;芽孢杆菌属(Bacillus),占比0.01% ~ 2.19%;罗尔斯通氏菌属(Ralstonia)占比1.69%;梭菌属(Clostridium_sensu_stricto_1),占比1.69% (图 4B)。正常灌溉组E38CK和E39CK样品中的优势菌群均为假单胞菌属,相对丰度分别高达98.00% 和98.88%。干旱胁迫组样品E38D的主要优势菌群为红球菌属,相对丰度为59.00%,而假单胞菌属的相对丰度仅为0.70%;样品E39D的细菌群落结构未发生变化,优势菌群仍为假单胞菌属,相对丰度为99.00%。
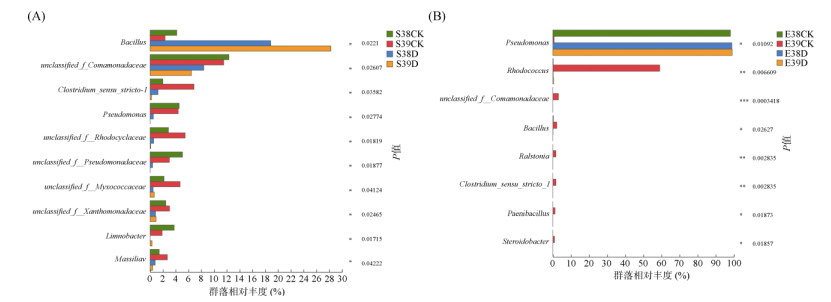
基于属水平,采用Kruskal-Wallis秩和检验的方法,对E000038和E000039的根际土壤细菌(图 5A)与根系内生细菌(图 5B)群落进行物种差异分析。在根际土壤中,与正常灌溉组S38CK和S39CK样品相比,干旱胁迫组S38D和S39D样品的芽孢杆菌属相对丰度显著上升(P < 0.05),unclassified_f__Comamonadaceae、假单胞菌属、unclassified_f__Rhodocyclaceae、unclassified_f__Pseudomonadaceae、unclassified_f__Myxococcaceae、unclassified_f__Xanthomonadaceae、溶杆菌属和马赛菌属的相对丰度显著下降(P < 0.05)。其中,样品S39CK中梭菌属的相对丰度显著高于样品S38CK、S38D和S39D(P < 0.05)。根际土壤细菌物种差异分析结果表明,芽孢杆菌属积极参与了水稻抵御干旱胁迫的响应。
|
(A:根际土壤细菌;B:根系内生细菌;星号表示不同样品间的细菌群落相对丰度具有显著性差异,*为P < 0.05,**为P < 0.01,***为P < 0.001) 图 5 组间差异的显著性检验 Fig. 5 Significance test of differences between groups |
根系组织中,样品E38CK、E39CK和E39D的假单胞菌属相对丰度显著高于样品E38D(P < 0.05),而样品E38D的红球菌属、unclassified_f__Comamonadaceae、芽孢杆菌属、罗尔斯通氏菌属、梭菌属、类芽孢杆菌属和黄色类固醇杆菌属相对丰度显著高于样品E38CK、E39CK和E39D(P < 0.05)。且样品E38CK、E39CK和E39D细菌群落中的物种丰度无显著差异(P < 0.05)。表明水稻E000038和E000039抗旱性的差异可能与假单胞菌属能否定殖于根系组织相关。
2.4 干旱胁迫对水稻根际土壤细菌关联网络的影响为进一步探究干旱胁迫对水稻根际土壤细菌群落关联网络的影响,揭示细菌之间的互作模式,利用属水平数据构建干旱胁迫前后水稻根际土壤细菌共现网络关系图(图 6),并计算相关的拓扑性质(表 3)。将节点按照模块化分组并以不同颜色填充区分。由于根系内生细菌种类较少,不同物种之间相互作用太弱或不存在,无法构建关联网络,因而本研究仅对水稻E000038和E000039的根际土壤细菌群落的关联网络进行分析。
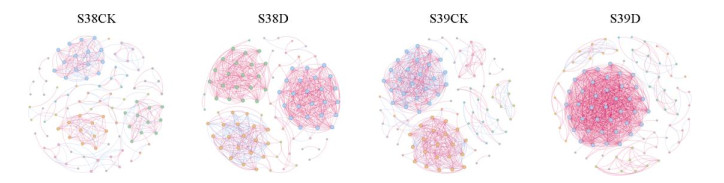
|
图 6 水稻根际土壤细菌共现网络分析 Fig. 6 Co-occurrence network analysis of bacterial in rice rhizosphere soil |
|
|
表 3 水稻根际土壤细菌群落共现网络分析拓扑结构特征 Table 3 Topological structure characteristics of bacterial community co-occurrence network analysis in rice rhizosphere soil |
正常灌溉组与干旱胁迫组根际土壤细菌群落网络拓扑特征有明显差异。相比于样品S38CK和S39CK,样品S38D和S39D中细菌共生网络总节点数无明显变化,平均路径长度、负相关性和模块化系数占比均有不同程度的降低,边数、平均连通度和正相关性均有不同程度的升高。总边数越多,网络越复杂;平均路径长度越低,网络越紧密[16]。说明干旱胁迫使水稻根际土壤细菌网络变得更加紧密。
2.5 干旱胁迫对水稻根系内生细菌潜在功能的影响基于PICRUSt2对干旱胁迫前后水稻根系内生细菌进行KEGG酶功能预测分析。结果表明,样品E38CK与E38D中参与水稻干旱胁迫的细菌功能基因编码的酶共有2 052个,样品E38D与E39D中参与水稻干旱胁的细菌功能基因编码的酶共有2 048个。采用t检验分析相对丰度前50个酶的差异性,样品E38CK与E38D中共有31个酶发生显著变化。相对于样品E38CK,样品E38D有17个酶相对丰度显著降低,14个酶相对丰度显著提高(图 7A);相对于样品E38D,样品E39D有18个酶相对丰度显著提高,16个酶相对丰度显著降低(图 7B)。样品E38D中谷胱甘肽转移酶(EC2.5.1.18)、谷氨酰胺合成酶(EC6.3.1.2)、肽基脯氨酰异构酶(EC5.2.1.8)和甘油-3-磷酸-磷酸酰基转移酶(EC2.3.1.15)等的丰度显著低于样品E38CK和E39D,但样品E39CK与E39D中的细菌酶丰度未发生显著变化。
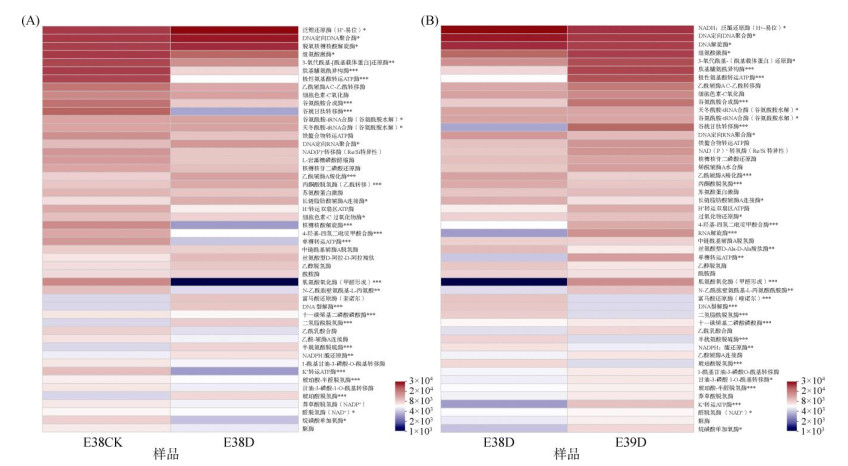
|
(A:E000038根系内生细菌;B:干旱胁迫组根系内生细菌。星号表示两个样本的细菌功能基因编码酶的相对丰度具有显著变化,* 为P < 0.05,**为P < 0.01,***为P < 0.001;图A中的蓝色星号表示样品E38D中相对于样品E38CK中显著降低,红色星号表示样品E38D中相对于样品E38CK中显著升高;图B中的蓝色星号表示样品E39D中相对于样品E38D中显著降低,红色星号表示样品E39D中相对于样品E38D中显著升高。下同) 图 7 根系内生细菌功能基因编码酶的相对丰度热图 Fig. 7 Heatmap of relative abundance of enzymes encoded by functional genes of endophytic bacteria in roots |
基于PICRUSt2对干旱胁迫前后水稻根系内生细菌进行KEGG代谢通路分析。结果表明,共有382条代谢通路参与了水稻根系内生细菌的代谢过程,采用t检验分别对样品E38CK和E38D中(图 8A)以及样品E38D和E39D中(图 8B)相对丰度前46条代谢通路进行差异性分析。样品E38CK和E38D中的KEGG pathway 3共有35条代谢通路发生显著变化。相对于样品E38CK,样品E38D中甲烷代谢、氨基酰基tRNA生物合成、三羧酸循环、丁酸代谢、糖酵解和氧化磷酸化代谢通路显著增加,烟酸盐代谢、烟酰胺代谢和生物膜的形成等29条代谢通路显著降低。样品E38D和E39D中的KEGG pathway3共有36条代谢通路发生显著变化。与样品E38D相比较,样品E39D中根系内生细菌参与碳氮代谢以及能量转化的代谢途径差异显著,例如甲烷代谢、肽聚糖生物合成、脂肪酸生物合成、三羧酸循环、氨基酸和核苷酸糖的代谢、氨基酰基tRNA生物合成、丁酸代谢、糖酵解和氧化磷酸化代谢通路显著低于样品E38D,生物膜的形成、烟酸盐和烟酰胺的代谢等27条代谢途径显著高于样品E38D。在干旱胁迫下,样品E39CK和E39D中的代谢途径未发生显著变化。
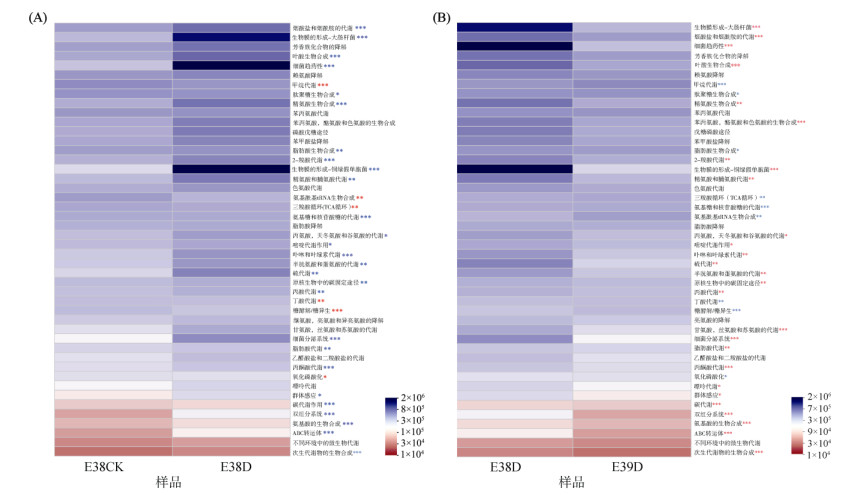
|
图 8 根系内生细菌差异代谢通路的相对丰度热图 Fig. 8 Heatmap of relative abundance of differential metabolic pathways of endophytic bacteria in roots |
本研究结果表明,敏感型水稻E000038和耐旱型水稻E000039根际土壤细菌群落α多样性指数在干旱胁迫下未发生显著变化。但主坐标分析(PCoA)表明,水稻E000038和E000039根际土壤细菌群落组成在干旱胁迫下与正常灌溉下存在差异。进一步通过细菌群落结构组成和物种差异分析发现,干旱胁迫显著影响了水稻E000038和E000039根际土壤细菌群落的结构组成。水稻根际土壤细菌群落结构的变化,可能是水稻–根际土壤细菌群落对干旱胁迫做出的积极响应。
植物本身会通过调节一系列生理生化反应来适应干旱胁迫,植物微生物群落也能够通过调节植物的渗透调节物质、抗氧化系统、干旱相关基因、生理指标和激素平衡等方面协助植物应对干旱胁迫,避免植物组织遭受氧毒害和渗透失衡,从而缓解干旱胁迫对植物的伤害[17-18]。本研究中,相比于正常灌溉组,干旱胁迫组S38D和S39D样品中芽孢杆菌属均显著增加,并为主要优势菌属。干旱胁迫组中芽孢杆菌属相对丰度上升可能与根际土壤细菌响应水稻干旱胁迫相关。同时有大量研究发现,芽孢杆菌属可以协助植物抵御干旱胁迫。如,解淀粉芽孢杆菌FZB42能够减轻拟南芥组织细胞脂质过氧化,有助于保持干旱胁迫下拟南芥幼苗叶片中细胞膜的完整性,同时使得拟南芥在干旱条件下增加气孔孔径,有利于拟南芥在干旱条件下的生长[19]。Woo等[20]发现干旱胁迫下接种枯草芽孢杆菌菌株GOT9提高了拟南芥的存活率,并在拟南芥的干旱胁迫耐受性中发挥积极作用。Ngumbi和Kloepper[21]发现,芽孢杆菌属的定殖会协助受到干旱胁迫的植物增加其渗透物脯氨酸的细胞含量和抗氧化酶的活性能力,且减少细胞丙二醛的产生。由此推测,水稻根际土壤中的芽孢杆菌属在水稻应对干旱胁迫中发挥着重要作用。
同时本研究通过共现关联网络分析发现,干旱胁迫使S38D和S39D样品中的细菌群落之间的关系变得更加紧密。研究发现,平均路径长度越短,细菌之间相互响应速度越快[22],平均连通度越大,细菌对外界变化的敏感程度越高[23]。说明干旱胁迫使S38D和S39D样品中细菌生态网络迅速受到影响,抵抗外界干扰能力降低,且网络结构稳定性变弱。
3.2 干旱胁迫对水稻根系内生细菌群落的影响通过根系内生细菌α多样性分析发现,干旱胁迫使水稻E000038的Sobs指数、ACE指数、Chao指数和Shannon指数显著升高,与吉泽等[24]研究结果一致。而水稻E000039的α多样性在干旱胁迫下与正常灌溉下无显著差异。主坐标分析(PCoA)表明,干旱胁迫使敏感型水稻E000038根系内生细菌群落的组成发生了显著改变,但耐旱型水稻E000039的根系内生细菌在正常灌溉和干旱胁迫下群落组成相似。结合细菌群落结构组成和物种差异分析,发现正常灌溉下水稻E000038、E000039和干旱胁迫下水稻E000039的根系内生细菌群落结构组成相似,且物种相对丰度无显著差异,其中优势菌群都为假单胞菌属,相对丰度占比均在98% 以上;而干旱胁迫下水稻E000038的红球菌属、芽孢杆菌属、罗尔斯通氏菌属等细菌群落相对丰度显著高于正常灌溉组,这可能是使水稻E000038在干旱胁迫下α多样性指数显著升高的原因,以及导致水稻E000038和E000039抗旱性差异的原因。
已有研究表明,假单胞菌属的定殖可以协助植物抵御干旱胁迫[25]。Yang等[19]发现在干旱胁迫下接种假单胞菌提高了豌豆植株的抗逆性。Tanveer等[26]发现接种恶臭假单胞菌可以提高脯氨酸、可溶性糖、蛋白质等保护剂的含量,从而帮助甘蓝型油菜缓解干旱胁迫,并提高产量。结合本研究结果,可以推测,干旱胁迫下敏感型水稻E000038根系组织微生境不再适合假单胞菌属的定殖生长,导致假单胞菌属被其他菌群竞争替代,而重新组建的根系内生细菌群落并不能通过与水稻互作来提高其抗旱性,由此导致敏感型水稻E000038叶片在干旱胁迫后出现明显卷曲和干枯的现象;而耐旱型水稻E000039在干旱胁迫后,其根系组织微生境仍然适合假单胞菌属的定殖生长,从而协助耐旱型水稻E000039抵御干旱胁迫。
结合干旱胁迫下根际土壤细菌群落多样性分析发现,相比于根际土壤细菌,水稻根系内生细菌在应对干旱胁迫时更为敏感,因而植物根系内生细菌可为提高水稻抗旱能力提供有效微生物资源。
3.3 干旱胁迫下水稻根系内生细菌潜在功能差异根据KEGG酶功能和代谢通路预测发现,干旱胁迫下水稻E000039根系内生细菌中与提高水稻抗旱性相关的酶丰度显著高于水稻E000038,主要有谷胱甘肽转移酶、谷氨酰胺合成酶和肽基脯氨酰异构酶和甘油-3-磷酸-磷酸酰基转移酶。其中,谷胱甘肽转移酶和谷氨酰胺合成酶都属于谷胱甘肽S-转移酶家族,谷胱甘肽S-转移酶家族通过保护植物免受氧化损伤,在植物的逆境耐受性中发挥关键作用[27]。同时,植物受到干旱胁迫后会通过产生脯氨酸、可溶性糖和淀粉等渗透保护剂,调节植物的生理过程,稳定酶和细胞膜的完整性[28]。而脯氨酰异构酶可将肽键的顺式和反式异构体与脯氨酸相互转化。甘油-3-磷酸-磷酸酰基转移酶控制着生物体内甘油三酯合成的初始反应,是油脂合成的关键限速酶[29],在各类组织中促进甘油酯类的生物膜合成。Wang等[30]研究表明,甘油-3-磷酸-磷酸酰基转移酶基因家族在种子发育、植物逆境耐受性的产生中发挥重要作用。由此推测,干旱胁迫下,水稻E000039根系内生细菌中与抵御干旱胁迫相关的酶被及时激活并且丰度提高,同时提高了碳代谢等相关代谢通路,进而提高了其抗旱性;而水稻E000038根系内生细菌中的相关酶和代谢通路未积极响应干旱胁迫,使水稻E000038受到干旱胁迫的损伤,导致叶片卷曲枯萎。
4 结论1) 不同抗旱性水稻E000038和E000039在苗期受到干旱胁迫,根际土壤细菌群落α多样性指数均未发生显著变化。但与正常灌溉组相比,干旱胁迫下两种水稻的根际土壤细菌群落结构和组成均发生了显著变化,在属水平上,都富集芽孢杆菌属,减少了假单胞菌属、溶杆菌属和马赛菌属。此外,水稻E000038和E000039干旱胁迫组的土壤根际细菌群落之间的相关网络关系比正常灌溉组更加紧密。
2) 苗期进行干旱胁迫,使水稻E000038根系内生细菌群落的α多样性指数显著上升,而水稻E000039的根系内生细菌α多样性指数无显著变化;显著改变了水稻E000038的根系内生细菌群落组成和结构,但水稻E000039的根系内生细菌群落组成和结构未受到影响。其中水稻E000039正常灌溉组和干旱胁迫组的根系内生细菌优势菌群均为假单胞菌属,而水稻E000038正常灌溉组的根系内生细菌的优势菌属为假单胞菌属,而干旱胁迫组假单胞菌属的生态位被红球菌属、肠杆菌属和芽孢杆菌属等取代,红球菌属成为主要优势菌属。干旱胁迫下,水稻E000038根系内生细菌中具有潜在抗旱功能酶和相关代谢通路的丰度显著低于水稻E000039。
致谢: 上海市农业生物基因中心罗利军研究员对试验材料的研究背景及分析方法进行了指导, 特此致谢。
| [1] |
李雪, 李春培, 李永梅, 等. 典型植物根系对紫色土化学属性和化学蚀变指数的影响[J]. 土壤, 2024, 56(2): 425-432 (  0) 0) |
| [2] |
吕柏辰, 孙海, 钱佳奇, 等. 药用植物根系分泌物与根际微生物相互作用及其在中药材生态种植中的应用[J]. 中国中药杂志, 2024, 49(8): 2128-2137 (  0) 0) |
| [3] |
刘洋. 西北地区甘草根系微生物群落及其功能特性的研究[D]. 杨凌: 西北农林科技大学, 2022.
(  0) 0) |
| [4] |
Hou S J, Thiergart T, Vannier N, et al. A microbiota-root-shoot circuit favours Arabidopsis growth over defence under suboptimal light[J]. Nature Plants, 2021, 7(8): 1078-1092 DOI:10.1038/s41477-021-00956-4 (  0) 0) |
| [5] |
徐春燕, 王涛, 徐婷, 等. 一株耐旱细菌的分离、筛选与鉴定[J]. 干旱区资源与环境, 2019, 33(4): 117-123 (  0) 0) |
| [6] |
康慧颖, 王伟, 刘佳莉, 等. 两株具促生作用的苜蓿内生菌的分离纯化与鉴定[J]. 微生物学通报, 2015, 42(2): 280-288 (  0) 0) |
| [7] |
Pang Z Q, Zhao Y, Xu P, et al. Microbial diversity of upland rice roots and their influence on rice growth and drought tolerance[J]. Microorganisms, 2020, 8(9): 1329 DOI:10.3390/microorganisms8091329 (  0) 0) |
| [8] |
Santos-Medellín C, Edwards J, Liechty Z, et al. Drought stress results in a compartment-specific restructuring of the rice root-associated microbiomes[J]. mBio, 2017, 8(4): e00764-e00717 (  0) 0) |
| [9] |
祝海竣, 唐舟, 石爱龙, 等. 灌溉模式和有机肥配施对水稻产量、光合特性和氮肥利用率的影响[J]. 土壤, 2022, 54(4): 700-707 (  0) 0) |
| [10] |
Shafi S, Shafi I, Zaffar A, et al. The resilience of rice under water stress will be driven by better roots: Evidence from root phenotyping, physiological, and yield experiments[J]. Plant Stress, 2023, 10: 100211 DOI:10.1016/j.stress.2023.100211 (  0) 0) |
| [11] |
Lesk C, Rowhani P, Ramankutty N. Influence of extreme weather disasters on global crop production[J]. Nature, 2016, 529(7584): 84-87 DOI:10.1038/nature16467 (  0) 0) |
| [12] |
DeAngelis K M, Brodie E L, DeSantis T Z, et al. Selective progressive response of soil microbial community to wild oat roots[J]. The ISME Journal, 2009, 3(2): 168-178 DOI:10.1038/ismej.2008.103 (  0) 0) |
| [13] |
Li P, Xue Y, Shi J L, et al. The response of dominant and rare taxa for fungal diversity within different root environments to the cultivation of Bt and conventional cotton varieties[J]. Microbiome, 2018, 6(1): 184 DOI:10.1186/s40168-018-0570-9 (  0) 0) |
| [14] |
Beckers B, De Beeck M O, Weyens N, et al. Structural variability and niche differentiation in the rhizosphere and endosphere bacterial microbiome of field-grown poplar trees[J]. Microbiome, 2017, 5(1): 25 DOI:10.1186/s40168-017-0241-2 (  0) 0) |
| [15] |
李玉洁, 葛蕾, 胡聪, 等. 土壤真菌群落和潜在功能对施加外源Bt毒素的响应[J/OL]. 土壤学报, 2023: 1–15. (2023-03-30). https://kns.cnki.net/kcms/detail/32.1119.P.20230329.1524.004.html.
(  0) 0) |
| [16] |
张颂安, 刘轩, 赵珮杉, 等. 呼伦贝尔沙地樟子松人工林土壤细菌网络特征[J]. 干旱区研究, 2023, 40(6): 905-915 (  0) 0) |
| [17] |
Cavicchioli R, Ripple W J, Timmis K N, et al. Scientists' warning to humanity: Microorganisms and climate change[J]. Nature Reviews Microbiology, 2019, 17(9): 569-586 DOI:10.1038/s41579-019-0222-5 (  0) 0) |
| [18] |
曹凯, 李远婷, 安登第, 等. 内生菌对植物抗干旱胁迫能力的影响研究进展[J]. 生物技术通报, 2015, 31(9): 23-29 (  0) 0) |
| [19] |
Yang L H, Schröder P, Vestergaard G, et al. Response of barley plants to drought might be associated with the recruiting of soil-borne endophytes[J]. Microorganisms, 2020, 8(9): 1414 DOI:10.3390/microorganisms8091414 (  0) 0) |
| [20] |
Woo O G, Kim H, Kim J S, et al. Bacillus subtilis strain GOT9 confers enhanced tolerance to drought and salt stresses in Arabidopsis thaliana and Brassica campestris[J]. Plant Physiology and Biochemistry, 2020, 148: 359-367 DOI:10.1016/j.plaphy.2020.01.032 (  0) 0) |
| [21] |
Ngumbi E, Kloepper J. Bacterial-mediated drought tolerance: Current and future prospects[J]. Applied Soil Ecology, 2016, 105: 109-125 DOI:10.1016/j.apsoil.2016.04.009 (  0) 0) |
| [22] |
李前, 李忠武, 聂小东, 等. 水土流失防治措施对马尾松林土壤微生物群落分子生态网络的影响[J]. 土壤学报, 2022, 59(3): 819-832 (  0) 0) |
| [23] |
李冰, 李玉双, 魏建兵, 等. 不同土地利用方式对土壤细菌分子生态网络的影响[J]. 环境科学, 2020, 41(3): 1456-1465 (  0) 0) |
| [24] |
吉泽, 肖关丽, 陈斌, 等. 干旱胁迫对马铃薯叶片内生细菌组成和结构的影响[J]. 华中农业大学学报, 2024, 43(1): 79-88 (  0) 0) |
| [25] |
Zhao X W, Yuan X M, Xing Y J, et al. A meta-analysis on morphological, physiological and biochemical responses of plants with PGPR inoculation under drought stress[J]. Plant, Cell & Environment, 2023, 46(1): 199-214 (  0) 0) |
| [26] |
Tanveer S, Akhtar N, Ilyas N, et al. Interactive effects of Pseudomonas putida and salicylic acid for mitigating drought tolerance in canola (Brassica napus L.)[J]. Heliyon, 2023, 9(3): e14193 DOI:10.1016/j.heliyon.2023.e14193 (  0) 0) |
| [27] |
Choudhury S, Panda P, Sahoo L, et al. Reactive oxygen species signaling in plants under abiotic stress[J]. Plant Signaling & Behavior, 2013, 8(4): e23681 (  0) 0) |
| [28] |
Urmi T A, Islam M M, Zumur K N, et al. Combined effect of salicylic acid and proline mitigates drought stress in rice (Oryza sativa L.) through the modulation of physiological attributes and antioxidant enzymes[J]. Antioxidants, 2023, 12(7): 1438 DOI:10.3390/antiox12071438 (  0) 0) |
| [29] |
高凯, 刘佳伟, 许多, 等. 水稻甘油-3-磷酸酰基转移酶基因(GPATs)家族的生信分析[J/OL]. 分子植物育种, 2023: 1–15. (2023-03-10). https://kns.cnki.net/kcms/detail/46.1068.s.20230309.1756.010.html.
(  0) 0) |
| [30] |
Wang J X, Singh S K, Geng S Y, et al. Genome-wide analysis of glycerol-3-phosphate O-acyltransferase gene family and functional characterization of two cutin group GPATs in Brassica napus[J]. Planta, 2020, 251(4): 93 (  0) 0) |
2. Shanghai Key Laboratory of Agricultural Genetics and Breeding, Biotechnology Research Institute, Shanghai Academy of Agricultural Sciences, Shanghai 201106, China;
3. Shanghai Agricultural Biological Gene Center, Shanghai 201106, China
 2024, Vol. 56
2024, Vol. 56


