2. 中国科学院大学, 北京 100049;
3. 黑土地保护与利用重点实验室(中国科学院东北地理与农业生态研究所), 长春 130102
农业氨(NH3)挥发贡献了全球NH3排放量的81% 以上,其中全球约24% 的NH3来自稻田[1]。稻田氮肥每年平均施氮量超过300 kg/hm2,其中超过50% 的氮通过多种途径流失到环境[2]。NH3挥发是稻田氮素损失的主要途径,约占施氮量的10% ~ 38%[3]。NH3挥发不仅增加生产成本,还会造成环境恶化。NH3作为大气中唯一碱性气体,能够与大气中的酸性气体结合,产生的二次无机气溶胶是PM2.5的主要成分,导致空气质量变差,对人体健康产生不利影响[4]。排放的NH3还可以通过沉降作用返回陆地和地表水,导致土壤和水体酸化、富营养化,从而威胁生物多样性[5]。因此,通过改善稻田氮肥管理措施来减少NH3挥发,提高氮肥利用率,对减轻氮的环境危害至关重要。
施用化学氮肥会在短时间内快速释放形成高浓度的NH4+-N,大大加剧NH3的挥发速率。固氮蓝细菌被发现既能利用大气中的氮气作为其氮源,又能同化环境中无机氮,对提高或维持水稻产量和减少氮肥施用均具有一定作用[6-7]。Zhang等[8]研究发现使用固氮鱼腥藻Anabaena azotica (FACHB-119)代替30% 化肥施用量能够提高或维持水稻产量。在稻田中接种小单歧藻Tolypothrix tenuis同样对提高水稻植株产量有较好的效果[9]。这主要有3个方面原因:①固氮蓝细菌死亡分解后储存在身体的氮、磷返回土壤,为水稻提供养分;②固氮蓝细菌在生长过程中会分泌多糖[10]和肽[11]等胞外化合物有助于土壤有机碳的增加[12-13];③固氮蓝细菌能够分泌生长素、赤霉素和细胞分裂素等植物促生激素,促进水稻根系生长[14],发达的根系有助于水稻从土壤中吸收水分和养分,进而促进水稻生长,增加产量。稻田蓝细菌品种很多,但不同蓝细菌的固氮能力不同[15]。稻田生物固氮主要发生在0 ~ 1 cm表层,并且发现念珠藻是稻田生物固氮的主要贡献者[16]。王慧等[17]研究结果表明接种念珠藻Aliinostoc sp. d389-10能显著提高土壤固氮酶活性和增加水稻产量。但施用念珠藻Aliinostoc sp. d389-10对稻田NH3挥发及氮肥利用率的影响,尤其在不同氮肥施用水平下的研究还相对缺乏。
本文以吉林黑土发育水稻土为对象,利用盆栽试验,研究了施用固氮蓝细菌Aliinostoc sp. d389-10对不同施氮水平下稻季NH3排放通量和氮肥利用率的影响,为固氮蓝细菌Aliinostoc sp. d389-10的合理应用和减少稻田生态系统活性氮损失提供科学依据。
1 材料与方法 1.1 供试材料供试土壤采自吉林省长春市宽城区米沙子镇广富村孙吉李屯(44°11’N,125°28’E),土壤基本性质:有机质17.18 g/kg、全氮1.06 g/kg、全磷0.56 g/kg、全钾7.00 g/kg、碱解氮86.33 mg/kg。供试固氮蓝细菌为固氮念珠藻 Aliinostoc sp. d389-10[17],首先在培养箱内利用无氮培养基培养,再接种到无氮培养液中进行大规模培养。无氮培养液为:K2HPO4 0.04 g/L,MgSO4·7H2O 0.075 g/L,CaCl2·2H2O 0.036 g/L,柠檬酸0.006 g/L,柠檬酸铁铵0.006 g/L,EDTANa2 0.001 g/L,Na2CO3 0.02 g/L,A5微量元素混合液1 mL,pH 7.1。A5微量元素混合液:H3BO3 2.86 g/L,MnCl2·4H2O 1.81 g/L,ZnSO4·7H2O 0.222 g/L,Na2MoO4·2H2O 0.39 g/L,CuSO4·5H2O 0.079 g/L,CO(NO3)2·6H2O 0.0494 g/L。水稻品种为盐粳15号。
1.2 试验设计盆栽试验于2023年6—10月在江苏省扬州市小纪镇宗村村进行,试验期间气温为11 ~ 35 ℃。试验设5个处理:不施氮肥(0N)、70% 施氮量(0.315 g/盆,计105 kg/hm2;0.7N)、全量施氮(0.45 g/盆,计150 kg/hm2;1N)、70% 施氮量配施高温灭活固氮蓝细菌(0.7NDB)、70% 施氮量配施新鲜固氮蓝细菌(0.7NB),每个处理3个重复。试验用PVC盆,长20 cm,宽15 cm,高20 cm(内径),且底部设有排水孔。在装土之前先用保温板将盆底部和侧面包裹,并在底部按照一层30目尼龙滤网、一层1 cm厚的石英砂、一层30目尼龙滤网的顺序铺设3层。剔除石块和根系后每盆装土4.95 kg(烘干基),装土容重1.1 g/cm3,装土15 cm高。为了确保土体紧实度一致,每次装5 cm,分3次装。在无氮培养液中收获100 g新鲜固氮蓝细菌,脱水后在70 ℃下烘干至恒重,测得新鲜固氮蓝细菌的含水量为83.77% ~ 86.76%。新鲜固氮蓝细菌脱水后施加到土壤表面,其施用量为2.17 g/盆(施用蓝细菌含氮量相当于N 7.5 kg/hm2)。高温灭活固氮蓝细菌即新鲜固氮蓝细菌脱水后(2.17 g/盆)放在高温灭菌锅中121 ℃灭菌2 h再施加到土壤表面。氮肥以尿素的形式按3∶4∶3的比例在基肥期、分蘖期和拔节抽穗期施用,磷肥(以P2O5计)和钾肥(以K2O计)施用量为75 kg/hm2,分别以Na2HPO4和KCl的形式在基肥期一次性施入。2023年6月21日每盆种植1穴水稻,移栽长势大致一致的秧苗2株,移栽后将氮肥溶于去离子水中,均匀喷洒到土壤中,随后将固氮蓝细菌均匀撒施到土壤表面,在7月2日追施分蘖肥,8月3日追施穗肥。水分管理为淹水–烤田–淹水–排水。于10月17日收获。
1.3 样品采集与测定NH3挥发量采用海绵法测定[18-19]。试验开始前,配制磷酸–丙三醇混合液,即取50 mL磷酸和40 mL丙三醇用蒸馏水定容到1 000 mL,取15 mL混合液将海绵(直径8 cm,厚度2 cm)浸湿。试验开始时,将已浸湿的海绵放入去底塑料瓶中,下端插入土壤中,拧松瓶盖,记录时间,第二天移出海绵。取回的海绵立即用2 mol/L的KCl溶液浸提,用靛酚蓝比色法测定NH4+-N浓度[20]。在施肥后的第1、2、3、5、7、10、14天进行持续采样,直至海绵中NH4+-N的浓度不再变化。
水稻成熟后脱粒,将籽粒、秸秆和根分开收集,105 ℃杀青30 min后,65 ℃烘干至恒重,记录不同部位干物质量。随后将样品粉碎、过100目筛,用H2SO4–H2O2–蒸馏法测植株各部位含氮量[20]。
在基肥、分蘖肥和穗肥施用后的第7天及收获当天,用五点取样法采集土壤样品,带回实验室,用2 mol/L KCl浸提–靛酚蓝比色法立即测定土壤NH4+-N、NO3--N含量。待土壤风干后过100目筛,用凯氏定氮法测定土壤全氮(TN)含量,用重铬酸钾外加热法测定土壤有机质(OM)含量[20]。
1.4 计算公式与数据分析土壤NH3挥发通量(kg/(hm2·d))计算公式:
| $\mathrm{NH}_3-N_{\text {挥发量 }}=C \times V \times \mathrm{ts} \times 10000 /\left(T \times A \times 10^6\right)$ | (1) |
式中:C为比色法测定的NH4+-N的浓度(mg/L);V为显色液体积(L);T为累计时间(d);A为塑料瓶的横截面积(m2);ts为分取倍数。
土壤NH3累积挥发通量(kg/hm2)计算公式如下,两次NH3挥发中间未测日期用前后两天平均值代替。
| $ \mathrm{NH}_3-N_{\text {累积 }}=\sum \mathrm{NH}_3-N_{\text {挥发量 }}$ | (2) |
| $ \text { 吸氮量 }(\mathrm{mg} /\text { 盆 })=\text { 某器官干物质量 } \times \text { 某器官含氮量 }$ | (3) |
| $ \;\;\;\;\;\;\text { 氮肥表观利用率 }(\%)=(\text { 施氮处理植株吸氮量-未 }\\\text { 施氮处理植株吸氮量 }) /\text { 施氮量 } \times 100 $ | (4) |
| $ \;\;\;\;\;\;\text { 氮肥农学利用率 }(\mathrm{g} /\mathrm{g})=(\text { 施氮区水稻籽粒产量-氮 }\\\text { 空白区水稻籽粒产量)/施氮量 } $ | (5) |
试验数据采用SPSS 27进行统计分析,采用Origin 2018作图,利用单因素方差分析(ANVOA)进行显著性检验。
2 结果与分析 2.1 水稻产量与产量构成对水稻产量构成进行分析发现(表 1),随着氮肥施用量的增加,每盆穗数显著增加(P < 0.05)。0.7NB处理穗数显著高于0.7N和0.7NDB处理,与1N处理相比无显著差异;0.7NDB处理穗数显著低于1N处理,显著高于0N处理,但与0.7N处理无显著差异。千粒重随着施氮量的增加显著降低。0.7NB处理的千粒重与0N、0.7N处理相比无明显差异,显著高于1N处理,却显著低于0.7NDB处理。与0.7N、1N处理相比,0.7NDB和0.7NB处理显著提高水稻结实率,表现为0.7NB > 0.7NDB > 1N > 0.7N。水稻籽粒重随着施氮量的增加而增加。与0.7N处理相比,0.7NDB处理对水稻籽粒重无显著影响;而0.7NB处理显著增加了水稻籽粒重,且与1N处理无显著差异。
|
|
表 1 减氮条件下施用固氮蓝细菌对水稻产量构成和籽粒重的影响 Table 1 Effects of nitrogen-fixing cyanobacteria on yield composition and grain weight of rice under nitrogen reduction |
水稻籽粒吸氮量与氮素总吸收量变化趋势一致,随着施氮量的增加,水稻籽粒氮素吸收量和氮素总吸收量显著增加(P < 0.05,表 2)。与0.7N处理相比,0.7NDB和0.7NB处理水稻籽粒吸氮量和氮素总吸收量显著增加;而与1N处理相比,0.7NB处理水稻籽粒吸氮量和氮素总吸收量都没有显著差异。秸秆吸氮量随着施氮量的增加而显著增加。与0.7N处理相比,0.7NDB和0.7NB处理对秸秆吸氮量无显著影响;与1N处理相比,0.7NB处理水稻秸秆吸氮量显著降低。根的吸氮量随着施氮量的增加而显著减少。0.7NB处理水稻根部吸氮量显著高于1N处理,但与0.7N处理相比无显著差异。0.7NDB和0.7NB处理的氮肥农学利用率和表观利用率显著高于0.7N处理;与1N处理相比,0.7NB处理氮肥农学利用率和表观利用率显著提高了48.00% 和35.57%;0.7NDB处理氮肥农学利用率显著低于1N处理,而其表观利用率显著高于1N处理。
|
|
表 2 减氮条件下施用固氮蓝细菌对水稻吸氮量和氮肥利用率的影响 Table 2 Effects of nitrogen-fixing cyanobacteria on nitrogen uptake and nitrogen use efficiency of rice under nitrogen reduction |
对不同处理NH3挥发的动态监测发现,NH3挥发速率共有3个峰值,波动较大,但其趋势相似(图 1)。稻田NH3挥发受氮肥添加的影响,在施加氮肥后的第1天达到峰值,随后迅速下降,到第5天NH3挥发速率降低至未施氮处理水平。随着施氮量的增加,NH3挥发速率逐渐提高。与0.7N处理相比,0.7NB处理NH3挥发速率降低,而0.7NDB处理NH3挥发速率提高。随着施氮量的增加,NH3挥发总累积量显著增加(表 3)。与1N处理相比,0.7NDB和0.7NB处理能显著降低NH3挥发总累积量(P < 0.05),而且新鲜固氮蓝细菌的作用显著大于高温灭活固氮蓝细菌。与0.7N处理相比,0.7NB处理的NH3挥发总累积量有下降的趋势,但是差异不显著;而0.7NDB处理的NH3挥发总累积量则显著增加。从不同施肥期来看,土壤NH3挥发主要集中在基肥期和分蘖肥期。其中,不施氮肥条件下,NH3挥发主要发生在基肥期,累积NH3挥发量占总累积NH3挥发量的89.36%;而在施氮条件下,分蘖肥期累积NH3挥发量大于基肥期,基肥期和分蘖肥期分别占NH3挥发总累积量的31.34% ~ 43.07% 和56.44% ~ 68.66%(表 3)。
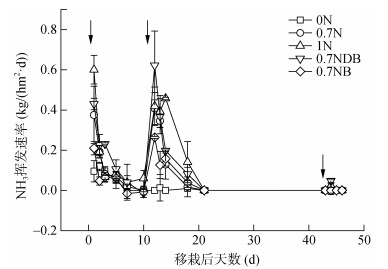
|
(箭头从左到右分别为基肥、分蘖肥、穗肥施用时间) 图 1 施用固氮蓝细菌对土壤NH3挥发速率的影响 Fig. 1 Effects of nitrogen-fixing cyanobacteria on soil ammonia volatilization rate |
|
|
表 3 施用固氮蓝细菌对水稻不同阶段施氮后土壤NH3挥发累积量的影响 Table 3 Effects of nitrogen-fixing cyanobacteria on cumulative soil NH3 volatilizations after N fertilization at different stages of rice |
水稻生长季在施用基肥、分蘖肥、穗肥后第7天及收获当天的土壤养分含量如图 2所示。土壤NH4+-N含量随着水稻生长呈现逐渐下降的趋势(图 2A)。在基肥和分蘖肥后第7天,土壤NH4+-N含量随着施氮量的增加而增加;与0.7N处理相比,0.7NDB处理土壤NH4+-N含量显著增加(P < 0.05),而0.7NB处理土壤NH4+-N含量则降低;与1N处理相比,0.7NB和0.7NDB处理土壤NH4+-N含量分别显著降低19.40% ~ 24.00% 和4.82% ~ 15.22%。在穗肥施用后第7天各处理间差异不大。在水稻收获当天,0.7NB和0.7NDB处理的土壤NH4+-N含量显著高于0.7N和1N处理,其中,比1N处理分别增加了10.19% 和21.88%。土壤NO3--N含量明显低于土壤NH4+-N含量,随着施肥量的增加,土壤NO3--N含量显著增加(图 2B)。在3次施肥后的第7天及收获当天,0.7NB处理土壤NO3--N含量均显著低于1N处理;0.7NDB处理土壤NO3--N含量在3次施肥后的第7天与1N处理相比有下降趋势,但是差异不显著,而在收获当天则显著低于1N处理。1N处理的土壤NO3--N含量在基肥期、分蘖肥期、穗肥期、收获期分别为1.73、2.31、2.98、1.69 mg/kg,分别比0.7N、0.7NDB、0.7NB处理高3.79% ~ 14.46%、3.18% ~ 20.20%、4.78% ~ 11.68% 和8.86% ~ 13.47%。
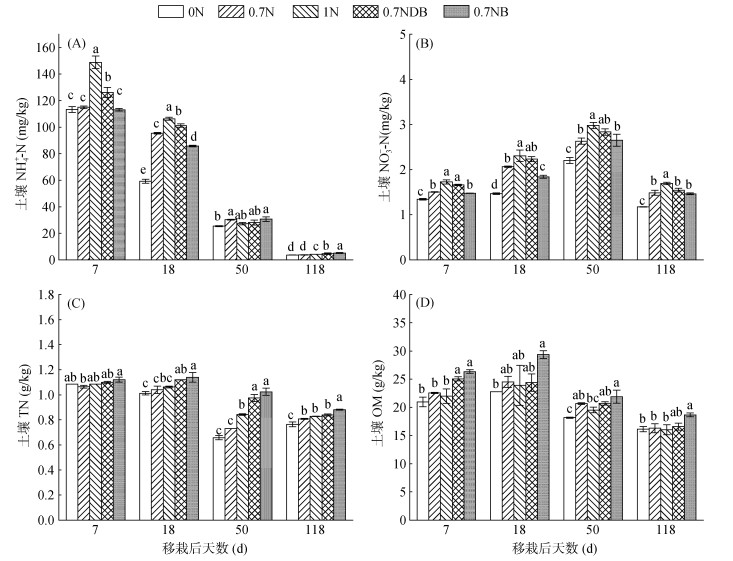
|
(移栽后7、18、50 d分别为基肥、分蘖肥和穗肥施用后的第7天,移栽后118 d则为水稻收获当天;图中小写字母不同表示同一时间不同处理间差异显著(P < 0.05)) 图 2 施用固氮蓝细菌对土壤养分含量的影响 Fig. 2 Effects of nitrogen-fixing cyanobacteria on soil nutrient contents |
0.7NDB和0.7NB处理土壤TN含量始终处于较高水平(图 2C)。不同处理在施用基肥后第7天土壤TN含量无显著差异;在施用分蘖肥、穗肥后第7天及水稻收获当天土壤TN含量随施氮量的增加而逐渐增加。与0.7N处理相比,各时期0.7NB处理土壤TN含量显著提高9.22% ~ 40.03%(P < 0.05);而0.7NDB处理土壤TN含量与0.7N处理相比,则表现为在施用分蘖肥和穗肥后第7天显著增加,收获当天影响不显著。与1N处理相比,0.7NB处理显著增加了施用分蘖肥、穗肥后第7天及收获当天的土壤TN含量,提高了6.37% ~ 21.42%。土壤OM含量随着水稻生长呈先增加后降低的趋势(图 2D)。在施用基肥后第7天,与0N、0.7N、1N处理相比,0.7NB和0.7NDB处理显著提高了土壤OM含量;其中与1N处理相比分别提高了19.84% 和14.00%。在施用分蘖肥、穗肥后第7天,与0.7N处理相比,0.7NDB处理对土壤OM含量无显著影响,0.7NB处理的土壤OM含量有增加的趋势但是差异不显著。在水稻收获当天,0.7NB处理土壤OM含量显著高于0.7N和1N处理,而0.7NDB处理与0.7N和1N处理无明显差异。
3 讨论 3.1 施用固氮蓝细菌对水稻籽粒重和氮肥利用率的影响与0.7N处理相比,0.7NB处理使水稻籽粒重显著增加23.32%(P < 0.05),与1N处理差异则不显著(表 1),这表明新鲜固氮蓝细菌具有较好的增产稳产效果。研究发现,增施氮肥能够增加水稻有效穗数,但在氮肥施用量超过180 kg/hm2后,水稻结实率快速降低[21]。这是因为水稻的营养生长抑制水稻生殖生长,导致水稻结实率下降,进而降低水稻产量[22]。因此,同时提高有效穗数和结实率是水稻高产的保障。施用新鲜固氮蓝细菌能够同时增加水稻有效穗数和结实率,进而提高水稻产量(表 1)。新鲜固氮蓝细菌能固定大气氮气和同化稻田中的活性氮,并且在其死亡后分解,释放氮使得氮肥后移来满足水稻生长,而且研究发现固氮蓝细菌在接种25 d后可在植株体内检测到固氮蓝细菌的氮,与水稻幼穗分化期相吻合[23],水稻结实率提高。Song等[24]通过施用15N标记的蓝细菌进行为期70 d盆栽试验发现,水稻根、茎、叶中均能检测到15N,而且茎和叶中15N含量显著高于根,同时蓝细菌固定的氮有57% ~ 71% 保留在土壤中,大幅度增加了水稻生长期的土壤氮库。另外,固氮蓝细菌分泌的胞外多糖能够增加土壤的渗透性,保持土壤营养,提高土壤肥力,增加土壤稳定性[25],为水稻生长提供了有利条件。不仅如此,蓝细菌能够产生大量具有不同性质的次级代谢产物[26],具有一定的生防效果,对真菌病害产生抗性,减少稻田病虫害,进而提高水稻产量。施用高温灭活固氮蓝细菌水稻籽粒重显著低于施用新鲜固氮蓝细菌和全量施氮,这是由于高温灭活的固氮蓝细菌在添加到土壤时已经死亡,相当于施用有机氮肥,与新鲜固氮蓝细菌相比,无法固定大气中的氮和利用土壤中无机氮,氮的后效短,对土壤氮素的供应能力显著低于新鲜固氮蓝细菌的供应,无法满足水稻生殖生长,使得水稻产量降低。
减氮30% 配施新鲜固氮蓝细菌提高氮肥利用率的作用显著大于施用高温灭活固氮蓝细菌(表 2)。施用新鲜固氮蓝细菌土壤供氮能力提高,水稻对氮肥的依赖性减弱,氮肥施用量减少,水稻对氮素吸收增加,氮肥利用率提高[27]。与1N处理相比,0.7NB处理能够显著增加氮肥利用率(氮肥农学利用率和表观利用率),这是因为在水稻生长前期,1N处理尿素快速分解,植株幼苗所需氮量远小于尿素释放的氮,导致氮素损失增加,而固氮蓝细菌具有“保氮效应”,在水稻生长后期又能释放出氮供水稻吸收利用。在本研究中,施用新鲜固氮蓝细菌的土壤NH4+-N含量在施用穗肥后第7天高于其他处理(图 2A),这表明固氮蓝细菌在水稻生长后期缓慢释放前期固定的氮,与水稻生长所需氮量相同步,提高了氮肥利用效率。
3.2 施用固氮蓝细菌对土壤养分含量的影响在水稻生长前期(幼苗期和分蘖期),0.7NB处理土壤NH4+-N含量低于0.7NDB处理,在生长后期(拔节抽穗后)则为0.7NB处理高于0.7NDB处理。这是因为新鲜固氮蓝细菌与高温灭活固氮蓝细菌相比,在水稻生长前期能够在淹水层繁殖生长,既能同化土壤中活性氮,又能在土壤活性氮不足时把大气中的氮气转化成微生物生物量氮,而灭活固氮蓝细菌不能发挥这些作用;在水稻生长后期,新鲜固氮蓝细菌在烤田后死亡,释放自身氮[28],为水稻生长提供氮源。与0.7N处理相比,0.7NB处理在施用分蘖肥和穗肥后第7天分别为土壤多提供了0.10、0.29 g/kg N(相当于165、478.5 kg/hm2 N,图 2C),在水稻生长结束后则多矿化了16.25% 的NH4+-N(图 2A)。由于土壤采样时处于淹水环境,土壤中的NO3--N含量处于较低水平,且变化不大(图 2B),施加固氮蓝细菌对土壤NO3--N含量影响也不大。
固氮蓝细菌作为绿肥的一种,是稻田重要的碳源,能够丰富微生物群落的结构和丰度,增加稻田土壤有机质含量,丰富有机碳库[29]。由于新鲜固氮蓝细菌可以通过光合作用固定CO2,并将CO2封存[30],增加稻田微生物生物量[31-32],产生更多的含碳化合物。当蓝细菌死亡后,随着其残体的分解和代谢,含碳化合物重新返回到土壤中,使土壤有机质含量增加[33]。有研究表明,施用新鲜固氮蓝细菌比单施尿素使土壤可氧化碳和可溶性碳分别增加7.63% 和241.14%[34]。本研究也发现0.7NDB处理的土壤有机质含量低于0.7NB处理(图 2D)。总的来说,稻田施用固氮蓝细菌能够增加土壤全氮和有机质含量,降低水稻生长季前期土壤NH4+-N含量。
3.3 施用固氮蓝细菌对NH3挥发的影响在基肥期和分蘖肥期的累积NH3挥发量占整个水稻生长季总累积NH3挥发量的绝大部分,与前人研究结果一致[35-36],这主要是由于基肥期和分蘖肥期的氮素投入量较高,增加了溶液中NH3的平衡压力,且水稻植株处于幼苗时期,氮素吸收较慢[37]。减氮30% 条件下,施用新鲜固氮蓝细菌对降低土壤NH3挥发有积极的作用但是差异不显著;与全量施氮相比,固氮蓝细菌代替部分尿素显著降低了土壤NH3挥发(图 1)。原因可能有3个方面:①稻田高温高湿的淹水条件为固氮蓝细菌的快速增殖提供了有利条件,生长中的固氮蓝细菌将尿素水解产物快速利用;②固氮蓝细菌死亡后通过矿化作用形成的NH4+-N释放速率低于尿素分解速率[23];③氮肥用量减少,能降低土壤NH4+-N浓度,抑制了NH4+-N向NH3的转化,降低了土壤NH3挥发速率。同时,尿素的快速水解导致土壤pH短期内迅速提高[38],增加了土壤NH3挥发。在整个生长期,减氮30% 施用高温灭活固氮蓝细菌NH3挥发量高于减氮30%,是因为灭活后的残体腐解形成有机氮被矿化[23],更早的参与氮代谢,进行氮转化,导致NH3挥发增加。
4 结论在减氮30%水平下,施用新鲜固氮蓝细菌水稻产量增加23.32%,但施用高温灭活固氮蓝细菌增产效果不明显;与施全量氮肥相比,减氮30% 配施新鲜固氮蓝细菌能够维持水稻产量,大幅度提高水稻氮肥利用率。固氮蓝细菌能够固定环境中的氮用于生长繁殖,并随着自身腐烂分解将体内的氮和含碳化合物返回土壤,提高土壤全氮和有机质含量。此外,减氮30% 配施新鲜固氮蓝细菌NH3挥发速率和累积NH3挥发量低于全量氮肥处理,有效减少NH3损失;而在减氮30% 条件下施用高温灭活固氮蓝细菌则增加累积NH3挥发量。总的来说,施用新鲜固氮蓝细菌能代替30% 氮肥,既不降低水稻产量,又能减少氮素损失,提高氮肥利用率,但此结果由盆栽试验获得,仍需大田验证。
| [1] |
Jiménez-de-Santiago D E, Ovejero J, Antúnez M, et al. Ammonia volatilization from pig slurries in a semiarid agricultural rainfed area[J]. Sustainability, 2023, 16(1): 238 DOI:10.3390/su16010238 (  0) 0) |
| [2] |
Wang H Y, Zhang D, Zhang Y T, et al. Ammonia emissions from paddy fields are underestimated in China[J]. Environmental Pollution, 2018, 235: 482-488 DOI:10.1016/j.envpol.2017.12.103 (  0) 0) |
| [3] |
陈若谷, 胡正华, 曾科, 等. 稻田养萍模式下不同施氮量对稻田氨挥发及红萍生物固氮作用的影响[J]. 土壤, 2023, 55(2): 245-253 (  0) 0) |
| [4] |
Mgelwa A S, Song L L, Fan M Y, et al. Isotopic imprints of aerosol ammonium over the North China plain[J]. Environmental Pollution, 2022, 315: 120376 DOI:10.1016/j.envpol.2022.120376 (  0) 0) |
| [5] |
Behera S N, Sharma M, Aneja V P, et al. Ammonia in the atmosphere: A review on emission sources, atmospheric chemistry and deposition on terrestrial bodies[J]. Environmental Science and Pollution Research International, 2013, 20(11): 8092-8131 DOI:10.1007/s11356-013-2051-9 (  0) 0) |
| [6] |
Song X N, Zhang J L, Li D H, et al. Nitrogen-fixing cyanobacteria have the potential to improve nitrogen use efficiency through the reduction of ammonia volatilization in red soil paddy fields[J]. Soil and Tillage Research, 2022, 217: 105274 DOI:10.1016/j.still.2021.105274 (  0) 0) |
| [7] |
Prasanna R, Adak A, Verma S, et al. Cyanobacterial inoculation in rice grown under flooded and SRI modes of cultivation elicits differential effects on plant growth and nutrient dynamics[J]. Ecological Engineering, 2015, 84: 532-541 DOI:10.1016/j.ecoleng.2015.09.033 (  0) 0) |
| [8] |
Zhang J L, Song X N, Wei H, et al. Effect of substituting nitrogen fertilizer with nitrogen-fixing cyanobacteria on yield in a double-rice cropping system in Southern China[J]. Journal of Applied Phycology, 2021, 33(4): 2221-2232 DOI:10.1007/s10811-021-02455-7 (  0) 0) |
| [9] |
Watanabe A. Effect of nitrogen-fixing blue-green Alga: Tolypothrix tenuis on the nitrogenous fertility of paddy soil and on the crop yield of rice plant[J]. The Journal of General and Applied Microbiology, 1962, 8(2): 85-91 DOI:10.2323/jgam.8.85 (  0) 0) |
| [10] |
Jochum M, Moncayo L P, Jo Y K. Microalgal cultivation for biofertilization in rice plants using a vertical semi-closed airlift photobioreactor[J]. PLoS One, 2018, 13(9): e0203456 DOI:10.1371/journal.pone.0203456 (  0) 0) |
| [11] |
Welker M, Von Döhren H. Cyanobacterial peptides— Nature's own combinatorial biosynthesis[J]. FEMS Microbiology Reviews, 2006, 30(4): 530-563 DOI:10.1111/j.1574-6976.2006.00022.x (  0) 0) |
| [12] |
Mandal B, Vlek P L G, Mandal L N. Beneficial effects of blue-green algae and Azolla, excluding supplying nitrogen, on wetland rice fields: A review[J]. Biology and Fertility of Soils, 1999, 28(4): 329-342 DOI:10.1007/s003740050501 (  0) 0) |
| [13] |
Li J Y, Deng K Y, Hesterberg D, et al. Mechanisms of enhanced inorganic phosphorus accumulation by periphyton in paddy fields as affected by calcium and ferrous ions[J]. Science of the Total Environment, 2017, 609: 466-475 DOI:10.1016/j.scitotenv.2017.07.117 (  0) 0) |
| [14] |
Chittapun S, Limbipichai S, Amnuaysin N, et al. Effects of using cyanobacteria and fertilizer on growth and yield of rice, pathum thani Ⅰ: A pot experiment[J]. Journal of Applied Phycology, 2018, 30(1): 79-85 DOI:10.1007/s10811-017-1138-y (  0) 0) |
| [15] |
黎尚豪, 叶清泉, 刘富瑞, 等. 固氮蓝藻对水稻肥效的初步研究[J]. 水生生物学集刊, 1959(4): 440-444 (  0) 0) |
| [16] |
Wang X J, Bei Q C, Yang W, et al. Unveiling of active diazotrophs in a flooded rice soil by combination of NanoSIMS and 15N2-DNA-stable isotope probing[J]. Biology and Fertility of Soils, 2020, 56(8): 1189-1199 DOI:10.1007/s00374-020-01497-2 (  0) 0) |
| [17] |
王慧, 靳海洋, 陈哲, 等. 稻田高效固氮蓝细菌的筛选鉴定及其促生潜力[J]. 微生物学通报, 2024, 51(10): 4043-4057 (  0) 0) |
| [18] |
吕金岭, 王小非, 骆晓声, 等. 减氮条件下砂壤质潮土区小麦–玉米轮作体系氨挥发特征及排放系数[J]. 植物营养与肥料学报, 2021, 27(2): 346-359 (  0) 0) |
| [19] |
吕金岭, 王小非, 寇长林. 两种方法测定砂姜黑土玉米季农田氨挥发[J]. 磷肥与复肥, 2020, 35(11): 45-49 (  0) 0) |
| [20] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科学技术出版社, 北京, 2000
(  0) 0) |
| [21] |
兰艳, 黄曌, 隋晓东, 等. 施氮量对低谷蛋白水稻产量及品质的影响[J]. 华南农业大学学报, 2019, 40(4): 8-15 (  0) 0) |
| [22] |
周亮, 荣湘民, 谢桂先, 等. 不同氮肥施用对双季稻产量及氮肥利用率的影响[J]. 土壤, 2014, 46(6): 971-975 (  0) 0) |
| [23] |
Irisarri P, Gonnet S, Deambrosi E, et al. Cyanobacterial inoculation and nitrogen fertilization in rice[J]. World Journal of Microbiology and Biotechnology, 2007, 23(2): 237-242 DOI:10.1007/s11274-006-9219-0 (  0) 0) |
| [24] |
Song X N, Peng C R, Li D H. Fate of nitrogen fixed by nitrogen-fixing cyanobacteria in rice and soil during the vegetative growth period of rice[J]. Journal of Applied Phycology, 2022, 34(4): 2051-2061 DOI:10.1007/s10811-022-02752-9 (  0) 0) |
| [25] |
Chamizo S, Mugnai G, Rossi F, et al. Cyanobacteria inoculation improves soil stability and fertility on different textured soils: Gaining insights for applicability in soil restoration[J]. Frontiers in Environmental Science, 2018, 6: 49 DOI:10.3389/fenvs.2018.00049 (  0) 0) |
| [26] |
Shishido T K, Humisto A, Jokela J, et al. Antifungal compounds from cyanobacteria[J]. Marine Drugs, 2015, 13(4): 2124-2140 DOI:10.3390/md13042124 (  0) 0) |
| [27] |
常单娜, 王慧, 周国朋, 等. 赣北地区稻-稻-紫云英轮作体系减施化肥对水稻产量、氮素吸收及土壤供氮能力的影响[J]. 植物营养与肥料学报, 2023, 29(8): 1449-1460 (  0) 0) |
| [28] |
Thind H S, Rowell D L. The fate of algal nitrogen in a flooded soil system[J]. Nutrient Cycling in Agroecosystems, 1999, 55(1): 89-94 DOI:10.1023/A:1009850915579 (  0) 0) |
| [29] |
Zhang X X, Zhang R J, Gao J S, et al. Thirty-one years of rice-rice-green manure rotations shape the rhizosphere microbial community and enrich beneficial bacteria[J]. Soil Biology and Biochemistry, 2017, 104: 208-217 DOI:10.1016/j.soilbio.2016.10.023 (  0) 0) |
| [30] |
Leong Y K, Chew K W, Chen W H, et al. Reuniting the biogeochemistry of algae for a low-carbon circular bioeconomy[J]. Trends in Plant Science, 2021, 26(7): 729-740 DOI:10.1016/j.tplants.2020.12.010 (  0) 0) |
| [31] |
杨帆. 固氮蓝藻和促腐剂对水稻土壤微生物和产量品质的影响[D]. 大庆: 黑龙江八一农垦大学, 2020.
(  0) 0) |
| [32] |
Edesi L, Järvan M, Noormets M, et al. The importance of solid cattle manure application on soil microorganisms in organic and conventional cultivation[J]. Acta Agriculturae Scandinavica, Section B - Soil & Plant Science, 2012, 62(7): 583-594 (  0) 0) |
| [33] |
He H B, Li W X, Zhang Y W, et al. Effects of Italian ryegrass residues as green manure on soil properties and bacterial communities under an Italian ryegrass (Lolium multiflorum L.)-rice (Oryza sativa L.) rotation[J]. Soil and Tillage Research, 2020, 196: 104487 (  0) 0) |
| [34] |
He H B, Li W X, Zhang Y W, et al. Effects of Italian ryegrass residues as green manure on soil properties and bacterial communities under an Italian ryegrass (Lolium multiflorum L.)-rice (Oryza sativa L.) rotation[J]. Soil and Tillage Research, 2020, 196: 104487 (  0) 0) |
| [35] |
Cao Y S, Tian Y H, Yin B, et al. Assessment of ammonia volatilization from paddy fields under crop management practices aimed to increase grain yield and N efficiency[J]. Field Crops Research, 2013, 147: 23-31 (  0) 0) |
| [36] |
何莉莉, 黄佳佳, 王梦洁, 等. 生物炭配施硝化抑制剂降低稻田土壤NH3和N2O排放的微生物机制[J]. 植物营养与肥料学报, 2023, 29(11): 2030-2041 (  0) 0) |
| [37] |
Zhao X, Yan X Y, Xie Y X, et al. Use of nitrogen isotope to determine fertilizer- and soil-derived ammonia volatilization in a rice/wheat rotation system[J]. Journal of Agricultural and Food Chemistry, 2016, 64(15): 3017-3024 (  0) 0) |
| [38] |
Mohanty S, Nayak A K, Swain C K, et al. Impact of integrated nutrient management options on GHG emission, N loss and N use efficiency of low land rice[J]. Soil and Tillage Research, 2020, 200: 104616 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Key Laboratory of Black Soils Conservation and Utilization, Northeast Institute of Geography and Agroecology, Chinese Academy of Sciences, Changchun 130102, China
 2024, Vol. 56
2024, Vol. 56


