2. 福建三明森林生态系统国家野外科学观测研究站, 福建三明 365002;
3. 福建师范大学地理研究所, 福州 350117
可溶性有机质(Dissolved organic matter,DOM)是生态系统中最具流动性和活性的有机化合物之一,普遍存在于水体、土壤、沉积物中。一般认为是可通过0.45 μm过滤器的有机混合物。在森林生态系统中,土壤DOM可敏感地反映土壤有机质的变化,为植物根系和土壤微生物代谢活动直接提供营养和能量来源,在土壤养分流动中起着重要作用[1]。植物作为陆地主要的生物因子,其生物量或其自身化学性质的差异,可能会在不同程度上改变土壤性质和微生物群落组成,进而影响土壤DOM特征。可溶性有机碳(Dissolved organic carbon,DOC)作为DOM重要组成部分,大约占DOM的50% ~ 70%,故DOC常用于表征DOM[2]。目前有关不同树种对DOM影响的研究表明,因不同树种土壤DOM易分解程度以及来源不同[3-4],不同林分土壤DOC含量存在差异,如Smolander等[5]研究发现,桦木成熟林(芬兰)土壤DOC含量显著高于相近林龄的松树成熟林。因此植物被认为是影响森林生态系统DOM数量和性质的重要因素之一[6]。
气候变暖已对全球生态系统结构和功能产生巨大影响[7]。在陆地生态系统中,增温可能会增加植被–土壤碳平衡的不稳定性[8]。DOM作为最具活性和流动性的化合物,温度升高对DOM的影响已引起了广泛关注。如Liechty等[9]研究发现土壤DOC含量与温度呈正比;增温提高了微生物代谢效率,进而提高DOM中微生物代谢产物的比例[10]。不同的是,Fröberg等[11]对瑞典北部云杉林开展长达14年的增温试验,发现增温对土壤DOC含量并无显著影响。MacDoald等[7]也发现增温没有显著影响土壤DOC。此外,温度可能会改变土壤DOM光谱特征,例如改变腐殖酸组成,提高土壤DOM浓度[12-13],也可能增加土壤DOM中陆源腐殖质成分和高芳香性碳化合物的占比[14-15]。目前对于增温影响土壤DOM浓度和光谱特征的机制尚不明确,已成为全球变化生态学研究领域的热点之一。
随着气候变暖的加剧,亚热带地区树种组成以及土壤环境将发生明显改变,但这些变化将如何影响不同树种土壤DOM浓度及光谱特征仍未知[16]。米槠(Castanopsis carlesii)是我国亚热带常绿阔叶林最典型的树种之一,而杉木(Cunninghamia lanceolata)又是我国亚热带地区常见的造林树种,因此,本研究选取这两种树种,通过设置根箱土壤增温试验,探究增温对种植不同树种土壤DOM浓度和光谱特征的影响,为理解亚热带区域森林土壤DOM的含量及组成提供基础数据,也可为全球气候变暖背景下造林树种选择提供一定的参考。
1 材料与方法 1.1 研究区概况试验地位于三明森林生态系统国家野外科学观测研究站——陈大站点(26°19′N,117°60′E)。该区以低山丘陵为主,属中亚热带型季风气候,温暖湿润,年平均气温19.5 ℃,最高气温40 ℃,最低气温–5.5 ℃,年蒸发量1 585 mm,年降水量1 670 mm。
1.2 试验设置2021年1月在实验地建立1.15 m (长)× 0.5 m(宽)根箱样方,设置种植米槠(Castanopsis carlesii,CC)、杉木(Cunninghamia lanceolata,CL)一年生植物幼苗及未种树(NT)处理,并对各根箱进行增温(+4 ℃,W)和对照(环境温度,CT)处理,每处理5个重复,样方依据随机区组分布,30个样方,样地于2021年11月开始增温。
植物稳定生长8个月后,于2022年7月,按照五点取样法分别取0 ~ 10 cm表层土壤,测定土壤基本理化性质、土壤DOM紫外和荧光光谱。根箱内布设ECH2O-5土壤水分传感器(Decagon,Pullman,WA,美国)和T109温度传感器(Campbell Scientific Inc.,Logan,UT,美国)。取样当天对照土壤温、湿度分别为28.33 ℃、33.12%,增温组土壤温、湿度分别为32.98 ℃、24.93%,二者均存在显著差异(P < 0.05)。
1.3 样品分析方法 1.3.1 土壤基本理化性质和植物指标的测定采集土壤样品前,测量各处理树根箱中米槠、杉木的株高、地径以及冠幅。土壤含水率(SWC)采用烘干法测定;利用土钻采集0 ~ 10 cm深度的土壤,并从中挑出植物根系,清洗后放入65 ℃烘箱烘至恒重,称其生物量[17]。使用pH计(STARTER 300,OHAUS,美国)以土水质量比1∶2.5浸提液测定土壤pH;使用土壤碳氮元素分析仪和植物碳氮元素分析仪测定土壤全碳含量(Soil-TC)、全氮含量(Soil-TN)、碳氮比(Soil-C∶N)和根系总碳含量(Root-TC)、总氮含量(Root-TN)、碳氮比(Root-C∶N);去离子水浸提鲜土(水土质量比2∶1),在4 000 r/min的转速下振荡离心后过0.45 μm滤膜得到渗滤液,提取不同树种土壤DOM,其中可溶性有机碳(Dissolved organic carbon,DOC)用总有机碳分析仪(TOC-VCPH/CPN,日本)测定[18];土壤铵态氮(NH4+-N)和硝态氮(NO3–-N)用2 mol/L K2SO4浸提,采用连续流动分析仪(Skalar san++,荷兰)测定;土壤微生物生物量碳、氮(MBC、MBN)采用改良氯仿熏蒸法(CHCl3-K2SO4提取),分别用总有机碳分析仪和连续流动分析仪测定[2]。
1.3.2 土壤DOM光谱指标测定采用紫外–可见光分光光度计(UV-2600,Shimadzu,日本)测定土壤DOM吸光度值。SUVA254、SUVA260、SUVA280分别为254、260和280 nm波长的吸光度与DOC含量的比值,分别表示DOM的芳香化程度、疏水性、相对分子量大小;光谱斜率比值SR(S275-295/S350-400)则代表DOM的光降解能力,其值越高说明DOM光降解性越强[19-20]。采用荧光光谱仪(F7000,Hitachi,Tokyo日本)测定DOM激发–发射矩阵荧光光谱(Excitation- emission matrix,EEM)。在Matlab 2018b,基于Peaklist工具箱,分别计算荧光指数(Fluorescence index,FluI)、新鲜度指数(Freshness index,Frl)、生物源指数(Biological index,BIX)、腐殖化指数(Humification index,HIX)[21-24]。
1.4 数据处理使用MATLAB R2018b,基于Peaklist和DOMFluor工具箱对EEMs数据集解析,确定DOM可识别的荧光组分及荧光强度Fmax[24]。使用SPSS 22.0和Rstudio对数据整理分析、作图。采用双因素方差分析对根箱植物状况、土壤基本理化性质和土壤DOM光谱特征进行差异显著性检验。采用Canoco 5.0软件将不同树种根箱土壤DOC含量和DOM光谱特征作为影响因子,根箱土壤基本理化性质、植物基本状况作为环境因子进行冗余分析(RDA)。采用R包PLS-MS包构建偏最小二乘模型(PLSR)验证DOC质量与土壤植物生化性质的相关性。
2 结果与分析 2.1 不同根箱的植物状况增温对根箱中米槠、杉木的树高、地径和冠幅均无显著影响(表 1)。比较不同树种,增温和对照处理中杉木树高、地径和冠幅均显著大于米槠(P < 0.05)。增温显著(P < 0.05)减少了米槠根系生物量和根系C∶N,且在两种温度处理中,米槠根系生物量均显著低于杉木。增温显著增加了杉木根系TC含量和米槠根系TN含量(P < 0.05)。
|
|
表 1 不同根箱的植物生长状况及土壤基本理化性质 Table 1 Plant growth status and soil physicochemical properties in different root boxes |
增温显著降低了杉木根箱土壤pH和米槠根箱土壤含水率(表 1,P < 0.05),对DOC含量无显著影响;不同树种间DOC含量存在显著差异(P < 0.05)。增温前米槠根箱土壤NO3–-N含量显著高于杉木根箱(P < 0.05)。增温前后,米槠根箱土壤DOC含量均显著低于杉木和未种树处理(P < 0.05),而杉木、未种树根箱的DOC含量无显著差异。增温前米槠根箱土壤MBC、MBN含量均高于杉木和未种树根箱,增温显著降低了米槠根箱土壤MBC、MBN含量。增温后杉木根箱MBC含量显著提高,且显著高于米槠、未种树处理(P < 0.05)。增温降低了杉木根箱土壤TC含量;增温处理中,米槠根箱土壤TN含量显著低于杉木和未种树处理(P < 0.05)。杉木根箱土壤C∶N在增温后显著降低;在增温处理中,未种树处理根箱土壤C∶N为12.07,显著高于米槠和杉木根箱(P < 0.05)。
2.3 不同根箱土壤DOM光谱指标由表 2可知,6种根箱处理土壤DOM的SUVA254 < 3,说明土壤DOM主要是亲水性芳香基团[25-27]。对照温度处理中,不同树种根箱处理土壤DOM的SUVA254、SUVA260、SUVA280无显著差异,且增温对各根箱土壤SUVA254、SUVA260和SUVA280无显著影响。而增温处理中,米槠、杉木树种土壤DOM的SUVA254、SUVA260和SUVA280均显著高于不种树处理(P < 0.05),但两种树种根箱土壤间无显著差异。有相关研究认为SR < 1时,表征DOM主要为外源(如新近凋落物、土壤腐殖质[28]);SR>1时,表征DOM主要为生物源[29]。增温对米槠和杉木处理根箱土壤DOM的SR值无显著影响,且均大于1;但显著降低了未种树根箱土壤DOM的SR值P < 0.05),且增温后SR<1。说明米槠、杉木根箱表层土壤DOM生物源特征明显,而增温环境下未种树根箱土壤DOM的生物源特征和光降解性减小,复杂程度增加。增温显著增加了米槠、杉木根箱土壤DOM的FluI指数P < 0.05),其中两树种根箱土壤的FluI荧光指数均大于2,表明根箱土壤增温后,土壤DOM的微生物来源显著增高[30-31]。此外,温度和树种对DOM的Frl、BIX和HIX指数均无显著影响。
|
|
表 2 不同根箱土壤DOM紫外、二维荧光光谱指标 Table 2 UV-vis and 2D fluorescence spectral indicators of soil DOM in different root boxes |
土壤DOM主要由4种荧光组分组成(图 1)。荧光组分1(C1)的激发波长在230 nm处,发射波长在360 nm处,代表了DOM中的芳香蛋白Ⅱ类物质。荧光组分2(C2)的激发波长在250 nm处,发射波长在290 nm处,代表了DOM中芳香蛋白Ⅰ类物质。荧光组分3(C3)的激发波长在280 nm处,发射波长峰值在450 nm处,代表DOM中的类富里酸。荧光组分4(C4)的激发波长在280 nm处,发射波长310 nm处,代表了DOM中的溶解性微生物副产物,即微生物产生的酪氨酸物质[32]。从整体上看,种树与未种树处理的根箱土壤DOM的C1、C2、C4组分的贡献率较高,即DOM的荧光组分中以芳香蛋白Ⅱ类物质、芳香蛋白Ⅰ类物质和溶解性微生物副产物对DOM荧光组分的贡献多于类富里酸。对照温度下种树与未种树根箱中,C3组分对杉木根箱土壤DOM荧光组分贡献最大(13.68% ± 1.4%),未种数根箱次之(11.08% ± 2.39%),米槠根箱最小。在增温处理中,C4组分在杉木根箱土壤DOM的相对贡献率(35.28% ± 4.2%)显著高于未种树根箱(P < 0.05)。温度对米槠和杉木根箱土壤DOM的4种荧光组分贡献率无显著影响,但增温显著降低了未种树根箱土壤DOM的C4组分贡献率(P < 0.05)。
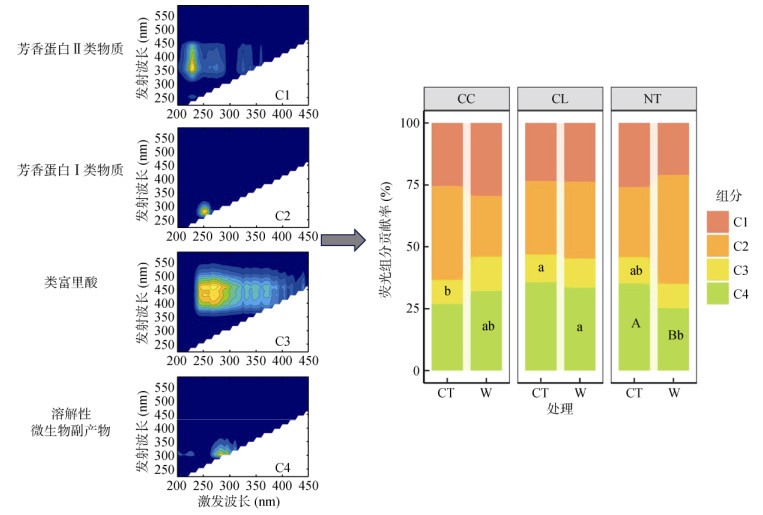
|
(C1为芳香蛋白Ⅱ类物质,C2为芳香蛋白Ⅰ类物质,C3为类富里酸,C4为溶解性微生物副产物) 图 1 不同处理土壤DOM荧光组分图 Fig. 1 Fluorescence component diagram of soil DOM under different treatments |
将不同根箱土壤基本理化性质、植物生长状况作为解释变量与土壤DOC含量和DOM光谱指标、荧光组分相对贡献率进行冗余分析。结果表明,米槠根箱中第一标准轴(RDA1)和第二标准轴(RDA2)分别解释了DOM各变量变化的87.5% 和7.1%(图 2A)。根系生物量、MBC、树高对DOC含量和DOM光谱特征变化的解释变量度分别达到28%、22.8% 和12.4%。其中MBC与DOC含量、Frl指数呈极显著正相关(P < 0.05),而与C4组分相对贡献率、FluI指数变化呈极显著负相关(P < 0.01)。
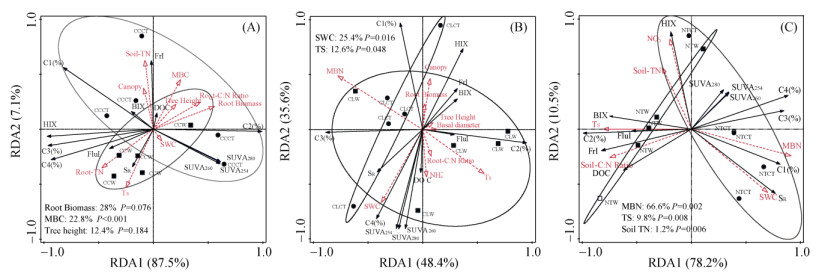
|
(A:米槠根箱;B:杉木根箱;C:未种树根箱;CCCT:对照(不增温)米槠根箱处理;CCW:增温米槠根箱处理;CLCT:对照(不增温)杉木根箱处理;CLW:增温杉木根箱处理;NTCT:对照(不增温)未种树根箱处理;NTW:增温未种树根箱处理。TS:土壤温度;Root biomass:根生物量Tree height:树高;Basal diameter:地径;Canopy:冠幅) 图 2 根箱土壤DOC含量以及DOM光谱学特征与环境因子的冗余分析 Fig. 2 Redundancy analysis of soil DOC concentrations and spectroscopy characteristics with environment factors in different root boxes |
在杉木根箱中,RDA1和RDA2分别解释因变量变化的48.4% 和35.6%,其中土壤含水率和土壤温度对DOC含量和DOM光谱特征变化的解释量分别为25.4%、12.6%(图 2B)。其中DOC含量变化、C4组分相对贡献率以及SR与SWC呈明显正相关关系,FluI指数与温度呈显著正相关(P < 0.05)。
根据图 2C可知,未种树根箱第一标准轴(RDA1)和第二标准轴(RDA2)分别解释因变量变化的78.2% 和10.5%。MBN和土壤温度是影响DOC含量和DOM光谱特征变化的重要因素(P < 0.01)。土壤DOC含量变化与MBN呈极显著负相关关系(P < 0.01)。土壤FluI指数变化则与土壤温度呈极显著正相关关系(P < 0.01)。
2.5 增温对不同根箱土壤DOC含量和DOM光谱特征影响的结构方程模型由图 3所示,结构方程模型分别解释了温度对米槠、杉木和未种树根箱土壤DOM光谱特征总方差的46.55%,58.47% 和69.48%。由图 3A可知,增温对米槠植物地下生物量有极显著正向影响(P < 0.01),其路径系数β为0.856 4,而温度对土壤基本理化性质有极显著负向影响(β=–0.856 3,P < 0.01)。地下生物量和土壤基本理化性质对DOM光谱特征有显著正向影响,相关路径系数为1.160 6(地下生物量) > 0.5354(土壤性质),温度和植物地上生物量则是负向影响,其相关效应分别是–0.2036和–0.2515。在杉木根箱中,温度、植物地上生物量和土壤基本理化性质对土壤DOM光谱特征均呈负向的影响,相关路径系数分别是–0.251 6,–0.156 4和–0.552 7。而温度对植物地下生物量呈极显著正向影响(β=0.8712,P < 0.01,图 3B)
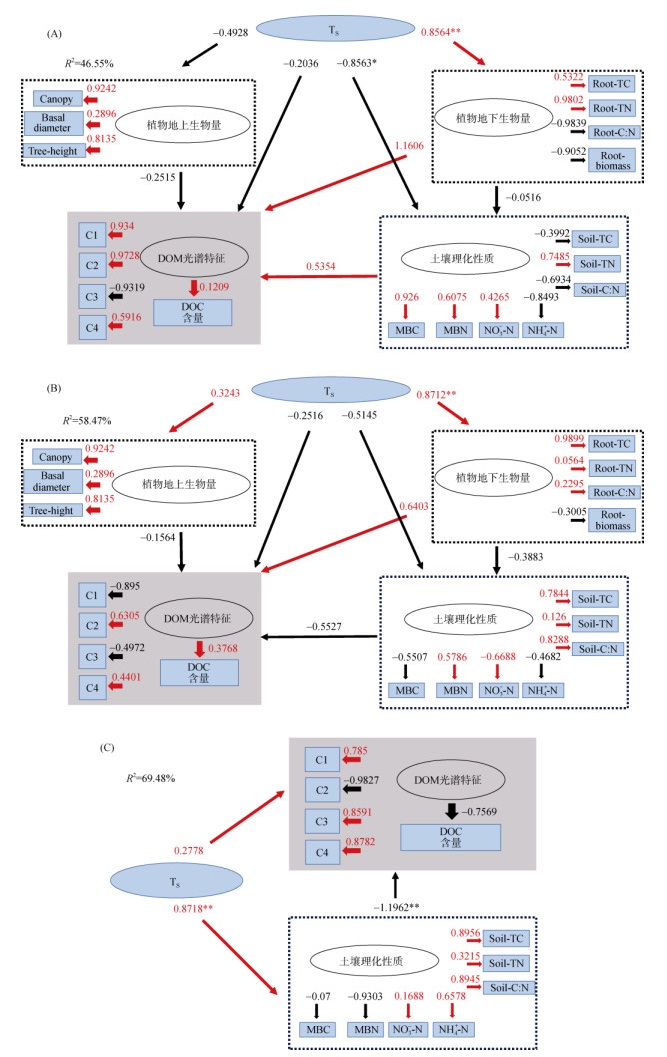
|
(A:米槠根箱;B:杉木根箱;C:未种树根箱;图中红色箭头表示因素间正向作用,黑色箭头表示因素间负向作用。*、**分别表示在P<0.05和P<0.01(双尾)显著;TS:土壤温度;Tree height:树高;Basal diameter:地径;Canopy:冠幅) 图 3 增温对不同根箱土壤DOC含量和DOM光谱特征影响的结构方程模型 Fig. 3 Structural equation model of warming effects on soil DOC concentration and spectral characteristics in different root boxes |
由图 3C可知,未种树根箱处理中,温度对土壤理化性质、DOC含量均是正向影响,且温度对土壤理化性质正向影响极显著(β=0.871 8,P < 0.01)。土壤理化性质对土壤DOC含量、DOM的C2组分有极显著负向影响(P < 0.01)。
3 讨论 3.1 增温对种植不同树种土壤DOC含量和DOM光谱特征的影响温度是影响土壤生物地球化学循环过程的重要环境因素之一。Liu等[32]研究认为增温对凋落物分解有促进作用,进而提高土壤表层DOC含量。本研究中增温对种植不同树种根箱土壤DOC含量无显著影响,可能是由于土壤DOC产生和降解之间存在相对平衡,故DOC含量无显著变化[33];也可能是因为增温加速植物增长,进而促进其对土壤表层DOC等的吸收利用,抵消了增长的那部分DOC[34]。本研究中,增温只显著增加了不同根箱土壤DOM的荧光指数,提高了DOM中溶解性微生物副产物组分,说明增温环境下微生物活性提高,大量难分解有机物被微生物分解[34],进而使米槠、杉木根箱土壤DOM的微生物代谢来源显著提高。与米槠、杉木不同,增温后未种树根箱土壤DOM中溶解性微生物副产物组分相对贡献率以及光降解性显著降低,这可能是因为未种树根箱土壤微生物量较少、微生物活性较弱,增温使得土壤微生物活动减少,故溶解性微生物副产物减少,也可能是因为增温后土壤含水率的降低导致微生物对DOM中相对分子量较大化合物的利用受阻,而转向对小分子量物质的分解,故根箱土壤中DOM复杂程度增加[35]。
本研究发现,土壤DOC含量和DOM光谱特征在不同树种间有显著差异。两种温度处理中,杉木(针叶树种)和未种树根箱土壤DOC含量均显著高于米槠(阔叶树种),这与前人研究得出的阔叶林土壤DOC含量通常低于针叶林土壤的结果[36]一致。一方面可能是杉木树种凋落物分解速度较慢,凋落物层厚[37],入渗水与有机物接触时间更长,从而使有机分子溶解为DOC的可能性增大,从而加速DOC的释放[38]。也可能是由于杉木和米槠植物根系在土层中分布特点不同,对土壤C分解和利用效率差异导致。米槠根箱中细根主要分布于土壤表层,这引起表层土壤DOC的产出可能优先被微生物群落利用,而杉木细根在土壤垂直深度上均有分布,这有助于更深层土壤C分解,故造成两树种土壤DOC含量有显著差异[39]。与张雅婷等[40]研究结果不同,本研究中增温前后未种树根箱土壤DOC含量均为最高,可能是因为未种树根箱中没有因植物快速生长对养分的需求导致的土壤DOC的利用,且微生物矿化作用相比种树根箱较弱,故土壤DOC含量保持稳定且不易被消耗,也有可能是因为DOC未随植物根系从表层向下生长[41],从而导致表层土壤(0 ~ 10 cm)中DOC含量高于米槠、杉木两种根箱。增温处理中,种树根箱(米槠、杉木)土壤DOM的紫外指数(SUVA254、SUVA260、SUVA280)以及SR均显著高于未种树根箱,表明种树根箱土壤DOM具有更强的植物源特征和生物降解性,DOM中小分子量亲水性化合物易于被土壤中微生物利用,芳香蛋白类物质较多,且DOM的光降解性随芳香性增加而增加[42]。而未种树根箱土壤活性较差[39],DOM结构较为复杂。与高颖等[43]的研究相似,不同树种土壤DOM的紫外指数以杉木树种最高,说明杉木土壤DOM中含有更多芳香性和多酚化合物等亲水性芳香物质,这部分有机质不易被微生物所降解,这也与杉木叶片在土壤表层分解有关[44-45]。在对照温度中,杉木根箱土壤DOM的C3组分即类富里酸显著高于米槠树种,说明杉木根箱土壤在正常条件下,土壤表层有机质分解慢于米槠树种,土壤DOM含有更多的包括弱脂肪和芳香族有机酸混合物的大分子量腐殖化物质[46]。增温后,有种树(米槠、杉木)根箱土壤DOM的C4组分即溶解性微生物副产物的相对贡献率均高于未种树根箱,可能是因为有树根箱内植物根际过程对土壤微生物、养分有富集效应[47],进而增加了DOM溶解性微生物副产物的相对贡献率。
3.2 增温对种植不同树种土壤DOC含量和DOM光谱特征影响的潜在机制为了进一步探究增温和树种对DOC含量和光谱特征的影响,本研究通过冗余分析以及结构方程模型的构建,表征土壤DOC含量和光谱特征与土壤基本理化性质、植物地上(下)生物量等环境因子的相关性。
冗余分析发现,米槠根箱土壤中DOC和MBC呈强正相关关系,可能是米槠根箱根系及其分泌物较多,土壤中DOC被微生物快速分解利用,表层土壤MBC也随之增加[34]。此外,米槠根箱土壤DOC也受地下根系生物量显著影响,根系生物量增加的同时与特定微生物群落结合,生成的根系分泌物,不仅刺激了微生物的活动和微生物对养分的需求,也为土壤中有机碳提供重要来源[48]。杉木根箱中,DOC含量随土壤含水率的减少而降低,这可能是由于增温后土壤含水率的降低抑制了土壤微生物活性,因而可能削弱增温对土壤微生物分解有机质释放DOC的促进效应[49]。杉木根箱土壤DOM芳香性随土壤含水率的减少而降低,这可能是因为土壤含水率降低会影响土壤颗粒和胶体的组成,阻碍DOM中芳香性物质成分聚集[50],而类富里酸相对贡献率(C3)、光降解性与温度呈负相关,说明增温后杉木根箱土壤DOM以小分子易分解物质为主[51],腐殖化来源占比减少。有研究认为土壤C∶N是土壤微生物群落组成的主要影响因素,未种树根箱土壤中DOC含量与土壤C︰N相关性较高,且土壤C∶N显著高于米槠、杉木根箱,加大了对土壤真菌群落的C分配[52],也因此促进微生物代谢,提高根箱土壤DOC含量。
对不同根箱处理土壤DOM的光谱特征影响因素构建结构方程模型发现,温度对米槠根箱土壤性质产生显著负向影响,对地下生物量产生极显著的正向影响(P < 0.01),二者均对土壤光谱特征起正向作用。其中根系TC、TN与米槠根箱土壤DOC含量呈正相关关系,增温促进根系周围N的释放[53],根系TN随温度的升高而显著增加,而根系C、N养分的增加、C∶N的减少一定程度减少微生物活动受养分的限制程度,从而增加微生物活性,表现出对DOC含量的正向作用,促进表层土DOC的释放,提高了DOM的微生物来源贡献度(C4)[54]。而根系生物量随增温而显著减少,可能是因为增温引起的水分胁迫抑制根系生长,减少米槠细根生物量,进而减少根系微生物对根源活性碳的利用[55],体现对DOM腐殖酸组分C3占比的负向影响。同时增温对土壤C∶N起负向作用,从而使土壤腐殖化产物减少[51],因而对C3组分相对贡献率有负向影响,此外增温对土壤TN、NO3–-N以及MBC、MBN起正向作用,以此满足微生物对养分的需求,进而表现出对DOC含量的正向影响。
增温正向作用于杉木根系TC、TN、C∶N以及土壤中MBN含量,加速根系生长,为微生物提供养分,促进微生物活动[56],因此表现出对C2、C4组分贡献率及DOC含量的正向作用。增温通过抑制土壤中NH4+-N、MBC含量,对DOC含量起负向作用,这是由于增温使微生物周转速度加快,加速易降解底物的消耗,进而使土壤微生物在较高温度下受到更强的养分限制[57]。未种树根箱中,增温对土壤理化性质有极显著正向作用(P < 0.01),土壤理化性质对DOC含量呈极显著负向作用(P < 0.01),其中DOC含量随MBN含量的减少而降低,可能是因为升温幅度较大(+4 ℃),不耐高温的微生物数量减少、活性降低[56],一定程度上抑制DOC含量的提高。
4 结论1) 增温促进种树(米槠、杉木)根箱表层土壤微生物活动,从而提高了DOM中微生物代谢来源的组分,降低其复杂程度;但增温抑制未种树根箱表层土壤微生物活性,使其复杂程度变高。
2) 不同树种土壤DOC含量存在差异,其中未种树根箱中DOC含量最高。由于本研究只初步探讨短期增温对种植不同树种表层土壤DOM性质的影响,未来需结合土壤DOM来源和微生物群落等因素深入开展不同土层DOM的研究,以促进对气候变暖背景下土壤生物地球化学循环的理解。
| [1] |
Bi R, Lu Q, Yuan T, et al. Electrochemical and spectroscopic characteristics of dissolved organic matter in a forest soil profile[J]. Journal of Environmental Sciences, 2013, 25(10): 2093-2101 DOI:10.1016/S1001-0742(12)60283-6 (  0) 0) |
| [2] |
王海珍. 不同菌根树种土壤渗滤液DOC通量和光谱特征对短期增温的响应[D]. 福州: 福建师范大学, 2023.
(  0) 0) |
| [3] |
Kiikkilä O, Kitunen V, Smolander A. Dissolved soil organic matter from surface organic horizons under birch and conifers: Degradation in relation to chemical characteristics[J]. Soil Biology and Biochemistry, 2006, 38(4): 737-746 DOI:10.1016/j.soilbio.2005.06.024 (  0) 0) |
| [4] |
Ye Q H, Wang Y H, Zhang Z T, et al. Dissolved organic matter characteristics in soils of tropical legume and non-legume tree plantations[J]. Soil Biology and Biochemistry, 2020, 148: 107880 DOI:10.1016/j.soilbio.2020.107880 (  0) 0) |
| [5] |
Smolander A, Kitunen V. Comparison of tree species effects on microbial C and N transformations and dissolved organic matter properties in the organic layer of boreal forests[J]. Applied Soil Ecology, 2011, 49: 224-233 DOI:10.1016/j.apsoil.2011.05.002 (  0) 0) |
| [6] |
Fegel T S, Boot C M, Covino T P, et al. Amount and reactivity of dissolved organic matter export are affected by land cover change from old-growth to second-growth forests in headwater ecosystems[J]. Hydrological Processes, 2021, 35(8): e14343 DOI:10.1002/hyp.14343 (  0) 0) |
| [7] |
MacDonald N W, Randlett D L, Zak D R. Soil warming and carbon loss from a lake states spodosol[J]. Soil Science Society of America Journal, 1999, 63(1): 211-218 DOI:10.2136/sssaj1999.03615995006300010030x (  0) 0) |
| [8] |
Batjes N H. Total carbon and nitrogen in the soils of the world[J]. European Journal of Soil Science, 2014, 65(1): 10-21 DOI:10.1111/ejss.12114_2 (  0) 0) |
| [9] |
Liechty H O, Kuuseoks E, Mroz G D. Dissolved organic carbon in northern hardwood stands with differing acidic inputs and temperature regimes[J]. Journal of Environmental Quality, 1995, 24(5): 927-933 (  0) 0) |
| [10] |
Fouché J, Christiansen C T, Lafrenière M J, et al. Canadian permafrost stores large pools of ammonium and optically distinct dissolved organic matter[J]. Nature Communications, 2020, 11(1): 4500 DOI:10.1038/s41467-020-18331-w (  0) 0) |
| [11] |
Fröberg M, Grip H, Tipping E, et al. Long-term effects of experimental fertilization and soil warming on dissolved organic matter leaching from a spruce forest in Northern Sweden[J]. Geoderma, 2013, 200: 172-179 (  0) 0) |
| [12] |
Wang H C, Chou C Y, Chiou C R, et al. Humic acid composition and characteristics of soil organic matter in relation to the elevation gradient of moso bamboo plantations[J]. PLoS One, 2016, 11(9): e0162193 DOI:10.1371/journal.pone.0162193 (  0) 0) |
| [13] |
Toosi E R, Schmidt J P, Castellano M J. Land use and hydrologic flowpaths interact to affect dissolved organic matter and nitrate dynamics[J]. Biogeochemistry, 2014, 120(1): 89-104 (  0) 0) |
| [14] |
Nguyen H V M, Choi J H. Changes in the dissolved organic matter leaching from soil under severe temperature and N-deposition[J]. Environmental Monitoring and Assessment, 2015, 187(6): 323 DOI:10.1007/s10661-015-4549-8 (  0) 0) |
| [15] |
Kalbitz K, Schmerwitz J, Schwesig D, et al. Biodegradation of soil-derived dissolved organic matter as related to its properties[J]. Geoderma, 2003, 113(3/4): 273-291 (  0) 0) |
| [16] |
Guo R H, Zheng J Q, Han S J, et al. Carbon and nitrogen turnover in response to warming and nitrogen addition during early stages of forest litter decomposition—An incubation experiment[J]. Journal of Soils and Sediments, 2013, 13(2): 312-324 DOI:10.1007/s11368-012-0630-x (  0) 0) |
| [17] |
马亚培. 氮沉降背景下生物炭施用对土壤可溶性有机质和微生物组成的影响[D]. 福州: 福建师范大学, 2021.
(  0) 0) |
| [18] |
程蕾, 林开淼, 周嘉聪, 等. 氮沉降对毛竹林土壤可溶性有机质数量与光谱学特征的影响[J]. 应用生态学报, 2019, 30(5): 1754-1762 (  0) 0) |
| [19] |
Moran M A, Sheldon Jr W M, Zepp R G. Carbon loss and optical property changes during long-term photochemical and biological degradation of estuarine dissolved organic matter[J]. Limnology and Oceanography, 2000, 45(6): 1254-1264 DOI:10.4319/lo.2000.45.6.1254 (  0) 0) |
| [20] |
Helms J R, Stubbins A, Ritchie J D, et al. Absorption spectral slopes and slope ratios as indicators of molecular weight, source, and photobleaching of chromophoric dissolved organic matter[J]. Limnology and Oceanography, 2008, 53(3): 955-969 DOI:10.4319/lo.2008.53.3.0955 (  0) 0) |
| [21] |
McKnight D M, Boyer E W, Westerhoff P K, et al. Spectrofluorometric characterization of dissolved organic matter for indication of precursor organic material and aromaticity[J]. Limnology and Oceanography, 2001, 46(1): 38-48 DOI:10.4319/lo.2001.46.1.0038 (  0) 0) |
| [22] |
Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719 DOI:10.1016/j.orggeochem.2009.03.002 (  0) 0) |
| [23] |
Wilson H F, Xenopoulos M A. Effects of agricultural land use on the composition of fluvial dissolved organic matter[J]. Nature Geoscience, 2009, 2: 37-41 DOI:10.1038/ngeo391 (  0) 0) |
| [24] |
Stedmon C A, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: A tutorial[J]. Limnology and Oceanography: Methods, 2008, 6(11): 572-579 DOI:10.4319/lom.2008.6.572 (  0) 0) |
| [25] |
Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science & Technology, 2003, 37(20): 4702-4708 (  0) 0) |
| [26] |
Yuan X C, Si Y T, Lin W S, et al. Effects of short-term warming and nitrogen addition on the quantity and quality of dissolved organic matter in a subtropical Cunninghamia lanceolata plantation[J]. PLoS One, 2018, 13(1): e0191403 DOI:10.1371/journal.pone.0191403 (  0) 0) |
| [27] |
Wang H, Holden J, Zhang Z J, et al. Concentration dynamics and biodegradability of dissolved organic matter in wetland soils subjected to experimental warming[J]. Science of the Total Environment, 2014, 470: 907-916 (  0) 0) |
| [28] |
杨玉盛, 郭剑芬, 陈光水, 等. 森林生态系统DOM的来源、特性及流动[J]. 生态学报, 2003, 23(3): 547-558 DOI:10.3321/j.issn:1000-0933.2003.03.019 (  0) 0) |
| [29] |
Zhou Y Q, Zhang Y L, Shi K, et al. Dynamics of chromophoric dissolved organic matter influenced by hydrological conditions in a large, shallow, and eutrophic lake in China[J]. Environmental Science and Pollution Research International, 2015, 22(17): 12992-13003 DOI:10.1007/s11356-015-4556-x (  0) 0) |
| [30] |
李帅东, 姜泉良, 黎烨, 等. 环滇池土壤溶解性有机质(DOM)的光谱特征及来源分析[J]. 光谱学与光谱分析, 2017, 37(5): 1448-1454 (  0) 0) |
| [31] |
Inamdar S, Finger N, Singh S, et al. Dissolved organic matter (DOM) concentration and quality in a forested mid-Atlantic watershed, USA[J]. Biogeochemistry, 2012, 108(1): 55-76 (  0) 0) |
| [32] |
Liu J X, Liu S G, Li Y Y, et al. Warming effects on the decomposition of two litter species in model subtropical forests[J]. Plant and Soil, 2017, 420(1): 277-287 (  0) 0) |
| [33] |
Hagedorn F, Martin M, Rixen C, et al. Short-term responses of ecosystem carbon fluxes to experimental soil warming at the Swiss alpine treeline[J]. Biogeochemistry, 2010, 97(1): 7-19 DOI:10.1007/s10533-009-9297-9 (  0) 0) |
| [34] |
元晓春, 陈岳民, 袁硕, 等. 氮沉降对杉木人工幼林土壤溶液可溶性有机物质浓度及光谱学特征的影响[J]. 应用生态学报, 2017, 28(1): 1-11 (  0) 0) |
| [35] |
郑小东, 陈香碧, 胡亚军, 等. 亚热带典型地貌下旱地和水田可溶性有机物化学组成特征[J]. 土壤, 2019, 51(6): 1114-1121 DOI:10.13758/j.cnki.tr.2019.06.010 (  0) 0) |
| [36] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The microbial efficiency-matrix stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter?[J]. Global Change Biology, 2013, 19(4): 988-995 DOI:10.1111/gcb.12113 (  0) 0) |
| [37] |
Camino-Serrano M, Gielen B, Luyssaert S, et al. Linking variability in soil solution dissolved organic carbon to climate, soil type, and vegetation type[J]. Global Biogeochemical Cycles, 2014, 28(5): 497-509 DOI:10.1002/2013GB004726 (  0) 0) |
| [38] |
Jiang J, Wang Y P, Yu M X, et al. Responses of soil buffering capacity to acid treatment in three typical subtropical forests[J]. Science of the Total Environment, 2016, 563: 1068-1077 (  0) 0) |
| [39] |
Förster A, Hertel D, Werner R, et al. Belowground consequences of converting broadleaf to conifer forest: Comparing the fine root systems of European beech and Scots pine[J]. Forest Ecology and Management, 2021, 496: 119457 DOI:10.1016/j.foreco.2021.119457 (  0) 0) |
| [40] |
张雅婷, 郑裕雄, 杨智杰, 等. 不同林龄杉木人工林根际与非根际土可溶性有机碳的差异[J]. 亚热带资源与环境学报, 2023, 18(1): 48-55 DOI:10.3969/j.issn.1673-7105.2023.01.008 (  0) 0) |
| [41] |
白皓宇, 杨智杰, 郑永, 等. 增温对亚热带森林土壤可浸提有机碳的影响[J]. 生态学杂志, 2020, 39(5): 1436-1444 (  0) 0) |
| [42] |
Van Stan J T, Stubbins A. Tree‐DOM: Dissolved organic matter in throughfall and stemflow[J]. Limnology and Oceanography Letters, 2018, 3(3): 199-214 DOI:10.1002/lol2.10059 (  0) 0) |
| [43] |
高颖, 鲍勇, 胡伟芳, 等. 亚热带地区3种典型林分土壤DOM数量及光谱特征[J]. 亚热带资源与环境学报, 2018, 13(1): 26-35 DOI:10.3969/j.issn.1673-7105.2018.01.005 (  0) 0) |
| [44] |
高颖. 亚热带地区森林转换背景下不同林分土壤DOM化学结构及其生物降解性[D]. 福州: 福建师范大学, 2018.
(  0) 0) |
| [45] |
Ding Y D, Xie X Y, Ji J H, et al. Tree mycorrhizal effect on litter-leached DOC amounts and biodegradation is highly dependent on leaf habits in subtropical forests of Southern China[J]. Journal of Soils and Sediments, 2021, 21(11): 3572-3579 DOI:10.1007/s11368-021-03032-8 (  0) 0) |
| [46] |
Kalbitz K, Solinger S, Park J H, et al. Controls on the dynamics of dissolved organic matter in soils: A review[J]. Soil Science, 2000, 165(4): 277-304 DOI:10.1097/00010694-200004000-00001 (  0) 0) |
| [47] |
马源, 李林芝, 张德罡, 等. 退化高寒草甸优势植物根际与非根际土壤养分及微生物量的分布特征[J]. 草地学报, 2019, 27(4): 797-804 (  0) 0) |
| [48] |
Finzi A C, Abramoff R Z, Spiller K S, et al. Rhizosphere processes are quantitatively important components of terrestrial carbon and nutrient cycles[J]. Global Change Biology, 2015, 21(5): 2082-2094 DOI:10.1111/gcb.12816 (  0) 0) |
| [49] |
张宇辉, 陈娟, 胥超, 等. 增温对亚热带格氏栲天然林凋落物可溶性有机质数量和结构的影响[J]. 应用生态学报, 2023, 34(4): 946-954 (  0) 0) |
| [50] |
Tiefenbacher A, Weigelhofer G, Klik A, et al. Antecedent soil moisture and rain intensity control pathways and quality of organic carbon exports from arable land[J]. CATENA, 2021, 202: 105297 DOI:10.1016/j.catena.2021.105297 (  0) 0) |
| [51] |
袁硕. 增温对亚热带常绿阔叶林土壤可溶性有机物数量与组成的影响[D]. 福州: 福建师范大学, 2018.
(  0) 0) |
| [52] |
Högberg M N, Högberg P, Myrold D D. Is microbial community composition in boreal forest soils determined by pH, C-to-N ratio, the trees, or all three?[J]. Oecologia, 2007, 150(4): 590-601 (  0) 0) |
| [53] |
王小南, 熊德成, 张宇辉, 等. 增温和氮添加对中亚热带杉木人工林土壤氮矿化和N2O排放的影响[J]. 林业科学研究, 2023, 36(3): 22-31 (  0) 0) |
| [54] |
Miano T M, Senesi N. Synchronous excitation fluorescence spectroscopy applied to soil humic substances chemistry[J]. Science of the Total Environment, 1992, 117: 41-51 (  0) 0) |
| [55] |
魏春雪, 杨璐, 汪金松, 等. 实验增温对陆地生态系统根系生物量的影响[J]. 植物生态学报, 2021, 45(11): 1203-1212 (  0) 0) |
| [56] |
梁百艳. 松嫩草地在模拟增温和氮沉降前后土壤微生物生物量对比研究[D]. 长春: 东北师范大学, 2013.
(  0) 0) |
| [57] |
陈滢伊. 模拟增温和氮沉降对亚热带杉木幼林土壤可溶性有机质与微生物群落结构的影响[D]. 福州: 福建师范大学, 2019.
(  0) 0) |
2. Sanming Forest Ecosystem National Observation and Research Station of Fujian Province, Sanming, Fujian 365002, China;
3. Institute of Geography, Fujian Normal University, Fuzhou 350117, China
 2025, Vol. 57
2025, Vol. 57


