2. 中国科学院、水利部成都山地灾害与环境研究所, 山地表生过程与生态调控重点实验室, 成都 610041
长期的磷矿石生产加工活动过程中,其伴生的大量重金属也会进入周边土壤环境,导致重金属污染[1]。微生物参与了土壤中元素循环和污染物降解等诸多生态过程,在提高土壤质量和生产力方面起着至关重要的作用[2]。土壤微生物群落结构和多样性的变化直接反映了土壤重金属污染水平[3]。研究发现,重金属含量与土壤微生物丰度和多样性显著相关[1]。因此,研究磷化工区周边农田土壤中微生物群落变化规律,对维持土壤健康、保障粮食安全具有重要意义。
微生物多样性和群落结构的形成受到确定性过程和随机性过程的共同作用,区分两者的贡献度是微生物生态学的研究重点。研究发现,重金属污染使得土壤细菌群落构建过程由随机性过程主导转变为确定性过程主导[4]。土壤微生物群落由大量的低丰度亚群(稀有类群)和少量的高丰度亚群(丰富类群)组成[4-5]。丰富和稀有类群具有不同的生态位特性,受到不同环境因素的影响,对外界胁迫的敏感性也存在差异[6-7]。然而,目前仍缺乏关于重金属污染农田土壤中不同微生物亚群特征的研究,涉及微生物群落构建过程的报道更少。
因此,本研究选取四川省什邡市一处磷化工厂集中区域,沿着该区域盛行风向下方,采集距化工区不同距离的农田土壤样品,利用化学分析方法和高通量测序技术,分析土壤理化性质、重金属含量以及样品中丰富(相对丰度 > 0.1%)和稀有(相对丰度 < 0.01%)细菌亚群的分布特征、群落构建过程和功能特征,以深入了解土壤细菌对重金属胁迫的响应规律,并为磷化工生产的生态安全性评估提供科学依据。
1 材料与方法 1.1 研究区、土样采集及分析研究区位于中国第六大磷矿基地四川省什邡市。该地区属典型的亚热带季风气候,年平均气温16 ℃,年平均降雨量940 mm,主导风向为东北风[8]。详细土壤样品采集方法见已发表文献[9]。简述为:于2019年2月,在磷化工区盛行风向下方布设3条采样线,沿着采样线分别采集距化工区边界墙20(D1)、500(D2)、1 000(D3)、1 500(D4)、2 000(D5)、3 000(D6)和4 000 m(D7)处的农田表层(0 ~ 20 cm)土壤样品。在每个采样点均随机布设3个间距为10 m的样方(10 m×10 m),在每个样方中,随机采取3个土壤样品混合成该样方的代表样品,置于冰盒内带回实验室。采用过2 mm筛的方法去除作物残体和可见石块,将同一采样点的3个样方样品等质量混合作为该样点的代表样品,最终共获得21个土壤样品。样品冷冻干燥后,一部分储存在–20 ℃用于DNA提取和微生物群落分析,另一部分保存在4 ℃用于土壤理化性质分析。本研究分析了土壤样品的pH、全氮(TN)、总有机碳(TOC)和重金属(Cd、Cr、Cu、Zn、Ni和Pb)全量,具体分析方法参见文献[9]。
1.2 土壤DNA提取及扩增子测序使用DNeasy PowerSoil Kits提取试剂盒提取样品基因组DNA (Qiagen,Germany)。利用引物对515F/909R对细菌16S rRNA的V4 ~ V5区进行扩增[10]。扩增产物使用Illumina Miseq平台进行测序。使用Silva v132作为数据库,采用QIIME 1.9.1软件默认参数对获得的序列进行分析,使用UCLUST算法基于97% 序列相似性阈值进行OTU(operational taxonomic unit)聚类。参考Greengenes数据库,采用RDP Classifier软件进行物种注释,阈值设为0.80。利用FAPROTAX预测土壤细菌功能[11],分析细菌的碳氮硫元素循环功能差异。测序数据已上传至美国国家生物技术信息中心,获取号为PRJNA423105。
1.3 数据处理与统计分析通过计算土壤样品中重金属含量与该重金属的生态土壤筛选值(Ecology soil screening limit values,Eco-SSLs)的比值获得其污染指数(Contamination index,Ci),分级标准:Ci < 1,无污染;1 < Ci≤2,轻微污染;2 < Ci≤3,轻度污染;3 < Ci≤5,中度污染;Ci > 5,重度污染。Eco-SSLs参考了农用地土壤污染风险管控标准[12]。为了去除稀有菌群判定过程中的随机效应,reads少于20的OTU被排除在后续分析中[13]。本研究中,将相对丰度高于0.1% 和低于0.01% 的OTU分别定义为丰富类群(Abundant taxa,AT)和稀有类群(Rare taxa,RT)[14]。
使用Excel 2016完成基本数据处理。采用R软件进行主坐标分析(Principal coordinates analysis,PCoA)、冗余分析(Redundancy analysis,RDA)、相关分析(Spearman)和热图绘制。
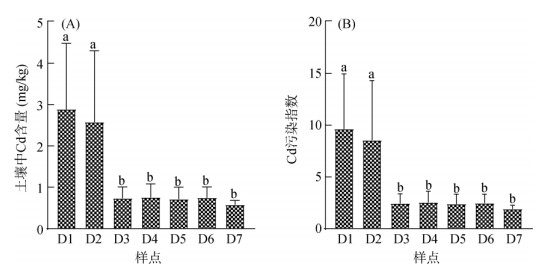
2 结果与分析 2.1 土壤理化性质和重金属污染水平研究区土壤理化性质和重金属含量见文献[9]。整体而言,研究区土壤呈弱酸性(5.69 ~ 6.62),以D1样点pH最高,随采样点距化工区距离增加pH呈先明显下降后略微升高的趋势,而不同样点土壤的TN和TOC含量无显著差异。此外,各样点Cr、Cu、Zn、Ni和Pb含量基本没有差别,且未超过国家风险控制标准[12]。但D1和D2样点的Cd含量虽然没有差别,但显著高于其他样点(图 1A)。进一步分析土壤Cd污染指数,发现研究区所有样本(D1 ~ D7)均受到污染,其中D1和D2两地达到重度污染水平(图 1B)。
|
(图中不同小写字母表示各样点间差异在P < 0.05水平显著;下同) 图 1 不同土壤样品的重金属Cd含量和污染指数 Fig. 1 Cd concentrations and contamination indexes in different soil samples |
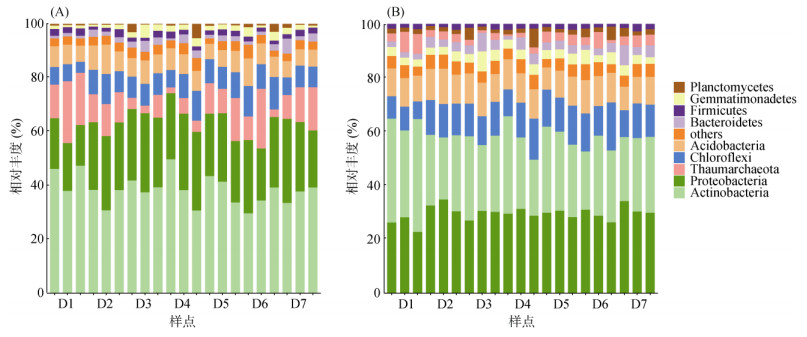
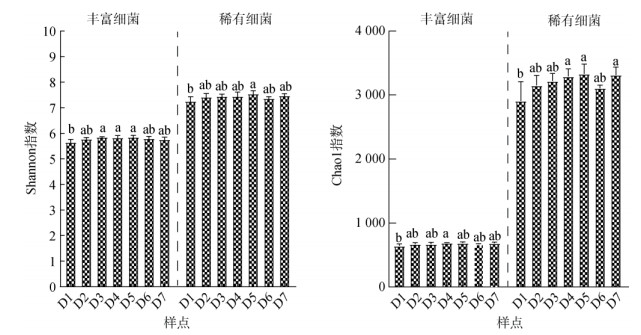
高通量测序结果表明,研究区土壤稀有细菌群落(24种)比丰富细菌群落(16种)包含更多的分类群。门水平上,两类细菌群落丰度组成差异不大,均以放线菌门(Actinobacteria)、变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)为主(图 2)。此外,不同样点土壤丰富和稀有细菌群落的菌门丰度组成均基本没有差别。由图 3可知,稀有细菌群落的多样性(Shannon指数)和丰富度(Chao1指数)均高于丰富细菌群落。相反,两类细菌群落α多样性随采样点距化工区距离的变化并未发生明显变化,但整体呈增加趋势。
|
(图中仅列出了丰度前9位的细菌门,其余菌门被归为others) 图 2 不同土壤样品中丰富(A)和稀有(B)细菌群落门水平相对丰度 Fig. 2 The relative abundance of abundant (A) and rare taxa (B) at the phylum level in different soil samples |
|
图 3 不同土壤样品中丰富和稀有细菌群落的α多样性 Fig. 3 The α diversity of abundant and rare taxa in different soil samples |
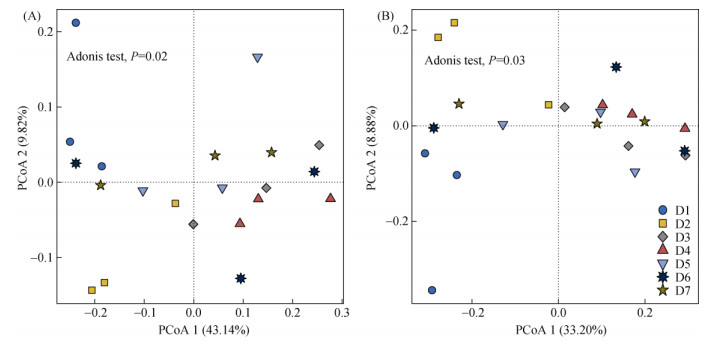
PCoA分析显示,前两轴上分别解释了52.96% 和42.08% 的丰富和稀有细菌群落变化(图 4)。丰富和稀有细菌群落组成的空间变化相似,D1和D2样品在排序图上各自聚集,而其余样品聚成一团。此外,D1和D2样品之间(沿第二排序轴)以及它们与其他样品(沿第一排序轴)之间表现出明显的分离趋势(图 4)。
|
图 4 不同土壤样品中丰富(A)和稀有(B)细菌群落的主坐标分析 Fig. 4 Principal coordinate analyses of abundant (A) and rare taxa (B) bacterial communities in different soil samples |
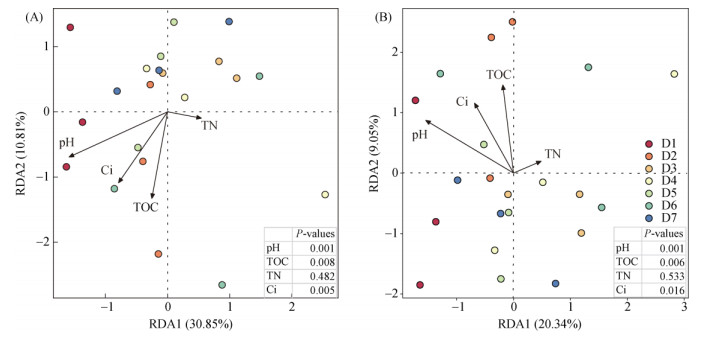
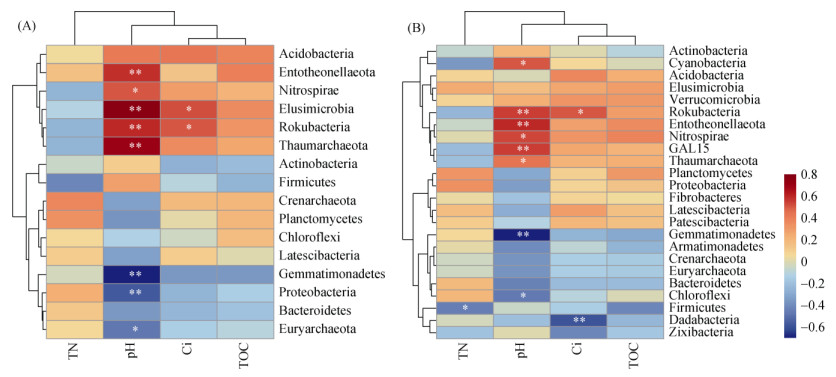
RDA分析结果表明,丰富和稀有细菌群落结构与土壤pH、TOC和Cd污染指数之间具有显著相关性,其中pH是影响D1样品中两种细菌群落的主要因素(图 5)。Spearman相关分析也表明,pH与细菌相对丰度的相关性更强(图 6)。土壤pH分别与5个丰富细菌门和6个稀有细菌门显著正相关,而与3个丰富细菌门和2个稀有细菌门显著负相关。此外,Cd污染指数与丰富细菌中的迷踪菌门(Elusimicrobia),以及两种细菌类群中的棒状杆菌门(Rokubacteria)显著正相关。在稀有细菌群落中,土壤TN和Cd污染指数分别与厚壁菌门(Firmicutes)和达达菌门(Dadabacteria)显著负相关。
|
图 5 丰富(A)和稀有(B)细菌群落结构与土壤理化性质的冗余分析 Fig. 5 Redundancy analyses between abundant (A) and rare taxa (B) bacterial community structures and soil properties |
|
图 6 环境因子与丰富(A)和稀有(B)细菌群落的Spearman相关性分析 Fig. 6 Spearman correlation analyses between environmental factors and abundant (A) and rare taxa (B) |
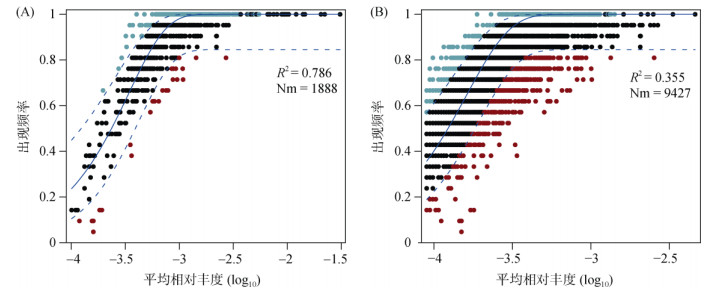
本研究采用中性模型对土壤细菌群落构建过程进行评估。由图 7可知,丰富细菌群落与中性模型的拟合程度很强,大部分OTU在中性模型预测的95% 置信区间内,而稀有细菌群落的情况则相反。在丰富细菌群落形成中,随机性过程比确定性过程的作用更大,而确定性过程则在稀有细菌群落形成中占据主导地位。
|
图 7 农田土壤中丰富(A)和稀有(B)细菌群落的中性模型拟合 Fig. 7 Fit of Neutral model for abundant (A) and rare taxa (B) bacterial communities in agricultural soils |
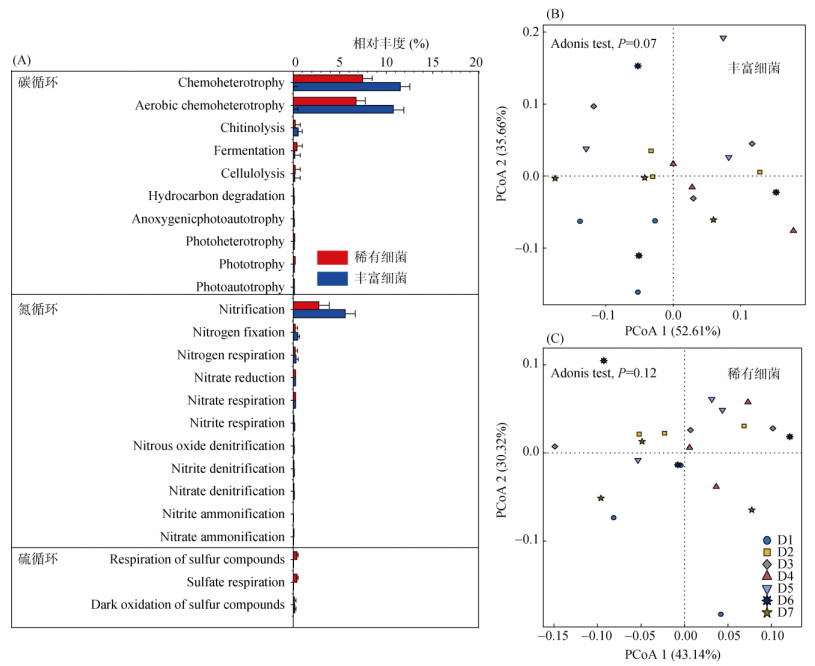
利用FAPROTAX对土壤中细菌群落功能进行预测,研究区土壤丰富和稀有细菌群落中分别发现55和70个细菌功能,其中与碳、氮、硫循环相关的功能分别为18、17和4个(丰富类群),以及19、15和8个(稀有类群)。由图 8A可知,化能异养(Chemoheterotrophy)、好氧化能异养(Aerobic chemoheterotrophy)和硝化作用(Nitrification)是丰富和稀有细菌群落共同的优势功能类型。整体而言,丰富细菌群落中与碳(23.85% vs 15.73%)和氮循环(7.59% vs 4.20%)相关功能总丰度高于稀有细菌群落,而与硫循环相关功能则表现出相反的趋势(0.30% vs 0.93%)。与群落组成相反,PCoA分析结果表明,不同采样点样品中两种细菌亚群的功能组成均不存在显著差异,但可以观察到丰富细菌群落在D1样点与其他样点有明显的分离(图 8B、8C)。
|
图 8 丰富和稀有细菌群落与碳、氮和硫循环相关的功能变化 Fig. 8 Functional changes of abundant and rare taxa bacterial communities associated with carbon, nitrogen and sulfur cycling |
本研究高通量测序结果表明,门水平上,研究区土壤丰富和稀有细菌群落具有相似的丰度组成,放线菌门、变形菌门和绿弯菌门细菌在两者中占主导地位(图 2),这与对山西典型煤炭产业园区周边土壤的研究结果相同[3]。此外,两种细菌亚群还具有类似的空间分布特征。D1和D2样品中两种细菌亚群的α多样性均低于其他样品(图 3),且群落组成与其余样品具有明显差异(图 4),这说明磷化工生产活动改变了周边农田土壤细菌的群落结构。而RDA分析表明,土壤pH和Cd污染水平与两种土壤细菌亚群显著相关(图 5),这也与先前的研究结果一致[1,3]。本研究Spearman相关分析进一步指出,pH是影响细菌群落的关键因素,其作用强度高于Cd污染水平(图 6)。在稻麦轮作的农田中,土壤细菌结构与pH之间的相关性最强[15]。此外,Liu等[3]也发现,磷化工区周边农田土壤中整体细菌群落组成并未受到Cd污染水平差异的明显影响,可能与土壤中较低的Cd含量(0.89 ~ 1.93 mg/kg)有关。
丰富和稀有细菌群落的构建过程反映了生态系统内部复杂的生态动态,这一构建过程受到多种因素的影响[16]。本研究中性模型分析结果显示,丰富细菌群落构建过程表现出较高的随机性,而稀有细菌群落则主要受确定性过程的影响。对造林演替及长期种植小麦和玉米的农田土壤细菌群落构建过程的研究也发现了类似的结果[17]。丰富和稀有细菌群落不同的环境适应能力和生态位宽度可能是导致两者群落组装过程差异的主要原因。两种亚群生态位分化明显,对环境变化的响应可能不同[18-19]。稀有细菌群落的生态位较为狭窄,易受环境过滤作用的影响,而占据广泛生态位的丰富细菌则表现出更强的环境适应性和随机性[4,7]。
本研究发现,土壤稀有细菌群落的α多样性及其所属菌门数量均高于丰富细菌群落,这与前人的研究一致[20-22]。稀有细菌群落作为“种子库”,在维持微生物结构和功能多样性方面起着重要作用[23]。稀有细菌群落较多的分类群说明其可能具有更多的代谢功能,这与FAPROTAX功能预测分析的结果一致。然而,考虑到丰富细菌群落在分类丰度和功能丰度上较大的占比,丰富细菌亚群对发挥相关细菌功能的作用可能更大[24]。细菌组成差异一般会导致细菌功能上的差异[25],与这一预期相反,本研究丰富细菌群落功能组成排序图中的D1样点与其他样点有明显的分离,而各采样点稀有细菌功能组成无明显差异(图 8)。稀有细菌群落较高的物种多样性使得其在物种功能上存在重叠的可能性大大增加,从而具有较高的功能冗余[23]。因此,本研究中稀有细菌群落较高的功能稳定性可能与其高冗余性有关。
4 结论磷化工区周边农田土壤中丰富和稀有细菌群落具有相似的空间分布特征和影响因子。最靠近化工区样品中两种细菌群落的α多样性均低于其他样品,其群落结构也异于后者,但功能组成差异并不显著。土壤pH是影响土壤中细菌群落的最主要因素。两种细菌亚群的功能多样性和群落构建过程存在明显差异。丰富类群的α多样性和功能数量均显著低于稀有类群,它们的群落装配分别主要受到随机性和确定性过程的影响。
| [1] |
Liu H K, Wang C, Xie Y L, et al. Ecological responses of soil microbial abundance and diversity to cadmium and soil properties in farmland around an enterprise-intensive region[J]. Journal of Hazardous Materials, 2020, 392: 122478 DOI:10.1016/j.jhazmat.2020.122478 (  0) 0) |
| [2] |
朱永官, 彭静静, 韦中, 等. 土壤微生物组与土壤健康[J]. 中国科学: 生命科学, 2021, 51(1): 1-11 (  0) 0) |
| [3] |
郑丹凤, 刘娣, 苏超, 等. 典型煤炭产业园区土壤重金属污染对细菌群落结构的影响[J]. 环境科学, 2023, 44(11): 6354-6361 (  0) 0) |
| [4] |
Jia X, Dini-Andreote F, Falcão Salles J. Community assembly processes of the microbial rare biosphere[J]. Trends in Microbiology, 2018, 26(9): 738-747 DOI:10.1016/j.tim.2018.02.011 (  0) 0) |
| [5] |
Ji M K, Kong W D, Stegen J, et al. Distinct assembly mechanisms underlie similar biogeographical patterns of rare and abundant bacteria in Tibetan Plateau grassland soils[J]. Environmental Microbiology, 2020, 22(6): 2261-2272 DOI:10.1111/1462-2920.14993 (  0) 0) |
| [6] |
Xue Y Y, Chen H H, Yang J R, et al. Distinct patterns and processes of abundant and rare eukaryotic plankton communities following a reservoir cyanobacterial bloom[J]. The ISME Journal, 2018, 12(9): 2263-2277 DOI:10.1038/s41396-018-0159-0 (  0) 0) |
| [7] |
Jiang Y L, Song H F, Lei Y B, et al. Distinct co-occurrence patterns and driving forces of rare and abundant bacterial subcommunities following a glacial retreat in the eastern Tibetan Plateau[J]. Biology and Fertility of Soils, 2019, 55(4): 351-364 DOI:10.1007/s00374-019-01355-w (  0) 0) |
| [8] |
Wang M, LI X, HE W Y, et al. Distribution, health risk assessment, and anthropogenic sources of fluoride in farmland soils in phosphate industrial area, southwest China[J]. Environmental Pollution, 2019, 249: 423-433 DOI:10.1016/j.envpol.2019.03.044 (  0) 0) |
| [9] |
Cheng J H, Tang X Y, Guan Z, et al. Occurrence of antibiotic resistome in farmland soils near phosphorus chemical industrial area[J]. Science of the Total Environment, 2021, 796: 149053 DOI:10.1016/j.scitotenv.2021.149053 (  0) 0) |
| [10] |
Cheng J H, Tang X Y, Liu C. Bacterial communities regulate temporal variations of the antibiotic resistome in soil following manure amendment[J]. Environmental Science and Pollution Research, 2021, 28(23): 29241-29252 DOI:10.1007/s11356-021-12746-8 (  0) 0) |
| [11] |
Sansupa C, Wahdan S F M, Hossen S, et al. Can we use functional annotation of prokaryotic taxa (FAPROTAX) to assign the ecological functions of soil bacteria?[J]. Applied Sciences, 2021, 11(2): 688 DOI:10.3390/app11020688 (  0) 0) |
| [12] |
生态环境部, 国家市场监督管理总局. 土壤环境质量农用地土壤污染风险管控标准(试行): GB15618—2018[S]. 北京: 中国标准出版社, 2018.
(  0) 0) |
| [13] |
Jiao S, Lu Y H. Abundant fungi adapt to broader environmental gradients than rare fungi in agricultural fields[J]. Global Change Biology, 2020, 26(8): 4506-4520 DOI:10.1111/gcb.15130 (  0) 0) |
| [14] |
Zheng W, Zhao Z Y, Lv F L, et al. Assembly of abundant and rare bacterial and fungal sub-communities in different soil aggregate sizes in an apple orchard treated with cover crop and fertilizer[J]. Soil Biology and Biochemistry, 2021, 156: 108222 DOI:10.1016/j.soilbio.2021.108222 (  0) 0) |
| [15] |
周聪聪, 于东升, 陆晓松, 等. 县域尺度下样点距离和土壤分类对农田土壤细菌多样性的影响[J]. 土壤学报, 2021, 58(1): 69-81 (  0) 0) |
| [16] |
褚海燕, 冯毛毛, 柳旭, 等. 土壤微生物生物地理学: 国内进展与国际前沿[J]. 土壤学报, 2020, 57(3): 515-529 (  0) 0) |
| [17] |
He Z B, Liu D, Shi Y, et al. Broader environmental adaptation of rare rather than abundant bacteria in reforestation succession soil[J]. Science of the Total Environment, 2022, 828: 154364 DOI:10.1016/j.scitotenv.2022.154364 (  0) 0) |
| [18] |
Jiao S, Chen W M, Wei G H. Biogeography and ecological diversity patterns of rare and abundant bacteria in oil-contaminated soils[J]. Molecular Ecology, 2017, 26(19): 5305-5317 DOI:10.1111/mec.14218 (  0) 0) |
| [19] |
Jiao S, Wang J M, Wei G H, et al. Dominant role of abundant rather than rare bacterial taxa in maintaining agro-soil microbiomes under environmental disturbances[J]. Chemosphere, 2019, 235: 248-259 DOI:10.1016/j.chemosphere.2019.06.174 (  0) 0) |
| [20] |
Zhou Z B, Zhang Y J, Zhang F G. Abundant and rare bacteria possess different diversity and function in crop monoculture and rotation systems across regional farmland[J]. Soil Biology and Biochemistry, 2022, 171: 108742 DOI:10.1016/j.soilbio.2022.108742 (  0) 0) |
| [21] |
Pan C C, Feng Q, Li Y L, et al. Rare soil bacteria are more responsive in desertification restoration than abundant bacteria[J]. Environmental Science and Pollution Research International, 2022, 29(22): 33323-33334 DOI:10.1007/s11356-021-16830-x (  0) 0) |
| [22] |
Jiao S, Luo Y T, Lu M M, et al. Distinct succession patterns of abundant and rare bacteria in temporal microcosms with pollutants[J]. Environmental Pollution, 2017, 225: 497-505 DOI:10.1016/j.envpol.2017.03.015 (  0) 0) |
| [23] |
Liang Y T, Xiao X, Nuccio E E, et al. Differentiation strategies of soil rare and abundant microbial taxa in response to changing climatic regimes[J]. Environmental Microbiology, 2020, 22(4): 1327-1340 DOI:10.1111/1462-2920.14945 (  0) 0) |
| [24] |
Louca S, Polz M F, Mazel F, et al. Function and functional redundancy in microbial systems[J]. Nature Ecology & Evolution, 2018, 2(6): 936-943 (  0) 0) |
| [25] |
喻言, 刘浩, 匡崇婷, 等. 不同园地土壤细菌亚群的结构与功能分异[J]. 土壤, 2023, 55(5): 1035-1043 DOI:10.13758/j.cnki.tr.2023.05.013 (  0) 0) |
2. Key Laboratory of Mountain Surface Processes and Ecological Regulation, Institute of Mountain Hazards and Environment, Chinese Academy of Sciences, Chengdu 610041, China
 2025, Vol. 57
2025, Vol. 57


