2. 青岛市生态环境局胶州分局, 山东青岛 266300
滨海湿地是地球陆地生态系统中重要的“蓝色碳汇”(blue carbon,蓝碳),在全球碳循环和碳收支平衡过程中发挥着重要的作用[1]。然而,目前全球滨海湿地土壤正以每年约0.34 ~ 0.98万hm2的速度退化[2],导致滨海湿地系统“蓝碳”功能和其他生态功能受到了严重威胁。近年来,生物质炭因其在土壤改良和固碳增汇等方面表现出的巨大潜力而受到了广泛关注[3],其在滨海湿地土壤中的应用也开展了许多研究[4]。已有的关于生物质炭在滨海湿地土壤改良/修复中的研究主要关注了不同生物质炭对土壤理化性质[5]、养分循环与利用[6]和植物生长[7]等方面的影响,也有部分研究关注了对土壤有机碳(Soil organic carbon,SOC)的影响。如,Liu等[8]研究了矿物离子改性生物质炭对滨海湿地SOC矿化的影响,发现矿物离子改性生物质炭能够通过改善土壤团聚体特性显著提高SOC的含量和稳定性。但在关于有机碳的研究中,更多的是关注生物质炭添加对SOC矿化及活性组分的影响[9],而缺乏对土壤微生物残体碳(microbial necromass carbon,MNC)影响的研究,生物质炭介导的土壤化学特性和微生物群落的变化对MNC含量影响的过程及机制尚不清楚。MNC被认为是构成土壤中稳定SOC库的重要组成部分,在调节生物地球化学循环中发挥重要作用[10]。因此,加强生物质炭在滨海湿地土壤中应用的研究,能够更加深入和准确地认识生物质炭对滨海湿地SOC的影响过程,进而为更好地应用生物质炭以增强滨海湿地系统“蓝碳”功能提供理论支撑。
城市污水污泥和海洋藻类废弃物(如浒苔)是沿海地区有机废弃物管理的重要对象,如何实现这两类有机废弃物的资源化再利用是沿海城市面临的重大需求[11]。本课题前期的研究证实,以城市污水污泥和其他碳含量高的有机物质为原料共热解能够制备得到性能优良的污泥生物质炭[11]。因此,本研究选取城市污水污泥与浒苔作为生物质炭制备的原料,在不同条件下制备了6种纯污泥、污泥与浒苔共热解、海藻酸钠改性污泥与浒苔共热解生物质炭,并通过开展为期100 d的室内土壤培养试验,基于对土壤基本化学性质、SOC和MNC含量、微生物群落等指标的测定,结合方差分析、相关性分析、线性回归分析和偏最小二乘–路径分析等方法,探究了不同污泥生物质炭添加对SOC和MNC含量的影响及其内在机制。
1 材料与方法 1.1 供试土壤采集及生物质炭样品制备供试土壤取自山东省青岛市胶州湾洋河口(36°7′N,120°5′E),采样深度为0 ~ 20 cm。采集的土壤带回实验室后,剔除明显的砂砾、植物和其他垃圾残体后在自然条件下风干,均质化并过2 mm筛,取一部分用于测定土壤基本化学性质(表 1),剩余部分用自封袋抽真空保存备用。
|
|
表 1 供试土壤和生物质炭样品的基本性质 Table 1 Basic properties of tested soil and biochar samples |
供试生物质炭的原料为市政生活污水污泥(取自山东省青岛市麦岛污水处理厂)和浒苔(取自青岛海边)。将收集的原料适当处理之后,污泥和浒苔按照不同的质量比(1∶0、1∶1)混合后在低(300 ℃)、高(700 ℃)两个热解温度下,使用真空管式炉进行热解,具体方法见Yin等[11]的研究。另外,为了使污泥和浒苔在热解过程中更好结合,提高污泥生物质炭的比表面积,在污泥与浒苔质量比为1∶1混合原料中另添加3%(m/m)的海藻酸钠溶液,充分混合静置1 h后在60 ℃烘箱中烘干,待降至室温后热解。本研究最终得到6种不同条件下制备的污泥生物质炭:纯污泥生物质炭(污泥与浒苔质量比为1∶0)(SSB3和SSB7)、污泥‒浒苔生物质炭(污泥与浒苔质量比为1∶1)(SEB3和SEB7)和海藻酸钠改性污泥–浒苔生物质炭(污泥与浒苔质量比为1∶1,外加3% 海藻酸钠)(SA-SEB3和SA-SEB7)。命名中的“3”和“7”分别代表热解温度300 ℃和700 ℃。所有供试生物质炭过0.2 mm筛,自封袋真空保存备用。利用元素分析仪(VARIO EL Ⅲ,Elementar,Germany)测定污泥生物质炭的元素组成(C、H、N和S),使用常规方法测定污泥生物质炭的pH、电导率(EC)、阳离子交换量(CEC)[11],使用比表面积分析仪(ASAP 2460,Micromeritics,USA)测定污泥生物质炭比表面积(SSA)。生物质炭的基本性质详见表 1。
1.2 土壤培养试验土壤培养试验中共设计7个处理,包括无污泥生物质炭添加对照(CK)和6个污泥生物质炭添加处理(添加量土壤质量的为3%),分别记作SSB3、SSB7、SEB3、SEB7、SA-SEB3和SA-SEB7。为了恢复微生物活性,在添加污泥生物质炭之前先将供试土壤预培养2周[12]。土壤培养在棕色培养瓶中进行,每瓶含1 kg土壤和30 g污泥生物质炭,培养环境温度为25 ℃ ± 2℃,培养期为100 d。培养过程中,采用称重法保持土壤含水率在田间持水量的60%。每个处理设3个平行。在培养开始后第9天(该时间CO2排放速率达到峰值,表明微生物最为活跃)和第100天(培养结束)时对土壤进行取样,测定土壤基本化学性质、氨基糖含量和微生物群落磷脂脂肪酸(PLFA)含量。
1.3 测定指标与方法 1.3.1 土壤特性指标测定使用常规方法[12]测定土壤pH、氧化还原电位(Eh)、EC和CEC。SOC含量采用重铬酸钾氧化硫酸亚铁滴定法测定[12],土壤全碳(TC)、全氮(TN)采用元素分析仪测定,土壤铵态氮(NH4+-N)和硝态氮(NO3–-N)分别采用靛酚蓝比色法和紫外分光光度法测定[12]。
1.3.2 土壤氨基糖测定根据Wang等[13]的方法对土壤氨基糖进行提取和分析,具体方法为:称取0.5 g土壤,用6 mol/L盐酸在105℃下水解8 h后过滤,调节滤液pH为6.60 ~ 6.80,将其离心以沉淀金属离子;利用冷冻干燥机冻干上清液后,使用无水甲醇将其溶解;利用衍生试剂和乙酸酐使其转化为衍生物,用氯仿进行萃取;萃取后,溶液过0.22 μm滤膜,使用高效液相色谱仪(LC-20A,Shimadzu,Japan)检测。
本研究对氨基葡萄糖(glucosamine,GluN)、氨基半乳糖(galactosamine,GalN)和胞壁酸(muramic acid,MurA)进行了定量测定。根据微生物细胞壁中氨基葡萄糖和胞壁酸估算土壤真菌残体碳(fungal necromass carbon,F-MNC)、细菌残体碳(germ necromass carbon,G-MNC)和总微生物残体碳(T-MNC)含量(公式(1)~(3))。
| $ {\text{F}} - {\text{MNC}} = \left( {\frac{{{C_{{\text{GluN}}}}}}{{179.17}} - 2 \times \frac{{{C_{{\text{MurA}}}}}}{{251.23}}} \right) \times 179.17 \times 9 $ | (1) |
| $ {\text{G}} - {\text{MNC}} = {C_{{\text{MurA}}}} \times 45 $ | (2) |
| $ {\text{T}} - {\text{MNC}} = {\text{G}} - {\text{MNC}} + {\text{F}} - {\text{MNC}} $ | (3) |
式(1)中:CGluN和CMurA分别表示GluN和MurA的含量;9是利用GluN计算真菌残体碳的转换系数;179.17和251.23分别是GluN和MurA的分子量。式(2)中:45是利用MurA计算细菌残体碳的转换系数[13]。
1.3.3 土壤微生物分析土壤微生物含量和群落结构分析采用磷脂脂肪酸(PLFA)法。依据Ma等[14]方法:取3 g土壤于35 mL离心管中,加入15 mL 0.2 mol/L甲醇化的KOH,混匀后,在37 ℃下培养1 h。培养过程中,每10 min漩涡1次,培养结束后,加入3 mL 1 mol/L冰醋酸,中和调节管内混合液的pH。随后加入10 mL正己烷,离心15 min,将正己烷层转移至干净试管,使用N2吹干并溶解于0.5 mL正己烷与甲基叔丁基醚混合溶液(二者体积比为1∶1)后,转移到色谱管中,使用气相色谱仪(7890B,Agilent,USA)搭载火焰离子检测器(GC-FID)进行分析。再根据Ma等[14]的方法,分别表征细菌、真菌、放线菌、革兰氏阳性菌(G+)、革兰氏阴性菌(G-)和总微生物数量。
1.4 数据处理与统计分析所有测定的土壤和生物质炭特性,以及SOC、MNC和PLFA含量等指标均使用单因素方差分析(one-way ANOVA)计算均值和标准差,邓肯检验检测同一时间不同处理之间或同一处理不同观测时间之间差异的显著性,显著性水平为P < 0.05和P < 0.01。使用Pearson相关性分析探究土壤特性、生物质炭特性与微生物指标,以及MNC含量指标与微生物指标之间的关系,并对其进行线性回归分析。使用偏最小二乘–路径建模(PLS-SEM)对土壤化学特性、微生物指标和MNC含量之间的因果关系进行分析。使用SPSS 23.0进行数据处理和统计分析,使用OriginPro 2021软件进行图形绘制。
2 结果与讨论 2.1 土壤基本性质的变化培养100 d后对土壤基本化学性质进行测定,其结果如表 2所示。污泥生物质炭添加显著提高了土壤CEC值,这归结于污泥生物质炭自身较高的CEC值(表 1)。虽然,污泥生物质炭的pH普遍高于初始土壤(表 1),但是培养结束后,各污泥生物质炭处理土壤的pH与CK处理相比无显著性变化。土壤EC值的变化和pH一致。从土壤Eh值的变化来看,高温热解污泥生物质炭显著增加了土壤Eh值,而低温热解污泥生物质炭中的SA-SEB3显著降低了土壤Eh值。土壤Eh值作为反映土壤氧化还原特性的指标,与土壤易分解有机质及微生物含量呈负相关[15]。高温热解污泥生物质炭处理土壤Eh值较CK处理显著增加,表明其土壤中易分解有机质含量较低,从而导致微生物生长受到限制,而SA-SEB3处理则相反。生物质炭是一种具有高稳定性的碳质材料[15],因此所有污泥生物质炭处理都显著增加了土壤的TC含量(增加约118% ~ 183%),其中,高温污泥‒浒苔共热解生物质炭(SEB7和SA-SEB7)处理增加的程度最高,这与其较高的碳含量(表 1)和稳定性密切相关[15]。同样地,由于污泥生物质炭中TN含量(13.21 ~ 18.14 g/kg)远高于初始土壤(6.13 g/kg),因此所有污泥生物质炭添加处理均显著提高了土壤的氮含量。与TC和TN含量的变化对应,各污泥生物质炭添加处理均显著提高了土壤C/N比值。C/N比值提高,能够抑制土壤中微生物的分解矿化作用,继而增强SOC在土壤中的固存作用[16]。培养100 d后,虽然所有污泥生物质炭处理(除SSB7处理外)均表现出增加土壤NH4+-N含量的趋势,但仅低温热解污泥生物质炭处理(如SSB3、SEB3和SA-SEB3)与CK处理之间存在显著性差异。对于NO3–-N含量,除SEB3和SEB7处理外,其他所有污泥生物质炭处理均显著增加了土壤NO3–-N含量。上述结果表明,污泥生物质炭(尤其是低温热解污泥生物质炭)对土壤无机氮含量具有积极的提升作用,这有利于提高土壤肥力。生物质炭的C/N比值决定了其是否会引发土壤氮固定化或矿化,当比值低于20时,土壤极易发生有机氮矿化[16],进而导致土壤中NH4+-N和NO3–-N含量的增加。本研究所使用的污泥生物质炭的C/N比值在6.54 ~ 11.91范围内,污泥生物质炭可能会通过促进土壤中有机氮的矿化提高NH4+-N和NO3–-N的含量。
|
|
表 2 培养结束时各处理土壤的基本化学性质 Table 2 Basic chemical properties of soils under different treatments at the end of incubation |
培养结束时,对土壤SOC含量进行测定,结果如图 1A所示。污泥生物质炭添加处理显著增加了土壤中SOC的含量,最大的贡献是源于污泥生物质炭自身稳定有机碳的输入[16]。值得注意的是,虽然SA-SEB7处理的TC含量并不是所有污泥生物质炭中最高的(表 1),但是其对SOC增加的程度最为显著(288%)。这表明,污泥生物质炭除本身对SOC含量的贡献外,还会通过影响本底SOC的周转来影响最终SOC的含量[15]。
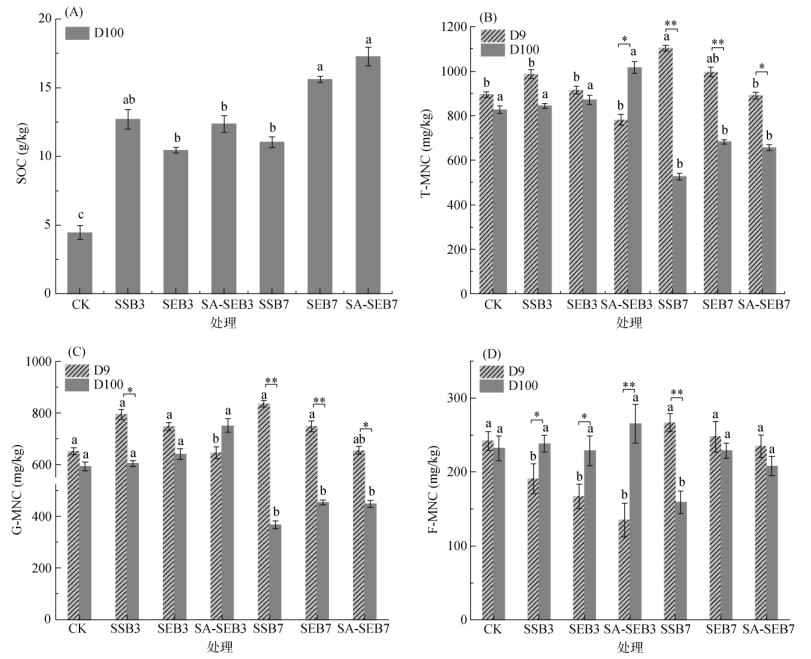
|
(图中不同小写字母表示同一时间不同处理间差异显著(P < 0.05);*(P < 0.05)和**(P < 0.01)表示同一处理在第9天和第100天时差异显著;不同) 图 1 各处理第100天时的土壤SOC含量(A)以及第9天(D9)和第100天(D100)时的T-MNC(B)、G-MNC(C)和F-MNC(D)含量 Fig. 1 SOC contents measured on the 100th day(A), and T-MNC (B), G-MNC (C) and (F-MNC (D) observed on the 9th (D9) and 100th (D100) day under different treatments |
在培养第9天和第100天时测定土壤T-MNC、G-MNC和F-MNC含量,其结果如图 1B ~ 1D所示。在培养第9天时,各污泥生物质炭添加处理对土壤T-MNC含量的影响较小,仅SSB7处理显著增加了T-MNC的含量(图 1B)。然而,在培养第100天时,所有高温热解污泥生物质炭处理均显著降低了T-MNC含量,而低温热解污泥生物质炭处理略提高T-MNC含量,但变化不显著。比较前后两个观测时间点,T-MNC含量随时间的变化规律为:在CK、SSB3、SEB3、SSB7、SEB7和SA-SEB7处理中呈下降趋势,而在SA-SEB3处理中呈上升趋势。与T-MNC含量变化相似,在培养第9天时,大部分污泥生物质炭处理对G-MNC含量的影响不显著,而低温热解污泥生物质炭处理则显著降低了F-MNC含量(图 1C和1D)。在培养第100天时,G-MNC含量在高温热解污泥生物质炭处理中较CK处理中显著降低,而在低温热解污泥生物质炭处理中较CK处理中略有增加(图 1B)。对F-MNC含量,培养第100天时,仅SSB7处理显著降低了该指标(图 1C)。结合图 1B ~ 1D的结果来看,高温热解污泥生物质炭处理均对MNC的积累具有降低作用,而低温热解污泥生物质炭处理则提高MNC的累积,但作用效果不显著。总体上,对比前后两个观测时间点,T-MNC含量的变化仅在SA-SEB3处理中显示MNC随培养时间呈积累的结果,这与先前的研究结果一致[17]。如Zhang等[17]研究表明,玉米秸秆生物质炭的添加刺激微生物的活性,提高了MNC含量。但是,除SA-SEB3处理外,其他所有污泥生物质炭处理均表现出降低T-MNC累积的作用效果,这可能与新产生的MNC再利用有关。在生物质炭添加初期,随生物质炭新引入的可利用性碳源增加,促进了微生物的生长[15],进而提高了T-MNC的含量(如培养第9天时,图 1B)。当土壤中可利用性碳源减少,生物质炭添加导致土壤C/N比值提高,从而诱导微生物利用新生成的MNC以获取其生长所必需的氮[18]。Kaiser等[19]研究表明,当提高底物的C/N比值时,土壤中的微生物会加速对MNC中氮的再循环,促进MNC的再利用。
进一步对F-MNC和G-MNC的比值进行了计算与分析,结果如图 2所示。图 2中的结果清楚地显示了在培养第9天时,F-MNC/G-MNC比值在污泥生物质炭处理中较CK处理中均呈下降趋势(降低了3.26% ~ 43.71%),但显著性的变化仅在3种低温热解污泥生物质炭处理中观测到。与此相反,在培养第100天时,除SEB3和SA-SEB3处理外,其他污泥生物质炭处理中的F-MNC/G-MNC比值均高于CK处理,但无显著性差异。通过比较F-MNC/G-MNC比值随培养时间(从培养第9天到第100天)的变化发现:该比值在CK处理中未发生显著变化,但在所有污泥生物质炭处理中均显著提高,其中以SEB7处理的提高程度最大(17.32%)。与G-MNC相比,F-MNC的可分解性较低,是通过与矿物结合而形成稳定碳库(MAOC)的重要来源[19]。因此,污泥生物质炭添加导致F-MNC占比的提高有利于增强土壤固碳潜力和稳定性[20]。
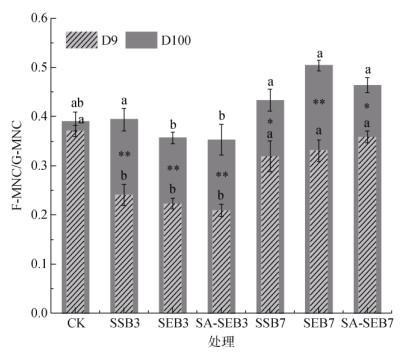
|
图 2 各处理培养第9天和第100天时的F-MNC/G-MNC比值 Fig. 2 Ratios of F-MNC/G-MNC observed on the 9th and 100th day under different treatments |
细菌、真菌和总PLFA的含量以及微生物群落结构在培养第9天和第100天的观测结果如图 3所示。培养第9天时,各污泥生物质炭处理中的真菌含量与CK处理相比变化不显著;但在培养第100天时,低温热解污泥生物质炭处理中的真菌含量显著高于CK处理和高温热解污泥生物质炭处理(图 3A)。比较前后两个观测时间点,低温热解污泥生物质炭处理中的真菌含量随培养时间增加而显著增加,而其在高温热解污泥生物质炭处理中则呈现相反的变化结果。与CK处理相比,在培养第9天时,除SA-SEB3处理显著降低细菌含量外,其他所有污泥生物质炭处理均显著提高了细菌含量(图 3B);而在培养第100天时,仅SA-SEB3处理表现出显著提高细菌含量的结果。随着培养时间的增加(从培养第9天到第100天),细菌含量在CK、SSB3和SEB3处理中未发生显著性变化,而在SA-SEB3处理中显著增加,在3种高温热解污泥生物质炭处理中显著降低。上述结果表明,低温热解污泥生物质炭总体上对真菌和细菌表现出积极的促进效应,这可能与其较高的溶解性有机质含量相关[21];而高温热解污泥生物质炭则对真菌和细菌具有不利影响,这可能与高温热解污泥生物质炭中含有某些抑制微生物活性的有毒化合物(如苯、甲氧基苯酚多环芳烃等)有关,且热解温度越高,生物质炭中毒性化合物的含量越高[22]。
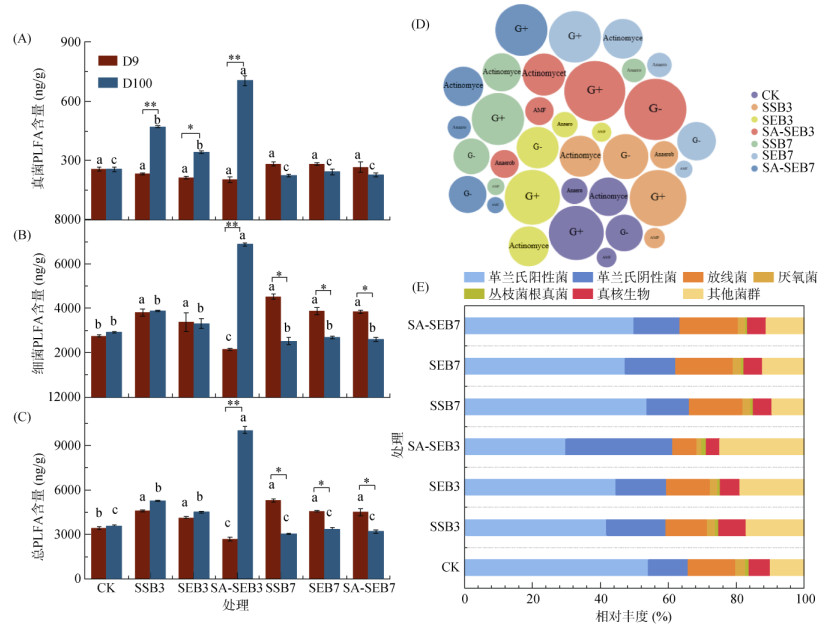
|
图 3 各处理土壤在培养第9天和第100天时的细菌(A)、真菌(B)和总PLFA(C)含量以及第100天时的优势微生物种群(D)和微生物群落结构(E) Fig. 3 Contents of bacteria (A), fungi (B), and total PLFAs (C) observed on the 9th (D9) and 100th (D100) days and dominant microbial taxa (D) and microbial community structure (E) detected on the 100th day in the soils under different treatments |
与真菌和细菌含量的变化相对应,培养第9天时,除SA-SEB3处理显著降低总PLFA含量外,其他污泥生物质炭处理均显著提高了总PLFA含量;在培养第100天时,低温热解污泥生物质炭处理中的总PLFA含量较CK处理显著增加,而高温热解生物质炭处理总PLFA含量略有降低但并不显著(图 3C)。此外,部分低温热解污泥生物质炭处理的总PLFA含量在培养第9天和第100天时差异不显著,仅在SA-SEB3处理中发现总PLFA含量随培养时间的增加而显著提高,而在所有高温热解污泥生物质炭处理中总PLFA含量随培养时间的增加而显著减少(图 3C)。高温热解污泥生物质炭处理导致的土壤总PLFA含量呈现降低的趋势,可能是因为高温热解污泥生物质炭具有较大的比表面积(表 1),能够更多地吸附土壤有机物,进而降低了土壤有机质的生物可利用性[23]。此外,有研究表明,生物质炭对N-酰基高丝氨酸内酯等信号分子存在较强的吸附或水解作用,这将会抑制多种G+ 通过N-3-氧代十二烷基-1-高丝氨酸内酯信号分子调节种内交流[24],从而降低土壤中G+总量,进而表现为微生物总量减少。
为了考察微生物群落结构的变化,进一步比较了不同处理中G+、G-、放线菌、厌氧菌和丛枝菌根真菌的含量及其占总PLFA的比例。从图 3D和3E可知,G+ 是所有处理中的优势种群,占微生物总数的29.32% ~ 54.01%,其次是G-,占微生物总数的11.73% ~ 30.86%。此外,放线菌在各处理中也占比较大,除SA-SEB3处理外,其占微生物总数的比重均超过12.06%。具体而言,G+占微生物总量的比重在所有污泥生物质炭处理中均较CK处理略有下降,其中以3种低温热解污泥生物质炭处理的下降幅度更为显著,SA-SEB3处理表现出最大的降幅(24.12%)。与G+比重下降对应,所有污泥生物质炭处理中G-和其他微生物种群的比重增加(图 3E)。在3种高温热解生物质炭处理中观测到的放线菌比重显著增加,其在SA-SEB7处理中较SA-SEB3处理中增加10.37%。放线菌能够通过分泌蛋白质促进土壤团聚体的形成,增强土壤的稳定性,对SOC的积累具有积极的作用[24]。因此,SA-SEB7表现出更大的提高放线菌含量的结果与其最大地提高SOC含量(图 1A)的结果一致。
为了进一步对微生物群落变化进行分析,对G+/G-比值和真菌/细菌(F/G)比值进行了计算与分析。如图 4所示,G+/G-比值在各污泥生物质炭处理中较CK处理(4.60)降低了0.29 ~ 3.65个单位,而F/G比值在各污泥生物质炭处理中较CK处理(0.087)提高了0.002 ~ 0.034个单位,类似的结果在之前的研究中也有报道[25]。真菌为主的群落可以提高碳的利用效率[26],因此F/G比值的增加可能会减少碳的流失。此外,G+/G-比值较高时往往对SOC的矿化具有正激发效应,能增强SOC的矿化[26]。
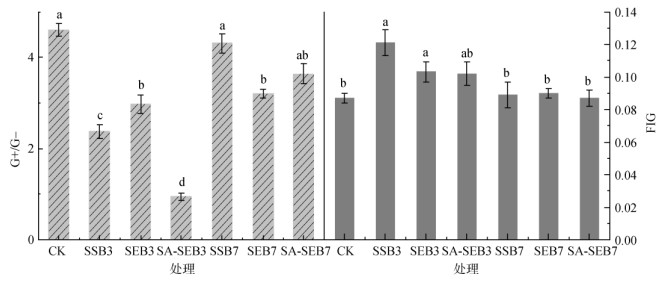
|
图 4 各处理在培养第100天时的G+/G-比值(A)和F/G比值(B) Fig. 4 Ratios of G+/G- (A) and F/G (B) calculated on the 100th day under different treatments |
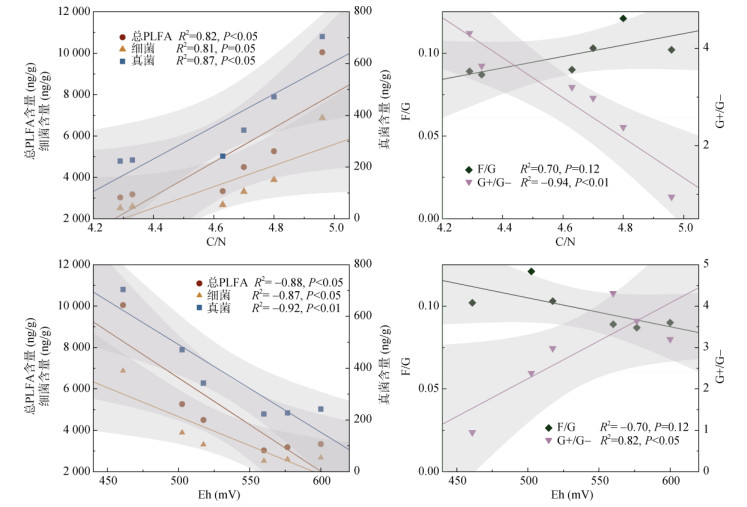
为深入分析污泥生物质炭添加及其介导的土壤化学特性变化对微生物含量的影响,对污泥生物质炭特性指标(pH、EC、CEC、SSA)、培养100 d后土壤化学指标(pH、EC、CEC、Eh、C/N、NH4+-N、NO3–-N)与微生物指标(总PLFA、细菌和真菌PLFA含量、G+/G-和F/G比值)进行了线性回归分析,结果表明除土壤指标C/N和Eh外,其他指标与微生物指标之间未见显著性关系(相关结果未在本文中给出)。如图 5所示,总PLFA、细菌和真菌含量与土壤C/N、Eh之间均呈显著线性关系(P < 0.05)。其中,土壤C/N与微生物含量呈正相关,而Eh与微生物含量呈负相关。此外,G+/G-比值也与土壤C/N和Eh分别呈显著正相关或负相关,但F/G比值与这两个指标相关性并不显著,这与之前的研究结果一致[27]。Eh作为反映土壤氧化还原状况的指标,数值越小代表土壤中易分解有机质越多,微生物活动越剧烈[18]。添加高温热解污泥生物质炭后,虽然在短期内提供了部分可利用性碳源,促进了微生物数量的增加,但随着可利用性碳源被消耗殆尽,剩余的高度稳定的碳难以被微生物所利用,因而在培养第100天时,土壤中微生物含量显著低于培养第9天时。同时,培养结束时,高温热解污泥生物质炭处理下Eh的显著增加也验证了土壤中易分解有机质含量显著降低。
|
(图中阴影部分表示数据拟合95% 置信区间;下同) 图 5 微生物指标(总PLFA含量、细菌含量、真菌含量、G+/G-、F/G)与土壤化学性质(C/N、Eh)之间的线性回归分析 Fig. 5 Linear-regression analyses of microbial indicators (contents of total PLFAs, bacteria, fungus, and ratios of G+/G-, F/G) and soil chemical properties (C/N and Eh) |
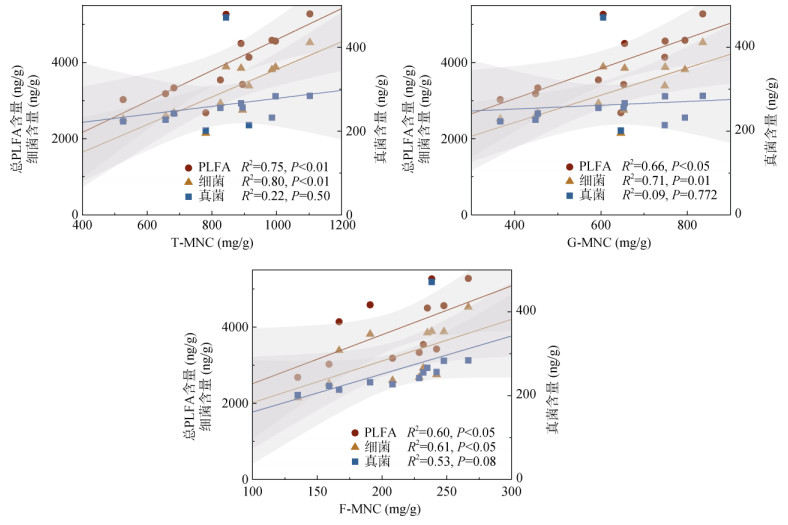
上文结果显示,不同热解温度制备的污泥生物质炭对MNC含量的影响表现出明显的差异(图 1),这与不同污泥生物质炭介导的土壤微生物群落变化密切相关[27]。因此,进一步对各MNC指标(包括T-MNC、G-MNC、F-MNC)和微生物群落指标(总PLFA含量、细菌含量、真菌含量)之间的关系进行分析。如图 6所示,除真菌含量外,总PLFA和3个MNC含量指标(T-MNC、G-MNC、F-MNC)之间均表现出显著的正相关关系,表明微生物的生物量能够直接影响土壤中MNC的积累[27],这与之前相关研究的结果一致[28]。分别从细菌或真菌与MNC指标之间的关系来看,细菌含量与3个MNC含量指标均呈显著正相关关系,但真菌含量与MNC含量指标之间的相关性不显著,这一结果支持了细菌是MNC的主要贡献者,而真菌对MNC积累的贡献较小[29]。
|
图 6 T-MNC、G-MNC、F-MNC含量和总PLFA、细菌、真菌含量之间的线性回归分析 Fig. 6 Linear-regression analysis of contents of T-MNC, G-MNC, and F-MNC and contents of total PLFAs, bacteria, and fungus |
所有污泥生物质炭添加处理均提高了G-的相对丰度(特别是SA-SEB3处理,图 3E),该类细菌是r-策略菌中的主要菌种[30]。同时,高温热解污泥生物质炭处理增加了放线菌(一种重要的K-策略菌群)的相对丰度,而低温热解污泥生物质炭处理则表现出相反的结果(图 3E)。有研究发现,r-策略菌群所产生的MNC能够为K-策略微生物提供一个更容易获取的氮来源[30]。因此,当污泥生物质炭添加导致土壤的C/N比值显著提高时(表 2),使得放线菌更易通过利用r-策略菌群产生的MNC为自身提供生长所需的氮[30],最终导致新生成的MNC再利用。
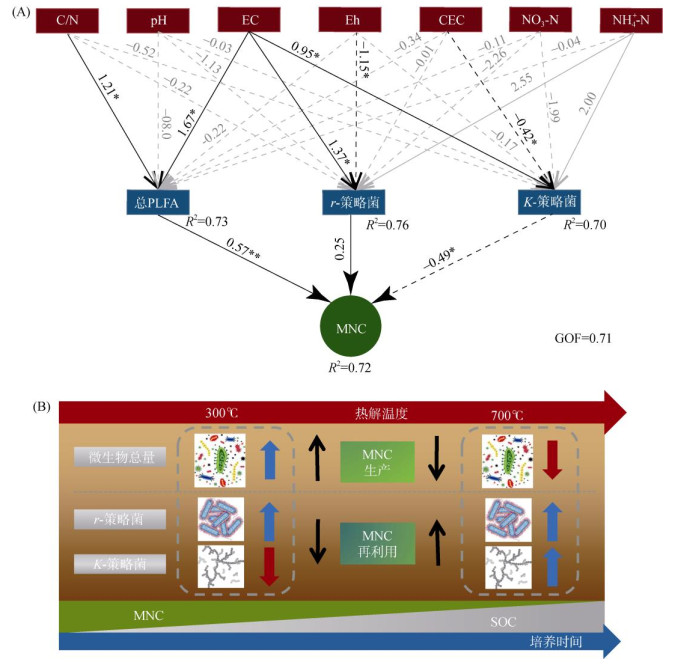
2.5 污泥生物质炭影响微生物残体碳累积的微生物机制利用PLS-SEM进一步分析土壤基本化学特性、微生物指标等对MNC的作用关系,结果(图 7A)显示,PLFA总量和K-策略菌相对丰度分别对MNC含量具有显著的正向和负向影响,而r-策略菌相对丰度虽然对MNC含量表现出正向影响,但是影响不显著。这一结果进一步证实污泥生物质炭添加主要通过影响微生物总量和K-策略菌相对丰度,进而影响MNC含量。从土壤特性来看,C/N、EC、Eh和CEC分别对微生物总量和不同策略菌群具有不同方向的显著影响。具体而言,C/N和EC对PLFA总量表现出显著的正向影响,同时EC对r-策略菌和K-策略菌相对丰度也具有显著的正向影响;Eh和CEC分别对r-策略菌和K-策略菌相对丰度表现出显著的负向影响。基于上述结果,不同热解温度的污泥生物质炭对MNC含量影响的主要机制如图 7B所示:低温热解污泥生物质炭通过提高微生物总量(促进新MNC的生成),且降低K-策略菌相对丰度(减少MNC的再利用),进而增加土壤中MNC的累积;而高温热解污泥生物质炭则通过不显著地影响(甚至略有降低)微生物总量(减少新MNC的生成),而提高r-策略菌相对丰度(增加MNC的再利用),进而减少MNC的累积。此外,由于不同热解温度污泥生物质炭对土壤关键特性(C/N、EC、Eh和CEC)影响的差异不显著(表 2),因此,它们介导的土壤特性变化对微生物的影响,进而对MNC含量影响的过程与机制仍需要进一步研究。
|
(图A中线上方的数值表示路径系数;黑色实线和虚线分别表示P < 0.05的正路径系数和负路径系数,灰色实线和虚线分别表示P > 0.05的正路径系数和负路径系数(*和**分别表示在P < 0.05和P < 0.01水平显著);R2和GOF值表示模型的拟合度和解释方差) 图 7 土壤化学特性、微生物指标对MNC含量影响的PLS-SEM路径分析(A)及污泥生物质炭对MNC含量影响机制图解(B) Fig. 7 Effects of soil chemical and microbial indicators on MNC content analyzing by PLS-SEM (A) and schematic diagram of the mechanism of sludge biochars addition on soil MNC (B) |
1) 污泥生物质炭显著提高了滨海湿地土壤的SOC含量,其中SA-SEB7的提高潜力最为显著。因此,使用污泥‒浒苔共热解生物质炭修复滨海湿地土壤对增强滨海湿地土壤的“碳汇”功能具有积极的意义。
2) 低温条件下制备的污泥生物质炭对MNC含量的影响不显著,而高温条件下制备的污泥生物质炭显著降低了MNC含量,表明高温污泥生物质炭的添加不利于MNC的积累。
3) 与CK处理相比,PLFA总量在高温热解污泥生物质炭处理中未发生显著变化,但在低温热解污泥生物质炭处理中显著提高,表明高温热解污泥生物质炭对MNC产生量影响较小,而低温热解污泥生物质炭可能促进MNC生产。
4) 高温热解污泥生物质炭(特别是SA-SEB7)添加提高土壤中放线菌等K-策略菌群的占比,而降低革兰氏阴性菌等r-策略菌群的占比。K-策略菌群能够利用r-策略菌群产生的MNC作为自身生长所需,导致新生成MNC的再利用。此外,放线菌还能够通过分泌蛋白质促进土壤团聚体的形成,增强土壤的稳定性,这将更有利于滨海湿地SOC的稳定固存。
| [1] |
Martinetto P, Alberti J, Becherucci M E, et al. The blue carbon of southern southwest Atlantic salt marshes and their biotic and abiotic drivers[J]. Nature Communications, 2023, 14: 8500 DOI:10.1038/s41467-023-44196-w (  0) 0) |
| [2] |
Wang X X, Xiao X M, Xu X, et al. Rebound in China's coastal wetlands following conservation and restoration[J]. Nature Sustainability, 2021, 4: 1076-1083 DOI:10.1038/s41893-021-00793-5 (  0) 0) |
| [3] |
Cowie A L. Biochar as a fast track to net zero[J]. Nature Food, 2023, 4(3): 203-204 DOI:10.1038/s43016-023-00714-z (  0) 0) |
| [4] |
Luo X X, Chen W J, Liu Q, et al. Corn straw biochar addition elevated phosphorus availability in a coastal salt-affected soil under the conditions of different halophyte litter input and moisture contents[J]. Science of the Total Environment, 2024, 908: 168355 DOI:10.1016/j.scitotenv.2023.168355 (  0) 0) |
| [5] |
An X, Liu Q, Pan F X, et al. Research advances in the impacts of biochar on the physicochemical properties and microbial communities of saline soils[J]. Sustainability, 2023, 15(19): 14439 DOI:10.3390/su151914439 (  0) 0) |
| [6] |
卢孟雅, 丁雪丽. 稻田土壤微生物残体积累对外源秸秆输入的响应研究进展[J]. 土壤, 2024, 56(1): 10-18 (  0) 0) |
| [7] |
Ashraf F, Chen Y Y. Synergistic effects of biochar and arbuscular mycorrhizal fungi on enhancing Elymus elymoides growth in saline coastal soil[J]. Pakistan Journal of Botany, 2023, 55: 119-126 (  0) 0) |
| [8] |
Liu S H, Kong F L, Li Y, et al. Mineral-ions modified biochars enhance the stability of soil aggregate and soil carbon sequestration in a coastal wetland soil[J]. CATENA, 2020, 193: 104618 DOI:10.1016/j.catena.2020.104618 (  0) 0) |
| [9] |
Ren T T, Liao J H, Delgado-Baquerizo M, et al. Organic fertilization promotes the accumulation of soil particulate organic carbon in a 9-year plantation experiment[J]. Land Degradation & Development, 2023, 34(15): 4741-4750 (  0) 0) |
| [10] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578-3590 DOI:10.1111/gcb.14781 (  0) 0) |
| [11] |
Yin X W, Xi M, Li Y, et al. Improvements in physicochemical and nutrient properties of sewage sludge biochar by the co-pyrolysis with organic additives[J]. Science of the Total Environment, 2021, 779: 146565 DOI:10.1016/j.scitotenv.2021.146565 (  0) 0) |
| [12] |
Wang X J, Kong F L, Li Y, et al. Effect of simulated tidal cycle on DOM, nitrogen and phosphorus release from sediment in Dagu River-Jiaozhou Bay estuary[J]. Science of the Total Environment, 2021, 783: 147158 DOI:10.1016/j.scitotenv.2021.147158 (  0) 0) |
| [13] |
Wang B R, Huang Y M, Li N, et al. Initial soil formation by biocrusts: Nitrogen demand and clay protection control microbial necromass accrual and recycling[J]. Soil Biology and Biochemistry, 2022, 167: 108607 DOI:10.1016/j.soilbio.2022.108607 (  0) 0) |
| [14] |
Ma Q X, Wen Y, Wang D Y, et al. Farmyard manure applications stimulate soil carbon and nitrogen cycling by boosting microbial biomass rather than changing its community composition[J]. Soil Biology and Biochemistry, 2020, 144: 107760 DOI:10.1016/j.soilbio.2020.107760 (  0) 0) |
| [15] |
王钰皓, 庞津雯, 卫婷, 等. 旱作农田覆膜和秸秆碳投入对土壤团聚特性及作物产量的影响[J]. 土壤学报, 2024, 61(1): 272-284 (  0) 0) |
| [16] |
李毅, 梁嘉平, 王小芳, 等. 改善土壤理化性质和作物出苗率的最佳生物质炭施用量[J]. 土壤学报, 2024, 61(1): 64-76 (  0) 0) |
| [17] |
Zhang Y L, Xie H T, Wang F P, et al. Effects of biochar incorporation on soil viable and necromass carbon in the luvisol soil[J]. Soil Use and Management, 2022, 38(1): 318-330 DOI:10.1111/sum.12720 (  0) 0) |
| [18] |
Bingham A H, Cotrufo M F. Organic nitrogen storage in mineral soil: Implications for policy and management[J]. Science of the Total Environment, 2016, 551/552: 116-126 DOI:10.1016/j.scitotenv.2016.02.020 (  0) 0) |
| [19] |
Kaiser C, Franklin O, Dieckmann U, et al. Microbial community dynamics alleviate stoichiometric constraints during litter decay[J]. Ecology Letters, 2014, 17(6): 680-690 DOI:10.1111/ele.12269 (  0) 0) |
| [20] |
Possinger A R, Zachman M J, Enders A, et al. Organo-organic and organo-mineral interfaces in soil at the nanometer scale[J]. Nature Communications, 2020, 11(1): 6103 DOI:10.1038/s41467-020-19792-9 (  0) 0) |
| [21] |
邓倩, 马娟娟, 孙西欢, 等. 生物质炭对农田土壤腐殖质的影响——Meta分析[J]. 土壤, 2024, 56(1): 42-48 (  0) 0) |
| [22] |
de Souza Souza C, Bomfim M R, Conceição de Almeida M D, et al. Induced changes of pyrolysis temperature on the physicochemical traits of sewage sludge and on the potential ecological risks[J]. Scientific Reports, 2021, 11(1): 974 DOI:10.1038/s41598-020-79658-4 (  0) 0) |
| [23] |
Muhammad N, Brookes P C, Wu J. Addition impact of biochar from different feedstocks on microbial community and available concentrations of elements in a Psammaquent and a Plinthudult[J]. Journal of Soil Science and Plant Nutrition, 2016 (  0) 0) |
| [24] |
Xu Z W, Wang Y T, Sun D J, et al. Soil nutrients and nutrient ratios influence the ratios of soil microbial biomass and metabolic nutrient limitations in mountain peatlands[J]. CATENA, 2022, 218: 106528 DOI:10.1016/j.catena.2022.106528 (  0) 0) |
| [25] |
Zhang L Y, Jing Y M, Xiang Y Z, et al. Responses of soil microbial community structure changes and activities to biochar addition: A meta-analysis[J]. Science of the Total Environment, 2018, 643: 926-935 DOI:10.1016/j.scitotenv.2018.06.231 (  0) 0) |
| [26] |
Xiao D, He X Y, Wang G H, et al. Network analysis reveals bacterial and fungal keystone taxa involved in straw and soil organic matter mineralization[J]. Applied Soil Ecology, 2022, 173: 104395 DOI:10.1016/j.apsoil.2022.104395 (  0) 0) |
| [27] |
Yokobe T, Hyodo F, Tateno R, et al. Soil mineral fraction influences the bacterial abundance: Evidence from a mineral and plant materials incubation study[J]. Biogeochemistry, 2022, 161(3): 273-287 DOI:10.1007/s10533-022-00978-w (  0) 0) |
| [28] |
Wang C, Qu L R, Yang L M, et al. Large-scale importance of microbial carbon use efficiency and necromass to soil organic carbon[J]. Global Change Biology, 2021, 27(10): 2039-2048 DOI:10.1111/gcb.15550 (  0) 0) |
| [29] |
Li J, Yang Y, Wen J L, et al. Continuous manure application strengthens the associations between soil microbial function and crop production: Evidence from a 7-year multisite field experiment on the Guanzhong Plain[J]. Agriculture, Ecosystems & Environment, 2022, 338: 108082 (  0) 0) |
| [30] |
Cui J, Zhu Z K, Xu X L, et al. Carbon and nitrogen recycling from microbial necromass to cope with C: N stoichiometric imbalance by priming[J]. Soil Biology and Biochemistry, 2020, 142: 107720 DOI:10.1016/j.soilbio.2020.107720 (  0) 0) |
2. Qingdao Ecological Environment Bureau, Jiaozhou Branch, Qingdao, Shandong 266300, China
 2025, Vol. 57
2025, Vol. 57


