2. 文山苗乡三七科技有限公司, 云南文山 663000;
3. 江苏省土壤利用与农业可持续发展工程研究中心, 南京 210023;
4. 江苏省地理信息资源开发与利用协同创新中心, 南京 210023
三七(Panax notoginseng (Burk) F. H. Chen)是五加科人参属多年生草本植物,其药用部分为根及根茎,是我国特有的名贵道地药材,素有“金不换”、“南国神草”等美誉。近代药理学研究发现,三七中含有70多种单体皂苷、三七黄酮、三七多糖等活性物质,对冠状动脉疾病、心脑血管系统疾病具有很好的疗效,并且对癌症具有一定的预防作用[1]。总皂苷是三七主要的药用活性成分,其中三七皂苷R1、人参皂苷Rb1、人参皂苷Rg1和人参皂苷Rd的含量最为丰富,因此其含量常被用于评价中药材三七的品质[2]。云南省文山州是三七的道地产区,也是三七的传统主产区,当地已有400多年的三七栽培历史,但随着规模化种植历史的延长,加之严重的连作障碍问题,文山州境内适宜栽培三七的土地资源不断减少,已无法满足日益增加的市场需求[3-4]。目前,三七的主产区逐渐由文山州向红河、玉溪、昆明、普洱、临沧等地扩张,甚至四川、贵州等省也有少量栽种[5]。
由于三七生长对土壤、气候、生境等条件的要求极为苛刻,产区外扩势必会影响三七某些农艺性状控制基因的表达,改变其生理代谢特征,并进而对药用活性成分累积产生深刻影响。孙玉琴等[6]对云南省11个产区的三七进行取样分析发现,不同产地三七的总皂苷含量差异显著,总体表现为文山州各县区高于其他地州。杨勇等[7]的研究同样表明,传统产区文山州的三七总皂苷含量大于楚雄、昆明、红河等新兴产区。还有一些研究发现,四川、大理等少量引种地区的三七总皂苷含量较传统产区云南文山高[8-9]。以上研究表明,产地对三七皂苷累积及品质形成具有显著影响,但目前关于传统产区与新兴产区的三七品质孰优孰劣还有一定的争论,且对不同产区三七皂苷含量随时间变化规律的认识还不充分。因此,以不同生长阶段的三七植株为研究对象,开展产地对三七主根中皂苷累积的影响研究具有较为重要的意义。
研究表明,次生代谢产物是植物对环境的一种适应结果,而逆境胁迫有利于植物次生代谢产物的生成[10-11]。皂苷是三七主要的次生代谢产物,适度胁迫能够促进三七皂苷的累积及品质提升。如周润泽等[12]研究表明,在一定的低温胁迫下,三七根部的皂苷含量明显增加。Zang等[13]通过亏缺灌溉联合氯化钠施用,构建了一种能够促进三七产量、品质及经济效益提升的非生物胁迫解决方案。作为典型的生物胁迫因子,土壤致病菌与药用植物有效成分的相互关系受到了广泛的关注。Li等[14]通过土壤添加试验研究表明,三七皂苷Rg1、Rb1、Rh1及其混合物能够促进土壤中链格孢属(Alternaria)、柱孢属(Cylindrocarpon)、镰刀菌属(Fusarium)等病原真菌的增殖。Jiao等[15]的研究发现,土传病原真菌镰刀菌(Fusarium sp.)侵染能够提高西洋参中人参皂苷Rb1的含量,一定程度上表明病原真菌侵染胁迫能够促进西洋参药效成分累积。然而,三七主要致病真菌如腐皮镰刀菌(F. solani)、毁坏柱孢霉(C. destructans)等能否促进三七皂苷积累及品质形成,尚未见报道。
基于以上,本研究选取传统产区文山州丘北县和新兴产区昆明市石林县的适宜地块建立三七种植基地,分别于不同生长阶段采集三七植株样品,并收集其根际土壤,研究产地对三七生物量、主根中皂苷含量及累积量,以及根际土壤中病原真菌数量的影响,并在此基础上探究三七根际土壤中病原真菌数量及其在真菌中的占比与主根中皂苷含量及累积量之间的关系,为阐明产地外扩对三七品质的影响以及解析传统产区三七品质形成的机制提供一定的理论依据和数据支撑。
1 材料与方法 1.1 田间试验设计与样品采集田间试验分别设置于云南省文山州丘北县树皮乡小新寨村(104°08'55" E,23°50'30" N,海拔1 631 m)和云南省昆明市石林县圭山镇石头寨村(103°31'38" E,24°40'54 " N,海拔1 958 m)。其中,丘北试验点(传统产区)土壤基本理化性质为pH 7.89,有机质31.9 g/kg,电导率279.6 μS/cm,硝态氮57.8 mg /kg,有效磷33.1 mg/kg,速效钾278.1 mg/kg;石林试验点(新兴产区)土壤基本理化性质为pH 7.72,有机质35.6 g/kg,电导率415.1 μS/cm,硝态氮107.6 mg/kg,有效磷75.4 mg/kg,速效钾305.5 mg/kg。
试验开始前丘北试验点土壤中尖孢镰刀菌(F. oxysporum)、腐皮镰刀菌(F. solani)和毁坏柱孢霉(C. destructans)的数量分别为6.08 × 106、2.94 × 103和3.14 × 104 copies/g(以干基计,下同),而石林试验点土壤中3种病原菌的数量分别为6.16 × 106、4.93 × 103和6.71 × 104 copies/g,两地无显著差异。
2021年1月,将大小一致的1年生三七籽条分别移栽至上述试验基地,待籽条出苗后采用相同的田间管理措施进行管理,并分别于2年生苗期(2021年4月)、2年生根部生长期(2021年10月)、3年生花期(2022年7月)、3年生采收期(2022年10月)同步在丘北和石林基地采集三七植株及其根际土壤样品。
在每个采样时间点,分别于丘北和石林基地随机选取20株长势一致的三七植株进行取样,并参照Wang等[16]的方法收集其根际土壤样品。对于植株样品,将其清洗干净后分别称量地上部鲜重与地下部鲜重,后置于55℃烘箱中烘干,称量地上部干重与地下部干重。对于根际土壤样品,剔除残根、石砾等杂质,过筛(2 mm)后置于–80 ℃保存,用于土壤基因组DNA的提取。为了降低不同三七植株及根际土壤间的异质性,本研究将每个时间点采集的三七地下部样品随机分成5组,并基于此分组将根际土壤样品进行混合,故各试验基地每个采样点分别有5个地下部和5个根际土壤样品的生物学重复。
1.2 三七主根中皂苷的提取与测定除去各分组三七地下部主根上的须根和剪口后用球磨仪研磨至粉末,过4号筛(0.25 mm)后待用。三七主根中皂苷类物质的提取参照Wei等[17]的方法并做适当调整。具体步骤如下:准确称取0.1 g上述粉末至锥形瓶中,加入10 mL 100% 甲醇,涡旋振荡10 s后超声提取30 min,随后置于−20 ℃条件下冷冻萃取1 h,结束后收集上清液,用0.22 μm有机滤膜过滤后保存于−20 ℃冰箱中备用。
称取三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1和人参皂苷Rd标准物质(购自北纳生物,纯度≥98%)若干溶于甲醇溶液,梯度稀释后制成混合标准溶液。利用高效液相色谱(HPLC)Waters e2695系统的PDA检测器对标准溶液和三七皂苷浸提液进行测定,色谱柱为Waters C18(250 mm × 4.6 mm,5 μm),流动相由乙腈(A)和超纯水(B)组成,其梯度设置为:0 min,流动相A为18%,流动相B为82%;3 min,流动相A为18%,流动相B为82%;8 min,流动相A为30%,流动相B为70%;15 min,流动相A为35%,流动相B为65%;25 min,流动相A为55%,流动相B为45%;28 min,流动相A为18%,流动相B为82%;35 min,流动相A为18%,流动相B为82%。流速1 mL/min,波长203 nm,柱温40 ℃,进样量10 μL。以标准样品的保留时间为依据,对浸提液中的皂苷类物质进行鉴定,并根据标准曲线和各皂苷的峰面积计算其含量(mg/g)。在本研究中,将三七皂苷R1、人参皂苷Rg1、人参皂苷Rb1和人参皂苷Rd的含量之和定义为总皂苷含量(mg/g),用地下部干重与其皂苷含量相乘得到的皂苷积累量(mg/株)表征三七主根中皂苷的累积情况。
1.3 土壤DNA提取及荧光定量PCR分析准确称取保存于−80 ℃冰箱中的土壤样品0.5 g,使用FastDNA® SPIN Kit for Soil(MP Biomedicals,美国)按照说明书的步骤提取土壤基因组DNA。所有DNA样品经DS-11超微量分光光度计(DeNovix,美国)进行质量控制后,保存于−20 ℃冰箱待用。实时荧光定量PCR扩增反应在QuanStudio 3 Real-Time PCR系统(Applied Biosystems,美国)上进行,反应体系(20 μL)包括SYBR® Premix Ex Taq™(2×,Takara,中国大连)10 μL,正、反引物(10 μmol/L)各1 μL,DNA模板2 μL和dd H2O 6 μL。用于定量真菌(ITS1F/ ITS2R)、尖孢镰刀菌(ITS1F/AFP308R)、腐皮镰刀菌(ITS1F/AFP346R)的ITS基因和毁坏柱孢霉(CDU2/ CDL2b)的IGS基因的引物及扩增条件如表 1所示。
|
|
表 1 荧光定量PCR所用引物和扩增条件 Table 1 Primers and PCR conditions used in real-time PCR |
所有试验数据使用Excel 2019进行均值和标准差计算。利用SPSS 22.0对数据进行统计分析,采用单因素方差分析(one-way ANOVA)及Duncan法检验同一产地不同生长阶段各指标差异的显著性,采用双因素方差分析(two-way ANOVA)比较生长阶段、产地及其交互作用对各指标的影响,采用t检验比较两个产地同一生长阶段各指标差异的显著性。此外,采用Spearman相关分析检验根际土壤病原菌数量及其占比与三七主根皂苷含量和累积量的相关性。上述数据的可视化均使用Origin 2021软件完成。
2 结果与分析 2.1 产地对三七生物量的影响由表 2可知,在2年生苗期,产自丘北地区的三七地上部鲜重、地上部干重、总鲜重和总干重均显著高于石林地区(P < 0.05),而地下部鲜重和干重则呈现相反的趋势。随着三七的生长,地上部和地下部生物量逐渐增大,在2年生根部生长期、3年生花期和3年生采收期,丘北地区的三七地上部鲜重和干重、地下部鲜重和干重以及总鲜重和总干重均显著高于石林地区(P < 0.05)。特别地,在3年生采收期时,产自丘北地区的三七总鲜重和总干重分别为118.1和33.9 g/株,比同期石林地区高27.7% 和31.1%。以上结果表明,产地对三七生长和生物量累积具有重要的影响,其中丘北地区的三七生物量总体上较石林地区高,且随着时间的推移,两地三七生物量的差异愈发显著。
|
|
表 2 产地对三七生物量的影响 Table 2 Effect of producing regions on the biomass of Sanqi ginseng |
产地对三七主根中皂苷含量的影响与皂苷种类和三七生长阶段有关(图 1A ~ 1D)。除2年生苗期外,丘北地区三七主根中的人参皂苷Rg1、Rb1和Rd的含量均高于石林地区,其中丘北三七的人参皂苷Rg1在2年生根部生长期、3年生花期和3年生采收期的含量均显著高于石林(P < 0.05),而两地三七人参皂苷Rb1和Rd的含量差异分别在3年生花期以及2年生根部生长期和3年生花期达到显著水平(P < 0.05)。然而,产地对三七主根中三七皂苷R1的含量无显著影响。如图 2A所示,在2年生根部生长期至3年生采收期,丘北地区的三七总皂苷含量达80.5 ~ 94.8 mg/g,显著高于石林地区的65.9 ~ 80.6 mg/g(P < 0.05)。双因素方差分析显示,生长阶段、产地及其交互作用对人参皂苷Rg1、Rd和总皂苷含量的影响显著(P < 0.05),而人参皂苷Rb1的含量仅受生长阶段和产地的显著影响(P < 0.05,图 1A ~ 1D和图 2A)。
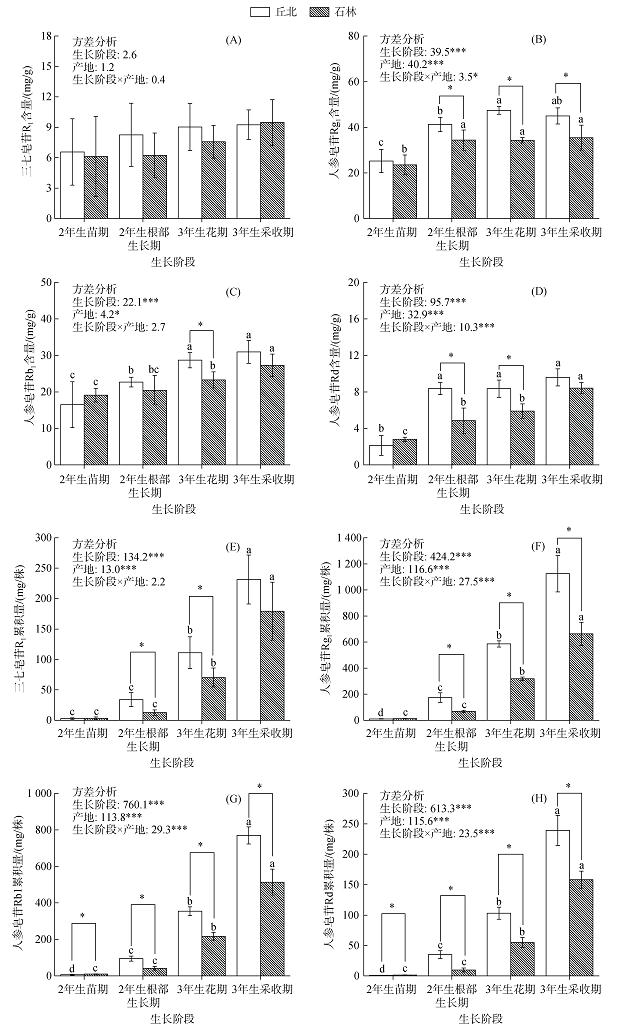
|
(图中误差线表示标准差(n = 5);柱上方不同小写字母表示同一产地三七不同生长阶段间差异显著(P < 0.05),柱上方*表示不同产地间差异显著(P < 0.05);方差分析中的*、**、***分别表示各因素的影响在P < 0.05、P < 0.01、P < 0.001水平显著;下同) 图 1 产地对三七皂苷R1(A)、人参皂苷Rg1(B)、Rb1(C)、Rd(D)含量及其累积量(E ~ H)的影响 Fig. 1 Effects of producing regions on the contents of Sanqi ginseng saponin R1 (A), ginsenoside Rg1 (B), ginsenoside Rb1 (C), and ginsenoside Rd (D) and their cumulative contents (E‒H) |
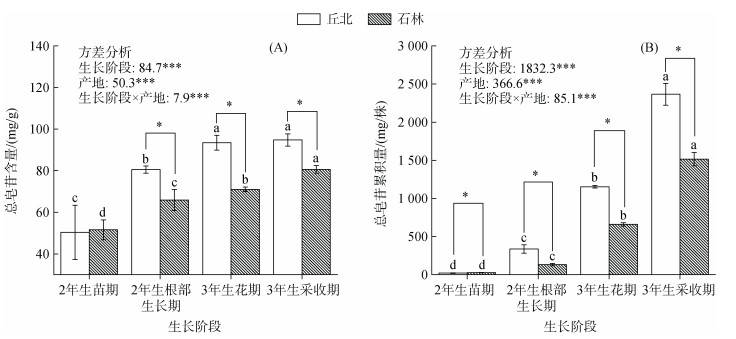
|
图 2 产地对三七总皂苷含量(A)及其累积量(B)的影响 Fig. 2 Effects of producing regions on the total saponin content (A) and its accumulation (B) of Sanqi ginseng |
如图 1E ~ 1H所示,产地对三七主根中单体皂苷的累积量具有显著的影响,其中在2年生根部生长期、3年生花期和3年生采收期,丘北地区三七主根中人参皂苷Rg1、Rb1和Rd的累积量均显著高于石林地区(P < 0.05),而两地三七皂苷R1的累积量差异仅在2年生根部生长期和3年生花期达到显著水平(P < 0.05)。由图 2B可知,产地对三七总皂苷累积量的影响较含量大,在3年生采收期时,产自丘北地区三七的总皂苷累积量为2 364.8 mg/株,是石林三七的1.56倍。不论是丘北地区还是石林地区,自2年生根部生长期开始,三七主根中各皂苷单体和总皂苷的累积量均随着三七生长阶段的进行而显著增加(P < 0.05)。双因素方差分析表明,除生长阶段和产地的交互作用对三七皂苷R1的累积量无显著影响外,生长阶段、产地及其交互作用对三七皂苷R1、人参皂苷Rg1、Rb1、Rd和总皂苷的累积量均有显著影响(P < 0.001,图 1E ~ 1H和图 2B)。以上结果表明,丘北地区的生境更有利于三七主根中皂苷类物质的累积。
2.3 产地对三七根际土中常见病原真菌数量及其在真菌中占比的影响如图 3A所示,各生长阶段丘北和石林三七根际土壤中真菌的数量分别为4.41 × 107 ~ 8.31 × 107和4.05 × 107 ~ 1.03 × 108 copies/g,其中两地三七根际土壤中真菌数量的差异仅在2年生苗期时达到显著水平(P < 0.05)。由图 3B ~ 3D可知,产地对三七根际土壤中病原真菌数量的影响与其种类和三七生长阶段有关,其中各生长阶段丘北三七根际土壤中腐皮镰刀菌的数量为1.16 × 106 ~ 1.49 × 106 copies/g,均显著高于石林三七(3.17 × 105 ~ 7.40 × 105 copies/g) (P < 0.05),而尖孢镰刀菌总体呈现相反的趋势,且在2年生苗期和3年生花期,石林三七根际土壤中尖孢镰刀菌的数量显著高于丘北地区(P < 0.05)。特别地,随着三七的生长,丘北三七根际土壤中毁坏柱孢霉的数量呈现先显著增加后显著减少的变化规律,而石林三七根际土壤中毁坏柱孢霉的数量变化幅度不大(图 3D)。双因素方差分析结果显示,生长阶段、产地及其交互作用对三七根际土壤中尖孢镰刀菌和腐皮镰刀菌的数量均具有显著影响(P < 0.05),而真菌和毁坏柱孢霉的数量仅受生长阶段以及生长阶段×产地的显著影响(P < 0.01)。
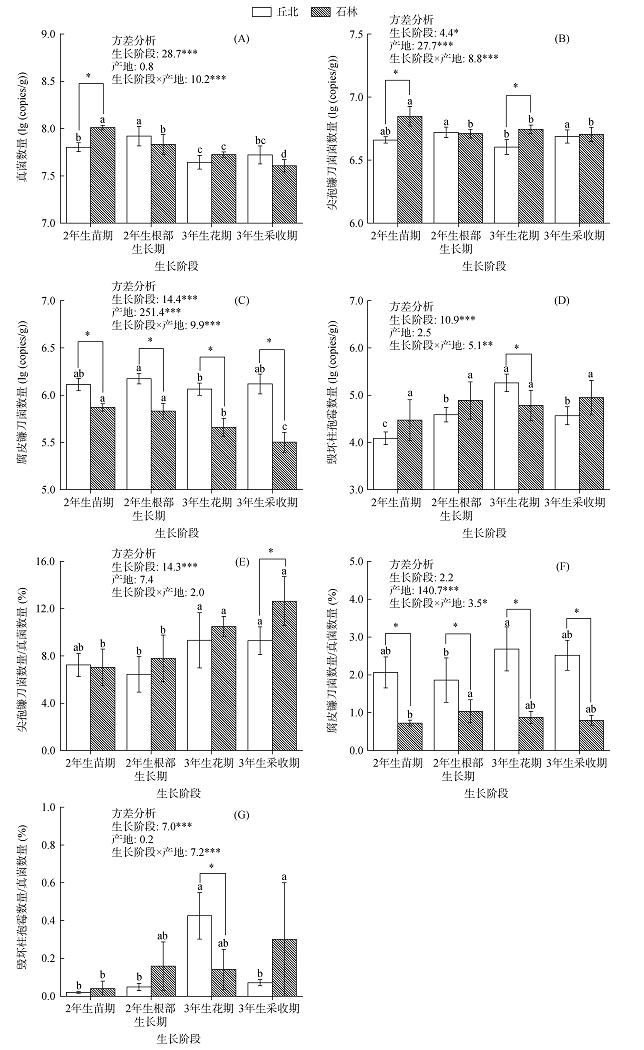
|
图 3 产地对三七根际土中真菌(A)、尖孢镰刀菌(B)、腐皮镰刀菌(C)和毁坏柱孢霉属(D)的数量及其在真菌中占比(E ~ G)的影响 Fig. 3 Effects of producing regions on the quantities of fungi (A), F. oxysporum (B), F. solani (C), and C. destructans (D) and their proportions to fungi (E‒G) in rhizosphere soil of Sanqi ginseng |
如图 3E所示,丘北三七根际土壤中尖孢镰刀菌在真菌中的占比为6.46% ~ 9.32%,总体较石林地区低(7.02% ~ 12.63%),且随着三七的生长,两地尖孢镰刀菌的占比呈逐渐上升的趋势,其差异在3年生采收期时达到显著水平(P < 0.05)。与腐皮镰刀菌的数量相似,丘北三七各生长阶段根际土壤中腐皮镰刀菌的占比(1.86% ~ 2.68%)均显著高于石林地区(0.72% ~ 1.03%)(P < 0.05,图 3F)。与尖孢镰刀菌和腐皮镰刀菌相比,三七根际土壤中毁坏柱孢霉的占比较低,仅为0.02% ~ 0.43%,其中在3年生花期,丘北三七根际土壤中毁坏柱孢霉的占比显著高于石林地区(P < 0.05,图 3G)。双因素方差分析结果表明,生长阶段对三七根际土壤中尖孢镰刀菌的占比具有显著影响(P < 0.05),产地和生长阶段×产地的交互作用对腐皮镰刀菌的占比具有显著影响(P < 0.05),而毁坏柱孢霉的占比受生长阶段和生长阶段×产地的影响显著(P < 0.05)。
2.4 土壤中病原真菌数量及其占比与三七皂苷含量及累积量的相关性Spearman相关性分析显示(图 4),根际土壤中尖孢镰刀菌、腐皮镰刀菌、毁坏柱孢霉的数量及占比与三七主根中各皂苷单体含量、总皂苷含量及其累积量具有一定的关联,且随着三七的生长,两者之间的相关性呈先增强后减弱的趋势。在2年生苗期,土壤病原真菌数量及其占比与三七单体皂苷和总皂苷含量均无显著相关性,而腐皮镰刀菌的数量及其占比与人参皂苷Rb1和Rd的累积量呈显著负相关(P < 0.05,图 4A)。2年生根部生长期时,腐皮镰刀菌的数量与人参皂苷Rd含量、总皂苷含量、各皂苷单体及总皂苷累积量呈显著正相关(P < 0.01),而腐皮镰刀菌占比与人参皂苷Rd含量和总皂苷含量具有显著正相关关系(P < 0.05,图 4B)。如图 4C所示,病原真菌类型对三七皂苷含量及累积量的影响具有显著差异,其中腐皮镰刀菌和毁坏柱孢霉的数量及其占比与大部分三七单体皂苷和总皂苷的含量及累积量具有显著正相关关系(P < 0.05),而尖孢镰刀菌的数量与人参皂苷Rg1、Rb1、Rd和总皂苷含量、各单体皂苷及总皂苷累积量均呈显著负相关(P < 0.05)。在3年生采收期,尖孢镰刀菌的占比与人参皂苷Rg1含量、Rd含量、总皂苷含量以及各单体皂苷和总皂苷累积量呈显著负相关(P < 0.05),而腐皮镰刀菌的数量及占比则呈现相反的趋势(图 4D)。此外,毁坏柱孢霉的数量与人参皂苷Rg1的含量及累积量具有显著负相关关系(P < 0.05)。以上结果表明,产地对三七品质形成的影响可能与根际土壤中病原真菌的种类和数量有关。
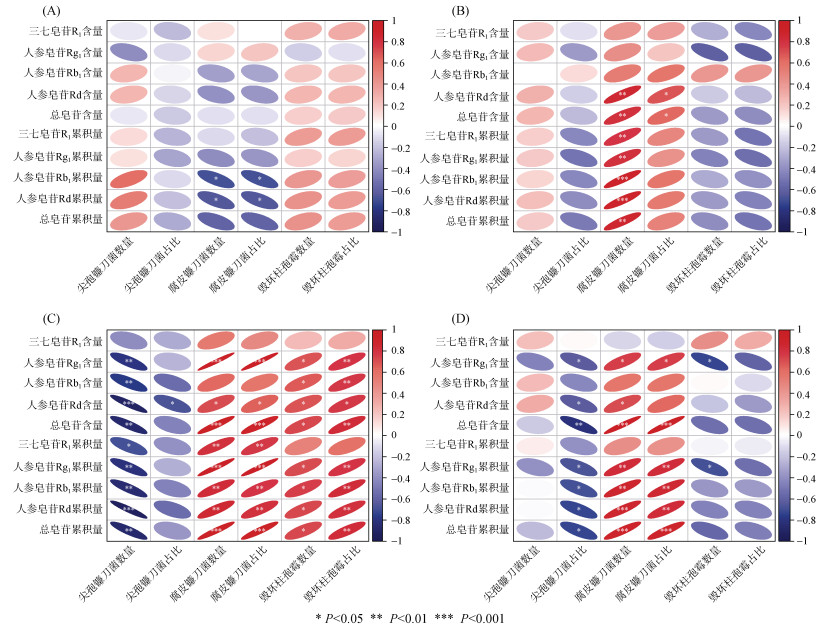
|
(A:二年生苗期;B:二年生根部生长期;C:三年生花期;D:三年生采收期) 图 4 不同采样时期三七根际土中病原真菌数量及其占比与皂苷含量及累积量的相关性分析 Fig. 4 Correlation analysis of the number and proportion of pathogenic fungi in the rhizosphere soil of Sanqi ginseng with saponin content and accumulation in the taproots in different sampling periods |
《本草经集注》指出“诸药所生,皆有境界”;《新修本草·孔志约序》认为“离其本土,则质同而效异”;《用药法象》记载“凡诸草木昆虫,产之有地,失其地则性味少异”,这些典籍无不强调了产地对中药材品质形成和药效的重要性[22-23]。Wei等[24]对云南省内不同产地采收期三七主根中的皂苷含量进行分析,发现传统产区文山州的三七总皂苷含量总体高于外扩产区昆明市和曲靖市。本研究也发现,产自丘北地区的三七主根中总皂苷的含量及累积量均显著高于石林产区,这也与孙玉琴等[6]和杨勇等[7]的研究结果类似,即产地对三七皂苷积累具有重要影响,且传统产区三七的品质往往优于外扩产区。Zhang等[25]进一步分析了不同产区三七的药用功效差异,发现传统产区三七的抗凝血活性显著高于新兴产区,这从侧面表明产区盲目外扩可能是导致三七品质和药用功效下滑的重要原因。
近年来,学者们通过大规模田间采样与控制试验相结合的方式,对影响三七品质形成的因素展开了大量研究,取得了一系列研究成果。如,杨勇等[7]对来自云南省6个州市92个三七样品主根中的总皂苷含量(Rb1、Rg1和R1)与其地理位置和土壤养分的相关性分析发现,三七总皂苷含量与纬度和海拔呈显著负相关,而与土壤有机质、全氮、有效磷等养分含量无显著相关性,表明高纬度和高海拔不利于三七总皂苷的积累。本研究也发现,海拔和纬度较高的石林产区的三七总皂苷含量及累积量均低于海拔和纬度较低的丘北产区。此外还有一些研究表明,温度、湿度、光照等气候因素对药用植物生长以及次生代谢产物的积累具有重要影响[12,26-27]。因此,丘北和石林地区温度、降雨等气候因子的差异也可能是导致本研究中三七皂苷累积产生差异的重要原因。
3.2 土壤病原真菌数量及占比与三七品质的关系黄璐琦等[10,28]研究指出,逆境胁迫是药用植物次生代谢产物积累与道地品质形成的关键。即当药用植物在遭受干旱、盐害、病原菌侵袭等非生物或生物胁迫时,其能够通过激活次生代谢产物的生物合成途径,以提高体内次生代谢产物含量及抵御逆境的能力,保证自身的生长发育[11,29-30]。Jiao等[15]研究了尖孢镰刀菌和腐皮镰刀菌侵染对西洋参主根中皂苷含量的影响,发现病原真菌侵染能够显著提高人参皂苷Rb1的含量,但对人参皂苷Re和Rg1含量的影响不显著。Zhao等[31]采用超高液相色谱‒串联质谱技术对腐皮镰刀菌侵染引起的人参根内代谢组分随时间的变化特征进行了剖析,发现皂苷、糖类和有机酸类代谢组分的变化显著,其中皂苷类物质如Rd、Re的相对含量有所下降。本研究发现,三七主根中各皂苷单体与总皂苷含量及其累积量与根际土壤中病原真菌的数量及其占比密切相关,特别地,在3年生花期时,三七主根中各皂苷单体与总皂苷含量及其累积量与腐皮镰刀菌和毁坏柱孢霉的数量及其占比均呈正相关关系,这在一定程度上表明腐皮镰刀菌和毁坏柱孢霉的侵染胁迫有利于三七药效成分的累积及品质提升。这可能与病原真菌侵染能够特异性地增强药用植物中皂苷类物质生物合成途径相关的基因和关键酶的表达,从而促进了皂苷类物质在其根部的积累有关[32]。然而,已有研究表明,一旦根际土壤中病原真菌的种群丰度超过一定阈值,就会引起土传病害爆发,进而导致植物死亡[33-35],这可能与生物胁迫过度有关。值得注意的是,传统产区丘北地区三七根际土壤中腐皮镰刀菌的数量及其占比在整个生长周期均显著高于石林地区,这可能是道地三七品质优于其他产区的重要原因之一,是药用植物三七与病原真菌长期互作进化所形成的结果。以上结果表明,土壤病原真菌引起的生物胁迫是促使三七皂苷累积与品质形成的关键环节,但其作用机制以及如何通过精准调控土壤病原真菌以实现高品质三七的生产还有待进一步研究。
4 结论传统产区丘北地区三七主根中各皂苷单体、总皂苷含量及其累积量总体上高于新兴产区石林地区,同时根际土壤中腐皮镰刀菌的数量及其在真菌中的占比均显著高于石林地区;三七主根中皂苷含量及其累积量与根际腐皮镰刀菌的数量及占比具有明显的正相关关系。本研究结果从生物逆境胁迫角度初步揭示了土壤病原真菌在促进药用植物三七有效成分累积与品质形成方面的重要作用,为通过研发特定的土壤病原真菌调控措施以促进高品质三七的生产提供了理论依据和数据支撑。
| [1] |
Ng T B. Pharmacological activity of Sanchi ginseng (Panax notoginseng)[J]. Journal of Pharmacy and Pharmacology, 2006, 58(8): 1007-1019 DOI:10.1211/jpp.58.8.0001 (  0) 0) |
| [2] |
Liu H B, Lu X Y, Hu Y, et al. Chemical constituents of Panax ginseng and Panax notoginseng explain why they differ in therapeutic efficacy[J]. Pharmacological Research, 2020, 161: 105263 DOI:10.1016/j.phrs.2020.105263 (  0) 0) |
| [3] |
李云龙, 王宝英, 常亚锋, 等. 土壤强还原处理对三七连作障碍因子及再植三七生长的影响[J]. 土壤学报, 2019, 56(3): 703-715 (  0) 0) |
| [4] |
常亚锋, 于文豪, 陈厚朴, 等. 种植年限对健康三七根际土壤微生物活性和功能的影响[J]. 土壤, 2023, 55(1): 132-139 DOI:10.13758/j.cnki.tr.2023.01.016 (  0) 0) |
| [5] |
崔秀明, 黄璐琦, 郭兰萍, 等. 中国三七产业现状及发展对策[J]. 中国中药杂志, 2014, 39(4): 553-557 (  0) 0) |
| [6] |
孙玉琴, 向飞军, 曾江, 等. 云南省不同产地三七皂苷含量的比较[J]. 文山学院学报, 2013, 26(6): 8-10 (  0) 0) |
| [7] |
杨勇, 梁文, 赵亮庆, 等. 不同产地三七总皂苷和土壤矿质元素、水质的相关性分析[J]. 云南大学学报(自然科学版), 2023, 45(6): 1331-1339 (  0) 0) |
| [8] |
孙孔春, 吴乐艳, 侯雯清, 等. 云南省不同产地三七的成分分析[J]. 昆明医科大学学报, 2020, 41(1): 1-10 (  0) 0) |
| [9] |
岳攀, 白静, 董强, 等. 低海拔产区四川遂宁三七品质的多维评价[J]. 中药材, 2020, 43(11): 2729-2733 (  0) 0) |
| [10] |
黄璐琦, 郭兰萍. 环境胁迫下次生代谢产物的积累及道地药材的形成[J]. 中国中药杂志, 2007, 32(4): 277-280 (  0) 0) |
| [11] |
蒋妮, 覃柳燕, 李力, 等. 环境胁迫对药用植物次生代谢产物的影响[J]. 湖北农业科学, 2012, 51(8): 1528-1532 (  0) 0) |
| [12] |
周润泽, 王翊豪, 周玉厚, 等. 不同温度对三年生三七各部位皂苷含量的影响[J]. 西南农业学报, 2019, 32(12): 2802-2806 (  0) 0) |
| [13] |
Zang Z N, Liang J P, Yang Q L, et al. An adaptive abiotic stresses strategy to improve water use efficiency, quality, and economic benefits of Panax notoginseng: Deficit irrigation combined with sodium chloride[J]. Agricultural Water Management, 2022, 274: 107923 (  0) 0) |
| [14] |
Li Y L, Dai S Y, Wang B Y, et al. Autotoxic ginsenoside disrupts soil fungal microbiomes by stimulating potentially pathogenic microbes[J]. Applied and Environmental Microbiology, 2020, 86(9): e00130-20 (  0) 0) |
| [15] |
Jiao X L, Bi W, Li M, et al. Dynamic response of ginsenosides in American ginseng to root fungal pathogens[J]. Plant and Soil, 2011, 339(1): 317-327 (  0) 0) |
| [16] |
Wang B Y, Xia Q, Li Y L, et al. Root rot-infected Sanqi ginseng rhizosphere harbors dynamically pathogenic microbiotas driven by the shift of phenolic acids[J]. Plant and Soil, 2021, 465(1): 385-402 (  0) 0) |
| [17] |
Wei G F, Dong L L, Yang J, et al. Integrated metabolomic and transcriptomic analyses revealed the distribution of saponins in Panax notoginseng[J]. Acta Pharmaceutica Sinica B, 2018, 8(3): 458-465 (  0) 0) |
| [18] |
Durán P, Thiergart T, Garrido-Oter R, et al. Microbial interKingdom interactions in roots promote Arabidopsis survival[J]. Cell, 2018, 175(4): 973-983.e14 (  0) 0) |
| [19] |
Lievens B, Brouwer M, Vanachter A C R C, et al. Real-time PCR for detection and quantification of fungal and oomycete tomato pathogens in plant and soil samples[J]. Plant Science, 2006, 171(1): 155-165 (  0) 0) |
| [20] |
Lievens B, Brouwer M, Vanachter A C R C, et al. Quantitative assessment of phytopathogenic fungi in various substrates using a DNA macroarray[J]. Environmental Microbiology, 2005, 7(11): 1698-1710 (  0) 0) |
| [21] |
吴照祥, 郝志鹏, 曾燕, 等. 三七根腐病原菌毁坏柱孢霉分子定量检测方法及其应用[J]. 微生物学通报, 2015, 42(3): 598-607 (  0) 0) |
| [22] |
贺玉林. 丹参有效成分的积累及其与生态因子的关系[D]. 北京: 中国协和医科大学, 2007.
(  0) 0) |
| [23] |
何冬梅, 王海, 陈金龙, 等. 中药微生态与中药道地性[J]. 中国中药杂志, 2020, 45(2): 290-302 (  0) 0) |
| [24] |
Wei G F, Zhang G Z, Li M Z, et al. Core rhizosphere microbiome of Panax notoginseng and its associations with belowground biomass and saponin contents[J]. Environmental Microbiology, 2022, 24(12): 6238-6251 (  0) 0) |
| [25] |
Zhang H Z, Liu D H, Zhang D K, et al. Quality assessment of Panax notoginseng from different regions through the analysis of marker chemicals, biological potency and ecological factors[J]. PLoS One, 2016, 11(10): e0164384 (  0) 0) |
| [26] |
匡双便, 徐祥增, 孟珍贵, 等. 不同透光率对三七生长特征及根皂苷含量的影响[J]. 应用与环境生物学报, 2015, 21(2): 279-286 (  0) 0) |
| [27] |
吴灿, 叶辰, 张俊星, 等. 思茅松林下生境差异对三七生长和品质的影响[J]. 云南农业大学学报(自然科学), 2021, 36(4): 691-699 (  0) 0) |
| [28] |
黄璐琦, 陈美兰, 肖培根. 中药材道地性研究的现代生物学基础及模式假说[J]. 中国中药杂志, 2004, 29(6): 494–496, 610 (  0) 0) |
| [29] |
苏琦, 张珂, 黄淑琪, 等. 逆境胁迫对药用植物药效成分积累的影响[J]. 湖北民族大学学报(自然科学版), 2022, 40(2): 129–134, 180 (  0) 0) |
| [30] |
Yadav R K, Sangwan R S, Srivastava A K, et al. Prolonged exposure to salt stress affects specialized metabolites-artemisinin and essential oil accumulation in Artemisia annua L. : Metabolic acclimation in preferential favour of enhanced terpenoid accumulation accompanying vegetative to reproductive phase transition[J]. Protoplasma, 2017, 254(1): 505-522 (  0) 0) |
| [31] |
Zhao G J, Xing S Y, Wang Y, et al. Metabolomic profiling of Panax ginseng in response to Fusarium solani infection[J]. Physiological and Molecular Plant Pathology, 2023, 127: 102110 (  0) 0) |
| [32] |
Li J X, Liu S J, Wang J, et al. Fungal elicitors enhance ginsenosides biosynthesis, expression of functional genes as well as signal molecules accumulation in adventitious roots of Panax ginseng C. A. Mey[J]. Journal of Biotechnology, 2016, 239: 106-114 (  0) 0) |
| [33] |
苏浩, 张锐澎, 吴思炫, 等. 连作障碍产生机理及防控现状[J]. 土壤, 2024, 56(2): 242-254 (  0) 0) |
| [34] |
杨珍, 戴传超, 王兴祥, 等. 作物土传真菌病害发生的根际微生物机制研究进展[J]. 土壤学报, 2019, 56(1): 12-22 (  0) 0) |
| [35] |
Li X G, Ding C F, Zhang T L, et al. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing[J]. Soil Biology and Biochemistry, 2014, 72: 11-18 (  0) 0) |
2. Wenshan Miaoxiang Sanqi Technology Co., Ltd., Wenshan, Yunnan 663000, China;
3. Jiangsu Engineering Research Center for Soil Utilization & Sustainable Agriculture, Nanjing 210023, China;
4. Jiangsu Center for Collaborative Innovation in Geographical Information Resource Development and Application, Nanjing 210023, China
 2025, Vol. 57
2025, Vol. 57


