2. 中国科学院大学, 北京 100049;
3. 国家红壤改良工程技术研究中心, 南昌 330046
花生是我国重要的油料作物和经济作物。据联合国粮农组织统计,2022年,我国花生总产量为1 838万t,仅次于大豆[1],为我国第二大油料作物。近年来,我国花生种植面积逐年增加,且种植区域相对集中,逐渐在国内形成了以北方产区、华南产区、长江流域产区和东北农牧交错带产区为代表的四大花生产区[2]。然而,花生产量在不同产区间存在较大差异,南方产区花生产量往往低于北方产区[3]。王明珠和陈学南[4]的研究表明,南方红壤花生产区低产的障碍因子除气候条件、品种选择以及肥力条件外,连作障碍是不容忽视的因素。
连作障碍是指在同一土壤中连续栽培同种或同科的作物时,即使在正常的栽培管理状况下,也会出现生长势变弱、产量降低、品质下降、病虫害严重的现象[5]。已有研究表明,土壤养分失衡、植物化感自毒作用以及根际微生态失衡是花生连作障碍的主要成因[6-8]。随着研究人员对连作障碍中土壤–植物–-微生物之间的相互作用不断深入探究,根际微生态失衡导致的有害病原菌的累积以及微生物群落的失衡逐渐被认为是连作障碍产生的关键因素[9-10]。针对花生连作障碍,目前的解决方法主要包括合理施肥、轮间作、选育抗病新品种、生物防治和土壤消毒等,其中,土壤化学消毒快速、高效,是最常见、最有效的土壤消毒措施[11]。但传统的化学消毒剂如氯化苦、棉隆以及百菌清等杀菌剂使用不当易造成土壤污染,且长期使用易使病原菌产生抗药性,不利于花生质量的保证。因此,应综合评估不同化学消毒剂对土壤环境以及花生生长的影响,筛选环保安全且高效的化学药剂,才能更好地防控花生连作障碍。有研究表明,过氧化物反应后可以释放氧化性极强的超氧自由基,快速杀灭土壤中的有害病原菌[12]。其中,过氧化氢不仅具有强氧化性,且能在土壤中快速分解为氧气和水,是一种“绿色氧化剂”[13],而过氧化钙在氧化杀菌的同时还可以提高酸性红壤pH,提供钙素,改善土壤环境[14],目前常作为土壤酸化改良剂应用于实际生产。但是,过氧化物在南方红壤区花生连作障碍消除中的应用效果及机理还有待明确。综上,本研究选择过氧化钙和过氧化氢两种过氧化物作为土壤处理剂,从土壤化学性质和微生物群落特征两个方面探究其对花生连作障碍的消减效果,以为缓解花生连作障碍提供有效的技术措施。
1 材料与方法 1.1 试验地概况试验地位于江西省鹰潭市余江县刘家站中国科学院红壤生态实验站(28°13′N,116°55′E)。该地属亚热带季风湿润气候,1月平均气温5.9 ℃,7月平均气温30 ℃,年均降水量1 750 mm。试验地土壤为第四纪红色黏土母质发育而成的土壤,其基础理化性质为:pH 5.96,有机质10.11 g/kg,全氮0.68 g/kg,全磷0.85 g/kg,全钾13.32 g/kg,有效磷84.96 mg/kg,速效钾385.00 mg/kg。该试验地于2010年夏季开始种植花生,冬季轮作萝卜和荞麦。
1.2 试验设计试验共设3个处理,分别为CK(不添加任何试剂)、T1(添加400 g/m2过氧化钙)、T2(添加2 L/m2过氧化氢),采用随机区组划分田间小区,每个小区面积为3 m × 5 m,每个处理设3次重复。试验开始前按当地常规施肥量(尿素300 kg/hm2,钙镁磷肥600 kg/hm2,氯化钾300 kg/hm2)进行氮磷钾化肥混施。试验于2023年3月中旬开始,两周后进行花生播种,于8月中旬进行收获,期间按照当地种植习惯进行常规田间管理。供试花生品种为赣花1号;供试土壤改良剂为过氧化钙粉末(碳酸钙+过氧化钙质量分数≥60%)和30% 过氧化氢,二者分别由江门市农鑫动物保健科技有限公司和镇江市久亿化学试剂有限公司提供。
1.3 土壤样品采集与分析 1.3.1 样品采集花生收获时,每块样地随机选取3个点,小心拔起花生后去除土壤表层的枯枝落叶与杂物,用土钻取根附近0 ~ 20 cm表层土样。将3个分样充分混匀后分成2份,一份保存于–80 ℃冰箱用于土壤微生物群落高通量分析,另一份自然风干、研磨过筛后进行土壤性质分析。
1.3.2 土壤化学指标测定土壤pH采用酸度计法测定(土水质量比1∶2.5),有机质(SOM)采用高温外热重铬酸钾氧化–容量法测定,铵态氮NH4+-N含量采用靛酚蓝比色法测定,有效磷(AP)采用钼锑抗比色法测定,速效钾(AK)采用乙酸铵浸提–火焰光度计法测定[15];硝态氮NO3–-N含量采用双波长紫外分光光度法测定[16]。
1.3.3 土壤微生物DNA提取与高通量测序利用E.Z.N.A.® Soil DNA kit (Omega Bio-tek,Norcross,GA,U.S.)抽提微生物群落总基因组DNA,并使用1% 的琼脂糖凝胶电泳和Nano Drop 2000分别对抽提的DNA进行质检以及浓度和纯度的测定。随后利用ABI GeneAmp® 9700型PCR仪进行细菌、真菌的PCR扩增,细菌引物序列为338F:ACTCCTACGG GAGGCAGCAG和806R:GGACTACHVGGGTWT CTAAT,真菌引物序列为ITS1F:CTTGGTCATTT AGAGGAAGTAA和ITS2R:GCTGCGTTCTTCATC GATGC。PCR扩增均采用20 μL的反应体系:4 μL 5 × FastPfu Buffer,2 μL 2.5 mmol/L dNTPs,0.8 μL正向引物(5 μmol/L),0.8 μL反向引物(5 μmol/L),0.4 μL聚合酶,0.2 μL BSA,10 ng土壤DNA,补充ddH2O至20 μL。PCR扩增条件为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s),72 ℃延伸10 min。每个样本3个重复,由上海美吉生物医药科技有限公司完成高通量测序。
1.4 数据分析试验所获得的土壤化学性质数据采用SPSS 23.0进行分析,采用单因素方差分析(one-way ANOVA) 及LSD法进行处理间差异显著性检验,并使用Origin 2018进行绘图。使用Fastp 0.19.6对双端原始测序序列进行质控,FLASH1.2.11进行pari-end双端序列拼接,基于默认参数使用QIIME2流程中的DADA2插件对质控拼接之后的优化序列进行降噪处理。采用Mothur 1.30.2计算微生物α多样性指标如Shannon指数和ACE指数。采用RDP classifier贝叶斯算法对97% 相似水平的OTU (操作分类单元)代表序列进行分类学分析,并分别在各个分类学水平统计各样本的群落物种组成,根据分类学分析结果,绘制群落组成柱状图。最后利用R语言(3.3.1)进行冗余分析(RDA)、主坐标分析(PCoA)以及Spearman相关性分析。
2 结果与分析 2.1 不同处理对土壤化学性质的影响由表 1可以看出,T1处理后,土壤pH有所提高,而T2处理降低了土壤pH;T1与T2处理显著降低了连作花生土壤有效磷和速效钾含量,有效磷含量分别由101.4 mg/kg显著下降为53.96 mg/kg和58.01 mg/kg,分别下降了46.80% 和42.81%,速效钾含量则分别下降了45.94% 和43.13%;T1与T2处理的土壤有机质含量相较于CK处理有所下降,铵态氮含量有所增加,但差异均未达到显著性水平;相较于CK处理,土壤硝态氮含量在T1处理后显著降低,T2处理后硝态氮含量虽有所下降,但差异未达到显著性水平。
|
|
表 1 不同处理对土壤化学性质的影响 Table 1 Effects of different treatments on soil chemical properties |
ACE指数主要用于表征微生物群落丰富度,ACE指数越大,表示微生物群落物种数越多。Shannon指数则用于表征群落多样性,Shannon指数越大,表示微生物群落的多样性越高。由表 2可见,相较于CK处理,土壤细菌和真菌的ACE指数和Shannon指数在T1处理后均有所提高,在T2处理后则有所降低。由此说明,T1处理可以提高土壤中微生物群落结构的多样性,而T2处理则正好相反。
|
|
表 2 不同处理下连作花生土壤细菌与真菌的α多样性指数 Table 2 α diversity indexes of bacteria and fungi in peanut continuous-cropping soil under different treatments |
如图 1所示,对花生连作土壤微生物群落进行PCoA分析,结果表明,对于细菌,PC1和PC2的解释度分别为32.15% 和20.85%,共解释了53.00% 的细菌群落差异,其中CK和T1处理均与T2处理明显分离,表明T2处理土壤细菌群落物种组成与前二者存在显著差异,而CK与T1处理存在交叠则说明二者的细菌群落组成存在一定的相似性。对于真菌,PC1和PC2的解释度分别为48.19% 和17.04%,共解释了65.23% 的真菌群落差异,而T1、T2处理存在交叠且均与CK处理明显分离,说明T1和T2处理的土壤微生物群落存在一定的相似性,且二者能够显著改变花生连作土壤真菌群落结构。
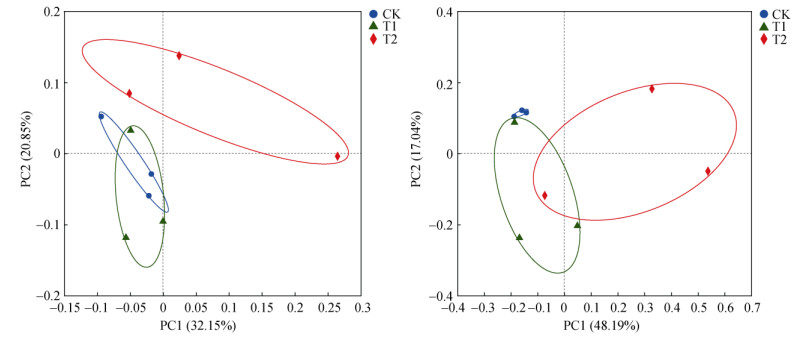
|
图 1 不同处理下土壤细菌(左)和真菌(右)群落属水平上PCoA分析 Fig. 1 Principal co-ordinates analysis of bacterial (left) and fungal (right) communities at genus level under different treatments |
基于OTU的相对丰度和注释信息,对样品中细菌和真菌相对丰度排名前10位的优势菌门绘制物种相对丰度柱状图(图 2),结果表明,在门水平上,各处理细菌优势菌门主要包括放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、芽单胞菌门(Gemmatimonadota)、厚壁菌门(Firmicutes)、粘球菌门(Myxococcota)、拟杆菌门(Bacteroidota)、蓝藻门(Cyanobacteria)和髌骨细菌门(Patescibacteria),相对丰度共占总相对丰度的77.98% ~ 80.71%。与CK处理相比,T1处理放线菌门的相对丰度降低了17.76%,T1和T2处理下变形菌门的相对丰度分别增加了3.25% 和16.51%;T2处理下绿弯菌门和酸杆菌门的相对丰度分别为16.17% 和8.76%,相较于CK处理分别降低了12.64% 和26.39%;T1处理下酸杆菌门和芽单胞菌门的相对丰度分别为13.53% 和6.19%,相较于CK处理分别增加了13.70% 和40.36%。
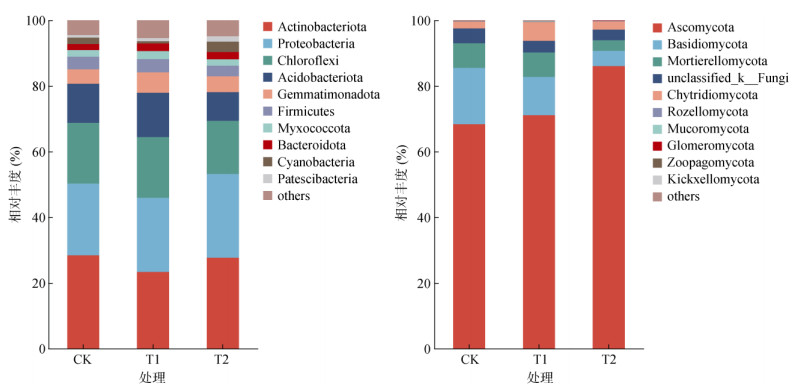
|
图 2 不同处理下土壤细菌(左)和真菌(右)门水平相对丰度 Fig. 2 Relative abundance of bacteria (left) and fungi (right) at phylum level in soils under different treatments |
各处理真菌优势菌门主要包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、未分类真菌门(unclassified_k__Fungi)、壶菌门(Chytridiomycota)、罗兹菌门(Rozellomycota)、毛霉门(Mucoromycota)、球囊菌门(Glomeromycota)、Zoopagomycota和梳霉亚门(Kickxellomycota)。其中,子囊菌门、担子菌门、被孢霉门、未分类真菌门、壶菌门为最主要的优势菌门,相对丰度共占总相对丰度的99% 以上。与CK处理相比,T1和T2处理增加了子囊菌门和壶菌门的相对丰度,其中,子囊菌门分别增加了4.02% 和25.89%,壶菌门分别增加了177.88% 和20.19%;担子菌门、被孢霉门以及未分类真菌门的相对丰度在T1和T2处理下均有所下降,担子菌门分别下降了32.11% 和72.73%,被孢霉门分别下降了0.40% 和56.80%,未分类真菌门则分别下降了23.14% 和29.26%。
2.2.4 不同处理对土壤微生物群落属水平物种组成的影响如图 3所示,在属水平上,各处理相对丰度排名前10位的细菌优势菌属主要有鞘氨醇单胞菌属(Sphingomonas)、unclassified_f__Micrococcaceae、norank_f__Roseiflexaceae、norank_f__norank_o__Gaiellales、norank_f__norank_o__Vicinamibacterales、芽单胞菌属(Gemmatimonas)、地杆菌属(Terrabacter)、芽孢杆菌属(Bacillus)、norank_f__Gemmatimonadaceae和norank_f__norank_o__C0119。与CK处理相比,T1处理下,norank_f__Roseiflexaceae、芽单胞菌属、芽孢杆菌属等的相对丰度分别增加了14.53%、51.58% 和12.39%,鞘氨醇单胞菌属和地杆菌属的相对丰度分别由5.44% 和2.28%下降为4.53% 和1.72%,分别下降了16.73% 和24.56%;T2处理增加了鞘氨醇单胞菌属和芽单胞菌属的相对丰度,降低了地杆菌属和芽孢杆菌属等的相对丰度,其中,芽孢杆菌属相对丰度由2.26% 下降为1.23%,下降了45.58%。
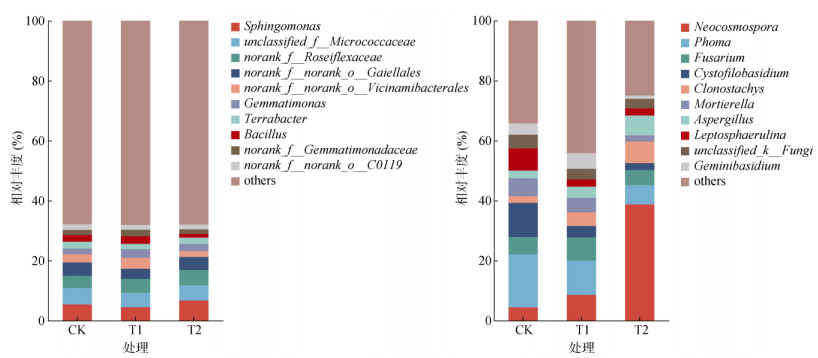
|
图 3 不同处理下土壤细菌(左)和真菌(右)属水平相对丰度 Fig. 3 Relative abundance of bacteria (left) and fungi (right) at genus level in soils under different treatments |
各处理相对丰度排名前10位的优势真菌菌属均为新赤壳菌属(Neocosmospora)、茎点霉属(Phoma)、镰刀菌属(Fusarium)、Cystofilobasidium、枝穗霉属(Clonostachys)、被孢霉属(Mortierella)、曲霉属(Aspergillus)、小光壳菌属(Leptosphaerulina)、未分类真菌属(unclassified_k__Fungi)、双子担子菌属(Geminibasidium)。T1和T2处理新赤壳菌属、枝穗霉属和曲霉属的相对丰度较CK处理均有所增加,茎点霉属、Cystofilobasidium、被孢霉属的相对丰度则有所下降,其中,新赤壳菌属的相对丰度分别增加了94.81% 和774.27%,枝穗霉属相对丰度分别增加了104.93% 和219.73%,而曲霉属相对丰度增加了48.02% 和161.90%,茎点霉属相对丰度降低了35.29% 和63.24%,Cystofilobasidium分别降低了66.87% 和79.79%,而被孢霉属则分别降低了19.44% 和64.45%。相较于CK处理,镰刀菌属的相对丰度在T1处理下增加了33.74%,而在T2处理下降低了12.70%。
2.3 土壤化学性质与土壤微生物群落组成的关系对不同处理下土壤微生物群落和土壤化学性质进行冗余分析(RDA),结果如图 4所示。对于细菌,RDA1轴的解释度为39.38%,RDA2轴的解释度为23.60%,总解释度为62.98%,土壤pH、硝态氮以及速效钾是影响细菌群落组成的关键土壤因子;对于真菌,RDA1轴的解释度为80.60%,RDA2轴的解释度为4.72%,总解释度为85.32%,其中,土壤pH、有效磷、速效钾以及硝态氮是影响真菌群落组成的关键土壤因子。
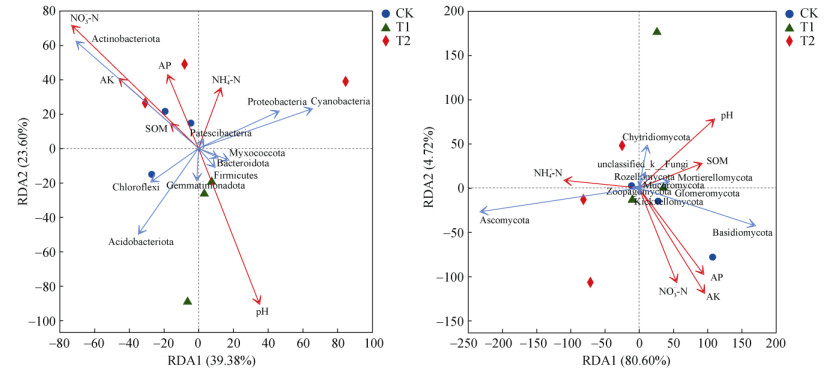
|
Actinobacteriota:放线菌门,Proteobacteria:变形菌门,Chloroflexi:绿弯菌门,Acidobacteriota:酸杆菌门,Gemmatimonadota:芽单胞菌门,Firmicutes:厚壁菌门,Myxococcota:粘球菌门,Bacteroidota:拟杆菌门,Cyanobacteria:蓝藻门,Patescibacteria:髌骨细菌门,Ascomycota:子囊菌门,Basidiomycota:担子菌门,Mortierellomycota:被孢霉门,unclassified_k__Fungi:未分类真菌门,Chytridiomycota:壶菌门,Rozellomycota:罗兹菌门,Mucoromycota:毛霉门,Glomeromycota:球囊菌门,Zoopagomycota:捕虫霉门,Kickxellomycota:梳霉亚门) 图 4 不同处理下土壤细菌(左)和真菌(右)群落RDA分析(门水平) Fig. 4 Redundancy analysis of soil bacterial and fungal communities under different treatments(phylum level) |
进一步对土壤中细菌和真菌的优势菌门相对丰度与土壤化学因子进行相关性分析,结果(表 3)表明,对于细菌,放线菌门与土壤pH呈显著负相关关系,与硝态氮呈显著正相关关系;芽单胞菌门与土壤有效磷呈显著负相关关系,而与土壤pH呈正相关关系。对于真菌,担子菌门与土壤pH呈显著正相关关系,被孢霉门与铵态氮呈显著负相关关系,毛霉门和梳霉亚门均与土壤有机质呈显著正相关关系。
|
|
表 3 土壤优势菌门与土壤化学因子的相关性分析 Table 3 Correlation analysis of soil dominant bacterial and fungal phyla and chemical characteristics |
花生长期连作导致的土壤理化性质的变化显著影响着花生的健康生长。已有研究表明,花生长期连作会降低土壤的有效养分含量,导致花生根系土壤营养元素失衡,且这种影响因连作年限和花生品种的不同而存在差异[17-18]。本研究中,过氧化氢和过氧化钙处理均显著降低了土壤中有效磷以及速效钾含量,这与王梓[19]、王凤娇等[20]的研究的结果不一致。一方面,这可能因为过氧化钙处理降低了土壤磷酸酶活性及其他相关微生物活性,磷、钾等元素在土壤中的转化受阻,从而导致其在土壤中的含量下降[21],但也有研究[22]表明,过氧化钙的添加可以促进生物修复,从而促进微生物将有机磷降解为正磷酸盐。另一方面,过氧化钙是一种良好的吸附剂,其施入土壤后易与土壤磷酸盐通过化学沉淀产生羟基磷酸钙,从而导致土壤中磷素的缺失[23]。因此,过氧化物处理土壤虽然可能会对某些养分的有效性产生影响,但整体上,它对土壤理化性质的影响是复杂的。因此,可以通过合理的土壤培肥手段,避免过氧化物所致养分有效性下降,从而提高过氧化物措施的有效性。
3.2 不同处理对土壤细菌和真菌群落组成的影响连作导致根际土壤微生态的失衡被认为是花生连作障碍最主要的成因[24]。已有研究表明,花生多年连作导致土壤微生物群落结构改变,细菌数量减少,真菌数量显著增加,土壤由“细菌型”转化为“真菌型”,病原菌聚集,有益菌生长受到抑制,最终导致花生产量品质的下降[25-27]。本研究中,过氧化钙处理提高了土壤细菌和真菌群落的丰富度和多样性,在门水平上过氧化物处理增加了变形菌门、芽单胞菌门、拟杆菌门、子囊菌门等的相对丰度,降低了绿弯菌门、被孢霉门等的相对丰度,而在属水平上,过氧化物处理均提高了芽单胞菌属和新赤壳菌属的相对丰度,降低了茎点霉属的相对丰度,同时,过氧化钙处理降低了鞘氨醇单胞菌属的相对丰度,增加了镰刀菌属的相对丰度,过氧化氢处理则同时降低了芽孢杆菌属和镰刀菌属的相对丰度。有研究表明,变形菌门与土壤抗病性密切相关[28];芽单胞菌门具有植物促生作用,拟杆菌门为富营养菌,密切参与土壤元素循环[29];鞘氨醇单胞菌属和芽孢杆菌属常作为生防菌应用于防治植物病害[30];茎点霉属常与土传病害密切相关[31]。镰刀菌属是连作花生土壤中最主要的病原真菌,其相对丰度的大小与花生根腐病的发病率密切相关[32]。因此,本研究结果表明,过氧化钙和过氧化氢处理均改善了连作花生土壤微生物环境,但不同过氧化物在对某些特定微生物群落尤其是镰刀菌属等病原真菌的影响方面存在差异,而这种差异对于作物生长的影响尚不明确,仍需要进一步探究。
3.3 土壤化学性质与土壤微生物群落组成的关系土壤理化因子作为土壤环境中的非生物部分,可以通过塑造对微生物有益或有害的生存环境影响微生物的群落结构组成和分布。本研究结果表明,土壤化学性质显著影响连作花生土壤细菌和真菌的群落结构,这与石程仁等[18]研究结果相一致。本研究的冗余分析结果与目前其他研究结果相似,如Chen等[33]的研究表明,土壤pH的提高可以显著提升根际土壤微生物多样性,增强土壤的抑菌效果;李莹等[34]的研究也表明,土壤有机质和有效磷是影响连作辣椒土壤细菌群落的关键土壤因子;田敬宇等[35]的研究则发现,影响哈密瓜根际土壤细菌群落的关键土壤因子是全磷和pH;孙海航等[36]研究了生物质炭对三七连作土壤真菌群落的影响后也发现,土壤pH、硝态氮、有效磷及速效钾是造成三七土壤真菌群落结构与多样性差异的关键土壤因子。此外,本研究中过氧化钙处理可能通过改变土壤中钙素含量从而影响了土壤微生物群落结构。迟晓元等[37]研究表明,钙肥施用可以显著提升土壤钙素含量,增加连作花生土壤有益真菌的相对丰度。可见,土壤细菌和真菌群落对土壤各理化因子的响应存在差异,而这种差异可能正是连作障碍发生的关键因素,同时,这也表明即使是同种微生物群落也会因作物类型、种植年限以及种植方式等的不同而存在差异。
4 结论本研究中,过氧化物处理显著降低了土壤有效磷、速效钾以及硝态氮的含量,过氧化钙处理提升了土壤pH,而过氧化氢处理则相反。过氧化钙处理提升了土壤细菌和真菌群落的多样性和丰富度,但差异未达到显著性水平。过氧化物添加均提高了芽单胞菌属和新赤壳菌属等有益菌属的相对丰度,降低了茎点霉属等有害菌属的相对丰度,同时,过氧化钙处理降低了有益菌属鞘氨醇单胞菌属的相对丰度,增加了有害致病菌属镰刀菌属的相对丰度,而过氧化氢处理则同时降低了有益菌属芽孢杆菌属和有害菌属镰刀菌属的相对丰度。土壤化学因子对土壤细菌和真菌群落的影响不同,铵态氮、硝态氮以及有机质是影响细菌群落组成的关键土壤因子,而铵态氮、速效钾、有效磷以及pH则是影响真菌群落组成的关键土壤因子。因此,过氧化物处理虽然在一定程度上改善了土壤微生物群落结构,但不同过氧化物对某些特定微生物群落尤其是与连作障碍密切相关的病原菌群的影响机制仍不明确,还需进一步探究。
| [1] |
曾瑞儿, 耿庆辉, 高恒宽, 等. 氮素调控花生共生结瘤的机制研究进展[J]. 遗传, 2023, 45(9): 801-812 (  0) 0) |
| [2] |
廖伯寿. 我国花生生产发展现状与潜力分析[J]. 中国油料作物学报, 2020, 42(2): 161-166 (  0) 0) |
| [3] |
李孝刚, 张桃林, 王兴祥. 花生连作土壤障碍机制研究进展[J]. 土壤, 2015, 47(2): 266-271 (  0) 0) |
| [4] |
王明珠, 陈学南. 低丘红壤区花生持续高产的障碍及对策[J]. 花生学报, 2005, 34(2): 17-22 (  0) 0) |
| [5] |
吴凤芝, 赵凤艳, 刘元英. 设施蔬菜连作障碍原因综合分析与防治措施[J]. 东北农业大学学报, 2000, 31(3): 241-247 (  0) 0) |
| [6] |
唐朝辉, 郭峰, 张佳蕾, 等. 花生连作障碍发生机理及其缓解对策研究进展[J]. 花生学报, 2019, 48(1): 66-70 (  0) 0) |
| [7] |
滕应, 任文杰, 李振高, 等. 花生连作障碍发生机理研究进展[J]. 土壤, 2015, 47(2): 259-265 (  0) 0) |
| [8] |
王兴祥, 张桃林, 戴传超. 连作花生土壤障碍原因及消除技术研究进展[J]. 土壤, 2010, 42(4): 505-512 (  0) 0) |
| [9] |
Li X G, Ding C F, Zhang T L, et al. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing[J]. Soil Biology and Biochemistry, 2014, 72: 11-18 (  0) 0) |
| [10] |
Li X G, Ding C F, Hua K, et al. Soil sickness of peanuts is attributable to modifications in soil microbes induced by peanut root exudates rather than to direct allelopathy[J]. Soil Biology and Biochemistry, 2014, 78: 149-159 (  0) 0) |
| [11] |
曹克丽, 邱璐, 万欣, 等. 土壤消毒法及其在土传病害防治中的研究与应用[J]. 湖北农业科学, 2021, 60(S2): 32-38 (  0) 0) |
| [12] |
习海玲, 赵三平, 周文. 基于过氧化物的消毒技术研究进展[J]. 环境科学, 2013, 34(5): 1645-1652 (  0) 0) |
| [13] |
Więckol-Ryk A, Thomas M, Białecka B. Improving the properties of degraded soils from industrial areas by using livestock waste with calcium peroxide as a green oxidizer[J]. Materials, 2021, 14(11): 3132 (  0) 0) |
| [14] |
Lu S G, Zhang X, Xue Y F. Application of calcium peroxide in water and soil treatment: A review[J]. Journal of Hazardous Materials, 2017, 337: 163-177 (  0) 0) |
| [15] |
鲁如坤. 土壤农业化学分析法[M].
中国农业科学技术出版社, 北京, 1999
(  0) 0) |
| [16] |
郭志明, 贺光忠, 李月英. 双波长紫外分光光度法测定水中硝酸盐氮方法的改进[J]. 中国卫生检验杂志, 2006(11): 1313-1314 (  0) 0) |
| [17] |
李忠, 江立庚, 唐荣华, 等. 连作对花生土壤酶活性、养分含量和植株产量的影响[J]. 土壤, 2018, 50(3): 491-497 DOI:10.13758/j.cnki.tr.2018.03.008 (  0) 0) |
| [18] |
石程仁, 禹山林, 杜秉海, 等. 连作花生土壤理化性质的变化特征及其与土壤微生物相关性分析[J]. 花生学报, 2018, 47(4): 1–6, 18 (  0) 0) |
| [19] |
王梓. 阿氏菌与过氧化钙配施对设施连作番茄生长效应及土壤环境的影响[D]. 泰安: 山东农业大学, 2023.
(  0) 0) |
| [20] |
王凤娇, 郭新送, 丁方军, 等. 腐植酸与枯草芽孢杆菌和过氧化钙对丹参连作田土壤肥力的影响[J]. 山东农业科学, 2021, 53(10): 85-90 (  0) 0) |
| [21] |
Małachowska-Jutsz A, Niesler M. The effect of calcium peroxide on the phenol oxidase and acid phosphatase activity and removal of fluoranthene from soil[J]. Water, Air, and Soil Pollution, 2015, 226(11): 365 (  0) 0) |
| [22] |
Hanh D N, Rajbhandari B K, Annachhatre A P. Bioremediation of sediments from intensive aquaculture shrimp farms by using calcium peroxide as slow oxygen release agent[J]. Environmental Technology, 2005, 26(5): 581-590 (  0) 0) |
| [23] |
岳薇, 李大鹏, 吴玲予, 等. CaO2@FA复合材料富集磷效能及其回收物对土壤改良作用[J]. 环境科学, 2022, 43(10): 4697-4705 (  0) 0) |
| [24] |
王小兵, 骆永明, 刘五星, 等. 红壤连作花生不同生育期根际微生物区系变化研究[J]. 扬州大学学报(农业与生命科学版), 2011, 32(4): 23–27, 38 (  0) 0) |
| [25] |
孙秀山, 封海胜, 万书波, 等. 连作花生田主要微生物类群与土壤酶活性变化及其交互作用[J]. 作物学报, 2001, 27(5): 617-621 (  0) 0) |
| [26] |
封海胜, 张思苏, 万书波, 等. 花生连作对土壤及根际微生物区系的影响[J]. 山东农业科学, 1993(1): 13-15 (  0) 0) |
| [27] |
姚小东, 李孝刚, 丁昌峰, 等. 连作和轮作模式下花生土壤微生物群落不同微域分布特征[J]. 土壤学报, 2019, 56(4): 975-985 (  0) 0) |
| [28] |
周信雁, 杨尚东. 番茄连作土壤中微生物群落的变化特征及其重塑研究进展[J]. 华中农业大学学报, 2024, 43(1): 1-8 (  0) 0) |
| [29] |
姜伟, 薛国萍, 白红梅, 等. 不同改良措施对黄瓜连作土壤细菌群落结构组成和多样性的影响[J]. 北方农业学报, 2022, 50(2): 28-37 (  0) 0) |
| [30] |
薛国萍, 白红梅, 杜金伟, 等. 不同处理措施对辣椒连作土壤细菌群落结构及多样性的影响[J]. 中国蔬菜, 2023(3): 78-84 (  0) 0) |
| [31] |
王政, 刘久羽, 李智, 等. 施用不同有益菌剂对长期连作烤烟根际土壤微生态的影响[J]. 西南农业学报, 2024, 37(3): 612-621 (  0) 0) |
| [32] |
魏世平, 吴萌, 李朋发, 等. 腐殖酸对花生连作地土壤真菌群落结构的影响[J]. 土壤学报, 2023, 60(3): 846-856 (  0) 0) |
| [33] |
Chen D L, Wang X X, Carrión V J, et al. Acidic amelioration of soil amendments improves soil health by impacting rhizosphere microbial assemblies[J]. Soil Biology and Biochemistry, 2022, 167: 108599 (  0) 0) |
| [34] |
李莹, 刘兰英, 姜宇杰, 等. 辣椒连作对土壤细菌群落的影响[J]. 微生物学报, 2023, 63(1): 297-318 (  0) 0) |
| [35] |
田敬宇, 高雁, 高兴旺, 等. 哈密瓜种植对根际土壤细菌群落组成和多样性的影响[J]. 新疆农业科学, 2023, 60(5): 1253-1262 (  0) 0) |
| [36] |
孙海航, 官会林, 王旭, 等. 生物炭对三七连作土壤性质及真菌群落的影响[J]. 生物技术通报, 2023, 39(2): 221-231 (  0) 0) |
| [37] |
迟晓元, 陈明娜, 许静, 等. 钙肥、铁肥对长期连作花生土壤真菌群落结构的影响[J]. 花生学报, 2023, 52(4): 7-18 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. National Engineering and Technology Research Center for Red Soil Improvement, Nanchang 330046, China
 2025, Vol. 57
2025, Vol. 57


