2. 中国科学院大学, 北京 100049
近年来,在化肥减施增效的政策指导下,我国氮肥利用率得到了一定的提升,据农业农村部统计,截至2020年我国主要粮食作物氮肥利用率比2015年提高5个百分点,达到40.2% 左右[1],但仍低于世界平均水平。未被作物吸收利用的盈余氮素会通过淋溶、径流、挥发等多种途径进入水体和大气,不仅增大了农业生产成本,威胁粮食安全,对环境安全也造成了巨大威胁[2-3]。土壤中的硝化与反硝化作用是造成农田氮损失的重要途径之一,其中硝化作用是指NH4+-N通过硝化微生物在好氧条件下转化为NO3–-N的过程[4]。该过程不仅加速了NO3–-N随水流失,污染环境,还会产生三大温室气体之一的N2O,它的增温潜势在百年尺度下能够达到CO2的298倍[5-6]。因此,探索调控土壤硝化作用的有效措施对于提高氮肥利用率,保障粮食安全和环境安全具有重要意义。
硝化抑制剂是一类能够调控土壤氮素的迁移转化,从而延长相对稳定NH4+-N存在时间的化合物[7]。很多研究证明硝化抑制剂不仅能有效减缓硝化作用,还能抑制土壤N2O的产生[8-10]。硝化抑制剂主要包括人工合成的化学硝化抑制剂(SNIs)和从植物中提取的天然生物硝化抑制剂(BNIs)。目前以双氰胺(Dicyandiamide,DCD)、3,4-二甲基吡唑磷酸盐(3,4-dimethylpyrazole phosphate,DMPP)和2-氯-6-三氯甲基吡啶(2-chloro-6-trichloromethyl pyridine 2-chloro-6-trichloromethyl pyridine,Nitrapyrin)这三大类为主的SNIs在农业上已得到了一定应用[11-14],但其存在二次污染风险、生产成本高等缺点,而植物源BNIs则较好地规避了这些局限性[7,15-16]。近年来,BNIs在热带牧草、大田作物、树木等中逐步被发现、提取和进行效应验证,如:臂形草内脂(Brachialactone)[17]、对羟基苯丙酸甲酯(Methyl 3-(4-hydroxyphenyl)propionate,MHPP)[18]、高粱酮(Sorgoleone)[19]、玉米酮[20]、6-甲氧基-2-苯并恶唑啉酮(MBOA)[21]、1,9-癸二醇(1,9-Decanediol)[22]、丁香酸(Syringic acid,SA)[23]、Nimin[24]和Neem[25]等。但BNIs的研究进程相对而言还比较短,在我国粮食需求大、氮肥使用量高、绿色农业标准严的发展背景下,对BNIs在土壤中的作用效应与机制探索具有广阔的应用市场和良好的发展潜力。
BNIs的应用被认为是一种绿色环境友好的抑制硝化与减少N2O排放的策略[7,15]。其中1,9-癸二醇对我国3种典型农田土壤(碱性潮土、中性水稻土和酸性红壤)硝化活性与N2O排放均有显著抑制作用,且在酸性土壤上的抑制效果强于中性和碱性土壤[26];MHPP在酸性紫色土上的硝化抑制效果强于中性紫色土,对N2O的减排效果则相反[27];高剂量的亚麻酸在硝化活性强的酸性土壤上有促进N2O排放的风险[28]。可见,不同BNIs在不同土壤类型上效果可能有较大差异。然而,目前BNIs的效应研究大多集中在单一土壤上[24,29],用量水平单一[9,30],缺乏不同因子的交互研究。本研究选取较易获得的丁香酸为目标物质,挑选了3种我国典型的农田土壤,设置不同剂量水平,研究丁香酸在3种不同土壤上对土壤硝化速率和N2O排放等的影响,探究影响丁香酸调控效果的主要因子,为后续BNIs在农业氮肥管理上的精准应用提供理论依据。
1 材料与方法 1.1 供试材料供试肥料:硫酸铵((NH4)2SO4分析纯),由南京化学试剂股份有限公司生产。
供试生物硝化抑制剂:丁香酸(SA,Sigma- Aldrich,美国)。
供试土壤分别是潮土、水稻土和黄壤。潮土采自河南封丘(35°00′N,114°24′E),水稻土采自江苏宜兴(31°17′ N,119°54′ E),黄壤采自贵州兴义(105°2'59"E,25°11'43"N)。3种类型土壤均取自农田耕作表层(0 ~ 20 cm),剔除新鲜土样中的杂物与残留根系,经自然风干后过2 mm筛备用,土壤基本理化性质见表 1。
|
|
表 1 供试土壤基本理化性质 Table 1 Basic physiochemical properties of tested soils |
试验采用室内土壤培养方法,均由100 mL玻璃盐水瓶培养,供试氮肥为(NH4)2SO4(N 100 mg/kg土),每种土壤类型设置3个处理:①(NH4)2SO4处理(CK,对照);②(NH4)2SO4+100 mg/kg SA处理(SA-100);③(NH4)2SO4+500 mg/kg SA处理(SA-500);每个处理设置3个重复。丁香酸(SA)的用量根据其他添加生物硝化抑制剂土壤培养试验的含量范围设置[23,29]。
称取过2 mm筛备用的干土10 g置于培养瓶中,加蒸馏水调节土壤含水量至40% 田间持水量(WHC),25 ℃恒温遮光培养。按试验处理称取不同质量的丁香酸溶于(NH4)2SO4,均匀混入土壤中,最终土壤含水量调节至60% WHC。每隔3天,打开瓶子进行曝气并称重,然后加入适量的去离子水以保持土壤水分。在培养第0、7、14天进行破坏性采集土壤样品。在加入处理液后的第1、2、3、4、5、7、14天进行N2O气体采集,每次采样前一天将玻璃瓶排气后用橡皮塞密封23 h,采样时用25 mL针筒注射器反复3次抽提后采集20 mL气体注入真空瓶内,用于测定N2O浓度。
1.3 测定方法土壤样品采用1 mol/L的KCl溶液浸提(m土∶VKCl=1∶10),振荡1 h后过滤得到浸提液,使用紫外可见分光光度计(D-8,南京菲勒仪器公司)测定NH4+-N、NO3–-N含量[31]。气相样品采用配备电子捕获色谱仪(ECD)的气相色谱仪(HP7820A,安捷伦科技,CA,美国)测定N2O浓度。
1.4 计算公式1) 土壤硝化速率。
| $ {R_{\text{n}}} = \left[ {{{\left( {{\text{NO}}_{\text{3}}^ - {\text{ - N}}} \right)}_t} - {{\left( {{\text{NO}}_{\text{3}}^ - {\text{ - N}}} \right)}_0}} \right]/t $ | (1) |
式中:Rn表示硝化速率,mg/(kg·d);t为间隔时间,d;(NO3–-N)0和(NO3–-N)t分别为0、t时的NO3–-N含量,mg/kg。平均硝化速率根据时间加权计算得出。
2) 土壤N2O产生速率。
| $ F = \frac{{{{\text{d}}_c}}}{{{{\text{d}}_t}}}\frac{M}{{{V_{\text{m}}}}}V\frac{{273}}{{273 + T}}\frac{1}{m} $ | (2) |
式中:F表示N2O排放通量,μg/(kg·d);M为N2O-N摩尔质量,28 g/mol;Vm为气体摩尔体积,22.4 L/mol;dc/dt为单位时间内培养瓶内气体浓度增加量,10–9/h;T为培养温度,℃;V为培养瓶中气体有效空间体积,L;m为培养瓶中干土重,kg。
| $ \sum {{\text{N}}_2}{\text{O}} = \sum \left[ {\left( {{F_{n + 1}} + {F_n}} \right)/2} \right] \times \left( {{D_{n + 1}} - {D_n}} \right)/1000 $ | (3) |
式中:
3) 生物硝化抑制剂对土壤硝化作用的抑制率。
| $ I = \frac{{\left( {A - B} \right)}}{A} \times 100 $ | (4) |
式中:I表示抑制率,%;A为对照组处理的硝化速率或N2O排放总量,B为添加生物硝化抑制剂处理组的硝化速率或N2O排放总量,mg/(kg·d) 或N2O-N μg/kg。
1.5 数据统计分析采用SPSS 25.0、Excel 2010、Origin 2018软件进行数据的统计分析与绘图,其中不同处理之间样品的差异显著性比较采用单因素方差分析(one-way ANOVA)和Tukey检验;土壤类型、硝化抑制剂浓度以及二者的交互作用对土壤硝化速率和N2O累积排放量的影响采用双因素方差分析;采用相关性热力图分析确定影响丁香酸对土壤硝化抑制效果与N2O减排的主导因素。
2 结果与分析 2.1 丁香酸对土壤硝化速率的影响如图 1所示,不同时间段潮土CK处理的硝化速率(12.63 ~ 16.74 mg/(kg·d))均明显高于水稻土(0.69 ~ 0.76 mg/(kg·d))和黄壤(7.05 ~ 8.16 mg/(kg·d)),说明碱性潮土的硝化作用较强烈。在0 ~ 14 d内,随着培养时间增长,潮土硝化速率有所下降。不同剂量丁香酸处理对潮土硝化作用均无显著抑制效果。与CK相比,SA-100的相对低用量丁香酸处理对水稻土硝化作用抑制效果不显著,高用量SA-500处理能显著抑制水稻土硝化作用(P < 0.05)。如图 1D,在第7天时,水稻土丁香酸的最高硝化抑制率达到55%。黄壤的硝化作用介于潮土与水稻土之间,丁香酸处理在0 ~ 7 d的硝化抑制作用最佳,SA-100和SA-500处理的硝化抑制率分别为30%、60%,有显著的剂量效应(P < 0.05)。
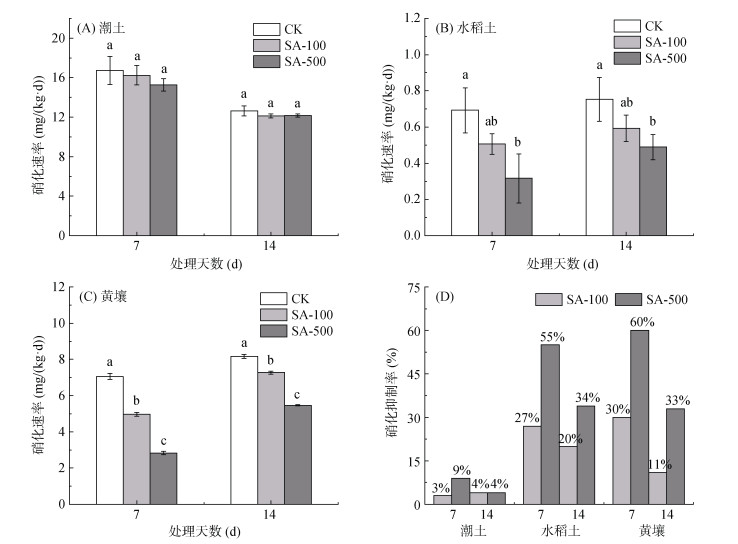
|
(图中小写字母不同表示处理间差异达P<0.05显著水平,下同) 图 1 不同剂量丁香酸处理对土壤硝化速率和硝化抑制率的影响 Fig. 1 Effects of different doses of SA treatments on soil nitrification rates and nitrification inhibition rates |
从CK来看,自然条件下潮土的N2O排放通量峰值(595 μg/(kg·d))高于黄壤(185 μg/(kg·d))和水稻土(77 μg/(kg·d))。N2O累积排放量(4.09 mg/kg)也高于黄壤(0.92 mg/kg)和水稻土(0.38 mg/kg)(图 2)。不同用量丁香酸对3种土壤的N2O排放影响不同。丁香酸在潮土上使N2O排放峰值分别延后了1 ~ 2 d,但对N2O累积排放量无显著减排效果。丁香酸在水稻土上第一天开始便显著抑制了土壤N2O的排放,前3 d抑制效果达到最佳,不同剂量处理不仅延后了N2O排放峰值3 ~ 5 d,对N2O累积排放量也达到了显著抑制(P < 0.05)。丁香酸在黄壤上也在第一天显著抑制了土壤N2O的排放,抑制效果的发挥主要在前5 d,对峰值出现时间影响不大,但显著抑制了土壤N2O累积排放量(P < 0.05)。丁香酸在水稻土上对N2O排放的抑制效果最强,100 mg/kg剂量的抑制率达到55%,500 mg/kg剂量的抑制率达到65%,没有剂量效应。丁香酸在黄壤上对N2O排放也能起到一定抑制效果,100 mg/kg剂量的抑制率为24%,500 mg/kg剂量的抑制率为13%,也无明显剂量效应。
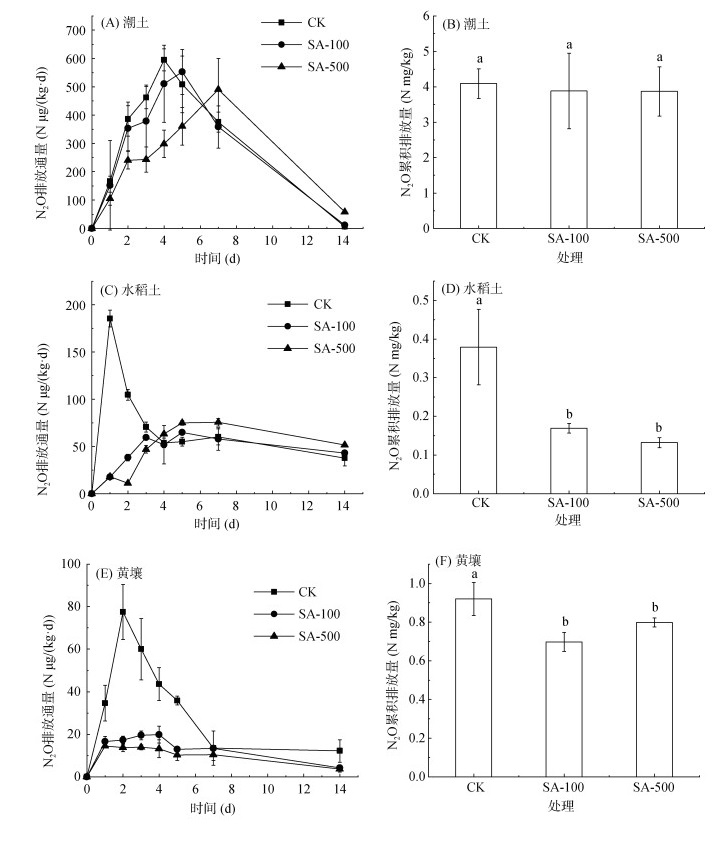
|
(A、B为潮土;C、D为水稻土;E、F为黄壤) 图 2 不同剂量丁香酸处理对土壤N2O排放的影响 Fig. 2 Effects of different doses of SA treatments on soil N2O emissions |
由表 2可知,土壤类型和硝化抑制剂含量显著影响了土壤硝化速率,且二者的影响具有交互作用。其中土壤类型除了显著影响硝化作用外,也与土壤N2O产生显著相关。硝化抑制剂含量则仅显著影响土壤的硝化作用,对土壤N2O的排放无显著影响。
|
|
表 2 土壤类型和丁香酸剂量对土壤硝化速率及N2O排放量的影响 Table 2 Effects of different soil types and nitrification inhibitor concentrations on soil nitrification and N2O emissions |
通过相关性热力图分析,进一步研究了土壤理化性质(pH、有机质含量、黏粒含量)和丁香酸含量等因子与土壤硝化速率、N2O排放的关系(图 3)。发现在丁香酸处理条件下,土壤pH与土壤硝化速率、土壤N2O排放存在显著正相关关系,即pH偏低情况下,丁香酸在土壤上的硝化抑制效果与N2O减排效果越好。此外,土壤有机质含量与土壤硝化作用和N2O排放存在显著负相关性。土壤黏粒含量和丁香酸的硝化抑制作用与土壤N2O产生也具有相关性,影响趋势与土壤有机质含量一致,即土壤有机质含量与黏粒含量较高情况下,丁香酸在土壤上的硝化抑制效果与N2O减排效果越好。
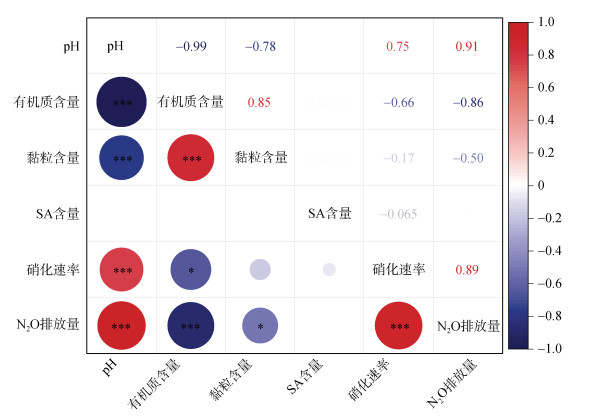
|
(*、**、***分别表示相关性达P < 0.05、P < 0.01和P < 0.001显著水平) 图 3 土壤属性与N2O排放量和硝化速率之间的相关性 Fig. 3 Correlations between soil properties with N2O emission and nitrification rate |
本研究结果表明,丁香酸的硝化抑制作用主要取决于土壤类型,而土壤类型之间的差异主要是由于土壤理化性质的不同,其中最重要的是土壤pH、有机质以及黏粒含量。土壤pH是调控土壤硝化过程的关键性因素[14,32-33],前人研究表明在偏中碱性范围内,硝化速率与土壤pH呈正相关关系[34],本研究中潮土的表观硝化率最大的结果与已有研究一致。与碱性土壤相比,丁香酸在酸性黄壤中的硝化抑制作用是最强的,这与丁香酸在不同pH的欧洲亚硝化单胞菌纯培养体系中的效果类似[23],也与以往其他天然BNIs如1,9-癸二醇、MHPP和亚麻酸等的抑制效果研究结论相一致[26,35]。这可能是因为:一方面,土壤pH对于物质的保持起决定性作用,目前广泛研究的BNIs多来源于生长在偏酸性环境的植物,如水稻、热带牧草等[16,22],偏酸性条件对丁香酸的生物有效性保持可能更有利;另一方面,土壤pH主导着土壤硝化过程关键性微生物氨氧化古菌(AOA)和氨氧化细菌(AOB)的生态位划分[32-33,36]。AOA主导酸性土壤的硝化作用,AOB主导中性和碱性土壤的硝化作用[37-38]。BNIs可以同时作用于AOA和AOB,从而与通常只能作用于AOB,在碱性土壤上作用更好的SNIs相比[39-40],在偏酸性土壤上的硝化抑制效果更佳,从而也抑制了土壤N2O的产生[41]。土壤有机质含量和黏粒含量也是影响丁香酸硝化抑制与N2O减排作用的关键因子。丁香酸在有机质、黏粒含量较高的水稻土和黄壤上抑制作用更好,这可能与有机质能促进土壤团粒结构形成有关[42]。本研究所选取的3种土壤中有机质含量较高的土壤黏粒含量也较高,为了维持土壤有机质的稳定性,它们常常与土壤黏粒结合形成有机无机复合体形式存在[43]。以往对于SNIs的研究发现,有机质与黏粒对硝化抑制剂的吸附能减少抑制剂的挥发损失,也限制了它们的生物有效性,从而降低其抑制效力[44-46]。对于BNIs而言,这种吸附可能延长了丁香酸在土壤中的保存时间,这使其与土壤NH4+以及氨氧化微生物之间在时空匹配上会更好,从而增强了其在土壤硝化作用与N2O产生上的抑制效力[23]。
此外,丁香酸的剂量也会影响其硝化抑制效应,在黄壤上用量增加,抑制效果更好。然而,丁香酸对土壤N2O的产生不具有剂量效应,且在黄壤上随着用量增加,丁香酸对土壤N2O减排作用反而有变弱趋势。这可能是由于BINs含量较高时,其结构中所含的碳为土壤微生物提供了碳源。因此,BNIs可能在抑制硝化产生N2O的同时,促进了反硝化源N2O,从而中和了一部分减排效果[47]。今后,硝化与反硝化过程对不同土壤N2O排放贡献解析将有助于阐明BNIs的剂量效应及其减排机理。鉴于BNIs发挥功能的剂量不是越高越好,从实际应用角度考虑,推荐BNIs在低剂量作为信号物质发挥功能,可以减少成本与温室气体排放[48]。
通过双因素方差分析进一步发现,丁香酸添加水平与土壤类型对硝化抑制效果具有交互影响,这表明在不同土壤上有必要考虑适宜的BNIs用量。相比单因子,多因子交互分析更好地模拟了实际土壤环境的复杂性[49],能为其他BNIs的调控效果研究提供参考。然而,本试验为短期培养,且仅选择了3种土壤,丁香酸的硝化抑制作用及其影响因子研究今后有必要在更多的土壤类型以及更长期的试验条件下进行验证。此外,丁香酸的硝化抑制作用及N2O减排效应可能与其能抑制土壤中AOA和AOB有关[23,29],同时也可能与其对反硝化过程参与的微生物基因的丰度影响有关[50]。因此,丁香酸对不同土壤硝化抑制效应不同的微生物机制也有待探索,从而为BNIs的精准应用提供更多的理论指导。
4 结论生物硝化抑制剂丁香酸在pH相对较低、有机质与黏土比例高的酸性黄壤和中酸性水稻土中具有较强的硝化抑制与N2O减排作用,在碱性、有机质与黏粒含量低的潮土上抑制作用有限。土壤类型与丁香酸添加量是影响其作用效果的关键性因子,且两者对土壤硝化抑制效果有交互影响。丁香酸在酸性与中性土壤上具有氮肥减施增效的潜力,这为未来基于天然生物硝化抑制剂新型绿色肥料的开发提供了理论依据。
| [1] |
农业农村部新闻办公室. 化肥农药使用量零增长行动目标顺利实现我国三大粮食作物化肥农药利用率双双达40%以上[OL]. 2021-01-17.
(  0) 0) |
| [2] |
黄微尘, 周丰, 梁浩, 等. 稻田氮磷径流流失模型研究进展[J]. 湖泊科学, 2021, 33(2): 336–348, 658–659 (  0) 0) |
| [3] |
Vitousek P M, Aber J D, Howarth R W, et al. Human alteration of the global nitrogen cycle: Sources and consequences[J]. Ecological Applications, 1997, 7(3): 737-750 (  0) 0) |
| [4] |
贺纪正, 张丽梅. 氨氧化微生物生态学与氮循环研究进展[J]. 生态学报, 2009, 29(1): 406-415 (  0) 0) |
| [5] |
Li Z X, Zhou F, Miao C Y, et al. Dataset of inland waters nitrogen deposition in China (1990s—2010s)[J]. Journal of Resources and Ecology, 2023, 14(3): 675-680 (  0) 0) |
| [6] |
夏龙龙, 颜晓元. 中国粮食作物生命周期生产过程温室气体排放的研究进展及展望[J]. 农业环境科学学报, 2020, 39(4): 665-672 (  0) 0) |
| [7] |
曾后清, 朱毅勇, 王火焰, 等. 生物硝化抑制剂——一种控制农田氮素流失的新策略[J]. 土壤学报, 2012, 49(2): 382-388 (  0) 0) |
| [8] |
金何玉, 张明超, 陈光蕾, 等. 硝化抑制剂对糯玉米产量和氮肥利用率的影响[J]. 华北农学报, 2020, 35(5): 171-177 (  0) 0) |
| [9] |
Yao Y L, Zeng K, Song Y Z. Biological nitrification inhibitor for reducing N2O and NH3 emissions simultaneously under root zone fertilization in a Chinese rice field[J]. Environmental Pollution, 2020, 264: 114821 (  0) 0) |
| [10] |
Simon P L, Dieckow J, Zanatta J A, et al. Does Brachiaria humidicola and dicyandiamide reduce nitrous oxide and ammonia emissions from cattle urine patches in the subtropics?[J]. Science of the Total Environment, 2020, 720: 137692 (  0) 0) |
| [11] |
孙海军, 闵炬, 施卫明, 等. 硝化抑制剂影响小麦产量、N2O与NH3排放的研究[J]. 土壤, 2017, 49(5): 876-881 DOI:10.13758/j.cnki.tr.2017.05.003 (  0) 0) |
| [12] |
张昊青, 赵学强, 张玲玉, 等. 石灰和双氰胺对红壤酸化和硝化作用的影响及其机制[J]. 土壤学报, 2021, 58(1): 169-179 (  0) 0) |
| [13] |
Wu S F, Wu L H, Shi Q W, et al. Effects of a new nitrification inhibitor 3, 4-dimethylpyrazole phosphate (DMPP) on nitrate and potassium leaching in two soils[J]. Journal of Environmental Sciences, 2007, 19(7): 841-847 (  0) 0) |
| [14] |
张忠庆, 高强. 硝化抑制剂2-氯-6-三氯甲基吡啶在农业中应用研究进展及其影响因素[J]. 中国土壤与肥料, 2022(4): 249-258 (  0) 0) |
| [15] |
陆玉芳, 施卫明. 生物硝化抑制剂的研究进展及其农业应用前景[J]. 土壤学报, 2021, 58(3): 545-557 (  0) 0) |
| [16] |
Subbarao G V, Rondon M, Ito O, et al. Biological nitrification inhibition (BNI)—Is it a widespread phenomenon?[J]. Plant and Soil, 2007, 294(1): 5-18 (  0) 0) |
| [17] |
Subbarao G V, Nakahara K, Hurtado M P, et al. Evidence for biological nitrification inhibition in Brachiaria pastures[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(41): 17302-17307 (  0) 0) |
| [18] |
Zakir H A K M, Subbarao G V, Pearse S J, et al. Detection, isolation and characterization of a root-exuded compound, methyl 3-(4-hydroxyphenyl) propionate, responsible for biological nitrification inhibition by Sorghum (Sorghum bicolor)[J]. New Phytologist, 2008, 180(2): 442-451 (  0) 0) |
| [19] |
Subbarao G V, Nakahara K, Ishikawa T, et al. Biological nitrification inhibition (BNI) activity in Sorghum and its characterization[J]. Plant and Soil, 2013, 366(1): 243-259 (  0) 0) |
| [20] |
Otaka J, Subbarao G V, Ono H, et al. Biological nitrification inhibition in maize—Isolation and identification of hydrophobic inhibitors from root exudates[J]. Biology and Fertility of Soils, 2022, 58(3): 251-264 (  0) 0) |
| [21] |
Otaka J, Subbarao G V, Jiang M L, et al. Isolation and characterization of the hydrophilic BNI compound, 6-methoxy-2(3H)-benzoxazolone (MBOA), from maize roots[J]. Plant and Soil, 2023, 489(1): 341-359 (  0) 0) |
| [22] |
Sun L, Lu Y F, Yu F W, et al. Biological nitrification inhibition by rice root exudates and its relationship with nitrogen-use efficiency[J]. New Phytologist, 2016, 212(3): 646-656 (  0) 0) |
| [23] |
Lu Y F, Zhang X N, Ma M K, et al. Syringic acid from rice as a biological nitrification and urease inhibitor and its synergism with 1, 9-decanediol[J]. Biology and Fertility of Soils, 2022, 58(3): 277-289 (  0) 0) |
| [24] |
Datta A, Adhya T K. Effects of organic nitrification inhibitors on methane and nitrous oxide emission from tropical rice paddy[J]. Atmospheric Environment, 2014, 92: 533-545 (  0) 0) |
| [25] |
Majumdar D, Kumar S, Pathak H, et al. Reducing nitrous oxide emission from an irrigated rice field of North India with nitrification inhibitors[J]. Agriculture, Ecosystems & Environment, 2000, 81(3): 163-169 (  0) 0) |
| [26] |
Lu Y F, Zhang X N, Jiang J F, et al. Effects of the biological nitrification inhibitor 1, 9-decanediol on nitrification and ammonia oxidizers in three agricultural soils[J]. Soil Biology and Biochemistry, 2019, 129: 48-59 (  0) 0) |
| [27] |
赖晶晶, 兰婷, 王启, 等. 硝化抑制剂对紫色土硝化作用及N2O排放的影响[J]. 农业环境科学学报, 2019, 38(6): 1420-1428 (  0) 0) |
| [28] |
Ma Y, Jones D L, Wang J Y, et al. Relative efficacy and stability of biological and synthetic nitrification inhibitors in a highly nitrifying soil: Evidence of apparent nitrification inhibition by linoleic acid and linolenic acid[J]. European Journal of Soil Science, 2021, 72(6): 2356-2371 (  0) 0) |
| [29] |
华瑶, 陆玉芳, 高维常, 等. 生物硝化抑制剂对黔西南黄壤硝化作用及N2O排放的影响[J]. 土壤, 2023, 55(3): 512-519 DOI:10.13758/j.cnki.tr.2023.03.007 (  0) 0) |
| [30] |
Lan T, Huang Y X, Song X, et al. Biological nitrification inhibitor co-application with urease inhibitor or biochar yield different synergistic interaction effects on NH3 volatilization, N leaching, and N use efficiency in a calcareous soil under rice cropping[J]. Environmental Pollution, 2022, 293: 118499 (  0) 0) |
| [31] |
鲍 士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [32] |
熊旭梅, 周雪, 郭佳, 等. 不同pH和氧气条件下土壤古菌与海洋古菌的竞争适应机制[J]. 土壤学报, 2022, 59(3): 833-843 (  0) 0) |
| [33] |
Zhang L M, Hu H W, Shen J P, et al. Ammonia-oxidizing Archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils[J]. The ISME Journal, 2012, 6(5): 1032-1045 (  0) 0) |
| [34] |
Kyveryga P M, Blackmer A M, Ellsworth J W, et al. Soil pH effects on nitrification of fall-applied anhydrous ammonia[J]. Soil Science Society of America Journal, 2004, 68(2): 545-551 (  0) 0) |
| [35] |
Lan T, Li M X, He X Q, et al. Effects of synthetic nitrification inhibitor (3, 4-dimethylpyrazole phosphate; DMPP) and biological nitrification inhibitor (methyl 3-(4-hydroxyphenyl) propionate; MHPP) on the gross N nitrification rate and ammonia oxidizers in two contrasting soils[J]. Biology and Fertility of Soils, 2022, 58(3): 333-344 (  0) 0) |
| [36] |
Wang B Z, Zhao J, Guo Z Y, et al. Differential contributions of ammonia oxidizers and nitrite oxidizers to nitrification in four paddy soils[J]. The ISME Journal, 2015, 9(5): 1062-1075 (  0) 0) |
| [37] |
贺纪正, 张丽梅. 土壤氮素转化的关键微生物过程及机制[J]. 微生物学通报, 2013, 40(1): 98-108 (  0) 0) |
| [38] |
王国强, 孙焕明, 彭婧, 等. 生物硝化抑制剂应用研究进展[J]. 安徽农业科学, 2016, 44(11): 66–69, 78 (  0) 0) |
| [39] |
张闻汉, 陈照明, 张金萍, 等. 硝化抑制剂对稻田土壤N2O排放及硝化作用的影响[J/OL]. 浙江农林大学学报. https://kns.cnki.net/kcms/detail/33.1370.S.20230427.1033.002.htm.
(  0) 0) |
| [40] |
Beeckman F, Motte H, Beeckman T. Nitrification in agricultural soils: Impact, actors and mitigation[J]. Current Opinion in Biotechnology, 2018, 50: 166-173 (  0) 0) |
| [41] |
杨钰, 赵永鉴, 宋晓桐, 等. 典型旱作农田土壤氧化亚氮排放的氨氧化微生物相对贡献[J/OL]. 土壤学报. https://kns.cnki.net/kcms2/detail/32.1119.P.20230609.1548.002.htm.
(  0) 0) |
| [42] |
施春亮, 付晓晨. 创造良好土壤团粒结构提高土壤种植效益[J]. 现代化农业, 2012(1): 23-24 (  0) 0) |
| [43] |
金维续, 王小平, 赵学蕴, 等. 探头超声处理分离土壤有机无机复合体的研究[J]. 土壤肥料, 1982(1): 37-39 (  0) 0) |
| [44] |
俞巧钢, 殷建祯, 马军伟, 等. 硝化抑制剂DMPP应用研究进展及其影响因素[J]. 农业环境科学学报, 2014, 33(6): 1057-1066 (  0) 0) |
| [45] |
李学红, 李东坡, 武志杰, 等. 脲酶/硝化抑制剂在黑土和褐土中对尿素氮转化的调控效果[J]. 应用生态学报, 2021, 32(4): 1352-1360 (  0) 0) |
| [46] |
薛妍, 武志杰, 张丽莉, 等. 土壤含水量、pH及有机质对DMPP硝化抑制效果的影响[J]. 应用生态学报, 2012, 23(10): 2663-2669 (  0) 0) |
| [47] |
Langarica-Fuentes A, Manrubia M, Giles M E, et al. Effect of model root exudate on denitrifier community dynamics and activity at different water-filled pore space levels in a fertilised soil[J]. Soil Biology and Biochemistry, 2018, 120: 70-79 (  0) 0) |
| [48] |
Lu Y F, Kronzucker H J, Yu M, et al. Nitrogen-loss and carbon-footprint reduction by plant-rhizosphere exudates[J]. Trends in Plant Science, 2024, 29(4): 469-481 (  0) 0) |
| [49] |
刘发波, 马笑, 张芬, 等. 硝化抑制剂对我国蔬菜生产产量、氮肥利用率和氧化亚氮减排效应的影响: Meta分析[J]. 环境科学, 2022, 43(11): 5140-5148 (  0) 0) |
| [50] |
马明坤, 陆玉芳, 王方嘉, 等. 不同生物硝化抑制剂对红壤性水稻土N2O排放的影响及其机制[J]. 土壤, 2024, 56(1): 19-27 DOI:10.13758/j.cnki.tr.2024.01.003 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57


