2. 福建师范大学地理科学学院, 福州 350007;
3. 闽江学院地理与海洋学院, 福州 350108;
4. 自然资源部东南生态脆弱区监测修复工程技术创新中心, 福州 350001
硝化作用是典型的由微生物主导的氮循环过程,是指氨在微生物的作用下被氧化为硝酸盐的过程。传统认为硝化作用由两步完成:先由氨氧化微生物,即氨氧化古菌(AOA)或氨氧化细菌(AOB),将氨氧化成亚硝酸盐;然后由亚硝酸盐氧化菌(NOB)将亚硝酸盐氧化成硝酸盐[1]。Costa等[2]提出了存在可以独立完成硝化过程的微生物。2015年,两个研究团队发现了具备单独将氨氧化为硝酸盐能力的微生物,并将其定义为完全氨氧化菌(comammox Nitrospira)[3-4]。完全氨氧化菌自发现以来,受到广泛关注。完全氨氧化菌在一系列陆地和水生生态系统中广泛存在,包括农业土壤、淡水栖息地和污水处理厂等[3-6]。
河口湿地位于河流和海洋的交汇处,具有物质交换频繁、物理化学生物变化多样等特征,是研究氨氧化微生物,尤其是完全氨氧化菌的理想区域[6]。闽江河口湿地是福建省面积最大、生态类型最齐全、冲淤演变最复杂的典型淤泥质滨海湿地。短叶茳芏是闽江河口鳝鱼滩湿地的典型植被,而互花米草入侵鳝鱼滩湿地已有十余年,在鳝鱼滩中西部形成一些大小不一的斑块。互花米草入侵带来一系列生态危害,例如取代本土植被、妨碍了潮沟和水道的畅通、降低生物多样性、妨碍鱼类对资源的利用等[7-10],以及降低土壤有效磷[11]。关于互花米草入侵对闽江河口湿地土壤有机碳及养分[12-13]、土壤孔隙水盐基离子浓度[14]、植物残体分解[15]等方面的影响研究已有很多,但对氨氧化微生物,尤其是新发现的完全氨氧化菌丰度影响的研究仍较为匮乏。
互花米草的治理方式中,将互花米草刈割后种植红树林是较为有效的方法。红树林是生长在热带亚热带海岸潮间带,以红树植物为主体的具有高生产力的木本植物群落[16]。红树林湿地生态系统生境与功能独特,不仅在防浪护岸、环境净化及保护生物多样性等方面价值显著,其碳储量及碳汇能力在全球碳平衡中的地位也极为重要[17]。有研究发现,刈草种林可恢复土壤碳含量[18],提高全氮与全磷的比值,降低有机碳与全氮比值。土壤含水率、全磷含量与刈草种林后红树林的生物量呈正相关[19]。但刈草种林如何影响氨氧化微生物丰度仍不清楚,制约着该治理方案的整体评估。
鉴于此,本研究选择了短叶茳芏湿地、互花米草入侵湿地、刈草种林后湿地土壤为研究对象,利用实时荧光定量PCR(聚合酶链式反应)技术,测定AOA、AOB、完全氨氧化菌clade A(COMXA)和clade B(COMXB)的amoA基因丰度,旨在阐明互花米草入侵及其刈草种林修复方式对闽江河口湿地土壤氨氧化微生物功能基因丰度,尤其是完全氨氧化菌功能基因丰度的影响,研究结果可为滨海湿地生态修复和可持续发展提供理论基础和科学依据。
1 材料与方法 1.1 样地概况及样品采集试验样地位于福建省闽江河口的鳝鱼滩湿地(25°50′ N,119°16′ E)。该地区年均气温为19.7 ℃,年均降水量约为1 346 mm,属于亚热带海洋性季风气候区。短叶茳芏是该区的典型土著植被,21世纪初互花米草入侵该地区,为了治理互花米草的危害,2020年夏季将互花米草刈割,然后种植红树林秋茄。分别于2022年8月和2023年2月采集短叶茳芏、互花米草和红树林湿地土壤。利用铁锹,按照五点采样法采集5个0 ~ 20 cm土柱,分别装入无菌塑料自封袋中,放置在装有冰袋的保温箱中立即送回实验室进行后续处理。用无菌镊子除去碎石和细根等杂物后,将每个土壤样品分为两份,一份放置于–80 ℃冰箱,用于DNA提取,另一份用于测定土壤基本理化性质。
1.2 土壤理化性质分析土壤基本理化性质的分析按照鲁如坤[20]方法进行:取10 g新鲜土壤样品,置于烘箱中,105 ℃烘干至恒重,测定土壤含水量;取5 g冷冻干燥后的土壤样品,加入25 mL经高温除去CO2的去离子水,振荡30 min,使用pH计(FE20-FiveEasyTMpH,MettlerToledo,德国)测定土壤pH。土壤全氮(TN)、有机碳(SOC)利用碳氮元素分析仪(VarioMAX,Elementar,德国)测定。土壤硝态氮(NO3–-N)和铵态氮(NH4+-N)含量用2 mol/L KCl溶液按照水土比5︰1(V︰m)提取,利用流动分析仪测定。土壤有效磷(AP)用盐酸氟化铵试剂浸提,钼蓝比色法测定。取10 g鲜土,离心后,使用便携式水质分析仪(HQ40d,HACH,美国)测定土壤盐度(Salinity)。此外,称取10 g新鲜土壤,加入50 mL去离子水,振荡离心后,利用0.45 μm滤膜过滤,用岛津碳氮分析仪(TOC Vcph,Shimadzu,Kyoto,日本)测定土壤可溶性有机碳(DOC)。
1.3 土壤总DNA提取和实时荧光定量PCR采用FastDNA SPIN Kit for Soil(MP Biomedicals,Santa Ana,CA,美国)试剂盒,按照说明书操作步骤提取土壤总DNA。氨氧化微生物的amoA基因丰度采用定量PCR(qPCR)方法利用CFX384 Optical Real-Time Detection System(Bio-Rad Laboratories Inc.,Hercules,CA,美国)进行测定。PCR引物序列和反应条件见表 1。扩增体系为10 μL,包含5 μL SYBR预混液、前后引物各0.1 μL、1 μL 10倍稀释的DNA模板和3.8 μL去离子水。每个样品重复3次,并设置3个阴性对照。标准曲线制作方法参考He等[24]进行。本试验中各反应的熔解曲线均为单峰,扩增效率介于87% ~ 105%,R2介于0.992 ~ 0.999。
|
|
表 1 定量PCR引物和热循环条件 Table 1 PCR primers and thermal cycling conditions |
采用SPSS19.0软件进行统计分析,所有数据在分析之前进行同质性和正态分布检验。采用双因素方差分析(Two-factor ANOVA)探讨植被类型和不同季节处理及其交互作用对土壤氨氧化基因丰度和土壤理化性质的影响。采用OriginPro 2021软件绘图。图表中数据为平均值±标准误。
2 结果与分析 2.1 土壤基本理化性质由表 2可知,植被类型和季节变化都显著影响土壤理化性质。短叶茳芏湿地土壤的pH在夏季和冬季分别为6.65和7.18,互花米草入侵对土壤pH无显著影响,但和互花米草入侵湿地相比,刈草种林湿地在夏季降低土壤pH。短叶茳芏湿地土壤夏季和冬季SOC含量分别为16.92和19.96 g/kg,DOC含量分别为102.68和111.04 mg/kg,互花米草入侵对土壤SOC和DOC无显著影响,但刈草种林显著降低DOC和冬季SOC含量。互花米草入侵对NH4+-N和夏季TN无显著影响,但显著提高NO3–-N含量。和互花米草入侵湿地相比,刈草种林均显著降低NO3–-N和TN含量,但对NH4+-N含量无显著影响。植被类型对AP无显著影响,对盐度影响规律不明显。季节变化对土壤理化性质的影响大致表现为和夏季相比,冬季的pH、SOC、TN和NH4+-N含量更高,盐度更低,而DOC、NO3–-N和AP含量相近。
|
|
表 2 植被类型和季节变化对土壤基本理化性质的影响 Table 2 Effects of different plant species and seasons on soil properties |
由表 3可知,植被类型显著影响AOA和AOB丰度,对COMXA和COMXB丰度无显著影响。季节变化仅显著影响AOB丰度,而植被类型和季节变化的交互作用对所有氨氧化微生物功能基因丰度均无显著影响。
|
|
表 3 植被类型和季节变化对氨氧化微生物丰度影响的双因素方差分析 Table 3 Two-factor variance analysis of plant species and seasons on ammonia oxidizer abundance |
从图 1可以看出,短叶茳芏湿地土壤AOA amoA基因拷贝数在夏季和冬季分别为7.80×108 copies/g和7.16×108 copies/g,互花米草入侵对AOA amoA基因丰度无显著影响,但刈草种林显著降低了AOA amoA基因丰度。季节变化对AOA amoA基因丰度无显著影响。短叶茳芏湿地土壤AOB amoA基因拷贝数在夏季和冬季分别为5.21×107 copies/g和7.96× 107copies/g,互花米草入侵对AOB amoA基因拷贝数无显著影响,刈草种林仅在冬季显著增加AOB amoA基因拷贝数。此外,冬季3种植被类型湿地的AOB基因丰度均高于夏季。短叶茳芏湿地土壤COMXA基因拷贝数在夏季和冬季分别为2.43×108 copies/g和2.95×108 copies/g,互花米草入侵显著降低了冬季COMXA基因丰度,刈草种林对COMXA丰度无显著影响。3种植被湿地土壤COMXB基因拷贝数为2.49×107 ~ 4.56×107 copies/g,除夏季的互花米草湿地外,植被类型和季节变化对COMXB基因拷贝数均无显著影响。
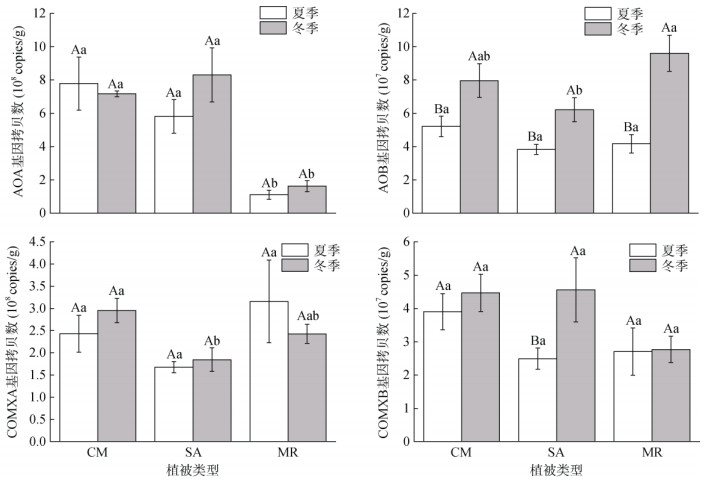
|
(图中大写字母不同表示同一植被类型不同季节间差异显著(P<0.05),小写字母不同表示同一季节不同植被类型间差异显著(P<0.05)) 图 1 植被类型和季节变化对滨海湿地土壤氨氧化微生物丰度的影响 Fig. 1 Effects of different plant species and seasons on ammonia oxidizer abundance in coastal wetland soils |
随机森林模型分析表明,土壤DOC含量是影响AOA丰度最主要的环境因子,SOC和NH4+-N对AOA基因丰度也有显著影响(图 2);相关性分析表明,AOA丰度与SOC和DOC呈显著正相关(图 3)。TN是影响AOB丰度最主要的环境因子,NH4+-N和Salinity也显著影响AOB丰度(图 2);AOB丰度与TN和Salinity呈显著负相关,但与pH、SOC、NO3–-N和NH4+-N呈显著正相关(图 3)。TN是影响COMXA丰度最主要的环境因子,而所测定土壤理化性质对COMXB丰度均无显著影响。
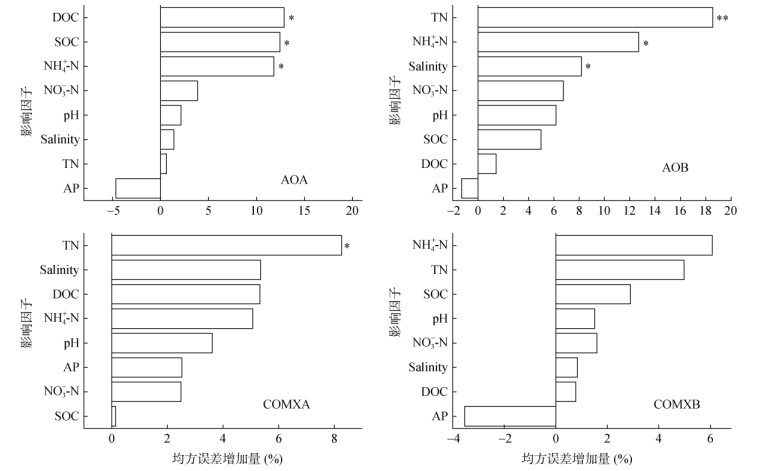
|
(*和**分别表示达P < 0.05和P < 0.01显著水平,下图同) 图 2 氨氧化微生物丰度与土壤理化性质的随机森林分析 Fig. 2 Random forest analysis of ammonia oxidizer abundance and soil physicochemical properties |
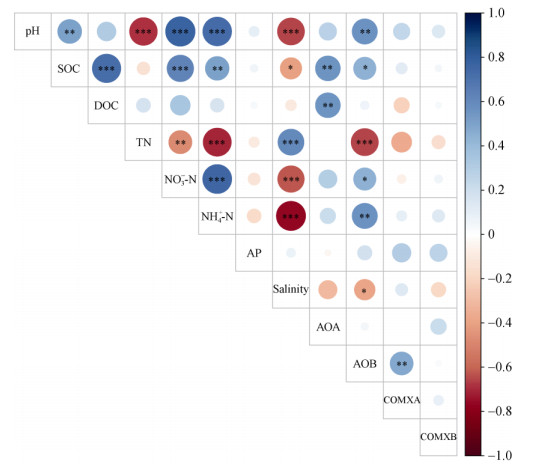
|
图 3 氨氧化微生物丰度与土壤理化性质的相关性 Fig. 3 Correlation between ammonia oxidizer abundance and soil physicochemical properties |
鳝鱼滩湿地的土壤pH整体呈中性,互花米草入侵对土壤pH影响较小,但刈草种林后显著降低夏季土壤pH。这可能是由于红树林含有较多酸性的有机物质,在夏季快速发酵产生有机酸,从而导致pH下降[25]。此外,红树林湿地的硫含量比互花米草高,而土壤中硫化物会显著影响土壤pH,随着硫含量增加,土壤pH呈对数下降[26]。再者,前人研究也表明,土壤pH与全硫含量呈负相关关系[27]。因此,由于红树林湿地硫含量比互花米草高,促进硫循环,刈草种林后显著降低了夏季土壤pH。本研究发现,互花米草入侵显著增加NO3–-N含量,而刈草种林则显著降低湿地土壤NO3–-N含量,这可能是因为互花米草的生物量和根系分泌物均比土著植物高[28],根际微生物活性也高于土著群落,从而促进土壤硝化作用,使大量NH4+-N转化为NO3–-N。
季节变化同样显著影响滨海湿地土壤的理化性质,冬季土壤pH,SOC、TN和NH4+-N含量均显著高于夏季,盐度则显著低于夏季。这可能是由于土壤温度可以通过影响有机质的分解、矿物质的风化、养分的转化等影响土壤养分有效性[29]。前人研究同样表明,凉爽季节向温暖季节转化会导致土壤SOC的损失[30-31]。
3.2 植被类型和季节变化对土壤氨氧化微生物功能基因丰度的影响不同植被类型湿地土壤中,AOA的amoA基因丰度最高,表明AOA在闽江河口湿地土壤中是丰度最高的氨氧化微生物。互花米草入侵对AOA无显著影响,但刈草种林显著降低AOA丰度。可能原因如下:①AOA偏好低NH3浓度环境,尤其是NH3主要来源于有机氮矿化的环境[32-33],因此,SOC含量可能是影响AOA丰度的重要因素。AOA丰度与SOC和DOC呈显著正相关(图 2、图 3),因此,刈草种林导致的SOC和DOC含量下降可能是其AOA丰度下降的重要因素。互花米草入侵增加了土壤含水率,创造了厌氧环境,有利于碳的积累[34];此外,刈草种林可能会移除互花米草生物量,减少有机物质的输入,同时将土壤有机质暴露在空气中,加快土壤SOC和DOC的分解。②相较于草本植物短叶茳芏和互花米草,木本植物红树林可能含有一些不利于AOA生长的物质,例如,红树林向土壤中释放的有机酸、氢硫酸等致酸物质相对较多[35],从而降低AOA丰度,但其潜在机制仍有待进一步挖掘。与AOA相反,刈草种林提高了冬季AOB丰度,这可能说明AOB的生态位与AOA不一致,不喜欢高有机氮的环境。AOB丰度与TN呈显著负相关也佐证了这一观点,然而AOB偏好红树林湿地土壤的机制仍有待进一步研究。此外,双因素方差分析表明,植被类型对完全氨氧化菌clade A和clade B均无显著影响(表 3),这可能是由于完全氨氧化菌比AOA和AOB拥有更宽的生态位,可以适应贫营养和富营养的环境,对环境变化的响应效果对较弱。
本研究结果表明,季节变化仅对AOB基因丰度有显著影响,AOB丰度在冬季高于夏季。可能的原因:①氨氧化微生物对温度的适应能力不同,AOB可能更偏好中低温的环境[36]。目前发现的AOB菌株均属于喜中低温菌,且采样点处于亚热带地区,冬季的日均温普遍高于10 ℃,因此,冬季温度更加适合AOB的生长;②相比于AOA,AOB对NH3亲和力较低,更喜欢在高NH3的碱性环境生存[37],而本研究夏季土壤pH显著低于冬季,限制AOB生长,这可能是冬季AOB丰度高于夏季的重要原因。
4 结论互花米草入侵和刈草种林修复措施均显著影响土壤理化性质,其中,互花米草入侵提高土壤NO3–-N含量,而刈草种林则降低NO3–-N含量。冬季土壤pH,SOC、TN和NH4+-N含量均显著高于夏季,盐度则显著低于夏季。植被类型显著影响AOA和AOB丰度,季节变化仅显著影响AOB丰度。互花米草入侵显著降低了冬季COMXA基因丰度,刈草种林则显著降低AOA amoA基因丰度,但增加冬季AOB amoA基因丰度。3种植被类型湿地冬季的AOB基因丰度均高于夏季。
| [1] |
贺纪正, 张丽梅. 土壤氮素转化的关键微生物过程及机制[J]. 微生物学通报, 2013, 40(1): 98-108 (  0) 0) |
| [2] |
Costa E, Pérez J, Kreft J U. Why is metabolic labour divided in nitrification?[J]. Trends in Microbiology, 2006, 14(5): 213-219 DOI:10.1016/j.tim.2006.03.006 (  0) 0) |
| [3] |
Daims H, Lebedeva E V, Pjevac P, et al. Complete nitrification by Nitrospira bacteria[J]. Nature, 2015, 528(7583): 504-509 DOI:10.1038/nature16461 (  0) 0) |
| [4] |
van Kessel M A H J, Speth D R, Albertsen M, et al. Complete nitrification by a single microorganism[J]. Nature, 2015, 528(7583): 555-559 DOI:10.1038/nature16459 (  0) 0) |
| [5] |
Pinto A J, Marcus D N, Ijaz U Z, et al. Metagenomic evidence for the presence of comammox Nitrospira-like bacteria in a drinking water system[J]. mSphere, 2015, 1(1): e00054-15 (  0) 0) |
| [6] |
Sun Z G, Sun W G, Tong C, et al. China's coastal wetlands: Conservation history, implementation efforts, existing issues and strategies for future improvement[J]. Environment International, 2015, 79: 25-41 DOI:10.1016/j.envint.2015.02.017 (  0) 0) |
| [7] |
Chen Z Y, Li B, Zhong Y, et al. Local competitive effects of introduced Spartina alterniflora on Scirpus mariqueter at Dongtan of Chongming Island, the Yangtze River estuary and their potential ecological consequences[J]. Hydrobiologia, 2004, 528(1): 99-106 (  0) 0) |
| [8] |
Liu C Y, Jiang H X, Zhang S Q, et al. Expansion and management implications of invasive alien Spartina alterniflora in Yancheng salt marshes, China[J]. Open Journal of Ecology, 2016, 6(3): 113-128 DOI:10.4236/oje.2016.63012 (  0) 0) |
| [9] |
Daehler C C, Strong D R. Status, prediction and prevention of introduced cordgrass Spartina spp. invasions in Pacific estuaries, USA[J]. Biological Conservation, 1996, 78(1/2): 51-58 (  0) 0) |
| [10] |
陈潘, 张燕, 朱晓静, 等. 互花米草入侵对鸟类的生态影响[J]. 生态学报, 2019, 39(7): 2282-2290 (  0) 0) |
| [11] |
黄庄, 黑杰, 刘旭阳, 等. 互花米草入侵对滨海湿地不同质地土壤碳氮磷及其生态化学计量比的影响[J]. 土壤, 2023, 55(2): 340-347 DOI:10.13758/j.cnki.tr.2023.02.014 (  0) 0) |
| [12] |
李丽纯, 林瑞坤, 吴振海, 等. 闽江口湿地互花米草地上生物量的月动态特征[J]. 资源科学, 2009, 31(11): 1967-1972 DOI:10.3321/j.issn:1007-7588.2009.11.019 (  0) 0) |
| [13] |
仝川, 李旭伟, 雍石泉, 等. 闽江口互花米草不同治理方式对土壤有机碳及养分含量的影响[J]. 水土保持学报, 2012, 26(4): 138-142 (  0) 0) |
| [14] |
翟水晶, 田琳琳, 仝川. 闽江河口短叶茳芏和互花米草沼泽土壤剖面间隙水营养盐含量比较[J]. 湿地科学, 2013, 11(1): 68-74 DOI:10.3969/j.issn.1672-5948.2013.01.011 (  0) 0) |
| [15] |
曾从盛, 张林海, 王天鹅, 等. 闽江河口湿地植物枯落物立枯和倒伏分解主要元素动态[J]. 生态学报, 2012, 32(20): 6289-6299 (  0) 0) |
| [16] |
Lee S Y, Primavera J H, Dahdouh-Guebas F, et al. Ecological role and services of tropical mangrove ecosystems: A reassessment[J]. Global Ecology and Biogeography, 2014, 23(7): 726-743 DOI:10.1111/geb.12155 (  0) 0) |
| [17] |
Brander L M, Wagtendonk A J, Hussain S S, et al. Ecosystem service values for mangroves in Southeast Asia: A meta-analysis and value transfer application[J]. Ecosystem Services, 2012, 1(1): 62-69 DOI:10.1016/j.ecoser.2012.06.003 (  0) 0) |
| [18] |
Lunstrum A, Chen L Z. Soil carbon stocks and accumulation in young mangrove forests[J]. Soil Biology and Biochemistry, 2014, 75: 223-232 DOI:10.1016/j.soilbio.2014.04.008 (  0) 0) |
| [19] |
Feng J X, Zhou J, Wang L M, et al. Effects of short-term invasion of Spartina alterniflora and the subsequent restoration of native mangroves on the soil organic carbon, nitrogen and phosphorus stock[J]. Chemosphere, 2017, 184: 774-783 DOI:10.1016/j.chemosphere.2017.06.060 (  0) 0) |
| [20] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [21] |
Francis C A, Roberts K J, Beman J M, et al. Ubiquity and diversity of ammonia-oxidizing Archaea in water columns and sediments of the ocean[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(41): 14683-14688 (  0) 0) |
| [22] |
Rotthauwe J H, Witzel K P, Liesack W. The ammonia monooxygenase structural gene AmoA as a functional marker: Molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied and Environmental Microbiology, 1997, 63(12): 4704-4712 DOI:10.1128/aem.63.12.4704-4712.1997 (  0) 0) |
| [23] |
Jiang R, Wang J G, Zhu T, et al. Use of newly designed primers for quantification of complete ammonia-oxidizing (comammox) bacterial clades and strict nitrite oxidizers in the genus Nitrospira[J]. Applied and Environmental Microbiology, 2020, 86(20): e01775-20 (  0) 0) |
| [24] |
He J Z, Shen J P, Zhang L M, et al. Quantitative analyses of the abundance and composition of ammonia-oxidizing bacteria and ammonia-oxidizing Archaea of a Chinese upland red soil under long-term fertilization practices[J]. Environmental Microbiology, 2007, 9(9): 2364-2374 DOI:10.1111/j.1462-2920.2007.01358.x (  0) 0) |
| [25] |
Jayalath N, Fitzpatrick R W, Mosley L, et al. Type of organic carbon amendment influences pH changes in acid sulfate soils in flooded and dry conditions[J]. Journal of Soils and Sediments, 2016, 16(2): 518-526 DOI:10.1007/s11368-015-1240-1 (  0) 0) |
| [26] |
何琴飞, 蒋燚, 刘秀, 等. 钦州湾不同类型红树林土壤因子调查与分析[J]. 湿地科学与管理, 2011, 7(3): 45-48 (  0) 0) |
| [27] |
龚子同, 张效朴. 中国的红树林与酸性硫酸盐土[J]. 土壤学报, 1994, 31(1): 86-94 (  0) 0) |
| [28] |
陈秋宇, 杨仁敏, 朱长明. 基于VIS-NIR光谱的互花米草入侵湿地土壤有机碳预测研究[J]. 土壤学报, 2021, 58(3): 694-703 (  0) 0) |
| [29] |
傅国海, 刘文科. 日光温室甜椒起垄内嵌式基质栽培根区温度日变化特征[J]. 中国生态农业学报, 2016, 24(1): 47-55 (  0) 0) |
| [30] |
Lipson D A, Schmidt S K, Monson R K. Carbon availability and temperature control the post-snowmelt decline in alpine soil microbial biomass[J]. Soil Biology and Biochemistry, 2000, 32(4): 441-448 (  0) 0) |
| [31] |
Corre M D, Schnabel R R, Shaffer J A. Evaluation of soil organic carbon under forests, cool-season and warm-season grasses in the northeastern US[J]. Soil Biology and Biochemistry, 1999, 31(11): 1531-1539 (  0) 0) |
| [32] |
Di H J, Cameron K C, Shen J P, et al. Nitrification driven by bacteria and not Archaea in nitrogen-rich grassland soils[J]. Nature Geoscience, 2009, 2: 621-624 (  0) 0) |
| [33] |
Shen J P, Zhang L M, Di H J, et al. A review of ammonia-oxidizing bacteria and Archaea in Chinese soils[J]. Frontiers in Microbiology, 2012, 3: 296 (  0) 0) |
| [34] |
Yang W, An S Q, Zhao H, et al. Impacts of Spartina alterniflora invasion on soil organic carbon and nitrogen pools sizes, stability, and turnover in a coastal salt marsh of Eastern China[J]. Ecological Engineering, 2016, 86: 174-182 (  0) 0) |
| [35] |
廖金凤. 雷州半岛红树林盐土的某些理化性质[J]. 土壤, 2004, 36(5): 561-564 (  0) 0) |
| [36] |
Jiang Q Q, Bakken L R. Comparison of Nitrosospira strains isolated from terrestrial environments[J]. FEMS Microbiology Ecology, 1999, 30(2): 171-186 (  0) 0) |
| [37] |
Martens-Habbena W, Berube P M, Urakawa H, et al. Ammonia oxidation kinetics determine niche separation of nitrifying Archaea and Bacteria[J]. Nature, 2009, 461(7266): 976-979 (  0) 0) |
2. School of Geographical Sciences, Fujian Normal University, Fuzhou 350007, China;
3. School of Geography and Oceanography, Minjiang University, Fuzhou 350108, China;
4. Southeast Ecological Fragile Area Monitoring and Restoration Engineering Innovation Center, Ministry of Natural Resources, Fuzhou 350001, China
 2025, Vol. 57
2025, Vol. 57


