2. 中国科学院大学, 北京 100049
玉米是我国重要的粮食作物,氮素是玉米最重要营养元素之一,合理施氮能有效提高玉米的产量和品质[1]。然而,部分氮肥通过氨挥发、硝化和反硝化作用、淋洗和径流等途径损失到环境中[2],导致氮肥利用率降低[3-4]。其中,硝化作用和反硝化作用造成的氮素损失在农业生产中的占比较高[5]。施用化学合成硝化抑制剂(SNIs)是抑制硝化过程的常用手段之一[6-7]。研究表明,SNIs能控制玉米氮素损失和提高产量与品质[8-9],减少土壤酸化[10]。但目前SNIs种类较少,还存在影响环境质量与食品安全等风险[11]。
生物硝化抑制剂(BNIs)是一类由植物本身分泌,能抑制硝化作用的物质[12]。相比于SNIs而言对环境更加友好[13],它是现代农业中提高氮肥利用率和减少环境污染的新策略[13-14]。因此,玉米BNIs的研究对于推进玉米化肥减施增效与农业绿色发展具有重要意义。根系分泌的BNIs分为水溶性和脂溶性两类[15]。水溶性BNIs容易随溶液流失,而脂溶性BNIs移动性弱,主要在根表附近起作用,更为稳定[16]。同时,脂溶性分泌物往往能作为化学信号,在植物养分吸收、抗病、抗逆等方面起到“四两拨千斤”的作用[17-18],对于玉米总硝化活性抑制(BNI)贡献达一半[19]。
植物品种之间由于基因组不同,根系分泌物的生物活性存在较大差异。多品种植物根系分泌物同步收集是植物–微生物互作领域的技术基础,也是一大难点。一方面,可以通过多品种分泌物活性比较,筛选高活性品种进行后续物质鉴定[20-21]。另外,还可以结合其他指标进行全基因组关联分析,寻求植物根系调控的关键遗传位点[22-24]。然而,目前常用的传统水培收集体系在进行多品种根系分泌物收集时存在培育周期长、占地面积大、收集效率低、多批次误差大等不足[25-26]。Dessureault-Rompré等[27]和王占义等[28]对其做出了一定的改进,但仍很难在小空间内实现大量品种(超过10个品种)同时收集,更无法满足几十或上百个植物品种根系分泌物活性对比研究的试验需求。
综上,本研究旨在设计一种同时/同步收集多品种玉米苗期脂溶性根系分泌物的收集体系(以下简称新收集体系),比较该新收集体系与传统水培收集体系的收集效率差异,并检测不同玉米品种根系分泌物中生物硝化抑制活性,为后续玉米源新的BNIs物质挖掘和玉米BNIs分泌的遗传位点研究奠定基础。
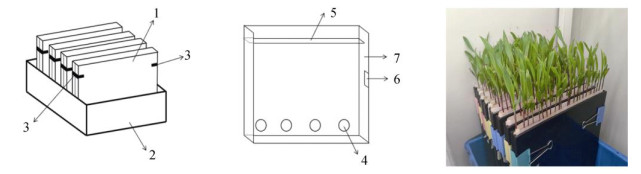
1 材料与方法 1.1 新型多品种根系分泌物同步收集体系本新收集体系包括培养装置和收集方法。如图 1所示,培养装置由固持板、储水箱和活动卡扣3部分构成。其原理和操作步骤是:植物种子先在培养皿中萌发,之后放入固持板中由板内滤纸夹住继续生长,借助重力作用和黑色有机玻璃板内壁使其根系能够竖直生长。待植物在固持板内生长到一定生物量后(大概12 d),通过合适的有机溶剂对其根表进行淋洗或浸泡等收集方法达到脂溶性根系分泌物收集的目的。由图 1可见,固持板由进出水孔、支撑凸槽、内部卡扣、滤纸4个部分组成。固持板的规格为30 cm×30 cm×1 cm,板体采用黑色有机玻璃制作,可以保证植物根系在避光条件下引导其竖直生长。固持板两片为一组,由板内卡扣嵌合后接近竖直(85°左右)放置,由于玉米苗期主要营养由种子供给,所以采取200 mmol/L CaCl2溶液作为培养液以维持其渗透压平衡。培养过程中纯水液面不超过进出水孔上端。滤纸为快速定性滤纸,板内壁采用滤纸包被植物种子,并利用滤纸的吸水能力向植物种子和培育过程中的植物根系提供水分。储水箱规格为35 cm× 50 cm×10 cm,内部可同时放置20组固持板,其规格可随试验所需组数灵活调整。活动卡扣主要用来保证固持板嵌合紧密。当玉米植株在固持板内生长12 d后,可以发现部分玉米根系长至进出水口处。此时即可进行根系分泌物的收集:拆卸固持板,取出板内滤纸包被的植物根系,去除顶部受光照作用的红根部分和下端进出水口以下被营养液没过部分,称取10 g剩余根系,用250 mL二氯甲烷对其根部剩余部分浸泡2 d收集其脂溶性根系分泌物。将收集的二氯甲烷冲洗液或浸泡液经过旋转蒸发仪(Eyela,N-1100D- WD,日本)在40 ℃下蒸干后加入2 mL甲醇溶解提取,经过0.22 μm孔径有机相滤膜过滤后重新用甲醇定容至2 mL即可进行保存或使用。定容后的甲醇溶液称之为新收集体系甲醇提取液。
|
(1.固持板;2.储水箱;3.活动卡扣;4.进出水孔;5.支撑凸槽;6.内部卡扣;7.滤纸) 图 1 新型玉米培养装置 Fig. 1 New corn cultivation device |
水培收集体系同样选择纯水作为培养液,其主要操作步骤为:使用纯水润湿过的海绵将萌发的植物种子固定在周转箱(0.2 m×0.3 m)顶部带孔有机玻璃板中,向周转箱内加纯水至液面接触种子。每两天更换一次纯水。待玉米植株累计生长12 d后,选择长势相近的玉米植株6 ~ 8株转移至1 L装满纯水的烧杯中避光培养2 d,收集培养后的水溶液经0.22 μm孔径水相滤膜过滤,经由旋转蒸发仪(Eyela,N-1100D-WD,日本)在40 ℃下蒸干后加入2 mL甲醇溶解提取。该甲醇溶液称之为水培甲醇提取液。
1.3 植物材料的选取与培育选取6个我国东北地区玉米主栽品种吉单33、1908D、海禾116、翔旺9、北育851、先亚983,以及4个全国主栽品种金玉188、瑞普909、郑单958、先玉335,共10个品种玉米种子作为植物材料。将供试玉米种子洗去包衣后用5% 次氯酸钠溶液消毒,加入纯水没过种子浸泡1 d使其充分吸水。第二天将吸饱水的种子转至培养皿中萌发。1 d后,选取大小一致的萌发种子平铺于湿润滤纸凸槽处,每组固持板15 ~ 20颗。将固持板组装好后竖直放置于储水箱中并加入纯水,每两天更换储水箱中纯水并保持其液面始终高于出水孔口。水培体系中,将萌发后的种子通过海绵包被移入周转箱中培养,每箱培养植株15 ~ 20株,每两天更换一次纯水。
1.4 培育前装置的准备储水箱、固持板组件和活动卡扣先后用自来水和纯水进行冲洗,待其自然晾干后用75% 乙醇进行表面消毒,之后和滤纸一起进行高温灭菌处理。灭菌后的滤纸由营养液浸润后铺于固持板内壁,等待植物种子萌发后进行移植。水培体系的培养箱和海绵同样进行高温灭菌处理。
1.5 根系分泌物生物硝化抑制活性的测定根系分泌物BNI活性的测定参考Sun等[21]的方法。欧洲亚硝化单胞菌Nitrosomonas europaea(NBRC 14298 = ATCC 19718)购于日本技术评价研究所生物资源中心(Biological Resource Center,NITE,日本)。菌株活化和培养采用该菌种库推荐的HEPES培养基,培养基成分如下(1 L):(NH4)2SO4 2.5 g,KH2PO4 0.5 g,HEPES 11.92 g,NaHCO3 0.5 g,MgSO4•7H2O 100 mg,CaCl2•2H2O 5 mg,Fe-EDTA 75 mg,pH 7.8 ~ 8.0。取培养一周的菌液,将其离心后重新悬浮于新鲜的HEPES培养基中至菌液OD600≈0.67。之后对重悬菌液进行NO2–检测,方法参考改进的Griess法[29],具体操作如下:向2 mL离心管中加入10 μL根系分泌物甲醇溶解液,用氮气将甲醇吹干后加入5 μL二甲基亚砜(DMSO)进行溶解,依次加入195 μL无菌水和300 μL重悬菌液,置于25 ℃黑暗条件下水浴培养2 h。向培养后的离心管中加入20 μL 0.1 mol/L烯丙基硫脲以终止亚硝化反应。取反应后的混合液300 μL于10 mL试管中并加水稀释至5 mL,加入1 mL对氨基苯磺酸溶液并摇匀,静置5 min左右加入1 mL盐酸N-(1-萘基)-乙二胺溶液,摇匀后加水定容至10 mL。放置10 min左右待其完全显色后,以去离子水为参比,测定其540 nm波长处吸光值,以同样处理测定NO2–-N标准曲线,得到在玉米根系分泌物作用下体系内产生的NO2–,并通过公式:亚硝化抑制率(%)=(1–样品NO2–生成量/空白NO2–生成量)×100,计算不同品种玉米脂溶性根系分泌物的生物硝化抑制率。
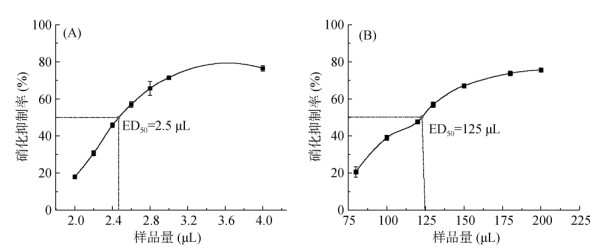
2 结果与分析 2.1 两种收集体系下玉米根系分泌物硝化抑制效率的对比选取玉米品种郑单958,测定其在新收集体系与传统水培收集体系下玉米根系分泌物BNI活性情况。图 2A和图 2B分别为新收集体系和传统水培收集体系获得的根系分泌物的硝化抑制率剂量效应曲线。结果表明,传统水培体系下,水培甲醇提取液在80 μL时有20% 左右硝化抑制率,样品抑制率达到50%(ED50)的剂量为125 μL,随着样品量的增加,其硝化抑制率可以达到80%。对于新收集体系收集到的根系分泌物,其也表现出明显的硝化抑制能力。在新收集体系培养下,新收集体系甲醇提取液在2 μL时有20% 左右硝化抑制率,ED50的剂量为2.5 μL,随着样品量的增加,其硝化抑制率同样可以达到80%。同传统水培体系相比较,相同体积下,新收集体系获得的根系分泌物硝化抑制效果显著高于传统水培收集体系。
|
图 2 多品种同步收集体系(A) 和传统水培体系(B)下郑单958根系分泌物的硝化抑制率曲线 Fig. 2 Nitrification inhibition rate curves of root exudates of Zhengdan 958 under multi variety synchronous collection system (A) and hydroponic system (B) |
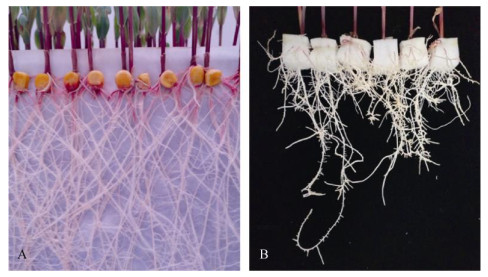
图 3A和图 3B分别为玉米在固持板滤纸上和水溶液中根系生长12 d的情况。新收集体系中玉米根系较发达,生物量较多,且长势统一;传统水培体系中的玉米根系较短,且长势不一。因此,相比于传统水培体系,新收集体系培养的玉米根系能更好地满足多品种活性试验的比较。
|
图 3 玉米根系在多品种同步收集体系(A)和传统水培体系(B)下的生长情况 Fig. 3 Root growth of maize under multi variety synchronous collection system (A) and hydroponic system cultivation (B) |
为明确两种收集体系的玉米培养效率参数,采用新收集体系和传统水培分别培养300株郑单958玉米种子。表 1为两种体系培养下所需资源和效率的对比。在收集空间方面,传统水培体系需要1.26 m2,新收集体系仅占用0.15 m2,节省了88%。在营养液用量上,培养期间传统水培体系需用水1 680 L,而新收集体系仅用18 L,节省了99% 的水量。而且,新收集体系还能节省前处理时间和人力约94%。除了收集效率的提高,新收集体系收集样品的BNI活性也显著高于传统水培收集法,在50% 硝化抑制率条件下能节省98% 的分泌物样品。综上所述,相比于传统水培体系,新收集体系能够在获得更适用于本试验的玉米根系的前提下,还能够有更高的收集效率,因此,新收集体系收集根系分泌物效率显著高于传统水培收集体系。
|
|
表 1 多品种同步收集体系与传统水培体系下玉米根系分泌物收集效率对比(300株苗) Table 1 Collection efficiencies of maize root exudates under hydroponic and new device systems |
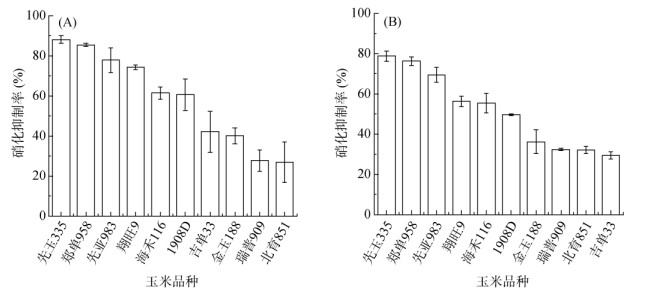
为探究在新收集体系下不同玉米品种根系分泌物活性的差异,对10个典型玉米品种根系分泌物进行了两个批次的收集,并分别测定了BNI活性(图 4)。在第一批次中,10个品种根系分泌物BNI活性为26.2% ~ 88.6%,6个品种抑制率超过50%,平均达58.5%。其中,先玉335和郑单958超过80%,吉单33、金玉188、瑞普909和北育851的硝化抑制率分别为42.1%、40.1%、27.7% 和26.9%。在第二批次中,10个品种根系分泌物BNI活性为29.4% ~ 78.7%,5个品种抑制率超过50%,平均达51.6%。其中,先玉335和郑单958依旧最高达75% 以上,吉单33、金玉188、瑞普909和北育851分别为29.4%、36.1%、32.4% 和32.0%。因此,10个玉米品种根系分泌物均有较高的BNI活性,不同品种间表现出明显的差异,且两个批次间各品种BNI活性数据相对标准偏差(RSD)均在10% 左右,重复性较好。
|
(A. 第一批次试验;B. 第二批次试验) 图 4 多品种同步收集体系收集的不同玉米品种根系分泌物的硝化抑制率对比 Fig. 4 Nitrification inhibition rates of root exudates collected from different maize varieties using a multi variety synchronous collection system |
本研究重点关注了玉米脂溶性根系分泌物BNI活性,原因之一是由于脂溶性根系分泌物BNI活性几乎占玉米总体BNI活性的一半[19];其次是以往的研究主要关注水溶性根系分泌物,对脂溶性根系分泌物的研究较少,部分原因可能跟缺乏适宜的收集系统有关。研究结果发现利用新收集体系获得的玉米脂溶性根系分泌物BNI活性显著优于传统水培体系。这可能是因为传统水培体系在培育植物过程中,旱作植物根系处在淹水条件下通气效果不佳,会抑制玉米的根系生长与代谢能力[30],进而影响根系分泌物BNI活性;而本新收集体系使用黑色有机玻璃板加湿润滤纸包被植物根系,能更好地模拟旱作玉米在土壤环境下的生长条件[31]。此外,新收集体系收集的脂溶性根系分泌物不易随溶液扩散,主要积累在根表[16],收集的根系分泌物量相比于水培体系可能更多。目前研究报道的根系分泌物中脂溶性有机物相比于亲水性分泌物能更多地作为信号物质参与到根际物质能量交流中,起到促进植物生长、抵抗外界胁迫的作用[18,32-34];而传统水培收集法得到的分泌物相比新收集体系收集的分泌物其脂溶性物质比例更小,可能会有更少的部分参与硝化抑制过程,从而造成分泌物整体BNI活性较低[19]。其次新体系在收集过程中的试剂二氯甲烷服务于脂溶性根系分泌物,这与传统水培收集法的收集试剂不同,这可能也会造成新体系整体收集效率的提高。尽管新体系收集的物质目前被认为大部分是根系分泌物,但不能完全排除根内物质溶解出来。由于脂溶性根系分泌物的研究历程较短,现有技术还不能精确区分收集物质的来源,具体有待今后进一步研究。
在玉米品种选择方面,挑选的6个品种来自我国玉米主产区东北地区(吉单33、1908D、海禾116、翔旺9、北育851、先亚983)。为增加品种数量和扩大研究范围,还加入了金玉188、瑞普909、郑单958、先玉335共4个全国主栽品种。本研究中10个玉米品种根系分泌物均有约50% 的硝化抑制能力,这比不同水稻品种BNI均值略高[20-21]。品种间的抑制效率有较大差距,先玉335、郑单958与先亚983 3个品种BNI活性最高,它们也是典型的玉米氮高效品种[35]。这与水稻根系BNI活性与氮吸收效率正相关结果一致[21],表明与水稻类似,玉米BNI活性与玉米氮素利用率可能也是紧密连锁,但这一假设还需通过测定不同品种玉米氮吸收效率来进一步验证。本研究基于Okata等[36-37]在单一甜玉米品种根系分泌物中发现了BNI活性的基础上,从多品种角度丰富了这一结论,同时还进一步明确了玉米品种间BNI活性差异,为筛选我国自己的典型高BNI活性玉米品种、特定新型的玉米源BNIs物质以及作物BNI遗传位点等研究奠定了基础。
除了分泌物活性的提高,本新收集体系中固持板之间相对独立,体积小,在培养过程中占地面积较少,且能节省大量水资源;在收集过程中,前处理操作简单、耗时短;固持板规格统一,不同品种玉米能够获取均一水分和光照,长势一致,使试验结果更可靠。而且,本新收集体系在多品种同时收集上相较传统水培体系等优势较大,效率提高显著,其优势将随着品种数增加越发明显。两个批次不同玉米品种根系分泌物BNI活性结果重复性好,效果稳定,表明该新型玉米多品种根系分泌物同步收集体系能较好地应用于我国玉米BNIs研究,还有望在其他旱作植物BNI研究中发挥作用,为未来基于作物群体BNI活性和BNIs分泌的遗传位点研究提供技术支撑。目前Petroli等[19]从多个CIMMYT亚热带玉米品种中初步明确了调控玉米BNI活性的关键遗传位点。由于本新收集体系能够快速高效收集多品种根系分泌物,今后在根系分泌物介导的作物抗逆、抗病与土壤健康等领域也有望有较好的应用前景。
4 结论本研究设计了一种多品种玉米苗期脂溶性根系分泌物同步收集体系,该体系操作简单,培养装置制作方便。相比于传统水培收集体系,能节省大量的人力物力和空间时间资源,且玉米根系生长更好,分泌物样品利用率与BNI活性明显提高。
基于该新收集体系,发现10个我国典型玉米品种根系分泌物均具有可观的BNI活性,其中先玉335、郑单958、先亚983是主要的高BNI活性玉米品种。不同玉米品种间BNI活性差异显著,两批次试验数据重复性好。综上,本新收集体系可应用到多品种玉米根系分泌物同步收集试验中,为我国玉米源BNIs物质鉴定与BNI遗传位点解析奠定了基础,同时还有望应用于其他旱作植物多品种根系分泌物研究中。
| [1] |
巨晓棠, 张福锁. 关于氮肥利用率的思考[J]. 生态环境, 2003, 12(2): 192-197 (  0) 0) |
| [2] |
朱兆良. 农田中氮肥的损失与对策[J]. 土壤与环境, 2000, 9(1): 1-6 (  0) 0) |
| [3] |
张福锁, 王激清, 张卫峰, 等. 中国主要粮食作物肥料利用率现状与提高途径[J]. 土壤学报, 2008, 45(5): 915-924 DOI:10.3321/j.issn:0564-3929.2008.05.018 (  0) 0) |
| [4] |
于飞, 施卫明. 近10年中国大陆主要粮食作物氮肥利用率分析[J]. 土壤学报, 2015, 52(6): 1311-1324 (  0) 0) |
| [5] |
朱兆良. 中国土壤氮素研究[J]. 土壤学报, 2008, 45(5): 778-783 DOI:10.3321/j.issn:0564-3929.2008.05.003 (  0) 0) |
| [6] |
闫湘, 金继运, 何萍, 等. 提高肥料利用率技术研究进展[J]. 中国农业科学, 2008, 41(2): 450-459 (  0) 0) |
| [7] |
孙志梅, 武志杰, 陈利军, 等. 硝化抑制剂的施用效果、影响因素及其评价[J]. 应用生态学报, 2008, 19(7): 1611-1618 (  0) 0) |
| [8] |
Ren B Z, Ma Z T, Zhao B, et al. Influences of split application and nitrification inhibitor on nitrogen losses, grain yield, and net income for summer maize production[J]. Frontiers in Plant Science, 2022, 13: 982373 DOI:10.3389/fpls.2022.982373 (  0) 0) |
| [9] |
Vogel C, Sekine R, Huang J Y, et al. Effects of a nitrification inhibitor on nitrogen species in the soil and the yield and phosphorus uptake of maize[J]. Science of the Total Environment, 2020, 715: 136895 DOI:10.1016/j.scitotenv.2020.136895 (  0) 0) |
| [10] |
张昊青, 赵学强, 张玲玉, 等. 石灰和双氰胺对红壤酸化和硝化作用的影响及其机制[J]. 土壤学报, 2021, 58(1): 169-179 (  0) 0) |
| [11] |
孙海军, 闵炬, 施卫明, 等. 硝化抑制剂施用对水稻产量与氨挥发的影响[J]. 土壤, 2015, 47(6): 1027-1033 DOI:10.13758/j.cnki.tr.2015.06.003 (  0) 0) |
| [12] |
Subbarao G V, Ito O, Sahrawat K L, et al. Scope and strategies for regulation of nitrification in agricultural systems—Challenges and opportunities[J]. Critical Reviews in Plant Sciences, 2006, 25(4): 303-335 (  0) 0) |
| [13] |
陆玉芳, 施卫明. 生物硝化抑制剂的研究进展及其农业应用前景[J]. 土壤学报, 2021, 58(3): 545-557 (  0) 0) |
| [14] |
曾后清, 朱毅勇, 王火焰, 等. 生物硝化抑制剂——一种控制农田氮素流失的新策略[J]. 土壤学报, 2012, 49(2): 382-388 (  0) 0) |
| [15] |
Subbarao G V, Nakahara K, Ishikawa T, et al. Biological nitrification inhibition (BNI) activity in Sorghum and its characterization[J]. Plant and Soil, 2013, 366(1): 243-259 (  0) 0) |
| [16] |
Subbarao G V, Yoshihashi T, Worthington M, et al. Suppression of soil nitrification by plants[J]. Plant Science, 2015, 233: 155-164 (  0) 0) |
| [17] |
朱丽霞, 章家恩, 刘文高. 根系分泌物与根际微生物相互作用研究综述[J]. 生态环境, 2003, 12(1): 102-105 (  0) 0) |
| [18] |
陆玉芳, 施卫明. 根际化学信号物质与土壤养分转化[J]. 生物技术通报, 2020, 36(9): 14-24 (  0) 0) |
| [19] |
Petroli C D, Subbarao G V, Burgueño J A, et al. Genetic variation among elite inbred lines suggests potential to breed for BNI-capacity in maize[J]. Scientific Reports, 2023, 13(1): 13422 (  0) 0) |
| [20] |
Tanaka J P, Nardi P, Wissuwa M.. Nitrification inhibition activity, a novel trait in root exudates of rice[J]. AoB Plants, 2010 DOI:10.1093/aobpla/plq014 (  0) 0) |
| [21] |
Sun L, Lu Y F, Yu F W, et al. Biological nitrification inhibition by rice root exudates and its relationship with nitrogen-use efficiency[J]. New Phytologist, 2016, 212(3): 646-656 (  0) 0) |
| [22] |
Ma Y, Yao L, Zhang L W, et al. Genome-wide association analysis of chilling-tolerant germination in a new maize association mapping panel[J]. Food and Energy Security, 2023, 12(3): e445 (  0) 0) |
| [23] |
Mokrzycka M, Stojałowski S, Tyrka M, et al. Genome-wide association analysis for hybrid breeding in wheat[J]. International Journal of Molecular Sciences, 2022, 23(23): 15321 (  0) 0) |
| [24] |
Sheoran S, Jaiswal S, Raghav N, et al. Genome-wide association study and post-genome-wide association study analysis for spike fertility and yield related traits in bread wheat[J]. Frontiers in Plant Science, 2022, 12: 820761 (  0) 0) |
| [25] |
郭婉玑, 张子良, 刘庆, 等. 根系分泌物收集技术研究进展[J]. 应用生态学报, 2019, 30(11): 3951-3962 (  0) 0) |
| [26] |
Williams A, Langridge H, Straathof A L, et al. Comparing root exudate collection techniques: An improved hybrid method[J]. Soil Biology and Biochemistry, 2021, 161: 108391 (  0) 0) |
| [27] |
Dessureault-Rompré J, Nowack B, Schulin R, et al. Modified micro suction cup/rhizobox approach for the in situ detection of organic acids in rhizosphere soil solution[J]. Plant and Soil, 2006, 286(1): 99-107 (  0) 0) |
| [28] |
王占义, 潘宁, 罗茜, 等. 一种新型根系分泌物收集装置与收集方法的介绍[J]. 土壤学报, 2010, 47(4): 747-752 (  0) 0) |
| [29] |
邢书才. 萘乙二胺分光光度法测定大气降水中亚硝酸盐方法存在的问题及对分析测试的影响[J]. 干旱环境监测, 2007, 21(4): 244–245, 249 (  0) 0) |
| [30] |
Ren B Z, Dong S T, Zhao B, et al. Responses of nitrogen metabolism, uptake and translocation of maize to waterlogging at different growth stages[J]. Frontiers in Plant Science, 2017, 8: 1216 (  0) 0) |
| [31] |
Jacobsen A G R, Jervis G, Xu J, et al. Root growth responses to mechanical impedance are regulated by a network of ROS, ethylene and auxin signalling in Arabidopsis[J]. New Phytologist, 2021, 231(1): 225-242 (  0) 0) |
| [32] |
Lebeis S L, Paredes S H, Lundberg D S, et al. Salicylic acid modulates colonization of the root microbiome by specific bacterial taxa[J]. Science, 2015, 349(6250): 860-864 (  0) 0) |
| [33] |
Stringlis I A, Yu K, Feussner K, et al. MYB72-dependent coumarin exudation shapes root microbiome assembly to promote plant health[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(22): E5213-E5222 (  0) 0) |
| [34] |
Zhang L, Feng G, Declerck S. Signal beyond nutrient, fructose, exuded by an arbuscular mycorrhizal fungus triggers phytate mineralization by a phosphate solubilizing bacterium[J]. The ISME Journal, 2018, 12(10): 2339-2351 (  0) 0) |
| [35] |
王玲敏, 叶优良, 陈范骏, 等. 施氮对不同品种玉米产量、氮效率的影响[J]. 中国生态农业学报, 2012, 20(5): 529-535 (  0) 0) |
| [36] |
Otaka J, Subbarao G V, Ono H, et al. Biological nitrification inhibition in maize—Isolation and identification of hydrophobic inhibitors from root exudates[J]. Biology and Fertility of Soils, 2022, 58(3): 251-264 (  0) 0) |
| [37] |
Otaka J, Subbarao G V, Jiang M L, et al. Isolation and characterization of the hydrophilic BNI compound, 6-methoxy-2(3H)-benzoxazolone (MBOA), from maize roots[J]. Plant and Soil, 2023, 489(1): 341-359 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57


