2. 文山学院, 云南文山 663000;
3. 云南省烟草公司曲靖市公司, 云南曲靖 655000;
4. 云南省农业科学院农业环境资源研究所, 昆明 650205
土壤真菌作为土壤生态环境的重要组成部分,其群落结构变化与作物连作密切相关。当土壤微生物类型逐渐由“细菌型”向“真菌型”转变时,土壤微生物群落结构出现失衡[1-2]。微生物群落结构失衡是导致作物连作障碍的根本原因[3-4]。研究发现,抑病型土壤中一些有益微生物如曲霉菌(Aspergillus)、木霉菌(Trichoderma)、漆斑菌(Myrothecium)等真菌属的相对丰度显著高于导病型土壤,致病微生物劳尔氏菌属(Ralstonia)的相对丰度显著低于导病型土壤[5],说明抑病型土壤的抑病能力与土壤中特定有益微生物富集有关[6]。可见,深入认识土传病原微生物适宜生长的土壤环境是防控作物土传病原微生物生长的关键[7]。
烟草根腐病(Tobacco root rot)主要是由镰刀菌引起的一种典型土传病害,近年来在我国各大烟区均有发生和发展趋势。镰刀菌根腐病在烟草苗期至大田期均可发生,发病率3% ~ 5%,重病田发病率高达30%以上[8],但造成经济损失程度取决于病原体、宿主脆弱性及气候条件等因素[9]。由于土传病害具有很强的隐秘性,防控难度大,利用作物抗逆性和抗病性来降低连作的负面效应被认为是一种有效方式。如LaMondia[10]研究认为开发和培育抗病或耐根腐病烟草品种是防治青枯病和根腐病的有效方法之一。诸多研究表明,作物富集生防菌群能力与抗病性密切相关。涂娜娜等[11]研究指出,青枯病抗性桑品种根际土壤具有更高丰度的淡紫拟青霉属和丛枝菌根球霉菌目。高小宁等[12]研究也指出,甘蔗宿根矮化病感病品种YT60内生真菌和细菌群落多样性指数高于抗病品种,主要菌群的组成和丰度存在显著差异。因而在育种上,通过塑造根际微生物群落,改变其多样性[13],促进或抑制根面和根际微生物种群以调控病原菌侵染几率[14-15]成为评价品种抗病性的重要指标之一。前期研究结果表明,连作条件下烟草根腐病抗病品种根际土壤细菌群落结构相对丰度及代谢途径相对丰度高于感病品种可能是其抗根腐病的原因之一[16]。但连作条件下抗感品种根际土壤真菌群落结构和功能特征目前仍不清楚,而弄清楚烟草根腐病抗感品种根际土壤真菌群落结构及功能有助于深入理解烟草根腐病的发病机理。鉴于此,本研究采用高通量测序技术,分析了烟草根腐病不同抗性品种根际土壤真菌群落结构和功能,研究结果为深入理解烟草根腐病发生的土壤微生物学机制及绿色控制提供理论支撑。
1 材料与方法 1.1 供试材料 1.1.1 供试土壤供试连作(2、4和8 a)土壤和撂荒土壤(记为‘0’)均采自于云南省曲靖市马龙区核心烟区(103°23´9"E,25°20´19"N)。撂荒土壤为同区域撂荒3 a以上的土壤,未种植任何作物。3种连作年限烟田为同一农户家种植,植烟历史可考证。于2021年7月烟叶成熟期根腐病发病率调查结果显示,该连作2、4、8 a的烟田根腐病发病率分别介于2.5% ~ 5.5%、7.5% ~ 10.5% 和15.0% ~ 25.5%。调查后在对应烟田按照“S”形随机选取5个点,去除表土和杂物,挖取垄土(0 ~ 20 cm)运至云南农业大学试验场备用。
1.1.2 供试烟草品种供试烤烟品种云烟87为烟草根腐病抗病品种[17],记为“R”;红花大金元为烟草根腐病感病品种,记为“S”。
1.2 试验设计采用漂浮育苗方式育苗。待烟苗培育至4叶1心并经过2次剪叶后移栽至塑料花盆(高×上口径×下口径=33 cm×21 cm×17 cm)中,栽后浇足定根水。移栽时施烟草专用复合肥(m(N)︰m(P2O5)︰m(K2O)= 12︰10︰24)36 g/株和商品有机肥(有机质≥45%,总养分≥5%)200 g/株为基肥。移栽后20 d施硝酸钾(m(N)︰m(K2O)=13.5︰44.5) 9 g/株进行追肥,环施后覆薄土。试验设置如表 1所示。每个处理30盆,设3次重复。移栽后第65天进行处理,采用抖根法取根际土50 g用于真菌高通量测序,每个处理随机取4个重复样。
|
|
表 1 试验设置 Table 1 Experiment design |
土壤真菌高通量测序和分析由北京果壳生物科技有限公司完成。试验时,准确称取0.50 g鲜土,用E.Z.N.A.® soil DNA Kit (Omega Bio-tek,Norcross,GA,美国)试剂盒对样本的基因组DNA进行提取后,用琼脂糖凝胶电泳检测DNA的纯度和浓度。稀释后的基因组DNA采用具有Barcode标记的特征引物,ITS2 F:5´-GCATCGATGAAGAACGCAGC-3´;ITS2 R:5-TCCTCCGCTTATTGATATGC-3´对真菌ITS2区进行MiSeq扩增子测序。用Bio-rad T100梯度PCR仪(Bio-rad,美国)对获得的PCR产物经2% 浓度的琼脂糖凝胶电泳纯化后,使用Ⅰllumina公司TruSeq DNA PCR-Free Library Preparation Kit建库试剂盒进行文库的构建,Qubit定量和文库检测合格后,使用NovaSeq 6000测序平台进行测序。
1.4 数据及生信分析采用Excel 2016进行数据处理和SPSS 20.0进行方差分析,采用Origin 2018进行作图。测序数据经过拼接、过滤、去除嵌合体,在相似性97% 的水平上利用USEARCH 5.2.236软件对有效tags进行操作分类单元(Operational taxonomic unit,OTU)聚类以获得OTU的相对丰度和OTU代表序列。利用QIIME (version 1.9.1)软件中的assign taxonomy.py对OTU进行分类学注释,比对数据库为Unite (Release7.2,http://unite.ut.ee/index.php)。使用软件Mothur(version v.1.30.1)计算反映群落丰富度的Sobs指数和反映多样性的香农–维纳指数(Shannon-Wiener’s)。利用主坐标分析(Principal coordinates analysis,PCoA)分析真菌群落结构Beta多样性MetaCye(Metabolic pathways from all domains of life)数据库预测土壤真菌群落代谢途径及相对丰度。群落组成柱状图利用R语言工具进行。
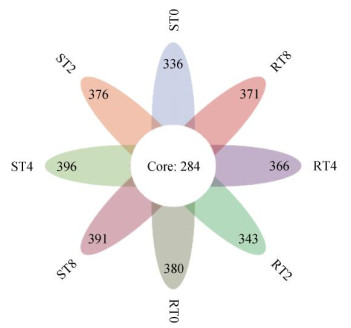
2 结果与分析 2.1 连作条件下烟草根腐病抗(感)品种根际土壤真菌群落OTU分析基于97% 的相似性条件下,32个样品共得到5 231个OTU(图 1)。RT0处理特有OTU数较ST0处理增加13.1%;RT2较ST2处理,RT4较ST4处理,RT8处理较ST8处理特有OTU分别降低了9.6%、8.2% 和5.4%,说明相同连作年限下感病品种根际土壤真菌特有OTU数较抗病品种多。
|
(不同颜色表示不同分组,重叠部分数字代表多个分组中共有物种数,非重叠部分的数字代表对应分组所特有的物种数目) 图 1 不同处理下根际土壤真菌的OTU数量比较 Fig. 1 Comparison of OUT numbers of rhizosphere soil fungi under different treatments |
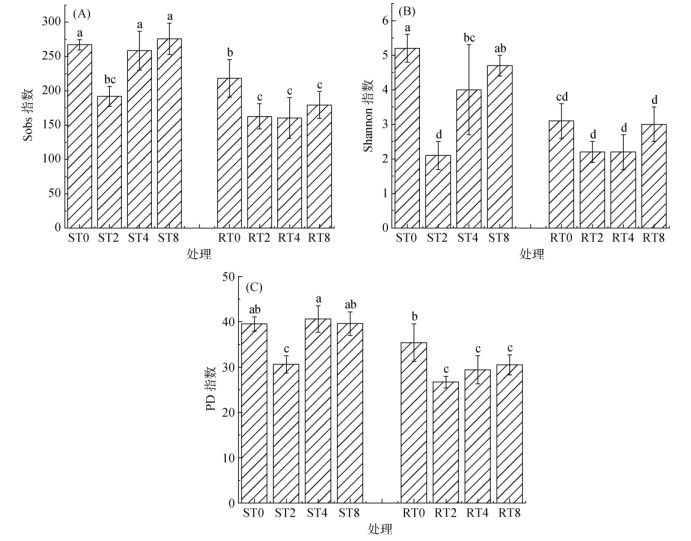
图 2A和图 2B显示,ST0、ST4和ST8处理真菌群落Sobs指数和Shannon指数均显著高于ST2、RT0、RT2、RT4、RT8处理(P<0.05),其中ST2 ~ ST8处理Sobs指数和Shannon指数呈增加趋势,RT2 ~ RT8处理变幅较小,长期连作(4 a和8 a)下感病品种(ST4和ST8)Sobs指数和Shannon指数均显著高于抗病品种(RT4和RT8)。图 2C显示,ST0、ST4和ST8处理烟株根际土壤真菌群落PD指数(PD whole tree index)均显著大于ST2、RT2、RT4和RT8处理(P<0.05),不同长期连作年限下感病品种根际土壤真菌群落PD指数处理间差异不显著。综上,长期连作年限(4 ~ 8 a)下,感病品种根际土壤真菌群落相对丰度、多样性及均匀度均显著高于抗病品种。
|
(A. Sobs指数;B. Shannon指数;C. PD指数;图中小写字母不同表示处理间差异达P<0.05显著水平) 图 2 连作条件下烟草根腐病不同抗性品种根际土壤真菌群落Alpha多样性 Fig. 2 Alpha diversities of rhizosphere soil fungi in different varieties resistant to tobacco root rot under continuous cropping |
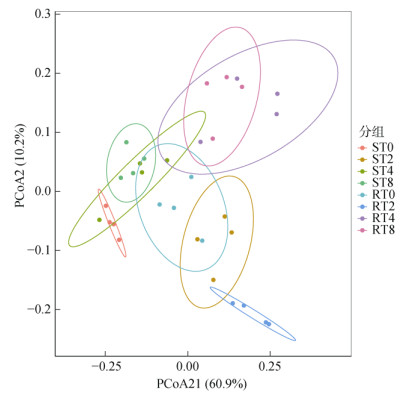
基于主坐标分析结果显示(图 3),主成分1和主成分2对样品差异性的贡献值累计为71.1%。总体看,RT0、RT4和RT8处理根际土壤真菌群落主要分布PCoA2的正值区域,而ST0、ST2、RT2主要分布在PCoA1和PCoA2的负值区域,说明连作下烟草根腐病抗(感)品种根际土壤真菌物种组成存在明显差异。进一步Anosim检验结果显示连作条件下烟草根腐病不同抗性品种根际土壤真菌群落结构较离散(P=0.001)。
|
图 3 连作条件下烟草根腐病不同抗性品种根际土壤真菌群落Beta多样性 Fig. 3 Beta diversities of rhizosphere soil fungi in different varieties resistant to tobacco root rot under continuous cropping |
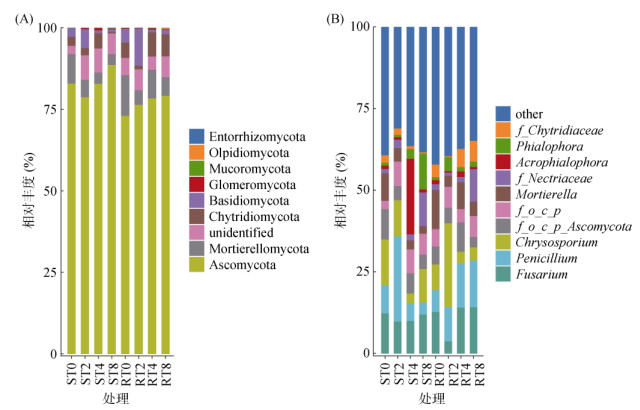
图 4A显示了相对丰度前8位的各处理的共有优势菌门分别为子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、壶菌门(Chytridiomycota)、担子菌门(Basidiomycota)、球囊菌门(Glomeromycota)、毛霉菌门(Mucoromycota)、油壶菌门(Olpidiomycota)及根肿黑粉菌门(Ebtorrhizomycota)。其中,子囊菌门为不同连作年限烟草根腐病抗(感)品种根际土壤最大的优势菌群,相对丰度分别介于73.4% ~ 78.8% 和79.2% ~ 87.9%;被孢霉门相对丰度分别介于4.3% ~ 12.9% 和3.4% ~ 9.1%;担子菌门相对丰度分别介于1.0% ~ 12.7% 和0.8% ~ 5.7%;壶菌门相对丰度分别介于0.9% ~ 7.1% 和0.5% ~ 3.3%。说明不同连作年限下烟草根腐病感病品种根际土壤子囊菌门丰度整体高于抗病品种,被孢霉门、担子菌门和壶菌门有益菌群相对丰度均整体低于抗病品种。
|
(A. 门水平上优势菌群相对丰度;B. 属水平上优势菌群相对丰度) 图 4 连作条件下烟草根腐病不同抗性品种根际土壤真菌优势菌群 Fig. 4 Dominant flora of rhizosphere soil fungi of different resistant varieties of tobacco root rot under continuous cropping |
图 4B显示了相对丰度前10位的优势菌属,分别为镰刀菌属(Fusarium)、青霉菌属(Penicillium)、金孢霉属(Chrysosporium)、f_o_c_p Ascomycota、f_o_c_p、被孢霉属(Mortierella)、f_Nectriaceae、端梗孢属(Acrophialophora)、瓶霉属(Phialophora)和f_Chytridiaceae。ST2、ST4、ST8处理镰刀菌属相对丰度依次为9.8%、10.1%、12.0%,青霉菌属相对丰度分别为26.1%、5.4% 和3.7%,说明随连作年限的增加,镰刀菌属相对丰度呈增加趋势,青霉菌属相对丰度呈降低趋势。RT2、RT4、RT8处理镰刀菌属相对丰度依次为3.8%、14.1% 和14.2%,青霉菌属有益菌丰度分别为10.6%、13.4% 和14.3%,均呈增加趋势。另外,长期连作(4 a和8 a)下RT4、RT8处理根际土壤真菌f_Chytridiaceaes属相对丰度明显高于ST4和ST8处理。综上,长期连作下,抗病品种根际土壤根腐病原菌丰度及有益菌丰度均高于感病品种。
2.4 连作条件下烟草根腐病不同抗性品种根际土壤真菌群落代谢途径从表 2可以看出,ST8处理根际土壤真菌群落脂肪酸延伸–饱和、脂肪酸氧化I、乙醛酸循环、磷酸戊糖途径(非氧化支)、卡尔文循环、糖酵解Ⅲ(从葡萄糖)、血红素生物合成I、辅酶A生物合成I、L-亮氨酸降解I、糖异生I代谢途径相对丰度均极显著高于ST0、ST2、ST4、RT0、RT2、RT4、RT8处理(P<0.01)。除脂肪酸延伸–饱和代谢途径丰度外,ST4处理9种主要代谢途径相对丰度极显著高于RT4(P<0.01),ST2处理根际土壤真菌10种主要代谢途径相对丰度高于RT2,ST0处理则均小于RT0处理。说明短期(2 a)或长期(4 a和8 a)连作条件下烟草根腐病感病品种根际土壤真菌群落代谢途径相对丰度均明显高于抗病品种,撂荒土壤上则相反。
|
|
表 2 连作条件下烟草根腐病抗(感)品种根际土壤真菌代谢差异 Table 2 Differences of fungal metabolism in rhizosphere soils of tobacco varieties resistant to root rot under continuous cropping |
本研究结果表明,撂荒及长期连作(4 a和8 a)条件下,烟草根腐病感病品种根际土壤真菌群落的Sobs、Shannon及PD指数明显高于抗病品种,且在相同连作年限下特有OTU较多。其原因可能与感病品种根系分泌物能够招募更多的微生物,而抗病品种能够产生较多的抑制某些真菌物种生长的物质,从而降低根际土壤真菌物种相对丰度及多样性有关。该结果与郑元仙等[18]研究认为烟株根际土壤中真菌群落结构改变及物种多样性降低是烤烟根腐病发生的重要特征结论不完全一致,其原因可能与试验烤烟品种对特有微生物招募能力不同有关。因为微生物数量及群落多样性受寄主生长发育和抗性的影响[19]。另外,作物长期连作后,土壤微生物由细菌主导型向真菌主导型转变,而许多真菌与植物疾病密切相关[15]。说明烟草根腐病感病品种根系能够招募更多的真菌类群,病原菌在竞争中占据优势,拮抗菌可能因竞争能力弱而被淘汰或被抑制,是连作条件下感病品种易发生烟草根腐病的主要原因之一,研究结果与生产实际相符。
3.2 烟草根腐病抗(感)品种根际土壤真菌群落组成对连作的响应该研究结果表明,子囊菌门是不同处理根际土壤真菌群落相对丰度较高的主要菌门,这与前人的研究结论[20]一致。子囊菌以腐生菌为主,可引起动植物残体的腐烂和分解[21]。试验中,感病品种根际土壤真菌子囊菌门相对丰度均明显高于抗病品种,这说明感病品种能够在长期连作(4 a和8 a)及撂荒土壤条件下招募更多的子囊菌门真菌。在子囊菌门中,镰刀菌属为典型土传病原真菌[22-23],是多种作物、药材的主要病原菌。青霉菌属是土壤中重要的有益菌[24-25],如灰黄青霉对引起草莓根腐病原菌具有较好的拮抗作用[26]。被孢霉门中的被孢霉属是对土壤有益的微生物[27]。本试验中,烟草根腐病抗(感)品种根际土壤镰刀菌属为优势菌属,与李晶晶和续勇波[28]的研究结论一致。贺璐等[29]研究认为卷丹百合根腐病的发生可能与根际土壤中真菌物种结构的改变,尤其是散囊菌纲、外瓶霉属等有害真菌的增殖密切相关。相较而言,长期连作下,抗病品种根际土壤镰刀菌属相对丰度较高,但其根际同时维持较高丰度的青霉菌属、被孢霉属等有益菌对镰刀菌形成更好的制衡关系,可能是在长期连作下田间感病率较低的原因之一,其拮抗机制有待进一步研究。
3.3 烟草根腐病抗(感)品种根际土壤真菌群落代谢功能多样性对连作的响应本试验中,短期(2 a)或长期(4 a和8 a)连作条件下烟草根腐病感病品种根际土壤真菌群落排前10位的代谢途径相对丰度均明显高于抗病品种,撂荒土壤上相反。刘春增等[30]采用FUNGuild功能预测的方法分析试验处理对土壤真菌群落功能类群的影响指出施肥模式改变了功能类群丰度,说明其代谢途径丰度也会随之改变,说明连作下烟草根腐病抗(感)品种根际土壤真菌群落代谢途径丰度存在明显差异可能与抗(感)品种对特定微生物类群的增殖及活性调控效应不同有关。在撂荒土壤上,抗病品种根际土壤真菌群落排前10位的代谢途径相对丰度均稍高于感病品种可能与其被孢霉门和f_Chytridiaceaes属相对丰度较高有关。不同抗病品种根际土壤真菌代谢途径相对丰度的高低是否与其抗病能力有关需进一步研究。
4 结论1) 长期连作(4 a和8 a)下,烟草根腐病感病品种红花大金元根际土壤真菌群落相对丰度、多样性、均匀度及特有真菌类群相对丰度均高于抗病品种云烟87,群落结构明显聚集。
2) 门水平上子囊菌门、被孢霉门和属水平上镰刀菌属、青霉菌属是烟草根腐病抗(感)品种根际土壤主要优势菌群,抗病品种云烟87根际土壤含有较高相对丰度的镰刀菌属、青霉菌属和f_Chytridiaceae属。
3) 连作条件下,烟草根腐病感病品种红花大金元根际土壤真菌群落代谢途径相对丰度均明显高于烟草根腐病抗病品种云烟87。
总体看,烟草根腐病抗病品种根际土壤维持相对低的真菌群落相对丰度、多样性、特有OTU数及代谢途径相对丰度,并保持相对高的青霉菌属、f_Chytridiaceae属有益真菌可能是其连作下保持较高抗病性的原因之一。该研究初步解释了连作下烟草根腐病不同抗性烤烟品种根际土壤真菌群落对连作的响应差异及其与抗病性的关系,研究结论为新品种抗病性评价及连作土壤烤烟优质适产提供了理论依据。
| [1] |
殷继忠, 李亮, 接伟光, 等. 连作对大豆根际土壤细菌菌群结构的影响[J]. 生物技术通报, 2018, 34(1): 230-238 (  0) 0) |
| [2] |
Liu H J, Yang X Y, Miao Z Q, et al. Characteristics of soil microflora of Panax notoginseng in different continuous cropping years[J]. Allelopathy Journal, 2018, 44(2): 145-158 DOI:10.26651/allelo.j./2018-44-2-1160 (  0) 0) |
| [3] |
Zhao Y N, Mao X X, Zhang M S, et al. Response of soil microbial communities to continuously mono-cropped cucumber under greenhouse conditions in a calcareous soil of North China[J]. Journal of Soils and Sediments, 2020, 20(5): 2446-2459 DOI:10.1007/s11368-020-02603-5 (  0) 0) |
| [4] |
Liu X, Li Y J, Ren X J, et al. Long-term greenhouse cucumber production alters soil bacterial community structure[J]. Journal of Soil Science and Plant Nutrition, 2020, 20(2): 306-321 DOI:10.1007/s42729-019-00109-9 (  0) 0) |
| [5] |
黎妍妍, 李春黎, 杨小琼, 等. 烟草青枯病抑病型土壤中有益微生物的组成分析[J]. 烟草科技, 2022, 55(1): 9-16 (  0) 0) |
| [6] |
Yuan J, Zhao J, Wen T, et al. Root exudates drive the soil-borne legacy of aboveground pathogen infection[J]. Microbiome, 2018, 6(1): 156 DOI:10.1186/s40168-018-0537-x (  0) 0) |
| [7] |
蔡祖聪, 黄新琦. 土壤学不应忽视对作物土传病原微生物的研究[J]. 土壤学报, 2016, 53(2): 305-310 (  0) 0) |
| [8] |
田艳艳, 王伟杰, 苗圃, 等. 河南烟草镰刀菌的初步分子鉴定[J]. 烟草科技, 2014, 47(11): 89-92 (  0) 0) |
| [9] |
Gaulin E, Jacquet C, Bottin A, et al. Root rot disease of legumes caused by Aphanomyces euteiches[J]. Molecular Plant Pathology, 2007, 8(5): 539-548 DOI:10.1111/j.1364-3703.2007.00413.x (  0) 0) |
| [10] |
LaMondia J. Pathogenicity and vegetative compatibility of Fusarium oxysporum isolated from tobacco[J]. Tobacco International, 1990, 192: 58-61 (  0) 0) |
| [11] |
涂娜娜, 武华周, 娄德钊, 等. 海南青枯病抗、感桑品种根际土壤真菌群落多样性分析[J]. 热带作物学报, 2021, 42(12): 3671-3677 (  0) 0) |
| [12] |
高小宁, 刘睿, 吴自林, 等. 宿根矮化病抗感甘蔗品种茎部内生真菌和细菌群落特征分析[J]. 生物技术通报, 2022, 38(6): 166-173 (  0) 0) |
| [13] |
Bakker M G, Manter D K, Sheflin A M, et al. Harnessing the rhizosphere microbiome through plant breeding and agricultural management[J]. Plant and Soil, 2012, 360(1): 1-13 (  0) 0) |
| [14] |
陈宏宇, 李晓鸣, 王敬国. 抗病性不同大豆品种根面及根际微生物区系的变化Ⅱ. 连作大豆(重茬)根面及根际微生物区系的变化[J]. 植物营养与肥料学报, 2006, 12(1): 104-108 (  0) 0) |
| [15] |
Gao Z Y, Hu Y Y, Han M K, et al. Effects of continuous cropping of sweet potatoes on the bacterial community structure in rhizospheric soil[J]. BMC Microbiology, 2019, 10: 2269 (  0) 0) |
| [16] |
王政, 王所良, 李智, 等. 连作条件下烟草根腐病不同抗性品种根际土壤细菌群落特征[J]. 江苏农业科学, 2024, 52(5): 222-228, 236 (  0) 0) |
| [17] |
邱睿, 李芳芳, 徐敏, 等. 烟草品种对镰刀菌根腐病的抗性鉴定[J]. 中国烟草学报, 2019, 25(4): 59-63 (  0) 0) |
| [18] |
郑元仙, 杨敏, 王继明, 等. 烤烟根腐病对烟株根际土壤真菌群落结构的影响[J]. 中国烟草科学, 2021, 42(2): 50-55 (  0) 0) |
| [19] |
王弋, 杨焕文, 赵正雄, 等. 不同抗性烤烟品种根际微生物数量及多样性差异研究[J]. 植物营养肥料学报, 2012, 8(2): 451-458 (  0) 0) |
| [20] |
王峰, 陈玉真, 吴志丹, 等. 化肥减施对茶园土壤真菌群落结构和功能类群的影响[J]. 茶叶学报, 2021, 62(4): 170-178 (  0) 0) |
| [21] |
Lienhard P, Terrat S, Prévost-Bouré N C, et al. Pyrosequencing evidences the impact of cropping on soil bacterial and fungal diversity in Laos tropical grassland[J]. Agronomy for Sustainable Development, 2014, 34(2): 525-533 DOI:10.1007/s13593-013-0162-9 (  0) 0) |
| [22] |
廖长宏, 陈军文, 吕婉婉, 等. 根和根茎类药用植物根腐病研究进展[J]. 中药材, 2017, 40(2): 492-497 (  0) 0) |
| [23] |
张向民. 镰刀菌属分类学研究历史与现状[J]. 菌物研究, 2005, 3(2): 59-62 (  0) 0) |
| [24] |
郑婕施, 江北, 张琪, 等. 青霉属真菌活性代谢产物研究进展[J]. 工业微生物, 2017, 47(6): 50-56 (  0) 0) |
| [25] |
许婷婷, 吴垠, 贾阳阳, 等. 红海榄根际土壤来源的青霉属真菌XGH2321及其抑菌活性[J]. 微生物学通报, 2009, 36(11): 1682-1687 (  0) 0) |
| [26] |
申光辉, 薛泉宏, 张晶, 等. 草莓根腐病拮抗真菌筛选鉴定及其防病促生作用[J]. 中国农业科学, 2012, 45(22): 4612-4626 (  0) 0) |
| [27] |
Goto B, Maia L. Glomerospores: A new denomination for the spores of Glomeromycota, a group molecularly distinct from the Zygomycota[J]. Mycotaxon, 2006, 96: 129-132 (  0) 0) |
| [28] |
李晶晶, 续勇波. 连作年限对设施百合土壤微生物多样性的影响[J]. 土壤通报, 2020, 51(2): 343-351 (  0) 0) |
| [29] |
贺璐, 马杰, 傅淋, 等. 卷丹百合根腐病植株与健康植株根际土壤真菌群落结构差异[J]. 西南农业学报, 2023, 36(11): 2419-2425 (  0) 0) |
| [30] |
刘春增, 张琳, 丁丽, 等. 稻田土壤真菌群落结构与功能对化肥减量配施紫云英还田的响应[J]. 中国土壤与肥料, 2023(9): 68-76 (  0) 0) |
2. Wenshan University, Wenshan, Yunnan 663000, China;
3. Yunnan Tobacco Company Qujing Branch, Qujing, Yunnan 655000, China;
4. Agricultural Resources & Environment Institute, Yunnan Academy of Agricultural Sciences, Kunming 650205, China
 2025, Vol. 57
2025, Vol. 57


