2. 中国科学院城市环境研究所城市环境与健康重点实验室, 福建厦门 361020;
3. 浙江科技大学浙江省废弃生物质循环利用与生态处理技术重点实验室, 杭州 310023;
4. 丽水市土肥植保能源总站, 浙江丽水 323000
“万物土中生,有土斯有粮”,土壤是万物之本、生命之源,是人类赖以生存和发展的物质基础,对于保障国家粮食安全、国民经济发展和社会稳定起着重要的作用[1-2]。然而,工业化和城镇化进程的加速不断扩大对土地的需求,导致占用耕地数量急剧增加[3]。“占补平衡”是指按照“占多少,垦多少”的原则,由占用耕地的单位负责开垦与所占用耕地的数量和质量相当的耕地,该项制度是缓解耕地短缺、守住耕地红线、保障区域经济高效可持续发展的重要举措[4]。“十一五”以来,浙江省在“占补平衡”推进过程中,通过开垦荒山缓坡、土地整理、开发复垦等方式新增加了300多万亩的新垦耕地,新垦耕地面积约占全省耕地面积的1/10[3]。因此,做好新垦耕地的改良培育对于保障粮食综合生产能力和实现农业可持续发展意义重大。
调查发现,新垦耕地普遍存在酸碱失衡、养分瘠薄、结构不良、有机质偏低等问题[5-6]。近年来,国内外学者聚焦新垦耕地土壤质量提升和生产能力提高开展了大量研究[7-8],主要通过应用商品有机肥、菌菇渣、秸秆以及黏土矿物、磷石膏、石灰石、羧甲基纤维素钠等物料改造提升新垦耕地,并取得了显著成效[9-10]。土壤微生物参与土壤结构的形成、矿质养分的分解转化,并通过调控土壤生态系统的多功能性影响土壤本身的抵抗力和恢复力[11],是提升土壤肥力及其可持续生产能力的核心与关键[12]。然而,当前新垦耕地的改良培育技术研究主要集中在外源材料的施用对土壤结构和肥力水平的提升方面,对新垦耕地土壤微生物群落的关注较少。
生物质炭被誉为“黑色黄金”,是指由富含碳的生物质在无氧或缺氧条件下经过高温裂解生成的一种具有高度芳香化、富含碳素的多孔固体物质[13-14]。生物质炭含有大量的营养元素,且具有丰富的孔隙结构、较大的比表面积和较多的活性基团,不仅在土壤肥力提升、结构改善方面表现突出[15-16],在提高微生物多样性、改善群落结构方面也表现出较好的成效[17-20]。基于此,本研究以新垦耕地土壤为研究对象,采用盆栽试验和高通量测序技术,研究生物质炭用量对新垦耕地土壤理化性状、细菌群落结构和功能及作物生长的影响,以期为合理施用生物质炭、快速培肥改良新垦耕地土壤、保障新垦耕地高产稳产等提供理论依据。
1 材料与方法 1.1 供试材料供试土壤采集于浙江省丽水市龙泉兰巨乡炉田村新岙湾新垦耕地项目区(28°04′39.92″N、119°08′10.98″E),取样前为闲置荒坡。土壤取样深度为0 ~ 20 cm,多点采集后将土壤混匀、风干,去除杂草根系,风干过5 mm筛备用。土壤基本理化性质:有机碳6.9 g/kg,全氮0.48 g/kg,有效磷19.11 mg/kg,速效钾144 mg/kg,水溶性盐1.3 g/kg,pH 5.62。供试作物为甘蓝,品种为浙甘70。供试生物质炭为玉米秸秆炭,在马弗炉500 ℃厌氧热解条件下产生,基本理化性质:全碳519.7 g/kg,全氮12.2 g/kg,全磷7.2 g/kg,全钾32.2 g/kg,pH 10.14,灰分135.7 g/kg。
1.2 试验设计试验于2023年4月14日至6月5日在浙江科技学院试验基地进行。采用盆栽试验,按照添加生物质炭的质量分数设置5个生物质炭用量水平:0(B0,对照)、0.5%(B5)、1.0%(B10)、2.0%(B20)和4.0%(B40),各处理重复3次,随机排列。试验用盆规格为高20 cm、上口直径30 cm、下口直径25 cm,每盆装土15 kg,栽种甘蓝3株,土壤容重1.16 g/cm3。按照甘蓝常规产量约45 000 kg/hm2,确定每公斤土壤N、P2O5和K2O用量分别为0.97、0.39和0.58 g。供试化肥为尿素(N,460 g/kg)、钙镁磷肥(P2O5,150 g/kg)和氯化钾(K2O,600 g/kg),全部作基肥并与生物质炭一次性混匀装盆。田间管理方式按照当地甘蓝常规生产技术标准统一执行。
1.3 植株生长和土壤理化指标测定甘蓝采收时,使用卷尺测量甘蓝株高,电子天平称量地上部和根系鲜重。甘蓝采收后采集土样,各处理采集4 ~ 6个土壤样品混匀,去除杂质,风干磨细过筛后用于土壤肥力参数的测定。其中,土壤pH采用电位计法测定,有机碳(SOC)含量采用重铬酸钾容量法测定,全氮(TN)含量采用凯氏定氮法测定,有效磷(AP)含量采用钼锑抗比色法测定,速效钾(AK)含量采用火焰光度计法测定,土壤阳离子交换量(CEC)采用NH4OAc交换‒蒸馏法测定,具体方法参考文献[21]。
1.4 土壤DNA提取和高通量测序采用PowerSoil DNA提取试剂盒(MoBioLaboratories Inc.,Carlsbad,CA,USA)提取土壤DNA。利用NanoDrop ND-1000(Thermo Fisher Scientific Inc.,Waltham,MA,USA)测定DNA浓度。采用引物338F(5′-ACTCCTACGGGAGGCAGCAC-3′)和519R(5′-GGACTACNNGGGTATCTAAT-3′)扩增16S rRNA基因的V3 ~ V4区,引物的5′端加上barcode以区别不同样品。PCR扩增反应采用50 μL×2体系,包括:1 μL模板DNA、1 μL 10 mmol/L上游和下游引物、25 μL TaKaRa Ex Taq DNA聚合酶(2×)以及22 μL灭菌后的超纯水。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,持续25个循环;72 ℃最终延伸7 min,降温至4 ℃。采用2% 琼脂糖凝胶电泳检测PCR产物。获得的PCR扩增产物用Universal DNA Purification Kit (TIANGEN,中国)进一步进行纯化回收,利用高通量测序仪Illumina MiSeq对16S rRNA基因进行测序(深圳微科盟科技集团有限公司)。
基因测序原始序列利用Quantitative Insights Into Microbial Ecology (QIIME2) 软件和DADA2插件评估序列质量、裁剪引物、降噪并去除嵌合体。质控后的序列于Sliva数据库进行物种注释,生成扩增子序列ASV表格。利用Phylogenetic Investigation of Communities by Unobserved States (PICRUSt2) [22],通过16S rRNA基因测序数据预测微生物代谢功能,使用KEGG数据库进行功能注释。
1.5 数据处理与统计分析采用DPS 2000软件进行方差分析(ANOVA),处理间差异采用Duncan’s新复极差法进行检验(P < 0.05),采用Origin 8.5软件进行制图。利用R 4.1.3软件的vegan包对抽平后的测序数据进行α多样性指数计算。利用生科云平台(https://www.bioincloud.tech)进行LEfSe分析。通过vegan包进行Adonis和Anosim分析,并计算Bray-Curtis距离,进行细菌群落结构主坐标分析(PCoA)。采用Canoco 5.0软件进行冗余分析(RDA)。利用R软件中的linkET、ggcor、ggplot2、dplyr包进行植物指标相关性及其与细菌群落和代谢功能间的Mantel分析并绘图。利用R软件中的pheatmap、psych以及stringr包进行指示物种与植物指标间的相关性分析并绘图。
2 结果与分析 2.1 生物质炭用量对甘蓝生长的影响与B0对照处理相比,0.5% 生物质炭用量(B5)对甘蓝地上部生物量、根系质量及根冠比影响不大;增加生物质炭用量至1.0%(B10)有效提高了甘蓝地上部生物量、根系质量,并显著降低了根冠比;继续增加生物质炭用量至2.0%(B20)和4.0%(B40),甘蓝地上部生物量、根系质量及根冠比变化不大(表 1)。此外,生物质炭的施用显著提高了甘蓝株高,其中B5、B10、B20和B40处理甘蓝株高分别较B0处理提高34.51%、32.26%、16.04% 和18.73%,但不同生物质炭用量间甘蓝株高无显著差异。
|
|
表 1 生物质炭用量对甘蓝生长的影响 Table 1 Effect of biochar dosage on cabbage growth |
土壤养分是土壤的本质属性,其含量的高低直接影响作物产量和品质[23]。由表 2可见,施用生物质炭提高了土壤有机碳、全氮、速效钾含量以及土壤pH和CEC,但不影响土壤有效磷含量水平。不同生物质炭用量的土壤理化性状不同,B5处理显著提高了土壤pH和CEC,但土壤有机碳、全氮和速效含量与B0处理无显著差异;B10处理土壤有机碳、全氮和速效钾含量及土壤pH和CEC均显著提高,其中土壤有机碳、全氮、速效钾含量和CEC分别较B0处理提高52.93%、20.33%、95.03% 和38.19%,土壤pH较B0处理提高0.61个单位;继续提高生物质炭用量,B20和B40处理土壤有机碳、速效钾含量和pH进一步提高,但土壤全氮含量和CEC变化不大。
|
|
表 2 生物质炭用量对土壤肥力参数的影响 Table 2 Effects of biochar dosages on soil physicochemical properties |
为明确生物质炭用量对新垦耕地土壤细菌群落多样性的影响,对土壤细菌群落α多样性进行分析,结果(表 3)表明,相较于B0对照,B5处理显著提高了Chao 1、Observed species和Shannon指数,而B10处理还在此基础上提高了Faith's PD指数,即Chao 1、Faith's PD、Observed species和Shannon指数分别较B0处理提高31.66%、15.65%、30.69% 和14.00%。继续增加生物质炭用量,B20和B40处理的Chao 1、Faith's PD、Observed species和Shannon指数基本不变。此外,不同处理土壤细菌获得质控后序列数为82 420 ~ 86 185条,且处理间Simpson指数无显著差异,主要集中在0.987 2 ~ 0.997 8。
|
|
表 3 生物质炭用量对土壤细菌群落α多样性指数的影响(P < 0.05) Table 3 Effects of biochar dosage on α diversity indices of soil bacterial community (ANOVA analysis, P < 0.05) |
如图 1所示,Adonis和Anosim分析结果表明,土壤细菌群落在不同生物质炭处理间具有显著差异。PCoA分析结果表明,PCoA1和PCoA2分别解释了土壤细菌群落变异的29.65% 和13.54%。生物质炭处理(B5、B10、B20和B40)与B0处理之间距离较远,表明生物质炭的施用显著改变了土壤细菌群落结构。B5与B10处理距离接近,与B20、B40处理距离逐渐拉大,表明细菌群落结构随着生物质炭用量的增加显著改变。
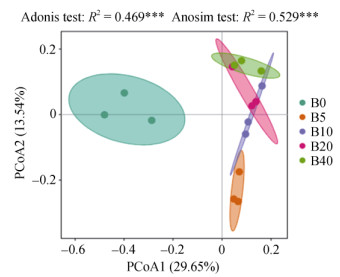
|
图 1 生物质炭处理土壤细菌群落结构差异分析 Fig. 1 Difference analysis of soil bacterial community structures treated by biochar |
如图 2所示,LEfSe分析可筛选出每个生物质炭处理下对群落差异贡献最高的指示物种(LDA > 3.0),能够直观反映样本中对群落变化具有显著影响的细菌类群。结合图 2和图 3可知,B0处理共筛选出指示物种18个,而随着生物质炭施用量的增加,B5、B10、B20、B40处理中指示物种数量呈逐渐上升趋势,分别为8、13、27、42个。
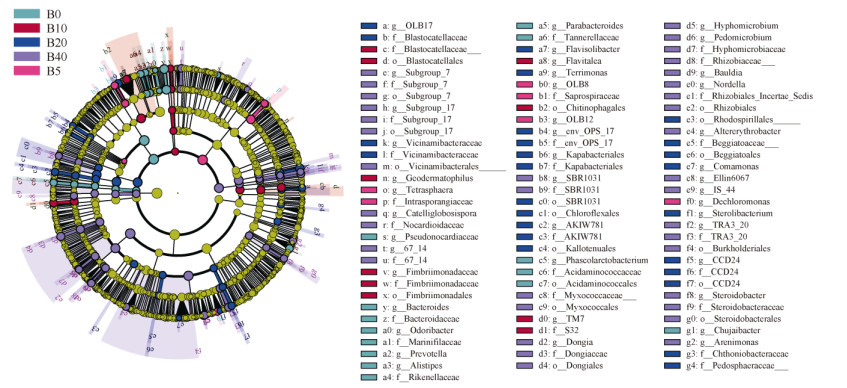
|
图 2 不同处理中细菌群落的LEfSe分析(LDA > 3.0) Fig. 2 LEfSe analysis of bacterial communities under different treatments (LDA > 3.0) |
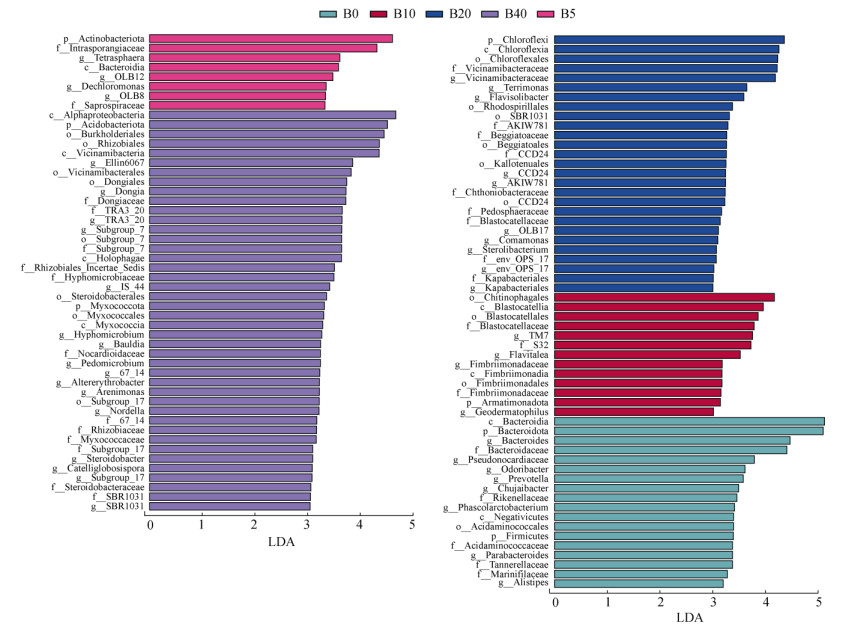
|
图 3 不同处理中细菌群落指示物种LDA值(LDA > 3.0) Fig. 3 LDA values of bacterial biomarkers under different treatments (LDA > 3.0) |
如图 3所示,根据不同指示物种的LDA值分布可知,B0处理下的指示物种主要隶属于拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)两种菌门,并主要以拟杆菌纲(Bacteroidia)、伪诺卡氏菌科(Pseudonocardiaceae)等菌群为主。随着生物质炭施用量的增加,不同处理的指示物种则主要隶属于酸杆菌门(Acidobacteriota)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、黏细菌门(Myxococcota)、变形菌门(Proteobacteria)等细菌门,其中B40处理指示物种主要以α-变形菌纲(Alphaproteobacteria)、伯克氏菌目(Burkholderiales)、根瘤菌目(Rhizobiales)等菌类为主。
根据RDA结果,除有效磷外,土壤pH、CEC、全氮、有效钾以及有机碳含量可显著驱动土壤细菌群落变化,且这些环境因子的升高均可正向调控施用生物质炭处理土壤中的细菌群落(图 4A)。其中,土壤CEC和pH是驱动土壤细菌群落变化最主要的两个环境因子(R2 > 0.75,图 4B)。
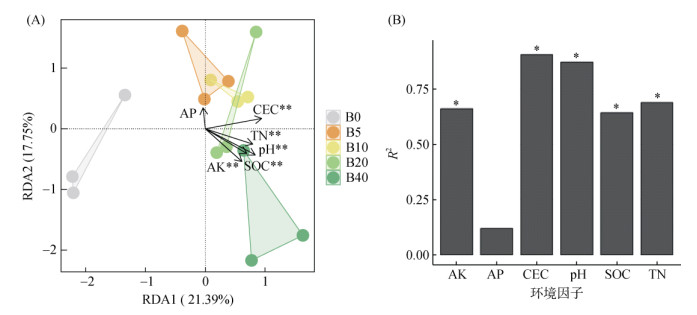
|
(图中*、**表示该环境因子在P < 0.05、P < 0.01水平具有显著影响) 图 4 施用生物质炭土壤细菌群落结构的RDA分析(A)以及各个驱动因子的R2(B) Fig. 4 RDA analysis (A) of soil bacterial community structures treated by biochar and R2 (B) of each driving factor |
根据ASV信息与KEGG数据库的ASV比较和注释,本研究获得了在KEGG L1水平上的6类主要代谢传递途径(图 5),不同处理中代谢传递途径的相对丰度为:新陈代谢(Metabolism) > 遗传信息处理(Genetic information processing) > 细胞过程(Cellular processes) > 人类疾病(Human diseases) > 有机系统(Organismal systems) > 环境信息处理(Environmental information processing)。
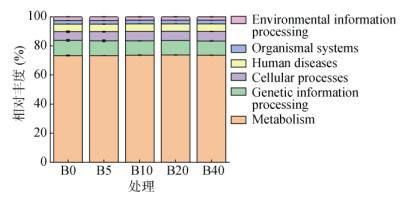
|
图 5 不同处理土壤中细菌群落主要代谢途径在KEGG L1水平上的分布 Fig. 5 Distribution of major metabolic pathways of bacterial communities at KEGG L1 level in different treated soils |
如表 5所示,本研究针对L1水平上丰度最高的新陈代谢(Metabolism)功能类别开展进一步分析,发现在L2水平下,该功能类别中氨基酸代谢、维生素代谢、碳水化合物代谢、其他氨基酸代谢、脂类代谢、其他次生代谢等代谢途径的相对丰度均大于5%,是新垦耕地土壤细菌的主要子功能。生物质炭处理显著影响了氨基酸代谢、碳水化合物代谢、其他氨基酸代谢、脂类代谢和KEGG代谢通路中的全局和总览图谱,其中B10处理氨基酸代谢和脂类代谢代谢显著高于B10处理,而碳水化合物代谢和其他氨基酸代谢显著低于B10处理。
|
|
表 5 生物质炭用量对土壤细菌群落Metabolism功能类别下KEGG L2水平上多种主要代谢途径丰度的影响 Table 5 Effects of biochar dosage on the abundance of multiple major metabolic pathways at the KEGG L2 level in the Metabolism functional class of soil bacterial communities |
如图 6所示,生物质炭施用量与甘蓝地上部生物量、根系质量呈显著正相关,而与根冠比则呈显著负相关。此外,Mantel分析结果进一步表明,土壤细菌群落及其相应的代谢功能均与甘蓝地上部生物量和根冠比显著相关,其中与根冠比相关性达到极显著相关水平(P < 0.01),然而土壤细菌群落则与株高和根系质量无显著相关性。
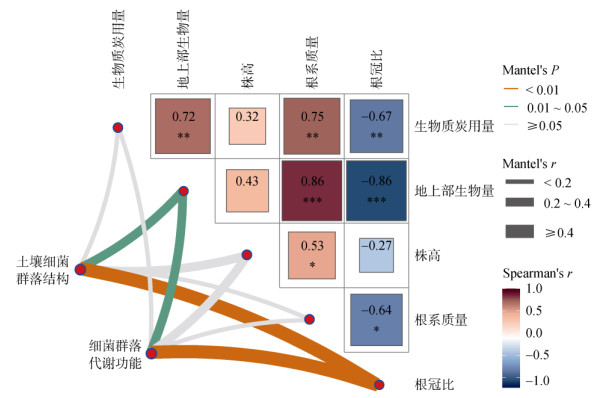
|
(*、**、***分别表示相关性在P < 0.05、P < 0.01、P < 0.001水平显著;下同) 图 6 不同植物指标间相关性及其与土壤细菌群落和代谢功能间的Mantel分析 Fig. 6 Correlations between different plant indices and their Mantel analysis with soil bacterial communities and metabolic functions |
利用Spearman相关性进一步分析不同处理中指示物种与甘蓝生长指标间的相关性(图 7),发现在B0处理的18指示物种中,仅有7个指示物种与甘蓝生长指标呈显著相关;而在施用生物质炭处理中,除B20处理下27个指示物种中有16个与植物生长指标显著相关以外,其他生物质炭处理中的绝大多数细菌指示物种均与至少1种甘蓝生长指标呈显著相关。
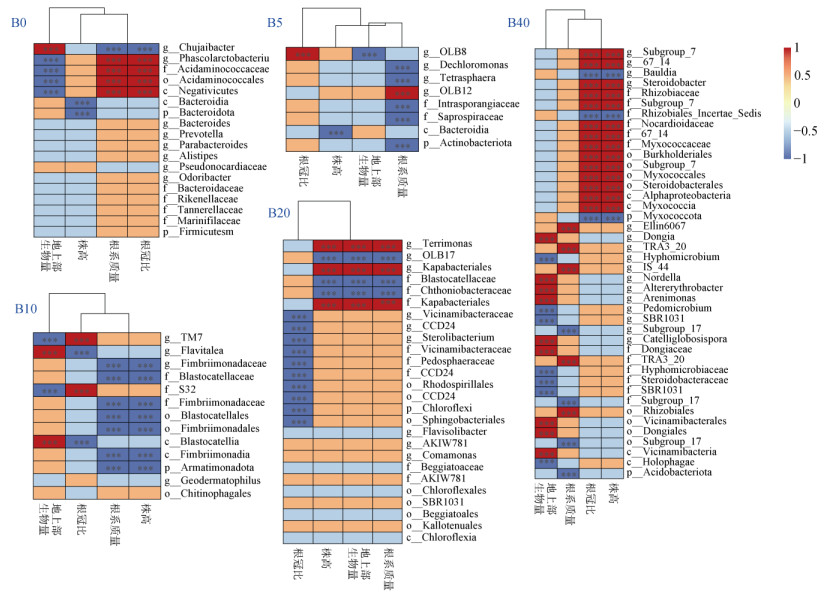
|
图 7 不同处理中细菌指示物种与植物指标间的Spearman相关性分析 Fig. 7 Spearman correlation analysis between bacterial biomarkers and plant indices under different treatments |
生物质炭被誉为“黑色黄金”,通常呈碱性,有较大的表面积、发达的孔隙结构和较强的吸附能力,在提高土壤肥力、改善土壤结构方面表现优异,近年来被广泛应用于退化耕地的改良培肥[24]。前人研究发现,施用生物质炭的土壤有机质、全氮、有效磷、速效钾、碱解氮等养分含量以及土壤pH和CEC均显著提升[25-26]。本研究证实,生物质炭的施用提高了土壤养分含量,且土壤有机碳、全氮和速效钾含量随着生物质炭用量的增加而提高,当生物质炭用量≥1.0% 时,土壤有机碳、全氮和速效钾等养分含量显著高于对照。一方面是因为生物质炭的灰分中富含大量的矿质元素,其中全氮、全磷和全钾的含量分别为12.2、7.2和32.2 g/kg,生物质炭用量增加自然会提高土壤养分含量水平;另一方面,本研究同样发现,施用生物质炭可显著提高土壤CEC,这可能是由于生物质炭具有疏松多孔的结构和较强的吸附能力,且其表面拥有丰富的阴离子芳香族碳的氧化和羧基官能团,不仅可吸附固定大量土壤氮磷有效养分,也可显著提高土壤CEC值,从而显著降低土壤养分的淋溶损失[27]。本研究还发现,生物质炭的施用提高了土壤pH,这与前人的研究结果基本一致[25,28],主要是因为本研究施用的生物质炭pH为10.14,本身呈碱性,其疏松多孔的表面结构富含丰富的碳酸盐和碱基官能团,因此随着生物质炭施用量的增加土壤pH显著升高。可见,施用生物质炭是快速提高新垦耕地土壤肥力水平、改善土壤保水保肥能力的有效措施,从而有助于植物生长。
3.2 生物质炭对新垦耕地土壤细菌群落的影响细菌群落是土壤生态系统最重要的组成部分,其具有多样性高、生物量大、代谢速率快等特点,是土壤养分生物地球化学循环的关键驱动者和重要载体,并显著影响农作物产量和品质[29-30]。本研究发现,施用生物质炭显著提高了土壤细菌群落多样性,这可能是由于生物质炭为土壤细菌群落提供充足且种类更为多样的养分,从而刺激了土壤中不同类型细菌的大量增殖,这也与前人的研究结果相吻合[31-32]。此外,LEfSe分析结果进一步发现,随着生物质炭施用量的增加,土壤中对细菌群落差异贡献最高的指示物种数量也随之增加,进一步证明施用生物质炭可促使土壤中更多的细菌类群大量增殖,进而显著影响土壤养分代谢潜力以及甘蓝的生长发育。
PCoA分析以及Adonis、Anosim分析结果共同表明,施用生物质炭可显著改变土壤细菌群落结构,且不同生物质炭施用量间的差异同样显著。有研究证明,土壤pH是驱动土壤微生物群落变化最关键的环境因素之一[19]。本研究利用RDA分析证明,生物质炭诱导的土壤pH升高同样是新垦耕地土壤细菌群落变化最关键的驱动因子,这与前人的研究结果相吻合[32-33]。此外,生物质炭通常具有较强的吸附性能和良好的多孔结构,从而能够显著增强土壤阳离子交换能力,这也进一步解释了LEfSe分析中指示物种数量随着生物质炭施用量增加而递增的结果。且本研究发现,在高量施用生物质炭处理中,α-变形菌纲(Alphaproteobacteria)、伯克氏菌目(Burkholderiales)、根瘤菌目(Rhizobiales)、噬几丁质菌目(Chitinophagales)等典型的富营养菌群丰度显著增加,表明施用生物质炭可通过塑造富营养的土壤环境为部分细菌类群提供良好的栖息环境,显著改变土壤微生物多样性和群落结构,进而改善土壤细菌群落的代谢能力[34-35]。以上结果表明,施用生物质炭可通过提供更丰富的养分、提高土壤pH和保肥能力等方式促使新垦耕地中富集更多的有益菌群,从而有助于加快土壤养分周转效率,进而促进甘蓝生长。
3.3 生物质炭对新垦耕地土壤微生物功能的影响为进一步阐明不同生物质炭施用量对土壤细菌群落功能的影响,本研究利用PICRUSt 2功能预测软件分析,发现不同处理下微生物群落结构的变化可显著影响其代谢功能。土壤细菌群落部分代谢功能在施用生物质炭的新垦耕地土壤中显著升高,例如,B10处理可显著提高氨基酸代谢和脂类代谢等代谢功能,并显著降低碳水化合物代谢和其他氨基酸代谢等代谢功能。可见,施用生物质炭不仅可调控土壤细菌群落结构,同时也能增强细菌群落的部分关键代谢功能,从而有助于促进生物质炭中养分的快速释放和甘蓝生长。
3.4 生物质炭对甘蓝生长的影响本研究进一步发现,施用生物质炭可通提高土壤养分含量以及改善土壤细菌群落结构及其代谢功能等方式影响甘蓝的生长发育。当生物质炭施用量增加至1.0%、2.0% 和4.0% 时,甘蓝地上部和根系生物量显著提高,这可能是由于施用生物质炭增加了新垦耕地土壤养分含量并改善土壤环境导致的,与以往针对小麦、葡萄、白菜、烟草等其他农作物的研究结果类似[36-37]。其中,生物质炭施用量为1.0% 的处理甘蓝地上部生物量达到最高,且其根冠比同样显著低于其他处理。这一结果表明,适量施用生物质炭在促进甘蓝根系生长发育的同时,也可有效协调地上部和地下部的生物量比例,促使更多生物质炭中的养分转移至地上部,从而显著提高甘蓝产量。本研究还进一步发现,甘蓝地上部生物量和根冠比与土壤细菌群落结构及其代谢功能变化显著相关,且施用生物质炭可促使土壤中绝大多数细菌指示物种丰度与甘蓝生长指标间呈显著相关,表明适量施用生物质炭可促使土壤中更多功能菌群与植物根系之间形成良好的互惠关系,从而显著促进土壤养分活化并提高养分利用率。此外,本研究还发现,高量施用生物质炭可促使土壤中更多的指示物种与甘蓝根冠比呈显著正相关,这表明高量施用生物质炭虽然能够富集更多的富营养菌群,但同时较高的土壤碳氮比也加剧了土壤细菌群落与根系对土壤养分的竞争关系[38-39],进而导致甘蓝吸收的养分被更多的分配在根部,降低了甘蓝地上部生物量。
4 结论适量施用生物质炭可通过提供充足的养分,改善土壤环境和保肥能力,以及调控土壤有益菌群丰度、生态功能及其多样性等多种途径,显著改善新垦耕地土壤理化性状和土壤生物肥力。其中,施用1.0%水平的生物质炭不仅能够显著提升新垦耕地土壤的有机碳、全氮、速效钾含量以及土壤pH和CEC,甘蓝地上部产量最高,且根冠比达到最低,表明1.0% 是最有助于甘蓝生长的生物质炭施用量。
| [1] |
李玉浩, 王红叶, 张骏达, 等. 华南区稻田耕地质量空间分布与产能提升潜力[J]. 中国生态农业学报(中英文), 2023, 31(10): 1613-1625 (  0) 0) |
| [2] |
Song W, Pijanowski B C. The effects of China's cultivated land balance program on potential land productivity at a national scale[J]. Applied Geography, 2014, 46: 158-170 DOI:10.1016/j.apgeog.2013.11.009 (  0) 0) |
| [3] |
陈惠英, 王峰, 王强, 等. 新垦耕地土壤肥力提升路径探析——以浙江省为例[J]. 中国农学通报, 2023, 39(18): 75-80 (  0) 0) |
| [4] |
耿丽娟, 黄宏胜, 何亚芬. 中国耕地占补平衡制度的演变与展望[J]. 安徽农业科学, 2016, 44(7): 231-235 DOI:10.3969/j.issn.0517-6611.2016.07.076 (  0) 0) |
| [5] |
沈建国, 王忠, 李丹, 等. 余杭区新垦红壤耕地肥力特征及地力评价[J]. 土壤通报, 2018, 49(1): 55-60 (  0) 0) |
| [6] |
郑铭洁, 姜铭北, 章明奎, 等. 浙江省新垦耕地土壤熟化指标研究[J]. 浙江农业学报, 2020, 32(10): 1834-1840 (  0) 0) |
| [7] |
吕晓菡, 章明奎, 严建立. 黏土矿物改良剂对新垦砂壤质耕地土壤有机碳积累的影响[J]. 农学学报, 2021, 11(12): 48-52 (  0) 0) |
| [8] |
Han J Q, Dong Y Y, Zhang M. Chemical fertilizer reduction with organic fertilizer effectively improve soil fertility and microbial community from newly cultivated land in the Loess Plateau of China[J]. Applied Soil Ecology, 2021, 165: 103966 DOI:10.1016/j.apsoil.2021.103966 (  0) 0) |
| [9] |
严建立, 章明奎, 王道泽. 磷石膏与石灰石粉配施对新垦红壤耕地的改良效果[J]. 农学学报, 2022, 12(7): 33-37 (  0) 0) |
| [10] |
丁志峰, 陈宇航, 徐秋桐, 等. 组合调理剂对南方低丘新垦耕地肥力质量提升效果研究[J]. 江西农业大学学报, 2023, 45(4): 994-1005 (  0) 0) |
| [11] |
Philippot L, Chenu C, Kappler A, et al. The interplay between microbial communities and soil properties[J]. Nature Reviews Microbiology, 2024, 22(4): 226-239 DOI:10.1038/s41579-023-00980-5 (  0) 0) |
| [12] |
向春雨, 罗栋源, 郭莉, 等. 植物-微生物联合修复化学退化土壤研究进展[J]. 土壤通报, 2024, 55(1): 288-300 (  0) 0) |
| [13] |
Xie Y Q, Wang L, Li H L, et al. A critical review on production, modification and utilization of biochar[J]. Journal of Analytical and Applied Pyrolysis, 2022, 161: 105405 DOI:10.1016/j.jaap.2021.105405 (  0) 0) |
| [14] |
Qian K Z, Kumar A, Zhang H L, et al. Recent advances in utilization of biochar[J]. Renewable and Sustainable Energy Reviews, 2015, 42: 1055-1064 DOI:10.1016/j.rser.2014.10.074 (  0) 0) |
| [15] |
Hossain M Z, Bahar M M, Sarkar B, et al. Biochar and its importance on nutrient dynamics in soil and plant[J]. Biochar, 2020, 2(4): 379-420 DOI:10.1007/s42773-020-00065-z (  0) 0) |
| [16] |
Nguyen T T N, Xu C Y, Tahmasbian I, et al. Effects of biochar on soil available inorganic nitrogen: A review and meta-analysis[J]. Geoderma, 2017, 288: 79-96 DOI:10.1016/j.geoderma.2016.11.004 (  0) 0) |
| [17] |
虞轶俊, 徐青山, 张均华, 等. 土壤培肥技术对土壤健康的影响途径与作用机制[J]. 中国土壤与肥料, 2024(2): 220-227 (  0) 0) |
| [18] |
冯今萍, 周际海, 魏倩, 等. 花生壳及其生物炭施用对旱地红壤微生物活性及红薯产量的影响[J]. 土壤通报, 2023, 54(2): 392-399 (  0) 0) |
| [19] |
李富, 王雪力, 张武, 等. 生物炭添加对三江平原白浆土玉米农田细菌群落的影响[J]. 土壤通报, 2024, 55(3): 758-768 (  0) 0) |
| [20] |
谢祖彬, 刘琦, 许燕萍, 等. 生物炭研究进展及其研究方向[J]. 土壤, 2011, 43(6): 857-861 (  0) 0) |
| [21] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [22] |
Douglas G M, Maffei V J, Zaneveld J R, et al. PICRUSt2 for prediction of metagenome functions[J]. Nature Biotechnology, 2020, 38(6): 685-688 (  0) 0) |
| [23] |
张学林, 徐钧, 安婷婷, 等. 不同氮肥水平下玉米根际土壤特性与产量的关系[J]. 中国农业科学, 2016, 49(14): 2687-2699 (  0) 0) |
| [24] |
傅志强, 刘祯, 马春花, 等. 生物炭及炭基肥对土壤质量与植物生长的影响[J]. 浙江农业学报, 2024, 36(7): 1634-1645 (  0) 0) |
| [25] |
王昆艳, 官会林, 卢俊, 等. 生物质炭施用量对旱地酸性红壤理化性质的影响[J]. 土壤, 2020, 52(3): 503-509 (  0) 0) |
| [26] |
陈明婉, 金鑫, 李晨, 等. 施用生物炭对燥红土基本理化性质及酶活性的影响[J]. 土壤通报, 2022, 53(4): 919-930 (  0) 0) |
| [27] |
康日峰, 张乃明, 史静, 等. 生物炭基肥料对小麦生长、养分吸收及土壤肥力的影响[J]. 中国土壤与肥料, 2014(6): 33-38 (  0) 0) |
| [28] |
刘冲, 刘晓文, 吴文成, 等. 生物炭及炭基肥对油麦菜生长及吸收重金属的影响[J]. 中国环境科学, 2016, 36(10): 3064-3070 (  0) 0) |
| [29] |
褚海燕, 冯毛毛, 柳旭, 等. 土壤微生物生物地理学: 国内进展与国际前沿[J]. 土壤学报, 2020, 57(3): 515-529 (  0) 0) |
| [30] |
戴雅婷, 闫志坚, 解继红, 等. 基于高通量测序的两种植被恢复类型根际土壤细菌多样性研究[J]. 土壤学报, 2017, 54(3): 735-748 (  0) 0) |
| [31] |
谭春玲, 刘洋, 黄雪刚, 等. 生物炭对土壤微生物代谢活动的影响[J]. 中国生态农业学报(中英文), 2022, 30(3): 333-342 (  0) 0) |
| [32] |
Xiang Y Z, Liu Y, Niazi N K, et al. Biochar addition increased soil bacterial diversity and richness: Large-scale evidence of field experiments[J]. Science of the Total Environment, 2023, 893: 164961 (  0) 0) |
| [33] |
Singh H, Northup B K, Rice C W, et al. Biochar applications influence soil physical and chemical properties, microbial diversity, and crop productivity: A meta-analysis[J]. Biochar, 2022, 4(1): 8 (  0) 0) |
| [34] |
Li X, Romanyà J, Li N, et al. Biochar fertilization effects on soil bacterial community and soil phosphorus forms depends on the application rate[J]. Science of the Total Environment, 2022, 843: 157022 (  0) 0) |
| [35] |
Liao H K, Zheng C L, Long J, et al. Effects of biochar amendment on tomato rhizosphere bacterial communities and their utilization of plant-derived carbon in a calcareous soil[J]. Geoderma, 2021, 396: 115082 (  0) 0) |
| [36] |
许跃奇, 赵铭钦, 尤方芳, 等. 生物炭与常规施肥对烟草生长及镉污染吸收的影响[J]. 土壤, 2016, 48(3): 510-515 (  0) 0) |
| [37] |
惠超, 杨卫君, 宋世龙, 等. 生物炭施用对麦田土壤团聚体机械稳定性及春小麦产量的影响[J]. 土壤通报, 2022, 53(2): 349-355 (  0) 0) |
| [38] |
Wang D, Lan Y, Chen W F, et al. Response of bacterial communities, enzyme activities and dynamic changes of soil organic nitrogen fractions to six-year different application levels of biochar retention in Northeast China[J]. Soil and Tillage Research, 2024, 240: 106097 (  0) 0) |
| [39] |
Yao Q, Liu J J, Yu Z H, et al. Changes of bacterial community compositions after three years of biochar application in a black soil of NorthEast China[J]. Applied Soil Ecology, 2017, 113: 11-21 (  0) 0) |
2. Key Laboratory of Urban Environment and Health, Institute of Urban Environment, Chinese Academy of Sciences, Xiamen, Fujian 361020, China;
3. Laboratory of Recycling and Eco-treatment of Waste Biomass, Zhejiang University of Science and Technology, Hangzhou 310023, China;
4. Soil Fertilizer and Plant Protection and Energy Sources Station of Lishui City, Lishui, Zhejiang 323000, China
 2025, Vol. 57
2025, Vol. 57


