2. 土壤与农业可持续发展全国重点是实验室(中国科学院南京土壤研究所), 南京 211135
小分子有机酸在土壤中发挥着重要作用。大量研究[1-4]发现小分子有机酸可以调节土壤pH,改善土壤结构,加快土壤有机质、矿物质的分解,加速碳、氮等元素循环,有助于植物吸收氮、磷等养分。同时,小分子有机酸对污染物转化具有重要影响,它与土壤中重金属离子形成络合物,活化重金属,减少重金属元素的毒性,提高了土壤重金属元素的有效性[5],同时影响土壤微生物的生长和活动,促进微生物对有机污染物的降解。土壤中的自由基在土壤生态系统中也具有重要作用[6],自由基通过参与氧化还原反应,促进有机物质的分解、调节土壤中的元素平衡等,影响着土壤的肥力、生物多样性和生态平衡。近年来,小分子有机酸影响土壤自由基的生成机制引起了学者们的关注。研究表明,小分子有机酸中的羧基可发生解离反应[7],或结构上含有的酚羟基官能团与土壤中的金属离子和其他有机物发生氧化还原反应,也可能通过改变土壤微生物的代谢过程,从而影响土壤中自由基的生成和消除。例如,柠檬酸通过与土壤中的金属离子形成络合物,影响土壤自由基的产生[8]。小分子有机酸在土壤中具有重要影响,尤其在调控自由基行为、土壤结构和功能以及环境效应方面。本文对小分子有机酸影响土壤自由基形成过程与机制的研究进行了综述,并对未来研究方向和发展趋势进行了展望。
1 小分子有机酸的来源、种类及作用小分子有机酸是碳原子数较少的有机分子(碳原子数通常为1 ~ 10),其中至少含有一个羧基(-COOH)[9]。由于羧酸根的离解,小分子有机酸通常携带负电荷,带负电荷的小分子有机酸会与土壤颗粒表面带正电荷的矿物之间形成静电吸引力(比如氧化铁、氧化铝等),使其能够迅速且容易被土壤固相所吸附,从而和土壤中的金属阳离子络合,与土壤基质中的阴离子进行置换[7]。
1.1 小分子有机酸的来源小分子有机酸广泛存在于土壤环境中,其来源主要有3个方面:动植物残体的分解、植物根系的分泌和微生物的代谢[10]。研究发现,有机肥的大量施用也可以加速土壤中小分子有机酸的积累[11]。土壤中存在的小分子有机酸是植物根系分泌物最具活性的组分之一,在植物根系分泌物中含量较高,影响土壤的养分供应、微生物活动、土壤酸碱平衡等。
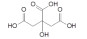
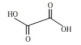
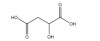
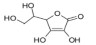
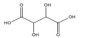
1.2 小分子有机酸的种类土壤中存在多种小分子有机酸(如柠檬酸、草酸、苹果酸、乙酸、甲酸和酒石酸等),在土壤生产力方面发挥重要作用,对土壤生物地球化学过程的影响从高到低依次是:三元羧酸(柠檬酸)、二元羧酸(草酸、马来酸、苹果酸等)和一元羧酸(抗坏血酸、甲酸、乙酸等)[12-13]。在土壤地球生态系统中,二元/三元羧酸的浓度通常在0 ~ 50 µmol/L,一元羧酸的浓度在0 ~ 1 mmol/L [10]。其中,柠檬酸、草酸、酒石酸和苹果酸等普遍存在于植物根际土壤环境中,是累积浓度最高的小分子有机酸[14]。表 1列举了土壤中一些典型小分子有机酸。
|
|
表 1 土壤中典型小分子有机酸 Table 1 Typical low molecular weight organic acids in soil |
小分子有机酸参与成土过程,对土壤性质产生影响。其与土壤矿物发生化学反应,改变矿物表面的化学性质,促进土壤矿物溶解吸附,改变土壤结构和通透性。研究发现高pH导致小分子有机酸对Cu、Cd等金属产生更多的吸附和沉淀[20];破坏有机–无机复合体,通过离子交换释放出土壤中的阳离子(Ca2+、Mg2+、K+等),柠檬酸、草酸可产生H+,从而显著影响Ca的淋失,其影响程度是柠檬酸 > 草酸[9];对土壤酸碱度产生影响,改变根际土壤理化性质,促进植物对养分的吸收;影响有机质的稳定性,研究表明有机酸和氨基酸渗出物会导致矿物相关的有机物积累[2];影响土壤Fe元素的循环,促进污染物降解和植物的重金属富集,有利于重金属污染土壤植物修复技术的发展。
小分子有机酸对土壤养分也具有重要影响。研究发现植物根系分泌的小分子有机酸能增强植物根系土壤溶液中无机磷和有机磷的释放,释放能力为草酸 > 柠檬酸 > 苹果酸[3],这与小分子有机酸的种类、浓度和土壤类型等有关。为减少磷的过量施用及积累,通过施加草酸增加土壤酸度,提高磷吸收和小麦产量[4]。Li和Wang[21]采用土柱模拟淋溶试验,研究了酸雨和几种小分子有机酸对红壤pH和交换性Al的影响,发现小分子有机酸可能比酸雨在土壤酸化方面有更大的威胁。此外,一些小分子有机酸可以作为植物营养物质的来源,直接对植物生长起促进作用,提高植物的养分吸收效率。Qiao等[22]以油籽、向日葵为主要研究植物,发现添加外源小分子有机酸均能提高生物量,降低植物根际的养分和盐度,促进植物根系对养分的吸收。总而言之,小分子有机酸在土壤发生过程中发挥重要作用,影响着土壤性质和养分含量,对土壤生态系统的稳定和植物的生长发育具有重要意义。
1.3.2 小分子有机酸对土壤微生物的影响小分子有机酸是微生物所需碳和能量的来源,能加快根际微生物的生长增殖和代谢活动,促进植物与微生物对碳、氮、磷等养分的吸收以及土壤有益微生物群落形成与功能发挥。土壤中的微生物可以将小分子有机酸迅速分解,且作用时间较短。Zhu等[3]发现小分子有机酸作为微生物的碳源,能显著促进酸性森林土壤磷的有效性。植物根系释放的糖类、有机酸等分泌物可以促进土壤微生物的活动,根系分泌物酶系统能帮助降解土壤中的有机污染物[23]。Braissant等[24]研究表明小分子有机酸是某些土壤细菌唯一的碳和能量来源,真菌和植物产生的柠檬酸和草酸等可以迅速被这些细菌消耗。此外,土壤吸附的小分子有机酸可能是微生物降低生物利用度和矿化的重要机制。
1.3.3 小分子有机酸对土壤有机污染物转化的影响小分子有机酸促进有机污染物在土壤中的迁移和转化,对土壤环境修复和污染物行为产生影响。小分子有机酸通过酸化溶解、桥联络合等机制显著影响土壤中疏水性有机污染物的吸附–解吸行为,从而影响其生物有效性。Ling等[25]研究表明根系分泌物中的小分子有机酸(草酸、柠檬酸、苹果酸)显著促进土壤中多环芳烃(PAHs)的解吸,并提高了降解效率。Yuan等[26]发现小分子有机酸的加入显著抑制PAHs的吸附,促进PAHs从矿物中的解吸。Ren等[27]探讨了小麦根系分泌物对生物质炭改良土壤中阿特拉津解吸的影响,研究表明根系分泌物中含羧基阴离子的小分子有机酸促进了阿特拉津的解吸。
1.3.4 小分子有机酸对土壤重金属的影响土壤中的重金属具有残留时间长、隐蔽性强、难迁移、毒性大等特点,而小分子有机酸与土壤中的重金属离子发生反应,形成络合物使重金属更容易迁移,提高重金属的去除效率,减少土壤重金属的毒害,降低重金属的浓度、迁移性和生物有效性。小分子有机酸通过静电效应、形成三元络合物和表面沉淀等方式,显著促进重金属在土壤颗粒上的吸附和固定,有助于降低重金属的迁移性和生物有效性,为重金属污染土壤的修复提供了理论依据和技术支持。Zia-ur-Rehman等[5]发现外源添加柠檬酸可以提高Cd的植物有效性,促进超积累植物对Cd污染土壤的修复。Wang和Mulligan[16]研究发现小分子有机酸可用于As和重金属污染场地的自然衰减和修复。而在某些情况下小分子有机酸会产生相反作用,通过形成可溶性络合物、与重金属竞争吸附位点等方式抑制重金属的吸附[28]。
2 土壤中活性氧自由基(ROS)的种类、来源及环境效应自由基是指原子或分子轨道中含有一个或多个未成对电子的原子、分子或者离子,其寿命很短,通常在10–9 ~ 10–6 s[29]。自由基通过均裂、加成等途径产生,并在化学反应中参与链式反应的引发、传递和终止步骤。稳定的自由基在化学反应中不容易发生反应,而不稳定的自由基则更容易参与反应。未成对电子数目、原子的电负性、空间位阻、分子中电子离域结构等都会影响自由基的稳定性。一般来说,自由基中的未成对电子数目越少,稳定性越高;原子的电负性越高,更倾向于吸引周围的电子,减少自由基上的未成对电子的反应性,形成的自由基越稳定;具有较大空间位阻的基团或原子的自由基能减少自由基与其他分子之间的碰撞,降低自由基参与不利反应的可能性,其更稳定;分子中存在共轭双键、芳香环或共轭体系等能够共享电子的电子离域结构,可以帮助分散自由基上的未成对电子,提高自由基的稳定性[30]。
2.1 土壤中ROS的种类氧气衍生的活性氧自由基(ROS)代表了生命系统中最重要的自由基种类,将一个电子添到双氧上可以形成超氧阴离子自由基(O2•−)[31]。单线态氧(1O2)是一种高能态氧分子,不会吸附在矿物表面,可通过中间氧化剂的产物降解有机污染物[32]。羟基自由基(•OH,E=2.8eV)是一种化学性质最活泼的活性氧自由基,具有高度反应性。•OH具有极强的得电子能力,是仅次于氟之外最强大的氧化剂,在地表水、大气和土壤等自然环境中广泛存在[33]。因 •OH具有极高的氧化电位,氧化能力极强,与大多数有机污染物都能快速发生氧化反应,形成CO2、H2O、矿物盐或无害化合物,且不产生二次污染。•OH也是目前所知活性氧中对生物体毒性最强、危害最大的一种自由基,几乎可以和所有细胞成分发生反应。如 •OH与糖、蛋白质、核酸等发生氧化反应,损伤蛋白质和DNA,导致细胞突变等。
2.2 土壤中ROS的来源自然界中的化学反应、光照、微生物代谢、人类活动等可以产生氧自由基、氮自由基、硫自由基、炭自由基。过去很长一段时间,光照被认为是自然中产生 •OH的主要途径。随着研究的深入,近年来发现自然条件下湿地、土壤、沉积物可以不借助太阳光照,自发产生 •OH和其他ROS[6]。Page等[34]报道黑暗条件下还原态的有机质可以将O2活化产生H2O2和 •OH。Tong等[35]研究发现黑暗条件下,还原态的沉积物受O2扰动后可产生 •OH,主要是含Fe(Ⅱ)矿物(蒙脱石、黄铁矿、黑云母等)被氧化。自然条件下,•OH的形成途径可根据物质类型划分为:溶解性有机质(DOM)的光敏反应、硝酸盐和亚硝酸盐的光解反应、光催化反应以及Fenton反应[36-37]。而一些生物酶也能产生自由基,例如过氧化物酶、超氧化物歧化酶等作为催化剂通过转移电子的方式促进底物氧化还原反应,从而释放自由基。除此之外,汽车尾气、工厂排放、燃烧过程等都会释放多种自由基,对环境和人体健康产生影响。焚烧产生的生物质炭中持久性自由基的浓度会增加,活化O2或H2O2产生 •OH或O2•−可以有效降解酚类化合物和多氯联苯等有机污染物[38]。
2.3 土壤ROS的重要作用自由基在土壤中的作用是多方面的,涉及到土壤组分形成、有机质分解、污染物降解、植物生长等方面,对土壤的生态环境和养分循环具有重要影响。自由基会影响土壤颗粒表面的化学性质,改变土壤结构,促进土壤颗粒的结合和团聚,影响土壤的肥力、通气性和水分保持能力。土壤中的自由基通过氧化反应加快有机质降解为小分子物质,从而释放出养分和能量,促进土壤有机质循环。研究发现,光化学氧化产生自由基可以矿化沙漠土壤中的有机质;•OH通过光照过程催化Fe(OH)3、Fe2O3等,产生O2•−和H2O2降解有机化合物[39]。Chen等[40]发现在地表水/土壤氧化还原波动过程中Fe(Ⅱ)氧化增强了 •OH的产生。Fang等[41]研究发现在活化过氧硫酸盐过程中,电子传递产生的SO4•−和 •OH能降解多氯联苯、全氟辛酸等新型污染物。光敏作用产生的ROS是土壤污染物降解的主要氧化剂,而ROS可能在非生物胁迫的植物激素信号传导中发挥关键作用。除此之外,自由基可能会对植物、生物体和环境造成损害。
3 小分子有机酸对土壤ROS过程的影响机制 3.1 小分子有机酸的酸化作用对土壤ROS过程的影响小分子有机酸通常含有羧基(-COOH),在水中发生解离生成H+和相应的阴离子以增加溶液的酸度[7]。小分子有机酸的羧基与土壤中的金属离子或其他有机物发生氧化还原反应,从而影响土壤自由基的产生。Wang等[42]发现添加小分子有机酸15 d后,土壤pH有不同程度的降低。Huang等[43]研究发现在弱酸性条件下,赤铁矿纳米颗粒上吸附的草酸可以通过光还原溶解使配体与金属之间发生电荷转移产生Fe(Ⅱ),而草酸会分解成羧基阴离子自由基,可以迅速将O2还原为H2O2,通过Fe(Ⅱ)/Fe(Ⅲ)循环,引发经典的Fenton反应产生 •OH,从而有效降解农田土壤中的罗丹明。Balmer和Sulzberger[44]研究发现含Fe的地表水中,草酸或腐殖酸会降低体系pH,有机络合的Fe(Ⅱ) 被O2快速氧化并产生 •OH,加快全氟辛酸的降解。
3.2 小分子有机酸的络合作用对土壤ROS过程的影响 3.2.1 小分子有机酸的络合作用机理小分子有机酸既能降低土壤pH,又能与重金属络合。其羧基上的羧基氧原子与金属离子形成配位键,在土壤中发生络合,形成稳定的环结构,金属离子被包裹在有机酸分子中,形成金属离子与有机酸之间的络合物。由于配体中的原子与金属离子形成共价键,使得小分子有机酸与Fe(Ⅱ)形成的内圈络合物通常具有较高的稳定性和较强的配位能力。相反,配体与金属离子之间通过静电相互作用,形成的外圈络合物具有较强的离子键性质,外圈络合物的配体离开和新配体的进入相对更容易一点,在某些场合下外圈络合物会更容易发生配体置换反应。由于小分子有机酸和Fe(Ⅱ)配位后形成内圈络合结构,能加速Fe(Ⅱ)氧化和自由基的产生,但产生 •OH的效率会降低[45]。同时,配体类型不同会导致配位体的结合能不同,进而对Fe(Ⅱ)的氧化形成差异。有机酸配体可以与离子态Fe(Ⅱ)发生络合反应,形成配体络合态Fe(Ⅱ),提高或降低Fe(Ⅱ)/Fe(Ⅲ)氧化还原电位,促进或抑制Fe(Ⅱ)的氧化,进而改变氧化过程中 •OH的产生效率。自然界中的小分子有机酸大都是通过综合作用促进Fe从固相中溶解出来活化O2进而产生 •OH降解污染物。
3.2.2 小分子有机酸的络合作用对土壤ROS过程的影响土壤的铁矿物被络合后才能在产生自由基过程中发挥更大作用,并且不同络合物有不同的反应活性。在pH为6 ~ 8时,小分子有机酸介导Fe(Ⅱ)/ Fe(Ⅲ)的氧化还原循环,柠檬酸的络合有效增强O2氧化黄铁矿产生 •OH,加速了黄铁矿的氧化[46]。Zhang等[47]研究也发现中性pH条件下,小分子有机酸对黄铁矿活化O2产生 •OH存在一定促进作用。Yu等[8]发现3种小分子有机酸(柠檬酸、乙二胺四乙酸和草酸)均可促进菱铁矿活化O2产生 •OH,其中柠檬酸促进作用最显著。Keenan和Sedlak[48]在纳米零价铁体系中发现,中性pH条件下存在小分子有机酸时,•OH的产量会大幅增加,可能是有机酸和Fe(Ⅱ)形成络合物活化O2产生 •OH。Fe(Ⅲ)-蒙脱石与苹果酸和草酸的络合物具有很强的光敏性,在光照时很容易产生 •CO2−,进一步产生 •OH或O2•−等,增强菲的降解[49]。柠檬酸络合的Fe(Ⅱ)产生自由基似乎对土壤中三氯乙烯的降解有效,但需要较长的反应时间[50]。总的来说,土壤环境中的小分子有机酸与金属离子的络合机制是一种重要的化学现象,对污染物降解、元素循环等具有重要意义。
3.3 小分子有机酸的还原作用对土壤ROS过程的影响一些小分子有机酸在适当条件下会发生还原反应,在土壤中充当还原剂的角色,影响土壤自由基的生成和消除。Wang和Zhang[51]研究发现草酸在光生空穴作用下产生 •CO2−,其强大的还原能力会显著影响全氟辛酸的降解。Hou等[52]发现抗坏血酸通过还原作用加速Fe(Ⅱ)/Fe(Ⅲ)循环来减缓Fe(Ⅲ)的积累,并通过螯合作用降低Fe(Ⅱ)/Fe(Ⅲ)的氧化还原电位,活化O2增强ROS产生,促进罗丹明的降解。Petsi等[53]探讨了光催化膜反应器技术在有机电子供体存在下从水源中去除硝酸盐的能力,发现甲酸在硝酸盐还原方面具有优势,其次是乙酸和腐植酸。小分子有机酸的还原作用对土壤自由基的平衡产生影响,这会进一步影响土壤的化学性质、微生物活性和生物地球化学循环等。
3.4 小分子有机酸调控土壤ROS对污染物的转化小分子有机酸在土壤中可以起到调节自由基活性的作用,从而影响污染物的转化过程。研究表明,适量添加小分子有机酸可以促进土壤污染物的降解和转化,提高土壤的净化能力。Xie等[54]研究发现柠檬酸和草酸能有效促进还原态沉积物活化O2产生 •OH。Sun等[55]发现柠檬酸和草酸在As表面诱导产生更多 •OH并加速蒽的去除。抗坏血酸的存在显著提高了含水层沉积物H2O2产 •OH的转化效率,高效地去除地下水中的污染物[56]。柠檬酸和草酸由于具有较强的络合能力,提高了电子利用效率,显著增强了水稻土好氧过程中 •OH的产生,并促进吡虫啉的降解[57]。Fe(Ⅱ)的氧化会诱导水铁矿和针铁矿的形成,影响Fe(Ⅱ)氧化还原循环和 •OH产生,产生的 •OH通过羟基化和开环机制可以有效降解多环芳烃[58]。研究发现,小分子有机酸与土壤中的重金属形成络合物,促使重金属离子从土壤固相中解吸并进入土壤溶液中,增加了重金属的活性和生物有效性,但不同类型的小分子有机酸对土壤重金属的洗涤具有不同作用[59]。因此,在土壤修复和环境保护中,可以考虑利用小分子有机酸来调控土壤Fe(Ⅱ)氧化及产生自由基的过程。
4 研究展望由于小分子有机酸在土壤中广泛存在,其调控土壤自由基的影响对土壤环境健康来说至关重要。本文综述了小分子有机酸在调控自由基过程中的关键作用,发现小分子有机酸的酸化、络合作用对土壤自由基的影响较大且研究较多,但有关还原、吸附作用所产生自由基在反应过程中的作用机理尚不明确。结合目前国内外小分子有机酸对土壤中自由基过程的影响研究进程来看,未来应从以下3个方面加强研究。
1) 由于小分子有机酸对土壤重金属具有活化作用,如何在调控自由基的基础上维持重金属平衡,避免其产生二次污染,这对于农田土壤污染修复至关重要。小分子有机酸与矿物表面金属相互作用的研究,目前大多在纯体系中进行,为探究自然环境中小分子有机酸的作用,有必要在复杂多相体系内或实际土壤中研究小分子有机酸的化学行为。
2) 进一步探讨不同类型小分子有机酸对实际土壤中自由基的调控作用和程度,以及自由基的产生与土壤生态系统功能之间的关联,特别是对农田土壤,需要更多的实际研究来验证。
3) 亟需探索绿色、高效、对土壤扰动小、对不同类型土壤具有较高调控效率和针对性的小分子有机酸,为土壤污染防控及作物生长研究提供理论基础和实践指导。
| [1] |
张大庚, 栗杰, 刘慧. 外源低分子量有机酸对土壤中钙素迁移特征的影响[J]. 水土保持学报, 2015, 29(5): 152-155 (  0) 0) |
| [2] |
Chari N R, Taylor B N. Soil organic matter formation and loss are mediated by root exudates in a temperate forest[J]. Nature Geoscience, 2022, 15(12): 1011-1016 DOI:10.1038/s41561-022-01079-x (  0) 0) |
| [3] |
Zhu H, Bing H J, Wu Y H. Citric acid promotes the mobilization of phosphorus under the lower concentration of low molecular weight organic acids in acidic forest soil[J]. Adsorption Science & Technology, 2022, 2022: 5071907 (  0) 0) |
| [4] |
Thammaiah M K, Pandey R N, Purakayastha T J, et al. Impact of low molecular weight organic acids on soil phosphorus release and availability to wheat[J]. Communications in Soil Science and Plant Analysis, 2022, 53(18): 2497-2508 DOI:10.1080/00103624.2022.2071935 (  0) 0) |
| [5] |
Zia-ur-Rehman M, Bani Mfarrej M F, Usman M, et al. Exogenous application of low and high molecular weight organic acids differentially affected the uptake of cadmium in wheat-rice cropping system in alkaline calcareous soil[J]. Environmental Pollution, 2023, 329: 121682 DOI:10.1016/j.envpol.2023.121682 (  0) 0) |
| [6] |
Zhang T, Hansel C M, Voelker B M, et al. Extensive dark biological production of reactive oxygen species in brackish and freshwater ponds[J]. Environmental Science & Technology, 2016, 50(6): 2983-2993 (  0) 0) |
| [7] |
Ryan P R, Delhaize E, Jones D L. Function and mechanism of organic anion exudation from plant roots[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 2001, 52: 527-560 DOI:10.1146/annurev.arplant.52.1.527 (  0) 0) |
| [8] |
Yu H, Zhang P, Liu J Y, et al. Effects of low-molecular- weight organic acids/thiols on hydroxyl radical production from natural siderite oxidation[J]. Chemical Geology, 2021, 584: 120537 DOI:10.1016/j.chemgeo.2021.120537 (  0) 0) |
| [9] |
赵宽, 周葆华, 马万征, 等. 不同环境胁迫对根系分泌有机酸的影响研究进展[J]. 土壤, 2016, 48(2): 235-240 (  0) 0) |
| [10] |
Strobel B W. Influence of vegetation on low-molecular- weight carboxylic acids in soil solution—a review[J]. Geoderma, 2001, 99(3/4): 169-198 (  0) 0) |
| [11] |
Bolan N S, Naidu R, Mahimairaja S, et al. Influence of low-molecular-weight organic acids on the solubilization of phosphates[J]. Biology and Fertility of Soils, 1994, 18(4): 311-319 DOI:10.1007/BF00570634 (  0) 0) |
| [12] |
丁永祯, 李志安, 邹碧. 土壤低分子量有机酸及其生态功能[J]. 土壤, 2005, 37(3): 243-250 (  0) 0) |
| [13] |
Adeleke R, Nwangburuka C, Oboirien B. Origins, roles and fate of organic acids in soils: A review[J]. South African Journal of Botany, 2017, 108: 393-406 DOI:10.1016/j.sajb.2016.09.002 (  0) 0) |
| [14] |
陈虹, 唐昊冶, 钟明, 等. 偶联酰胺化衍生-液相色谱法高灵敏度检测土壤圈样品中小分子单羧酸[J]. 土壤学报, 2022, 59(6): 1594-1605 (  0) 0) |
| [15] |
Książek E. Citric acid: Properties, microbial production, and applications in industries[J]. Molecules, 2023, 29(1): 22 DOI:10.3390/molecules29010022 (  0) 0) |
| [16] |
Wang S L, Mulligan C N. Effects of three low-molecular- weight organic acids (LMWOAs) and pH on the mobilization of arsenic and heavy metals (Cu, Pb, and Zn) from mine tailings[J]. Environmental Geochemistry and Health, 2013, 35(1): 111-118 DOI:10.1007/s10653-012-9461-3 (  0) 0) |
| [17] |
Xiao M, Wu F C. A review of environmental characteristics and effects of low-molecular weight organic acids in the surface ecosystem[J]. Journal of Environmental Sciences, 2014, 26(5): 935-954 DOI:10.1016/S1001-0742(13)60570-7 (  0) 0) |
| [18] |
Wagner A E, Huebbe P, Konishi T, et al. Free radical scavenging and antioxidant activity of ascorbigen versus ascorbic acid: Studies in vitro and in cultured human keratinocytes[J]. Journal of Agricultural and Food Chemistry, 2008, 56(24): 11694-11699 DOI:10.1021/jf802403d (  0) 0) |
| [19] |
Nishikiori R, Yamaguchi M, Takano K, et al. Application of partial least square on quantitative analysis of L-, D-, and DL-tartaric acid by terahertz absorption spectra[J]. Chemical & Pharmaceutical Bulletin, 2008, 56(3): 305-307 (  0) 0) |
| [20] |
Strobel B W, Hansen H C B, Borggaard O K, et al. Cadmium and copper release kinetics in relation to afforestation of cultivated soil[J]. Geochimica et Cosmochimica Acta, 2001, 65(8): 1233-1242 DOI:10.1016/S0016-7037(00)00602-5 (  0) 0) |
| [21] |
Li P, Wang X X. Effects of leaching with low molecular weight organic acids on soil pH and exchangeable aluminum[J]. Soils, 2005, 37(5): 669-673 (  0) 0) |
| [22] |
Qiao D M, Han Y, Zhao Y L. Organic acids in conjunction with various oilseed sunflower cultivars promote Cd phytoextraction through regulating micro-environment in root zone[J]. Industrial Crops and Products, 2022, 183: 114932 DOI:10.1016/j.indcrop.2022.114932 (  0) 0) |
| [23] |
Naidja A, Huang P M, Bollag J M. Enzyme-clay interactions and their impact on transformations of natural and anthropogenic organic compounds in soil[J]. Journal of Environmental Quality, 2000, 29(3): 677-691 (  0) 0) |
| [24] |
Braissant O, Verrecchia E P, Aragno M. Is the contribution of bacteria to terrestrial carbon budget greatly underestimated?[J]. Die Naturwissenschaften, 2002, 89(8): 366-370 DOI:10.1007/s00114-002-0340-0 (  0) 0) |
| [25] |
Ling W, Sun R, Gao X, et al. Low-molecular-weight organic acids enhance desorption of polycyclic aromatic hydrocarbons from soil[J]. European Journal of Soil Science, 2015, 66(2): 339-347 DOI:10.1111/ejss.12227 (  0) 0) |
| [26] |
Yuan L M, Wu Y Q, Fan Q H, et al. Influence mechanism of organic matter and low-molecular-weight organic acids on the interaction between minerals and PAHs[J]. Science of The Total Environment, 2023, 862: 160872 DOI:10.1016/j.scitotenv.2022.160872 (  0) 0) |
| [27] |
Ren X H, Wang F, Cao F M, et al. Desorption of atrazine in biochar-amended soils: Effects of root exudates and the aging interactions between biochar and soil[J]. Chemosphere, 2018, 212: 687-693 DOI:10.1016/j.chemosphere.2018.08.124 (  0) 0) |
| [28] |
Zhu J, Fu Q L, Qiu G H, et al. Influence of low molecular weight anionic ligands on the sorption of heavy metals by soil constituents: A review[J]. Environmental Chemistry Letters, 2019, 17(3): 1271-1280 DOI:10.1007/s10311-019-00881-1 (  0) 0) |
| [29] |
Swartz H M, Mason R P, Hogg N, et al. Free radicals and medicine[M]. Boston, MA; Springer US. 2005: 25–74.
(  0) 0) |
| [30] |
Chen X Y, Sun-Waterhouse D, Yao W Z, et al. Free radical- mediated degradation of polysaccharides: Mechanism of free radical formation and degradation, influence factors and product properties[J]. Food Chemistry, 2021, 365: 130524 DOI:10.1016/j.foodchem.2021.130524 (  0) 0) |
| [31] |
Miller D M, Buettner G R, Aust S D. Transition metals as catalysts of "autoxidation" reactions[J]. Free Radical Biology and Medicine, 1990, 8(1): 95-108 DOI:10.1016/0891-5849(90)90148-C (  0) 0) |
| [32] |
Gohre K, Scholl R, Miller G C. Singlet oxygen reactions on irradiated soil surfaces[J]. Environmental Science & Technology, 1986, 20(9): 934-938 (  0) 0) |
| [33] |
Mopper K, Zhou X. Hydroxyl radical photoproduction in the sea and its potential impact on marine processes[J]. Science, 1990, 250(4981): 661-664 DOI:10.1126/science.250.4981.661 (  0) 0) |
| [34] |
Page S E, Sander M, Arnold W A, et al. Hydroxyl radical formation upon oxidation of reduced humic acids by oxygen in the dark[J]. Environmental Science & Technology, 2012, 46(3): 1590-1597 (  0) 0) |
| [35] |
Tong M, Yuan S H, Ma S C, et al. Production of abundant hydroxyl radicals from oxygenation of subsurface sediments[J]. Environmental Science & Technology, 2016, 50(1): 214-221 (  0) 0) |
| [36] |
彭菲, 王肖磊, 方国东, 等. 过硫酸盐在不同类型土壤中分解产生自由基的过程机制研究[J]. 土壤, 2022, 54(6): 1210-1218 (  0) 0) |
| [37] |
曾宇, 张明洋, 李马波, 等. 稻田上覆水中光致活性组分形成过程及其环境效应研究进展[J]. 土壤学报, 2024, 61(4): 929-938 (  0) 0) |
| [38] |
Fang G D, Liu C, Gao J, et al. Manipulation of persistent free radicals in biochar to activate persulfate for contaminant degradation[J]. Environmental Science & Technology, 2015, 49(9): 5645-5653 (  0) 0) |
| [39] |
Wu F, Deng N S. Photochemistry of hydrolytic iron (Ⅲ) species and photoinduced degradation of organic compounds. A minireview[J]. Chemosphere, 2000, 41(8): 1137-1147 (  0) 0) |
| [40] |
Chen N, Geng M Y, Huang D Y, et al. Hydroxyl radical formation during oxygen-mediated oxidation of ferrous iron on mineral surface: Dependence on mineral identity[J]. Journal of Hazardous Materials, 2022, 434: 128861 (  0) 0) |
| [41] |
Fang G D, Zhang T, Cui H B, et al. Synergy between iron and selenide on FeSe2(111) surface driving peroxymonosulfate activation for efficient degradation of pollutants[J]. Environmental Science & Technology, 2020, 54(23): 15489-15498 (  0) 0) |
| [42] |
Wang Y Z, Peng X Y, Wang X Y, et al. Microbial phosphorus, available phosphorus organic carbon and pH changes in calcareous, neutral and acidic soils induced by low molecular weight organic acid addition[J]. Fresenius Environmental Bulletin, 2020, 29(2): 693-699 (  0) 0) |
| [43] |
Huang X P, Zhao Q, Young R P, et al. Photo-production of reactive oxygen species and degradation of dissolved organic matter by hematite nanoplates functionalized by adsorbed oxalate[J]. Environmental Science: Nano, 2020, 7(8): 2278-2292 (  0) 0) |
| [44] |
Balmer M E, Sulzberger B. Atrazine degradation in irradiated iron/oxalate systems: effects of pH and oxalate[J]. Environmental Science & Technology, 1999, 33(14): 2418-2424 (  0) 0) |
| [45] |
Huang J Z, Jones A, Waite T D, et al. Fe(Ⅱ) redox chemistry in the environment[J]. Chemical Reviews, 2021, 121(13): 8161-8233 (  0) 0) |
| [46] |
Zhang P, Yuan S H. Production of hydroxyl radicals from abiotic oxidation of pyrite by oxygen under circumneutral conditions in the presence of low-molecular-weight organic acids[J]. Geochimica et Cosmochimica Acta, 2017, 218: 153-166 (  0) 0) |
| [47] |
Zhang P, Yuan S H, Liao P. Mechanisms of hydroxyl radical production from abiotic oxidation of pyrite under acidic conditions[J]. Geochimica et Cosmochimica Acta, 2016, 172: 444-457 (  0) 0) |
| [48] |
Keenan C R, Sedlak D L. Ligand-enhanced reactive oxidant generation by nanoparticulate zero-valent iron and oxygen[J]. Environmental Science & Technology, 2008, 42(18): 6936-6941 (  0) 0) |
| [49] |
Jia H Z, Chen H X, Nulaji G, et al. Effect of low-molecular-weight organic acids on photo-degradation of phenanthrene catalyzed by Fe(Ⅲ)-smectite under visible light[J]. Chemosphere, 2015, 138: 266-271 (  0) 0) |
| [50] |
Liang C J, Bruell C J, Marley M C, et al. Persulfate oxidation for in situ remediation of TCE. Ⅱ. Activated by chelated ferrous ion[J]. Chemosphere, 2004, 55(9): 1225-1233 (  0) 0) |
| [51] |
Wang Y, Zhang P Y. Photocatalytic decomposition of perfluorooctanoic acid (PFOA) by TiO2 in the presence of oxalic acid[J]. Journal of Hazardous Materials, 2011, 192(3): 1869-1875 (  0) 0) |
| [52] |
Hou X J, Shen W J, Huang X P, et al. Ascorbic acid enhanced activation of oxygen by ferrous iron: A case of aerobic degradation of rhodamine B[J]. Journal of Hazardous Materials, 2016, 308: 67-74 (  0) 0) |
| [53] |
Petsi P N, Sarasidis V C, Plakas K V, et al. Reduction of nitrates in a photocatalytic membrane reactor in the presence of organic acids[J]. Journal of Environmental Management, 2021, 298: 113526 (  0) 0) |
| [54] |
Xie W J, Zhang P, Liao W J, et al. Ligand-enhanced electron utilization for trichloroethylene degradation by ·OH during sediment oxygenation[J]. Environmental Science & Technology, 2021, 55(10): 7044-7051 (  0) 0) |
| [55] |
Sun Z Y, Wang X H, Liu C, et al. Persistent free radicals from low-molecular-weight organic compounds enhance cross-coupling reactions and toxicity of anthracene on amorphous silica surfaces under light[J]. Environmental Science & Technology, 2021, 55(6): 3716-3726 (  0) 0) |
| [56] |
Hou X J, Huang X P, Li M L, et al. Fenton oxidation of organic contaminants with aquifer sediment activated by ascorbic acid[J]. Chemical Engineering Journal, 2018, 348: 255-262 (  0) 0) |
| [57] |
Wang Y X, Huang D Y, Ge C H, et al. Amendment of organic acids significantly enhanced hydroxyl radical production during oxygenation of paddy soils[J]. Journal of Hazardous Materials, 2023, 457: 131799 (  0) 0) |
| [58] |
Chen N, Huang D Y, Liu G X, et al. Active iron species driven hydroxyl radicals formation in oxygenation of different paddy soils: Implications to polycyclic aromatic hydrocarbons degradation[J]. Water Research, 2021, 203: 117484 (  0) 0) |
| [59] |
Gao C H, Fu R B. The removal of heavy metals by low molecular organic acids (LMWOAs) from contaminated soils and key influencing factors: A literature review[J]. Polish Journal of Environmental Studies, 2023, 32(1): 491-507 (  0) 0) |
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China
 2025, Vol. 57
2025, Vol. 57