2. 中国科学院大学, 北京 100049
烟嘧磺隆是一种磺酰脲类除草剂,由于其农田施用量低、生物活性高、选择性强以及对人体和哺乳动物毒性小等特点,在20世纪末就已成为世界范围内广泛应用的超高效除草剂,在农业生产过程中发挥了很大的作用[1-2]。然而,随着磺酰脲类除草剂使用面积和用量不断扩大,也带来了包括土壤长效残留[3-4]、后茬作物药害[5-6]和农药抗性[7-8]等诸多农业和生态环境问题,引起农业环境管理部门和科学研究者的持续关注。
土壤污染物微生物降解,是一种高效低廉、环境友好的绿色可持续发展技术,也是目前去除农药环境残留的重要技术手段之一[9-10]。为提高微生物降解技术的适用性,已有近百种磺酰脲类除草剂降解菌属,如红球菌[11]、假单胞菌[12]、黑曲霉菌[13]、青霉菌[14]被成功分离纯化。尽管大多研究已在一定程度上促进了单一降解体系中微生物的酶促降解功能与降解转化机制的认知,然而,土壤中微生物降解发生过程及土壤组成和关键活性组分对降解的影响机制,还缺乏深入研究。这在很大程度上限制了土壤磺酰脲类除草剂微生物降解去除技术发展与应用。已有研究发现,土壤中黏粒含量[15]、黏土矿物含量[16]、有机质含量[17]显著影响土壤中烟嘧磺隆的半衰期、迁移能力和对烟草、玉米等作物的药害程度。土壤黏土矿物和有机质是土壤重要的活性组分,其结构与含量将显著影响烟嘧磺隆在土壤体系的相间迁移与消散能力,可能导致其在土壤中流动性减小、土壤污染残留水平升高[18–20]。除对污染物环境行为的影响,土壤组成结构,如黏土矿物具有良好的层间结构以及有机质具有丰富的元素及表面官能团,也可能改变微生物生理与代谢活性;反之,微生物通过氧化还原过程及分泌有机酸、代谢副产物、胞外聚合物等生理活动,调节土壤黏土矿物及土壤有机质的结构性质[21]。因此,研究不同土壤活性组分对烟嘧磺隆除草剂微生物降解过程的影响与作用机制,将有助于更好地理解土壤组成结构对烟嘧磺隆微生物降解的调节意义,为农田土壤长效残留磺酰脲类除草剂的微生物修复技术应用提供科学依据。
本研究主要以烟嘧磺隆农药生产厂废水处理系统的活性污泥筛分菌株Talaromyces flavus LZM1为高效降解真菌,结合扫描电子显微镜–X射线能谱仪(SEM-EDS)、液相质谱–飞行时间质谱联用仪(LC-QTOF)等多元分析技术方法,揭示不同土壤活性组分对烟嘧磺隆微生物降解过程的影响与机制,阐明烟嘧磺隆微生物降解产物组成与通路变化及不同土壤活性组分对降解通路的调节作用,从而为土壤中微生物高效降解去除烟嘧磺隆长效残留污染物提供科学依据和理论指导。
1 材料与方法 1.1 供试材料试验用试剂烟嘧磺隆(> 95%)、2-氨基-4, 6-二甲氧基嘧啶(ADMP,98%)、2-氨基磺酰基-N, N-二甲基烟酰胺(ASDM,95%)、蒙脱土(MMT)购自美国Sigma-Aldrich公司。胡敏酸(HA)购自上海源叶生物科技有限公司。微生物营养基质与底物,包括马铃薯葡萄糖琼脂(PDA)、马铃薯葡萄糖水(PB)培养基,均购自青岛高科技工业园海博生物技术有限公司。磷酸盐缓冲盐水(PBS,pH 7.2 ~ 7.4)购自Biosharp公司。有机溶剂乙腈、乙酸(色谱纯度)购自默克公司。其他涉及的相关化学物质均为化学纯,购自国药集团化学试剂有限公司。微生物降解菌株LZM1(ACCC 32503)购自中国农业微生物菌种保藏管理中心。由实验室Millipore Synergy UV水净化系统(Millipore, Billerica, MA, USA)制备超纯水。
1.2 微生物培养取–80 ℃超低温冰箱中保藏的甘油菌株,于100 mL PB培养基中,在180 r/min、30 ℃条件下振荡活化培养2 d。使用接种环取少量活化培养液在PDA平板固体培养基进行划线分离,30 ℃条件下培养2 d,挑取单菌落于100 mL PB培养基中,在180 r/min、30 ℃条件下振荡纯化培养2 d。用无菌吸管吸取0.1 mL菌悬液于PDA平板固体培养基,涂匀,30 ℃条件下培养5 d。取已经培养好的LZM1平板菌种,加入5 mL无菌水,使用涂布棒轻轻将琼脂表面的孢子刮下,将该孢子悬浮液置于已灭菌50 mL三角瓶中,瓶内预先放置20粒无菌玻璃球,充分振荡摇匀后用灭菌的脱脂棉过滤到灭菌的15 mL离心管中,并用无菌水冲洗滤渣2 ~ 3次,最终使滤液体积达到10 mL,得到孢子悬浮液待用。
由于除对烟嘧磺隆具有较强的吸附固持能力外,土壤黏土矿物——蒙脱土(MMT)可能因其具有适宜的粒径分布可以为微生物生长提供良好的栖生环境,而胡敏酸也可作为唯一共代谢底物促进微生物生长代谢,因此以MMT和HA为典型土壤活性组分并制得混合PB培养基,以探究其对微生物生长代谢的影响。于25 mL PB纯培养基、混合PB培养基(分别含1% MMT、1% HA、1% MMT和HA)中,分别加入初始浓度为1×106 CFU的真菌孢子,在180 r/min、30 ℃条件下振荡培养2d,收获菌体浓度为1 ~ 1.5 g/L的培养液,继而置于离心机中以5 000 r/min高速离心10 min;弃去上清液,于离心管中加入25 mL PBS缓冲液重悬,重悬菌液再次以5 000 r/min离心10 min;以上过程重复两次,收获菌体母液。
1.3 烟嘧磺隆微生物降解初始配置2.4 mmol/L的烟嘧磺隆水溶液,过0.22 μm无菌水系针头滤器,使用灭菌PB培养基稀释制备0.24 mmol/L烟嘧磺隆培养基;以25 mL培养基稀释烟嘧磺隆水溶液重悬菌体,保证菌体浓度为1 ~ 1.5 g/L。在180 r/min、30 ℃条件下振荡培养,设置取样点为0、2、4、8、24、36、48、72、96、120 h。培养结束后,取2 mL培养液加入2 mL离心管中,在10 000 r/min、4 ℃超高速离心2 min。取0.2 mL上清液与1.8 mL乙腈混合,1 000 r/min涡旋5 min;再次在10 000 r/min、4 ℃条件下高速离心2 min以去除体系中少量盐组分;以0.22 μm有机系针头滤器过滤上清液,转移至2 mL进样瓶待测。取以上步骤中第一步离心后弃去上清液的沉淀菌体,向其中加入2 mL乙腈、0.5 g 95% 氧化锆珠(0.1 mm)和数粒大粒径95% 氧化锆珠(6 mm),破坏性提取细胞累积污染物;提取液经2 000 r/min条件下涡旋20 min、10 000 r/min和4 ℃离心2 min后,取0.2 mL上清液与1.8 mL乙腈混合;再次在10 000 r/min、4 ℃冷浴条件下高速离心2 min以去除体系中少量盐组分;由0.22 μm有机系针头滤器过滤上清液,转移至2 mL进样瓶待测。
1.4 分析测定方法以高效液相色谱(HPLC,Agilent 1200)法分别测定烟嘧磺隆母体化合物降解残留以及ADMP和ASDM关键微生物降解产物浓度水平。HPLC流动相为乙腈∶0.1%乙酸水= 40∶60,色谱柱选择waters symmetry C18(5 μm, 4.6 mm×250 mm),柱温箱温度设为30 ℃;使用二极管阵列检测器(DAD),检测波长分别设为240 nm(烟嘧磺隆)、265 nm(ADMP、ASDM);流速为1 mL/min,进样量为5 μL,保留时间为12 min;烟嘧磺隆、ADMP和ASDM的出峰时间分别为5.35、3.16、2.48 min。为深入解析烟嘧磺隆微生物降解产物组成与分布特征,以高分辨液相色谱–飞行时间质谱联用仪(X500R LC-QTOF,AB Sciex)进行产物定性分析。LC-QTOF色谱柱选择waters BEH C18 (1.8 μm, 2.1 mm × 100 mm),柱温为40 ℃,自动进样量为5 μL,流动相为梯度洗脱条件下的乙腈和2 mmol/L乙酸胺/0.1%甲酸混合溶液,流速为0.3 mL/min,使用IDA采集模式。TOF MS条件如下:离子源气体,55 Psi;温度,550 ℃;气帘气,35;CAD气,8。正离子模式条件下,优化参数如下:离子模式,ESI+;离子喷射电压,5 500 V;TOF MS采集时间,0.2 s;采集范围,60 ~ 800 Da;DP,60 V;CE,10 V;TOF MS/MS采集时间,0.07 s;采集范围,30 ~ 800 Da;CE Spread,15 V;DP,60 V;CE,15 V。负离子模式条件下,优化参数如下:离子模式,ESI-;离子喷射电压,–4 500 V;TOF MS采集时间,0.2 s;采集范围,50 ~ 800 Da;DP,–60 V;CE,–10 V;TOF MS/MS采集时间,0.07 s;采集范围,30 ~ 500 Da;CE Spread,15 V;DP,–60 V;CE,–15 V。物质鉴定依据一级质谱、二级质谱结果,部分物质依据标准品进行置信度分类[22]。
1.5 菌体结构表征分析为揭示土壤活性组分对微生物降解菌菌丝体结构形貌和生理活性的影响,进行了菌体结构的表征分析。收集新鲜真菌细胞样品及混合培养样品,5 000 r/min离心10 min,取少量置于1.5 mL离心管内,加入2.5%的戊二醛溶液,放置于4 ℃固定12 h后,去除2.5% 的戊二醛固定液。用0.1 mol/L、pH 7.0的磷酸缓冲液漂洗样品3次,每次15 min;用1% 的锇酸溶液固定样品1 ~ 2 h;小心取出锇酸废液,使用0.1 mol/L、pH 7.0的磷酸缓冲液漂洗样品3次,每次15 min;使用30%、50%、70%、80%、90% 和95% 梯度浓度的乙醇水溶液对样品进行脱水处理,每种浓度各处理15 min,再用100% 的乙醇处理两次,每次20 min。使用乙醇与醋酸异戊酯的混合液(V/V=1/1)处理样品30 min,再用纯醋酸异戊酯处理样品1 h或放置过夜。在临界点干燥、镀膜、观察。处理好的样品在SEM(Sigma 300, Zeiss)3 kV电压下观察MMT、HA和菌体的表面结构形貌特征,并联用EDS观察元素C、O、Al、Si、N、P、S、K和Ca的分布情况及在样品中的质量占比(%)。
1.6 数据分析及质量控制 1.6.1 沉淀–上清液分配系数以沉淀物中物质累积量(mol/kg)与上清液中物质浓度(mol/L)的比值,定义污染物的分配系数,并由此衡量物质在沉淀中累积的能力;分配系数越大,在沉淀中的累积能力越强。
| $ k=\frac{{C}_{沉淀}\text{ }}{{C}_{上清液} } $ | (1) |
式中:k为沉淀–上清液分配系数;
将LC-QTOF测定降解1 ~ 5 d的降解体系中烟嘧磺隆及每种降解产物的相对定量数据分别使用Min-Max法进行标准化处理[23],将相对定量数据通过线性变换映射到0 ~ 1的区间。由于相对定量数据仅能反映该物质的相对浓度,因此不同物质之间的标准化相对浓度数据不可比较,仅在同一物质内进行比较。
| $ {X_*} = \frac{{X - {X_{{\text{min}}}}}}{{{X_{{\text{max}}}} - {X_{{\text{min}}}}}} $ | (2) |
式中:X*为标准化处理后的数据;X为原始数据;Xmin为该物质数据集中的最小值;Xmax为该物质数据集中的最大值。
1.6.3 质量控制微生物分离纯化、低温储存、无菌操作、多个平行组设置以及LC-QTOF相对定量数据的标准化处理,均有助于实现良好的数据质量控制。高效液相色谱法目标物质谱峰具有良好峰形,标准曲线R2 > 0.999。实验中的物质回收率介于80% ~ 120%。数据记录为平均值±标准差(SD),以单因素方差分析并进行多重比较。由OriginPro 2023b和GraphPad Prism 9.5.1进行数据分析、处理及图形绘制。
2 结果与讨论 2.1 土壤活性组分对微生物菌丝体结构形态的影响由SEM-EDS分析发现,土壤活性组分MMT、HA对真菌菌丝体的结构形态、元素组成具有显著影响(图 1)。MMT颗粒直径约为5 ~ 20 nm,包含大量片状结构及碎屑状物质,O、Al、Si元素的总占比超过80%,仅含有少量的C(图 1A,表 1),这与MMT的硅氧化物和铝氧化物内涵结构组成有关[21, 24-25]。HA主要成分为大分子有机物,C、O元素总占比接近90%(表 1),结构表面含有醌基、羧基、羟基等多种官能团以及芳香性结构,不但具有氧化还原和络合能力,也可以作为微生物营养物质来源[26-27]。如图 1B所示,HA也包含少量Si、Al颗粒。真菌菌丝体本身几乎不含Si和Al,但含C、O、N的质量占比很高(图 1C,表 1),这与真菌细胞壁主要成分为多糖并含有少量糖蛋白的特征相符[28]。当在微生物降解培养体系中加入MMT后,微生物菌丝体结构形态发生了显著变化。如图 1D所示,真菌能够在MMT表面附着生长,并形成良好的包覆,颗粒物体积显著增加且散落碎屑状物质减少。矿物表面部分区域的C含量明显提高,真菌菌体表面也检测到了Si和Al。这说明共培养体系中,微生物氧化还原作用下MMT中具有微生物毒性的Al也被部分释放,造成不利影响。但与此同时,真菌分泌胞外聚合物,在具有良好吸附能力的MMT结构表面吸附使MMT发生团聚[29],这不仅改善了MMT松散的结构,同时真菌分泌的有机物质也能与Al发生络合减少其细胞毒性。相比于没有添加MMT的微生物培养体系(图 1C),附着在MMT表面的菌丝结构更为松散,且菌丝体包覆在矿物表面形成良好的生物膜结构,这可能为提高污染物的微生物吸附固持与生物可利用性、提升降解转化效率提供了有利条件。
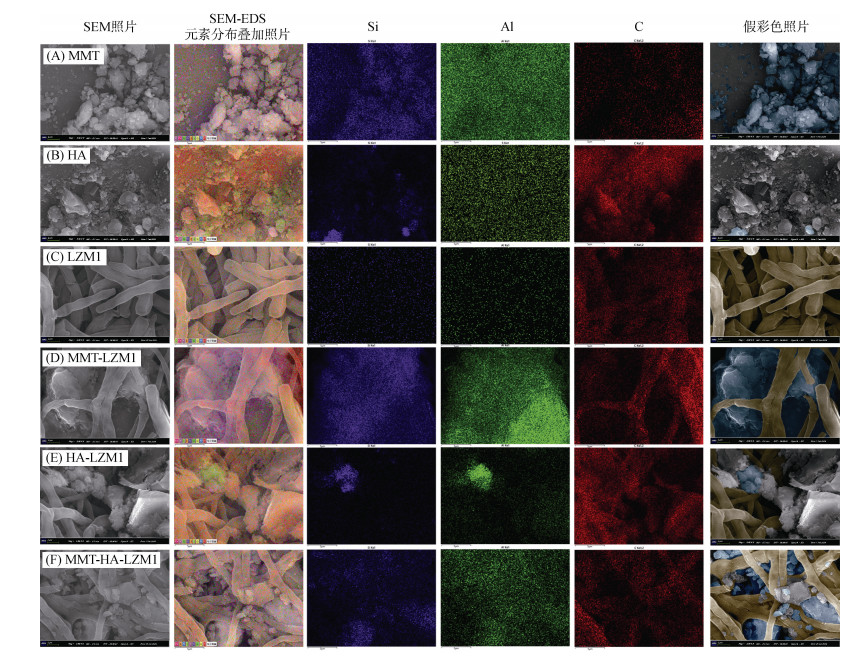
|
(假彩色照片中蓝色区域代表MMT,灰色区域代表HA,黄色区域代表真菌菌丝体) 图 1 蒙脱土对照(A)、胡敏酸对照(B)、微生物处理(C)、蒙脱土-微生物处理(D)、胡敏酸-微生物处理(E)、蒙脱土-胡敏酸-微生物处理(F)的SEM照片、元素分布叠加照片、Si元素分布、Al元素分布、C元素分布以及假彩色照片 Fig. 1 SEM images, superimposed images of element distribution, Si, Al, C element distribution, and false-color images for montmorillonite control (A), humic acid control (B), microbial treatment (C), montmorillonite-microbial treatment (D), humic acid-microbial treatment (E), and montmorillonite-humic acid-microbial treatment (F) |
|
|
表 1 SEM-EDS测定的元素组成及质量占比(%) Table 1 Elemental concentrations of samples by SEM-EDS |
添加HA对微生物菌丝体结构形态也产生显著影响,但与MMT不同。HA与MMT的颗粒直径大致相同,但碎屑状物质较少。如图 1E所示,HA颗粒物与菌丝体作用后,并没有进一步黏合形成更大的团聚物,而是散落在真菌菌丝中。这是因为HA可以作为营养物质被真菌分解利用而体积分散减小。HA与真菌共培养后,菌体表面出现了少量碎屑状有机物的附着,相对于MMT-LZM1处理,菌体的C含量明显提高(表 1)。这进一步验证了真菌可通过促进HA表面附着以强化HA部分有机物质的代谢利用,提高细胞活性,并可能影响微生物污染物代谢降解能力。混合土壤活性组分对微生物菌丝体结构形态也产生了较显著影响(图 1F),一方面真菌作用于MMT和HA,在MMT表面释放胞外聚合物,促进了MMT和HA颗粒物的黏结。另一方面,MMT和HA可能受到真菌影响而分别释放出无机金属离子和有机物质,增强其在菌体表面的附着与滞留。
2.2 土壤活性组分对烟嘧磺隆微生物降解过程影响土壤活性组分MMT、HA与微生物菌丝体间的相互作用,对烟嘧磺隆微生物降解性能及其ADMP和ASDM降解产物组成产生了显著影响(图 2)。未添加降解菌、MMT和HA时(CK),烟嘧磺隆浓度未发生明显减少,表明降解过程中未发生自然化学降解或挥发作用(图 2A)。分别加入MMT、HA和MMT-HA后,烟嘧磺隆的体系残留浓度减小,主要降解产物ADMP和ASDM浓度增加;相比之下,在MMT-HA混合体系中烟嘧磺隆的减少量大于MMT和HA单一体系,表明混合MMT-HA较单一MMT或HA可能通过对烟嘧磺隆的强烈吸附作用而加速了降解发生过程。在初始浓度0.12 mmol/L、pH=6和30 ℃条件下,6 h快速吸附试验发现:MMT、HA和MMT-HA对烟嘧磺隆的理论最大吸附量分别达2.22、0.11和2.26 mg/g,但在短时间内无降解产物检出;MMT、HA和MMT-HA对ADMP的理论最大吸附量分别为5.04、1.17和7.64 mg/g,对ASDM的吸附量分别为0.40、0.43和0.37 mg/g。可见,MMT和HA对ADMP具有很强的吸附能力,对烟嘧磺隆、ASDM也有一定的吸附效果,而MMT-HA混合体系对ADMP的吸附量要大于MMT和HA独立体系的吸附量之和,说明混合体系可以促进两种物质对ADMP的吸附能力。研究发现,MMT-HA表面的羟基发生配体交换反应从而形成稳定的复合物,且能在一定程度上增加土壤活性组分的比表面积[30-31],这可能为MMT-HA混合体系中烟嘧磺隆微生物降解的快速发生奠定了微观结构基础。在土壤活性组分对微生物降解多环芳烃[32-33]、磺胺甲恶唑[34]、邻苯二甲酸酯[35]的影响研究中,也得出了类似结论。然而,黏土矿物部分释放的溶解态金属离子[36]和产生的活性氧物种(ROS)可能会对微生物产生毒害作用[37-38],造成微生物降解性能下降。如图 2所示,在含有LZM1的处理中,添加HA、MMT和MMT-HA并没有增加烟嘧磺隆的消减量,但是改变了烟嘧磺隆的微生物降解动力学,使降解速率维持在稳定水平。根据表 2拟合参数中动力学模型拟合的降解速率常数k0、k1及拟合度R2,发现除LZM1处理体系中微生物降解过程符合一级动力学外,其他处理体系烟嘧磺隆的生物降解过程均遵从零级动力学,表明烟嘧磺隆的依时消减不仅来自微生物降解作用,也与HA和MMT在微生物降解过程中的吸附固定和催化作用有关。相较于单一微生物降解体系中过高污染物初始浓度对微生物生理活性的负面影响,土壤活性组分添加微生物体系中土壤吸附固定过程和微生物降解过程的耦联,可能不仅会影响烟嘧磺隆降解反应进程,也会极大缓解烟嘧磺隆高污染胁迫,即在高污染水平下,烟嘧磺隆微生物降解活性基本不受影响。关键降解产物的组成变化,即36 h后ASDM生成累积远超ADMP,进一步说明HA和MMT的添加可能不仅对产物ADMP有吸附固定作用,也改变了烟嘧磺隆微生物降解反应进程与降解通路。
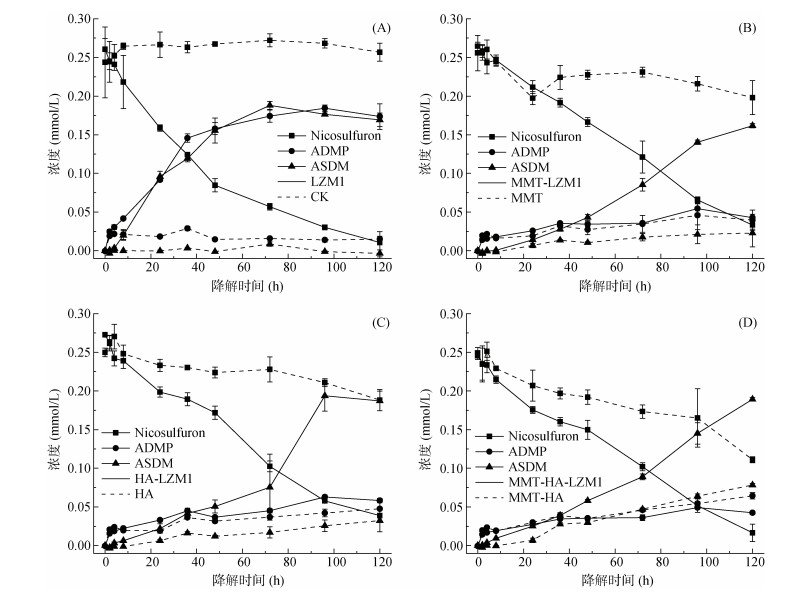
|
(A. CK、LZM1处理;B. MMT、MMT-LZM1处理;C. HA、HA-LZM1处理;D. MMT-HA、MMT-HA-LZM1处理) 图 2 烟嘧磺隆(Nicosulfuron)及其关键产物ADMP和ASDM动态变化 Fig. 2 Dynamic changes of nicosulfuron and its main degradation products (ADMP and ASDM) |
|
|
表 2 烟嘧磺隆浓度变化动力学拟合参数 Table 2 Kinetic fitting parameters for concentration changes of nicosulfuron |
对不同孵育处理体系离心后的沉淀物进行了烟嘧磺隆、ADMP和ASDM的提取与分析测定,发现不同处理沉淀物中的3种物质累积具有显著差异(图 3A)。但5 d后,由于降解体系中不同物质的总浓度不同,可能会导致沉淀物中的累积量不同。因此,引入沉淀–上清液分配系数来描述污染物累积潜能。MMT-LZM1和MMT-HA -LZM1处理中,虽然ADMP在总降解体系(图 2)以及沉淀物(图 3A)中的总浓度和累积量都远小于LZM1处理,但是ADMP的分配系数显著提高(图 3B)。这意味着MMT及MMT-HA可以显著提高ADMP在微生物沉淀的累积,降低ADMP的迁移能力。已有研究表明,ADMP的半致死浓度LD50远大于烟嘧磺隆和ASDM[39],是目前发现的毒性最大的烟嘧磺隆降解产物,并且容易残留,不易进一步发生降解。虽然在含有LZM1的处理中,添加HA、MMT和MMT-HA并没有增加烟嘧磺隆的消减量,但是能够促进具有较强毒性的重要降解产物ADMP在沉淀物中的累积,减少其移动能力,对于缓解微生物降解次生产物的生态毒性具有重要作用与意义。
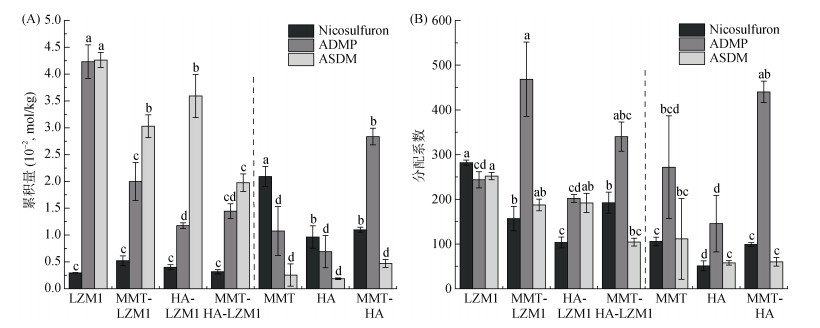
|
(图中小写字母不同表示同种物质在不同处理间差异显著(P < 0.05)) 图 3 降解第5天沉淀中累积的烟嘧磺隆、ADMP和ASDM浓度(A)以及烟嘧磺隆、ADMP和ASDM在沉淀-上清液中的分配系数(B) Fig. 3 Concentrations of accumulated nicosulfuron, ADMP and ASDM in precipitates (A) and distribution coefficients of nicosulfuron, ADMP and ASDM in precipitate-supernatant systems (B) under different treatments on 5th day of degradation |
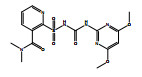
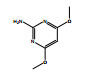
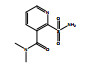
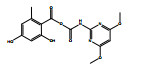
除了关键降解产物ADMP和ASDM以外,烟嘧磺隆微生物降解也产生了许多反应中间体和产物。通过LC-QTOF测定及其二级质谱解析,对不同降解产物进行了定性鉴定(表 3),并由此提出了烟嘧磺隆微生物降解通路及其与产物或中间体的转化反应关系(图 4)。总体来看,烟嘧磺隆的微生物降解主要分为3种途径,分别为磺酰脲桥酰胺键断裂、磺酰脲桥酰胺键Smile收缩重排以及嘧啶环羟基化。这与此前报道的烟嘧磺隆降解途径相似[40-41]。然而,值得注意的是,一种与真菌聚酮类物质苔色酸结合的降解产物P1以及甲醇醇解产物P2属首次分析报道。对无LZM1处理进行分析测定,发现少量降解产物ADMP、ASDM、P4和P5,说明在无微生物参与的MMT和HA的作用下,烟嘧磺隆也能在一定程度上发生磺酰脲桥酰胺键水解生成ADMP、ASDM以及通过磺酰脲桥收缩重排形成P3、P4,这也说明MMT和HA不仅对烟嘧磺隆有吸附能力,也有一定的催化降解功能,而这种能力可以在微生物混合体系中发挥一定的辅助功能。由图 4中相对浓度热图可以看出,在LZM1降解体系中添加MMT、HA会显著影响降解产物的生成方向;其中,ADMP、ASDM、P3、P4和P5的相对浓度要低于LZM1处理。特别是通过羟基化生成的降解产物P5,在含有MMT的处理中几乎没有检测到。烟嘧磺隆在微生物作用下的羟基化过程主要由P450酶为主导的加氧酶催化进行[42],这说明MMT、HA的加入显著影响了加氧酶酶促活性。另外,MMT-LZM1体系中的苔色酸结合产物P1和HA-LZM1体系中的醇解产物P2的相对浓度要高于LZM1处理,这两种降解产物都是与降解菌生理活动产生的代谢物质有关。Li等[43]研究发现,在丝状真菌Talaromyces flavus培养体系中分别添加包括绿泥石、角闪石、磁铁矿等多种矿物,均能促进孢子萌发和菌丝生长,显著提高菌体的代谢活性,促进次生代谢物生成;在与MMT结构类似的2∶1型黏土矿物绿泥石的影响下,培养体系中的苔色酸显著增加。这主要是因为矿物可能导致ROS的产生,对细胞产生氧化应激效应[44]。而苔色酸是良好的抗氧化剂,可以帮助消耗细胞中的ROS以缓解氧化胁迫,保持氧化与抗氧化内稳平衡[45–47]。可见,MMT的添加可能在一定程度上刺激了微生物体内次生代谢物质的产生,并进一步与烟嘧磺隆反应形成了相关降解产物。降解体系中ADMP更多地向P1产生方向进行流动,是加入MMT和HA后ADMP的浓度显著降低的原因之一。
|
|
表 3 烟嘧磺隆及其降解产物组成 Table 3 Nicosulfuron composition and its associated biodegradation products |
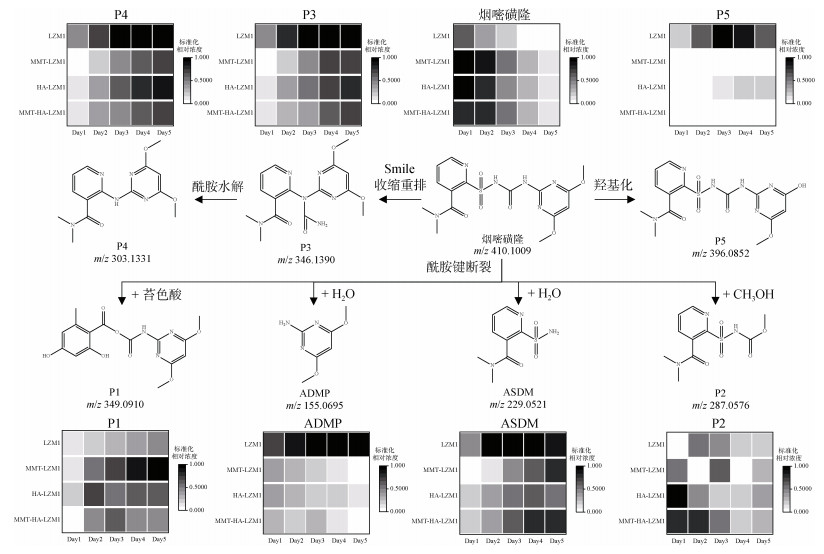
|
图 4 烟嘧磺隆降解通路和烟嘧磺隆及其降解产物标准化相对浓度热图 Fig. 4 Degradation pathway of nicosulfuron, and heatmap of normalized relative concentrations of nicosulfuron and its degradation products |
1) 土壤单一活性组分MMT、HA或混合活性组分MMT-HA能够通过提供微生物栖生表面环境或能源代谢物质,改变微生物菌丝体结构形态,提高细胞及污染物代谢降解活性,促进烟嘧磺隆降解转化,且混合组分效果优于单一组分。
2) 土壤活性组分添加驱动烟嘧磺隆微生物降解反应进程改变,活性组分通过吸附–降解耦联机制减缓微生物高污染胁迫、维持微生物降解活性并促进烟嘧磺隆快速降解,同时显著降低降解产物ADMP的土壤相间迁移性。
3) 土壤活性组分与微生物交互协同调控烟嘧磺隆微生物降解反应通路和产物组成,通过诱导微生物产生抗氧化物质抵抗氧化胁迫,并减少毒性中间体ADMP的累积水平和次生毒性。这为农田土壤烟嘧磺隆微生物降解性能调控与降解技术发展应用提供了科学依据。
| [1] |
Fletcher J S, Pfleeger T G, Ratsch H C. Potential environmental risks associated with the new sulfonylurea herbicides[J]. Environmental Science & Technology, 1993, 27(10): 2250-2252 (  0) 0) |
| [2] |
Lei Q Q, Zhong J F, Chen S F, et al. Microbial degradation as a powerful weapon in the removal of sulfonylurea herbicides[J]. Environmental Research, 2023, 235: 116570 DOI:10.1016/j.envres.2023.116570 (  0) 0) |
| [3] |
Ghani A, Wardle D A. Fate of 14C from glucose and the herbicide metsulfuron–methyl in a plant–soil microcosm system[J]. Soil Biology and Biochemistry, 2001, 33(6): 777-785 DOI:10.1016/S0038-0717(00)00225-X (  0) 0) |
| [4] |
Kotoula-Syka E, Eleftherohorinos I G, Gagianas A A, et al. Phytotoxicity and persistence of chlorsulfuron, metsulfuron-methyl, triasulfuron and tribenuron-methyl in three soils[J]. Weed Research, 1993, 33(5): 355-367 DOI:10.1111/j.1365-3180.1993.tb01951.x (  0) 0) |
| [5] |
Li Y F, Zhang Q N, Yu Y F, et al. Integrated proteomics, metabolomics and physiological analyses for dissecting the toxic effects of halosulfuron-methyl on soybean seedlings (Glycine max merr.)[J]. Plant Physiology and Biochemistry, 2020, 157: 303-315 DOI:10.1016/j.plaphy.2020.10.033 (  0) 0) |
| [6] |
Zhang H, Chen Q F, Shang N, et al. The enhanced mechanisms of Hansschlegelia zhihuaiae S113 degrading bensulfuron-methyl in maize rhizosphere by three organic acids in root exudates[J]. Ecotoxicology and Environmental Safety, 2021, 223: 112622 DOI:10.1016/j.ecoenv.2021.112622 (  0) 0) |
| [7] |
Yu Q, Powles S B. Resistance to AHAS inhibitor herbicides: Current understanding[J]. Pest Management Science, 2014, 70(9): 1340-1350 DOI:10.1002/ps.3710 (  0) 0) |
| [8] |
Zhao N, Yan Y Y, Liu W T, et al. Cytochrome P450 CYP709C56 metabolizing mesosulfuron-methyl confers herbicide resistance in Alopecurus aequalis[J]. Cellular and Molecular Life Sciences, 2022, 79(4): 205 DOI:10.1007/s00018-022-04171-y (  0) 0) |
| [9] |
Fenner K, Canonica S, Wackett L P, et al. Evaluating pesticide degradation in the environment: Blind spots and emerging opportunities[J]. Science, 2013, 341(6147): 752-758 DOI:10.1126/science.1236281 (  0) 0) |
| [10] |
任文杰, 滕应, 骆永明. 东北黑土地农田除草剂污染过程与消减技术研究进展与展望[J]. 土壤学报, 2022, 59(4): 888-898 (  0) 0) |
| [11] |
Zang H L, Wang H L, Miao L, et al. Carboxylesterase, a de-esterification enzyme, catalyzes the degradation of chlorimuron-ethyl in Rhodococcus erythropolis D310-1[J]. Journal of Hazardous Materials, 2020, 387: 121684 DOI:10.1016/j.jhazmat.2019.121684 (  0) 0) |
| [12] |
Li M M, Song J L, Ma Q Y, et al. Insight into the characteristics and new mechanism of nicosulfuron biodegradation by a Pseudomonas sp. LAM1902[J]. Journal of Agricultural and Food Chemistry, 2020, 68(3): 826-837 DOI:10.1021/acs.jafc.9b06897 (  0) 0) |
| [13] |
Lu X H, Kang Z H, Tao B, et al. Degradation of nicosulfuron by Bacillus subtilis YB1 and Aspergillus niger YF1[J]. Prikladnaia Biokhimiia i Mikrobiologiia, 2012, 48(5): 510-515 (  0) 0) |
| [14] |
Peng X X, Huang J F, Liu C L, et al. Biodegradation of bensulphuron-methyl by a novel Penicillium pinophilum strain, BP-H-02[J]. Journal of Hazardous Materials, 2012, 213: 216-221 (  0) 0) |
| [15] |
杨金印, 彭梁睿, 李彩斌, 等. 不同质地土壤中烟嘧磺隆降解特征与烟草致害阈值研究[J]. 中国烟草科学, 2023, 44(6): 29-35 (  0) 0) |
| [16] |
Gonzalez J, Ukrainczyk L. Transport of nicosulfuron in soil columns[J]. Journal of Environmental Quality, 1999, 28(1): 101-107 (  0) 0) |
| [17] |
Diehl K E, Taylor S L, Simpson D M, et al. Effect of soil organic matter on the interaction between nicosulfuron and terbufos in corn (Zea mays)[J]. Weed Science, 1995, 43(2): 306-311 (  0) 0) |
| [18] |
Regitano J B, Koskinen W C. Characterization of nicosulfuron availability in aged soils[J]. Journal of Agricultural and Food Chemistry, 2008, 56(14): 5801-5805 (  0) 0) |
| [19] |
Ukrainczyk L, Rashid N. Irreversible sorption of nicosulfuron on clay minerals[J]. Journal of Agricultural and Food Chemistry, 1995, 43(4): 855-857 (  0) 0) |
| [20] |
Gonzalez J M, Ukrainczyk L. Adsorption and desorption of nicosulfuron in soils[J]. Journal of Environmental Quality, 1996, 25(6): 1186-1192 (  0) 0) |
| [21] |
Dong H. Clay-microbe interactions and implications for environmental mitigation[J]. Elements, 2012, 8(2): 113-118 (  0) 0) |
| [22] |
Schymanski E L, Jeon J, Gulde R, et al. Identifying small molecules via high resolution mass spectrometry: Communicating confidence[J]. Environmental Science & Technology, 2014, 48(4): 2097-2098 (  0) 0) |
| [23] |
赵剑, 邓成军, 李文利, 等. 近35 a新疆天山巴音布鲁克草原退化程度评价[J]. 干旱区研究, 2023, 40(4): 636-646 (  0) 0) |
| [24] |
Xiang L Q, Zhao X P. Preparation of montmorillonite/titania nanocomposite and enhanced electrorheological activity[J]. Journal of Colloid and Interface Science, 2006, 296(1): 131-140 (  0) 0) |
| [25] |
徐海蓉, 洪志能, 徐仁扣, 等. 铁铝氧化物–层状硅酸盐矿物互作对Cr(Ⅵ)和As(Ⅴ)吸附的影响[J]. 土壤, 2023, 55(6): 1306-1315 DOI:10.13758/j.cnki.tr.2023.06.018 (  0) 0) |
| [26] |
牟海燕, 黄武, 万娟, 等. 不同分子量胡敏酸对蒙脱石吸附镉的影响及作用机制[J]. 工程科学与技术, 2021, 53(5): 207-213 (  0) 0) |
| [27] |
江韬. 胡敏酸氧化还原特性及其对汞非生物还原过程的影响研究[D]. 重庆: 西南大学, 2012.
(  0) 0) |
| [28] |
朱信霖, 扈东营, 陈显振, 等. 作用于细胞壁的抗真菌药物研究进展[J]. 菌物学报, 2022, 41(6): 871-877 (  0) 0) |
| [29] |
刘舒宁. 胞外聚合物模式分子与粘土矿物的吸附研究[D]. 武汉: 华中农业大学, 2021.
(  0) 0) |
| [30] |
Jones K D, Tiller C L. Effect of solution chemistry on the extent of binding of phenanthrene by a soil humic acid: A comparison of dissolved and clay bound humic[J]. Environmental Science & Technology, 1999, 33(4): 580-587 (  0) 0) |
| [31] |
张立超, 包先明, 余福波, 等. 富里酸和胡敏酸在蒙脱石上的吸附特性[J]. 环境科学研究, 2013, 26(12): 1333-1339 (  0) 0) |
| [32] |
尹媛, 生弘杰, 王紫泉, 等. 不同载体材料固定Sphingobium sp. PHE3对溶液中菲的降解研究[J]. 土壤学报, 2023, 60(4): 1192-1202 (  0) 0) |
| [33] |
Wang B B, Teng Y, Li R, et al. Exploring the PAHs dissipation and indigenous bacteria response in soil amended with two different microbial inoculants[J]. Science of the Total Environment, 2023, 859: 160186 (  0) 0) |
| [34] |
Liu Z B, Sun X P, Sun Z R. Degradation mechanism of montmorillonite-enhanced antibiotic wastewater: Performance, antibiotic resistance genes, microbial communities, and functional metabolism[J]. Bioresource Technology, 2022, 352: 127098 (  0) 0) |
| [35] |
刘厶瑶. HA和FA对土壤邻苯二甲酸酯微生物降解的影响及其机理[D]. 沈阳: 沈阳大学, 2020.
(  0) 0) |
| [36] |
Londono S C, Hartnett H E, Williams L B. Antibacterial activity of aluminum in clay from the Colombian Amazon[J]. Environmental Science & Technology, 2017, 51(4): 2401-2408 (  0) 0) |
| [37] |
董海良, 曾强, 刘邓, 等. 黏土矿物-微生物相互作用机理以及在环境领域中的应用[J]. 地学前缘, 2024, 31(1): 467-485 (  0) 0) |
| [38] |
Morrison K D, Misra R, Williams L B. Unearthing the antibacterial mechanism of medicinal clay: A geochemical approach to combating antibiotic resistance[J]. Scientific Reports, 2016, 6: 19043 (  0) 0) |
| [39] |
Carles L, Joly M, Bonnemoy F, et al. Identification of sulfonylurea biodegradation pathways enabled by a novel nicosulfuron-transforming strain Pseudomonas fluorescens SG-1: Toxicity assessment and effect of formulation[J]. Journal of Hazardous Materials, 2017, 324: 184-193 (  0) 0) |
| [40] |
Pan X, Wang S G, Shi N, et al. Biodegradation and detoxification of chlorimuron-ethyl by Enterobacter ludwigii sp. CE-1[J]. Ecotoxicology and Environmental Safety, 2018, 150: 34-39 (  0) 0) |
| [41] |
Zhou S, Song J L, Dong W W, et al. Nicosulfuron biodegradation by a novel cold-adapted strain Oceanisphaera psychrotolerans LAM-WHM-ZC[J]. Journal of Agricultural and Food Chemistry, 2017, 65(47): 10243-10249 (  0) 0) |
| [42] |
Choe E, Williams M M 2nd. Expression and comparison of sweet corn CYP81A9s in relation to nicosulfuron sensitivity[J]. Pest Management Science, 2020, 76(9): 3012-3019 (  0) 0) |
| [43] |
Li Z B, Liu L W, Lu X C, et al. Analysis of the Talaromyces flavus exometabolome reveals the complex responses of the fungus to minerals[J]. Geochimica et Cosmochimica Acta, 2021, 298: 70-86 (  0) 0) |
| [44] |
Dong H L, Huang L Q, Zhao L D, et al. A critical review of mineral-microbe interaction and co-evolution: Mechanisms and applications[J]. National Science Review, 2022, 9(10): nwac128 (  0) 0) |
| [45] |
Chou K C C, Yang S H, Wu H L, et al. Biosynthesis of antroquinonol and 4-acetylantroquinonol B via a polyketide pathway using orsellinic acid as a ring precursor in Antrodia cinnamomea[J]. Journal of Agricultural and Food Chemistry, 2017, 65(1): 74-86 (  0) 0) |
| [46] |
Lage T C A, Horta L P, Montanari R M, et al. Structural elucidation and free radical scavenging activity of a new o-orsellinic acid derivative iIsolated from the lichen Cladonia rappii[J]. Natural Product Communications, 2016, 11(9): 1311-1312 (  0) 0) |
| [47] |
Lopes T I B, Coelho R G, Yoshida N C, et al. Radical-scavenging activity of orsellinates[J]. Chemical & Pharmaceutical Bulletin, 2008, 56(11): 1551-1554 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57