当前,微塑料(Microplastics,MPs)在自然环境中被广泛检出,其作为一种新污染物受到了高度关注[1]。最新研究结果显示,我国农田土壤中MPs丰度为4 537个/kg干土[1]。与大块塑料碎片相比,MPs具有更小的粒径(通常小于5 mm)、更大的比表面积、更为发达的孔结构和丰富的表面官能团,其进入土壤后可能通过改变土壤物理、化学和生物等条件对土壤质量和养分循环产生重要的影响[1]。鉴于此,MPs的土壤环境风险已经成为当前研究的热点问题。
MPs的密度通常低于土壤的密度。因此,MPs在土壤中大量累积能够显著降低土壤容重[2]。MPs还会与有机质通过吸附等过程发生胶结作用,提高或降低团聚体的稳定性[3],进而对土壤物理结构、水分和养分保持、土壤有机碳保护等产生重要影响。研究表明,有近72% 的MPs参与土壤团聚体的形成和发展过程[2]。此外,MPs会改变土壤pH和溶解性有机质、NH4+-N及NO3−-N等含量[3-5],但影响的结果(如方向和程度)因MPs种类、形状、浓度等条件的不同而存在较大差异[3, 5]。土壤微生物参与有机质分解和腐殖质形成,在改善土壤肥力、增加土壤养分等方面发挥着至关重要的作用[6]。MPs可通过不同的路径影响土壤酶和微生物活性,以及微生物群落结构的演变[6]。一方面,MPs较大的比表面积和较高的粗糙度,使其可以为微生物提供良好的生态位,促使微生物生物膜和独特微生物群落结构的形成[6],提高酶的活性[6];相反,MPs通过与土壤微生物竞争物理化学小生境而降低微生物和酶的活性[7]。另一方面,MPs通过改变土壤理化条件(如土壤水分、通气、pH等[7]),间接作用于土壤微生物群落的演变。MPs的暴露浓度对其介导的微生物活性和群落结构变化具有显著的影响[3, 8]。Ng等[9]发现高剂量(30 g/kg)的聚乙烯微塑料(PE-MP)能刺激微生物活性,增强有机质代谢,从而可能会增加土壤呼吸。综上所述,前期研究证实了MPs能够对土壤理化和微生物特性产生重要的影响,并探究了MPs的种类、形状、浓度等因素在这些影响过程中的作用规律和相关机制。值得注意的是,MPs在土壤中经过一系列的物理、光、化学和生物降解作用分解(破碎)成不同粒径水平的颗粒(如毫米级、微米级和纳米级)[10],且粒径越小,在土壤中的流动性越好,分布范围和比例越大。在辽西地区典型旱作农田土壤中,MPs主要以 < 1 mm的小尺寸为主,且粒径越小,在土壤中的数量占比呈增加的趋势[11]。在滇池湖滨区域不同土地利用类型的表层土壤中,MPs粒径主要集中于0.05 ~ 0.25 mm,其比重高达82.54%[11]。研究发现,纳米级MPs由于其体积小于细胞体积而容易被植物吸收[11]。当纳米级MPs进入植物体内后,会触发植物发生氧化应激反应而产生过量的活性氧,进而对植物细胞造成不可逆的氧化损伤[11]。因此,不同粒径水平的MPs必然会对土壤特性和营养元素的生物地球化学过程产生不同的影响。然而,当前缺乏系统的研究比较不同粒径MPs对土壤物理、化学和微生物特性影响的差异。
聚乙烯(PE)塑料薄膜具有延展性好、成本低等特点,在农业生产过程中被广泛使用。其作为母质材料产生的PE-MP性质稳定,因而易于在农田土壤中富集[12],是农田土壤中最常见的MPs类型之一[12]。据此,本文选择PE-MP为研究对象,系统研究其在不同粒径水平下对农田土壤团聚体、化学和微生物特性的影响,进而讨论这些变化对土壤质量和养分循环的潜在影响,以期有助于更加准确地认识MPs在农田土壤中的生态风险和更好地做好其污染防控。
1 材料与方法 1.1 土壤和MPs样品准备供试土样于2022年8月采集于山东省青岛市即墨区温泉街道农田(120°39'19.3"E,36°25'45.7"N,海拔43 m),种植的主要农作物为花生。该区域为暖温带,土壤类型为棕壤。采集的表层(0 ~ 20 cm)土壤样品带回实验室后,立即分取部分土样通过烘干法,测量其田间持水量、土壤含水率;剩余土样放置于阴凉处自然风干,并剔除土壤中的石块、动植物残体、塑料等,需要指出的是,在土样中未见MPs。将准备好的土样磨碎,过2 mm筛,充分混合,随机取部分土样,测定土壤理化性质;其余土样过100目筛,进行为期两周的预培养,以恢复微生物活性[13]。土壤基本性质测定结果如下:pH为5.58,土壤容重为1.49 g/cm3,NO3−-N和NH4+-N含量分别为9.05和22.29 mg/kg,土壤有机碳和溶解性有机碳(DOC)含量分别为20.57 g/kg和251.98 mg/kg。
供试颗粒状PE-MP购买自中国石化公司,粒径分为3个水平:毫米级(1 mm左右)、微米级(44 μm左右)和纳米级(1 ~ 100 nm),分别定义为mMP、μMP和nMP。使用元素分析仪(VarioElcube,ELEMETAR,德国)测量PE-MP中C、H、S和N的含量。使用傅里叶变换红外光谱(FTIR,Nicolet is 50,Thermo electron Corporation,美国)和比表面分析仪(BET,ASAP2460,Micromeritics Instrument Corporation,美国)测量3种粒径PE-MP的表面官能团、比表面积、孔隙度和孔径。具体结果见图 1和表 1。
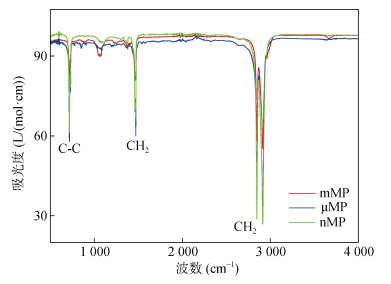
|
图 1 3种粒径PE-MP的傅里叶红外光谱图 Fig. 1 FTIRs of three particle sizes of PE-MP |
|
|
表 1 3种粒径PE-MP的表征分析 Table 1 Characteristics of three particle sizes of PE-MP |
试验采用室内培养的方法,共设置4个处理,分别为无PE-MP添加的空白对照(CK)、添加毫米级PE-MP处理(mMP)、添加微米级PE-MP处理(μMP)和添加纳米级PE-MP处理(nMP),每个处理设置3个平行。目前在自然土壤中检测到的MPs含量在0.055 ~ 67 g/kg[13],同时在室内培养试验研究中MPs的暴露水平通常为1 ~ 100 g/kg[13-14]。考虑到微塑料在自然环境中的积累,本试验各处理组均设置PE-MP含量为20 g/kg[13]。将PE-MP进行消毒灭菌处理后,与土壤(600 g)充分混合,加入棕色培养瓶中。将处理好的试验装置放置在25℃±2℃的恒温箱内进行培养,培养周期为180 d。在整个培养期内利用称重法将土壤含水率维持在田间最大持水量的60%。分别在培养的第2和180天从培养瓶中取样测定DOC含量、pH、NO3−-N和NH4+-N含量等。需特别说明,选择第2天取样是因为该点为土壤CO2排放的峰值点(由于CO2排放不在本文主题范围内,因而其结果未给出)。另外,在试验结束时(第180天)取样测定土壤团聚体和微生物特性指标。
1.3 土壤团聚体特性测定用湿筛法将土壤筛分为4个团聚体粒径等级[15]:> 2、0.25 ~ 2、0.053 ~ 0.25、< 0.053 mm,分别对应于大团聚体、小团聚体、微团聚体和黏粒。称量得到各级水稳定性团聚体质量,计算各级团聚体质量分数。通过计算平均重量直径(MWD)、几何平均直径(GMD)和大团聚体含量(R0.25)(式(1)~(3))来评估土壤团聚的稳定性。
| $ {\text{MWD}} = \mathop \sum \limits_{i = 1}^n ({x_i}{w_i}) $ | (1) |
| $ {\text{GMD}} = {\text{exp}}\left( {\mathop \sum \limits_{i = 1}^n {w_i}{\text{ln}}{x_i}} \right) $ | (2) |
| $ {R_{0.25}} = {m_{r \geqslant 0.25}}/{m_{\text{T}}} $ | (3) |
式中:xi为各粒级团聚体的平均粒径,mm;wi为各粒级团聚体质量占团聚体总质量的比例,%;mT和mr≥0.25分别为团聚体的总质量和粒径大于0.25 mm的团聚体质量,g。
1.4 土壤化学性质测定将去离子水与风干土按照5∶1(V/m)的比例混合,得到悬浊液,摇匀,静置后用pH计(BANTE PHS-3CW)测定土壤pH[16];采用靛酚蓝比色法和可见分光光度计(V-5600,上海梅塔施仪器有限公司,中国)测定土壤NH4+-N含量[3];NO3−-N含量使用Cary100紫外–可见分光光度计(Agilent Technologies,USA)测定[17];将去离子水与风干土按照5∶1(V/m)的比例混合,并于振荡器上在200 r/min条件下振荡2 h,然后用离心机4 000 r/min离心5 min,取上清液过0.45 μm滤膜,用紫外–可见分光光度计测量DOC含量[16]。
1.5 土壤微生物群落结构测定 1.5.1 土壤微生物DNA提取和PCR扩增微生物群落(包括细菌和真菌群落)的测定委托集思慧远生物科技有限公司完成。具体测试方法如下:根据制造商的说明,使用e.zn.a.®土壤DNA试剂盒(Omega Bio-tek,Norcross,GA,美国)从土壤样品中提取微生物DNA。使用引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和907R(5′-CCGTCAATTCMTTTRAGTTT-3′)对细菌的V4 ~ V5区16S rRNA基因进行PCR扩增,使用引物ITS1F(5′-GGAAGTAAAAGTCGTAACAAGG-3′)和ITS1R(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌核糖体ITS1rDNA进行PCR扩增。PCR扩增条件为:95℃预变性5 min,然后95℃变性30 s,55℃退火30 s,72℃延伸45 s,扩增25个循环,最终72℃终延伸5 min,同时每个样品加上6个碱基条形码用于识别。PCR反应在30 μL混合物中进行,其中高保真DNA聚合酶为15 μL,F/R引物(10 μmol/L)各1 μL,模板DNA为20 ng。扩增子从2% 的琼脂糖凝胶中提取,根据制造商的说明,使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,Union City,CA,美国)进行纯化,并使用Qubit®3.0(Life Invitrogen)进行定量。
1.5.2 文库构建与测序按照每个样品所需的数据量进行混样。根据Illumina的基因组DNA库制备程序,将聚合后的DNA产品构建Illumina对端文库。然后在IlluminaNovaseq6000平台(Nanjin GenePioneer Co. Ltd)上按照标准协议对扩增子库进行双端测序(2×250)。使用QIIME(1.91)去除低质量序列并用核蛋白体数据库(Ribosomal Database Project)去除嵌合体,将高质量序列使用Uparse软件以97% 相似度划分后,采用Blast方法以联合数据库(Unite Database)进行真菌注释。原始reads被存入NCBI Sequence Read Archive(SRA)数据库。
1.6 数据处理与分析采用Excel 2021记录数据并进行预处理;所有柱状图均采用Origin 2018进行绘制;采用Chiplot绘图网站绘制微生物多样性指数点线图;使用Canoco 5软件进行冗余分析(RDA分析)并绘图;使用SPSS 26软件进行统计分析,其中采用单因素方差分析(One-way ANOVA)结合Duncan法检验处理间差异显著性(显著性水平为P < 0.05)。
2 结果与分析 2.1 PE-MP对土壤团聚体特性的影响培养结束后,PE-MP添加显著改变了土壤团聚体特性(图 3)。如图 3A所示,与CK处理相比,3个PE-MP处理中大团聚体的含量均显著增加,同时小团聚体含量也呈提高趋势,但仅μMP处理与CK处理之间具有显著性差异;与之对应,微团聚体和黏粒的含量均呈下降趋势,但仅μMP处理与CK处理之间具有显著性差异。从各粒级土壤团聚体含量分布的变化结果来看,不同粒径的PE-MP均对土壤水稳性团聚体的形成具有积极作用。进一步计算团聚体MWD、GMD和R0.25指标发现,与CK处理相比,3种粒径PE-MP处理均具有提高团聚体MWD和GMD的作用,但是仅μMP处理提高作用显著(图 3B和图 3C);而3种粒径PE-MP处理均显著提高了团聚体R0.25值,其中以μMP处理更为显著(图 3D)。综合上述结果可以得出,PE-MP暴露对土壤团聚体稳定性的提高具有积极的作用,并且中等粒径水平(微米级)的PE-MP作用效果更加显著。这可能是由于微米级微塑料具有更大的孔体积、比表面积和更丰富的表面官能团(图 1和表 1),使得该粒级PE-MP与土壤胶体物质之间的相互吸附作用更强[3]。
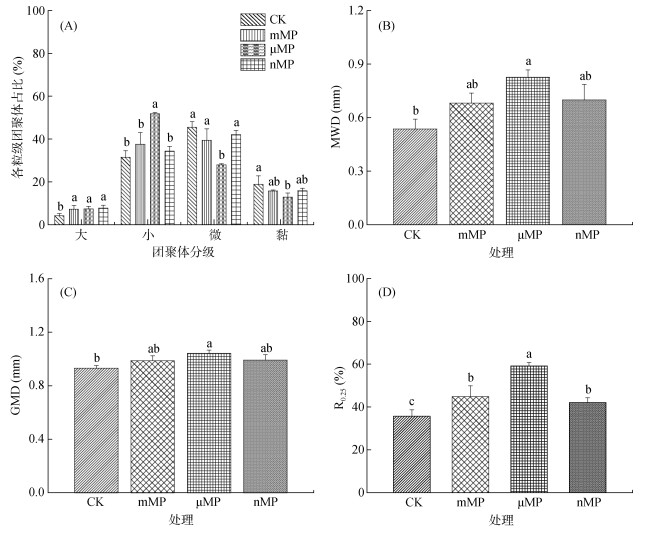
|
(图中不同小写字母表示不同处理间的差异显著(P < 0.05)) 图 2 各处理中各粒级土壤团聚体含量及土壤团聚体稳定性指标 Fig. 2 Contents of aggregates with different sizes and stability indexes of soil aggregates in different treatments |
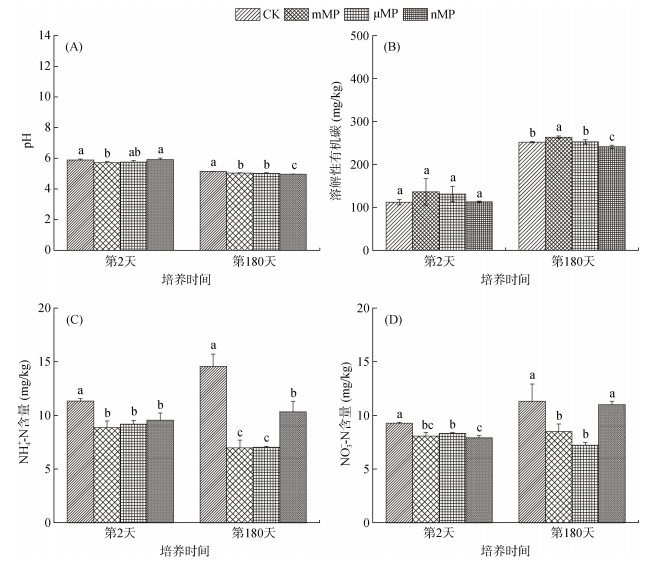
|
(图中不同小写字母表示同一时间不同处理间的差异显著(P < 0.05)) 图 3 各处理组第2天和第180天的土壤、pH(A)、DOC含量(B)、NH4+-N含量(C)和NO3--N含量(D) Fig. 3 pH (A), DOC contents (B), NH4+-N (C) and NO3--N (D) contents (D) at day 2 and day 180 under different treatments |
与CK处理相比,所有PE-MP添加处理均显著改变了土壤的pH和DOC、NO3−-N、NH4+-N含量,但变化的方向和程度因PE-MP的粒径不同而表现出明显差异(图 3)。培养初期(第2天)仅mMP处理显著降低了土壤的pH,而其他处理对土壤pH无显著影响;培养结束(第180天)时,3种粒径PE-MP处理均显著降低了土壤pH,并且nMP处理的降低程度最大(图 3A)。对土壤DOC,培养初期,3种粒径PE-MP处理均对DOC含量无显著性影响,而在培养结束时DOC含量在mMP处理中显著提高,在nMP处理中显著降低,在μMP处理中则表现出无显著性变化(图 3B)。造成这一差异的原因可能源于两个方面:一是大粒径MPs可以通过刺激微生物活性增强土壤大分子有机质的分解,从而增加DOC的产生;二是小粒径MP(如nMPs)较大粒径MPs (如mMP)具有更大的比表面积较大,因而具有更强的吸附DOC的能力[3]。另外,3种粒径PE-MP处理均显著降低了培养初期和结束时的NH4+-N含量和培养初期的NO3−-N含量,而mMP和μMP处理显著降低了培养结束时的NO3−-N含量(图 3C、3D)。导致两种无机氮含量降低的潜在原因包括两个方面:首先,PE-MP表面含有的官能团(图 1)与无机氮之间发生吸附络合作用[18];其次,可能是通过上调硝化和反硝化功能基因的表达量,促进了NH4+-N和NO3−-N的转化[19]。
2.3 PE-MP对土壤微生物群落的影响经过180 d培养后,不同粒径PE-MP添加对细菌和真菌群落Alpha多样性指数(Chao1和Simpson指数)的影响如图 4所示。与CK处理相比,细菌群落的Chao1指数值在mMP处理中呈下降趋势,而在μMP和nMP处理中呈上升趋势(图 4A),而Simpson指数值在3个PE-MP处理中均呈上升的趋势(图 4B)。这表明大粒径PE-MP降低了细菌群落的丰富度,而小粒径的PE-MP则提高了细菌群落的丰富度,同时,所有粒径PE-MP添加均增加了细菌群落的多样性。因此,总体上,PE-MP的添加对细菌群落的活性和稳定性具有积极的作用。从真菌群落来看,与CK处理相比,Chao1和Simpson指数在3种粒径PE-MP处理中均有所下降(图 4C和图 4D)。这一结果表明,PE-MP暴露降低了真菌群落的物种丰富度和多样性,对真菌群落的活性和稳定性产生消极的作用,并且PE-MP的粒径越小,作用效果越明显。
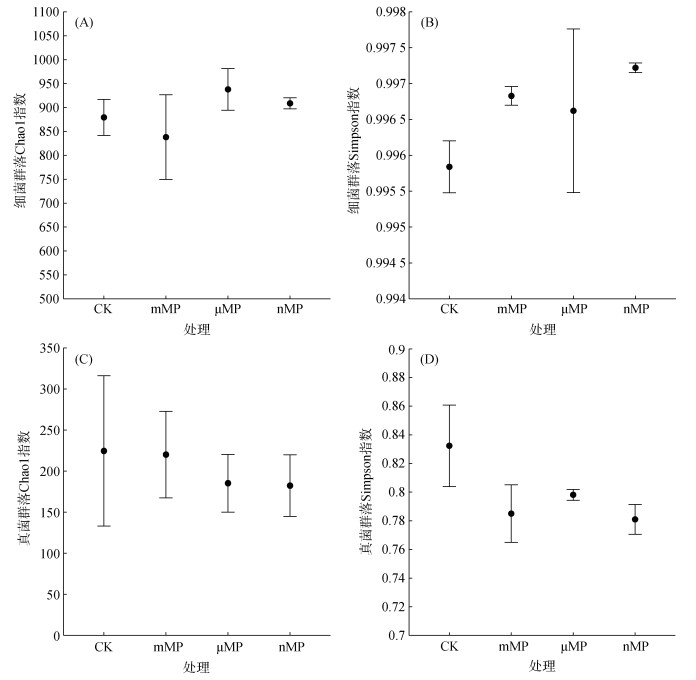
|
图 4 细菌(A和B)和真菌(C和D)群落的微生物多样性指数 Fig. 4 Microbial diversity indexes of bacterial (A and B) and fungal (C and D) communities |
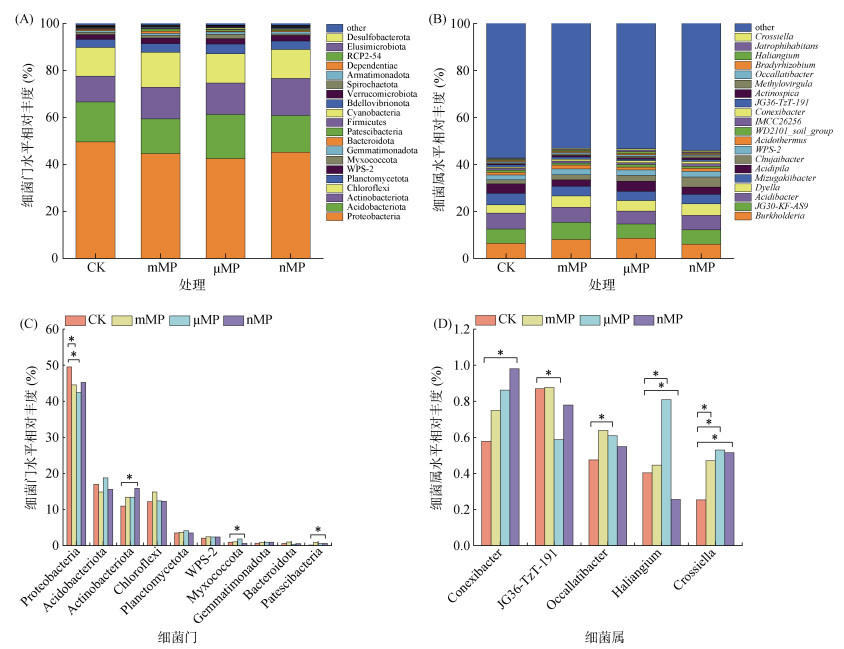
经过180 d培养后,不同粒径PE-MP添加对土壤细菌群落结构的影响如图 5所示。在门水平上,所有处理中的优势菌群均为Proteobacteria(变形菌门)、Acidobacteriota(酸杆菌门)、Actinobacteriota(放线菌门)、Chloroflexi(绿弯菌门)和Planctomycetota(浮霉菌门)(图 5A),但它们的相对丰度在不同处理中表现出明显的差异。与CK处理相比,mMP、μMP处理中的Proteobacteria相对丰度、nMP处理中的Myxococcota(粘细菌门)相对丰度显著下降;而nMP处理中的Actinobacteriota相对丰度显著提高(图 5B)。在属水平上,所有处理中前5位的优势种群依次为Burkholderia、JG30-KF-AS9、Acidibacter、Dyella和Mizugakiibacter(图 5C),但它们在不同处理之间没有显著性差异。相比之下,其他非优势种群的相对丰度变化明显。与CK处理相比,Crossiella的相对丰度在所有PE-MP处理中均显著提高;Haliangium的相对丰度在μMP处理中显著提高,而在nMP处理中显著下降;Occallatibacter的相对丰度在μMP处理中显著提高;Conexibacter的相对丰度在nMP处理中显著增加(图 5D)。
|
(图中*表示处理间差异在P < 0.05水平显著;下同) 图 5 细菌群落结构分析:门(A)和属(B)水平的细菌群落结构组成,及门(C)和属(D)水平上具有显著性变化的细菌种群 Fig. 5 Bacterial community structure analysis: structural compositions at phylum (A) and genus (B) levels, bacterial taxa with significant changes at phylum (C) and genus (D) levels |
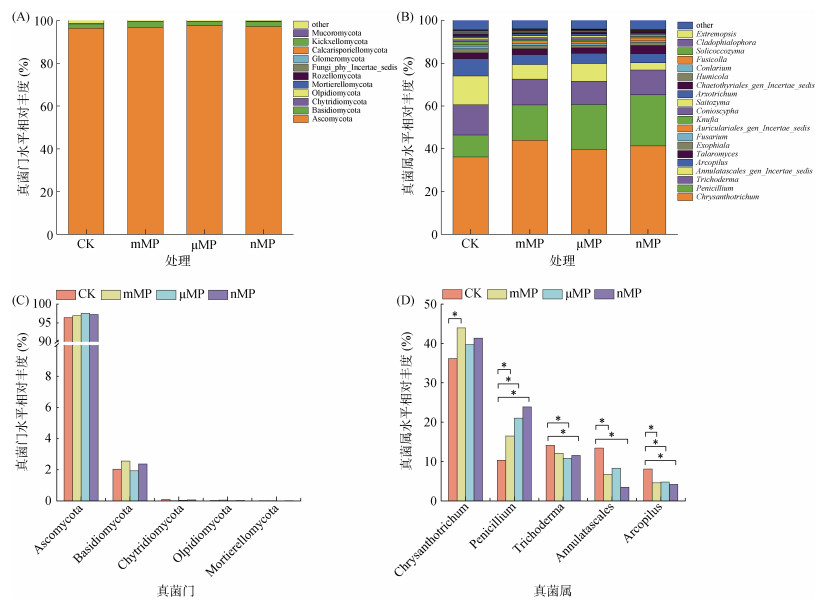
经过180 d培养后,不同粒径PE-MP添加对土壤真菌群落结构的影响如图 6所示。在门水平上,Ascomycota(子囊菌门)在所有处理中占绝对优势,其相对丰度达96.4% ~ 97.5%(图 6A),同时主要真菌菌门的相对丰度在不同处理间没有显著性变化(图 6C)。在真菌属水平上,排名前5位的优势真菌属分别为Chrysanthotrichum、Penicillium、Trichoderma、Annulatascales和Arcopilus(图 6B),这5种真菌均属于Ascomycota门。与CK处理相比,3种粒径PE-MP暴露均显著提高了Penicillium的相对丰度,而显著降低了Arcopilus的相对丰度;mMP暴露显著提高了Chrysanthotrichum的相对丰度,而显著降低了Annulatascales的相对丰度;μMP暴露显著降低了Trichoderma的相对丰度;nMP暴露显著降低了Trichoderma和Annulatascales的相对丰度(图 6D)。上述结果表明,PE-MP添加对微生物群落结构具有显著的影响,并且因粒径水平的不同,产生的影响也具有明显的差异。
|
图 6 真菌群落结构分析:门(A)和属(B)水平的真菌群落结构组成,及门(C)和属(D)水平上具有显著性变化的真菌种群 Fig. 6 Fungal community structure analysis. Structural compositions at phylum (A) and genus (B) levels, Fungal taxa with significant changes at phylum (C) and genus (D) levels |
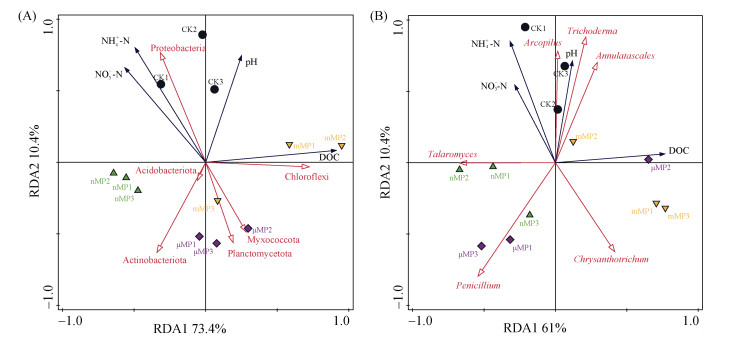
土壤微生物群落结构的变化与土壤化学性质的变化密切相关。由于细菌属水平和真菌门水平中主要物种的相对丰度在各处理之间差异不明显,因此,本文选择在细菌门水平和真菌属水平上进行主要微生物种群与土壤化学性质的RDA分析。RDA结果(图 7A)显示,细菌群落中Proteobacteria的相对丰度与NH4+-N和NO3−-N等无机氮源的含量呈显著正相关。因此,mMP和μMP处理显著降低土壤无机氮含量(图 3C和图 3D)可能是Proteobacteria相对丰度下降的潜在原因。同时,无机氮含量与Myxococcota相对丰度呈显著负相关,而Myxococcota也被证明有利用并消耗无机氮的能力[20]。mMP和μMP处理中较高的Myxococcota相对丰度与其较低的NH4+-N和NO3−-N含量一致。此外,Proteobacteria对pH的变化较为敏感,在酸性条件下不利于其生存[21]。本文的RDA结果也显示,Proteobacteria相对丰度与pH呈显著正相关关系,因此PE-MP添加导致土壤pH酸化程度进一步加剧,这也可能是导致Proteobacteria相对丰度降低的原因之一。此外,RDA结果还显示,Actinobacteriota相对丰度与pH呈显著的负相关关系,nMP处理中土壤pH降低程度最大(图 3A),因而使得其Actinobacteriota的相对丰度提高程度也最大(图 5C)。同时,RDA结果显示,Actinobacteriota的相对丰度与DOC含量之间存在显著负相关关系,表明该种细菌对不稳定碳源具有较强的消耗作用[22],这也可以用来解释为什么nMP处理中的DOC含量显著低于其他处理(图 3B)。另外,真菌群落的RDA分析(图 7B)显示,Annulatascale、Trichoderma和Arcopilus 3个真菌属相对丰度与土壤pH、NH4+-N和NO3−-N含量之间呈显著正相关关系。可见,PE-MP添加对土壤pH和无机氮含量的降低(图 3)是导致这3种真菌种群相对丰度降低的重要原因。相反,Penicillium和Chrysanthotrichum真菌属与pH、NH4+-N及NO3−-N含量之间呈显著负相关关系。
|
图 7 主要细菌(A)和真菌(B)种群的相对丰度与土壤化学性质之间的RDA分析 Fig. 7 RDA analysis between relative abundances of key bacterial (A) and fungal (B) populations with soil chemical properties |
本研究结果进一步证实PE-MP暴露能够显著改变农田土壤的物理、化学和微生物特性,这必然将进一步对土壤质量和养分循环产生直接或间接的影响。3种粒径PE-MP处理均对土壤团聚体稳定性表现出积极的促进效应,其中以μMP的效果更为显著(图 2)。喻晨[12]的研究发现,相较于大粒径PE-MP(0.55 mm),较小粒径的PE-MP(50 μm和6 μm)对土壤团聚体稳定性提高的程度更高,这与本研究的结果具有一致性。土壤团聚体稳定性的提高可能与PE-MP介导的土壤微生物群落变化密切相关。例如,3种PE-MP添加均提高了Actinobacteriota相对丰度(以nMP处理尤为显著,图 5C),而该细菌种群被认为有利于稳定大团聚体的形成[23]。土壤团聚体稳定性提高将有利于提高土壤结构的稳定性,有助于增强土壤的有机质、水分和养分等的保持能力[24]。因此,本研究结果表明,PE-MP添加诱导的土壤团聚体稳定性的改善可能会对土壤质量的提高具有积极的作用。
土壤pH是影响土壤质量(如酸化程度、养分循环和微生物活性等)的重要指标之一[25]。PE-MP暴露180 d后,土壤pH显著降低(图 3A)。土壤pH的进一步降低,导致土壤酸化程度加剧(如pH由CK处理的5.16下降全PE-MP处理的4.97 ~ 5.07),这将会降低土壤营养元素的有效性。例如,当pH < 6时,磷养分的有效性可能会随着pH的降低而降低[25],进而影响农作物生长。此外,PE-MP暴露180 d后,土壤NH4+-N和NO3−-N含量呈降低趋势,这意味着土壤中可利用性氮含量降低,进而可能会对微生物和植物生长带来养分限制。同时,值得注意的是,大粒径PE-MP对土壤无机氮含量的减少幅度更大,因而其可能对土壤的氮养分循环产生更大的影响。DOC在土壤养分的生物地球化学循环及土壤肥力的保持等过程中发挥着重要作用[26]。PE-MP暴露180 d后,nMP显著降低了DOC含量,而mMP则显著增加了DOC含量(图 3B),表明PE-MP的粒径越小对土壤DOC含量的负面影响效果越大。
PE-MP介导的土壤微生物活性和群落结构的变化在养分循环和固碳等方面起着至关重要的作用[20]。如Myxococcota种群具有较强的促进氮养分转化利用的作用[20],RDA的结果也显示Myxococcota相对丰度与无机氮含量呈显著负相关(图 7A)。因此,与mMP和μMP处理相比,nMP处理显著降低Myxococcota的相对丰度(图 5C),这意味着nMP暴露使得土壤的无机氮转化能力下降,这可能是nMP处理中无机氮含量高于mMP和μMP处理的(图 3C和图 3D)一个重要原因。此外,土壤细菌群落活性的增加通常会增强土壤有机碳的矿化,而真菌群落活性的抑制将削弱其固碳的功能[27]。因此,小粒径(尤其是纳米级)的PE-MP提高细菌群落的丰富度和多样性,而降低真菌群落的丰富度和多样性(图 4),将不利于土壤有机碳的固存。然而,从其他微生物种群的变化来看,PE-MP添加降低了Proteobacteria细菌门的相对丰度(图 5C),该种群是具有较强的分解不稳定有机碳(如DOC)能力的种群[28]。Proteobacteria相对丰度的降低可能与土壤团聚体稳定性的提高密切相关,因为后者的改善将增强对DOC的保护,降低其微生物的可利用性[29]。在真菌中,PE-MP暴露导致属水平上Penicillium的相对丰度提高,该真菌属与纤维素(较稳定有机碳)的分解密切相关[30]。上述特定微生物种群的变化将会对土壤有机碳的矿化产生重要影响。基于上述讨论,粒径大小对PE-MP介导的土壤微生物群落变化表现出重要的影响,进而导致土壤有机碳矿化在不同粒径的PE-MP间还存在很大的不确定性,需要在未来的研究中进一步阐明。
4 结论PE-MP在不同的粒径水平下对土壤物理(团聚体稳定性)、化学(DOC含量、pH、NH4+-N含量、NO3--N含量)和微生物(细菌和真菌)群落特性的影响表现出显著的差异。大粒径PE-MP(mMP)对DOC含量的提高效果以及对土壤无机氮(NH4+-N和NO3--N)含量的降低作用更为显著,而小粒径PE-MP(nMP)降低土壤pH以及DOC含量的潜力更大,中等粒径PE-MP(μMP)则对土壤团聚体稳定性表现出更高的改善效果。从土壤微生物群落变化来看,粒径大小对PE-MP介导的细菌和真菌微生物群落多样性、特定种群相对丰度的变化均表现出显著的影响,这将进一步影响PE-MP介导的土壤碳、氮等物质循环。鉴于不同粒径PE-MP添加的差异性结果,当对PE-MP的潜在环境风险进行评估时,需要建立综合的评价指标体系,充分考虑PE-MP在不同粒径水平下对各土壤特性的综合效应。
| [1] |
Ren S Y, Wang K, Zhang J R, et al. Potential sources and occurrence of macro-plastics and microplastics pollution in farmland soils: A typical case of China[J]. Critical Reviews in Environmental Science and Technology, 2024, 54(7): 533-556 DOI:10.1080/10643389.2023.2259275 (  0) 0) |
| [2] |
刘鑫蓓, 董旭晟, 解志红, 等. 土壤中微塑料的生态效应与生物降解[J]. 土壤学报, 2022, 59(2): 349-363 (  0) 0) |
| [3] |
陈锟. 微塑料对滨海湿地土壤有机碳矿化和温室气体排放的影响[D]. 青岛: 青岛大学, 2023.
(  0) 0) |
| [4] |
赵婷, 黄顺寅, 蔡怡敏, 等. 微塑料对抗生素污染土壤中氮素转化功能基因与抗生素抗性基因丰度的影响[J]. 土壤, 2023, 55(6): 1323-1328 DOI:10.13758/j.cnki.tr.2023.06.020 (  0) 0) |
| [5] |
Boots B, Russell C W, Green D S. Effects of microplastics in soil ecosystems: Above and below ground[J]. Environmental Science & Technology, 2019, 53(19): 11496-11506 (  0) 0) |
| [6] |
范萍. 微塑料对土壤溶解性有机质组成和结构的影响[D]. 南昌: 南昌大学, 2022.
(  0) 0) |
| [7] |
Yu H, Fan P, Hou J H, et al. Inhibitory effect of microplastics on soil extracellular enzymatic activities by changing soil properties and direct adsorption: An investigation at the aggregate-fraction level[J]. Environmental Pollution, 2020, 267: 115544 DOI:10.1016/j.envpol.2020.115544 (  0) 0) |
| [8] |
黄萌, 程思, 李嘉琪, 等. 聚苯乙烯微塑料对秀丽隐杆线虫取食偏好的影响[J]. 土壤, 2022, 54(1): 47-54 DOI:10.13758/j.cnki.tr.2022.01.007 (  0) 0) |
| [9] |
Ng E L, Lin S Y, Dungan A M, et al. Microplastic pollution alters forest soil microbiome[J]. Journal of Hazardous Materials, 2021, 409: 124606 DOI:10.1016/j.jhazmat.2020.124606 (  0) 0) |
| [10] |
Xu C Y, Zhang B B, Gu C J, et al. Are we underestimating the sources of microplastic pollution in terrestrial environment?[J]. Journal of Hazardous Materials, 2020, 400: 123228 DOI:10.1016/j.jhazmat.2020.123228 (  0) 0) |
| [11] |
王聪聪. 微塑料的典型旱作农田土壤污染特征及其对作物的毒性效应研究[D]. 沈阳: 沈阳大学, 2022.
(  0) 0) |
| [12] |
喻晨. 聚乙烯微塑料对豌豆生长及土壤特性的影响研究[D]. 西安: 西安理工大学, 2023.
(  0) 0) |
| [13] |
Gao B, Yao H Y, Li Y Y, et al. Microplastic addition alters the microbial community structure and stimulates soil carbon dioxide emissions in vegetable-growing soil[J]. Environmental Toxicology and Chemistry, 2021, 40(2): 352-365 (  0) 0) |
| [14] |
Wang F L, Wang X X, Song N N. Polyethylene microplastics increase cadmium uptake in lettuce (Lactuca sativa L.) by altering the soil microenvironment[J]. Science of The Total Environment, 2021, 784: 147133 (  0) 0) |
| [15] |
Zhang G S, Zhang F X. Variations in aggregate-associated organic carbon and polyester microfibers resulting from polyester microfibers addition in a clayey soil[J]. Environmental Pollution, 2020, 258: 113716 (  0) 0) |
| [16] |
王馨. 铁氧化物改性生物炭对滨海湿地土壤Pb-Cd复合污染修复及固碳机制的研究[D]. 青岛: 青岛大学, 2023.
(  0) 0) |
| [17] |
梁兰英. 紫外分光光度法测定土壤中的硝态氮[J]. 甘肃环境研究与监测, 2001(2): 80-81 (  0) 0) |
| [18] |
Xiang Y Z, Peñuelas J, Sardans J, et al. Effects of microplastics exposure on soil inorganic nitrogen: A comprehensive synthesis[J]. Journal of Hazardous Materials, 2023, 460: 132514 (  0) 0) |
| [19] |
苏品杰. 微塑料对土壤生物及碳氮循环的影响及潜在机制研究[D]. 沈阳: 辽宁大学, 2023.
(  0) 0) |
| [20] |
Liu H Y, Al-Dhabi N A, Jiang H L, et al. Toward nitrogen recovery: Co-cultivation of microalgae and bacteria enhances the production of high-value nitrogen-rich cyanophycin[J]. Water Research, 2024, 256: 121624 (  0) 0) |
| [21] |
Li B B, Roley S S, Duncan D S, et al. Long-term excess nitrogen fertilizer increases sensitivity of soil microbial community to seasonal change revealed by ecological network and metagenome analyses[J]. Soil Biology and Biochemistry, 2021, 160: 108349 (  0) 0) |
| [22] |
Ge Z, Li S Y, Bol R, et al. Differential long-term fertilization alters residue-derived labile organic carbon fractions and microbial community during straw residue decomposition[J]. Soil and Tillage Research, 2021, 213: 105120 (  0) 0) |
| [23] |
Zhang C, Zhao X, Liang A J, et al. Insight into the soil aggregate-mediated restoration mechanism of degraded black soil via biochar addition: Emphasizing the driving role of core microbial communities and nutrient cycling[J]. Environmental Research, 2023, 228: 115895 (  0) 0) |
| [24] |
冯雪莹, 孙玉焕, 张书武, 等. 微塑料对土壤-植物系统的生态效应[J]. 土壤学报, 2021, 58(2): 299-313 (  0) 0) |
| [25] |
Hartemink A E, Barrow N J. Soil pH-nutrient relationships: the diagram[J]. Plant and Soil, 2023, 486: 209-215 (  0) 0) |
| [26] |
Gmach M R, Cherubin M R, Kaiser K, et al. Processes that influence dissolved organic matter in the soil: A review[J]. Scientia Agricola, 2020, 77(3): e20180164 (  0) 0) |
| [27] |
Wang C, Wang X, Zhang Y, et al. Integrating microbial community properties, biomass and necromass to predict cropland soil organic carbon[J]. ISME Communications, 2023, 3(1): 86 (  0) 0) |
| [28] |
Liu S H, Kong F L, Li Y, et al. Mineral-ions modified biochars enhance the stability of soil aggregate and soil carbon sequestration in a coastal wetland soil[J]. Catena, 2020, 193: 104618 (  0) 0) |
| [29] |
朱孟涛, 刘秀霞, 王佳盟, 等. 生物质炭对水稻土团聚体微生物多样性的影响[J]. 生态学报, 2020, 40(5): 1505-1516 (  0) 0) |
| [30] |
Wang H Y, Fan B Q, Hu Q X, et al. Effect of inoculation with Penicillium expansum on the microbial community and maturity of compost[J]. Bioresource Technology, 2011, 102: 11189-11193 (  0) 0) |
 2025, Vol. 57
2025, Vol. 57


