3. 中向旭曜科技有限公司, 江苏江阴 214400;
4. 农业农村部耕地质量监测保护中心, 北京 100125
近年来,我国设施蔬菜的种植面积逐年扩大[1]。但由于种植过程中不合理的温度控制、施肥、种植管理,致使土壤理化性质恶化、微生物群落比例失衡,从而产生土传病害[2–4]。青枯病、根腐病、根结线虫病等是设施蔬菜种植过程中易发生的主要土传病害[3],它们对蔬菜的生长发育和产量造成了不可忽视的影响。在设施环境下,土传病害的传播迅速,发病速度较快,一旦爆发,往往带来严重的经济损失。
目前,解决设施蔬菜土传病害的方法主要包括化学防治、生物防治和土壤改良等多种手段[5]。化学防治主要是通过化学熏蒸剂对土壤病害微生物和原生动物进行灭除,主要的化学熏蒸剂有二甲基二硫、异硫氰酸烯丙酯等[5–7]。化学防治虽然在短时间内能够显著抑制病害的发生,但长期使用容易导致土壤环境的恶化,对生态系统造成潜在危害[8]。生物防治由于对环境友好的特点逐渐受到重视,通过接种生物制剂促进植物根际免疫,但效果受多种因素制约,仍需进一步完善[9-10]。而土壤改良作为一种可持续的防治手段,通过施加土壤改良剂,如秸秆、有机肥、生物质炭等,以此改善土壤结构及理化性质、调节土壤微生物群落结构、促进土壤微生物活性[11–14],为蔬菜提供良好的生长环境,减缓土传病害的发生。而生物质炭老化使其理化性质和结构发生改变,作为外源有机物料其改良效果不持久[15-16];有机肥中大量腐殖化程度较低的有机碳[17],易导致病原菌的大量繁殖。天然腐殖质材料作为一种新型土壤改良剂,其具有富含腐殖酸和惰性有机碳,且降解周期长等特点,主要分布在热带和温带地区,是提升土壤有机质的重要材料[17-18]。其在改善土壤物理结构、调控微生物群落比例方面具有较大潜力,但其对设施菜地土壤退化问题的改良效果尚不清楚。
本研究通过探究天然腐殖质材料对设施菜地土壤结构、理化性质及根际细菌组成的影响,并挖掘对土传病害发生具有潜在影响的根际促生微生物,旨在系统评估天然腐殖质材料在设施蔬菜土传病害防治中的效果和可行性,为我国设施蔬菜产业的可持续发展提供科学依据和技术支持。
1 材料与方法 1.1 试验区概况田间试验位于安徽省铜陵市天门村(30°50′60″N,117°52′36″E),该地属于北亚热带湿润季风气候,全年温暖湿润,雨量充沛。年均温18 ℃,年均降水量1 333.2 mm。土壤类型为江泥砂土,属灰潮土亚类灰潮黏土土属。试验地常年种植铜陵白姜,试验开始前土壤基本理化性质为:pH 6.01,有机质(SOM)含量8.48 g/kg,土壤容重(BD)1.41 g/cm3。
1.2 田间试验设计试验于2022年3月开始,共设置3个处理:①不施用有机物料对照(CK);②施用天然腐殖质材料(MT);③施用有机肥(OF)。每个处理3个重复,共9个小区,随机区组设计,每个小区面积为100 m2,长20 m,宽5 m。
天然腐殖质材料购自中向旭曜科技有限公司,有机碳含量为428.62 g/kg,总氮(TN)、总磷(TP)和总钾(TK)含量为0.08、0.04、0.39 g/kg;有机肥为当地腐熟秸秆,有机碳含量为153.82 g/kg,TN、TP和TK含量为0.38、14.24、10.63 g/kg。天然腐殖质材料和有机肥在起垄种植前通过旋耕机翻入土壤,用量均为15 000 kg/hm2,同时按照60 kg/hm2施用复合肥(N∶P∶K=17∶17∶17)。生姜品种为铜陵白姜,株距10.52 cm,种植密度为6万棵/hm2。
1.3 样品采集与土壤理化性质测定2023年9月生姜成熟后,采收各小区整株生姜,用5点取样法对每个小区进行测产,并计算各处理生姜产量均值。采收过程中同步采集生姜根际土壤样品:抖落生姜根部松散的土壤,留下约1~3 mm的土壤附着在根部,将植物根系置于磷酸盐缓冲液(PBS)中,涡旋振荡15 s,重复两次,并混合土壤悬浮液;土壤悬浊液用100 μm的尼龙网过滤,去除植物碎片和大型沉积物;将过滤后的土壤悬浊液离心后弃上清液,收集沉淀作为根际土壤用于提取土壤DNA。同时采集生姜样本根系附近的耕层土壤,并进行风干、过筛,用于测定土壤pH、物理结构及全量和速效养分含量。
青枯病发病情况统计:记录发病情况直至病情稳定,选取最后一次记录表征生姜发病率。病情指数计算公式:病情指数(%)=小区发病植株数/小区总植株数×100。
土壤理化性质及养分测定参照NY/T 1121.19—2006《土壤检测第19部分:土壤水稳性大团聚体组成的测定》、NY/T 1121.2—2006《土壤检测第2部分:土壤pH的测定》、HJ 802—2016《土壤电导率的测定电极法》、NY/T 1121.6—2006《土壤检测第6部分:土壤有机质的测定》、NY/T 1121.8—2006《土壤检测第8部分:土壤有效磷的测定》、NY/T 889—2004 《土壤速效钾和缓效钾含量的测定》。
1.4 细菌16S rRNA基因扩增子测序将采集到的生姜根际土样用Fast®DNA Spin Kit for Soil(MP Biomedicals, LLC, Ohio, USA)试剂盒提取土壤样品DNA,构建细菌16S rRNA基因库。使用Nanodrop™2000分光光度计(NanoDrop Technologies Inc., Wilmington, DE, USA)测量DNA纯度和浓度,确保所提取DNA的浓度均在40 ng/µL以上。将分离获得的DNA保存于20 ℃,用于后续基因分析。选用细菌16S rRNA进行高通量测序,测序前引物为338F:ACTCCTACGGGAGGCAGCA,后引物为806R:GGACTACHVGGGTWTCTAAT,在NovaSeq6000平台(Illumina, Inc., SanDiego, CA, USA)上进行DNA测序。
采用QIIME2软件进行序列处理,使用cutadapt插件去除引物序列,通过dada2 denoise-paired插件对去重复后的序列进行低质量控制、去除嵌合体序列并生成特征序列表。将序列聚类为扩增子序列变体(Amplicon sequence variants,ASVs),可以认为是100% 相似度聚类的操作分类单元(OTUs)。Naïve-Bayes分类器从GreenGenes2中下载数据库训练,使用q2-feature classifier插件将序列和物种注释匹配。
1.5 数据统计分析使用SPSS 25.0对土壤理化指标进行单因素方差分析(ANOVA),并使用Duncan多重比较分析生姜病情指数和土壤理化性质在不同处理间的差异。利用R 4.3进行土壤理化性质和养分含量的主成分分析(Principal component analysis, PCA)。运用置换多元方差分析(Permutational multivariate analysis of variance, PERMANOVA)评估不同处理间细菌群落结构的异同。
利用Spearman相关性矩阵和Mantel检验评估土壤微生物与环境因子和病情指数的相关性,并建立各处理土壤相关生境细菌共生网络(基于6个样本构建),采用Holm方法对P值进行矫正,仅保留P<0.05和r>0.6的相关性。R包“igraph”用于生成网络对象并计算网络参数。软件“Gephi”用于细菌共生网络的可视化。
在R 4.3的“DESeq2”包中进行模块中优势物种的差异分析,通过log2 fold change>1.0和log2 fold change<-1.0分别鉴定增加的和减少的ASVs。微生物丰度与生姜青枯病病情指数的相关性用Mantel检验。
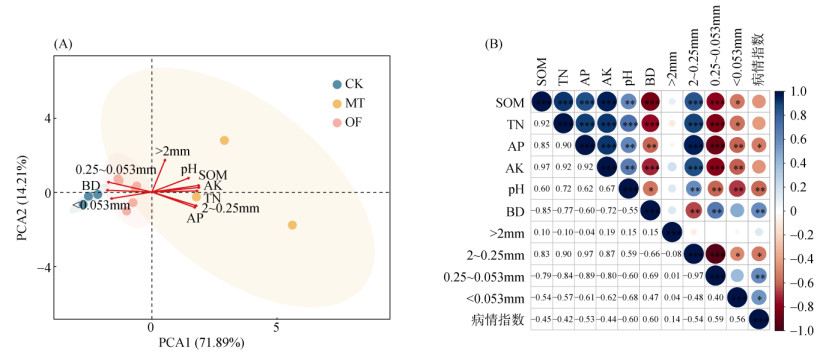
2 结果 2.1 土壤理化性质及养分含量基于土壤理化性质和养分含量的PCA前两轴解释度达到86.10%,其中主成分一解释度达到71.89%,能够较好解释其差异,有机质、全氮、有效磷、速效钾、土壤pH指标间呈正相关关系,与容重、<2 mm水稳性团聚体呈负相关关系(图 1A)。施用天然腐殖质材料对设施蔬菜土壤的理化性质和养分状况影响显著(表 1)。天然腐殖质材料显著改变了土壤物理结构,与CK相比,MT处理的容重为1.16 g/cm3,降低了14.1%,而OF处理无显著变化。同时天然腐殖质材料的施用能够显著提高土壤大团聚体含量,并显著降低小团聚体的含量。与CK处理相比,MT处理中>2 mm团聚体含量提高到8%,上升了56.8%;2~0.25 mm团聚体含量显著提高了59.6%,含量达52.67%;而0.25~0.053 mm、<0.053 mm团聚体则分别降低了37.09%、35%,有效地改善了土壤物理结构。OF处理对土壤团聚体含量无显著影响。天然腐殖质材料和有机肥处理均能够显著提高土壤的养分库容,与CK处理相比,MT处理有机质、全氮、有效磷、速效钾均显著提高,OF处理土壤有机质、全氮、速效钾含量显著提高,且MT处理土壤养分指标含量均显著高于OF处理。此外,与CK处理相比,MT处理显著提升了土壤pH(表 1)。
|
(图中*、**、***表示相关性达 P<0.05、P<0.01 和 P<0.001 显著水平) 图 1 基于土壤理化性质的PCA分析(A)和土壤理化性质与病情指数的相关性分析(B) Fig. 1 PCA analysis based on soil physicochemical properties(A)and correlation analysis between soil physicochemical properties and disease index (B) |
|
|
表 1 天然腐殖质材料对设施姜地土壤理化性质的影响 Table 1 Effects of natural humic materials on soil physicochemical properties of facility ginger |
为了探究土壤理化性质对生姜青枯病病情指数的影响,通过相关性分析发现:生姜青枯病病情指数与土壤有机质、全氮、有效磷、速效钾、pH、2~0.25 mm团聚体呈显著负相关关系,与土壤容重、<0.25 mm团聚体呈正相关关系,与>2 mm团聚体无显著相关性(图 1B)。
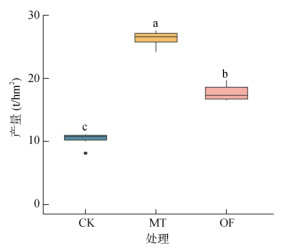
2.2 生姜产量生姜产量如图 2所示,与CK处理相比,施用有机物料处理(MT、OF)能显著提升生姜产量。其中MT处理的增产效果优于OF处理,与CK相比,MT处理的生姜产量显著提高了155.0%,而OF处理产量增加了71.9%;MT处理相比OF处理增产48.3%。
|
(图中小写字母不同表示处理间差异显著(P<0.05);箱体中间线代表数据的中位数,箱体的上下底边分别代表数据的上四分位数和下四分位数,上下边缘代表最大值和最小值。下图同) 图 2 外源有机物料对生姜产量的影响 Fig. 2 Effects of exogenous organic materials on ginger yield |
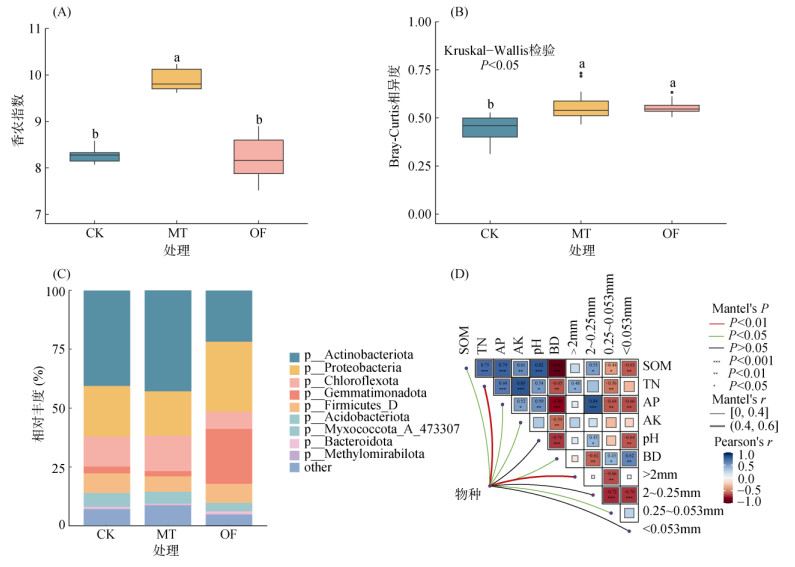
与CK处理相比,MT处理显著提高了土壤细菌群落的α、β多样性,这表明天然腐殖质材料增加了土壤细菌的物种丰富度且显著改变了土壤细菌群落组成;OF处理对土壤细菌群落α多样性无显著影响,显著提高了土壤β多样性(图 3A、3B)。各处理细菌门水平相对丰度如图 3C所示,其中丰度最高的5种菌分别为:放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexota)、芽单胞菌门(Gemmatimonadata)、厚壁菌门(Fimicutes_D),共占细菌总丰度的87.7%~90.6%。
|
图 3 土壤微生物香农指数(A)、β多样性指数(B)、门水平相对丰度(C)以及微生物与土壤理化性质的相关性(D) Fig. 3 Shannon index (A), β diversity index (B), relative abundance at the phylum level (C) of soil microbes, and correlation between microbia and soil physicochemical properties (D) |
土壤细菌群落受土壤理化性质的影响显著,有机质、全氮、有效磷、速效钾、容重、水稳性团聚体含量(>2 mm、0.25~0.053 mm)均能显著影响土壤细菌群落组成,其中全氮、>2 mm水稳性团聚体含量与细菌群落的相关性最强(0.4<r≤0.6)。土壤pH,2~0.25 mm、<0.053 mm水稳性团聚体含量对土壤细菌群落无显著影响(图 3D)。
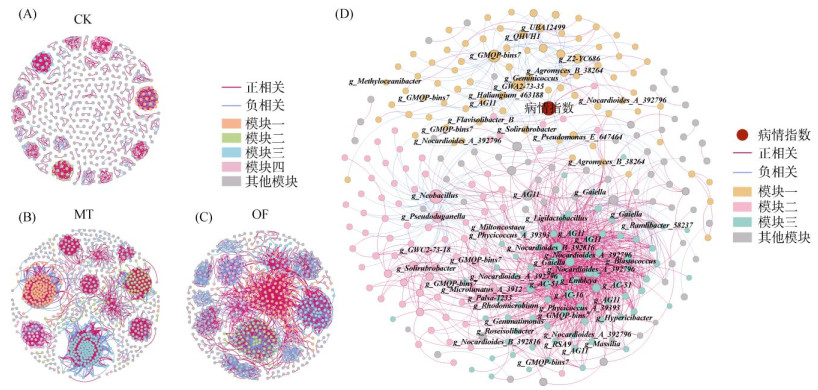
2.4 细菌共现网络为了明确土壤细菌群落中各个菌属之间的相关关系,利用“Spearman”相关关系构建了各处理细菌共现网络(图 4A~ 4C)。天然腐殖质材料加强了土壤中细菌的相互作用,促进了细菌之间的相互关联。与CK相比,MT的网络有着较高的网络平均度(表 2),表明MT处理的土壤微生物网络更复杂,呈现出更强的连通性和交互性,其中介数中心数最高的是厚壁菌门Clostridium_J菌属;而CK处理的网络较为稀疏,网络平均度最低,表明其土壤细菌之间的相互作用较弱,彼此之间倾向于独自生存而不是相互协作(图 4,表 2)。
|
图 4 细菌共现网络(CK (A),MT(B),OF (C))以及细菌与病情指数网络(D) Fig. 4 Bacterial co-occurrence networks(CK (A)), MT(B), OF (C)) and network diagram of bacterial co-occurrence with disease indices(D) |
|
|
表 2 细菌共现网络拓扑参数 Table 2 Topology parameters of bacterial co-occurrence networks |
从模块来看,CK处理的网络模块小且多,前4个模块共占比13.10%,这表明CK处理中细菌之间相互作用小,网络稳定性差,较难抵抗病害(图 4A)。MT处理前4个模块占比达56.60%,其中模块一占比达到23.10%,主要包含了Niastella、Pseudomonas、Nitrospira等参与土壤营养循环、促进有机物分解的细菌属,能够促进植物生长,提高植物对病害的抵抗能力;模块之间相互作用较少,模块二与模块三之间的相互作用以负相关关系为主(图 4B)。OF处理呈现出与MT处理相似的结构,前4个模块占比达46.05%,模块一占比达到17.94%,模块之间的相互作用较为复杂(图 4C)。
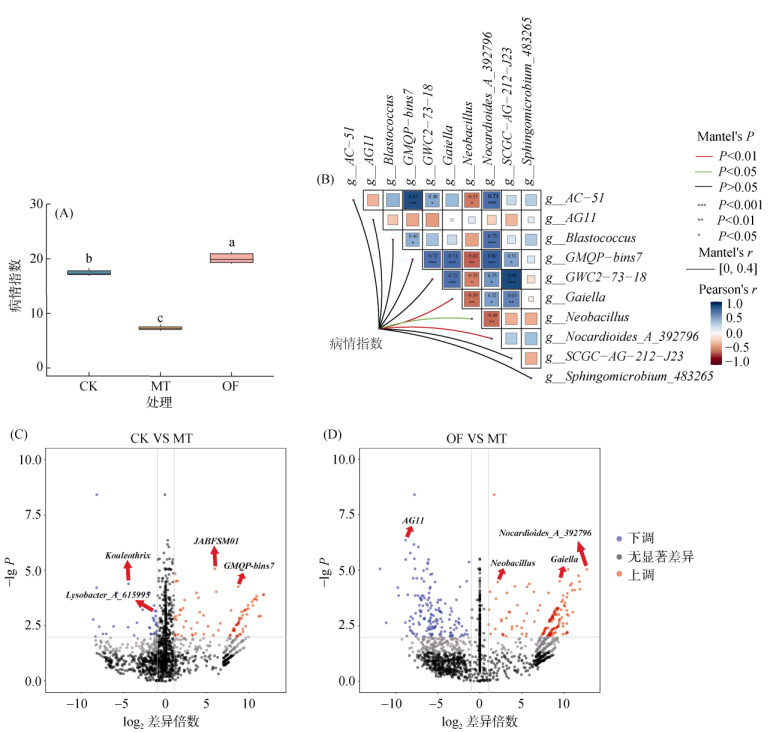
图 4D是土壤细菌与病情指数的共现网络,通过共现网络能够更直观地发现影响生姜病情指数的土壤菌群。整个网络主要分为三大模块,共占比77.55%,模块一占比27.39%,其中主要包含GMQP-bins7、AG11等菌属,这些菌属在模块中起到重要的关联作用,与模块内的其余菌属紧密联系,主要为负相关关系;模块二中菌属关系较为复杂,Neobacillus、Pseudoduganella、Ligilactobacillus等重要菌属在模块中与其余菌属呈负相关关系,与其余模块关联较少,而Solirubrobacter、Jiangella等菌属在模块中与其余菌属呈正相关关系,且与模块三之间主要以正相关关系为主;在模块三中,Nocardioides_A_392796、AC-51、Gaiella等菌属在模块中占重要地位,模块内菌属之间关系主要为正相关,且与其余模块的联接以正相关关系为主,这三大模块共同构成了土壤菌群之间的关系。在网络图中,与病情指数相互关联的菌属较少,Peribacillus_31373、Gaiella、AG11是与其直接关联的菌属,病情指数与Gaiella和AG11菌属呈负相关关系,这表明该两种菌属对病情指数起到抑制作用;与Peribacillus_31373菌属呈正相关关系,表明其对病情指数起促进作用。其余与病情指数相关联的细菌主要为Proteobacteria门的细菌,Neobacillus、Nocardioides_B_392816等在网络起重要作用的细菌通过影响这些Proteobacteria门的细菌来间接影响生姜病情指数。
2.5 细菌群落对生姜青枯病的影响天然腐殖质材料对生姜青枯病具有较好的缓解作用,施用天然腐殖质材料后,生姜青枯病病情指数显著下降,而有机肥处理生姜青枯病病情指数显著上升(图 5A)。为了探究天然腐殖质材料与有机肥处理中对病情指数造成影响的主要土壤菌属,对各处理进行差异分析。结果表明:与CK相比,MT处理中JABFSM01和GMQP-bins7属的细菌显著上调,Kouleothrix和Lysobacter_A_615995属的细菌显著下调;与OF相比,MT处理中AG11属的细菌显著下调,而Nocardioides_A_392796、Gaiella和Neobacillus属的细菌显著上调(图 5C、5D)。
|
图 5 不同处理对生姜青枯病病情指数的影响(A),细菌属水平群落相关性及对生姜青枯病的影响(B),CK和MT处理间微生物差异分析(C)以及OF和MT处理间微生物差异分析(D) Fig. 5 Disease index of ginger bacterial wilt under different treatments(A), correlation at bacterial genus level and its impact on ginger bacterial wilt(B), and microbial differences between CK and MT(C) and between OF and MT(D) |
为了探究细菌群落与生姜青枯病的关系,进行相关性分析,其中细菌群落中前十的属水平优势细菌与生姜青枯病病情指数的相关性如图 5B所示,Nocardioides_A_392796、Neobacillus和Gaiella属与众多优势菌群有紧密联系,其中Nocardioides_A_392796和Gaiella细菌与其余细菌主要呈正相关关系,具有相互促进作用;而Neobacillus细菌与优势细菌主要呈负相关关系,具有抑制作用。青枯病病情指数与细菌群落属水平优势细菌的Mantel检验表明:Nocardioides_A_392796、Gaiella及Neobacillus细菌与病情指数均呈显著负相关(图 5B,表 3)。
|
|
表 3 优势细菌属和差异物种与生姜青枯病病情指数相关性 Table 3 Correlations between dominant and differential species with disease index of ginger bacterial wilt |
天然腐殖质材料施入后转化形成的土壤有机质能够作为重要的胶结物质,促进团聚体的形成和腐殖质向颗粒态、闭蓄态和有机无机结合态转变,促进土壤良好团聚结构的形成[17]。本研究中土壤为砂姜黑土,黏粒含量较高,土壤质地黏重,小团聚体含量较高,天然腐殖质材料的施用显著提高了大团聚体含量,显著降低了小团聚体的含量,而有机肥处理对土壤物理结构的影响不显著(表 1)。天然腐殖质材料显著降低了土壤容重,这是因为天然腐殖质材料是疏松多孔的介质[17],并且天然腐殖质材料的施用能够促进大团聚体的形成,从而降低土壤容重[19]。此外,天然腐殖质材料的施用显著提高了土壤pH,与CK相比,MT处理pH提高到6.93,这可能是由于天然腐殖质材料中含有大量羟基等官能团[17, 20]导致的,大量的羟基官能团能够中和土壤溶液中的H+,从而缓慢降低土壤酸性。
天然腐殖质材料的施用能够显著改善土壤养分状况,提高土壤养分库容。与CK处理相比,MT和OF处理的土壤有机质、全氮、有效磷、速效钾含量显著提高,而MT处理的土壤养分含量又显著高于OF处理。大量研究表明,外源有机物料的施用能够显著提高土壤有机质、全氮等养分含量[21-22]。本研究中的天然腐殖质材料腐殖化程度、品质和稳定性较高,难以被细菌降解,能够显著提高土壤中的惰性有机碳,而有机肥腐殖质的分子和颗粒排列更为疏松,表面活性较高,施用后易被土壤中的细菌分解[17]。因此,有机肥处理的有机质含量提升效果不如天然腐殖质材料。
土壤理化性质中有机质、全氮、有效磷、速效钾、pH、2~0.25 mm水稳性团聚体与生姜青枯病病情指数呈显著负相关关系,表明提高土壤养分含量能够抑制生姜青枯病发生,这可能是由于土壤养分含量的升高能够改变土壤微生物群落结构,促进共生细菌的生长,激活植物先天免疫来抵抗病原菌的侵染[23-24]。而生姜青枯病病情指数与土壤容重、<0.25 mm水稳性团聚体呈正相关关系,这可能是由于随着土壤紧实度增加,孔隙度减小,抑制了植物的侧根生长,改变了根系结构[25],降低了作物对病害的抵抗能力。
3.2 土壤理化性质对土壤细菌群落组成的影响施用天然腐殖质材料显著提高了土壤微生物的α和β多样性指数,降低了变形菌门(Proteobacteria)和厚壁菌门(Fimicutes_D)的丰度,提高了放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexota)和芽单胞菌门(Gemmatimonadata)的丰度,改变了土壤细菌的微生物组成。这与先前研究一致,土壤中变形菌门、放线菌门是最丰富的细菌门,施用天然腐殖质材料后能够提升土壤中富养型细菌的丰度,帮助土壤积累有机质[26–28]
本研究中,土壤有机质、有效磷、速效钾、全氮、容重、0.25~0.053 mm水稳性团聚体含量均对土壤细菌群落组成有显著影响。研究表明,土壤有机质、有效磷、全氮、速效钾是影响土壤微生物群落结构的关键性因素[11, 29-30],通过增强土壤肥力可以为微生物提供更富营养的环境,从而促进异养型微生物的生长,提高异养型微生物的群落丰度,增加微生物多样性。杨继芬等[31]研究发现小团聚体中的碱解氮含量升高,改变了优势菌的相对丰度和多样性,这可能是因为容重和不同粒径团聚体组分影响了土壤的通气状况、水分和孔隙,改变了不同粒径团聚体中的养分情况,影响土壤中微生物与环境的物质与能量交换,进而影响细菌群落[32]。
细菌共现网络结果表明,MT处理的网络密度和网络平均度均高于CK处理,且其网络结构和功能稳定性都更强,这说明天然腐殖质材料能够通过促进土壤细菌之间的相互作用,保持土壤中各菌群功能的稳定,从而降低生姜青枯病病情发病程度。且在MT处理中介数中心最高的门为厚壁菌门(Fimicutes_A),而不是丰度最高的放线菌门(Actinobacteriota),这表明核心微生物的形成并不完全取决于它们的相对丰度,也可能受到网络中其他微生物因素和环境因素的影响[33]。此外,天然腐殖质材料提高了土壤细菌网络模块多样性,进而能够促进土壤细菌的多功能性,模块的多样性同样也能够提高土壤微生物群落的生态稳定性,多模块易产生功能冗余,使得土壤微生物群落具有重叠的功能,进而提高对病害的抵抗能力[34-35]。
3.3 土壤细菌群落组成对生姜青枯病的影响天然腐殖质材料能够显著缓解生姜青枯病发病情况,通过微生物与病情指数相关性分析发现,Nocardioides_A_392796、Gaiella和Neobacillus细菌与病情指数呈显著负相关,这与先前的研究[36]一致。Nocardioides_A_392796和Gaiella细菌均属于放线菌门,病情指数的降低可能与放线菌释放抗生素导致的拮抗作用或放线菌和细菌病原体之间的生态位重叠有关[37-38];Neobacillus菌属于芽孢杆菌,Yang等[39]发现,在有多个碳源情况下,解淀粉芽孢杆菌能够快速生长并分泌抗生素从而抑制青枯菌的繁殖。通过上述研究发现,天然腐殖质材料通过调节土壤中的放线菌门和芽孢杆菌门细菌的丰度,进而抑制土壤中病原菌的繁殖,以此来控制生姜青枯病的发生程度。
4 结论天然腐殖质材料能够显著改善土壤结构,降低土壤容重、促进土壤大团聚体形成;并能扩充土壤养分库容,显著提高土壤有机质、养分有效性,提高土壤pH,显著提高生姜产量。生姜青枯病病情指数与土壤养分和2~0.25 mm水稳性团聚体含量呈负相关关系。施用天然腐殖质材料明显提高了土壤细菌群落的α和β多样性,这些细菌群落的变化主要受土壤全氮和0.25~0.053 mm水稳性团聚体的驱动。此外,细菌共现网络的研究发现,天然腐殖质材料有助于促进土壤中细菌之间的相互作用,从而增强细菌网络的结构和功能的稳定性,促进网络模块的形成,这些模块在土壤中扮演着重要角色。因此,天然腐殖质材料通过影响土壤养分指标、2~0.25 mm水稳性团聚体含量以及土壤中的关键菌属(Nocardioides_A_392796、Gaiella和Neobacillus)的丰度,显著减轻了生姜青枯病的发病情况。
| [1] |
袁为海. 我国现代设施农业发展现状与方向[J]. 中国农村科技, 2023(6): 18-21 DOI:10.3969/j.issn.1005-9768.2023.06.005 (  0) 0) |
| [2] |
李建明. 我国蔬菜设施结构现状、问题与建议[J]. 中国蔬菜, 2023(11): 1-8 (  0) 0) |
| [3] |
曹坳程, 刘晓漫, 郭美霞, 等. 作物土传病害的危害及防治技术[J]. 植物保护, 2017, 43(2): 6-16 DOI:10.3969/j.issn.0529-1542.2017.02.002 (  0) 0) |
| [4] |
邱伟. 设施蔬菜土壤退化问题分析及改良利用技术探讨[J]. 农业工程技术, 2021, 41(4): 70-72 (  0) 0) |
| [5] |
曹坳程, 张大琪, 方文生, 等. 土传病害防治技术进展及面临的挑战[J]. 植物保护, 2023, 49(5): 260-269 (  0) 0) |
| [6] |
范怀峰. 山东番茄土传病害调查与化学防治技术研究[D]. 泰安: 山东农业大学, 2014.
(  0) 0) |
| [7] |
Zhang Y, Fang W S, Yan D D, et al. Comparison of drip-irrigated or injected allyl isothiocyanate against key soil-borne pathogens and weeds[J]. Pest Management Science, 2023, 79(10): 3860-3870 DOI:10.1002/ps.7590 (  0) 0) |
| [8] |
Sennett L B, Goyer C, Burton D L, et al. Chemical fumigation combined with soil amendments of contrasting carbon availability alters soil bacterial and fungal community diversity[J]. Applied Soil Ecology, 2023, 188: 104858 DOI:10.1016/j.apsoil.2023.104858 (  0) 0) |
| [9] |
Luo M, Chen Y, Huang Q R, et al. Trichoderma koningiopsis Tk905: An efficient biocontrol, induced resistance agent against banana Fusarium wilt disease and a potential plant-growth-promoting fungus[J]. Frontiers in Microbiology, 2023, 14: 1301062 DOI:10.3389/fmicb.2023.1301062 (  0) 0) |
| [10] |
Tian L B, Zhang W L, Zhou G D, et al. A biological product of Bacillus amyloliquefaciens QST713 strain for promoting banana plant growth and modifying rhizosphere soil microbial diversity and community composition[J]. Frontiers in Microbiology, 2023, 14: 1216018 DOI:10.3389/fmicb.2023.1216018 (  0) 0) |
| [11] |
周谈坛, 李丹丹, 邱丽丽, 等 . 不同配施比例下秸秆和木本泥炭对快速提升土壤有机质和作物产量的耦合影响[J]. 土壤学报, 2023, 60(6): 1699-1711 (  0) 0) |
| [12] |
申云鑫, 施竹凤, 唐加菜, 等. 有机物料输入对作物土传病害防控作用的Meta分析[J]. 植物营养与肥料学报, 2023, 29(8): 1495-1506 (  0) 0) |
| [13] |
杨天杰, 王玉鑫, 王佳宁, 等. 不同基质生物有机肥防控番茄土传青枯病及促生效果研究[J]. 土壤, 2021, 53(5): 961-968 DOI:10.13758/j.cnki.tr.2021.05.010 (  0) 0) |
| [14] |
王晓娟, 贾志宽, 梁连友, 等. 旱地施有机肥对土壤有机质和水稳性团聚体的影响[J]. 应用生态学报, 2012, 23(1): 159-165 (  0) 0) |
| [15] |
Liu L, Yuan M, Wang X R, et al. Biochar aging: Properties, mechanisms, and environmental benefits for adsorption of metolachlor in soil[J]. Environmental Technology & Innovation, 2021, 24: 101841 (  0) 0) |
| [16] |
Rahim H U, Allevato E, Radicetti E, et al. Research trend of aging biochar for agro-environmental applications: A bibliometric data analysis and visualization of the last decade (2011–2023)[J]. Journal of Soil Science and Plant Nutrition, 2023, 23(4): 4843-4855 DOI:10.1007/s42729-023-01456-4 (  0) 0) |
| [17] |
郑延云, 张佳宝, 谭钧, 等. 不同来源腐殖质的化学组成与结构特征研究[J]. 土壤学报, 2019, 56(2): 386-397 (  0) 0) |
| [18] |
王忠强, 张心昱, 孟宪民, 等. 泥炭形成过程对泥炭基质替代物研究的启示[J]. 自然资源学报, 2012, 27(7): 1252-1258 (  0) 0) |
| [19] |
付威, 雍晨旭, 马东豪, 等. 黄土丘陵沟壑区治沟造地土壤快速培肥效应[J]. 农业工程学报, 2019, 35(21): 252-261 (  0) 0) |
| [20] |
席改红, 石国荣, 李强, 等. 木本泥炭对Cr(Ⅵ)的吸附性能[J]. 环境化学, 2019, 38(1): 202-208 (  0) 0) |
| [21] |
陈美淇, 马垒, 赵炳梓, 等. 木本泥炭对红黄壤性水田土壤有机质提升和细菌群落组成的影响[J]. 土壤, 2020, 52(2): 279-286 DOI:10.13758/j.cnki.tr.2020.02.008 (  0) 0) |
| [22] |
王孝芳, 梅新兰, 黄大鹏, 等. 生物质炭载体联合有益菌防控番茄土传青枯病的效果研究[J]. 土壤学报, 2022, 59(2): 536-544 (  0) 0) |
| [23] |
Ma K W, Niu Y L, Jia Y, et al. Coordination of microbe-host homeostasis by crosstalk with plant innate immunity[J]. Nature Plants, 2021, 7(6): 814-825 DOI:10.1038/s41477-021-00920-2 (  0) 0) |
| [24] |
Castrillo G, Teixeira P J P L, Paredes S H, et al. Root microbiota drive direct integration of phosphate stress and immunity[J]. Nature, 2017, 543(7646): 513-518 DOI:10.1038/nature21417 (  0) 0) |
| [25] |
Correa J, Postma J A, Watt M, et al. Soil compaction and the architectural plasticity of root systems[J]. Journal of Experimental Botany, 2019, 70(21): 6019-6034 DOI:10.1093/jxb/erz383 (  0) 0) |
| [26] |
赵文慧, 马垒, 徐基胜, 等. 秸秆与木本泥炭短期施用对潮土有机质及微生物群落组成和功能的影响[J]. 土壤学报, 2020, 57(1): 153-164 (  0) 0) |
| [27] |
Chen Y J, Neilson J W, Kushwaha P, et al. Life-history strategies of soil microbial communities in an arid ecosystem[J]. The ISME Journal, 2021, 15(3): 649-657 DOI:10.1038/s41396-020-00803-y (  0) 0) |
| [28] |
Li B B, Roley S S, Duncan D S, et al. Long-term excess nitrogen fertilizer increases sensitivity of soil microbial community to seasonal change revealed by ecological network and metagenome analyses[J]. Soil Biology and Biochemistry, 2021, 160: 108349 DOI:10.1016/j.soilbio.2021.108349 (  0) 0) |
| [29] |
Xu Y D, Liang T B, Dai H X, et al. Characteristics of soil microbial communities in farmland with different comprehensive fertility levels in the Panxi area, Sichuan, China[J]. Frontiers in Microbiology, 2023, 14: 1237409 DOI:10.3389/fmicb.2023.1237409 (  0) 0) |
| [30] |
Chen Z M, Wang H Y, Liu X W, et al. Changes in soil microbial community and organic carbon fractions under short-term straw return in a rice–wheat cropping system[J]. Soil and Tillage Research, 2017, 165: 121-127 DOI:10.1016/j.still.2016.07.018 (  0) 0) |
| [31] |
杨继芬, 李永梅, 李春培, 等. 大豆玉米间作提高红壤团聚体中真菌群落结构和多样性[J]. 植物营养与肥料学报, 2023, 29(5): 889-899 (  0) 0) |
| [32] |
Bell C W, Asao S, Calderon F, et al. Plant nitrogen uptake drives rhizosphere bacterial community assembly during plant growth[J]. Soil Biology and Biochemistry, 2015, 85: 170-182 (  0) 0) |
| [33] |
Shi Y, Delgado-Baquerizo M, Li Y T, et al. Abundance of kinless hubs within soil microbial networks are associated with high functional potential in agricultural ecosystems[J]. Environment International, 2020, 142: 105869 (  0) 0) |
| [34] |
Allison S D, Martiny J B H.. Colloquium paper: Resistance, resilience, and redundancy in microbial communities[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(Suppl 1): 11512-11519 (  0) 0) |
| [35] |
Xiao Y, Zhou G X, Qiu X W, et al. Biodiversity of network modules drives ecosystem functioning in biochar-amended paddy soil[J]. Frontiers in Microbiology, 2024, 15: 1341251 (  0) 0) |
| [36] |
Zhao F Y, Zhang Y Y, Dong W G, et al. Vermicompost can suppress Fusarium oxysporum f. sp. lycopersici via generation of beneficial bacteria in a long-term tomato monoculture soil[J]. Plant and Soil, 2019, 440(1): 491-505 (  0) 0) |
| [37] |
Trivedi P, Delgado-Baquerizo M, Trivedi C, et al. Keystone microbial taxa regulate the invasion of a fungal pathogen in agro-ecosystems[J]. Soil Biology and Biochemistry, 2017, 111: 10-14 (  0) 0) |
| [38] |
Cha J Y, Han S, Hong H J, et al. Microbial and biochemical basis of a Fusarium wilt-suppressive soil[J]. The ISME Journal, 2016, 10(1): 119-129 (  0) 0) |
| [39] |
Yang C L, Dong Y, Friman V P, et al. Carbon resource richness shapes bacterial competitive interactions by alleviating growth-antibiosis trade-off[J]. Functional Ecology, 2019, 33(5): 868-875 (  0) 0) |
 2025, Vol. 57
2025, Vol. 57


