2. 中国科学院、水利部成都山地灾害与环境研究所, 成都 610299;
3. 嘉兴职业技术学院现代农业学院, 浙江嘉兴 314036;
4. 浙江省江山市林业局, 浙江江山 324199;
5. 浙江农林大学林业与生物技术学院, 杭州 311300
毒死蜱(Chlorpyrifos)的化学名称为O, O-二乙基-O-(3, 5, 6-三氯-2-吡啶基)硫代磷酸酯,属于广谱类有机磷杀虫剂,为目前使用最为广泛的杀虫剂之一。毒死蜱易被土壤吸附并发生消解,其在土壤中的消解受到土壤性质(如:有机质含量、pH)、环境因子(如:温度、土壤含水量)和土壤微生物的影响[1-2]。施入稻田的毒死蜱既会通过渗漏作用进入地下水,也可能通过地表径流或田面排水进入地表水,从而造成水体污染[2-4]。毒死蜱在土壤和水环境中的主要降解产物均为3, 5, 6-三氯-2-吡啶醇(3, 5, 6-trichloro-2-pyridinol, TCP)。与母体化合物相比,TCP对土壤生物的毒性较高、残留期较长且迁移性较强[5]。
毒死蜱在农田土壤中常有检出[6]。以四川省盐亭县截流小流域调查结果为例,稻田和旱地土壤中毒死蜱残留量分别在0.001 ~ 0.013 mg/kg和0.005 ~ 0.021 mg/kg范围内[7]。毒死蜱在旱地土壤中的半衰期因土壤类型及其他环境条件而异,介于11 ~ 141 d[2];TCP在旱地表层土壤中的半衰期为42 ~ 49 d,而在深层土壤中则为64 ~ 117 d[1]。毒死蜱在水稻土中的半衰期则为10 d或者更短[8-10],尚未见稻田土壤中TCP的消减规律研究报道。目前,对于稻田环境中毒死蜱及TCP的动态变化规律及其影响因子尚缺乏系统认识。
本文以紫色土发育的水稻土为对象,分别以土壤溶液(水提液)、上覆水-土壤以及水分饱和与非饱和土壤为培养体系,通过室内微宇宙试验,在灭菌和未灭菌处理下探究水分和温度条件对稻田中毒死蜱及TCP归趋特征的影响规律,为毒死蜱的安全使用及污染风险评估提供科学依据。
1 材料与方法 1.1 供试材料 1.1.1 药品与试剂毒死蜱(分子式:C9H11Cl3NO3 PS;分子量:350.59;水中溶解度:2.0 mg/L)和TCP(分子式:C5H2Cl3NO;分子量:198.43;水中溶解度:49 g/L)的标准品购自美国Sigma-Aldrich公司,纯度均为99.9%;毒死蜱乳油(有效含量40%)购自天津市华宇农药有限公司。实验用甲醇、乙酸乙酯和乙酸均为色谱纯,石油醚和叠氮化钠均为分析纯。实验用水为超纯水。
1.1.2 试验仪器气相色谱仪配火焰光度检测器(7890A,Agilent公司,美国);高效液相色谱配紫外检测器(1260,Agilent公司,美国);生化培养箱(SHP,北京中兴伟业仪器有限公司);旋转蒸发仪(R-3HB,BUCHI公司,瑞士);冷冻干燥机(FD-1A-50,北京博医康实验仪器有限公司);超声波清洗器(KQ-500DE,昆山市超声仪器有限公司)。
1.2 土样采集及处理在中国科学院盐亭紫色土农业生态试验站附近(四川省盐亭县林山乡,105°27′ E, 31°16′ N)选取一块紫色土发育的长期稻田,取耕作层(0 ~ 20 cm)土壤,自然风干后,过2 mm筛待用。以未灭菌处理和灭菌处理(121 ℃、0.115 MPa条件下1 h)的土壤作为供试土壤。土壤pH 8.43,有机质含量23.0 g/kg,阳离子交换量19.94 cmol/kg,砂粒、粉粒和黏粒含量分别为480、260和260 g/kg。
1.3 微宇宙试验 1.3.1 土壤溶液体系以稻田土壤溶液(水提液)为对象,对微生物存在与否(灭菌与否)和2个温度(25 ℃和40 ℃)做正交设计,设置灭菌+25 ℃、灭菌+40 ℃、未灭菌+25 ℃和未灭菌+40 ℃共4种培养条件。将土壤放入玻璃容器中,加水至上覆水高度为5 cm,搅拌均匀后静置3 d,用虹吸法取出上层水体,用0.45 μm聚四氟乙烯滤膜过滤,获得pH为8.3的土壤溶液。在灭菌处理的土壤溶液中添加抑菌剂叠氮化钠(0.1 g/L),未灭菌处理的土壤溶液中则不添加,置于25 ℃或40 ℃培养箱中保存备用。
在土壤溶液中加入农药毒死蜱乳油,使其初始浓度为2 mg/L,置于恒温培养箱中,分别在25 ℃和40 ℃下培养,在0、2、5、6、7、10、15、20、25、30、40、45、50、55、65、85和105 d采集水样(3个平行样),分析其毒死蜱和TCP浓度。
1.3.2 土壤体系将土壤(灭菌或未灭菌)分别加入玻璃器皿中,对微生物存在与否、2个温度(25 ℃和40 ℃)、4种水分状况(5、3、0 cm高度上覆水和60% 土壤田间持水量)做正交试验设计。由于上覆水高度0 cm和60% 土壤田间持水量条件下均难以持续保持无菌状态,故在这两种水分条件下仅分析未灭菌条件下的消解动态。
将0.077 mL农药毒死蜱乳油加入14 mL水中,混合均匀后,用移液枪逐滴加入720 g风干土中,并即时捏碎混匀直至全部加入,该过程耗时约4 h(期间毒死蜱已发生部分降解,故培养试验正式开始时上覆水和土壤中TCP的初始含量分别在0.72 ~ 2.98 μmol/L和5.39 ~ 17.26 μmol/kg);然后,将土壤平铺于密封性能良好的长方体玻璃容器(长19 cm、宽14 cm)内,在不同条件下进行培养,其中灭菌条件通过在上覆水中添加叠氮化钠(0.1 g/L)实现。在105 d或110 d内于不同时间点(主要间隔5 d或10 d)采集上覆水和土壤样品(3个平行样),分析其毒死蜱和TCP含量。
1.4 土壤和水样中毒死蜱和TCP的提取与检测 1.4.1 提取水样:准确吸取2 mL用于分析毒死蜱的水样(土壤溶液或上覆水样品),加入4 mL石油醚,300 W超声处理20 min,静置分层后收集有机相,提取二次,合并有机相后经氮吹仪浓缩至近干,用乙酸乙酯定容至1 mL,经0.22 μm PTFE滤膜过滤后存于进样瓶中,保存于4 ℃冰箱待测。对于分析TCP的水样,用0.22 μm聚四氟乙烯滤膜过滤后,保存于4 ℃冰箱待测。
土样:将土壤样品冻干后研磨混匀,称取2 g,加入20 mL乙酸乙酯后涡旋10 s混匀,300 W超声20 min后,4 000 r/min离心5 min,吸取上清液,再次添加10 mL乙酸乙酯进行提取,合并两次上清液,用旋转蒸发仪浓缩至近干,用乙酸乙酯定容至1 mL,用0.22 μm聚四氟乙烯滤膜过滤于进样瓶中待测。土样中TCP的提取方法与毒死蜱相似,仅将提取剂和定容溶剂均换成甲醇,其他条件相同。
1.4.2 检测采用气相色谱仪分析毒死蜱含量,色谱条件:HP-5柱(30 m× 0.32 mm× 0.25 μm);载气(高纯N2)流量:1 mL/min;柱温:初始温度50 ℃,保持1 min,以30 ℃/min升温至180 ℃,保持1 min,再以10 ℃/min升温至250 ℃,保持5 min。进样口:250 ℃;检测器:250 ℃;进样量:1 μL。
采用高效液相色谱仪分析TCP含量,色谱条件:Eclipse plus C18柱,4.6 mm× 150 mm(5 μm);流动相为甲醇–水(体积比80∶20),水相加入体积百分比为0.02% 的乙酸;等度洗脱,流量:1 mL/min;柱温:30 ℃;紫外检测波长:293 nm;进样量:10 μL。
水样中毒死蜱的加标回收率为98% ~ 102%,其校准曲线的线性范围为0.005 ~ 2.5 mg/L(检出限0.002 5 mg/L)。水样中TCP的加标回收率为96% ~ 105%,其线性范围为0.01 ~ 5 mg/L(检出限0.005 mg/L)。土样中毒死蜱的加标回收率为91% ~ 105%,其线性范围为0.005 ~ 2.5 mg/kg(检出限0.002 5 mg/kg)。土样中TCP的加标回收率为95% ~ 105%,其线性范围为0.005 ~ 2.5 mg/kg(检出限0.002 5 mg/kg)。
1.5 数据分析采用一级非线性动力学方程拟合土壤溶液、上覆水或土壤中毒死蜱的消解动态:
| $ \frac{C}{{{C_0}}} = {{\text{e}}^{ - kt}} $ | (1) |
式中:C为施药t时间后的毒死蜱浓度或含量(μmol/L或μmol/kg);C0为毒死蜱初始浓度或含量(μmol/L或μmol/kg);t为施药后的历时(d);k为毒死蜱的一级消解速率常数。
稻田土壤溶液中毒死蜱降解生成TCP(以下简称TCP净生成率)的快速增加段用线性方程表示:
| $ \frac{{C}_{\text{TCP}}-{C}_{0,\text{ TCP}}}{{C}_{0, 毒死蜱}}={k}_{\text{TCP}}t $ | (2) |
式中:CTCP为施药t时间后的TCP浓度(μmol/L);C0, TCP为TCP初始浓度(μmol/L;来源于商品农药毒死蜱乳油所含TCP杂质);C0, 毒死蜱为毒死蜱初始浓度(μmol/L);kTCP为TCP净生成率。
土壤溶液、上覆水或土壤中毒死蜱的半衰期(DT50,d)采用下式计算:
| $ {\text{D}}{{\text{T}}_{50}} = \frac{{{\text{ln}}2}}{k} $ | (3) |
单位面积上覆水中的TCP净发生量采用下式计算:
| $ Y = c \times h $ | (4) |
式中:Y为单位面积的TCP净发生量(nmol/cm2);c为TCP浓度(μmol/L);h为上覆水高度(cm)。
2 结果与讨论 2.1 土壤溶液体系中毒死蜱和TCP的动态变化特征及其影响因子在4种培养条件下,加药后土壤溶液中毒死蜱浓度的变化趋势均表现为:在前期快速消解,随着时间进一步推移,消解速率常数逐渐降低。土壤溶液中毒死蜱一级消解动力学方程的拟合参数和半衰期结果列于表 1。两种温度条件下的方程拟合结果均较好(P < 0.01)。在未灭菌(微生物存在)、40 ℃高温条件下毒死蜱的消解最为迅速(DT50=2.22 d)。
|
|
表 1 土壤溶液中毒死蜱消解的一级动力学方程拟合参数 Table 1 Parameters of fitted first-order kinetic equations to the temporal changes of chlorpyrifos concentration in the soil water |
由于商品农药毒死蜱乳油中含有TCP,农药初始加入时土壤溶液即检出一定浓度的TCP(0.27 μmol/L)。随着培养时间的推移,TCP浓度先迅速提高,然后缓慢上升至一定浓度,随后基本维持稳定水平(图 1A)。温度会影响TCP净生成率的变化速率,但不影响最终的净生成率。在25 ℃和40 ℃下,灭菌处理的TCP最终净生成率均为61%,远低于未灭菌处理(均达90%,图 1B)。有研究表明,水解是毒死蜱在碱性(pH≥8)条件下的一条重要消解途径,其作用随温度的升高而增强[2]。因此,可以推断:在灭菌处理的土壤溶液中毒死蜱主要通过水解作用生成TCP;而未灭菌处理的土壤溶液中毒死蜱向TCP的高转化率是水解和微生物降解共同作用的结果,其中,微生物降解作用贡献了29% 的TCP净生成率。在环境中已发现的能降解毒死蜱但不能降解TCP的菌株包括Sphingomonas sp. Dsp、Dsp-2、Bacillus thuringiensis strain BRC-HZM2、Enterobacter sp. B-14、Stenotrophomonas sp. YC-1等[11-15]。可以推测,本研究土壤溶液中毒死蜱的生物降解是多种微生物共同作用的结果。
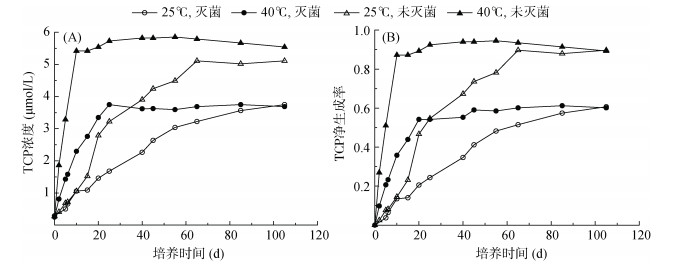
|
图 1 土壤溶液中TCP浓度和净生成率随时间的变化 Fig. 1 Temporal changes of TCP concentration and net production rate in the soil water |
表 2列出了不同条件下初期线性变化段的TCP净生成率。未灭菌、40 ℃条件下的TCP净生成率最高(与加药初期毒死蜱的快速降解相对应),其次为灭菌、40 ℃条件下,以灭菌、25 ℃条件下的TCP净生成率最低。可见,高温和微生物的存在均有利于TCP的生成;尽管高温能在更短的时间内使TCP净生成率迅速上升,但温度并不影响TCP的最终净生成率。
|
|
表 2 水稻土溶液中TCP净生成率线性变化段数据的方程拟合参数 Table 2 Parameters of fitted linear equations to the temporal change of TCP concentration in the paddy soil water |
在5 cm上覆水高度下,经两相分配平衡的上覆水中毒死蜱的初始浓度为1.49 μmol/L,在5 d内4种处理的毒死蜱浓度都迅速下降(均降至低于0.5 μmol/L),随后缓慢降低(图 2A)。在第10天(含)之后的培养时段内,25 ℃、灭菌处理上覆水中毒死蜱的残留浓度明显高于其他3种处理。在3 cm上覆水高度下,毒死蜱浓度呈现与5 cm上覆水高度下相似的时间变化趋势及处理间差异(图 2B)。
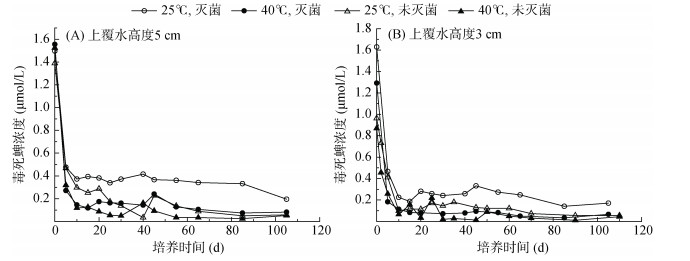
|
图 2 上覆水中毒死蜱浓度随时间的变化 Fig. 2 Temporal changes of chlorpyrifos concentration in the overlying water |
毒死蜱主要被吸附在土壤固相中,故土壤中毒死蜱含量的变化显得尤为重要。土壤中毒死蜱初始投加量为139.21 μmol/kg,在两种上覆水高度下,土壤中毒死蜱含量呈现与上覆水中毒死蜱浓度相似的消减趋势,但处理间差异更为明显。在培养中后期,以25 ℃、灭菌条件下土壤中毒死蜱的残留含量最高,而40 ℃、未灭菌条件下土壤中毒死蜱残留最低(图 3)。
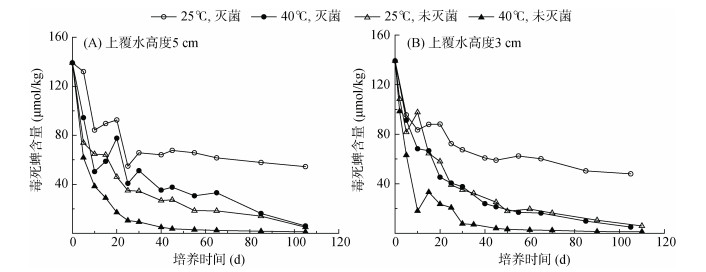
|
图 3 土壤中毒死蜱含量随时间的变化 Fig. 3 Temporal changes of chlorpyrifos concentration in the soil |
一般认为,施药后,稻田上覆水中毒死蜱浓度的变化主要是土壤对毒死蜱的吸附作用以及上覆水和土表的毒死蜱生物与非生物消解过程(如:水解、微生物降解、光解、水–土界面交换等)的净结果[2]。在本研究中,不同处理上覆水和土壤中毒死蜱含量消解数据均可用一级非线性动力学方程较好地描述(P < 0.01),拟合结果如表 3所示。
|
|
表 3 上覆水和土壤中毒死蜱消解的一级非线性动力学方程拟合参数 Table 3 Parameters of fitted first-order kinetic equations to the temporal changes of chlorpyrifos and TCP contents in the overlying water and soil |
在上覆水中,40 ℃下的毒死蜱消解速率常数明显高于25 ℃下,而覆水高度和灭菌处理的影响未见一致规律(表 3)。同一稻田的田间施药试验与监测结果表明,田面水中毒死蜱的半衰期为1.2 d[5],低于本研究室内消解动力学试验的结果。毒死蜱在其他地区稻田田面水中的半衰期更低,仅为0.52 ~ 0.90 d[8, 10, 16]。在两种上覆水高度下,温度和灭菌处理对土壤中毒死蜱的消解速率表现出一致的影响规律,高温和微生物的存在均有利于毒死蜱的消解(表 3)。
在灭菌处理中,单位面积上覆水中的TCP净发生量在整个培养期间均呈现逐渐升高的趋势,40 ℃下的TCP净发生量高于25 ℃下,5 cm上覆水高度下的TCP净发生量高于3 cm上覆水高度下(图 4A)。在未灭菌处理中,25 ℃和40 ℃下单位面积上覆水中TCP净发生量的动态变化规律完全不同:25 ℃下呈现先上升后降低的趋势,40 ℃下持续升高但增速逐渐变缓,达最大值后缓慢降低;40 ℃下整个培养期间的TCP净发生量一直高于25 ℃下(图 4B)。
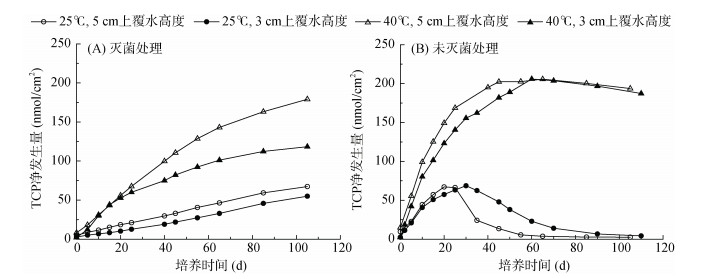
|
图 4 土壤单位面积上覆水中TCP净发生量随时间的变化 Fig. 4 emporal changes of TCP net production in the overlying water per unit area of the soil |
由于土壤对TCP为弱吸附作用,土壤中TCP残留量在较低水平波动(整个培养周期内含量低于30 μmol/kg)。在培养后期(第30天后),不同处理之间土壤TCP残留量开始出现差异,尤其是培养试验结束时,常温(25 ℃)、未灭菌条件下土壤中的TCP残留量远低于其他3个处理。
TCP残留水平的高低可指示稻田环境中毒死蜱被彻底脱毒的可能性的大小。总体来看,毒死蜱在上覆水中的半衰期短、消减快,而TCP在上覆水中会长时间存在,尤其是在高温条件下。因此,在稻田水分管理中,建议田面排水应在TCP含量较低的清晨实施,以减少对农田沟渠水体的污染。
2.3 不同土壤含水量条件下毒死蜱和TCP的动态变化特征在未灭菌、无上覆水饱和条件下土壤中毒死蜱的消解趋势也可用一级非线性动力学方程较好地描述(表 4)。高温(40 ℃)更有利于毒死蜱的降解。在相同的高温条件下,无上覆水饱和条件下土壤中毒死蜱的半衰期(仅为1.62 d)明显短于有上覆水条件下。在整个培养周期内,土壤中TCP残留量在较高水平波动(25 ℃和40 ℃下分别为15.53 ~ 63.90 μmol/kg和17.26 ~ 86.65 μmol/kg),且常温下的TCP残留量始终低于高温下,表明常温(25 ℃)更有利于TCP的净降解。
|
|
表 4 未灭菌饱和与非饱和土壤中毒死蜱消解的一级动力学方程拟合参数 Table 4 Parameters of fitted first-order kinetic equations to the temporal changes of chlorpyrifos and TCP contents in saturated and unsaturated soils |
未灭菌、非饱和(60%田间持水量)条件下土壤中毒死蜱的消解趋势与未灭菌、无上覆水饱和条件下相似,可用一级非线性动力学方程较好地描述(表 4)。同样,高温(40 ℃)能促进毒死蜱的降解。然而,在整个培养周期内,25 ℃和40 ℃下土壤中TCP含量的差异不大,分别为6.00 ~ 78.08 μmol/kg和6.01 ~ 77.21 μmol/kg。
2.4 培养体系中毒死蜱的归趋特征已有等温吸附试验结果表明:线性模型和Freundlich模型均能很好地拟合毒死蜱和TCP在供试水稻土的等温吸附数据(P < 0.01);毒死蜱的吸附容量常数(Kf)和两相分配系数(Kd)均比TCP高3个数量级;40 ℃时两种目标物的吸附Kf与Kd均低于25 ℃[5]。这些结果可以推断,夏季白昼的高温有利于毒死蜱由土壤固相向水相释放,从而有利于TCP的生成(图 1)。
各培养试验结束时毒死蜱和TCP的残留特征汇总于表 5。在上覆水–土壤体系中,灭菌处理中毒死蜱绝大部分残留于土壤中,25 ℃下的最终残留率大幅高于40 ℃下,而TCP主要残留于上覆水中,25 ℃下的最终累积量低于40 ℃下;上覆水高度越高,体系中毒死蜱及TCP的最终残留量/累积量以及各相最终残留量/累积量越高。在未灭菌条件下,各处理毒死蜱的最终总残留率及各相最终残留率均远低于灭菌的相应处理;25 ℃下TCP的最终总累积量及各相累积量均远低于灭菌的相应处理,而40 ℃下TCP的最终累积量及各相累积量均大幅高于灭菌的相应处理。因此,在未灭菌条件下,尽管40 ℃高温下毒死蜱在上覆水和土壤中的最终残留率均低于25 ℃常温下,但不利于TCP的降解,导致上覆水和土壤中TCP的最终累积量均很高,预示在田间高温条件下存在较高的TCP流失风险。这与夏季大田试验中观测到的耕作层土壤孔隙水TCP浓度昼高夜低的节律性变化的田间观测结果[5]是一致的。
|
|
表 5 培养试验结束时毒死蜱及TCP的残留特征 Table 5 Residual characteristics of chlorpyrifos and TCP at the end of incubation experiment |
在25 ℃下,60% 田间持水量未灭菌土壤中的毒死蜱最终残留率(仅1.44%)低于同温度下所有其他土壤处理,表明非饱和(富氧)条件更有利于降低毒死蜱的最终残留;无上覆水条件下未灭菌土壤中的TCP最终累积量大幅高于有上覆水条件下,且60% 田间持水量下(46.56%)高于饱和条件下(19.70%),表明TCP降解菌在淹水及水饱和(少氧)条件的活性高于在非饱和条件下。40 ℃高温、无上覆水条件下,水饱和度对土壤中毒死蜱和TCP最终累积量的影响规律则相反。
类似地,印度水旱轮作农田土壤悬液的室内培养试验(温度18 ~ 32 ℃)研究表明,好氧条件下毒死蜱的残留率低于厌氧条件下;而在好氧和厌氧条件下TCP均会发生累积[17]。
综上,水分条件对土壤中毒死蜱及TCP消解的影响规律因温度而异,说明毒死蜱的主要降解菌及其适宜温度与氧化还原条件可能与TCP的不同。在未来研究中,可采集不同成土母质、水旱轮作制度及水肥管理的水稻土,分离并鉴定能高效降解毒死蜱及TCP的菌株及菌群,明确最适宜降解的温度、水分及养分条件,为毒死蜱残留的彻底脱毒提供科学指导[18-20]。
3 结论1) 毒死蜱在土壤溶液、上覆水–土壤体系和无上覆水土壤中的消解动态均可用一级动力学方程很好地描述。
2) 40 ℃高温下上覆水和土壤中毒死蜱的消解速率常数明显高于25 ℃常温下;微生物的存在显著促进土壤中毒死蜱的消解;上覆水的存在不利于土壤中毒死蜱的消解;在无上覆水情况下,非饱和水分条件下土壤中毒死蜱的消解速率常数低于水饱和条件下。
3) TCP可能在上覆水中长时间残留,高温下上覆水和土壤中TCP的最终累积量均高于常温下。
| [1] |
Baskaran S, Kookana R S, Naidu R. Contrasting behaviour of chlorpyrifos and its primary metabolite, TCP (3, 5, 6-trichloro-2-pyridinol), with depth in soil profiles[J]. Soil Research, 2003, 41(4): 749-760 DOI:10.1071/SR02062 (  0) 0) |
| [2] |
Racke K D. Environmental fate of chlorpyrifos[J]. Reviews of Environmental Contamination and Toxicology, 1993, 131: 1-150 (  0) 0) |
| [3] |
刘慧云, 关卓, 程建华, 等. 间歇灌溉对稻田毒死蜱迁移转化特征的影响[J]. 农业工程学报, 2020, 36(1): 214-220 (  0) 0) |
| [4] |
王鑫, 于东升, 马利霞, 等. 基于万维网大数据的农药场地土壤污染快速预测方法研究[J]. 土壤学报, 2022, 59(3): 708-721 (  0) 0) |
| [5] |
Liu H Y, Guan Z, Cheng J H, et al. Ambient temperature modulates dissipation and redistribution of chlorpyrifos and 3, 5, 6-trichloro-2-pyridinol in paddy field[J]. Soil and Sediment Contamination, 2022, 31(5): 533-555 DOI:10.1080/15320383.2021.1969636 (  0) 0) |
| [6] |
薛南冬, 刘寒冰, 杨兵, 等. 毒死蜱土壤环境行为研究进展[J]. 浙江大学学报(农业与生命科学版), 2017, 43(6): 713-726 (  0) 0) |
| [7] |
刘慧云. 稻田系统中毒死蜱的迁移转化特征研究[D]. 成都: 中国科学院大学(中国科学院水利部成都山地灾害与环境研究所), 2021.
(  0) 0) |
| [8] |
Fu Y, Liu F F, Zhao C L, et al. Distribution of chlorpyrifos in rice paddy environment and its potential dietary risk[J]. Journal of Environmental Sciences, 2015, 35: 101-107 DOI:10.1016/j.jes.2015.02.015 (  0) 0) |
| [9] |
Garg A K, Sethi G R. Persistence of insecticide residues in paddy soil[J]. Indian Journal of Plant Protection, 1980, 8(2): 157-163 (  0) 0) |
| [10] |
Zhang X, Shen Y, Yu X Y, et al. Dissipation of chlorpyrifos and residue analysis in rice, soil and water under paddy field conditions[J]. Ecotoxicology and Environmental Safety, 2012, 78: 276-280 DOI:10.1016/j.ecoenv.2011.11.036 (  0) 0) |
| [11] |
李晓慧, 贾开志, 何健, 等. 一株毒死蜱降解菌株Sphingomonas sp. dsp-2的分离鉴定及降解特性[J]. 土壤学报, 2007, 44(4): 734-739 (  0) 0) |
| [12] |
王晓, 楚小强, 虞云龙, 等. 毒死蜱降解菌株Bacillus latersprorus DSP的降解特性及其功能定位[J]. 土壤学报, 2006, 43(4): 648-654 (  0) 0) |
| [13] |
Singh B K, Walker A, et al. Biodegradation of chlorpyrifos by Enterobacter strain B-14 and its use in bioremediation of contaminated soils[J]. Applied and Environmental Microbiology, 2004, 70(8): 4855-4863 (  0) 0) |
| [14] |
Wu S Q, Peng Y, Huang Z M, et al. Isolation and characterization of a novel native Bacillus thuringiensis strain BRC-HZM2 capable of degrading chlorpyrifos[J]. Journal of Basic Microbiology, 2015, 55(3): 389-397 (  0) 0) |
| [15] |
Yang C, Liu N, Guo X M, et al. Cloning of mpd gene from a chlorpyrifos-degrading bacterium and use of this strain in bioremediation of contaminated soil[J]. FEMS Microbiology Letters, 2006, 265(1): 118-125 (  0) 0) |
| [16] |
Zulkifli M, Tejada A W, Magallona E D. The fate of BPMC and chlorpyrifos in some components of paddy rice ecosystem[J]. Philippine Entomologist, 1983, 6: 555-565 (  0) 0) |
| [17] |
Tiwari M K, Guha S. Kinetics of biotransformation of chlorpyrifos in aqueous and soil slurry environments[J]. Water Research, 2014, 51: 73-85 (  0) 0) |
| [18] |
李婉怡, 於维维, 余琼阳, 等. 土壤重金属–有机物复合污染环境效应与修复技术研究进展[J]. 土壤, 2023, 55(3): 453-463 DOI:10.13758/j.cnki.tr.2023.03.001 (  0) 0) |
| [19] |
李锦涛, 杨涵, 陈洋, 等. 降解多菌灵和啶虫脒残留的复合菌剂研发及初步应用[J]. 土壤, 2022, 54(3): 646-652 DOI:10.13758/j.cnki.tr.2022.03.027 (  0) 0) |
| [20] |
唐凯迪, 高乃征, 刘娟, 等. 六六六对红壤和紫色土中细菌群落多样性及结构的影响[J]. 土壤学报, 2022, 59(3): 844-853 (  0) 0) |
2. Institute of Mountain Hazards and Environment, Chinese Academy of Sciences, Chengdu 610299, China;
3. College of Modern Agriculture, Jiaxing Vocational & Technical College, Jiaxing, Zhejiang 314036, China;
4. Jiangshan Forestry Bureau of Zhejiang Province, Jiangshan, Zhejiang 324199, China;
5. College of Forestry and Biotechnology, Zhejiang A & F University, Hangzhou 311300, China
 2025, Vol. 57
2025, Vol. 57


