2. 中国科学院大学, 北京 100049
人类活动向农业生态系统排放大量重金属,对土壤健康和粮食作物安全生产构成严重威胁。镉(Cd)作为生物体的非必需元素,由于其强生物毒性和流动性,以及通过土壤–植物系统的积累,经由食物链对人体健康构成威胁[1-2]。我国农田重金属污染情况也较为严重。2014年发布的《全国土壤污染状况调查公报》[3]显示我国耕地土壤点位超标率为19.4%,且污染物以Cd、As、Hg等重金属为主。因此,对Cd污染农田土壤进行修复受到越来越多研究者的关注。土壤中Cd的生物毒性在很大程度上取决于其生物可利用性和形态[4-6]。与物理修复相比,较低成本的土壤钝化剂在农产品安全和绿色农业发展中的应用越来越受到关注[7]。
稻田土壤的特点是周期性淹水和排水过程,即在水稻收割前20 d左右保持排水以控制过度分蘖。由于土壤淹水会使酸性土壤向非活性分馏过渡,从而降低Cd在酸性土壤中的可用性,而排水过程可以将Cd从低活性转变为高活性。因此,淹水和排水交替过程会导致土壤中的Cd活性显著增加,从而使水稻籽粒中的Cd浓度增加。最近的一项研究表明,水稻籽粒中超过80% 的Cd是在水稻灌浆阶段积累的,而这一阶段与水稻收获前的排水过程相吻合[8]。因此,在氧化阶段提高土壤pH是减少Cd在土壤和稻米中积累的有效方法。
与普通材料相比,纳米材料具有独特的小尺寸效应[9]以及更高的反应活性和吸附能力[10],因此纳米材料已成为农业工程的一个新兴领域。许多研究表明,纳米材料在植物病害控制、土壤修复和促进植物生长方面具有很好的效果[11-13]。纳米材料可以通过直接相互作用或间接改变土壤性质来稳定重金属,从而降低重金属在土壤中的迁移转化和生物可利用率[14]。纳米碳酸钙(NCC)和纳米羟基磷灰石(NHAP)这两种材料都表现出独特的效应,如小尺寸效应和表面效应,是正常尺寸的碳酸钙和羟基磷灰石等非纳米材料所不具备的。
经研究发现,NCC拥有极高的化学能,当原子周围悬空键较多时,就易与其他原子结合,从而达到稳定状态。刘畅[15]研究了NCC对Cd2+的吸附性能,试验发现NCC对Cd的吸附容量高达2 207.4 mg/g。而NHAP可使土壤可交换态Cd含量降低约10%,残渣态Cd含量提高34% ~ 50%[16]。因此,这两种纳米材料具有固定土壤中Cd的巨大潜力。然而,目前研究主要集中在纳米材料在水相和土壤中吸附Cd性能方面,对纳米材料在土壤–水稻体系中的修复研究较少。因此,本研究通过水稻盆栽试验,探究施加NCC和NHAP对水稻生物量,土壤溶液pH、Eh的动态变化,土壤有效态Cd含量的变化,水稻根表铁膜元素含量,水稻各器官Cd含量以及富集、转运系数的影响,进而评价NCC和NHAP作为土壤修复材料对土壤–水稻系统的影响,以期为农田土壤Cd污染修复材料安全性评价提供科学数据与支持。
1 材料与方法 1.1 供试材料供试土壤采自江西省新余市(114°58'16''E,27°47'N)受Cd污染的水田耕作层(0 ~ 20 cm),稻田因采矿活动或用受污染的水灌溉而受到Cd污染。土壤类型属粉砂壤土。土壤经自然风干后剔除杂物,碾碎、研磨后过10目尼龙网筛备用。土壤基本理化性质见表 1。其中,pH为5.8,全Cd含量为0.58 mg/kg,高于GB15618—2018《土壤环境质量农用地土壤污染风险管控标准》[17]的筛选值(5.5 < pH≤6.5下全Cd含量0.4 mg/kg)。试验所用的NCC和NHAP购自南京埃普瑞纳米材料公司,平均直径为50 nm。
|
|
表 1 供试土壤基本理化性质 Table 1 Basic properties of the tested soil |
试验共设置6个处理:CK,不添加材料组;0.4% NCC、0.4% NHAP,土壤分别添加0.4% (m/m)NCC和NHAP;C+P (1∶1)、C+P (5∶1)、C+P (10∶1),土壤分别添加0.4% (m/m) NCC和NHAP的1∶1、5∶1和10∶1混合材料。按照处理设置准备试验土壤后,经自然风干,过10目尼龙筛网,装入28.5 cm(直径)×19 cm(高)的盆栽桶,每桶装土6 kg。每个处理重复3次,共计18盆。同时在每个盆栽桶垂直埋设土壤溶液采样器采集孔隙水,埋设深度约为10 cm。
供试水稻品种为荃两优粤农丝苗,是一种籼型两系杂交水稻品种。挑选饱满、大小相似的水稻种子阳光下晾晒24 h,经过15% H2O2浸泡15 min消毒后,用去离子水冲洗多次。然后,在25 ℃黑暗条件下浸种24 h,取出放置在湿纱布上催芽24 h,等待水稻种子发芽至1 ~ 2 cm时,于2023年4月17日直播到育苗盘内进行前期培养。水稻秧苗长至三叶一心时,取长势一致的健康水稻幼苗移栽到盆栽桶内,每桶2穴,每穴3株。水稻移栽时间为2023年5月16日,收获于2023年9月3日。水稻移栽前桶内土壤淹水培养一周,灌溉水均使用周边居民生活用水,后续水稻生长阶段保持淹水3 ~ 5 cm。施肥情况:基肥施用量为N 0.2 g/kg(CO(NH2)2)、P2O5 0.15 g/kg (KH2PO4)和K2O 0.2 g/kg(KCl),并于水稻分蘖期追肥N 0.06 g/kg,抽穗期追肥N 0.04 g/kg和K2O 0.1 g/kg。
1.3 样品采集与测定 1.3.1 样品采集土壤溶液:在移栽水稻后的第30、60、62、65、70、90天用已经埋好的土壤溶液采样器抽取土壤溶液20 mL,立即测定土壤溶液样品的pH、Eh值。
土壤样品:采用五点取样法在水稻成熟收获期采集土壤,混合后自然风干,过10目尼龙筛,用于测定土壤有效态Cd含量。
植物样品:水稻成熟收获期记录水稻株高、有效分蘖数,并将每盆收获的籽粒混合一起后测定千粒重。收获的样品分别用自来水和去离子水反复冲洗去除表面土壤和灰尘,分成根、茎、叶和糙米。所有样品在105 ℃杀青30 min,在75 ℃干燥至恒重,然后研磨、粉碎、过1 mm筛,储存于密封聚乙烯袋中备用。
1.3.2 样品测定采用DTPA法提取土壤有效态Cd。DTPA溶液:0.005 mol/L DTPA、0.01 mol/L CaCl2和0.1 mol/L三乙醇胺,pH=7。取2 g土样和10 mL的DTPA溶液于50 mL离心管中,在25 ℃条件下以200 r/min震荡2 h,以4 000 r/min离心10 min,经过0.45 μm的过滤器收集上层清液经电感耦合等离子体质谱仪(ICP-MS)测定Cd含量。
根表铁膜含量测定采用DCB(Dithionite citrate bicarbonate)提取法[18],称取6.000 0 g用超纯水洗净的鲜样根,置于150 mL三角瓶中,加入0.3 mol/L柠檬酸钠(Na3C6H5O7·2H2O)40 mL,1 mol/L碳酸氢钠(NaHCO3) 5 mL,3 g保险粉(Na2S2O4),混合均匀,在25 ℃下置于150 r/min的摇床上振荡3 h,溶液转移至100 mL容量瓶中并用去离子水定容。定容后溶液过0.22 μm滤膜,加入2滴5% 的浓HNO3作酸化处理,利用电感耦合等离子体光谱仪(ICP-OES)测定溶液中Fe、Mn含量。
水稻样品重金属含量测定参照《土壤农业化学分析方法》[19],通过HNO3-HClO4(V∶V=5∶1)消解,定容后,使用ICP-MS测定重金属含量,同时使用标准物质柑橘叶GBW10020(GSB-11)以及空白样对实验误差进行校正,回收率为97% ~ 110%。
1.4 数据统计与分析试验数据均以平均值±标准差(SD) 表示。数据分析使用Excel 2019、SPSS 22.0软件进行。统计分析采用单因素方差分析(ANOVA),然后采用邓肯检验确定不同处理均值之间的差异显著性(P < 0.05)。使用Origin 9.1软件绘制图表。
2 结果与分析 2.1 水稻生物量及其构成要素施用NCC和NHAP对水稻生物量及其构成要素影响见表 2。相比于CK处理,0.4%NHAP处理水稻株高显著提高了3.8%(P < 0.05);C+P (10∶1)处理水稻地下部生物量显著提高了70.7%;而0.4%NCC处理水稻有效穗数提高了7.7%。各处理对水稻地上部生物量、结实率和千粒重没有显著影响。
|
|
表 2 水稻生物量及其构成要素 Table 2 Rice biomass and its components |
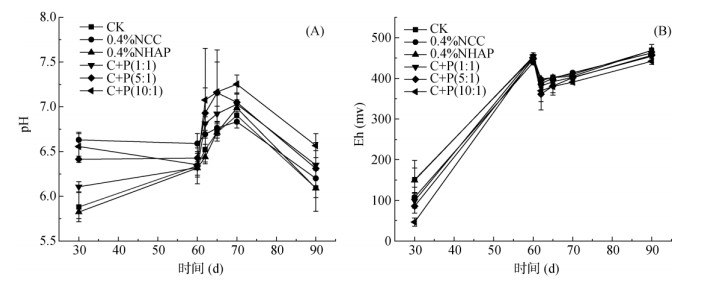
移栽水稻后,整个生育期土壤溶液pH随时间的动态变化如图 1A所示。不同处理间的土壤溶液pH动态变化趋势一致,在淹水阶段,随着淹水时间的延长,土壤溶液pH逐渐升高至接近中性,并在第70天达到水稻生育期最高值。与CK相比,0.4%NCC、C+P(5∶1)、C+P(10∶1)处理在淹水阶段pH较高,这主要是因为这3个处理中NCC质量占比较大而NCC本身的pH较高。进入排水阶段后,土壤溶液pH开始逐渐降低,最终稳定在略高于初始pH。与CK相比,0.4%NCC、C+P(5∶1)、C+P(10∶1) 处理在排水阶段pH也保持较高值,分别提高了1.7%、3.6% 和7.8%。整个水稻生育期,土壤溶液pH介于6.67 ~ 7.25。
|
图 1 土壤溶液pH(A)、Eh(B)的动态变化 Fig. 1 Dynamics of soil solution pH (A), Eh(B) |
土壤溶液Eh随时间的动态变化如图 1B所示。不同处理间的土壤溶液Eh动态变化趋势也是一致的。在淹水阶段,土壤溶液的Eh迅速升高至400 ~ 500 mV的最高值。排水阶段短暂降低至300 mV左右后保持稳定。
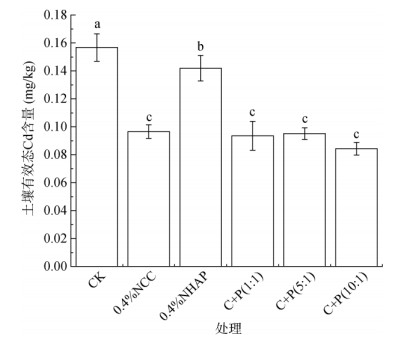
2.3 土壤有效态Cd含量变化水稻收获后,DTPA提取态Cd的含量变化如图 2所示。从图中可见,未施加纳米材料的CK组土壤中有效态Cd含量为0.16 mg/kg,施加纳米材料后的土壤中有效态Cd含量为0.08 ~ 0.14 mg/kg。与CK组相比,各处理均能显著降低土壤有效态Cd含量,分别降低了38.4%、9.4%、40.3%、39.3% 和46.2% (P < 0.05),其中C+P(10∶1) 处理组降低土壤有效态Cd含量效果最好。
|
(图中小写字母不同表示处理间差异达P < 0.05显著水平,下图同) 图 2 土壤有效态Cd含量变化 Fig. 2 Changes of available Cd in soil |
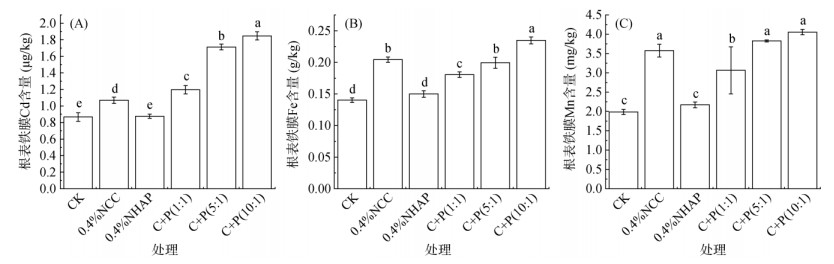
水稻根表铁膜中元素含量变化如图 3所示。根表铁膜中Cd元素含量范围在0.87 ~ 1.85 μg/kg,与CK组相比,除0.4%NHAP处理,其他处理组均能显著提高根表铁膜Cd含量,其中C+P(10∶1)处理提高量最大,相较于CK组显著提高了53.1%(P < 0.05)。根表铁膜中Fe元素含量范围在0.14 ~ 0.24 g/kg,与CK组相比,除0.4%NHAP处理,其他处理组均能显著提高根表铁膜Fe含量,其中C+P(10∶1)处理提高量最大,相较于CK组显著提高了40.3%。根表铁膜中Mn元素含量范围在1.99 ~ 4.33 mg/kg,与CK组相比,除0.4%NHAP处理,其他处理均能显著提高根表铁膜Mn含量,其中0.4%NCC、C+P(5∶1)和C+P(10∶1) 3个处理提高量较大,相较于CK组显著提高了44.4%、48.1% 和51.0%(P < 0.05)。
|
图 3 水稻根表铁膜中Cd(A)、Fe(B)、Mn(C)含量 Fig. 3 Contents of Cd (A), Fe (B) and Mn (C) in iron plaque on rice roots |
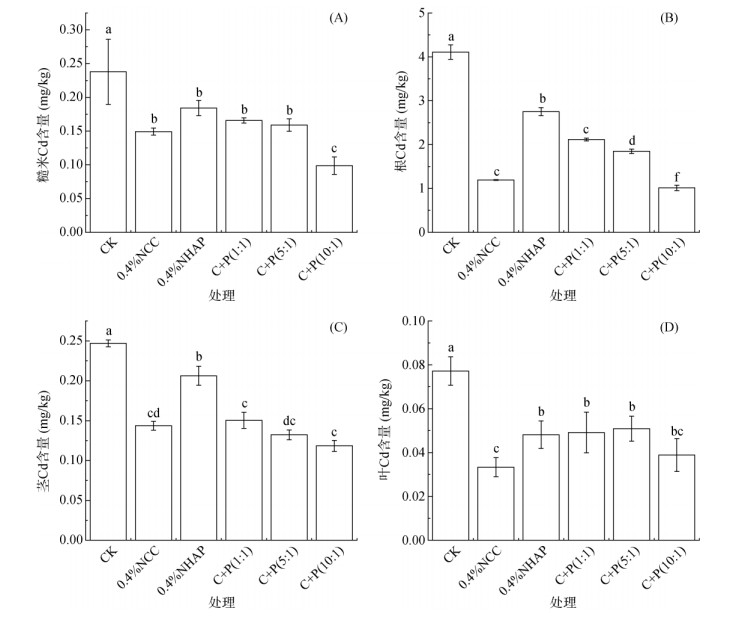
与CK相比,施用NCC和NHAP处理组使水稻根、茎、叶、糙米Cd含量显著降低(P < 0.05,图 4)。叶片中Cd含量显著低于根、茎和糙米中Cd含量。其中C+P(10:1)处理糙米、根和茎中Cd含量最低,相较于CK组显著降低了41.7%、75.4% 和52.0%。0.4%NCC处理叶片中Cd含量最低,相较于CK组显著降低了51.4%。值得关注的是,与CK组相比,各处理组水稻糙米中Cd含量分别降低了37.3%、22.5%、30.3%、33.2% 和41.7%,均低于GB2762—2012《食品安全国家标准食品中污染物限量》[20]中限定的0.2 mg/kg。
|
图 4 水稻糙米(A)、根(B)、茎(C)、叶(D)的Cd含量 Fig. 4 Cd concentrations in rice grains (A), roots (B), stem(C) and leaves (D) |
不同处理组水稻地上部的生物富集系数(BCF)和转移系数(TF)见表 3。富集系数不仅可用来表征土壤-水稻体系中重金属元素迁移的难易程度, 而且也能较清楚地比较水稻不同器官对重金属元素的吸收积累能力。不同器官中Cd的富集系数均表现为根 > 秸秆 > 糙米,且与CK相比,各处理组均能降低水稻各组织中的Cd富集系数。水稻根、秸秆、糙米的Cd富集系数范围分别为2.35 ~ 9.56、0.37 ~ 0.75、0.23 ~ 0.55,其中C+P(10∶1) 处理降低水稻各组织Cd积累作用最为显著。
|
|
表 3 水稻Cd富集和转运系数 Table 3 Cd bioaccumulation and transport factors in rice |
转移系数体现水稻不同部位之间对Cd的转移能力。不同器官中Cd的转移系数均表现为TF茎-糙米 > TF茎-叶 > TF根-茎,其中根-茎转移系数范围为0.06 ~ 0.12, 说明水稻地下部向地上部输送Cd的能力非常弱;茎-叶转移系数范围为0.31 ~ 0.38,茎-糙米转移系数为0.83 ~ 1.20。与CK相比,C+P(10∶1)处理TF茎-糙米最小,显著降低13.5% (P < 0.05),Cd在茎-糙米中的转运系数越小,表明积累在茎的Cd运输到水稻籽粒中越少。
3 讨论 3.1 NCC与NHAP施用对土壤pH以及有效Cd含量的影响水稻在灌浆期排水落干过程中显著提高了土壤Cd的活性,促进Cd向水稻中的迁移,进而导致水稻籽粒中Cd的含量升高。Wang等[8]的研究表明土壤排水时Cd的活性增加是由于土壤pH降低导致Cd从铁-锰(氢氧)氧化物中释放出来。Chen等[21]的研究也表明当土壤pH从5.5升至6.5后,铁氧化物对Cd的吸附大幅提高,导致土壤排水过程中活性Cd显著减少。因此,在水稻排水阶段提高土壤pH是一种能显著降低水稻Cd吸收的措施。本研究发现C+P(10∶1)处理组在排水期提升pH的效果最好,与CK相比显著提高了7.8%;同时,C+P(10∶1)处理组也能最显著地降低Cd生物有效性,与CK相比显著降低了46.2%。这可能是因为NCC和NHAP本身pH较高、反应活性高、比表面积大,对重金属能产生更强的吸附作用,因此可以更强烈地吸附土壤中的Cd2+并降低其有效性[22]。因此,C+P(10∶1)处理可以通过提升土壤pH和降低Cd活性来减少Cd积累。
3.2 NCC与NHAP施用对水稻根表铁膜吸附Cd的影响根表铁膜是指在厌氧土壤条件下通过根系氧化作用沉积于根表及质外体的铁锰氧化膜,可影响多种元素在水稻体内的吸收与分布[23]。一般普遍认为水稻根表铁膜的形成机理主要是由于淹水条件下Fe2+、Mn2+被水稻根系分泌的氧气和氧化性物质氧化成铁锰氧化物,并在根系氧化酶和铁氧化细菌等共同作用下将根际土壤中的Fe2+氧化后沉积在水稻根表面形成铁膜[24]。当根表铁膜含量变少时,会促进根系对Cd的吸收,当铁膜含量变多时,水稻根部对Cd的吸收减少[25]。
本研究发现除NHAP处理,施用纳米材料后均促进根表铁-锰薄膜的形成,促进作用最佳的是0.4%NCC和C+P(10∶1)处理。由于水稻根际土壤pH的变化对根表铁膜的形成起着至关重要的作用[26],且在水稻成熟期促进作用最大。而本研究发现0.4%NCC和C+P(10∶1)处理在水稻成熟期均保持着较高的土壤pH,使得0.4%NCC和C+P(10∶1)处理水稻根表形成的铁膜含量更多,根表吸附的Cd含量也更多,而根表铁膜能通过吸附沉淀Cd从而阻碍水稻对Cd的吸收转运,因此0.4%NCC和C+P(10∶1)这两种处理能将Cd更多地固定在水稻根系从而减少Cd向水稻地上部的转运。
3.3 NCC与NHAP施用对水稻吸收转运Cd的影响Rossi等[27]认为纳米材料可以通过直接与Cd作用或间接改变土壤特性和植物根系活性来固定Cd,从而抑制植物根系对Cd的吸收。而本研究发现根部富集系数较高且根-茎转移系数较低,说明水稻地下部向地上部输送Cd的能力非常弱,这一现象可归因于NCC表面CaCO3的溶解和随后形成CdCO3沉淀,对重金属Cd2+吸附结合并稳定化[28]。此外,NHAP释放的可溶性磷沉淀并吸附Cd,形成相对稳定的含Cd磷酸盐,从而使Cd转化为稳定形态[29]。两种材料均能快速固定土壤中的Cd并富集在根部。
4 结论1) NHAP能显著提高水稻生物量,而NCC对水稻生物量没有显著影响。
2) 水稻土壤排水落干阶段0.4% NCC、C+P (5∶1)、C+P (10∶1) 3个处理组土壤保持较高pH;除0.4% NHAP处理组外,纳米材料施用均能促进根表铁–锰膜的形成,使大量Cd吸附在根表,降低Cd向地上部迁移。施用纳米材料尤其是C+P(10∶1),可显著降低土壤有效态Cd含量,从而显著降低糙米Cd含量。
3) 本研究认为NCC是一种有效的土壤Cd污染修复材料,且联合施用少量NHAP不仅能有效降低水稻糙米Cd含量,还能提高水稻产量。需要进一步开展田间试验,以全面评估NCC和NHAP在水稻安全生产和重金属稳定化方面的实际效果。
| [1] |
Liu H T, Luo L, Jiang G Y, et al. Sulfur enhances cadmium bioaccumulation in Cichorium intybus by altering soil properties, heavy metal availability and microbial community in contaminated alkaline soil[J]. Science of the Total Environment, 2022, 837: 155879 DOI:10.1016/j.scitotenv.2022.155879 (  0) 0) |
| [2] |
Wang X S, Fu H L, Gong F Y, et al. Lignin side chain region participates in Cd detoxification related to the cultivar-dependent Cd accumulation in Brassica chinensis L[J]. Journal of Hazardous Materials, 2020, 392: 122264 DOI:10.1016/j.jhazmat.2020.122264 (  0) 0) |
| [3] |
中华人民共和国环境保护部. 全国土壤污染状况调查公报[EB/OL]. (2014–04–17). https://www.gov.cn/foot/site1/20140417/782bcb88840814ba158d01.pdf.
(  0) 0) |
| [4] |
Wang Z, Liu W J, Liu J, et al. Differences and mechanism of dynamic changes of Cd activity regulated by polymorphous sulfur in paddy soil[J]. Chemosphere, 2022, 291: 133055 DOI:10.1016/j.chemosphere.2021.133055 (  0) 0) |
| [5] |
Wiggenhauser M, Aucour A M, Bureau S, et al. Cadmium transfer in contaminated soil-rice systems: Insights from solid-state speciation analysis and stable isotope fractionation[J]. Environmental Pollution, 2021, 269: 115934 DOI:10.1016/j.envpol.2020.115934 (  0) 0) |
| [6] |
Zhao M, Liu X W, Li Z T, et al. Inhibition effect of sulfur on Cd activity in soil-rice system and its mechanism[J]. Journal of Hazardous Materials, 2021, 407: 124647 DOI:10.1016/j.jhazmat.2020.124647 (  0) 0) |
| [7] |
Xu M, Hao X L, Xiong Z Q, et al. Soil amendments change bacterial functional genes more than taxonomic structure in a cadmium-contaminated soil[J]. Soil Biology and Biochemistry, 2021, 154: 108126 DOI:10.1016/j.soilbio.2020.108126 (  0) 0) |
| [8] |
Wang J, Wang P M, Gu Y, et al. Iron-manganese (oxyhydro)oxides, rather than oxidation of sulfides, determine mobilization of Cd during soil drainage in paddy soil systems[J]. Environmental Science & Technology, 2019, 53(5): 2500-2508 (  0) 0) |
| [9] |
Xiong L, Wang P, Kopittke P M. Tailoring hydroxyapatite nanoparticles to increase their efficiency as phosphorus fertilisers in soils[J]. Geoderma, 2018, 323: 116-125 DOI:10.1016/j.geoderma.2018.03.002 (  0) 0) |
| [10] |
Chen D Y, Zhu H G, Yang S, et al. Micro-nanocomposites in environmental management[J]. Advanced Materials, 2016, 28(47): 10443-10458 DOI:10.1002/adma.201601486 (  0) 0) |
| [11] |
Omran B A, Baek K H. Control of phytopathogens using sustainable biogenic nanomaterials: Recent perspectives, ecological safety, and challenging gaps[J]. Journal of Cleaner Production, 2022, 372: 133729 DOI:10.1016/j.jclepro.2022.133729 (  0) 0) |
| [12] |
Wu H X, Tong J H, Jia F, et al. Nano hydroxyapatite pre-treatment effectively reduces Cd accumulation in rice (Oryza sativa L. ) and its impact on paddy microbial communities[J]. Chemosphere, 2023, 338: 139567 DOI:10.1016/j.chemosphere.2023.139567 (  0) 0) |
| [13] |
Wu Q H, Jiang X H, Wu H X, et al. Effects and mechanisms of copper oxide nanoparticles with regard to arsenic availability in soil-rice systems: Adsorption behavior and microbial response[J]. Environmental Science & Technology, 2022, 56(12): 8142-8154 (  0) 0) |
| [14] |
Li Y D, Xu R H, Ma C L, et al. Potential functions of engineered nanomaterials in cadmium remediation in soil-plant system: A review[J]. Environmental Pollution, 2023, 336: 122340 DOI:10.1016/j.envpol.2023.122340 (  0) 0) |
| [15] |
刘畅. 电石渣基纳米碳酸钙的制备及吸附重金属的研究[D]. 呼和浩特: 内蒙古工业大学, 2019.
(  0) 0) |
| [16] |
Zhao C C, Ren S X, Zuo Q Q, et al. Effect of nanohydroxyapatite on cadmium leaching and environmental risks under simulated acid rain[J]. Science of the Total Environment, 2018, 627: 553-560 DOI:10.1016/j.scitotenv.2018.01.267 (  0) 0) |
| [17] |
中华人民共和国生态环境部, 国家市场监督管理总局. 土壤环境质量农用地土壤污染风险管控标准(GB15618—2018)[S]. 北京: 中国标准出版社, 2018.
(  0) 0) |
| [18] |
Zheng S, Liao Y L, Xu C, et al. Milk vetch returning reduces rice grain Cd concentration in paddy fields: Roles of iron plaque and soil reducing-bacteria[J]. Chemosphere, 2022, 308: 136158 DOI:10.1016/j.chemosphere.2022.136158 (  0) 0) |
| [19] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000
(  0) 0) |
| [20] |
中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. 食品安全国家标准食品中污染物限量: GB 2762—2012[S]. 北京: 中国标准出版社, 2012.
(  0) 0) |
| [21] |
Chen H P, Wang P, Gu Y, et al. The within-field spatial variation in rice grain Cd concentration is determined by soil redox status and pH during grain filling[J]. Environmental Pollution, 2020, 261: 114151 DOI:10.1016/j.envpol.2020.114151 (  0) 0) |
| [22] |
殷晓春, 思广慧, 师玉卓, 等. 纳米纤维素的改性及其吸附重金属离子的应用研究[J]. 高分子通报, 2019(11): 15-25 (  0) 0) |
| [23] |
Fu Y Q, Yang X J, Ye Z H, et al. Identification, separation and component analysis of reddish brown and non-reddish brown iron plaque on rice (Oryza sativa) root surface[J]. Plant and Soil, 2016, 402(1): 277-290 (  0) 0) |
| [24] |
Liu J G, Cao C X, Wong M, et al. Variations between rice cultivars in iron and manganese plaque on roots and the relation with plant cadmium uptake[J]. Journal of Environmental Sciences, 2010, 22(7): 1067-1072 DOI:10.1016/S1001-0742(09)60218-7 (  0) 0) |
| [25] |
Chang H, Zhou X B, Wang W H, et al. Effects of selenium application in soil on formation of iron plaque outside roots and cadmium uptake by rice plants[J]. Advanced Materials Research, 2013, 750/751/752: 1573-1576 (  0) 0) |
| [26] |
Li S S, Chen S B, Wang M, et al. Iron fractions responsible for the variation of Cd bioavailability in paddy soil under variable pe+pH conditions[J]. Chemosphere, 2020, 251: 126355 DOI:10.1016/j.chemosphere.2020.126355 (  0) 0) |
| [27] |
Rossi L, Sharifan H, Zhang W L, et al. Mutual effects and in planta accumulation of co-existing cerium oxide nanoparticles and cadmium in hydroponically grown soybean (Glycine max (L.) Merr.)[J]. Environmental Science: Nano, 2018, 5(1): 150-157 DOI:10.1039/C7EN00931C (  0) 0) |
| [28] |
Wang S G, Zhou D L, Zhou J B, et al. Cd(Ⅱ) removal by novel fabricated ground calcium carbonate/nano-TiO2 (GCC/TiO2) composite from aqueous solution[J]. Water, Air, & Soil Pollution, 2019, 230(7): 147 (  0) 0) |
| [29] |
Zhao X, Dai J N, Teng Z D, et al. Immobilization of cadmium in river sediment using phosphate solubilizing bacteria coupled with biochar-supported nano-hydroxyapatite[J]. Journal of Cleaner Production, 2022, 348: 131221 DOI:10.1016/j.jclepro.2022.131221 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57


