2. 土壤与农业可持续发展全国重点实验室(中国科学院南京土壤研究所), 南京 211135
多环芳烃(PAHs)是一类由有机物(如石油、天然气、煤炭等)不完全燃烧产生的持久性有机污染物,因其潜在致癌性、致畸性和致突变性受到广泛关注[1]。美国环境保护署(EPA)早于20世纪70年代便将其中16种PAHs列为优先管控污染物。有机污染土壤修复方法包括物理、化学和生物修复方法等,其中,生物修复因环境友好、成本低廉、可原位实施等优势,在绿色修复工程中展现较好的应用前景[2]。
微生物修复技术基于微生物对有机污染物的降解或转化过程来实现土壤污染物的去除或解毒,主要实施手段包括生物刺激、生物强化等。其中,生物刺激是通过添加有机物料等外源营养物来刺激土著降解菌从而促进污染物降解的修复方式[3],避免了外源引入微生物(生物强化)在土壤中存在的定殖难的问题,在实际修复中应用更加广泛。据报道,富含纤维素和木质素的农业废弃物在PAHs污染土壤中具有生物刺激效果[4],如使用菌菇栽培物料可以刺激土著真菌去除土壤中PAHs[5],添加木屑联合植物根系分泌物通过改变土壤微生物群落结构影响PAHs的降解[6]。实际土壤修复往往会耦合植物修复作用,植物根系可以增强土壤通透性,由根系分泌物提供营养而强化根区PAHs的微生物降解也被认为是植物修复有机污染土壤的主要机制[7]。木质素耦合黑麦草能够有效去除土壤老化PAHs[8]。此外,木质素和纤维素材料还可能刺激产木质素降解酶等微生物来共代谢降解PAHs[9]。
废纸回收再利用可以节约资源并保护环境。废纸是一种典型的废弃生物质材料和低成本的木质纤维材料,并含有一定量的有机质、氮、磷、钾等无机元素[10]。目前废纸回收利用方式主要以生产再生纸、焚烧以及作为肥料为主,尚未有关于将纸质废料用于PAHs污染土壤生物修复研究。本研究旨在探索办公室废纸碎料对PAHs污染土壤的修复潜力,通过盆栽试验评估其在土壤修复中的应用效果,分析修复过程中土壤细菌和真菌群落的响应变化,并采用放射性同位素示踪技术探究修复作用机制,研究将为碎纸废料进行PAHs污染土壤修复提供科学依据。
1 材料与方法 1.1 实验材料与化学试剂碎纸废料取自办公室碎纸机粉碎的打印废纸(2 mm ×12 mm),其全碳(TC)含量为354 g/kg,全氮(TN)含量为0.6 g/kg,通过CNS元素分析仪(elementar仪器有限公司,德国)测试;全磷(TP)含量为446.3 mg/kg,全钾(TK)含量为63.77 mg/kg,通过紫外可见光光度计(WFZ UV-200;尤尼柯(上海)仪器有限公司,中国)和火焰光度计(BWB XP;BWB科技有限公司,英国)测定。苯并[a]蒽(BaA,纯度为98%)购自Sigma-Aldrich公司(圣路易斯,密苏里州,美国),14C-BaA(纯度为99%)从美国放射性标记化学品公司(圣路易斯,密苏里州,美国)购买,二氯甲烷、正己烷、环己烷、乙腈等均为试剂纯或更高级别,购自Tedia公司(费尔菲尔德,俄亥俄州,美国)。
1.2 土壤样品土壤样品采自于天津某化工厂PAHs污染地块,样品采集后剔除植物根系和砂砾等杂物,过2 mm网筛混合备用。土壤为壤质土,pH为7.75,采用pH计(310P-49;美国赛默飞)测试;土壤TC含量为45.7 g/kg,TN为1.0 g/kg,TP为566 mg/kg,TK为2.16 mg/kg。土壤中12种EPA优控PAHs的总浓度为738 mg/kg(12种EPA-PAHs:菲(Phe)、蒽(Ant)、荧蒽(Flu)、芘(Pyr)、苯并[a]蒽(BaA)、䓛(ChR)、苯并[b]荧蒽(BbF)、苯并[k]荧蒽(BkF)、苯并[a]芘(BaP)、二苯并[a, h]蒽(DahA)、苯并[g, h, i]芘(BghiP)、茚并[1, 2, 3-cd]芘(lcdP),由于无法稳定回收,PAHs总量分析不包含16种常规EPA-PAHs中的萘(Nap)、苊烯(Ace)、苊(Acy)和芴(Flu))。
1.3 盆栽试验盆栽试验设置3组处理(表 1),每组3个重复。盆栽土壤用量为1 kg/盆,且每盆均加入20 g草炭;种植植物为黑麦草(Lolium multiflorum Lam.),种子使用之前用0.05% 次氯酸纳浸泡10 min,用无菌蒸馏水冲洗8次,温水浸泡过夜后使用,每盆种植10颗种子(约1 g);碎纸废料与草炭的混合添加量为5%(草炭∶碎纸=4∶6)。盆栽试验在日光温室中进行,采用正常盆栽管理模式进行水分管理,试验周期为3个月。试验结束后,收集地上部植物测试生物量;每盆钻取3份土壤混合成代表土样,留取新鲜土样用于土壤微生物群落分析,剩余土样风干后测试PAHs含量。
|
|
表 1 试验设置 Table 1 Experimental setup |
设置土壤微域试验研究无植物条件下碎纸废料对土壤14C-PAHs化学归趋的影响(表 1),包括添加5%碎纸废料的处理(MP)与不加材料的空白对照(MCK)。用1 mL丙酮预先混合非标记BaA和14C-BaA,混液再与1 g土壤进行充分混合制备人工污染土壤,将人工污染土壤放置通风橱过夜使丙酮挥发。待丙酮挥发后,将1 g人工污染土与4 g原始污染土在60 mL矿化管中充分混合。试验土壤中外加BaA终浓度为20 mg/kg,14C-BaA为3.33×103 Bq/管。矿化管用橡胶塞密封,胶塞内部悬挂一个装有1 mol/L NaOH溶液的小管收集培养过程中释放的14C-CO2。土壤调节含水量为最大持水量的60%,置于28 ℃培养箱中黑暗条件下孵育两个月,每周更换新的NaOH收集管动态监测培养过程中土壤释放的14C-CO2。
1.5 土壤中PAHs提取土壤风干后,称取0.5 g土样用60 mL二氯甲烷进行索氏提取(24 h),提取液经30 ℃旋转蒸发后用2 mL环己烷溶解,取0.5 mL环己烷溶液过C18固相萃取柱进行净化处理,用5 mL洗脱液(正己烷∶二氯甲烷=1∶1)进行洗脱处理。洗脱液用氮气吹至净干,再用5 mL乙腈溶解,最后取1 mL溶解物过0.22 μm有机滤膜后,采用高效液相色谱(HPLC)分析(Prominence UFLC XR;岛津仪器公司,日本)测试土壤中PAHs。对于包含14C-PAHs的土样,经由上述步骤提取后提取物采用液体闪烁分析仪(LSC,LS 6500, 贝克曼库尔特)监测可提取态的放射性量。由NaOH吸收的14C-CO2放射性量采用LSC进行测试[11]。结合态残留(Non-extractable residues, NER)的放射性量通过总量扣减可提取态和14C-CO2的放射性量得到。
1.6 DNA提取和高通量测序采用FastDNA® SPIN Kit for Soils试剂盒(MP Biomedicals, 俄亥俄州,美国)提取土壤(0.5 g)DNA,使用60 µL DES溶解DNA,保存于-20 ℃备用。DNA样品送至美吉公司(上海,中国),在Illumina MiSeq测序平台完成土壤微生物测序工作。细菌和真菌的扩增分别采用含5-bp条形码标记的515f/907r和ITS1F/ITS2R引物对进行测序分析。采用默认参数的QIIME2流程对高通量数据进行分析,使用UCLUST基于97% 序列同一性的阈值分配操作分类单位(OTU),通过分类器PLIVA-132与16S rRNA和ITS rRNA数据库进行比对归类。
1.7 数据处理使用单因素方差分析(ANOVA)和Duncan的多重范围检验评估处理之间的差异,包括PAHs残存量、PAHs归趋和微生物多样性,P<0.05显著。使用独立样本t检验进行两两比较,数据统计分析在SPSS 20中完成。微生物的α多样性(Shannnon指数)、微生物相对丰度、基于Bray-Curtis距离的非度量多维尺度分析(NMDS)和冗余分析(RDA)采用R语言(v.4.1.0)vegan包进行计算,相关性热图使用pheatmap包进行绘制。
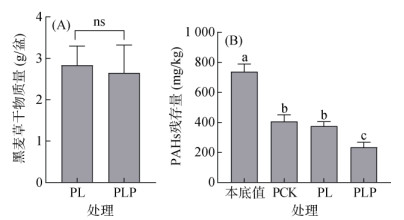
2 结果与讨论 2.1 纸质废料对土壤PAHs的降解效果不同处理下黑麦草的生物量如图 1A所示,种植黑麦草的PL处理和种植黑麦草耦合碎纸废料的PLP处理,其黑麦草地上干物质量没有显著差异。不同处理对土壤PAHs的降解影响如图 1B所示,试验土本底PAHs含量为738 mg/kg,培养3个月后,PCK处理的PAHs残存量降低至407 mg/kg,与本底值相比,残存量显著降低了44.8%(P < 0.05)。仅种植黑麦草的PL处理,PAHs残存量进一步降低至376 mg/kg,相较于本底值下降了49.0%,但与PCK处理相比无显著差异。而种植黑麦草耦合碎纸废料的PLP处理下,土壤PAHs残存量显著减少至235 mg/kg,较本底值下降68.1%,降解效果显著高于PL处理近20% (P < 0.05)。此外,各处理对不同环数PAHs的降解效果也有所差异(表 2)。与本底值相比,PCK、PL和PLP处理均能够显著降低4环、5环和6环PAHs的含量(P < 0.05)。在PCK、PL和PLP处理之间,三者对分环PAHs的降解效果明显呈依次递增关系。与PCK处理相比,PL处理显著降低了芘、苯并[a]蒽和䓛等4环PAHs,PLP处理显著降低了芘、苯并[a]蒽和䓛等4环PAHs以及苯并[b]荧蒽、苯并[k]荧蒽和苯并[a]芘等5环PAHs(P < 0.05)。
|
(图中小写字母不同表示处理间差异显著(P < 0.05),相同字母和ns表示没有显著差异;下同) 图 1 不同处理黑麦草干物质量(A)和PAHs的含量(B) Fig. 1 Dry weights of ryegrass (A) and total PAH concentrations (B) in soils under different treatments |
|
|
表 2 不同处理土壤中PAHs含量(mg/kg) Table 2 PAHs concentrations in soils under different treatments |
在盆栽试验中,与土壤本底值相比,不同处理土壤中PAHs均有一定程度的降解。由于该试验用土为高污染场地土,其本身具有较高的PAHs含量而极易被微生物降解,因而使PCK和PL处理在整体上并没有表现出差异(图 1B)。3环以上的高分子量PAHs(HMW-PAHs)在原土的本底值以及PCK处理中的残留量均很高(表 2),而PL和PLP处理HMW-PAHs的残存量显著低于前两者。沈其荣等[12]研究表明,在高污染土壤中种植黑麦草可以通过根际过程显著促进3环以上PAHs的降解,并且在修复过程中黑麦草本身会吸收累积污染物而达到去除环境污染物的效果[13],本试验结果与此相似,PL处理对4环PAHs降解效果显著。与PCK处理相比,PLP处理对4环和5环PAHs的降解效果显著,这与Haritash等[14]研究结果相似,添加含有木质素的废弃物,在共代谢底物存在的情况下,可以对4环以上的PAHs进行有效的生物降解。
2.2 纸质废料对土壤化学性质的影响相较于PCK处理,PLP处理显著提高了土壤中TK和TP的含量,分别增加了1.85% 和35%(P < 0.05,表 3)。此外,PL和PLP处理也显著影响了土壤的pH,其中PL处理提高了土壤pH,而PLP处理则降低了pH(P < 0.05)。然而,各处理对土壤中TC和TN含量的影响并不显著。本研究结果与之前的研究一致,例如何艳明等[15]研究显示,造纸泥浆可以作为酸性土壤改良剂,并在一定范围内调节土壤酸碱度至适宜植物生长的pH范围内;王传贵等[16]研究表明,造纸泥浆中含有氮、磷、钾等矿物质,在土壤中施加造纸泥浆可以提升土壤中磷、钾的有效性,提升土壤的肥效。
|
|
表 3 不同处理土壤化学性质 Table 3 Soil chemical properties under different treatments |
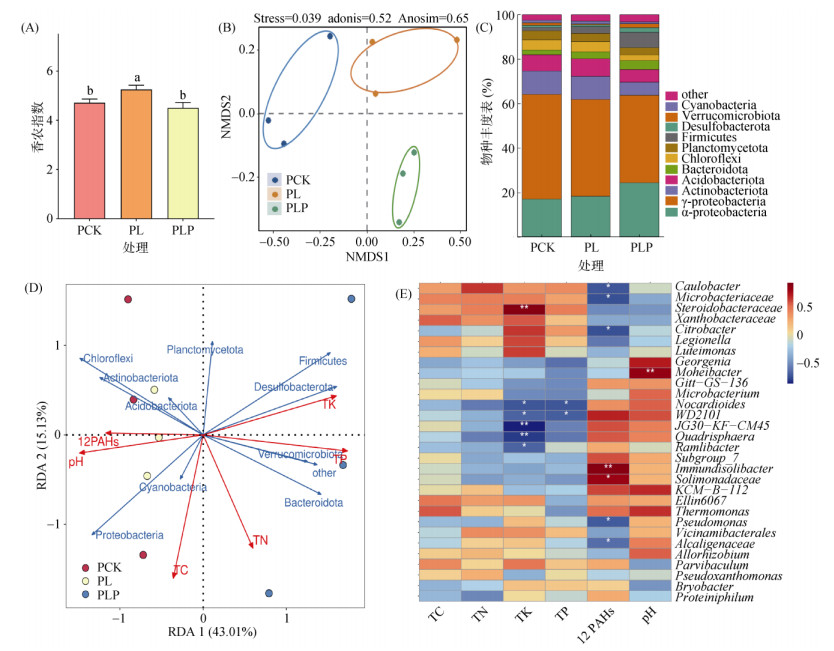
与PCK处理相比,PL处理显著提高了土壤细菌α多样性指数(P < 0.05),PLP处理下细菌多样性又恢复到PCK水平(图 2A,P < 0.05)。不同处理对土壤细菌群落结构产生了显著影响(图 2B,adonis:R2 = 0.52,P < 0.05;ANOSIM:R = 0.78,P < 0.05)。该结果与Hou等[17]的研究结果相似,即改良剂的添加提升对污染物的去除率与微生物多样性无关,主要与特定降解微生物群落有关。土壤中优势菌群为变形菌门(Proteobacteria,60.5% ~ 64.1%)、放线菌门(Actinobacteria,7.1% ~ 10.5%)、酸杆菌门(Acidobacteria,6.7% ~ 7.4%)、拟杆菌门(Bacteroidota,2.0% ~ 5.0%)和厚壁菌门(Firmicutes,1% ~ 8%),总占比为83.4% 以上(图 2C)。采用冗余分析(RDA)评估环境因素对土壤细菌门群落组成的影响,第一轴与第二轴共同解释了环境因素对细菌群落结构分异的58.14%,其中细菌群落在第一轴的分异主要与TK、TP、pH、∑PAHs相关联,PAHs含量又与TK、TP呈显著负相关。具体到优势菌门,拟杆菌门、厚壁菌门和硫酸盐还原菌门相对丰度与土壤TP和TK呈正相关,与∑PAHs呈负相关(图 2D)。Spearman等级相关性(属水平)结果表明,土壤变形菌门的Caulobacter、Steroidobacteraceae、Xanthobacteraceae、Citrobacter、Legionella、Luteimonas、Pseudoxanthomonas、Alcaligenaceae等属与土壤TK、TP呈正相关,同时与土壤PAHs含量呈负相关关系(图 2E),表明这些细菌类群在纸质碎料处理下对土壤PAHs具有潜在降解作用。
|
(A. α多样性;B. 群落组成NMDS分析;C.物种丰度(门水平);D. 冗余分析(门水平);E.相关性热图(属水平)。图E中*、**表示相关性达P < 0.05、P < 0.01显著水平;下图同) 图 2 不同处理土壤中细菌群落结构变化 Fig. 2 Soil bacterial community compositions under different treatments |
Jurelevicius等[18]的研究证明变形菌门中的革兰氏阴性菌可以降解石油烃,并且Pseudomonas、Citrobacter和Alcaligenaceae的细菌在多环芳烃污染场地中富集,具有PAHs降解能力[19]。拟杆菌门是革兰氏阴性异养细菌,在生态系统中较为常见。Drury等[20]研究证明拟杆菌可以降解高分子量有机化合物,包括石油烃等,并且拟杆菌门的部分细菌对生物大分子具有破坏能力,能够有效地分解有机残体,其可能与纸质碎料的分解相关[21]。厚壁菌门的细菌通常是生长在富含木质素的环境中,Ahmad等[22]的研究表明它们能通过产生特定的酶来分解木质素作为碳源进而生长和繁殖,这就使得厚壁菌门的细菌在生物降解木质素的过程中起到了关键作用,在纸质碎料处理组中厚壁菌门的相对丰度高于其他措施组。
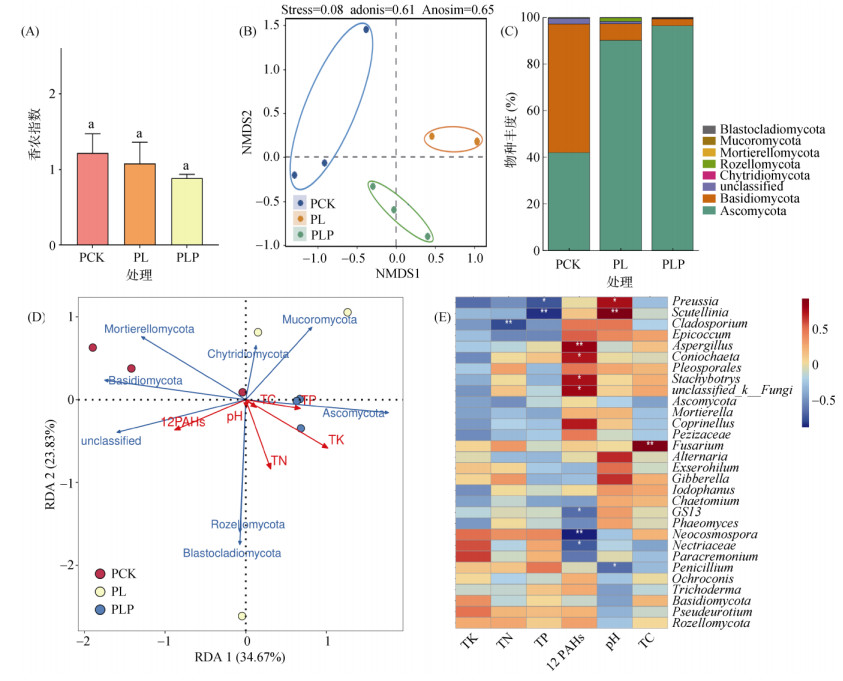
2.4 纸质废料处理对土壤真菌群落结构的影响不同处理下的土壤真菌α多样性指数没有显著差异(图 3A)。与细菌类似,各处理对真菌群落结构也产生了显著影响(图 3B,adonis:R2 = 0.61,P < 0.05;ANOSIM:R = 0.65,P < 0.05)。土壤中的优势真菌门为子囊菌门(Ascomycota,42% ~ 96.5%)和担子菌门(Basidiomycota,3% ~ 55.3%)(图 3C)。RDA结果表明,土壤PAHs和TP是导致真菌群落结构分异的两个主要因素,并呈负相关关系,子囊菌门与TP含量呈现正相关关系(图 3D)。子囊菌门下Neocosmospora、Nectriaceae、Paracremonium属与土壤TP呈正相关,与PAHs含量呈负相关(图 3E),可能提示这些真菌在降解HMW-PAHs方面的潜力[23]。Wu等[24]研究也表明,将富含木质素、纤维素的混合物添加到土壤中能刺激真菌的生长,进而增强微生物对土壤PAHs的降解。
|
(A. α多样性;B. 群落组成NMDS分析;C. 物种丰度(门水平);D. 冗余分析(门水平);E. 相关性热图(属水平)) 图 3 不同处理土壤中真菌群落结构变化 Fig. 3 Soil fungal community compositions under different treatments |
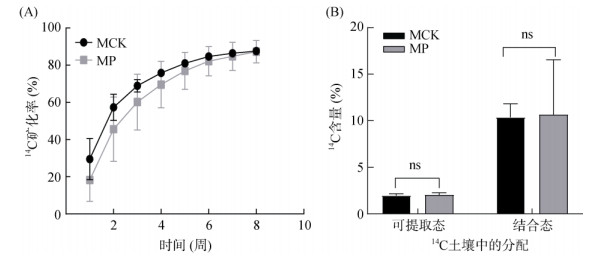
研究采用同位素示踪技术来分析BaA在不同处理下的环境归趋,有机污染物矿化和结合态残留形成都是由微生物主导的污染物去除过程[25]。研究发现,供试土壤具有非常强的PAHs降解能力,2个月的培养周期内14C-BaA主要以微生物矿化的形式而释放(图 4A),自然衰解(MCK)的矿化率高达87.7%,纸质碎料处理(MP)没有进一步提高PAHs的矿化,同时也没有显著影响污染物在土壤中的吸附和结合态形成过程(图 4B)。Zhu等[26]研究表明,在进行14C-BaA的矿化试验时,发现使用木质素相关底物(秸秆、菇渣等)对矿化速率影响不大,并且也没有显著促进污染物在土壤中的吸附和结合态的形成。本试验土壤为高污染场地土壤,其土著微生物本身就能高效降解污染物[27],这可能也是导致修复材料无法进一步促进污染物降解的原因。同时,该结果可能也提示添加纸质碎料刺激土壤中污染物降解需要植物参与。土壤根际修复是植物修复有机污染土壤的主要作用机理,它通过根系分泌刺激微生物降解活性从而提高有机污染物的去除效率[28]。
|
(A:2个月培养过程累积14C-CO2的释放量;B:土壤中14C-BaA的提取态与结合态残存量分布) 图 4 土壤中14C-BaA的环境归趋 Fig. 4 Environmental fate of 14C-BaA in soil |
本文探讨了利用纸质碎料作为土壤改良剂修复PAHs污染土壤的效果,通过盆栽试验明确了纸质碎料耦合黑麦草处理能够有效促进土壤中PAHs的降解,该处理虽然没有促进植物生长,但显著提高了土壤全磷和全钾的含量并改变了土壤微生物群落组成。基于与PAHs浓度、土壤磷钾养分的相关性分析,揭示了细菌变形菌门和真菌子囊菌门类群在该土壤修复过程中可能发挥了主要降解功能。14C同位素示踪试验表明纸质碎料并没有显著影响土著微生物高效的PAHs降解过程,同时提示该材料在实际土壤修复应用中需耦合植物修复。
| [1] |
Lerda D. Polycyclic aromatic hydrocarbons (PAHs) factsheet[R]. Joint Research Centre, Technical notes, 2011, 27.
(  0) 0) |
| [2] |
Kuppusamy S, Thavamani P, Venkateswarlu K, et al. Remediation approaches for polycyclic aromatic hydrocarbons (PAHs) contaminated soils: Technological constraints, emerging trends and future directions[J]. Chemosphere, 2017, 168: 944-968 DOI:10.1016/j.chemosphere.2016.10.115 (  0) 0) |
| [3] |
Han X M, Hu H W, Shi X Z, et al. Effects of different agricultural wastes on the dissipation of PAHs and the PAH-degrading genes in a PAH-contaminated soil[J]. Chemosphere, 2017, 172: 286-293 DOI:10.1016/j.chemosphere.2017.01.012 (  0) 0) |
| [4] |
Singh R, Chauhan M. Effective management of agro- industrial residues as composting in mushroom industry and utilization of spent mushroom substrate for bioremediation[M].
IGI Global, Toxicity and Waste Management Using Bioremediation. Hershey, PA, 2016: 158-177
(  0) 0) |
| [5] |
Cébron A, Beguiristain T, Bongoua-Devisme J, et al. Impact of clay mineral, wood sawdust or root organic matter on the bacterial and fungal community structures in two aged PAH-contaminated soils[J]. Environmental Science and Pollution Research, 2015, 22(18): 13724-13738 DOI:10.1007/s11356-015-4117-3 (  0) 0) |
| [6] |
Wu Y C, Ding Q M, Zhu Q H, et al. Contributions of ryegrass, lignin and rhamnolipid to polycyclic aromatic hydrocarbon dissipation in an arable soil[J]. Soil Biology and Biochemistry, 2018, 118: 27-34 DOI:10.1016/j.soilbio.2017.11.022 (  0) 0) |
| [7] |
Gitipour S, Sorial G A, Ghasemi S, et al. Treatment technologies for PAH-contaminated sites: A critical review[J]. Environmental Monitoring and Assessment, 2018, 190(9): 546 DOI:10.1007/s10661-018-6936-4 (  0) 0) |
| [8] |
García-Sánchez M, Košnář Z, Mercl F, et al. A comparative study to evaluate natural attenuation, mycoaugmentation, phytoremediation, and microbial- assisted phytoremediation strategies for the bioremediation of an aged PAH-polluted soil[J]. Ecotoxicology and Environmental Safety, 2018, 147: 165-174 DOI:10.1016/j.ecoenv.2017.08.012 (  0) 0) |
| [9] |
Wu Y C, Teng Y, Li Z G, et al. Potential role of polycyclic aromatic hydrocarbons (PAHs) oxidation by fungal laccase in the remediation of an aged contaminated soil[J]. Soil Biology and Biochemistry, 2008, 40(3): 789-796 DOI:10.1016/j.soilbio.2007.10.013 (  0) 0) |
| [10] |
刘琳, 张安龙, 罗清, 等. 造纸固体废弃物的性质与资源化利用[J]. 中国造纸, 2015, 34(6): 52-58 (  0) 0) |
| [11] |
Whiteley A S, Bailey M J. Bacterial community structure and physiological state within an industrial phenol bioremediation system[J]. Applied and Environmental Microbiology, 2000, 66(6): 2400-2407 DOI:10.1128/AEM.66.6.2400-2407.2000 (  0) 0) |
| [12] |
高彦征, 凌婉婷, 朱利中, 等. 黑麦草对多环芳烃污染土壤的修复作用及机制[J]. 农业环境科学学报, 2005, 24(3): 498-502 DOI:10.3321/j.issn:1672-2043.2005.03.018 (  0) 0) |
| [13] |
Sung K, Corapcioglu M Y, Drew M C, et al. Plant contamination by organic pollutants in phytoremediation[J]. Journal of Environmental Quality, 2001, 30(6): 2081-2090 DOI:10.2134/jeq2001.2081 (  0) 0) |
| [14] |
Haritash A K, Kaushik C P. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): A review[J]. Journal of Hazardous Materials, 2009, 169(1/2/3): 1-15 (  0) 0) |
| [15] |
何艳明, 江渝, 袁庆波, 等. 造纸废水治理工程实践与污泥资源化利用技术研究[J]. 云南冶金, 2005, 34(1): 56-60 (  0) 0) |
| [16] |
王传贵, 江泽慧, 刘贤淼, 等. 造纸污泥资源化利用研究进展[J]. 中国造纸, 2009, 28(1): 64-68 (  0) 0) |
| [17] |
Hou J Y, Liu W X, Wang B B, et al. PGPR enhanced phytoremediation of petroleum contaminated soil and rhizosphere microbial community response[J]. Chemosphere, 2015, 138: 592-598 DOI:10.1016/j.chemosphere.2015.07.025 (  0) 0) |
| [18] |
Jurelevicius D, Alvarez V M, Marques J M, et al. Bacterial community response to petroleum hydrocarbon amendments in freshwater, marine, and hypersaline water- containing microcosms[J]. Applied and Environmental Microbiology, 2013, 79(19): 5927-5935 DOI:10.1128/AEM.02251-13 (  0) 0) |
| [19] |
Cerniglia C E. Biodegradation of polycyclic aromatic hydrocarbons[J]. Current Opinion in Biotechnology, 1993, 4(3): 331-338 DOI:10.1016/0958-1669(93)90104-5 (  0) 0) |
| [20] |
Drury B, Rosi-Marshall E, Kelly J J. Wastewater treatment effluent reduces the abundance and diversity of benthic bacterial communities in urban and suburban rivers[J]. Applied and Environmental Microbiology, 2013, 79(6): 1897-1905 DOI:10.1128/AEM.03527-12 (  0) 0) |
| [21] |
Lydell C, Dowell L, Sikaroodi M, et al. A population survey of members of the Phylum Bacteroidetes isolated from salt marsh sediments along the east coast of the United States[J]. Microbial Ecology, 2004, 48(2): 263-273 DOI:10.1007/s00248-003-1068-x (  0) 0) |
| [22] |
Ahmad M, Taylor C R, Pink D, et al. Development of novel assays for lignin degradation: Comparative analysis of bacterial and fungal lignin degraders[J]. Molecular BioSystems, 2010, 6(5): 815-821 DOI:10.1039/b908966g (  0) 0) |
| [23] |
吴宇澄, 林先贵. 多环芳烃污染土壤真菌修复进展[J]. 土壤学报, 2013, 50(6): 1191-1199 (  0) 0) |
| [24] |
Sun Y, Liu L M, Zeng J, et al. Enhanced cometabolism of benzo(a)anthracene by the lignin monomer vanillate is related to structural and functional responses of the soil microbiome[J]. Soil Biology and Biochemistry, 2020, 149: 107908 DOI:10.1016/j.soilbio.2020.107908 (  0) 0) |
| [25] |
Kästner M, Nowak K M, Miltner A, et al. Classification and modelling of nonextractable residue (NER) formation of xenobiotics in soil–A synthesis[J]. Critical Reviews in Environmental Science and Technology, 2014, 44(19): 2107-2171 DOI:10.1080/10643389.2013.828270 (  0) 0) |
| [26] |
Zhu Q H, Wu Y C, Zeng J, et al. Influence of organic amendments used for benz [a] anthracene remediation in a farmland soil: Pollutant distribution and bacterial changes[J]. Journal of Soils and Sediments, 2020, 20(1): 32-41 DOI:10.1007/s11368-019-02368-6 (  0) 0) |
| [27] |
郭瑾, 葛蔚, 柴超, 等. 化学工业区周边土壤中多环芳烃含量、来源及健康风险评估[J]. 环境化学, 2018, 37(2): 296-309 (  0) 0) |
| [28] |
Segura A, Ramos J L. Plant–bacteria interactions in the removal of pollutants[J]. Current Opinion in Biotechnology, 2013, 24(3): 467-473 (  0) 0) |
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China
 2025, Vol. 57
2025, Vol. 57


