2. 中国科学院大学, 北京 100049
农作物秸秆是农业生产的重要生物资源[1]。随着农业生产集约化经营和对作物产量需求的增加,秸秆产量也在迅速增加[2]。然而,由于秸秆中木质纤维素含量较高,微生物难以降解利用[3],大量秸秆被当作废弃物抛弃、掩埋或焚烧。这不仅造成大量资源浪费,还带来了严重的环境污染[4]。近年来,我国许多地区开始采用的秸秆还田方法,逐渐取代了传统的焚烧处理方式,成为作物秸秆处理的一种常见做法[5]。
许多研究表明,秸秆还田不仅能提高土壤中有机碳(SOC)的含量,还能调控土壤的生化反应,对土壤微生物群落结构也有重要影响[6-7]。郭勇等[8]在稻麦轮作系统中发现,秸秆还田能显著提高土壤全氮(TN)含量,促进土壤微生物的活性和生长。此外,高碳氮比(C/N)的秸秆可以促进土壤微生物对铵态氮(NH4+-N)和硝态氮(NO3–-N)的同化,从而影响土壤养分循环[9]。然而,秸秆直接还田也可能带来一些负面影响,如携带一些病原菌滋生病虫害[10],秸秆的高C/N还会导致土壤酸化等问题[11-12]。大量研究表明,秸秆堆肥还田能有效解决上述问题,堆肥后的秸秆有机肥含有大量的优势功能菌,有利于改善土壤内部的微生态[13]。此外,秸秆堆肥还田后,能促进土壤中养分循环,提高作物产量[14]。因此,秸秆堆肥后还田能够实现减少危害、提高土壤肥力、提高作物产量和促进土壤生态系统绿色可持续发展的多重目标。
目前秸秆堆肥的方法有很多,包括秸秆与家禽畜粪混合堆肥[15]、秸秆与污泥混合堆肥[16],以及秸秆接种微生物菌剂堆肥[17]等。虽然秸秆与畜粪和污泥等混合堆肥能够提供外源氮,促进堆肥过程,但在此过程中会排放大量的温室气体(CO2、CH4和N2O)和氨气(NH3),从而给环境带来二次污染[18-19]。相比之下,秸秆接种微生物堆肥被认为是一种更加绿色环保可持续的堆肥方式[20]。Gou等[21]研究发现,在稻草与畜粪堆肥中接种复合微生物菌剂,不仅促进了秸秆木质纤维素的降解,还提高了堆肥的质量。在所有微生物中,白腐真菌对木质纤维素的降解能力最强,其菌丝能渗透到有机物的细胞腔内,产生降解木质纤维素的胞外酶,最终将木质素分解成CO2和H2O[22-23]。Du等[24]研究表明,接种真菌 Phanerochaete chrysosporium 和 Aspergillus niger 的秸秆,不仅能显著减少降解时间,增强堆肥的稳定性,还能减少氮损失。
土壤微生物是土壤养分循环的重要参与者。外源有机物料的添加会改变土壤理化性质,进而影响土壤微生物群落结构和多样性[25]。Wu等[6]通过5年的秸秆还田试验发现,秸秆还田能显著提高土壤氮含量,但显著降低了细菌群落的多样性。冯海玮等[26]通过秸秆堆肥盆栽试验发现,添加秸秆堆肥不仅显著提高了土壤TN、NH4+-N和NO3–-N含量以及蔬菜产量,还改善了土壤微生物群落结构。然而接种真菌后堆制的堆肥对土壤肥力、作物产量和土壤微生物群落结构和多样性的影响还有待研究。
基于以上,本研究旨在探讨玉米秸秆接种真菌后堆制的堆肥对土壤肥力、小麦生物量以及微生物群落结构的影响,为促进作物秸秆资源化、提高小麦产量提供科学依据。本研究的假设包括:①秸秆接种真菌后堆制的堆肥能够促进土壤微生物氮的积累,进而提高土壤肥力、增加小麦产量;②秸秆接种真菌后堆制的堆肥能够改善土壤微生物群落的结构组成,有助于促进土壤生态系统的健康发展。
1 材料与方法 1.1 供试土壤与玉米秸秆试验土壤采自中国黑龙江省齐齐哈尔市的小麦–大豆轮作旱地农田(123°41′E,47°16′N)。土壤风干、过5 mm筛,除去大石块和粗根,充分混合均匀后备用。土壤基本性质见表 1。
|
|
表 1 供试土壤的基本性质 Table 1 Basic properties of soil for pot experiment |
供试玉米秸秆采集自扬州市江都区的玉米田,并用多功能粉碎机粉碎成约2 cm。对玉米秸秆进行接种和不接种真菌堆制堆肥。接种的真菌为黄孢原毛平革菌(Phanerodontia chrysosporium)和黑曲霉(Aspergillus niger),这两株真菌均购自中国普通微生物菌种保藏管理中心,保藏号为CGMCC 5.776和CGMCC 3.11455。真菌接种量为2 g/kg玉米秸秆(基于烘干基)。接种真菌由 Phanerodontia chrysosporium 与 Aspergillus niger 按1∶1的比例混合而成。在玉米秸秆堆肥过程中,每两周翻动一次,以确保玉米秸秆的均匀降解。堆制42 d腐熟后,玉米秸秆接种真菌堆肥和玉米秸秆未接种真菌堆肥基本性质见表 2。试验所用不同预处理玉米秸秆形态见图 1。
|
|
表 2 不同预处理玉米秸秆基本性质 Table 2 Properties of differently pretreated maize straws |

|
图 1 不同预处理玉米秸秆照片:原始玉米秸秆(A)、玉米秸秆未接种真菌堆肥(B)和玉米秸秆接种真菌堆肥(C) Fig. 1 Images of differently pretreated maize straws: Original maize straws (A); Composted maize straws under no fungi inoculation (B); Composted maize straws under fungi inoculation (C) |
在小麦季(2022年11月—2023年5月)进行盆栽试验。试验共设置4个处理:无外源秸秆添加(CK)、添加原始玉米秸秆(S)、添加玉米秸秆未接种真菌堆肥(SC)和添加玉米秸秆接种真菌堆肥(SCPA)。每个处理3个重复,盆栽位置随机摆放。
试验时,每盆装风干土5.0 kg,每盆种植10粒小麦(Triticum aestivum L., cv. 济麦22),待小麦发芽后,挑选高度相近的麦苗,每盆保留6株麦苗。不同外源预处理玉米秸秆根据3 000 kg/hm2的原始玉米秸秆还田量施加到盆栽土壤中,所有处理的外源碳施加量相同(C 4 g/盆,相当于C 1 314 kg/hm2)。其中,S处理玉米秸秆施加量为3 000 kg/hm2,SC处理玉米秸秆未接种真菌堆肥施加量为3 112 kg/hm2,SCPA处理玉米秸秆接种真菌堆肥施加量为3 571 kg/hm2。不同外源预处理玉米秸秆在小麦生育期分3个阶段施加,基肥期施加量为30%(2022年11月12日),分蘖期施加量为40%(2023年3月7日),抽穗期施加量为30%(2023年4月4日)。第一次施加时,将秸秆或秸秆堆肥与土壤充分混匀后装盆;第二和第三次施加时,在不扰动小麦根系的前提下,从每盆中取约800 g土壤,与不同外源预处理玉米秸秆充分混合后,再倒入小麦盆栽中。各处理无机氮施用量一致(N 0.45 g/盆,相当于N 180 kg/hm2),按3∶4∶3的比例分别在基肥期(2022年11月12日)、分蘖期(2023年3月7日)和抽穗期(2023年4月4日)施加。磷肥(P2O5,75 kg/hm2)和钾肥(K2O,75 kg/hm2)以基肥方式施加。供试肥料分别为尿素、磷酸二氢钠和氯化钾。施加肥料时,将肥料溶解于200 mL去离子水中,均匀喷洒在土壤表面。
1.3 样品采集与土壤理化性质的测定在小麦成熟后,收割小麦样品(2023年5月23日),烘干后脱粒,计生物量等。在小麦收割后,采集土壤样品,用直径为3 cm的不锈钢土钻采集0 ~ 15 cm土壤样品3个,充分混合形成1个土壤样品。新鲜样品过2 mm筛后,部分土壤样品保存于–4 ℃冰箱,用于测定土壤NH4+-N、NO3–-N、微生物生物量氮(MBN)和微生物生物量碳(MBC);部分土壤样品保存于–80 ℃冰箱,用于提取土壤总DNA;剩余的土壤样品风干保存,以供后续土壤理化分析。
其中,土壤pH采用pH计(Mettler Toledo Seven Compact S210,Switzerland)以1∶2.5土液比(m/V)测定;土壤含水量采用烘干法测定。土壤NH4+-N和NO3–-N含量采用靛酚蓝比色法和双波长法测定[27]。土壤MBN和MBC采用氯仿熏蒸法测定[28]。土壤可溶性有机碳(DOC)和总可溶性氮(TDN)采用TOC元素分析仪(Multi N/C 3100,Germany)测定。土壤SOC采用H2SO4-K2Cr2O7消解法测定,TN采用凯氏定氮法测定,碱解氮(AN)采用碱解扩散法测定,全钾(TK)采用H2SO4-HF消煮–火焰光度法测定,全磷(TP)采用酸溶–钼锑抗比色法测定[29]。
1.4 土壤DNA提取与高通量测序称取0.25 g冻干土样,使用FastDNA® SPIN Kit for Soil(MP Biomedicals,Santa Ana,CA)提取土壤样品总DNA,用NanoDrop微量分光光度计(NanoDrop Technologies,USA)测定提取的DNA纯度,并通过0.8% 琼脂糖凝胶电泳检验提取的DNA质量。将合格的DNA样品保存在–80 ℃冰箱,以便进一步分析。
采用荧光定量PCR检测96孔板中细菌(16S rRNA)和真菌(18S rRNA)的丰度。每个qPCR反应混合物均由10 µL TB Green®Premix Ex Taq™(Takara Bio,Japan)、1 µL模板DNA、0.75 µL上下游引物和7.5 µL ddH2O组成。荧光定量PCR扩增条件:95 ℃预变性3 min;95 ℃变性10 s,56 ℃退火30 s,72 ℃延伸20 s,循环35次。溶解曲线65 ~ 90 ℃,每隔5 s增加0.5 ℃。每个qPCR过程均设置标准曲线,标准原液按10倍梯度进行稀释。扩增效率在98% ~ 110%,标准曲线的R2值在0.993 ~ 0.999。采用细菌通用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')对细菌16S rRNA基因的V3 ~ V4区进行扩增。采用真菌通用引物ITS1F (5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R (5′-GCTGCGTTCTTCATCGATGC-3′) 对真菌ITS1基因进行扩增。后续的高通量测序委托上海派森诺生物科技有限公司用Illumina MiSeq PE250测序技术平台进行序列测序。
1.5 数据处理与分析使用SPSS 22.0进行土壤理化性质、小麦生物量和微生物群落结构的单因素方差分析(One-way ANOVA),并在显著性水平为P < 0.05时采用Duncan法进行多重比较。小麦生物量和土壤理化性质的相关性计算为Pearson相关系数。使用R 4.3.1进行Mantel检验,分析土壤理化性质(作为环境变量)与土壤细菌和真菌群落组成(以相对丰度为物种数据)之间的相关性,使用microeco包进行α、β多样性分析和微生物群落组成分析。图形绘制采用Origin 2023。所有的数据均基于土壤风干基计算。
2 结果与分析 2.1 不同预处理秸秆施用对土壤性质和小麦生物量的影响不同处理下土壤性质如表 3所示。添加不同预处理的玉米秸秆(S、SC和SCPA)显著降低了土壤NH4+-N含量,其中,与CK处理相比,SCPA处理显著降低了NH4+-N含量达80.8%。与CK处理相比,S、SC和SCPA处理显著降低了土壤NO3–-N含量,而S、SC和SCPA处理间无显著差异。添加不同预处理的玉米秸秆均显著提高了土壤MBN含量,其中SCPA处理MBN含量最高,为24.54 mg/kg,与CK处理相比,相当于提高了土壤中氮同化量达到39.6 kg/hm2。土壤MBC含量处理间差异与MBN具有相同趋势,SCPA处理MBC含量最高,为152.89 mg/kg。此外,与CK处理相比,SC和SCPA处理分别显著提高了土壤TN含量4.9% 和7.4%,以及SOC含量7.3% 和5.7%。与CK处理相比,SCPA处理显著提高了土壤中DOC含量,而S和SC处理的土壤DOC含量无显著差异。此外,与CK处理相比,S处理显著降低了土壤pH。
|
|
表 3 小麦收获期不同处理土壤微生物和理化性质 Table 3 Soil microbial and physiochemical properties under different treatments at wheat harvest stage |
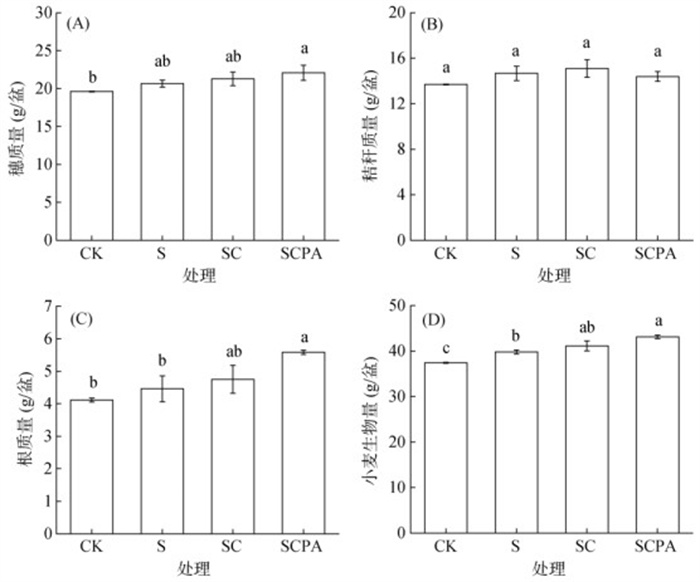
不同处理下小麦的生物量如图 2所示。与CK处理相比,SCPA处理显著提高了小麦穗质量12.7%,根质量35.8% 和总生物量15.3%;S和SC处理则显著提高了小麦的总生物量。与S处理相比,SCPA处理显著提高了小麦的根质量和总生物量;而SCPA处理与SC处理间各生物量指标间无显著差异。
|
(图中不同小写字母表示处理间差异显著(P < 0.05) 图 2 不同处理下小麦的生物量 Fig. 2 Wheat biomass under different treatments |
对不同外源预处理玉米秸秆添加下的土壤细菌和真菌的α多样性进行分析,结果发现,SCPA处理的细菌Chao1和Observed species指数显著低于其他处理;SCPA处理的真菌Chao1、Observed species和Shannon指数显著高于S和SC处理(表 4)。
|
|
表 4 不同处理下土壤细菌和真菌的α多样性指数 Table 4 diversities of soil bacteria and fungi under different treatments |
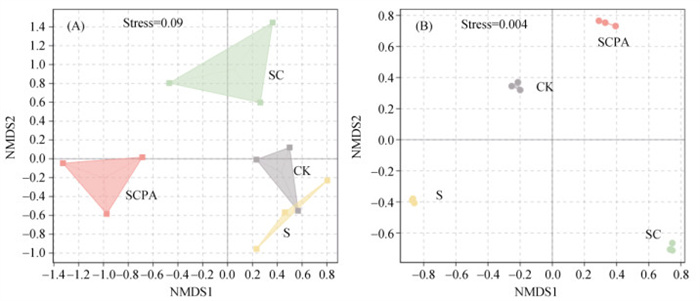
通过非度量多维尺度分析(Non-metric Multidimensional Scaling,NMDS)发现,不同处理下土壤细菌和真菌群落结构差异显著(Stress < 0.1)(图 3)。对于土壤细菌群落,S和CK处理聚集并与SC和SCPA处理显著分离,且SC和SCPA处理沿NMDS2轴分布(图 3A)。对于土壤真菌群落结构,各处理真菌群落结构差异显著,相比土壤细菌群落结构分离趋势更加明显(图 3B)。
|
图 3 土壤细菌(A)和真菌(B)群落非度量多维尺度分析 Fig. 3 NMDS analyses of soil bacterial (A) and fungi communities (B) |
在细菌目分类水平上,各处理下的优势菌群包括微球菌目(Micrococcales)、盖亚女神菌目(Gaiellales)和热微球菌目(Thermomicrobiales)等10个目(表 5)。总体来看,添加不同预处理秸秆土壤细菌群落在目水平组成上相似,只有少数菌目的丰度有差异。S处理与其他处理相比,显著增加了土壤中伯克氏菌目(Burkholderiales)的相对丰度;SCPA处理与其他处理相比,显著降低了土壤中芽单胞菌目(Gemmatimonadales)的相对丰度。
|
|
表 5 不同处理下细菌和真菌优势菌群在目水平上的相对丰度和绝对丰度 Table 5 Relative and absolute abundances of main taxes within bacterial and fungal communities at order levels under different treatments |
在真菌目分类水平上,各处理下的优势菌群包括粪壳菌目(Sordariales)、格孢菌目(Pleosporales)和散囊菌目(Eurotiales)等10个目(表 5)。S处理粪壳菌目的相对丰度和绝对丰度显著高于其他处理。SC和SCPA处理相较于S处理,显著增加了散囊菌目(Eurotiales)的绝对丰度,尤其是SC处理散囊菌目的绝对丰度增加最为显著。与CK、S和SC处理相比,SCPA处理显著增加了小囊菌目(Microascales)的相对和绝对丰度。相较于CK、S和SC处理,SCPA处理显著提高了肉座菌目(Hypocreales)的绝对丰度,增幅分别为287.0%、206.9% 和408.6%。
2.4 土壤理化性质对小麦生物量和微生物群落结构的影响Pearson相关性分析表明,小麦穗质量与土壤MBN、MBC含量呈显著正相关,小麦秸秆质量与土壤TDN、DOC含量呈显著正相关,小麦根质量与土壤MBN、MBC含量呈显著正相关,而与SOC含量呈显著负相关;此外,小麦总生物量与土壤MBN、MBC、TN、DOC含量呈显著正相关(表 6)。
|
|
表 6 小麦生物量和土壤理化性质的相关性 Table 6 Pearson correlations between wheat biomass and soil bio-physicochemical properties |
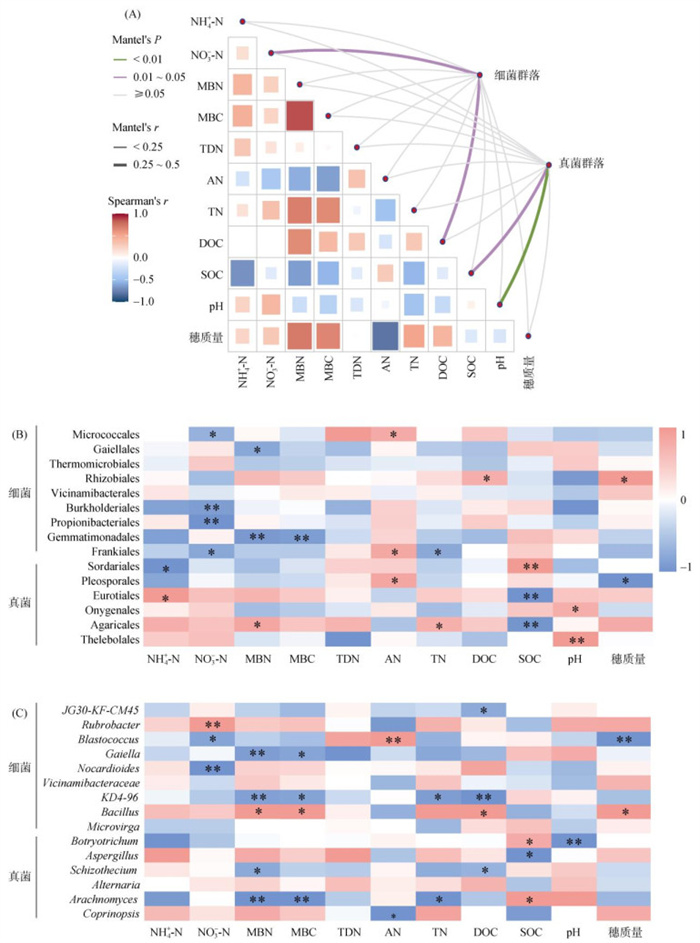
土壤DOC和NO3–-N与土壤细菌群落组成的Mantel显著值最小(Mantel’s P=0.01 ~ 0.05),且对细菌群落的解释值最大(Mantel’s r=0.25 ~ 0.5),表明土壤DOC和NO3–-N含量是调控土壤细菌群落组成的主要因子(图 4A)。土壤DOC含量与MBN含量呈显著正相关,并且与根瘤菌目(Rhizobiales)和芽孢杆菌属(Bacillus)相对丰度也存在显著正相关关系。土壤NO3–-N含量与土壤微球菌目(Micrococcales)、伯克氏菌目(Burkholderiales)和丙酸杆菌目(Propionibacteriales)相对丰度呈显著负相关。土壤MBN含量与土壤盖亚女神菌目(Gaiellales)和芽单胞菌目(Gemmatimonadales)相对丰度呈显著负相关,而与芽孢杆菌属(Bacillus)相对丰度呈显著正相关。此外,小麦穗质量与土壤中MBN、MBC、TN和DOC含量存在显著正相关关系,同时,也与土壤中根瘤菌目(Rhizobiales)和芽孢杆菌属(Bacillus)相对丰度呈显著正相关(图 4)。
|
(图A中线条的粗细表示Mantel’s r值,颜色表示Mantel’s P值。) 图 4 小麦穗质量和土壤理化性质与微生物群落结构的Mantel检验(A),及小麦穗质量和土壤理化性质与微生物群落结构的关系(B:目水平,C:属水平) Fig. 4 Mantel test analysis of wheat grain weight, soil physicochemical properties and microbial community structures (A), and relationships between wheat grain weight, soil physicochemical properties and microbial community structures (B, order level; C, genus level) |
Mantel检验表明,土壤SOC和pH是调控土壤真菌群落组成的主要因子。土壤SOC与NH4+-N呈显著负相关,土壤pH与TN呈显著负相关(图 4A)。土壤理化性质与真菌微生物群落在目水平和属水平上也存在不同程度的相关性(图 4B、4C)。土壤SOC含量与土壤粪壳菌目(Sordariales)和球孢毛葡孢霉属(Botryotrichum)相对丰度呈显著正相关,而与土壤散囊菌目(Eurotiales)和伞菌目(Agaricales)相对丰度呈显著负相关。土壤pH与土壤爪甲团囊菌目(Onygenales)和寡囊盘菌目(Thelebolales)相对丰度呈显著正相关,而与Botryotrichum相对丰度呈显著负相关。土壤MBN和TN含量与土壤伞菌目(Agaricales)相对丰度呈显著正相关,土壤NH4+-N含量与土壤散囊菌目(Eurotiales)相对丰度呈显著正相关。
3 讨论研究表明,有机物料还田可以提高土壤有机养分,并通过微生物作用促进土壤养分循环,进而促进作物生长[30]。本研究中,基于3 000 kg/hm2的玉米秸秆还田量,各处理的外源碳和肥料氮施加量保持一致,与CK处理相比,施用不同预处理的秸秆(S、SC和SCPA)提高了土壤微生物生物量和小麦生物量,这可能与外源碳及其伴随的养分输入有关[31]。周子军等[32]的研究表明,外源有机物的添加显著提高了SOC和有机氮含量,为土壤微生物提供了丰富的活性碳氮基质,进而激发了微生物的代谢活性,促进作物生长。此外,与S处理相比,SCPA处理显著提高了小麦生物量,这主要归因于真菌接种的玉米秸秆堆肥具有较低的C/N比和较高的腐殖化程度,溶解物质含量较高(表 2,图 1),对土壤肥力和作物生长具有更好的促进作用[33]。还有研究表明,堆肥处理的秸秆还田能改善土壤孔隙结构,促进根系和微生物的生长繁殖,从而提高作物产量[34]。Zhang等[35]的研究表明,根瘤菌目(Rhizobiales)能分解有机物释放养分,促进作物氮素利用和产量提升。在本研究中,Rhizobiales丰度与土壤中DOC含量呈显著正相关,同时DOC含量与小麦穗质量也呈显著正相关(图 4B),表明Rhizobiales丰度的增加不仅提高了DOC含量,也是提高作物产量的关键因素之一。此外,本研究还发现,土壤中芽孢杆菌属(Bacillus)与小麦穗质量呈显著正相关(图 4C),这一发现与Chen等[36]的研究结果一致,Bacillus是农业生态系统中重要的有益微生物,能够通过固氮作用促进作物生长。
有机物料的添加显著影响了土壤无机氮和微生物生物量碳氮的变化。本研究发现,与CK处理相比,添加不同预处理秸秆均显著降低了土壤中NH4+-N和NO3–-N含量,可能是由于外源碳的加入促进了微生物对无机氮的同化[37]。许多研究表明,当施加高C/N比有机物料时,土壤微生物通过强烈的同化作用,将无机氮转化为MBN,从而有效保氮[38-39]。在不同预处理秸秆处理中,SCPA处理土壤MBN含量最高,表明真菌接种的秸秆堆肥在微生物氮同化和土壤保氮效果上最为显著。与CK处理相比,所有预处理秸秆的添加都显著降低了土壤pH,其中S处理的pH最低,这一结果与Liang等[12]研究结果一致。在无机氮源充足的情况下,原始秸秆的分解会消耗土壤中的交换性钙镁离子,增加交换性氢铝离子,导致土壤pH下降。而堆肥处理的秸秆则通过增加土壤碱性阳离子,提高了土壤的酸中和能力,从而保持较高的pH[40]。此外,本研究还发现,添加不同预处理的秸秆显著提高了土壤中SOC的含量,这与很多研究结果一致[41-42]。外源秸秆的有机物质逐渐分解为较小的有机分子,包括水溶性化合物,为微生物的生长和代谢提供了必要的养分,从而促进了微生物的繁殖和活动[43]。在收获时,所有处理的SOC含量均有所增加,这可能与微生物分解有机物过程有关。微生物不仅是土壤中主要的有机质分解者,其生长和死亡也直接导致土壤有机质的积累[44]。
本研究中,接种真菌秸秆堆肥处理(SCPA),与CK处理相比,显著降低了土壤细菌的Chao1和Observed species指数(表 4)。导致这一结果可能是因为接种真菌的秸秆堆肥提高了土壤中TN的含量,进而引起了土壤细菌的生境发生改变[45]。此外,许多研究也表明,土壤细菌群落多样性随着土壤中氮含量的增加而减少[46-47]。此外,本研究还发现,与S、SC处理相比,SCPA处理显著提高了真菌群落的丰富度和多样性。真菌在土壤生态系统中扮演着重要的角色,参与有机物质的降解。真菌群落结构受土壤有机质含量的影响[48]。本研究结果也证实了这一观点,真菌群落组成受SOC的显著影响(图 4A)。微生物群落中各物种相对丰度的变化差异导致β多样性显著改变,例如,粪壳菌目(Sordariales)相对丰度在S处理中显著增加,散囊菌目(Eurotiales)相对丰度在SC处理中显著增加,小囊菌目(Microascales)相对丰度在SCPA处理中显著增加,这与该菌群喜欢生存于富碳环境有关。
土壤理化性质对微生物群落组成有重要的影响,微生物分类菌群与土壤理化性质表现出很强的相关性[49]。有研究表明,土壤NO3–-N、SOC和DOC是影响土壤细菌群落组成的主要环境因子[50-51],本研究结果与之相似。土壤环境中,伯克霍尔德氏菌目(Burkholderiales)是一类重要的植物促生菌,具有固氮、溶磷等功能,其群落结构的变化可能会影响作物的生长[52]。本研究中,土壤NO3–-N含量与Burkholderiales相对丰度呈显著负相关(图 4B),添加不同预处理秸秆均显著降低了土壤NO3–-N含量(表 3),说明不同预处理秸秆的添加可能会提高土壤中Burkholderiales的相对丰度,改善土壤的根际环境,促进作物的生长发育。另外,本研究还发现,土壤SOC含量和pH是调控土壤真菌群落组成的主要因子,这与童永尚等[53]的研究结果一致,接种真菌秸秆堆肥显著增加了肉座菌目(Hypocreales)的绝对丰度。Hannula等[54]利用13C稳定同位素标记法发现,Hypocreales能够快速分解有机质;并且Hypocreales的很多属为害虫的致病菌,并广泛应用于农作物的害虫防治[55]。可见,接种真菌 Phanerodontia chrysosporium 和 Aspergillus niger 玉米秸秆堆肥不仅能快速分解有机质,还有对抗害虫侵害的功能,对于促进土壤生态系统健康具有重要的作用。
4 结论1) 添加不同预处理秸秆显著提高了小麦的生物量,SCPA处理与CK处理相比,显著提高了小麦穗质量12.7%,根质量35.8% 和总生物量15.3%。
2) 添加不同预处理秸秆显著提高了土壤MBC和MBN含量,且SCPA处理土壤无机氮含量减少,土壤MBN含量最高,说明接种真菌的秸秆堆肥微生物同化氮量最高,土壤的保氮效果最好。
3) 堆肥处理(SC和SCPA)对土壤细菌和真菌群落结构产生显著影响,SCPA处理显著降低了土壤细菌α多样性,增加了土壤真菌的α多样性;其中显著增加了土壤中肉座菌目(Hypocreales)的绝对丰度,对促进土壤生态系统健康具有重要的作用。
| [1] |
Wang X L, Yang Z L, Liu X, et al. The composition characteristics of different crop straw types and their multivariate analysis and comparison[J]. Waste Management, 2020, 110: 87-97 (  0) 0) |
| [2] |
Shinde R, Shahi D K, Mahapatra P, et al. Management of crop residues with special reference to the on-farm utilization methods: A review[J]. Industrial Crops and Products, 2022, 181: 114772 (  0) 0) |
| [3] |
Feng Y Z, Zhao X L, Guo Y, et al. Changes in the material characteristics of maize straw during the pretreatment process of methanation[J]. BioMed Research International, 2012, 2012(1): 325426 (  0) 0) |
| [4] |
Ma M L, Bai K X, Qiao F X, et al. Quantifying impacts of crop residue burning in the North China Plain on summertime tropospheric ozone over East Asia[J]. Atmospheric Environment, 2018, 194: 14-30 (  0) 0) |
| [5] |
Yue Y, Gong X W, Zheng Y Z, et al. Organic material addition optimizes soil structure by enhancing copiotrophic bacterial abundances of nitrogen cycling microorganisms in Northeast China[J]. Agronomy, 2023, 13(8): 2108 (  0) 0) |
| [6] |
Wu L P, Ma H, Zhao Q L, et al. Changes in soil bacterial community and enzyme activity under five years straw returning in paddy soil[J]. European Journal of Soil Biology, 2020, 100: 103215 (  0) 0) |
| [7] |
隽英华, 何志刚, 刘慧屿, 等. 秸秆还田与氮肥运筹对农田棕壤微生物生物量碳氮及酶活性的调控效应[J]. 土壤, 2023, 55(6): 1223-1229 DOI:10.13758/j.cnki.tr.2023.06.008 (  0) 0) |
| [8] |
郭勇, 文丽, 石丽红, 等. 长期不同施肥模式对大麦–双季稻田根际土壤有机氮组分的影响[J]. 土壤, 2024, 56(2): 273-280 (  0) 0) |
| [9] |
Xia L L, Lam S K, Wolf B, et al. Trade-offs between soil carbon sequestration and reactive nitrogen losses under straw return in global agroecosystems[J]. Global Change Biology, 2018, 24(12): 5919-5932 (  0) 0) |
| [10] |
Govaerts B, Fuentes M, Mezzalama M, et al. Infiltration, soil moisture, root rot and nematode populations after 12 years of different tillage, residue and crop rotation managements[J]. Soil and Tillage Research, 2007, 94(1): 209-219 (  0) 0) |
| [11] |
Eiland F, Klamer M, Lind A M, et al. Influence of initial C/N ratio on chemical and microbial composition during long term composting of straw[J]. Microbial Ecology, 2001, 41(3): 272-280 (  0) 0) |
| [12] |
Liang F, Li B Z, Vogt R D, et al. Straw return exacerbates soil acidification in major Chinese croplands[J]. Resources, Conservation and Recycling, 2023, 198: 107176 (  0) 0) |
| [13] |
Gao Y, Wang J R, Ge Y H, et al. Partial substitution of nitrogen fertilizers by organic products of rural waste co-composting impacts on farmland soil quality[J]. Environmental Technology & Innovation, 2024, 33: 103470 (  0) 0) |
| [14] |
Albano X, Whitmore A P, Sakrabani R, et al. Effect of different organic amendments on actual and achievable yields in a cereal-based cropping system[J]. Journal of Soil Science and Plant Nutrition, 2023, 23(2): 2122-2137 (  0) 0) |
| [15] |
Lu X M, Lu P Z. Synergistic effects of key parameters on the fate of antibiotic resistance genes during swine manure composting[J]. Environmental Pollution, 2019, 252: 1277-1287 (  0) 0) |
| [16] |
Su J Q, Wei B, Ou-Yang W Y, et al. Antibiotic resistome and its association with bacterial communities during sewage sludge composting[J]. Environmental Science & Technology, 2015, 49(12): 7356-7363 (  0) 0) |
| [17] |
Wu Y P, Chen Y X, Shaaban M, et al. Evaluation of microbial inoculants pretreatment in straw and manure co-composting process enhancement[J]. Journal of Cleaner Production, 2019, 239: 118078 (  0) 0) |
| [18] |
Pandey A K, Gaind S, Ali A, et al. Effect of bioaugmentation and nitrogen supplementation on composting of paddy straw[J]. Biodegradation, 2009, 20(3): 293-306 (  0) 0) |
| [19] |
Wang Q, Awasthi M K, Ren X N, et al. Combining biochar, zeolite and wood vinegar for composting of pig manure: The effect on greenhouse gas emission and nitrogen conservation[J]. Waste Management, 2018, 74: 221-230 (  0) 0) |
| [20] |
黄金枝, 胡桂萍, 俞燕芳, 等. 微生物在农业废弃物堆肥应用中的研究进展[J]. 广东农业科学, 2019, 46(1): 64-70 (  0) 0) |
| [21] |
Gou C L, Wang Y Q, Zhang X Q, et al. Inoculation with a psychrotrophic-thermophilic complex microbial agent accelerates onset and promotes maturity of dairy manure-rice straw composting under cold climate conditions[J]. Bioresource Technology, 2017, 243: 339-346 (  0) 0) |
| [22] |
Jalč D. Straw enrichment for fodder production by fungi[M]// Agricultural Applications. Berlin, Heidelberg: Springer Berlin Heidelberg, 2002: 19–38.
(  0) 0) |
| [23] |
Kamkar B, Razavi S E, Sadeghipour H R, et al. Would it be possible to use nonpathogenic fungi to improve the turnover of crop residues?[J]. Journal of Basic Microbiology, 2021, 61(8): 721-735 (  0) 0) |
| [24] |
Du X R, Li B, Chen K J, et al. Rice straw addition and biological inoculation promote the maturation of aerobic compost of rice straw biogas residue[J]. Biomass Conversion and Biorefinery, 2021, 11(5): 1885-1896 (  0) 0) |
| [25] |
Liu X, Chen Q, Zhang H C, et al. Effects of exogenous organic matter addition on agricultural soil microbial communities and relevant enzyme activities in Southern China[J]. Scientific Reports, 2023, 13: 8045 (  0) 0) |
| [26] |
冯海玮, 孙玉静, 毛亮, 等. 接种灰略红链霉菌(Streptomyces griseorubens)对水稻秸秆堆肥及还田后土壤理化性质和微生物群落影响[J]. 上海交通大学学报(农业科学版), 2015, 33(4): 25-32 (  0) 0) |
| [27] |
Zhang H K, Fang Y Y, Chen Y C, et al. Enhanced soil potential N2O emissions by land-use change are linked to AOB-AmoA and nirK gene abundances and denitrifying enzyme activity in subtropics[J]. Science of The Total Environment, 2022, 850: 158032 (  0) 0) |
| [28] |
Zhang H J, Yao X D, Zeng W J, et al. Depth dependence of temperature sensitivity of soil carbon dioxide, nitrous oxide and methane emissions[J]. Soil Biology and Biochemistry, 2020, 149: 107956 (  0) 0) |
| [29] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科学技术出版社, 北京, 2000
(  0) 0) |
| [30] |
Song W F, Shu A P, Liu J A, et al. Effects of long-term fertilization with different substitution ratios of organic fertilizer on paddy soil[J]. Pedosphere, 2022, 32(4): 637-648 (  0) 0) |
| [31] |
Zhu H H, Wu J S, Huang D Y, et al. Improving fertility and productivity of a highly-weathered upland soil in subtropical China by incorporating rice straw[J]. Plant and Soil, 2010, 331(1): 427-437 (  0) 0) |
| [32] |
周子军, 郭松, 陈琨, 等. 长期秸秆覆盖对免耕稻-麦产量、土壤氮组分及微生物群落的影响[J]. 土壤学报, 2022, 59(4): 1148-1159 (  0) 0) |
| [33] |
Ye G P, Lin Y X, Liu D Y, et al. Long-term application of manure over plant residues mitigates acidification, builds soil organic carbon and shifts prokaryotic diversity in acidic Ultisols[J]. Applied Soil Ecology, 2019, 133: 24-33 (  0) 0) |
| [34] |
詹其厚, 张效朴, 袁朝良. 秸杆还田改良砂姜黑土的效果及其机理研究[J]. 安徽农业大学学报, 2002, 29(1): 53-59 (  0) 0) |
| [35] |
Zhang J F, Ye L B, Chang J J, et al. Straw soil conditioner modulates key soil microbes and nutrient dynamics across different maize developmental stages[J]. Microorganisms, 2024, 12(2): 295 (  0) 0) |
| [36] |
Chen Y H, Zang H W, Bai L Y, et al. Repeated inoculations improve wheat yield through modifying the rhizobacterial communities and nitrogen and phosphorus fractions[J]. Applied Soil Ecology, 2024, 196: 105287 (  0) 0) |
| [37] |
Cheng Y, Wang J, Wang J Y, et al. The quality and quantity of exogenous organic carbon input control microbial NO3– immobilization: A meta-analysis[J]. Soil Biology and Biochemistry, 2017, 115: 357-363 (  0) 0) |
| [38] |
Stark J M, Hart S C. High rates of nitrification and nitrate turnover in undisturbed coniferous forests[J]. Nature, 1997, 385(6611): 61-64 (  0) 0) |
| [39] |
Vaughan S M, Dalal R C, Harper S M, et al. Effect of fresh green waste and green waste compost on mineral nitrogen, nitrous oxide and carbon dioxide from a Vertisol[J]. Waste Management, 2011, 31(8): 1720-1728 (  0) 0) |
| [40] |
Shi R Y, Liu Z D, Li Y, et al. Mechanisms for increasing soil resistance to acidification by long-term manure application[J]. Soil and Tillage Research, 2019, 185: 77-84 (  0) 0) |
| [41] |
Hu Q Y, Li C F, Cao C G, et al. The rice–edible mushroom pattern promotes the transformation of composted straw-C to soil organic carbon[J]. Agriculture, Ecosystems & Environment, 2023, 353: 108560 (  0) 0) |
| [42] |
Li Y, Feng H, Dong Q G, et al. Ammoniated straw incorporation increases wheat yield, yield stability, soil organic carbon and soil total nitrogen content[J]. Field Crops Research, 2022, 284: 108558 (  0) 0) |
| [43] |
王孝芳, 万金鑫, 韦中, 等. 畜禽粪便堆肥过程中微生物群落演替[J]. 生物技术通报, 2022, 38(5): 13-21 (  0) 0) |
| [44] |
Tao F, Huang Y Y, Hungate B A, et al. Microbial carbon use efficiency promotes global soil carbon storage[J]. Nature, 2023, 618(7967): 981-985 (  0) 0) |
| [45] |
朱锦福, 黄瑞灵, 董志强, 等. 青海湖高寒湿地土壤细菌群落对氮添加的响应[J]. 生态环境学报, 2022, 31(6): 1101-1109 (  0) 0) |
| [46] |
Huang T W, Liu W G, Long X E, et al. Different responses of soil bacterial communities to nitrogen addition in moss crust[J]. Frontiers in Microbiology, 2021, 12: 665975 (  0) 0) |
| [47] |
Zeng J, Liu X J, Song L, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology and Biochemistry, 2016, 92: 41-49 (  0) 0) |
| [48] |
Frąc M, Hannula S E, Bełka M, et al. Fungal biodiversity and their role in soil health[J]. Frontiers in Microbiology, 2018, 9: 707 (  0) 0) |
| [49] |
Guo X P, Chen H Y H, Meng M J, et al. Effects of land use change on the composition of soil microbial communities in a managed subtropical forest[J]. Forest Ecology and Management, 2016, 373: 93-99 (  0) 0) |
| [50] |
Peng Y M, Xu H S, Shi J, et al. Soil microbial composition, diversity, and network stability in intercropping versus monoculture responded differently to drought[J]. Agriculture, Ecosystems & Environment, 2024, 365: 108915 (  0) 0) |
| [51] |
曾红丽, 白炜, 房佳辰, 等. 氮添加对青藏高原高寒沼泽草甸土壤细菌群落的影响[J]. 西北农业学报, 2022, 31(8): 1035-1045 (  0) 0) |
| [52] |
黄瑞林, 张娜, 孙波, 等. 典型农田根际土壤伯克霍尔德氏菌群落结构及其多样性[J]. 土壤学报, 2020, 57(4): 975-985 (  0) 0) |
| [53] |
童永尚, 张春平, 董全民, 等. 不同形态氮添加对多年生高寒栽培草地土壤理化性质和微生物群落结构的影响[J]. 环境科学, 2024, 45(6): 3595-3604 (  0) 0) |
| [54] |
Hannula S E, Boschker H T S, de Boer W, et al. 13C pulse-labeling assessment of the community structure of active fungi in the rhizosphere of a genetically starch-modified potato (Solanum tuberosum) cultivar and its parental isoline[J]. New Phytologist, 2012, 194(3): 784-799 (  0) 0) |
| [55] |
Rios-Velasco C, Pérez-Corral D A, Salas-Marina M Á, et al. Pathogenicity of the hypocreales fungi Beauveria bassiana and Metarhizium anisopliae against insect pests of tomato[J]. Southwestern Entomologist, 2014, 39(4): 739-750 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57


