2. 西南交通大学环境科学与工程学院, 成都 611756
近年来,抗生素作为一种新污染物因其在环境介质中的普遍性和耐药性而备受关注[1]。据估计,到2030年全球抗生素消耗量将提升3倍[2]。土壤作为抗生素以灌溉施肥、地表径流等方式污染最严重的环境介质之一,抗生素含量从ng/kg至μg/kg不等[3-4]。石灰性紫色土是长江上游分布最广的旱作土壤之一,具有有机质含量低等特点[5]。该地区的抗生素污染也不容乐观,土壤中抗生素残留水平在0.10 ~ 908.00 μg/kg[6]。磺胺嘧啶(SDZ)和氟苯尼(FFC)考作为我国使用量与生态毒性相对较高的两种弱疏水性抗生素,在碱性土壤中呈现较高的化学稳定性且难生物降解,自身高水溶性与不易离子化的特征又不利于其与土壤颗粒发生吸附反应,加速了其从土壤中迁移至水体环境,从而增强了这两种抗生素在环境中的持久性与生物有效性,对生态环境与人体健康具有潜在威胁。
在“双碳”背景下,生物质炭具有较强的减污降碳潜力,其发达的孔隙结构和比表面积可为污染物提供更多的吸附点位[7]。Jiang等[8]在热力学批量平衡吸附试验中发现,在添加马尾藻生物质炭或杉藻生物质炭后,供试样品对FFC的最大吸附量分别由23.15 mg/kg提升至84.75 mg/kg或70.92 mg/kg。但生物质炭的种类和热解温度等对其吸附抗生素具有显著影响。为对比不同生物质炭在紫色土中吸附抗生素的效用与机制,本研究以SDZ和FFC为目标污染物,开展紫色土、生物质炭以及生物质炭改良紫色土对两种抗生素的吸附热力学研究,评估生物质炭在生物质炭改良土吸附抗生素中的作用,以期为紫色土中抗生素污染控制提供理论基础。
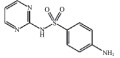
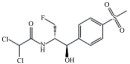
1 材料与方法 1.1 试剂及仪器供试磺胺嘧啶(sulfadiazine,SDZ)、氟苯尼考(florfenicol,FFC),纯度 > 98.00%,分别购自阿拉丁科技有限公司和罗恩试剂公司,基本性质见表 1。试验用水为超纯水器(UPHU-IV-90T,四川优普超纯科技有限公司)制备的超纯水(> 18.25 MΩ·cm)。
|
|
表 1 SDZ、FFC的基本性质 Table 1 Basic properties of tested SDZ and FFC |
试验仪器包括:分析天平(FA224,上海力辰仪器科技有限公司)、往复式恒温振荡箱(SH2-A,上海助蓝仪器科技有限公司)、精密台式酸度计(PH3-3E,上海仪电科学仪器股份有限公司)、离心机(TD-420台式低速离心机,四川蜀科仪器有限公司)、高效液相色谱仪(HPLC,LC-2030 Plus,日本岛津公司)。
1.2 供试土壤供试土壤样品采自四川省盐亭县,未曾施用生物质炭且不含有抗生素。土样自然风干后过2.00 mm筛密封保存。土壤基本理化性质:pH为8.29,有机碳含量为17.43 g/kg,全氮含量为0.83 g/kg,阳离子交换量为10.90 cmol/kg,比表面积为19.30 m2/g,马尔文激光衍射粒度分析仪(Mastersizer 2000,英国)测定的粒径分布为黏粒11.10%、粉粒49.75%、砂粒39.16%。
1.3 生物质炭的制备及表征生物质炭是由采自成都平原西北地区的油菜秸秆(RA)和水稻秸秆(RI)经清洗、自然风干,用研磨机粉碎并采用马弗炉烧制而成。烧制设置两个温度梯度(低温300 ℃和高温700 ℃),达到目标温度后保留2.00 h,再降至室温,从而制成不同类型生物质炭:低温油菜生物质炭(RAL)、低温水稻生物质炭(RIL)、高温油菜生物质炭(RAH)、高温水稻生物质炭(RIH)。当不同生物质炭和紫色土(S)混合后称为生物质炭改良紫色土,分别为RALS、RILS、RAHS、RIHS。生物质炭的元素组成和比表面积分别采用元素分析仪(Elementar Vario EL,Thermo Fisher)、全自动比表面及孔隙度分析仪(BET,麦克ASAP2460)测定。
1.4 试验方法通过批量平衡实验探究不同土壤样品对SDZ和FFC的吸附情况。分别称取1.00 g紫色土、0.99 g石英砂(对抗生素无吸附作用)+0.01g生物质炭、0.99紫色土+0.01g生物质炭于不同系列聚乙烯离心管中,并分别加入10.00 mL浓度为5.00、10.00、15.00、20.00、25.00 mg/L的SDZ、FFC抗生素溶液(背景溶液:0.01 mol/L CaCl2和1.00 g/L NaN3),再分别在278.15、298.15、318.15 K温度下避光振荡24 h至吸附平衡,经4 000 r/min离心,取上清液过0.22 μm PTEF滤膜,采用HPLC测定SDZ和FFC浓度。每个处理均设3组平行。
液相色谱柱为InertSustain C18(5.00 μm,4.60 mm×150.00 mm),检测器为紫外检测器,流动相为V水∶V乙腈=75.00∶25.00,进样量为20.00 μL,流速为1.00 mL/min,柱温30.00 ℃,采用低压梯度洗脱程序:0.00 ~ 7.00 min紫外波长为270.00 nm,7.00 ~ 10.00 min紫外波长为224.00 nm,测定SDZ、FFC的保留时间分别为3.10 min和7.80 min。
1.5 数据处理与分析采用Origin 2021软件绘制紫色土、生物质炭和生物质炭改良紫色土对SDZ和FFC的吸附等温线,并运用Freundlich等温吸附模型拟合,Freundlich等温吸附模型适用于非均质的多层吸附系统,可以更好地拟合紫色土、生物质炭和生物质炭改良紫色土的等温吸附线(R2≥0.709**);采用GraphPad Prism 8软件对生物质炭吸附抗生素的吸附容量常数(KF)进行差异性分析;采用吸附热力学公式对等温吸附试验数据进行热力学分析。
Freundlich等温吸附模型:
| $ Q_{\rm e}=K_{\rm F}(C_{\rm e})^{1/n} $ | (1) |
吸附热力学计算公式:
| $ ∆G^{θ}= –{\rm R}T\ln K_{\rm oc} $ | (2) |
| $ \ln K= –∆H^{θ}/{\rm R}T+∆S^{θ}/{\rm R} $ | (3) |
| $ K_{\rm oc}=K_{\rm F}/{\rm OC} $ | (4) |
式(1) ~ (4)中:Qe为吸附平衡时吸附剂表面的吸附质吸附量,mg/kg;KF为吸附容量常数;Ce为吸附平衡时溶液中吸附质浓度,mg/L;n为吸附亲和力值,表示吸附强度;∆Gθ为吸附过程的自由能变化,kJ/mol;R为气体常数,通常为8.314 J/(mol·K);T为热力学温度,K;Koc为以有机碳含量表示的土壤吸附常数,L/g;∆Hθ为吸附过程的晗变,kJ/mol;∆Sθ为吸附过程的熵变,J/(K·mol);OC为有机碳含量,g/kg。
2 结果与讨论 2.1 原材料与热解温度对生物质炭理化性质的影响生物质炭元素组成、比表面积见表 2。C、O元素是生物质炭的主要成分,随着热解温度的升高,除RIH外,其余生物质炭的C元素含量均升高,表明更高的温度可能会加速炭化。RA和RI的C元素含量仅相差2.07%,但RAL和RIL、RAH和RIH的C元素含量则分别相差7.81%、17.22%,说明RA比RI更易炭化。RIL的灰分从18.40% 上升到RIH的30.20%,且RIL、RIH的灰分明显高于RAL、RAH,因此,RIH的C元素含量降低可能是由于RI中含有更多的无机物质导致。O、H元素含量下降可能与生物质炭结构中某些弱键断裂有关[9]。H/C、O/C和(N+O)/C分别表征生物质炭芳香性、亲水性和极性,值越低则芳香性越高,亲水性和极性越低[10],芳香性提升有助于生物质炭表面形成更多的吸附位点[11],生物质炭的H/C、O/C和(N+O)/C随热解温度升高而降低,说明热解温度升高导致生物质炭芳香性提升,但亲水性和极性降低。同时,RAL和RAH的H/C与RIL和RIH相似,但其O/C和(N+O)/C均低于RIL和RIH,说明油菜秸秆生物质炭与水稻秸秆生物质炭的芳香性基本一致,但油菜秸秆生物质炭的亲水性和极性均低于水稻秸秆生物质炭。比表面积升高可归因于半纤维素、纤维素和木质素等挥发性物质的逃逸以及在热解过程中通道结构的形成[9],RAH、RIH比表面积要远高于RAL、RIL,说明只有达到某一温度后,生物质炭比表面积才会大幅度升高。这与Ahmad等[12]在研究300、700 ℃的大豆秸秆和花生壳生物质炭性质时所得到的结论一致。因此,油菜秸秆生物质炭相比水稻秸秆生物质炭具有相似的芳香性,较低亲水性和极性,但具有更大的比表面积,高温生物质炭相比低温生物质炭具有更高芳香性和比表面积,但亲水性和极性较低。
|
|
表 2 原材料及其生物质炭的元素组成和比表面积 Table 2 Elemental compositions and specific surface areas of raw materials and their biochars |
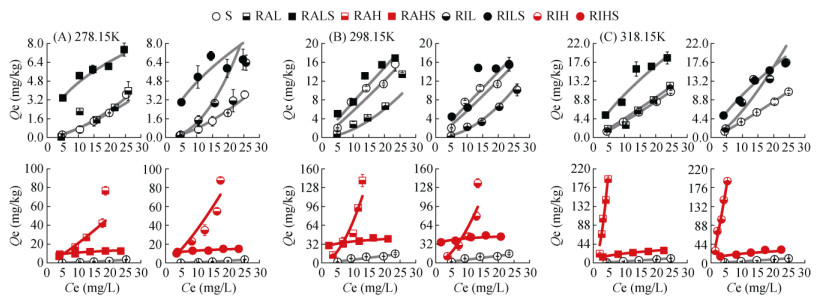
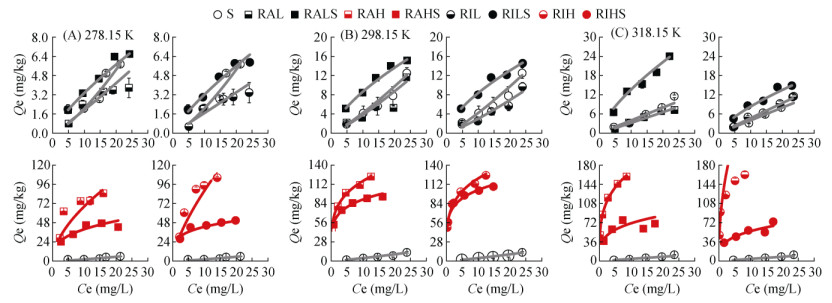
生物质炭对SDZ和FFC的吸附等温线如图 1、图 2所示,符合Freundlich等温吸附模型(R2≥0.752**),模型参数见表 3。由图 1、图 2和表 3可知,低温生物质炭对SDZ和FFC吸附等温线为S型(1/n > 1.00),高温生物质炭对SDZ吸附等温线仍为S型,说明在低SDZ和FFC浓度下,水分子与SDZ或FFC之间的吸附点位存在竞争[13];低温生物质炭对SDZ和FFC以及高温生物质炭对SDZ亲和力较低,随着初始浓度的增加,亲和力随之增加,呈现吸附上升趋势。而高温生物质炭对FFC的吸附等温线为L型(1/n < 1.00),说明此时高温生物质炭与FFC之间有很强的相互作用[14],随着初始浓度的增加,吸附趋势下降。
|
图 1 供试材料对SDZ的吸附等温线 Fig. 1 Adsorption isotherms of tested materials to SDZ |
|
图 2 供试材料对FFC的吸附等温线 Fig. 2 Adsorption isotherms of tested materials to SDZ |
|
|
表 3 供试材料对SDZ和FFC的Freundlich等温吸附模型参数 Table 3 rFitting parameters of Freundlich isothermal adsorption model of tested materials to SDZ and FFC |
热解温度的提高可有效提高生物质炭对弱疏水性抗生素的吸附性能。RAH在各试验温度下对SDZ的KF较RAL分别提高了42.33倍、34.67倍和26.92倍,对FFC的KF较RAL分别提高了121.80倍、278.79倍和292.93倍;RIH在各试验温度下对SDZ的KF较RIL分别提高了179.00倍、59.50倍和104.40倍,对FFC的KF较RIL分别提高了111.25倍、364.10倍和238.70倍。这与高温生物质炭更大比表面积以及更高芳香性有关,一方面,更大的比表面积增强了生物质炭对抗生素的孔道填充机制;另一方面,更高的芳香性提高了生物质炭表面的疏水性,提高了疏水分配作用,为高温生物质炭提供了更多的表面吸附位点。该结果与Zeng等[9]的研究结果一致,其研究表明,在700 ℃热解形成的稻壳生物质炭对盐酸四环素、盐酸强力霉素和环丙沙星的吸附能力远高于300 ℃和500 ℃的热解产物。差异性分析(图 3、图 4)显示,除SDZ在298.15 K下的试验组外,热解温度对KF的影响均具有显著性差异(P < 0.05),而在不同热解材料对比中,仅在318.15 K下RAH和RIH试验组对两种抗生素的KF具有显著性差异(P < 0.05),其他组间均无显著性差异(P > 0.05),这说明热解材料对KF的影响是极为有限的。
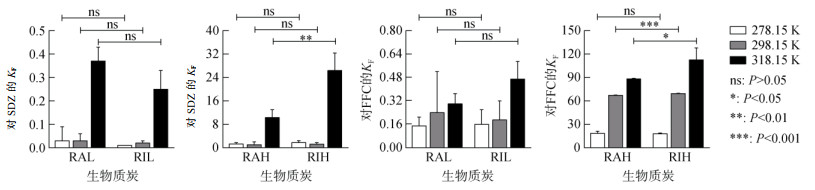
|
图 3 不同原材料生物质炭对SDZ和FFC的吸附容量常数(KF) Fig. 3 Histograms of adsorption capacity constants (KF) of biochars with different raw materials for SDZ and FFC |
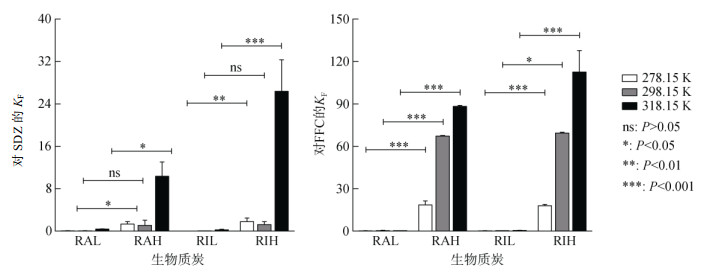
|
图 4 不同热解温度生物质炭对SDZ和FFC的吸附容量常数(KF) Fig. 4 Histograms of adsorption capacity constants (KF) of biochars for SDZ and FFC at different pyrolysis temperatures |
虽然RAH比表面积较RIH提高了51.14%,但更大比表面积并没有使RAH具有更高的KF,说明此时比表面积不是吸附作用的主控因子,导致RIH的KF更高的原因可能是由于在较高试验温度下表面更多灰分得到释放,促进了RIH对SDZ和FFC的吸附。例如,Zhou等[15]的研究结果发现,灰分含量高有利于花生壳生物质炭对Cu2+的吸附。因此,本试验所选用两种生物质炭的原材料不是影响抗生素吸附的主要因素。
生物质炭对SDZ和FFC的吸附热力学参数见表 4。由于高温生物质炭∆Gθ < 0 kJ/mol,低温生物质炭0 < ∆Gθ < 40 kJ/mol(318.15 K下RIL吸附FFC除外),说明高温生物质炭吸附SDZ和FFC为自发物理吸附,而低温生物质炭吸附SDZ和FFC为非自发物理吸附[16]。Zhao等[17]研究发现,500 ℃热解温度下制备的磁性芦苇生物质炭和芦苇生物质炭对FFC的吸附均为非自发反应。可以看到,低温生物质炭∆Gθ随着热解温度升高呈现下降趋势,说明热解温度是影响低温生物质炭能否自发吸附的原因之一。
|
|
表 4 供试材料的吸附热力学参数 Table 4 Adsorption thermodynamic parameters of tested materials |
紫色土和生物质炭改良紫色土对SDZ和FFC吸附等温线如图 1、图 2所示。在不同试验温度下,紫色土对SDZ和FFC的吸附等温线均为S型(1/n > 1.00),说明SDZ和FFC不容易通过多层吸附到紫色土表面[18],这是因为作为两性磺胺类药物的SDZ(pKa, 1=2.00,pKa, 2=6.48)可以阳离子、中性离子或阴离子形式在环境中存在,由于紫色土呈微碱性,因此SDZ在紫色土中主要以阴离子存在[13],阴离子态与负电荷吸附剂之间的静电斥力,使得紫色土对SDZ的KF仅为0.02 ~ 0.45。而FFC在紫色土中的离子化程度相当微弱(pKa=9.00),仅有1.20%,但以中性分子为主的FFC却具有较多的亲水基团(–OH等),水溶性高达1 320 mg/L,紫色土很难通过有机质疏水分配作用捕获FFC分子,从而导致FFC的KF仅为0.09 ~ 0.40。二者在紫色土中的吸附容量均显著低于氟喹诺酮类抗生素(KF=199.53 ~ 371.54)和四环素类抗生素(KF=229.99 ~ 505.03)[19-20]。这可能与SDZ和FFC较低的正辛醇水分配系数Kow有关,Wang等[21]的研究表明,紫色土中有机质对抗生素的吸附行为起着关键作用。这说明SDZ和FFC在紫色土中吸附主要是受控于土壤有机质疏水分配。另外,紫色土对SDZ和FFC的KF随试验温度的变化规律并不一致,这可能是试验温度达到某一温度后导致紫色土表面的高能点位和低能点位已经被完全覆盖,使得某些吸附分子与表面吸附点位碰撞变得更加困难,从而降低了紫色土对该种抗生素的吸附效率[22]。
将生物质炭施用到紫色土后,生物质炭改良土对两种抗生素的吸附等温线均为L型(1/n < 1.00),既不同于抗生素在紫色土中的吸附特征,也不与在生物质炭上的吸附特征完全相同,这表明抗生素分子最有可能吸附在平坦的位置[23],并非倾向吸附于生物质炭或土壤颗粒某一种吸附剂上。值得注意的是,不同生物质炭对紫色土吸附抗生素的影响具有明显差异,RALS对SDZ、FFC的KF较紫色土和RAL分别提高0.76倍~ 78倍、5.33倍~ 6.27倍和3.95倍~ 51.67倍、2.80倍~ 8.10倍;RILS对SDZ、FFC的KF较紫色土和RIL分别提高0.60倍~ 59.50倍、3.15倍~ 6.38倍和6.24倍~ 120.00倍、2.19倍~ 9.10倍;RAHS对SDZ、FFC的KF较紫色土和RAH分别提高34.58倍~ 334.00倍、94.10倍~ 221.88倍和–0.10倍~ 23.21倍、–0.57 ~ 0.01倍;RIHS对SDZ、FFC的KF较紫色土和RIH分别提高39.00倍~ 452.00倍、69.15倍~ 278.89倍和–0.61倍~ 26.45倍、–0.75倍~ 0.40倍。紫色土中生物质炭的施用对FFC在紫色土或生物质炭上的KF的影响幅度明显低于SDZ,这可归因于二者性质的差异。试验温度对SDZ吸附的影响幅度要远大于FFC,高温生物质炭较低温生物质炭对紫色土吸附性能的提升更为显著。但值得注意的是,高温生物质炭在施入土壤后较施入前对抗生素的吸附能力有所下降,而这种现象并未发生在低温生物质炭中。因此,紫色土中生物质炭的施用导致整体吸附抗生素的机制变得更加复杂。
不同热解温度的生物质炭在改良土壤中的作用存在着明显的差异。图 1、图 2中,抗生素在低温生物质炭改良紫色土中的吸附等温线均高于低温生物质炭或紫色土,复合吸附性能表现出叠加效应;而在高温生物质炭改良紫色土中,抗生素的吸附等温线则处于两种吸附剂单一的吸附等温线之间,二者之间出现拮抗效应。这说明生物质炭与紫色土两种吸附剂之间的相互作用可能与生物质炭的理化性质具有一定的相关性。由表 1可知,热解温度对生物质炭主要元素含量的影响并不显著,但对比表面积的影响却呈现数量级的差异。低温生物质炭的比表面积甚至低于紫色土,而高温生物质炭的比表面积则是紫色土的8.88倍~ 13.42倍。紫色土与低温生物质炭之间相似的KF和n导致抗生素在混合土壤环境中,紫色土与低温生物质炭相互作用的概率是相对均等的,抗生素在低温生物质炭及其改良紫色土中的吸附线性程度更高(1/n普遍大于0.70),更加符合于分配机制,因此,同一浓度势(液相平衡浓度)下,固相吸附量具有叠加性,低温生物质炭的施用增强了土壤的疏水分配作用。
更高的吸附非线性导致抗生素在高温生物质炭上的吸附作用明显不同于在紫色土中,生物炭疏松多孔的表面不仅为抗生素提供了丰富的吸附位点,同时也为紫色土中胶体物质发生相互作用提供了条件。例如,土壤中溶解性有机质(DOM)对生物质炭施用的响应明显,DOM通常含有–OH、–NH2、–C=O和–COOH等多种官能团,可以与生物吸附剂表面相互作用,改变其物理化学性质,从而影响其吸附,还可通过与抗生素络合来增强或抑制其吸附[24]。Feng等[25]的研究发现,低温生物质炭混合土壤试验组中低温生物质炭释放自身的DOM远超过其从土壤中吸附的DOM,导致整体DOM浓度上升,而高温生物质炭混合土壤试验组中高温生物质炭释放自身的DOM远低于其从土壤中吸附的DOM,导致整体DOM浓度下降。高温生物质炭中大部分碳以涡旋结晶的形式高度凝聚不溶,其自身所携带的DOM较低温生物质炭要少得多[26]。因此,随着热解温度的升高,高温生物质炭表面可能吸附了更多土壤释放的DOM,其会与抗生素竞争高温生物质炭表面的吸附位点,甚至可能会将表面孔隙阻塞,从而弱化了高温生物质炭的孔道填充机制,并且可能与抗生素分子发生竞争吸附与位阻效应[27],从而弱化了疏水分配作用。
两种抗生素在紫色土、生物质炭改良紫色土中的∆Gθ < 0、∆Hθ及∆Sθ > 0,且在高温生物质炭改良紫色土中的吸附相比于高温生物质炭中更具自发性,固液界面分子运动活跃程度增大,吸附混乱度增大[28]。这是由于高温生物质炭虽具有强吸附性,但由于低剂量施用,部分吸附特征可能会更加符合容纳其的土壤环境。在去除水中抗生素的研究中,无论使用何种原料,高热解温度生物质炭对水中抗生素的吸附均明显提高[29-30],采用更高能耗与经济成本的生物质炭虽在水相中具有可观的吸附性能,但在本研究中高热解温度生物质炭施用到紫色土后出现吸附性能降低的情况,这与现有的生物质炭–抗生素二元研究中的结果不一致。因此,一味地通过提高热解温度来增强生物质炭在土壤中的吸附性能,其效用可能无法达到相同水平,还需进一步考察土壤性质的影响。
3 结论1) 原材料和热解温度对生物质炭的理化性质均有影响。油菜秸秆生物质炭较水稻秸秆生物质炭具有相似的芳香性,较低的亲水性和极性,更大的比表面积,但油菜秸秆生物质炭和水稻秸秆生物质炭对SDZ和FFC的KF差异不明显。高温生物质炭较低温生物质炭具有更高的芳香性和比表面积,但亲水性和极性较低,高温生物质炭对SDZ和FFC的KF较低温生物质炭均有明显提高。
2) Freundlich等温吸附模型对紫色土、生物质炭、生物质炭改良紫色土吸附SDZ和FFC的拟合效果均呈现较好相关性。生物质炭改良紫色土较紫色土,以及高温生物质炭改良紫色土较低温生物质炭改良紫色土对SDZ和FFC的KF均有明显提高。除低温生物质炭的吸附过程为非自发进行的物理吸附过程外,其余均为自发进行的物理吸附过程。
3) 热解温度对SDZ和FFC在生物质炭改良紫色土中吸附特征的影响显著,低温生物质炭与紫色土对供试抗生素的吸附性能具有叠加效应,KF增加;而高温生物质炭在生物质炭改良紫色土中并未发挥其原有的吸附性能,对SDZ和FFC的KF甚至出现降低的趋势,最大降幅分别可达61.00%、75.00%.
| [1] |
张友爱, 王婷婷, 胡小婕, 等. 土壤抗生素抗性基因研究进展及热点分析[J]. 土壤学报, 2024, 61(3): 607-618 (  0) 0) |
| [2] |
Zhang Z B, Duan Y P, Zhang Z J, et al. Multimedia fate model and risk assessment of typical antibiotics in the integrated demonstration zone of the Yangtze River Delta, China[J]. Science of The Total Environment, 2022, 805: 150258 (  0) 0) |
| [3] |
Wang J H, Wang L J, Zhu L S, et al. Antibiotic resistance in agricultural soils: Source, fate, mechanism and attenuation strategy[J]. Critical Reviews in Environmental Science and Technology, 2022, 52(6): 847-889 (  0) 0) |
| [4] |
Sun J T, Zeng Q T, Tsang D C W, et al. Antibiotics in the agricultural soils from the Yangtze River Delta, China[J]. Chemosphere, 2017, 189: 301-308 (  0) 0) |
| [5] |
刘玲, 崔俊芳, 杨红薇, 等. 长期外源有机物料添加对川中丘陵区农田土壤养分和有机碳组分的影响[J]. 土壤, 2023, 55(5): 991-1000 DOI:10.13758/j.cnki.tr.2023.05.008 (  0) 0) |
| [6] |
刘欣雨, 张建强, 黄雯, 等. 中国土壤中抗生素赋存特征与影响因素研究进展[J]. 土壤, 2021, 53(4): 672-681 DOI:10.13758/j.cnki.tr.2021.04.002 (  0) 0) |
| [7] |
黄家威, 白嘉骏, 关松, 等. 田间老化生物质炭结构表征及吸附铵态氮效应[J]. 土壤学报, 2023, 60(5): 1468-1479 (  0) 0) |
| [8] |
Jiang C L, Cai H, Chen L L, et al. Effect of forestry-waste biochars on adsorption of Pb(Ⅱ) and antibiotic florfenicol in red soil[J]. Environmental Science and Pollution Research, 2017, 24(4): 3861-3871 DOI:10.1007/s11356-016-8060-8?fromPaywallRec=false (  0) 0) |
| [9] |
Zeng Z W, Tian S R, Liu Y G, et al. Comparative study of rice husk biochars for aqueous antibiotics removal[J]. Journal of Chemical Technology & Biotechnology, 2018, 93(4): 1075-1084 (  0) 0) |
| [10] |
Tan X F, Liu Y G, Zeng G M, et al. Application of biochar for the removal of pollutants from aqueous solutions[J]. Chemosphere, 2015, 125: 70-85 (  0) 0) |
| [11] |
Ahmad Z, Gao B, Mosa A, et al. Removal of Cu(Ⅱ), Cd(Ⅱ) and Pb(Ⅱ) ions from aqueous solutions by biochars derived from potassium-rich biomass[J]. Journal of Cleaner Production, 2018, 180: 437-449 (  0) 0) |
| [12] |
Ahmad M, Lee S S, Dou X M, et al. Effects of pyrolysis temperature on soybean stover- and peanut shell-derived biochar properties and TCE adsorption in water[J]. Bioresource Technology, 2012, 118: 536-544 (  0) 0) |
| [13] |
Sukul P, Lamshöft M, Zühlke S, et al. Sorption and desorption of sulfadiazine in soil and soil-manure systems[J]. Chemosphere, 2008, 73(8): 1344-1350 (  0) 0) |
| [14] |
Singh N. Sorption behavior of triazole fungicides in Indian soils and its correlation with soil properties[J]. Journal of Agricultural and Food Chemistry, 2002, 50(22): 6434-6439 (  0) 0) |
| [15] |
Zhou D D, Ghosh S, Zhang D, et al. Role of ash content in biochar for copper immobilization[J]. Environmental Engineering Science, 2016, 33(12): 962-969 (  0) 0) |
| [16] |
Feng D, Yu H M, Deng H, et al. Adsorption characteristics of norfloxacin by biochar prepared by cassava dreg: Kinetics, isotherms, and thermodynamic analysis[J]. BioResources, 2015, 10(4): 6751-6768 (  0) 0) |
| [17] |
Zhao H X, Lang Y H. Adsorption behaviors and mechanisms of florfenicol by magnetic functionalized biochar and reed biochar[J]. Journal of the Taiwan Institute of Chemical Engineers, 2018, 88: 152-160 (  0) 0) |
| [18] |
阴文敏, 关卓, 刘琛, 等. 生物炭施用及老化对紫色土中抗生素吸附特征的影响[J]. 环境科学, 2019, 40(6): 2920-2929 (  0) 0) |
| [19] |
轩盼盼, 唐翔宇, 鲜青松, 等. 生物炭对紫色土中氟喹诺酮吸附-解吸的影响[J]. 中国环境科学, 2017, 37(6): 2222-2231 (  0) 0) |
| [20] |
齐瑞环, 李兆君, 龙健, 等. 土壤粉碎粒径对土霉素在土壤中吸附的影响[J]. 环境科学, 2011, 32(2): 589-595 (  0) 0) |
| [21] |
Wang B, Li M, Zhang H Y, et al. Effect of straw-derived dissolved organic matter on the adsorption of sulfamethoxazole to purple paddy soils[J]. Ecotoxicology and Environmental Safety, 2020, 203: 110990 (  0) 0) |
| [22] |
Ma W J, Xu X Y, An B Y, et al. Single and ternary competitive adsorption-desorption and degradation of amphenicol antibiotics in three agricultural soils[J]. Journal of Environmental Management, 2021, 297: 113366 (  0) 0) |
| [23] |
Calvet R. Adsorption of organic chemicals in soils[J]. Environmental Health Perspectives, 1989, 83: 145-177 (  0) 0) |
| [24] |
Yang Z Y, Xing R, Zhou W J. Adsorption of ciprofloxacin and Cu2+ onto biochars in the presence of dissolved organic matter derived from animal manure[J]. Environmental Science and Pollution Research, 2019, 26(14): 14382-14392 (  0) 0) |
| [25] |
Feng Z J, Fan Z L, Song H P, et al. Biochar induced changes of soil dissolved organic matter: The release and adsorption of dissolved organic matter by biochar and soil[J]. Science of The Total Environment, 2021, 783: 147091 (  0) 0) |
| [26] |
Keiluweit M, Nico P S, Johnson M G, et al. Dynamic molecular structure of plant biomass-derived black carbon (biochar)[J]. Environmental Science & Technology, 2010, 44(4): 1247-1253 (  0) 0) |
| [27] |
Hameed R, Lei C, Fang J, et al. Co-transport of biochar colloids with organic contaminants in soil column[J]. Environmental Science and Pollution Research, 2021, 28(2): 1574-1586 (  0) 0) |
| [28] |
宋豆豆, 李莉, 刘伟婷. 玉米秸秆改性生物炭对磺胺类抗生素的吸附特性[J]. 生态与农村环境学报, 2021, 37(11): 1473-1480 (  0) 0) |
| [29] |
南志江, 蒋煜峰, 毛欢欢, 等. 玉米秸秆生物炭对灰钙土吸附金霉素的影响[J]. 环境科学, 2021, 42(12): 5896-5904 (  0) 0) |
| [30] |
Krasucka P, Pan B, Ok Y S, et al. Engineered biochar–A sustainable solution for the removal of antibiotics from water[J]. Chemical Engineering Journal, 2021, 405: 126926 (  0) 0) |
2. School of Environmental Science and Engineering, Southwest Jiaotong University, Chengdu 611756, China
 2025, Vol. 57
2025, Vol. 57