2. 成都市农业技术推广总站, 成都 611130;
3. 耕地资源调查监测与保护利用重点实验室, 成都 611130
氮素是实现作物高产的重要营养元素[1]。然而,我国主要作物氮利用效率低,是导致土壤退化、空气和水体污染的重要原因[2]。土壤氮的有效性及其在环境中的去向受不同形态氮素之间的相互转化过程控制[3]。通过15N同位素稀释法研究氮初级转化速率可量化土壤氮单独转化过程的转化速率[4]。硝化作用是在硝化细菌的作用下将NH4+氧化为NO2–再进一步氧化为NO3–的过程,在氮转化过程中扮演关键作用,主导着氮的氨挥发、淋洗、反硝化等损失途径。氨氧化是由氨氧化细菌(AOB)和氨氧化古菌(AOA)利用氨单加氧酶(AMO)将NH4+氧化为NO2–的过程,是硝化作用的第一步,也是限速步骤[5]。抑制硝化作用以及提高微生物对无机氮的同化作用被认为是缓解氮损失的有效途径[6]。由于硝化和微生物氮同化是争夺铵态氮的两个过程[7],有学者认为,硝化与微生物氮同化的比率可以反映潜在的氮损失[8]。
生物质炭具有孔隙率高、碳氮比高、芳香碳难降解等特点[9-10],其可以通过改变土壤通气性、pH和可溶性有机碳含量,并利用高孔隙度吸附NH4+,以及对硝化和反硝化微生物产生毒性等作用来影响氮转化过程[11-12]。一些研究发现,生物质炭可以提高微生物氮同化速率[11]。同时,有研究指出,生物质炭可以代替NO3–作为微生物的末端电子受体,从而刺激反硝化作用[13],或者利用生物质炭表面的金属作为催化剂促进反硝化的最后一步,进而减少N2O的排放[12]。然而,生物质炭对硝化过程的影响仍存在争议,促进、抑制或无明显影响等不同结果均有报道[14-16]。
化学硝化抑制剂可通过抑制硝化作用,有效减少氮损失[17],但其存在生产成本高、环境污染风险等问题[18]。与之相比,生物硝化抑制剂是从植物根系中提炼的有机化合物,例如高粱酮、甲基3, 4-羟苯基丙酸(MHPP)、1, 9-癸二醇等[2, 18],已被证实能有效抑制土壤硝化作用。此外,因其低环境污染风险、显著的硝化抑制能力而受到广泛关注[19]。Subbarao等[20]研究表明,MHPP对AOA和AOB的抑制效果为中等,而Lan等[21]进一步指出,MHPP的抑制率在14.1% ~ 55.5%,具体取决于其用量和土壤pH。尽管大部分研究表明生物硝化抑制剂可有效降低硝化速率[20, 22],但其对土壤中其他氮转化过程的具体作用仍不清楚[23]。
有研究发现,将生物质炭与化学硝化抑制剂配施,可以调控土壤氮转化过程,减少气态氮(NH3、N2O、N2和NO)损失[24-25]。然而,另有研究表明,生物质炭可能会吸附化学硝化抑制剂或促使化学硝化抑制剂降解,从而减弱其抑制能力[16]。例如,Li等[16]发现在生物质炭与3, 4二甲基吡唑磷酸盐(DMPP)配施,生物质炭削弱了DMPP对氨氧化微生物活性的抑制。那么,生物质炭与生物硝化抑制剂配施,是否存在同样现象?值得深入研究。
石灰性土壤占地球陆地面积的30%,主要分布在干旱和半干旱地区。石灰性土壤硝化速率快,作物的氮素利用率低[26]。因此,亟需有效的氮素管理措施以调控土壤氮转化过程,提高氮利用效率。生物质炭与生物硝化抑制剂配施能否有效抑制石灰性土壤氮转化?机理是什么?目前尚不清楚。为此,本研究通过开展15N好氧培养试验和厌氧乙炔抑制试验,研究了生物质炭和MHPP单施及其配施对土壤氮初级矿化速率、初级硝化速率、反硝化速率和铵同化速率的影响。
1 材料与方法 1.1 供试材料供试石灰性紫色土采自四川省遂宁市玉峰镇的水旱轮作农田(30°23′39”N,105°30′40”E)。土壤由紫色砂岩发育。采集新鲜土壤样品时,使用铲子从上层土壤(0 ~ 20 cm)进行取样,去除石块、根系和残留物后,通过2 mm网筛进行混合。土壤基本理化性质见表 1。
|
|
表 1 供试土壤基本理化性质 Table 1 Physicochemical properties of tested soil |
供试MHPP(纯度 > 98%)购买自Adamas Biomedical Technology公司,使用助溶剂(聚乙二醇)溶解,使用量相当于NH4+-N使用量的1/10。供试生物质炭由玉米秸秆在550 ℃条件下热解制得,过2 mm筛后使用,其碳氮比(C/N)为73.51。
1.2 15N好氧培养试验采集的新鲜土样立即用于开展15N同位素好氧培养试验,试验设置5个处理,分别是:①对照(CK);②1%BC处理(10 g/kg生物质炭);③1%BC+MHPP处理(10 g/kg的生物质炭和MHPP);④5%BC处理(50 g/kg生物质炭);⑤5%BC+MHPP处理(50 g/kg的生物质炭和MHPP)。
试验时,称取50 g(烘干基)鲜土于聚乙烯瓶(400 mL)内,加入蒸馏水调节土壤含水量至田间最大持水量的60%,用瓶盖密封,25℃恒温避光预培养3 d以稳定土壤代谢,之后将所有培养瓶分成两组,分别均匀加入2 mL 15NH4NO3溶液(15N丰度为10.1%)和2 mL NH415NO3溶液(15N丰度为10.2%),两组氮肥的加入量均为N 50 mg/kg。试验共设置5个处理、2种 15N标记形式、7个取样时间点、每次取样3个重复,共计210个培养瓶,置于25 ℃恒温避光培养。培养期间,每天打开盖子30 min以保持有氧环境,并及时称量培养瓶以确保含水量稳定,并分别在培养后的2 h和1、2、3、4、5、7 d进行破坏性取样。土样用2 mol/L 250 mL KCl溶液(水土比5∶1,V/m)振荡浸提1 h,定量滤纸过滤,收集滤液保存于4℃冰箱内以备NH4+-N、NO3–-N浓度及15N丰度的测定,其中15N丰度测定采用微扩散方法[27]。
1.3 厌氧乙炔抑制试验厌氧乙炔抑制试验基于高浓度乙炔(体积浓度1% ~ 10%)在反硝化过程中能阻碍N2O还原为N2的机理[28],并通过测定单位时间内N2O浓度的增加量来间接表征土壤反硝化速率。该试验处理与1.2中相同。具体步骤为:按1∶1(m/V)土水比向400 mL培养瓶中加入50 g(烘干基)新鲜土壤和50 mL去离子水,并加入KNO3溶液(氮加入量N 50 mg/kg)以提供反硝化底物。随后,立即盖上瓶盖并连接到多端口真空管上,保持真空状态,通入高纯N2(纯度 > 99.99%),直到瓶内压力与大气压平衡,在3次重复(每次10 min)后,瓶分成两组:一组充满高纯N2;另一组瓶内N2和C2H2的占比分别为90% 和10%(V/V)。之后,将培养瓶置于25 ℃恒温培养箱中避光培养,分别在在加入氮肥后的2、12 h,1、2、4、7、10 d,用注射器取顶部气体。每一处理、每一气体组、每一时间点均设置3个重复。采用气相色谱仪(Agilent 7890)测定N2O浓度。基于10%(V/V)C2H2处理瓶中产生的N2O浓度估算反硝化速率(以N计)[27-28]。
1.4 数据处理与统计分析土壤氮净矿化速率:
| $ {m_{{\text{net}}}} = \frac{{\left( {{{\left[ {{\text{NH}}_4^ + } \right]}_t} + {{\left[ {{\text{NO}}_3^ - } \right]}_t}} \right) - \left( {{{\left[ {{\text{NH}}_4^ + } \right]}_0} + {{\left[ {{\text{NO}}_3^ - } \right]}_0}} \right)}}{t} $ | (1) |
土壤氮净硝化速率:
| $ {n_{{\text{net}}}} = \frac{{{{\left[ {{\text{NO}}_3^ - } \right]}_t} - {{\left[ {{\text{NO}}_3^ - } \right]}_0}}}{t} $ | (2) |
土壤氮初级矿化速率:
| $ \begin{gathered} {m_{{\text{gross}}}} = \frac{{{{\left[ {{\text{NH}}_4^ + } \right]}_0} - {{\left[ {{\text{NH}}_4^ + } \right]}_t}}}{t} \hfill \\ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;{\text{ }} \times \frac{{\log \left( {{\text{APE}}\_{{\text{A}}_0}/{\text{APE}}\_{{\text{A}}_t}} \right)}}{{\log \left( {{{\left[ {{\text{NH}}_4^ + } \right]}_0}/{{\left[ {{\text{NH}}_4^ + } \right]}_t}} \right)}} \hfill \\ \end{gathered} $ | (3) |
土壤氮初级硝化速率:
| $ \begin{gathered} {n_{{\text{gross}}}} = \frac{{{{\left[ {{\text{NO}}_3^ - } \right]}_0} - {{\left[ {{\text{NO}}_3^ - } \right]}_t}}}{t} \hfill \\ {\text{ }} \times \frac{{\log \left( {{\text{APE}}\_{{\text{N}}_0}/{\text{APE}}\_{{\text{N}}_t}} \right)}}{{\log \left( {{{\left[ {{\text{NO}}_3^ - } \right]}_0}/{{\left[ {{\text{NO}}_3^ - } \right]}_t}} \right)}} \hfill \\ \end{gathered} $ | (4) |
铵同化速率:
| $ {i_{{\text{NH}}_4^ + }} = {m_{{\text{gross}}}} - \frac{{{{\left[ {{\text{NH}}_4^ + } \right]}_t} - {{\left[ {{\text{NH}}_4^ + } \right]}_0}}}{t} - {n_{{\text{gross}}}} $ | (5) |
式中:t代表时间间隔;[NH4+]0表示t=0时的NH4-+N含量(mg/kg);[NH4+]t表示t时的NH4+-N含量(mg/kg);[NO3–]0表示t=0时的NO3–-N含量(mg/kg);[NO3–]t表示t时的NO3–-N含量(mg/kg);APE_A0表示t=0时的NH4+-15N原子百分超;APE_At表示t时的NH4+-15N原子百分超;APE_N0表示t=0时的NO3–-15N原子百分超;APE_Nt表示t时的NO3–-15N原子百分超;mnet为土壤氮净矿化速率(N,mg/(kg·d));nnet为土壤氮净硝化速率(N,mg/(kg·d));mgross为土壤氮初级矿化速率(N,mg/(kg·d));ngross为土壤氮初级硝化速率(N,mg/(kg·d));
文中数据使用SPSS 26.0和R Studio进行统计分析。其中,通过单因素方差分析(One-way ANOVA)并结合LSD法检验处理间差异,采用Pearson法探讨氮转化过程之间的相关性。图表使用R 3.6.2的“ggplot2”包生成。
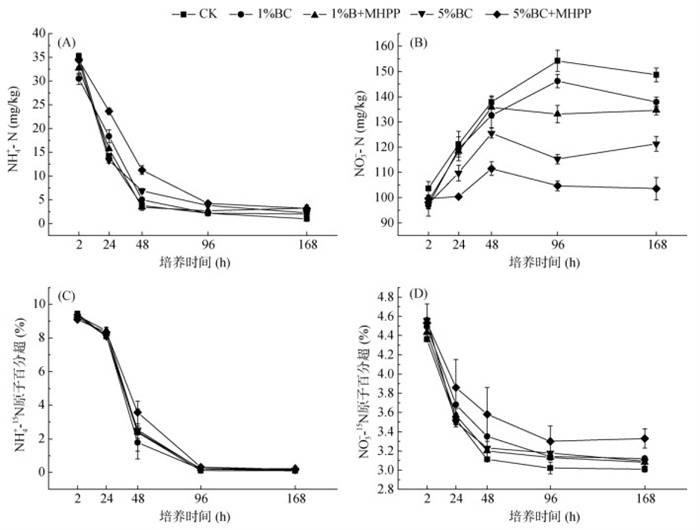
2 结果与分析 2.1 15N好氧培养试验 2.1.1 土壤NH4+-N、NO3−-N含量及其15N丰度变化在好氧培养过程中,5种处理的土壤NH4+-N含量均呈下降趋势(图 1A),NO3−-N含量则呈上升趋势(图 1B)。5%BC+MHPP处理NH4+-N含量在培养1 d和7 d时分别为23.66 mg/(kg·d)和3.20 mg/(kg·d),分别是CK处理的1.66倍和3.20倍。CK处理在培养7 d时的NO3−-N含量为148.62 mg/kg,是5%BC+MHPP处理的1.44倍。所有处理NH4+-15N和NO3−-15N丰度均随培养时间的增加有所降低。培养7 d时,5%BC+MHPP处理中NH4+-15N和NO3−-15N丰度分别为0.19% 和3.33%,相较于CK处理增加了90%和10.63%,与2 h时相比分别降低了97.9% 和26.5% (图 1C、1D)。
|
(误差条代表均值的标准差(n=3);下同) 图 1 15N好氧培养试验中不同处理土壤NH4+-N和NO3–-N含量(A、B)以及15N丰度的动态变化(C、D) Fig. 1 Dynamic changes in NH4+-N (mg/kg) and NO3–-N concentrations (A, B) and 15N abundance (C, D) under different treatments in 15N labeling experiment |
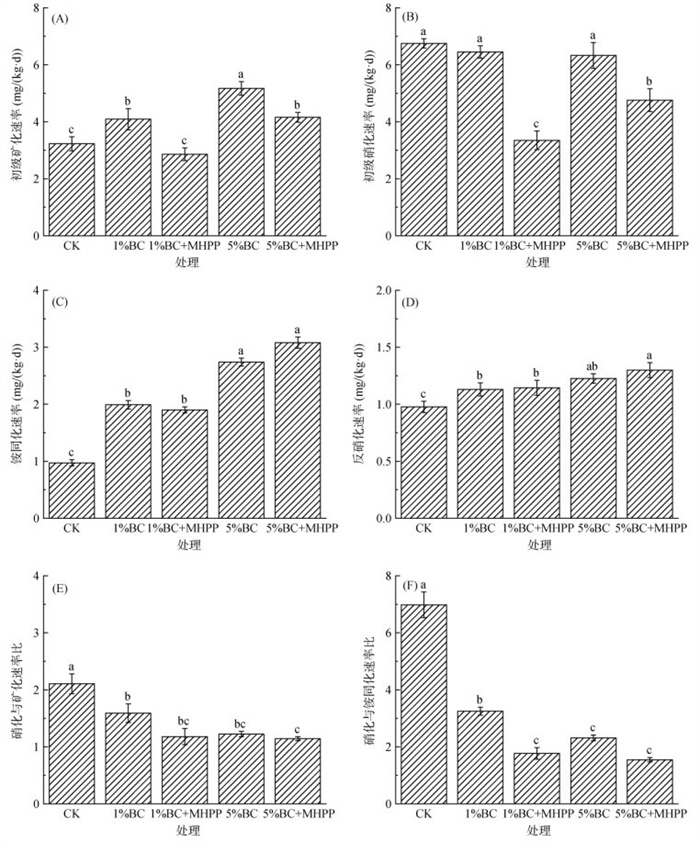
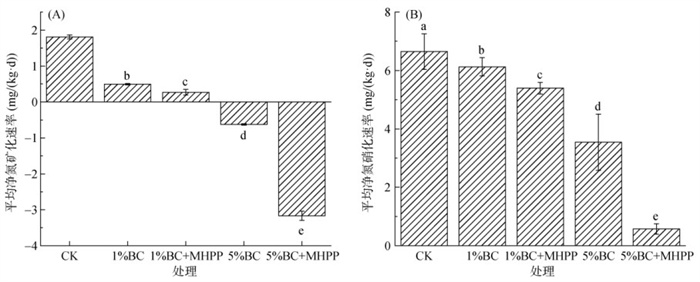
在15N好氧培养试验中,5种处理土壤氮初级矿化速率变化范围为2.86~ 5.17mg/(kg·d),与CK处理相比,1%BC和5%BC处理土壤氮初级矿化速率分别提高26.63% ~ 60.06%,但1%BC+MHPP和5%BC+MHPP处理降低了生物质炭单施对土壤矿化的激发作用(图 2A)。此外,CK处理土壤氮初级硝化速率为6.75 mg/(kg·d),与1%BC和5%BC处理基本相同,而1%BC+MHPP和5%BC+MHPP处理的氮初级硝化速率相较于CK处理显著降低50.3% 和29.4% (P < 0.05)(图 2B)。相较于CK处理(0.97 mg/(kg·d)),1%BC、1%BC+MHPP、5%BC和5%BC+MHPP处理的铵同化速率分别提高了105.15%、95.88%、182.47%和217.53%(图 2C)。各处理的铵同化速率随生物质炭添加量的增加而增加(图 2C),而各处理的氮净矿化速率和氮净硝化速率随生物质炭添加量的增加而降低(图 3)。另外,与CK处理相比,生物质炭配施MHPP处理的氮硝化速率与氮矿化速率比显著下降了53.5% ~ 77.9%,氮硝化速率与铵同化速率比下降了24.4% ~ 45.8%(图 2E、2F),其中,又以5%BC+MHPP处理的两个比值最低。
|
(图中不同小写字母表示处理间差异在P < 0.05水平显著;下同) 图 2 15N好氧培养试验中不同处理土壤氮平均转化速率:初级矿化速率(A)、初级硝化速率(B)、铵同化速率(C)、反硝化速率(D)、硝化与矿化速率比(E)和硝化与铵同化速率比(F) Fig. 2 Average nitrogen transformation rates under different treatments, including gross mineralization rate (A), gross nitrification rate (B), NH4+ assimilation rate (C), denitrification rate (D), nitrification rate to mineralization rate ratio (E), and nitrification rate to NH4+ assimilation rate ratio (F) |
|
图 3 不同处理下平均净氮矿化速率(A)和净氮硝化速率(B) Fig. 3 Average net nitrogen mineralization rates (A) and net nitrogen nitrification rates (B) under different treatments |
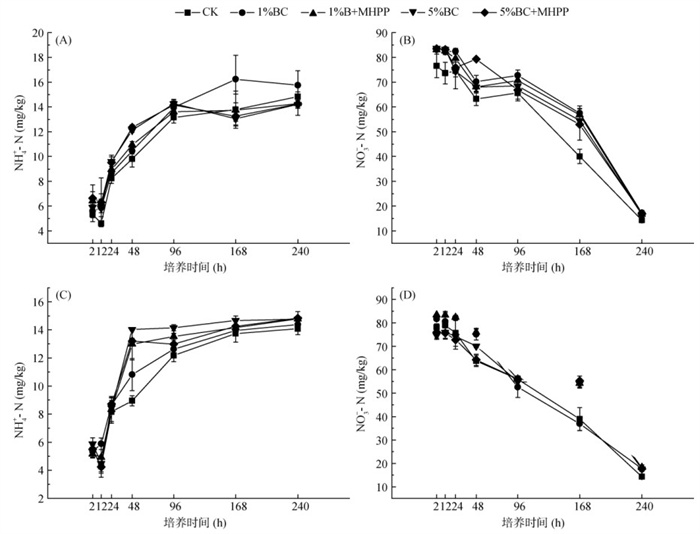
在厌氧培养试验过程中,不同处理土壤NH4+-N含量逐渐增加,NO3–-N含量逐渐减少。在添加C2H2的处理中,1%BC处理在培养10 d时的NH4+-N和NO3–-N含量分别为15.75和17.29 mg/kg,与培养2h时相比,其NH4+-N含量增加了180.77%,NO3–-N浓度减少了79.17%(图 4A、4B)。相比之下,在不添加C2H2的处理中(图 4C、4D),1% BC+MHPP处理和5%BC+MHPP处理在培养10 d时的NH4+-N含量分别为14.78和14.83 mg/kg,比培养2 h时增加了186.3%和169.76%。此外,1%BC+MHPP处理和5%BC+MHPP处理在培养10 d时NO3–-N含量分别为18.19和17.53 mg/kg,比培养2 h时减少了78.18% 和76.93%。
|
图 4 厌氧乙炔抑制培养试验中不同处理下添加C2H2(A、B)或不添加C2H2(C、D)时NH4+-N和NO3–-N含量的动态变化 Fig. 4 Dynamic changes in NH4+-N (mg/kg) and NO3–-N concentrations under different treatments in anaerobic acetylene inhibition incubation experiment, with (A, B) or without (C, D) C2H2 addition |
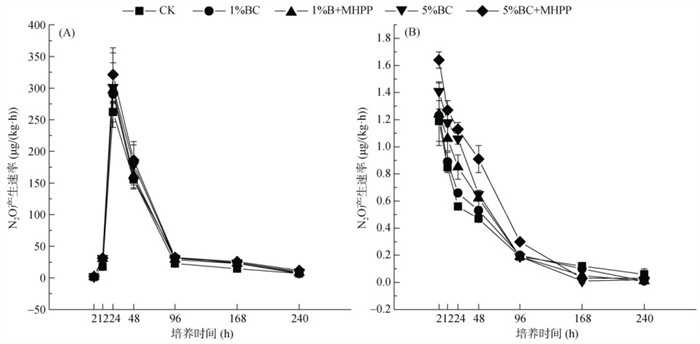
在厌氧乙炔试验的两组处理中,N2O排放速率由大到小为5%BC+MHPP > 5%BC > 1%BC+MHPP > 1%BC > CK。其中,在添加C2H2的处理组中,N2O排放速率均在培养1 d时达到峰值,然后迅速下降(图 5A)。且在培养1 d时,5%BC+MHPP处理的N2O排放速率为321.38 μg/(kg·h),是CK处理的1.23倍。在不添加C2H2的处理组中,N2O排放速率随时间延长逐渐减少(图 5B),在培养2 d时,5%BC+MHPP处理的N2O排放速率为0.91 μg/(kg·h),是CK处理的1.96倍。
|
图 5 厌氧乙炔抑制培养试验中不同处理添加(A)或不添加C2H2时N2O排放速率的动态变化(B) Fig. 5 Dynamic changes in N2O fluxes under different treatments in anaerobic acetylene inhibition incubation experiment, without (A) or with (B) C2H2 addition |
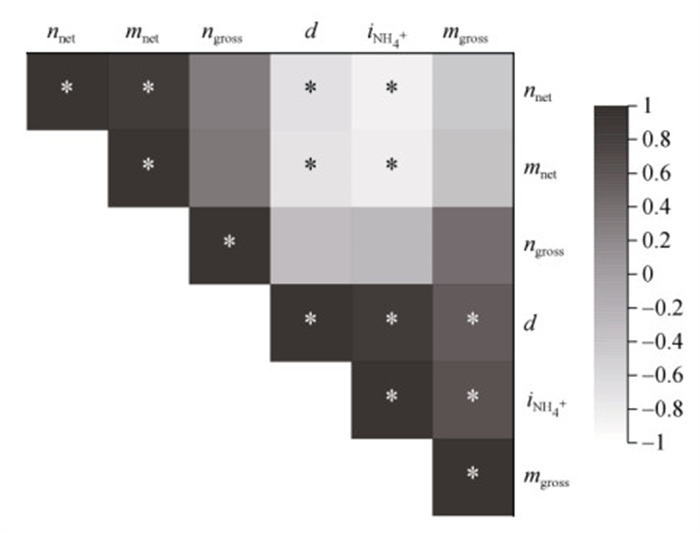
厌氧乙炔试验的结果显示,CK处理的反硝化速率为0.98 mg/(kg·d),1%BC和1%BC+MHPP处理比CK处理高约16%,5%BC和5%BC+MHPP处理比CK处理分别高25.5% 和33.0%(图 2D)。同时,相关分析结果显示,反硝化速率与初级矿化速率及铵同化速率呈显著正相关(P < 0.05)(图 6)。
|
(*表示在P < 0.05水平显著相关;mnet,氮净矿化速率;nnet,氮净硝化速率;mgross,氮初级矿化速率;ngross,氮初级硝化速率;iNH4+,铵同化速率;d,反硝化速率) 图 6 所有处理下土壤氮转化速率的Pearson相关分析矩阵图 Fig. 6 Pearson correlation matrix of nitrogen transformation rates under all treatments |
与部分前人研究一致[15],本研究结果表明,1%BC和5%BC处理促进了石灰性紫色土的氮初级矿化速率(图 2A),这可能是因为生物质炭能促进土壤中难降解有机氮的分解[15]。此外,MHPP中和了生物质炭单施时对石灰性紫色土氮矿化的激发效应,表明MHPP可能具有抑制土壤氮矿化的潜力。先前也有研究表明化学硝化抑制剂(包括DMPP和双氰胺DCD)能降低土壤氮矿化速率[29]。硝化抑制剂对土壤氮矿化的抑制作用很可能是因为矿化作用的反馈调节,即硝化抑制剂有效抑制了硝化作用,导致土壤中NH4+-N含量暂时增加,从而通过反馈作用抑制土壤氮矿化过程[29]。
本研究结果表明,1%BC和5%BC处理对石灰性紫色土的氮初级硝化速率几乎没有影响(图 2B),这与以往的一些研究结果一致[14]。本研究中估算的土壤氮初级硝化速率主要是自养硝化速率。当土壤中的碳源充足时,异养微生物可能比自养微生物生长得更快,从而增强其对NH3的竞争,导致氮初级硝化速率未明显增长[30]。但有研究指出,生物质炭可通过增加氨氧化物的amoA丰度促进自养硝化速率[15]。这些差异性研究结果可能是由于土壤的类型、结构、组成和特性以及生物质炭的施用量差异导致[15]。本研究中,1%BC+MHPP处理和5%BC+MHPP处理下石灰性紫色土的氮初级硝化速率降低29.4% ~ 50.3%(图 2B),这说明MHPP对氮初级硝化速率有抑制作用,且该作用受生物质炭施用量影响。尽管目前关于生物硝化抑制剂对氮初级硝化速率影响的研究较少,但Lu等[22]研究表明,MHPP可以抑制氮初级硝化速率25.1% ~ 50.1%。水稻根系分泌物中提炼出的一种生物硝化抑制剂1, 9-癸二醇可以抑制不同pH土壤中35.7% ~ 58.1% 氮初级硝化速率,抑制效果与化学硝化抑制剂DCD和DMPP相当[27, 29]。MHPP可能通过改变AOA和AOB之间的生态位差异以及AOB的群落结构来调节土壤的初级硝化速率,并且,AOB比AOA对MHPP更加敏感[21]。
本研究中,随着生物质炭使用量的增加铵同化速率呈增长趋势(图 2C),这与Zhao等[15]的发现相吻合,其发现生物质炭能够促进铵同化速率,这可能归因于生物质炭的高孔隙度对铵的吸附作用,以及其为土壤提供易分解有机碳的能力[31]。此外,MHPP对铵同化速率无显著影响,这表明MHPP处理不会影响微生物氮同化能力。已有研究表明,硝化抑制剂虽然可以抑制氨氧化,减少N2O排放,但同时会抑制尿素水解后产生NH4+的氧化,延长NH4+在土壤中的留存时间,增加NH3挥发损失风险[32]。本课题组之前的研究也发现,MHPP会增加紫色土–水稻系统中9.06% ~ 13.2% NH3挥发损失[25],但相对于如DMPP这类化学硝化抑制剂,MHPP增加NH3挥发风险相对较低[32]。且将MHPP与尿酶抑制剂等降低NH3挥发的试剂联合使用,可以有效地抵消生物硝化抑制剂对NH3挥发的负面影响[25]。本试验结果表明,随着生物质炭施用量增加,反硝化速率也随之上升(图 2D),但MHPP对反硝化速率几乎没有影响。现有证据表明,生物质炭可以通过调节亚硝酸盐还原酶基因(nirK)的丰度来促进反硝化过程的最后一步,从而导致N2O/(N2+N2O)的比例不断降低[12-13]。因此,生物质炭的作用类似于“电子穿梭器”,它促使电子向反硝化细菌转移。同时,生物质炭中的碱性成分可以中和土壤的酸性,提高土壤的pH,这为反硝化反应创造了适宜的环境条件,促使N2O完全还原为N2。
3.2 生物硝化抑制剂和生物质炭对石灰性紫色土硝化与矿化速率比以及硝化与铵同化速率比的影响硝化与矿化速率比控制着土壤中NH4+-N与NO3–-N相对含量[33]。在高硝化与矿化速率比的土壤中,NO3–-N是土壤无机氮的主要形态,反硝化和NO3–-N淋失损失风险高。反之,较低的硝化与矿化速率比使得在土壤中NH4+-N更占优势[34],反硝化和NO3–-N淋失损失风险低。本研究中,生物质炭和MHPP添加可以显著降低石灰性紫色土的硝化与矿化速率比(图 2E),并使得氮能以NH4+-N的形态在土壤中存留更长时间。同样地,硝化与铵同化速率比较高,则氮以NO3–-N淋失和反硝化损失风险也可能偏高[8]。本研究结果显示,1%BC和5%BC处理的硝化与铵同化速率比分别下降了54.1% 和61.5%(图 2F),这与Zhang等[35]的Meta分析结果一致,即生物质炭可使硝化与铵同化速率比降低67%,说明添加生物质炭可以通过降低硝化与铵同化速率比显著减少氮损失。当生物质炭和MHPP配施时,其效果更为显著。生物质炭与MHPP均能有效降低土壤硝化与铵同化速率比,但其机制可能不同。MHPP可能是通过抑制土壤硝化细菌的活性影响硝化与铵同化速率比,生物质炭则是通过高C/N刺激自养和异养微生物对NH4+的竞争来实现[35]。另外,根据Wan等[7]的研究,在没有添加生物质炭导致土壤碳限制的情况下,土壤通常会优先为异养微生物的生长提供NH4+,进而强化微生物对NH4+的同化作用,而非硝化作用。
4 结论本研究表明,生物质炭能显著提高石灰性土壤中氮的矿化速率和铵同化速率,但可能增加反硝化损失风险。生物硝化抑制剂MHPP与生物质炭配施对提高土壤氮矿化速率和降低硝化与铵同化速率比具有显著效果,尤其是50 g/kg生物质炭与MHPP配施,但同样反硝化作用也受到一定程度上的刺激。总体而言,尽管MHPP与生物质炭配施时,随着生物质炭用量增加,MHPP的硝化抑制作用有所减弱,但矿化–固持间的周转被大幅度增强。两者配施对于调控氮转化过程减少氮损失的积极影响高于负面影响。因此,在制定土壤氮素管理措施时,应综合考虑该措施对同时发生的多个氮素转化过程的作用效果。另外,由于本试验是在室内控制条件下进行,因此有必要通过田间试验,对生物质炭和MHPP配施的实际效果进行进一步验证。
| [1] |
Coskun D, Britto D T, Shi W M, et al. Nitrogen transformations in modern agriculture and the role of biological nitrification inhibition[J]. Nature Plants, 2017, 3: 17074 (  0) 0) |
| [2] |
Norton J, Ouyang Y. Controls and adaptive management of nitrification in agricultural soils[J]. Frontiers in Microbiology, 2019, 10: 1931 (  0) 0) |
| [3] |
Robertson G P, Groffman P M. Nitrogen transformations[M]// Soil Microbiology, Ecology and Biochemistry. Amsterdam: Elsevier, 2024: 407–438.
(  0) 0) |
| [4] |
Cheng Y, Wang J, Chang S X, et al. Nitrogen deposition affects both net and gross soil nitrogen transformations in forest ecosystems: A review[J]. Environmental Pollution, 2019, 244: 608-616 (  0) 0) |
| [5] |
Gruber N, Galloway J N. An Earth-system perspective of the global nitrogen cycle[J]. Nature, 2008, 451(7176): 293-296 (  0) 0) |
| [6] |
Ruser R, Schulz R. The effect of nitrification inhibitors on the nitrous oxide (N2O) release from agricultural soils—a review[J]. Journal of Plant Nutrition and Soil Science, 2015, 178(2): 171-188 (  0) 0) |
| [7] |
Wan Y J, Ju X T, Ingwersen J, et al. Gross nitrogen transformations and related nitrous oxide emissions in an intensively used calcareous soil[J]. Soil Science Society of America Journal, 2009, 73(1): 102-112 (  0) 0) |
| [8] |
Tietema A, Wessel W W. Gross nitrogen transformations in the organic layer of acid forest ecosystems subjected to increased atmospheric nitrogen input[J]. Soil Biology and Biochemistry, 1992, 24(10): 943-950 (  0) 0) |
| [9] |
孙宁婷, 王小燕, 周豪, 等. 生物质炭种类与混施深度对紫色土水分运移和氮磷流失的影响[J]. 土壤学报, 2022, 59(3): 722-732 (  0) 0) |
| [10] |
王湛, 李银坤, 徐志刚, 等. 生物质炭对土壤理化性状及氮素转化影响的研究进展[J]. 土壤, 2019, 51(5): 835-842 DOI:10.13758/j.cnki.tr.2019.05.001 (  0) 0) |
| [11] |
Feng Y F, Sun H J, Xue L H, et al. Biochar applied at an appropriate rate can avoid increasing NH3 volatilization dramatically in rice paddy soil[J]. Chemosphere, 2017, 168: 1277-1284 (  0) 0) |
| [12] |
Ji C, Li S Q, Geng Y J, et al. Decreased N2O and NO emissions associated with stimulated denitrification following biochar amendment in subtropical tea plantations[J]. Geoderma, 2020, 365: 114223 (  0) 0) |
| [13] |
Cayuela M L, Sánchez-Monedero M A, Roig A, et al. Biochar and denitrification in soils: When, how much and why does biochar reduce N2O emissions?[J]. Scientific Reports, 2013, 3: 1732 (  0) 0) |
| [14] |
Cheng Y, Cai Z C, Chang S X, et al. Wheat straw and its biochar have contrasting effects on inorganic N retention and N2O production in a cultivated Black Chernozem[J]. Biology and Fertility of Soils, 2012, 48(8): 941-946 (  0) 0) |
| [15] |
Zhao Y, Wang J, Cai Z C, et al. Short-term effects of nitrapyrin, rice straw and its biochar application on N transformation in soils of humid subtropical China[J]. Acta Agriculturae Scandinavica, Section B — Soil & Plant Science, 2018, 68(5): 448-456 (  0) 0) |
| [16] |
Li S, Chen D W, Wang C, et al. Reduced nitrification by biochar and/or nitrification inhibitor is closely linked with the abundance of comammox Nitrospira in a highly acidic sugarcane soil[J]. Biology and Fertility of Soils, 2020, 56(8): 1219-1228 (  0) 0) |
| [17] |
Ouyang Y, Norton J M, Stark J M, et al. Ammonia- oxidizing bacteria are more responsive than Archaea to nitrogen source in an agricultural soil[J]. Soil Biology and Biochemistry, 2016, 96: 4-15 (  0) 0) |
| [18] |
Subbarao G V, Sahrawat K L, Nakahara K, et al. Chapter six biological nitrification inhibition—a novel strategy to regulate nitrification in agricultural systems[J]. Advances in Agronomy, 2012, 114: 249-302 (  0) 0) |
| [19] |
陆玉芳, 施卫明. 生物硝化抑制剂的研究进展及其农业应用前景[J]. 土壤学报, 2021, 58(3): 545-557 (  0) 0) |
| [20] |
Subbarao G V, Nakahara K, Ishikawa T, et al. Biological nitrification inhibition (BNI) activity in sorghum and its characterization[J]. Plant and Soil, 2013, 366(1): 243-259 (  0) 0) |
| [21] |
Lan T, Li M X, He X Q, et al. Effects of synthetic nitrification inhibitor (3, 4-dimethylpyrazole phosphate; DMPP) and biological nitrification inhibitor (methyl 3-(4-hydroxyphenyl) propionate; MHPP) on the gross N nitrification rate and ammonia oxidizers in two contrasting soils[J]. Biology and Fertility of Soils, 2022, 58(3): 333-344 (  0) 0) |
| [22] |
Lu Y F, Zhang X N, Jiang J F, et al. Effects of the biological nitrification inhibitor 1, 9-decanediol on nitrification and ammonia oxidizers in three agricultural soils[J]. Soil Biology and Biochemistry, 2019, 129: 48-59 (  0) 0) |
| [23] |
Nardi P, Laanbroek H J, Nicol G W, et al. Biological nitrification inhibition in the rhizosphere: Determining interactions and impact on microbially mediated processes and potential applications[J]. FEMS Microbiology Reviews, 2020, 44(6): 874-908 (  0) 0) |
| [24] |
He T H, Liu D Y, Yuan J J, et al. Effects of application of inhibitors and biochar to fertilizer on gaseous nitrogen emissions from an intensively managed wheat field[J]. Science of The Total Environment, 2018, 628: 121-130 (  0) 0) |
| [25] |
Lan T, Huang Y X, Song X, et al. Biological nitrification inhibitor co-application with urease inhibitor or biochar yield different synergistic interaction effects on NH3 volatilization, N leaching, and N use efficiency in a calcareous soil under rice cropping[J]. Environmental Pollution, 2022, 293: 118499 (  0) 0) |
| [26] |
Ma S J, Hu Y H, Zeng Q H, et al. Temporal changes of calcareous soil properties and their effects on cadmium uptake by wheat under wastewater irrigation for over 50 years[J]. Chemosphere, 2021, 263: 127971 (  0) 0) |
| [27] |
Garrido F, Hénault C, Gaillard H, et al. N2O and NO emissions by agricultural soils with low hydraulic potentials[J]. Soil Biology and Biochemistry, 2002, 34(5): 559-575 (  0) 0) |
| [28] |
Lan T, Suter H, Liu R, et al. Effects of nitrification inhibitors on gross N nitrification rate, ammonia oxidizers, and N2O production under different temperatures in two pasture soils[J]. Environmental Science and Pollution Research, 2018, 25(28): 28344-28354 (  0) 0) |
| [29] |
Zhu G D, Ju X T, Zhang J B, et al. Effects of the nitrification inhibitor DMPP (3, 4-dimethylpyrazole phosphate) on gross N transformation rates and N2O emissions[J]. Biology and Fertility of Soils, 2019, 55(6): 603-615 (  0) 0) |
| [30] |
Cucu M A, Said-Pullicino D, Maurino V, et al. Influence of redox conditions and rice straw incorporation on nitrogen availability in fertilized paddy soils[J]. Biology and Fertility of Soils, 2014, 50(5): 755-764 (  0) 0) |
| [31] |
Chen X, Yang S H, Jiang Z W, et al. Biochar as a tool to reduce environmental impacts of nitrogen loss in water-saving irrigation paddy field[J]. Journal of Cleaner Production, 2021, 290: 125811 (  0) 0) |
| [32] |
曾科, 王书伟, 朱文彬, 等. 不同硝化抑制剂对稻季N2O排放、NH3挥发和水稻产量的影响[J]. 土壤, 2023, 55(3): 503-511 DOI:10.13758/j.cnki.tr.2023.03.006 (  0) 0) |
| [33] |
Zhang J B, Cai Z C, Zhu T B, et al. Mechanisms for the retention of inorganic N in acidic forest soils of Southern China[J]. Scientific Reports, 2013, 3: 2342 (  0) 0) |
| [34] |
Zhang J B, Wang L, Zhao W, et al. Soil gross nitrogen transformations along the Northeast China Transect (NECT) and their response to simulated rainfall events[J]. Scientific Reports, 2016, 6: 22830 (  0) 0) |
| [35] |
Zhang Y S, Pan B B, Lam S K, et al. Predicting the ratio of nitrification to immobilization to reflect the potential risk of nitrogen loss worldwide[J]. Environmental Science & Technology, 2021, 55(11): 7721-7730 (  0) 0) |
2. Chengdu Municipal Agricultural Technology Extension Center, Chengdu 611130, China;
3. Key Laboratory of Investigation, Monitoring, Protection and Utilization of Cropland Resources, Ministry of Natural Resources, Chengdu 611130, China
 2025, Vol. 57
2025, Vol. 57


