2. 中国科学院南京土壤研究所, 南京 211135;
3. 三峡库区生态环境教育部工程研究中心(三峡大学), 湖北宜昌 443002;
4. 复旦大学环境科学与工程系, 上海 200433
新烟碱类杀虫剂(Neonicotinoids insecticides,NIIs)因其具有杀虫谱广、活性高、用量少、持效长、与其他传统农药无交互抗性而受到人们青睐,被广泛用于农作物害虫防治。在过去的20年中,NIIs已占据约25% 的全球杀虫剂市场与80% 的种子处理市场[1]。NIIs进入环境会发生吸附解吸和迁移转化等多种行为。在施用初期,未被植物吸收的NIIs通过吸附作用在土壤中富集。NIIs具有高水溶性和高流动性,容易从土壤中解吸,经地表径流或排水浸出而最终进入水体[2]。随着NIIs大量投入使用,由于其在环境中的降解周期长,在中性和酸性条件下耐水解[3],水体中残留的NIIs浓度逐年增加,并在水生生物体内积累,进而通过饮用水或食物链的形式进入人体,导致人类暴露风险和生态风险提高[4]。研究人员在中国华南地区珠江广州段、广州市城市航道和广东珠江3条干流中均检测到高浓度NIIs残留,其中吡虫啉和噻虫嗪检出率较高,NIIs平均残留浓度为154 ng/L[5]。
NIIs可通过化学和生物途径降解,在酸性或中性条件下,NIIs相对稳定,而在碱性条件下,NIIs能被快速水解[6]。Wang等[7]观察到水稻土在氧化过程中能够产生大量羟基自由基(·OH)降解NIIs。Mori等[8]发现在好氧环境下,活性菌种嗜染料菌属(Pigmentiphaga)、假单胞菌属(Pseudomonas)和剑菌属(Ensifer)在纯菌培养体系中能够促使NIIs快速降解。然而,在厌氧环境中,NIIs的降解途径和产物还有待研究。
铁是自然界分布最广泛的元素之一,硫铁矿物广泛存在于多种无氧和微氧环境中,如稻田土壤、地下水、湖泊、江河海口沉积物中。在淹水稻田土壤或地下水等环境中,由于微生物呼吸作用消耗水中溶解氧,形成厌氧环境,其中含量丰富的硫铁元素会被硫酸盐还原菌(Sulfate reducing bacteria,SRB)和铁还原菌(Ferric reducing bacteria,FRB)还原形成还原性的S2-和Fe2+,二者进一步发生化学沉淀作用生成硫化亚铁(FeS)矿物[9]。因FeS具有卓越的还原重金属(如Cr(Ⅵ)、U(Ⅵ)、Tc(Ⅶ)等)能力,已经被广泛应用于重金属的环境修复中[10-11]。也有研究报道,由厌氧到好氧转化过程中,FeS的氧化过程会产生大量自由基,从而氧化土壤环境中毒性As(Ⅲ)为低毒的As(Ⅴ),进而减少砷对环境的危害[12]。目前,关于NIIs在厌氧条件下FeS介导的非生物还原转化机制尚不明晰。
噻虫嗪(Thiamethoxam,THI)作为第二代NIIs的典型代表,其在土壤和地下环境中的检出率和残留水平高,潜在危害性已经被多次报道[13]。本研究基于铁地球化学过程,模拟地下环境中原位产生的FeS,并在厌氧条件下对FeS介导的THI还原降解机制进行了研究。其中,利用光电子能谱(XPS)、X射线衍射(XRD)和透射电子显微镜(TEM)等结构表征技术研究了FeS矿物的形貌结构和元素组成,系统探究了FeS浓度、环境pH、无机阴离子、无机阳离子和腐殖酸对FeS降解THI的影响,并通过淬灭试验鉴定了主导THI还原降解的活性中心,进而阐释了THI在FeS介导下的降解机理。本研究结果可为理解和优化土壤及地下水中新烟碱类农药的自然降解过程提供新的视角,并为相关环境修复策略的制定提供理论依据。
1 材料与方法 1.1 试验材料噻虫嗪标准品(THI,99.7%)购自西格玛奥德里奇(上海)贸易有限公司,分子式C8H10ClN5O3S,分子量271.9 g/mol,米白色至黄色固体,pKa值0.99 ± 0.10,熔点139.1℃,蒸气压6.6×10-6 mPa (25℃),相对密度1.57 (20℃),水中溶解度4.1 g/L(25℃)。醋酸钠(NaOAc)和十水合四硼酸钠(Na2B4O7·10H2O)用作pH缓冲盐。四水合氯化亚铁(FeCl2·4H2O)、腐殖酸(HA)、一水合草酸铵(C2H10N2O5·H2O)、叔丁醇(C4H10O)、氯化钾(KCl)、二水氯化钙(CaCl2·2H2O)、氯化钠(NaCl)、六水合氯化镁(MgCl2·6H2O)、六水氯化铝(AlCl3·6H2O)、四水氯化亚锰(MnCl2·4H2O)、碳酸钠(Na2CO3)、硝酸钠(NaNO3)、亚硝酸钠(NaNO2)、2, 2′-联吡啶(C10H8N2)、氯化铵(NH4Cl)、硫化钠(Na2S·9H2O)均为分析纯试剂。
1.2 材料制备与表征参考前人[14]报道,FeS的制备在氮氢混合气氛(VN2∶VH2 = 9∶1)的手套箱内(ELECTROTEK,英国)进行。首先,将72 mL 1.1 mol/L的Na2S溶液缓慢加入120 mL 0.57 mol/L的FeCl2中,并在手套箱内混合3 d;然后,将悬浮液转移至密封的聚丙烯瓶中,并以10 000 r/min离心10 min,离心后样品转移回手套箱中,并对上清液电导率进行测定,随后用脱氧去离子水冲洗以取代上清液。重复上述过程直至电导率低于200 μS/cm,使用真空冷冻干燥器对沉淀物进行冷冻干燥,得到试验所用的FeS样品。
通过X射线光电子能谱(XPS)、电感耦合等离子体–发射光谱(ICP-OES)、X射线衍射(XRD)和透射电子显微镜(TEM)对制备的FeS样品表面元素价态、晶体结构和形貌进行测定。
1.3 THI降解试验为确保厌氧条件,本研究中降解试验在氮氢混合气氛(VN2∶VH2 = 9∶1)的手套箱内进行。配制浓度为200 μmol/L的THI母液储存在棕色玻璃瓶中以便进行后续厌氧降解试验。
FeS浓度影响试验:取9个15 mL离心管作为反应容器并加入10 μmol/L的THI溶液,向不同离心管内分别加入浓度0.5、1、2 g/L的FeS悬浮液,使用磁力搅拌器在25 ℃、2 000 r/min下对各离心管内反应溶液进行搅拌。在反应开始后的0、30、60、120、240、360 min时进行取样,每次取样收集0.5 mL反应溶液于预先装有0.5 mL甲醇的2 mL离心管内,以14 000 r/min离心5 min,取上清液过0.22 μm滤膜后用高效液相色谱仪对THI浓度进行检测。
反应体系pH影响试验:根据FeS浓度试验结果,选取1 g/L FeS悬浮液和10 μmol/L的THI溶液作为反应浓度,考察不同pH对FeS还原降解THI的影响。分别选取10 mmol/L醋酸钠和硼酸钠缓冲盐配制成pH为5、7、9的缓冲溶液,作为不同pH反应体系,试验其余操作同FeS浓度影响试验。
共存离子影响试验:本研究还探讨了无机阴离子(Cl–、CO32-、NO3-、NO2-)、无机阳离子(K+、Ca2+、Na+、Mg2+、Al3+、Fe2+、Mn2+、NH4+)和不同浓度腐殖酸(HA)对FeS还原降解THI的影响。根据上述试验结果,选择FeS悬浮液浓度为1 g/L、THI溶液浓度为10 μmol/L、pH 5为最优反应条件进行试验,试验中无机阴、阳离子浓度均为10 mmol/L,HA浓度设置为0、5、10、20 mg/L,试验其余操作同FeS浓度影响试验。所有试验均设置3组平行。
1.4 淬灭试验为探究FeS介导THI降解的机制,分别选取草酸铵(OA)、2, 2′-联吡啶(BPY)和叔丁醇(TBA)进行淬灭试验,其中OA(0.05、0.25、0.5 mol/L)用以验证硫(S)空位的还原贡献[15];BPY(0.5、2、8、32 mmol/L)对Fe(Ⅱ)具有强络合作用,用以验证Fe(Ⅱ)的还原贡献[16];TBA(0.05、0.1、0.2 mol/L)能够与·OH反应,用以验证是否有·OH的作用[17]。
为验证溶解态Fe(Ⅱ)的还原贡献,选取1 g/L FeCl2溶液和10 μmol/L的THI溶液,在pH 5条件下进行试验,在反应开始后的0、30、60、120、240、360、1 200 min时进行取样,试验其余操作同FeS浓度影响试验。
1.5 THI及其降解产物测定方法采用高效液相色谱法(HPLC,安捷伦1260 Infinity)测定THI的浓度。色谱柱为ZORBAX SB-C18 (4.6×12.5 mm, 5-Micron,安捷伦),流动相甲醇∶水体积比为50%∶50%,流速为0.8 mL/min,检测波长255 nm。采用高效液相色谱-串联质谱法(HPLC-MS/MS,AB SCIEX QTOF)鉴定THI的降解产物。
1.6 溶解态Fe(Ⅱ)和总铁(T-Fe)测定方法采用1, 10-菲咯啉分光光度法分析反应体系中Fe(Ⅱ)和T-Fe的浓度。在预定的时间间隔(0、120、240、360、1 200 min)内,用等体积的HCl(0.2 mol/L)酸化0.35 mL样品,然后将溶液与0.1 mL 100 mmol/L乙酸盐缓冲液(pH 4.6)、0.1 mL NaF溶液(10 mmol/L)和0.1 mL 1, 10-菲咯啉溶液(1.5 g/L)混合;显色10 min后,用紫外–可见分光光度计(UV-2700,Shimazu Co. Ltd,日本)在波长为510 nm处测量样品。按照与上述相同的方法,用盐酸羟胺(100 g/L)将Fe(Ⅲ)还原为Fe(Ⅱ)后,分析T-Fe的含量。
1.7 数据处理与统计分析文中数据结果均以均值±标准差表示,采用Excel 2019和Origin 2017进行数据处理及作图。
2 结果与讨论 2.1 FeS的表征 2.1.1 XRD和ICP-OES分析对合成的FeS矿物进行XRD表征以探究其晶体结构,并将所得图谱与标准卡片(FeS#15-0037)进行对比,结果如图 1所示。由图 1可知,在FeS矿物的XRD能谱图中,2θ = 17.61°的位置有明显的衍射峰,与标准卡片中FeS四方硫铁矿的(001)晶面相吻合[18-21],2θ = 30.06°、38.95°、50.43°处的3个特征衍射峰分别对应(101)、(111)和(112)晶面,表明本研究成功合成了FeS矿物。而FeS晶体主衍射峰较尖锐,且无杂峰,表明本次合成的FeS晶体具有良好的纯度及结晶度。此外,通过ICP-OES测定,发现FeS样品中Fe和S元素的质量分数分别为69.84% 和29.10%,也表明本次制备的样品纯度较高。
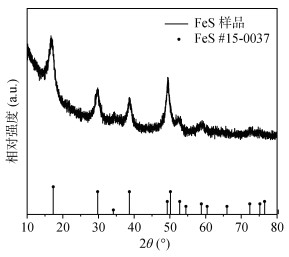
|
图 1 FeS的XRD谱图 Fig. 1 XRD spectra of FeS sample |
为探究本研究合成的FeS矿物的化学结构和元素表面价态,对其进行XPS谱图分析,结果如图 2所示。Fe 2p轨道(图 2A)的拟合结果显示,在结合能为732.52、723.80、718.90、710.44 eV出现的特征峰代表Fe(Ⅲ) –S键,而结合能为721.42、720.13、708.62、707.02 eV的特征峰代表Fe(Ⅱ) –S键,Fe(Ⅲ)和Fe(Ⅱ)的含量占比分别为74.47% 与25.53%。S 2p图谱的拟合结果(图 2B)中,结合能为160.78、161.54和162.03 eV的峰为S2–;结合能为162.64、163.21和164.31 eV的峰为Sn2–(n < 4),结合能为165.82和166.92 eV的峰为Sn2–(n≥4)。
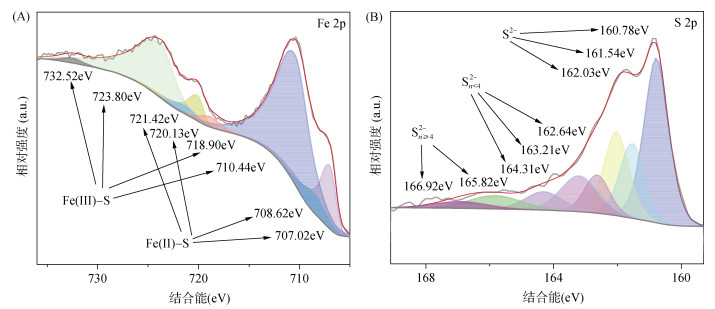
|
图 2 FeS的Fe 2p(A)和S 2p(B)XPS谱图 Fig. 2 XPS spectra of Fe 2p(A) and S 2p(B) of FeS |
XPS结果表明,本次合成的FeS矿物中Fe以Fe(Ⅲ)和Fe(Ⅱ)的形式存在,其中Fe(Ⅲ) –S与四方硫铁矿–胶黄铁矿的相变过程密切相关[22-23],在此过程中,晶体中的Fe(Ⅱ)被Fe(Ⅲ)取代,形成Fe(Ⅱ)xFe(Ⅲ)1-xS结构。此外,S 2p图谱的拟合结果表明,FeS中同时存在单硫化物和多硫化物。
2.1.3 TEM分析采用TEM对本研究合成的FeS矿物表面形貌进行观察,结果如图 3所示。本研究合成的FeS矿物呈现表面褶皱团聚的不规则球状,并在其周围有片状物质,无定形和晶格条纹均有存在。结合FeS矿物的XRD谱图分析,其为(001)片状和(112)晶面等主要矿相[24],片状结构平均长度为78.5 nm,晶格条纹平均间距为0.31 nm。

|
图 3 不同标尺下的FeS矿物TEM图 Fig. 3 TEM plots of FeS at different scales |
在模拟厌氧条件下,加入不同浓度FeS后THI降解情况如图 4A所示。在无FeS参与反应时,THI在厌氧条件下不降解;而在添加0.5 g/L的FeS后,反应6 h后THI降解率提高到81.1%;当FeS添加浓度为1.0和2.0 g/L时,反应360 min后THI几乎完全降解。该结果表明,高浓度的FeS使得THI能够被快速还原降解。
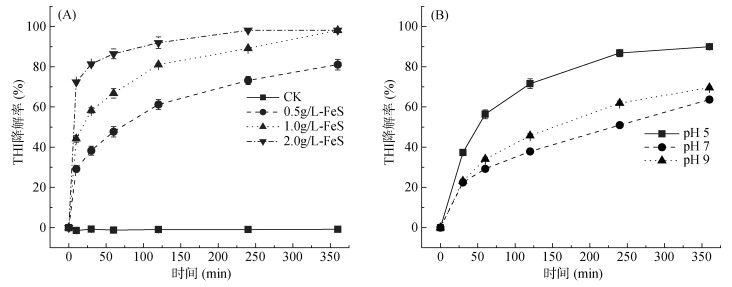
|
图 4 不同浓度FeS(A)和不同pH条件(B)下THI厌氧还原降解率变化情况 Fig. 4 Anaerobic reduction degradation rates of THI under different FeS concentrations (A) and pH values (B) |
我国南方地下水pH主要在5.6 ~ 7.2[25]。初始pH对铁基材料的反应体系具有显著影响,因此本研究选用醋酸钠和四硼酸钠作为缓冲盐,考察不同pH(pH 5 ~ 9)对THI降解的影响,结果如图 4B所示。当pH为7时,反应360 min后THI降解率仅为63.7%;当pH为9时,THI降解率达69.6%;而当pH为5时,THI降解率高达90%:表明酸性条件有利于THI的降解,而中性/碱性条件对该体系降解THI具有一定抑制作用。这可能是因为当pH低于7.0时,高浓度H+有利于界面痕量Fe(Ⅱ)溶解,从而导致FeS界面更多硫空位的产生,使得厌氧条件下FeS对THI的还原能力提高[26]。
2.2.2 共存离子对THI降解的影响环境中天然有机物和无机阴、阳离子的存在可能对FeS介导的THI降解存在影响[27-28],因此,本研究选择腐殖酸(HA)作为代表性天然有机质,选择Cl-、NO3-、CO32-和NO2-作为代表性无机阴离子,K+、Ca2+、Na+、Mg2+、Al3+、Fe2+、Mn2+、NH4+作为代表性无机阳离子,探究在这些有机质或离子存在的条件下FeS对THI降解的影响。如图 5A所示,HA对FeS介导的THI降解没有明显影响,当加入5、10和20 mg/L的HA时,反应360 min后THI降解率分别为90.3%、89.3% 和92.8%。
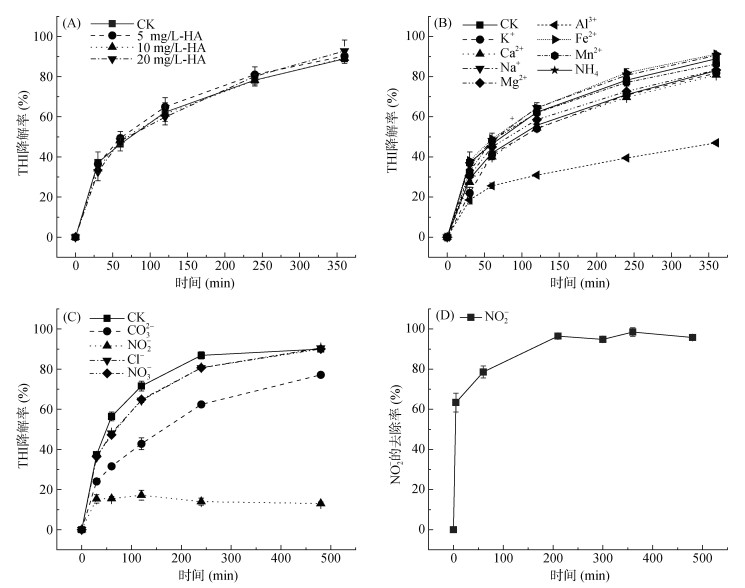
|
图 5 不同浓度HA(A)、不同无机阳离子(B)和不同无机阴离子(C)对THI降解率的影响及NO2-存在时体系NO2-浓度的变化情况(D) Fig. 5 Degradation rates of THI under different concentrations of HA (A), different inorganic cations (B) and inorganic anions (C), and changes of NO2- concentration in the system(D) |
无机阳离子的存在对FeS介导的THI降解具有不同程度的影响(图 5B),反应360 min后各体系THI降解率顺序为:Fe2+(91.2%) > Na+(90.5%) > Mn2+ (86.3%) > Mg2+(83.3%) > NH4+(83.0%) > K+(81.8%) > Ca2+(80.8%) > Al3+(47.0%),其中Ca2+与Al3+对THI降解抑制最为明显。由于FeS的零点电荷电位pHPZC为7.5[21],在pH 5时,Ca2+不仅可与表面带有正电的FeS聚集沉淀,而且在厌氧条件下其可与FeS表面的Fe(Ⅱ)竞争S(-Ⅱ),使结构态Fe(Ⅱ)向离子态Fe(Ⅱ)转化[29]。加入Al3+后,反应体系pH从5.0上升至5.8,溶液pH有可能改变FeS表面的电学性质,从而对THI的降解产生抑制作用[30]。
此外,本研究还考察了土壤环境中几种常见的共存阴离子(Cl-、NO3-、CO32-和NO2-)对FeS介导的THI降解的影响(图 5C)。其中,NO3-对THI的降解过程有轻微影响,反应360 min后,THI降解率能达90.1%,这与前人研究一致[31]。CO32-的存在对THI的降解具有一定抑制作用,反应360 min h后THI降解率为77.2%,这可能是因为CO32-易与·OH自由基反应形成HCO3-,导致体系中活性自由基的减少[26]。当NO2-共存时,THI的降解被显著抑制,降解率仅为13.1%。图 5D显示在与NO2-共存时,NO2-被快速转化,而THI反应在5 min后被中止。这可能归因于NO2-可与FeS表面的S(-Ⅱ)竞争THI,从而抑制THI降解 [32],其反应方程式为FeS+5H2O+9NO2-→ Fe3++SO42−+9NO+10OH−。同时,加入NO2-后,实测pH从5.0上升至5.7,这与NO2-与FeS反应导致OH−释放有关。
2.2.3 FeS还原降解THI的机制探究由于2, 2′-联吡啶(BPY)对Fe(Ⅱ)有很强的络合能力,因此其能快速螯合和钝化溶液和固相Fe(Ⅱ)。如图 6A所示,在厌氧FeS悬浮液中添加0.5 mmol/L的BPY,反应360 min后,THI降解率从88.9%显著下降到60.8%,并随着BPY浓度增加到32 mmol/L时降解率下降到13.1%。该结果证实Fe(Ⅱ)是FeS还原降解THI的主要活性中心,是THI还原的最终电子供体。图 6B为该体系中Fe(Ⅱ)和T-Fe的释放情况,可见,随着反应进行FeS中的铁以溶解态Fe(Ⅱ)的形式不断释放至溶液中,反应360 min后溶液中Fe(Ⅱ)和T-Fe的浓度分别为356 μmol/L和386 μmol/L。为考察释放的溶解态Fe(Ⅱ)在厌氧条件下是否对THI的降解具有贡献作用,因此选取浓度为1 g/L的FeCl2进行探究,结果如图 6C所示,溶解态Fe(Ⅱ)对THI并无降解作用。
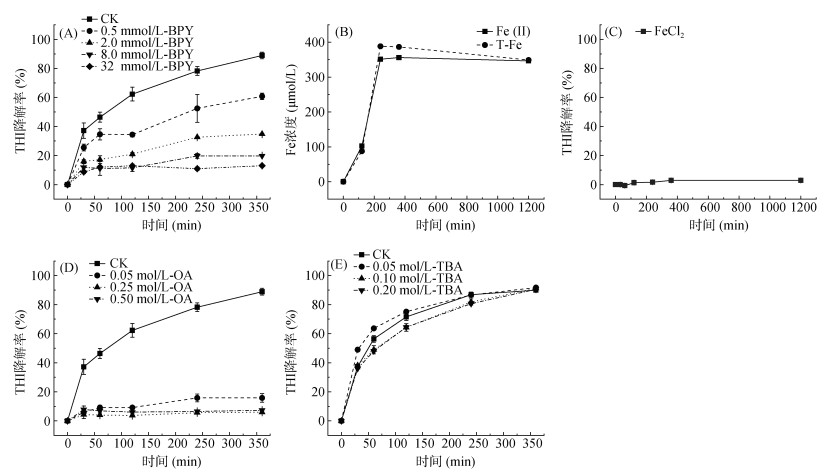
|
(A:不同浓度BPY对THI降解的影响;B:Fe(Ⅱ)和T-Fe在FeS反应体系中的释放情况;C:FeCl2对THI的降解情况;D:不同浓度OA对THI降解的影响;E:TBA对THI降解的影响) 图 6 淬灭试验结果 Fig. 6 Quenching test results |
草酸铵(OA)由于含有丰富的氧官能团,容易与硫空位相结合,通过添加OA可验证硫空位对THI还原降解的影响。图 6D结果表明,OA对THI降解具有显著的抑制作用,且高浓度的OA对THI降解的抑制作用更明显。与对照组相比,当OA浓度为0.05 mol/L时,反应360 min后THI的降解率从88.9%下降至16.8%。此外,当OA用量增加到0.25和0.5 mol/L时,THI的降解几乎完全被抑制。这主要是由于FeS上硫空位对THI的硝基官能团具有结合作用,从而增强了THI与Fe(Ⅱ)之间的电子传递过程,即FeS上Fe(Ⅱ)作为电子供体将电子传递给THI发生还原降解。而OA的加入使其氧原子极易与FeS上的硫空位结合,从而覆盖了FeS表面的硫空位,导致THI的降解完全被抑制[17, 33]。
已有研究报道,厌氧条件下FeS上硫空位能够诱导H2O分子产生·OH[34],因此,本研究在反应体系中添加适量的·OH淬灭剂叔丁醇(TBA)以考察·OH对THI还原的贡献[35]。如图 6E所示,随着TBA浓度增加,THI的降解速率明显受到轻微影响,因此推断,FeS上Fe(Ⅱ)和硫空位是主要活性位点,且溶解态Fe(Ⅱ)与自由基的贡献相对较小。
2.2.4 降解途径本研究采用HPLC-MS/MS检测FeS还原THI的降解产物,并提出了THI降解的可能途径,如图 7所示。首先,THI分子中的–NO2上带负电的O原子与FeS上带正电的硫空位结合,并发生电子转移使其断键,形成亚硝胺中间体,进一步亚硝基发生水解作用被消除转化为–NH2,形成对应的伯腙产物(P1);随后,–NH2官能团会进一步发生还原脱胺基作用,脱硝基THI(P2);产物P2的胺基会进一步发生水解反应,形成尿素–THI代谢产物(P3);在厌氧还原条件下,噻虫嗪中的五元噻唑环上的–Cl基团也会被FeS进一步还原去除,形成对应的脱氯产物(P4)[36-37]。综上,本研究提出FeS还原降解THI的两条路径:还原脱硝和还原脱氯。
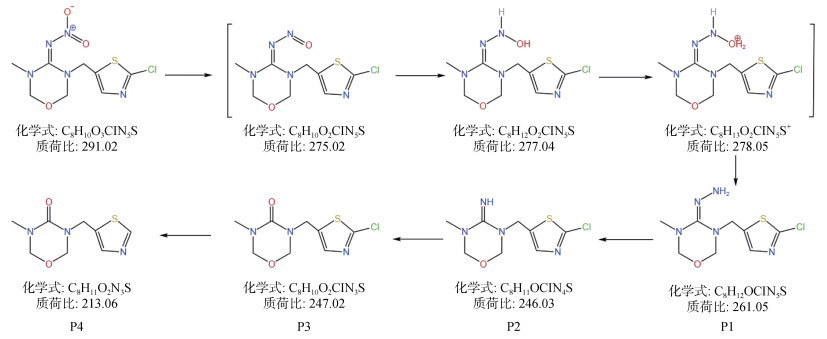
|
图 7 FeS降解THI的转化途径 Fig. 7 Proposed transformation pathways involved in THI degradation by FeS |
模拟厌氧环境中,THI能够被FeS快速还原降解,且在酸性条件下反应更为迅速;当与Al3+或NO2-共存时,THI的还原降解被明显抑制,而其他环境因子影响较小。FeS表面的Fe(Ⅱ)和硫空位是FeS还原降解THI的主要反应活性位点,硫空位与THI的硝基官能团相互作用,从而引发THI的还原降解。FeS还原降解THI主要形成还原性副产物,通过鉴定,本研究进一步提出了THI还原脱硝和还原脱氯两条主要降解途径。
| [1] |
Jeschke P, Nauen R, Schindler M, et al. Overview of the status and global strategy for neonicotinoids[J]. Journal of Agricultural and Food Chemistry, 2011, 59(7): 2897-2908 (  0) 0) |
| [2] |
Liu Z K, Zhang F X, Gao S, et al. Neonicotinoid insecticides in paddy fields: Dissipation dynamics, migration, and dietary risk[J]. Chemosphere, 2024, 359: 142371 (  0) 0) |
| [3] |
Morrissey C A, Mineau P, Devries J H, et al. Neonicotinoid contamination of global surface waters and associated risk to aquatic invertebrates: A review[J]. Environment International, 2015, 74: 291-303 (  0) 0) |
| [4] |
Alsafran M, Rizwan M, Usman K, et al. Neonicotinoid insecticides in the environment: A critical review of their distribution, transport, fate, and toxic effects[J]. Journal of Environmental Chemical Engineering, 2022, 10(5): 108485 (  0) 0) |
| [5] |
Yi X H, Zhang C, Liu H B, et al. Occurrence and distribution of neonicotinoid insecticides in surface water and sediment of the Guangzhou section of the Pearl River, South China[J]. Environmental Pollution, 2019, 251: 892-900 (  0) 0) |
| [6] |
Zhang P, Ren C, Sun H W, et al. Sorption, desorption and degradation of neonicotinoids in four agricultural soils and their effects on soil microorganisms[J]. Science of the Total Environment, 2018, 615: 59-69 (  0) 0) |
| [7] |
Wang W C, Huang D Y, Wang D X, et al. Extensive production of hydroxyl radicals during oxygenation of anoxic paddy soils: Implications to imidacloprid degradation[J]. Chemosphere, 2022, 286: 131565 (  0) 0) |
| [8] |
Mori T, Ohno H, Ichinose H, et al. White-rot fungus Phanerochaete chrysosporium metabolizes chloropyridinyl-type neonicotinoid insecticides by an N-dealkylation reaction catalyzed by two cytochrome P450s[J]. Journal of Hazardous Materials, 2021, 402: 123831 (  0) 0) |
| [9] |
Cheng D, Neumann A, Yuan S H, et al. Oxidative degradation of organic contaminants by FeS in the presence of O2[J]. Environmental Science & Technology, 2020, 54(7): 4091-4101 (  0) 0) |
| [10] |
Gong Y Y, Tang J C, Zhao D Y. Application of iron sulfide particles for groundwater and soil remediation: A review[J]. Water Research, 2016, 89: 309-320 (  0) 0) |
| [11] |
姚远, 余光辉, 滕辉. 土壤铁氧化物–亚铁的相互作用及其环境影响研究进展[J]. 土壤, 2023, 55(4): 718-728 DOI:10.13758/j.cnki.tr.2023.04.004 (  0) 0) |
| [12] |
Huang H, Ji X B, Cheng L Y, et al. Free radicals produced from the oxidation of ferrous sulfides promote the remobilization of cadmium in paddy soils during drainage[J]. Environmental Science & Technology, 2021, 55(14): 9845-9853 (  0) 0) |
| [13] |
程浩淼, 成凌, 朱腾义, 等. 新烟碱类农药在土壤中环境行为的研究进展[J]. 中国环境科学, 2020, 40(02): 736-747 (  0) 0) |
| [14] |
Cheng D, Yuan S H, Liao P, et al. Oxidizing impact induced by mackinawite (FeS) nanoparticles at oxic conditions due to production of hydroxyl radicals[J]. Environmental Science & Technology, 2016, 50(21): 11646-11653 (  0) 0) |
| [15] |
She P, Liu Z N, Sun H, et al. Bio-inspired spinach-leaf-based Au/ZnO nanocomposites as photocatalyst[J]. Journal of Bionic Engineering, 2019, 16(6): 1080-1091 (  0) 0) |
| [16] |
Liu W, Liu J, Zhou P P, et al. Mechanisms for hydroxyl radical production and arsenic removal in sulfur-vacancy greigite (Fe3S4)[J]. Journal of Colloid and Interface Science, 2022, 606(Pt 1): 688-695 (  0) 0) |
| [17] |
Zhu L J, Wang H, Sun J, et al. Sulfur vacancies in pyrite trigger the path to nonradical singlet oxygen and spontaneous sulfamethoxazole degradation: Unveiling the hidden potential in sediments[J]. Environmental Science & Technology, 2024, 58(15): 6753-6762 (  0) 0) |
| [18] |
Wang T, Liu Y Y, Liu B. The pH-sensitive oxygenation of FeS: Mineral transformation and immobilization of Cr(Ⅵ)[J]. Water Research, 2023, 233: 119722 (  0) 0) |
| [19] |
Rickard D, Luther G W. Chemistry of iron sulfides[J]. Chemical Reviews, 2007, 107(2): 514-562 (  0) 0) |
| [20] |
肖文燕. FeS和Fe/FeS颗粒的制备、表征及用于水中Cr(Ⅵ)去除的试验研究[D]. 重庆: 重庆大学, 2016.
(  0) 0) |
| [21] |
Wolthers M, Charlet L, van Der Linde P R, et al. Surface chemistry of disordered mackinawite (FeS)[J]. Geochimica et Cosmochimica Acta, 2005, 69(14): 3469-3481 (  0) 0) |
| [22] |
Mullet M, Boursiquot S, Abdelmoula M, et al. Surface chemistry and structural properties of mackinawite prepared by reaction of sulfide ions with metallic iron[J]. Geochimica et Cosmochimica Acta, 2002, 66(5): 829-836 (  0) 0) |
| [23] |
沈连舟, 蔡月, 孙昭玥, 等. 纳米铁–生物质炭复合材料对苋菜吸收累积菲的影响[J]. 土壤, 2023, 55(4): 848-859 DOI:10.13758/j.cnki.tr.2023.04.019 (  0) 0) |
| [24] |
王涛. 有氧条件下地下水中纳米硫化亚铁的非生物转化及其对Cr(Ⅵ)的去除性能[D]. 重庆: 重庆大学, 2021.
(  0) 0) |
| [25] |
程新伟, 孙继朝. 珠江三角洲地区酸性地下水分布特征及其影响因素研究[J]. 地下水, 2017, 39(5): 25–27, 87 (  0) 0) |
| [26] |
Ma X Y, Cui X L, Zhang H, et al. Efficient catalyst prepared from water treatment residuals and industrial glucose using hydrothermal treatment: Preparation, characterization and its catalytic performance for activating peroxymonosulfate to degrade imidacloprid[J]. Chemosphere, 2022, 290: 133326 (  0) 0) |
| [27] |
廖文娟, 彭薇, 吴聪, 等. 还原态蒙脱石结构Fe(Ⅱ)催化水铁矿转化特性及影响因素[J]. 土壤学报, 2023, 60(2): 469-478 (  0) 0) |
| [28] |
胡敏, 李芳柏. 土壤微生物铁循环及其环境意义[J]. 土壤学报, 2014, 51(04): 683-698 (  0) 0) |
| [29] |
Qi Z L, Lim T T, Snyder S A, et al. Concomitant electro-Fenton processes in iron-based electrocoagulation systems for sulfanilamide degradation: Roles of Ca2+ in Fe(Ⅱ)/Fe(Ⅲ) complexation and electron transfer[J]. ACS ES & T Water, 2022, 2(5): 778-785 (  0) 0) |
| [30] |
Hu H H, Bai Y, Zhou C W, et al. Nitrate chemodenitrification by iron sulfides to ammonium under mild conditions and transformation mechanism[J]. Environmental Science & Technology, 2024, 58(22): 9804-9814 (  0) 0) |
| [31] |
Jiang M Y, Xu Z J, Zhang T T, et al. Synergistic activation of persulfate by FeS@SBA-15 for imidacloprid degradation: Efficiencies, activation mechanism and degradation pathways[J]. Environmental Science and Pollution Research, 2023, 30(30): 75595-75609 (  0) 0) |
| [32] |
Gordon A D, Smirnov A, Shumlas S L, et al. Reduction of nitrite and nitrate on nano-dimensioned FeS[J]. Origins of Life and Evolution of the Biosphere, 2013, 43(4/5): 305-322 (  0) 0) |
| [33] |
Chang Y H, Wu M C. Enhanced photocatalytic reduction of Cr(Ⅵ) by combined magnetic TiO2-based NFs and ammonium oxalate hole scavengers[J]. Catalysts, 2019, 9(1): 72 (  0) 0) |
| [34] |
Ling C C, Liu X F, Li M Q, et al. Sulphur vacancy derived anaerobic hydroxyl radical generation at the pyrite-water interface: Pollutants removal and pyrite self-oxidation behavior[J]. Applied Catalysis B: Environmental, 2021, 290: 120051 (  0) 0) |
| [35] |
Lymar S V, Schwarz H A. Hydrogen atom reactivity toward aqueous tert-butyl alcohol[J]. The Journal of Physical Chemistry A, 2012, 116(5): 1383-1389 (  0) 0) |
| [36] |
Patil P B, Raut-Jadhav S, Pandit A B. Effect of intensifying additives on the degradation of thiamethoxam using ultrasound cavitation[J]. Ultrasonics Sonochemistry, 2021, 70: 105310 (  0) 0) |
| [37] |
Li X Y, Zhang X Y, Zhang P, et al. Incorporation of N-doped biochar into zero-valent iron for efficient reductive degradation of neonicotinoids: Mechanism and performance[J]. Biochar, 2023, 5(1): 78 (  0) 0) |
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China;
3. Engineering Research Center of Eco-environment in Three Gorges Reservoir Region, Ministry of Education, China Three Gorges University, Yichang, Hubei 443002, China;
4. Department of Environmental Science and Engineering, Fudan University, Shanghai 200433, China
 2025, Vol. 57
2025, Vol. 57


