2. 中国科学院大学, 北京 100049
土壤碳是陆地生态系统土壤肥力的重要组成部分,也是土壤结构的组成部分,可以防止土壤退化、荒漠化、侵蚀和养分淋失。土壤是地球第二大碳库,其碳储存量甚至大于生物圈和大气碳库的总和[1]。土壤碳库在全球碳循环中起着重要的碳源、碳汇作用,具有巨大的固碳潜力,其微小变化都会对全球碳平衡以及全球气候变化产生极大影响。土壤碳有两种形式:土壤有机碳(SOC)和无机碳(SIC)[2-4]。土壤中有机碳含量大约为2 000 Pg[5]。土壤有机碳库的巨大规模和潜在的长期封存使它成为全球碳循环的重要组成部分,是地球陆地生态系统最重要、最活跃的碳库。有机碳产生和降解过程可以显著影响CO2的封存或释放,从而直接影响短期气候调节,并为减缓持续的气候变化提供潜在途径[6]。同时,土壤有机碳在维持生态系统功能和健康方面发挥着重要作用,也是植物和土壤生物的重要养分和能量来源[7]。土壤有机碳循环是有机碳进入土壤并在土壤生物(微生物和动物)参与下分解和转化的过程。土壤有机碳的来源主要包括植物和动物残体,这些有机物在土壤中分解和转化并最终形成土壤腐殖质,另外,还包括微生物及其各级代谢产物、植物根系分泌物等[6]。土壤是大气CO2的重要汇和源,是碳捕获和储存的主要调节器之一,并在全球碳循环中发挥重要作用[8]。在干旱地区,由于土壤湿度低、植被少、盐分高、微生物活性低,土壤无机碳积累较多,越来越受到人们的关注[9]。
健康和肥沃的土壤是实现农业可持续发展和保障粮食安全的重要基础[10-11]。土壤酸度是制约耕地产能提升的障碍因素之一,耕地持续酸化对农业生产和生态环境造成严重危害[12]。耕地酸化是由含碳、氮和硫的化合物在土壤中的转化引发[13]。我国酸性土壤面积仍在不断扩大,20世纪80年代强酸性土壤(pH < 5.5)的面积约为1.69亿亩(15亩=1 hm2),21世纪初已增加到2.26亿亩[14]。从20世纪80年代至21世纪初,我国农田土壤pH平均下降了0.5个单位[15]。土壤酸化本是一个较为缓慢的自然过程[14]。然而,近几十年来,由于人为活动的影响使得土壤酸化的进程大大加速,尤其是农田土壤铵态氮肥的过量施用[16-17],导致铵态氮肥的大量剩余,这些铵态氮通过土壤微生物介导的硝化反应生成大量H+,加速土壤酸化[18]。铵态氮肥的过量施用还会导致硝化作用的产物硝酸根增加,硝酸根和盐基离子的耦合迁移淋失也是导致土壤酸化的一个重要因素[19]。35年长期定位施肥试验的结果表明,不施肥处理的土壤pH为5.08,单施尿素处理的土壤pH降低至4.19,其他施无机氮肥处理的土壤pH也显著降低(pH 4.24 ~ 4.78)[20]。1988—2013年25年间,我国南方水稻土pH平均下降0.59个单位,化学氮肥过量施用也是导致水稻土加速酸化的主要原因[21]。另外,酸雨问题也使土壤酸化形势更加严峻[22]。H+浓度升高会使土壤pH降低,土壤中铝、锰和其他重金属活性增加。其中铝对作物根系的毒害作用是酸性土壤中最常见的危害,重金属的活化也会通过食物链危害人体健康。另一方面,土壤酸化过程中H+会通过离子交换作用加速土壤表面交换位上的盐基阳离子(Ca2+,Mg2+,K+,Na+)淋失。这一过程产生大量交换性氢,这些交换性氢极不稳定会进一步转化为交换性铝[23]。此时,土壤固相铝被活化进入土壤阳离子交换位和土壤溶液成为活性铝。酸性条件下磷会与铁、铝形成沉淀而使磷的有效性大大降低,从而导致酸性土壤钙、镁和磷等必需营养元素的缺乏[24-25]。
根据土壤类型和酸化程度的不同,可采用不同的方法来调控土壤酸化。施用石灰、有机物料、生物质炭以及种植耐铝的作物品种是治理土壤酸化的常用方法[26]。改良土壤酸度的机理主要是通过改良剂提高土壤pH,减缓土壤酸化的主要机制是减少质子源和提升土壤pH缓冲容量。通过抑制土壤酸化过程中铝的活化,可以减轻铝毒危害,提高作物产量。其中施用有机物料、提升土壤有机质含量在减缓土壤酸化和抑制固相铝活化中发挥重要作用。
碳循环在土壤酸化及减缓土壤酸化中均发挥作用,虽然国内外对碳循环与土壤酸化和调控的关系已开展较多研究,但缺少系统和全面的总结,本文综述了碳循环在土壤酸化与调控中的作用,可为碳循环及土壤酸化机制的深入研究、土壤酸化调控措施的拟定等提供重要参考,为研发阻控土壤酸化和铝活化的有机调控措施提供理论依据。
1 碳循环在土壤酸化中的作用 1.1 土壤呼吸在土壤酸化中的作用土壤pH是决定土壤稳定性的最重要的指标[21]。当土壤pH≥6时,CO2溶于水形成H2CO3,其离解产生的质子会引起土壤中碳酸盐的消耗而导致盐基阳离子释放和流失[27-28]。由于H2CO3在室温下具有较大的离解常数(pKa1 = 3.76),在土壤CO2分压升高时,它可以作为一种较强的无机酸酸化土壤[4]。空气中CO2的平均分压为0.000 3大气压(0.03%)。由于微生物的活动,土壤空气中CO2浓度远大于0.03%。农田耕作层土壤空气中CO2浓度值从冬天的0.1% 变化到夏天的0.5%;在草被下和施用农家肥的土壤中,夏天峰值期CO2浓度可达1.5% ~ 2.2%。土壤空气中CO2含量为大气中的3倍~ 70倍,对土壤pH产生影响。由于H2CO3为弱酸,对土壤酸化的促进作用主要发生在弱碱性和中性土壤中。
土壤呼吸是指土壤中的植物根系,食碎屑动物、真菌和细菌等进行新陈代谢活动,消耗有机物,产生CO2的过程[29]。土壤呼吸是生态系统与大气之间的第二大碳通量[30]。土壤呼吸可分为异养呼吸和自养呼吸,分别为土壤有机质的分解和植物根系、凋落物的分解[29]。二者的共同之处是呼吸作用都会产生CO2,CO2浓度升高会使其在水中的溶解度增大,从而使土壤或地下水pH降低,导致土壤和地下水的酸化。土壤呼吸作用包括3个生物学过程(植物根呼吸、土壤微生物呼吸和土壤动物呼吸)和一个非生物学过程(含碳有机物质的化学氧化)。研究表明土壤呼吸释放的CO2中30% ~ 50% 来自根呼吸或自养呼吸,其余部分主要来自于土壤微生物对有机质的分解作用和异养呼吸作用[31]。
土壤酸化对土壤呼吸也会产生影响。一方面,土壤酸化过程中,pH不断降低,其对微生物群落结构会产生不利影响,从而会降低土壤呼吸的强度。另一方面,土壤酸化过程中土壤中盐基阳离子会不断被淋失,交换性氢和交换性铝不断增加。土壤酸化产生的Al3+对植物根系有很强的毒害作用,这也会使植物根系的呼吸作用受到抑制。
1.2 植物根系分泌有机酸在土壤酸化中的作用植物在生长过程中通过根,尤其细根,向土壤输入一系列化合物,这些化合物被称为根系分泌物。根系分泌有机物是根系正常、积极的生理现象,是根系固有的生理功能,是植物长期适应外界环境而形成的适应机制。根系分泌物的存在显著影响根际土壤的物理和化学性质[32-33]。植物通过向土壤释放根系分泌物积极调节根际环境,使根/土界面成为陆地生态系统中最具活力的界面之一,成为植物–土壤–微生物相互作用和物质循环的热点区域[32],在陆地生态系统的物质循环中也起着至关重要的作用。通常,为了研究方便,根据根系分泌物的分子质量大小将其大致分为三类:低分子量化合物、高分子量化合物和离子。低分子量根系分泌物主要由糖、脂肪酸、氨基酸、苯酚等组成。高分子量根系分泌物主要来自黏液和细胞外酶,其中黏液由多糖和多醛酸组成。离子主要是用来保持植物体内电荷平衡的H+和OH– [34-35]。植物根系分泌物在土壤溶液中的浓度虽然较低,但在植物生长过程中会持续释放,其是全球碳循环的重要组成部分。根系分泌物是地下碳输入的重要组成部分,占每年光合作用产量的5% ~ 21%[36]。根系分泌的H+和有机酸是土壤酸化的致酸源。
土壤酸化过程中由于H/Al转化导致固相铝活化并产生较多的活性铝,而这些活性铝对植物的根系有较强的毒害作用。植物根系附近的土壤称为根际土壤,植物根系分泌的有机酸或质子会使根际土壤pH降低,加速了根际土壤的酸化,促进土壤黏土矿物的风化和Fe/Al氧化物的溶解[35]。另一方面,当植物遭受酸性土壤铝胁迫时,根系释放有机酸是一些植物抵抗铝毒害的主要机制[37-38]。根系分泌物中的低分子量有机酸如苹果酸、柠檬酸、丙二酸和草酸等,在通常的土壤pH条件下主要以有机酸阴离子形式存在[39]。这些有机酸阴离子在根际与铝发生螯合作用,减少了进入植物根系细胞铝的数量,降低了铝的毒性[40-41]。Jorge和Arruda[42]的研究表明,酸性条件下Al3+诱导玉米根系分泌苹果酸、柠檬酸和草酸等,这些有机酸与铝发生络合作用使Al3+的毒性降低,使玉米根尖细胞对Al3+的吸收减少,缓解Al3+对植物根系的毒害。在这些有机酸中,柠檬酸和草酸与Al3+络合能力最强[43]。
研究发现,某些植物根系释放的特定分泌物对硝化反应有抑制作用[44]。铵态氮肥的硝化作用产生质子是加速农田土壤酸化的主要原因,故这种特定根系分泌物对土壤酸化的进程也会产生阻控作用。这种特定的根系分泌物即生物硝化抑制剂(BNIs)。BNIs可以选择性地抑制硝化微生物的活性,从而抑制土壤中铵态氮转化为硝酸盐的反应速率。目前分别从短柄菊、高粱、水稻和小麦根系分泌物中发现了5种BINs。但对于BNIs的释放部位和释放机制还有待于进一步研究[35, 44]。
1.3 碳酸盐在土壤酸化中的作用土壤碳酸盐占陆地碳库的1/4以上,这部分碳被认为是相对稳定的[45]。土壤碳酸盐(主要为CaCO3)在距地表1 m土层中约含750 Gt碳,在2 m土层中碳含量超过2 300 Gt,几乎与有机碳储量相当[46]。碳酸盐主要存在于中性和碱性土壤中。当土壤中含有碳酸盐时,进入土壤的H+首先与碳酸盐发生反应[47];当土壤pH < 6.2时[48],土壤中碳酸盐消耗殆尽,此时H+主要消耗于层状硅酸盐矿物的风化和与盐基阳离子发生离子交换反应。可见,土壤碳酸盐在减缓土壤酸化方面起着重要作用。碳酸盐对酸有很强的缓冲能力:
| $ \text{CaCO}_{3}+2\text{H}^{+}=\text{C}a^{2+}+\text{H}_{2} \text{O}+\text{CO}_{2} $ |
然而,过去短短几十年内,氮肥的不合理施用对土壤酸化的加速作用使表层土碳酸盐含量显著降低[45]。英国洛桑试验站的长期定位研究表明,连续施化肥80 ~ 90年会耗尽表层土壤碳酸盐[49]。Raza等[27]的研究表明,在过去40年里,中国700万hm2农田土壤已耗尽碳酸盐,到2100年,另有3 000万hm2农田土壤也将耗尽碳酸盐。这不仅使土壤无机碳库减小,而且使土壤对酸的缓冲能力显著降低。最近Huang等[50]发表在Science上的研究结果表明,未来30年,氮肥施用引起的土壤酸化将使全球土壤无机碳(0.3 m土层)减少230亿吨,且对中国和印度的影响最为严重。
土壤碳酸盐对土壤酸化的抑制作用与施用石灰类似。施用石灰是目前常用的改良酸性土壤的方法[46]。石灰在改良土壤酸度的同时,也提高了部分土壤养分的有效性,改善了土壤物理化学性质和生物学特性,并能降低酸性污染土壤中重金属的活性[51]。在酸性土壤上施用石灰的主要作用是消除H+、Al3+和Mn2+的毒性,并提供Ca2+、Mg2+等盐基阳离子。还能提高钼和磷对作物的有效性,故增加了根系活力和养分吸收。施用石灰使土壤pH增加,土壤负电荷增多,从而对阳离子养分的保持能力也有所增强[51]。除此之外,酸性土壤pH提高后土壤微生物活性也将增加,微生物的生态功能增强[51-52]。
1.4 土壤有机质累积和转化在土壤酸化中的作用土壤有机碳对提高土壤肥力和减缓全球变暖有重要意义[53-56]。农田土壤有机碳含量的增加主要归因于有机肥、生物质炭和秸秆等物料的输入,然而,最近的研究发现土壤酸化也是土壤有机碳累积的另一个重要原因[56]。土壤酸化过程中,pH的降低导致土壤微生物活性降低,从而减缓土壤有机质的分解和矿化作用,有利于土壤有机质累积。
土壤有机质是土壤重要的组成部分,对土壤肥力和污染物在土壤中的迁移转化有着重要影响。腐殖质占土壤有机质的85% ~ 90%,常与土壤矿物形成有机无机复合体,是改良土壤、改善土壤结构和供给养分的重要物质,也是土壤肥力水平高低的重要标志之一。
进入土壤中的有机物在微生物的作用下,进行着复杂的转化过程,其中包括矿质化和腐殖化2个方面。微生物分解有机质释放CO2和无机物的过程称为矿化过程,这一过程也是有机物中养分释放的过程。土壤有机质的矿化过程主要涉及有机碳和有机氮的矿化。有机碳的矿化是土壤呼吸作用的一种,前文已作介绍。有机碳矿化产生的CO2促进了中性和碱性土壤的酸化。土壤有机氮的矿化过程首先产生铵态氮,该过程消耗质子,对土壤酸化有缓解作用,但随后铵态氮的硝化过程产生质子。有机氮矿化对土壤酸化影响的方向和程度主要决定于上述2个过程对质子产消的相对贡献。
另外,有机质含较多弱酸性官能团,其离解产生的有机阴离子能够吸附大量盐基离子,增加土壤酸缓冲性能[57];另一方面,有机质中的有机阴离子具有较强的络和能力,能与强酸性土壤中的活性Al3+形成稳定络合物,降低Al3+浓度及其毒性[58-59]。有机质自身的特性对活性铝的吸附有很大影响,腐殖质的含量和芳构化程度越高,越有利于其对活性铝的吸附[58]。
2 有机物料对土壤酸度的改良作用 2.1 秸秆等农业有机废弃物对土壤酸度的改良作用世界各国每年都产生大量农作物秸秆等农业废弃物[60]。由于农作物秸秆含有一定量的碱性物质和丰富的盐基阳离子,可作为土壤酸度的改良剂[61-65]。利用农作物残留物和树木凋落物改良酸性土壤已经得到广泛研究[66-70]。由于植物生长过程中从土壤中吸收盐基养分阳离子(如Ca2+、Mg2+和K+等)的数量多于无机阴离子,为了保持植物体内电荷平衡,植物会通过根系向土壤分泌H+,并在体内合成有机阴离子,导致土壤pH降低,而植物体内积累了一定量的碱性物质(有机阴离子)。植物体积累的碱性物质可以用灰化碱来表征[71]。Wang等[72]的研究结果表明,由于豆科作物在生长过程中比禾本科作物吸收了更多的盐基阳离子,故豆科作物秸秆碱含量更高。然而,豆科作物秸秆中氮含量也比非豆科作物高,向酸性土壤中施用豆科作物秸秆后,由于有机氮的矿化和随后的硝化作用会释放H+,抵消了其本身的部分碱化效应。因此,豆科秸秆施用于酸性土壤时可以选择与硝化抑制剂配合施用从而更好地发挥豆科作物秸秆改良酸性土壤的作用[73]。Pan等[64]利用农作物秸秆制作腐解产物研究其对红壤酸度的改良作用。研究结果表明,豌豆秸秆的腐解产物对红壤的酸度改良作用最好,其次是花生秸秆的腐解产物,两者改良红壤酸度的效果均优于稻草和油菜秸秆腐解产物。
之前的研究表明,施用植物残体后土壤pH会有不同的反应,如pH升高[70]、pH降低[74-75]或pH先升高后降低[61, 68, 72, 76]。这主要与土壤初始pH有关,对于中性和碱性土壤,施用秸秆或秸秆还田会降低土壤pH[77],加速土壤酸化,秸秆分解过程中产生的有机酸及CO2溶解产生的碳酸是这类土壤酸化的质子源,但这些弱酸对酸性土壤的酸化作用非常有限。对于初始pH不同的酸性土壤,施用秸秆的数量和质量决定了土壤pH变化的方向和程度[78]。秸秆施用于土壤后,决定土壤pH变化的主要因素包括植物残体分解释放碱性物质的数量、净氮矿化和随后的硝化反应,故最终土壤pH由以上过程的相对贡献决定[76, 79-80]。因此,根据酸性土壤的特性选择合适的植物材料可更好地发挥其对土壤酸度的改良作用。
施用农作物秸秆提升土壤pH的主要原理是植物所含的碱性物质对土壤酸的中和作用,特别是有机阴离子与土壤溶液中质子的缔合及随后的脱羧基作用和酚羟基的氧化分解等[61, 64, 81]。在酸性土壤中施入秸秆,不仅促进了秸秆中养分的循环利用,而且使秸秆中的碱性物质和盐基阳离子返还土壤,从而提升土壤pH,增加土壤的盐基饱和度,改良土壤酸度[69]。秸秆在腐解过程中,所含养分和有机阴离子会浓缩;另外,秸秆在好氧腐解过程中还可以产生一定量的碳酸盐[64]。因此,秸秆腐解产物对酸性土壤的改良效果优于秸秆直接施用。
秸秆的C/N影响其对土壤无机氮的同化作用,较高的秸秆C/N促进土壤微生物对无机氮的利用,即微生物对硝酸根的同化量增加,这一过程可提升土壤pH,因为同化1 mol硝酸根可以消耗1 mol质子[82-83]。秸秆对土壤无机氮的同化作用是施用秸秆改良土壤酸度的另一个重要机制[81, 84-85]。同时,秸秆对硝酸根的同化还减少土壤中硝酸盐的淋失,减缓由此引起的土壤盐基阳离子的加速淋失[81]。
2.2 畜禽粪便等有机肥对土壤酸度的改良作用我国两千多年前就有在农业上施用有机粪肥的记录[86]。随着时代和科技的进步,人们认识到化肥能大幅度提高作物产量,逐渐减少了有机肥的施用。然而,在资源贫乏地区,由于石灰等无机改良剂资源缺乏,故有机改良剂的使用较为普遍。世界各国的畜禽养殖业将粪肥的农业利用作为养殖业废弃物处理的重要手段[86-87]。
畜禽粪便一般作为有机肥施用于土壤,能有效提高耕地土壤有机质含量、土壤肥力、土壤酶活性及改善土壤理化性质和微生物群落结构,从而提高作物生产的稳定性和可持续性[57, 86, 88-89]。研究表明,施用畜禽粪便等有机肥能有效改良土壤酸度[57, 90-92]。Cai等[93]的研究表明,与对照相比,施用猪粪使土壤pH提高0.2 ~ 0.4个单位,使玉米茎部生物量增加4.7倍~ 7.6倍。施用猪粪后土壤交换性酸明显降低,尤其是交换态铝。这表明施用猪粪能改良土壤酸度,有效促进作物生长。Yi等[94]的研究表明,施用鸡粪堆肥使茶园土壤pH从4.94提高至6.10,降低了茶园土壤酸度,使茶叶产量提高。Hue[95]在温室条件下利用绿叶山蚂蟥盆栽试验研究了鸡粪、污泥和石灰(Ca(OH)2)对强酸性红壤的改良作用。结果表明,添加石灰和有机肥均能明显提高酸性土壤pH并能有效降低酸性土壤的铝毒害作用;5 g/kg和10 g/kg鸡粪对红壤酸度的改良效果分别相当于3.4和6.7 cmol/kg石灰的效果,2% 的污泥相当于6.5 cmol/kg石灰的改良效果;与施用石灰相比,有机肥还明显促进了绿叶山蚂蟥对钙的吸收。这表明施用有机肥对土壤pH提升和植株生长促进作用的综合效果大于污泥和石灰。
另一方面,过量施用猪粪可能导致环境中磷过饱和,对地表水产生负面影响。针对这一问题,Cai等人[93]建议将石灰、秸秆与猪粪配合施用。长期施用化肥加速土壤酸化,将畜禽粪肥与化肥配施能有效改善土壤性质,减缓土壤酸化[96-97]。27年的长期定位田间试验表明,化肥与猪粪配施能有效提升土壤pH,同时还提高了土壤中原核微生物的多样性[91]。中国农科院祁阳红壤站20年长期定位田间试验结果表明,有机肥与化肥配施能阻止土壤酸化和提高作物产量[90]。
畜禽粪便中含有碱性物质,这些碱性物质主要以有机阴离子的形式存在,与阳离子保持电荷平衡[93, 98-99];且能够在土壤中缔合质子,从而使土壤pH升高。同时,畜禽粪便等有机肥还能为土壤提供盐基阳离子,提升土壤交换性盐基阳离子含量,降低土壤交换性酸。这些有机物也能与酸性土壤中的活性铝结合形成有机络合态铝,降低土壤溶液中毒性铝浓度,缓解铝对植物的毒害,改善作物生长条件[93, 100-101]。
2.3 微生物胞外聚合物对土壤酸度的改良作用胞外聚合物(EPS)是指异养微生物在生长代谢过程中产生的有机物质。EPS的主要成分是碳水化合物、蛋白质和核酸,其中碳水化合物和蛋白质占EPS的75% ~ 90%,其在土壤中几乎无处不在[102-105]。
Nkoh等[105]研究了EPS对5种可变电荷土壤酸度的影响。红外光谱的结果表明,EPS中的磷酰基与土壤中的铁铝氧化物形成了Fe-O-P和Al-O-P键,这一过程中释放的OH–使土壤pH提高。这说明EPS表面的有机阴离子在土壤铁铝氧化物表面发生专性吸附。土壤铁铝氧化物是专性吸附的主要吸附剂,铁铝氧化物含量越高的土壤对EPS的吸附量越大[104],释放净OH–越多,使土壤pH升高的幅度越大[104-105]。EPS处理后土壤有机结合态铝和羟基铝的比例增加,而交换性铝含量降低,说明EPS促进了土壤交换态铝向有机结合态铝和羟基铝等非活性铝的转化,能够达到改良土壤酸度的目的。
大部分EPS都含有阴离子官能团(羧基、羟基和巯基等)而带负电荷[106]。这些阴离子官能团与土壤溶液中质子结合,降低土壤酸度[104-105, 107-108]。EPS中的有机阴离子(如–COO–)与活性Al3+形成有机铝络合物,降低了土壤溶液中活性铝浓度,缓解铝毒害[105]。
2.4 壳聚糖等其他有机物对土壤酸度的改良作用壳聚糖是一种天然的可生物降解多糖,可通过一系列化学处理从渔业废物中获得[109]。制备壳聚糖的工艺一般为:鱼鳞、虾蟹壳等经洗涤干燥、脱蛋白,然后用0.5 mol/L NaOH处理生成几丁质,再用浓NaOH将几丁质去乙酰化[110-111]。壳聚糖在工业和农业方面已经得到了广泛应用[112]。如作为添加剂应用于食品、化妆品和制药等;在农业方面主要用于杀菌剂、缓解植物体内重金属积累、缓解盐胁迫以及促进作物对氮磷钾等大量元素的吸收,促进植物生长[113-116]。近年来,壳聚糖也用于土壤酸度的改良[109, 117]。Nkoh等[109]的研究表明,加入4% 壳聚糖的4种酸性红壤培养14天后,土壤pH升高约1个单位,交换性酸含量大幅度降低。对培养后的土壤进行模拟酸化试验,结果表明,相同的酸加入量下,加入壳聚糖处理的土壤交换性铝含量和水溶性铝含量明显低于加入石灰的处理。He等人[117]利用壳聚糖富含的官能团对生物质炭进行官能团扩增改性,然后将改性后的生物质炭施用于水稻土中用于土壤酸度的改良,FTIR和Boehm滴定的结果表明壳聚糖和海藻酸钠的引入使生物质炭的官能团增加,与未改性生物质炭相比,添加改性生物质炭进一步提升了水稻土的酸缓冲性能。
壳聚糖具有丰富的氨基(R-NH2)和羟基(-OH)官能团,当壳聚糖施用于酸性土壤后,其所含氨基和羟基会发生质子化而消耗质子,使土壤pH升高。阴离子官能团与土壤中铁铝氧化物发生配位交换的专性吸附会释放OH-,也能提高土壤pH和酸缓冲性,有机物与土壤中活性铝发生络合作用形成有机络合态铝,降低土壤中活性Al3+对作物的毒害作用。
壳聚糖制备工艺简单,原材料易获取,且成本低。Sapkota等人[118]的报道表明,全球每年会产生1 800 ~ 3 000万吨的鱼业废弃物,这给生态环境带来了严重威胁。若将这些废弃物用于壳聚糖的生产并将壳聚糖应用于酸性土壤改良,则能有效缓解养鱼业产生的废弃物对环境的危害,达到变废为宝的目的。
3 有机物料对土壤酸化的阻控作用pHBC是衡量土壤抗酸化能力的一个重要指标,是决定土壤酸化速率的一个重要因素[64]。土壤pH缓冲反应包括碳酸盐和黏土矿物的溶解、质子与土壤交换性盐基阳离子的交换反应、有机物中官能团的质子化反应。pHBC可以通过阳离子交换容量(CEC)、矿物组成、有机质(OM)和黏粒含量来确定[62, 119-120]。因此,提高土壤pHBC能有效阻控土壤酸化。在pH > 6.8时,pHBC主要受碳酸盐的溶解作用控制;在4.5 < pH < 7.5范围内,主要受盐基阳离子的交换反应影响;而当pH < 4.5时,含铝化合物的溶解作用对土壤pHBC有重要贡献[28]。在4.0 < pH < 6.5范围内,土壤pHBC与土壤有机质含量有密切关系[120-121]。
3.1 秸秆腐解产物对土壤酸化的阻控作用Pan等人[64]利用花生、油菜、水稻和豌豆秸秆腐解150天制备了秸秆腐解产物,施用于土壤进行30天培养试验,培养结束后测得土壤pHBC并进行模拟酸化试验。结果表明,秸秆腐解产物施用于土壤不仅提高了土壤pH,还提高了土壤pHBC,抑制了土壤酸化;其中豌豆秸秆腐解产物的效果最好,其次是花生秸秆腐解产物;秸秆腐解产物有机阴离子的质子化是其提升土壤pHBC的主要机制。盆栽试验进一步验证了上述4种秸秆腐解产物对红黏土和红砂土酸化的阻控作用[65],且施用秸秆腐解产物对红砂土pHBC的提升效果优于红黏土。
农业废弃物经过堆肥形成的腐解产物含有大量的有机物,这些有机物以腐殖质为主,其含有丰富的有机官能团[122-124]。当秸秆腐解产物的pH较高时,官能团离解产生较多有机阴离子[125]。当有外源酸进入土壤时,这些有机阴离子与质子缔合,从而提高了土壤pHBC。
3.2 长期使用畜禽粪肥和提升土壤有机质对土壤酸化的阻控作用为了量化施用化肥造成的土壤酸化速率以及由此确定改良该酸化土壤所需的粪肥量,Cai等人[126]利用18年长期定位试验研究了不同施肥处理的土壤酸度、酸化速率和pHBC变化。研究结果表明,长期施用粪肥的土壤与对照相比,有机碳、交换性盐基含量、pHBC、pH明显提高,而土壤交换性铝含量、酸化速率和石灰需要量明显降低。表明单施粪肥或化肥与粪肥配施均能有效阻控土壤酸化,有助于农业的可持续发展。
Shi等人[57]研究了长期施用畜禽粪肥后土壤酸度及土壤pHBC的变化,利用模拟酸化试验验证了提升土壤有机质抑制土壤酸化的效果。结果表明,长期施肥后土壤有机质含量、土壤pHBC和土壤CEC的大小顺序为:单施畜禽粪肥 > 畜禽粪肥与化肥配施 > 单施化肥。这说明长期施用畜禽粪肥主要通过提高土壤有机质含量和CEC提升土壤pHBC,有机质中有机阴离子的质子化是其提升土壤pHBC的主要机制。模拟酸化试验结果表明,当添加相同量的外源酸时长期单施畜禽粪肥处理pH下降幅度最小,其次是畜禽粪肥与化肥配施处理,单施化肥处理土壤pH下降幅度最大。这些结果进一步证实长期施用畜禽粪肥对土壤酸化的阻控作用。作者近期的研究[23]也表明,在恒pH条件下,同种类型的土壤其酸中和能力主要取决于土壤有机质含量。当用恒pH自动电位滴定仪将两种红壤pH降低至相同值时,有机质含量高的土壤其酸消耗量也多。这说明,土壤有机质在该条件下对土壤酸缓冲能力有重要贡献。另一方面,当用双氧水去除红壤中部分有机质后进行类似的试验,结果表明,部分去除有机质后,土壤酸消耗量明显降低。这说明部分去除有机质后土壤酸缓冲性能降低,即土壤有机质对土壤酸化有阻控作用。
Nelson和Su[120]的研究发现,随着土壤深度的增加,土壤pHBC逐渐降低,这也表明,随着土壤有机质含量的降低,土壤pHBC降低。目前学者们普遍认为土壤有机质中含有的羧基、酚羟基等弱酸性官能团离解产生的有机阴离子通过质子化作用消耗质子,从而提高了土壤pHBC[57, 62]。这是土壤有机质阻控土壤酸化的主要机制(图 1)。
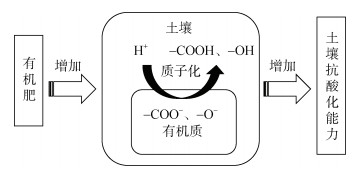
|
图 1 施用有机肥提高土壤抗酸化能力的机制 Fig. 1 Mechanisms for organic fertilizer application to improve soil resistance to acidification |
由于铵态氮肥过量施用,土壤中残留的多余铵态氮会迅速发生硝化作用而产生大量质子使土壤迅速酸化。因此除了合理施用铵态氮肥外,如果能控制残余铵态氮的硝化作用,则也能有效控制因过量施肥导致的农田土壤酸化。
最近,Guan等人[127]的研究表明,向土壤中添加易分解的有机碳,能有效促进微生物对碳的矿化作用和对铵态氮的同化作用,从而抑制因铵态氮肥的硝化作用引起的土壤酸化。
4 有机物对土壤铝活化的抑制作用 4.1 外源施用有机肥对土壤铝活化的抑制作用在酸性土壤上施用有机肥不仅能通过提高土壤的酸缓冲容量来阻控土壤酸化,还能通过抑制土壤铝的活化来降低酸性土壤中铝的毒害作用。早在1995年,Wong等[128]就发现施用农家肥可以改良布隆迪酸性砖红壤,缓解土壤铝毒害,提高玉米和大豆产量。这些有机物质改良土壤酸度的机制是有机阴离子的专性吸附和随后羟基的释放[95]。长达18年的长期定位试验结果表明,施肥8 ~ 12年后,施氮肥、氮磷肥、氮磷钾肥处理的土壤pH从5.7分别下降至4.2、4.5、4.5后趋于稳定[126],3种施肥处理均明显提高了土壤交换性酸,降低了土壤交换性盐基并且加快了土壤的酸化速率。与此相反,施用有机肥的土壤pH没有明显变化且增加了土壤交换性盐基。这表明施用有机肥能有效抑制因施化肥引起的土壤酸化,从而也抑制了土壤酸化过程中铝的活化。最近的研究表明,猪粪有机肥和石灰配施对改良土壤酸度和提高作物产量有显著的促进作用[93]。与单施石灰的处理相比,石灰与猪粪配施进一步降低土壤交换性酸,从而降低了铝对作物的毒害作用,提高了作物产量。
外源施用有机肥增加了土壤有机质含量,其中的有机官能团阴离子对H+有着很强的吸附作用,抑制了土壤酸化过程中的氢铝转化过程,从而抑制了质子与矿物表面的反应,抑制了铝的活化。
4.2 壳聚糖等其他有机物对土壤铝活化的抑制作用在酸性土壤中添加壳聚糖,不仅能提高土壤抗酸化能力,也能抑制土壤酸化过程中铝的活化。Nkoh等人[109]通过室内培养试验研究了壳聚糖对酸性土壤铝活化的影响。结果表明,在土壤中加入壳聚糖培养14天后,与对照相比,壳聚糖的加入能有效降低土壤交换性铝和水溶性铝等活性铝的含量。这是由于壳聚糖含有丰富的-NH2官能团来消耗更多的质子,抑制土壤酸化过程中铝的活化。
作者最近的研究[129]表明,利用硅氧烷改性土壤中常见的层状硅酸盐矿物后,对酸化过程中矿物铝活化也有抑制作用。其具体机理是,硅氧烷能与层状硅酸盐矿物表面的羟基发生脱水缩合反应生成共价键进而能嫁接到矿物表面,这阻止了H+与矿物表面羟基的反应,从而抑制了矿物固相铝的活化(图 2)。
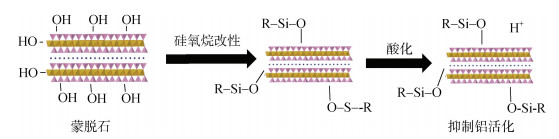
|
图 2 硅氧烷改性抑制蒙脱石酸化过程中固相铝活化示意图 Fig. 2 Schematic diagram of solid phase aluminum mobilization during acidification inhibition of montmorillonite modified with siloxane |
土壤有机质一般与层状硅酸盐矿物、铁/铝氧化物紧密结合而形成有机–无机复合体,这使得土壤有机质对酸化过程中矿物铝活化有重要抑制作用。
作者最近的研究[130]表明,相同pH条件下,红壤,黄棕壤和黑土中有机质含量较高的表层土壤交换性铝含量低于有机质含量较低的表下层土壤。这进一步证明了土壤酸化过程中有机质对铝活化的抑制作用。Shi等人[57]对长期施用有机肥的土壤进行模拟酸化试验,发现长期施用有机肥增加了土壤有机质含量,能有效抑制土壤酸化过程中交换性铝和水溶性铝的产生。
对于农田耕地土壤,可以通过施用有机肥、秸秆还田来增加土壤有机质含量,进而减缓酸性土壤铝活化及活性铝对作物的毒害作用。
4.4 可溶性有机物对铝毒的缓解作用土壤酸化过程中,随着pH的降低,土壤中会逐渐产生活性铝,尤其是在pH较低的条件下(pH < 5.0),土壤溶液中存在大量活性铝。这些活性铝不仅会对植物根系产生毒害作用,当其进入水体后,还会对水生生物产生毒害作用。植物根系对铝的吸附作用是铝毒害的机制之一[131]。吸附态铝通过减少细胞壁松弛导致根细胞破裂,然后在亚细胞水平上通过对质膜、细胞质和细胞核的不利作用减少根的生长[132]。尤其对于铝敏感植物[133-134],其根表一般带有较多负电荷,吸附的Al3+较多,受到铝毒害也越大。此外,铝对植物的毒害作用大小取决于土壤溶液中铝的形态。土壤溶液中铝一般以Al3+、羟基铝、络合态铝等形态存在[135]。其中,Al3+和单体羟基铝是毒性最强的形态,而以络合态铝形态存在的铝毒性一般较小或没有毒害[136]。
土壤溶液中可溶性有机碳(DOC)通过与溶液中毒性Al3+形成络合物缓解铝对植物的毒害。Shi等人[59]在土壤悬液体系中研究了施用生物质炭对酸性土壤玉米生长的影响。结果表明,与施用石灰处理相比,施用花生秸秆炭的土壤中玉米幼苗根系伸长增加99%,玉米根尖伊文斯蓝吸收量和铝含量分别降低60% 和51%。这归因于花生秸秆炭处理的土壤酸化过程中pH下降缓慢且花生秸秆炭释放的DOC与土壤中活性Al3+形成了DOC-Al络合物,大幅度降低了铝的毒性。最近,Yu等人[137]的研究也进一步证明了酸性土壤中施用生物质炭因能将土壤中毒性较大的单核铝转化为DOC-Al而有效缓解铝对玉米根系的毒害作用。
5 总结与展望本文较系统综述了土壤呼吸、根系分泌有机物、土壤碳酸盐反应和有机质的累积和转化等碳循环过程在土壤酸化中的作用,总结了畜禽粪便、壳聚糖等有机物料对土壤酸化的阻控和对土壤酸度的改良,阐明了土壤有机质等对土壤酸化过程中铝活化的抑制作用及有机质缓解植物铝毒害的机制。基于目前的研究现状与不足,未来应加强以下3个方面的研究。
1) 加强农业废弃物及其衍生产品在酸性土壤改良中的应用研究,通过提高土壤有机质含量阻控土壤酸化和铝活化。虽然直接施用农作物秸秆等农业废弃物对土壤酸度有一定的改良效果,但由于单位质量秸秆等农业废弃物的碱含量较低,改良效率不高。通过秸秆堆腐可以实现秸秆中有效成分的浓缩和减量化,利用一定的技术手段提升秸秆腐解过程中碳酸盐的生成量,可以制备高效有机–无机复合酸性土壤改良剂。如何提升秸秆腐解产物中碳酸盐的含量是下一步需要重点研究的方向。长期施用有机肥或有机肥与化肥配施能增加土壤有机质含量,有效阻控土壤酸化。然而,目前施用于土壤中的有机肥转化为土壤有机质的效率较低,尤其是结构稳定的有机质。因此,如何快速、高效提升土壤稳定态有机质含量,从而减缓土壤酸化和铝活化,也是未来需要重点加强的研究方向。
2) 加强土壤中黏土矿物和氧化物与土壤有机质相互作用的研究,通过提高土壤有机碳的稳定性,增强有机碳对土壤酸化和铝活化阻控作用的持续性。热带和亚热带酸性土壤地区,土壤有机质易分解,不易积累。但土壤有机质与铁铝氧化物形成复合物后其稳定性会增强,土壤有机质与层状硅酸盐矿物和铁铝氧化物形成多元复合物后,不仅可以提升土壤有机质的稳定性,而且能有效抑制土壤层状硅酸盐矿物中铝的活化。但如何在田间条件下促进土壤有机质与层状硅酸盐矿物和铁铝氧化物的结合以形成稳定的多元复合体,还有待今后的进一步研究。
3) 加强土壤C/N耦合研究,通过优化外源施用的有机物料与化学氮肥的配比来降低土壤中氮肥的硝化作用,减缓土壤酸化速率。通过外源添加易分解的碳源,可以促进微生物对无机氮的利用,将土壤中无机氮同化为微生物生物量氮,进而减少无机氮的硝化作用,降低H+的产生量,抑制土壤酸化。然而外源施加的有机物料与氮肥的具体配比还需要进一步研究,尤其对于弱酸性和中性土壤。需要满足作物对氮肥需求的同时,多余的氮肥能通过外源施加的碳源转化为微生物生物量氮,从而避免因硝化反应引起的土壤酸化。
| [1] |
Lu T P, Wang X J, Xu M G, et al. Dynamics of pedogenic carbonate in the cropland of the North China Plain: Influences of intensive cropping and salinization[J]. Agriculture, Ecosystems & Environment, 2020, 292: 106820 (  0) 0) |
| [2] |
Zhang F, Wang X J, Guo T W, et al. Soil organic and inorganic carbon in the loess profiles of Lanzhou area: Implications of deep soils[J]. Catena, 2015, 126: 68-74 (  0) 0) |
| [3] |
Guo Y, Wang X J, Li X L, et al. Dynamics of soil organic and inorganic carbon in the cropland of upper Yellow River Delta, China[J]. Scientific Reports, 2016, 6: 36105 (  0) 0) |
| [4] |
Ferdush J, Paul V. A review on the possible factors influencing soil inorganic carbon under elevated CO2[J]. Catena, 2021, 204: 105434 (  0) 0) |
| [5] |
Janzen H H. Carbon cycling in earth systems—a soil science perspective[J]. Agriculture, Ecosystems & Environment, 2004, 104(3): 399-417 (  0) 0) |
| [6] |
Wu H W, Cui H L, Fu C X, et al. Unveiling the crucial role of soil microorganisms in carbon cycling: A review[J]. Science of The Total Environment, 2024, 909: 168627 (  0) 0) |
| [7] |
Jansson J K, Hofmockel K S. Soil microbiomes and climate change[J]. Nature Reviews Microbiology, 2019, 18(1): 35-46 (  0) 0) |
| [8] |
Ahmad W, Singh B, Dalal R C, et al. Carbon dynamics from carbonate dissolution in Australian agricultural soils[J]. Soil Research, 2015, 53(2): 144 (  0) 0) |
| [9] |
Naorem A, Jayaraman S, Dalal R C, et al. Soil inorganic carbon as a potential sink in carbon storage in dryland soils—a review[J]. Agriculture, 2022, 12(8): 1256 (  0) 0) |
| [10] |
Holland J E, Bennett A E, Newton A C, et al. Liming impacts on soils, crops and biodiversity in the UK: A review[J]. Science of The Total Environment, 2018, 610: 316-332 (  0) 0) |
| [11] |
Davis A G, Huggins D R, Reganold J P. Linking soil health and ecological resilience to achieve agricultural sustainability[J]. Frontiers in Ecology and the Environment, 2023, 21(3): 131-139 (  0) 0) |
| [12] |
徐仁扣. 土壤酸化及其调控研究进展[J]. 土壤, 2015, 47(2): 238-244 (  0) 0) |
| [13] |
Huang K, Li M Q, Li R P, et al. Soil acidification and salinity: The importance of biochar application to agricultural soils[J]. Frontiers in Plant Science, 2023, 14: 1206820 (  0) 0) |
| [14] |
徐仁扣, 李九玉, 周世伟, 等. 我国农田土壤酸化调控的科学问题与技术措施[J]. 中国科学院院刊, 2018, 33(2): 160-167 (  0) 0) |
| [15] |
张福锁. 我国农田土壤酸化现状及影响[J]. 民主与科学, 2016(6): 26-27 DOI:10.3969/j.issn.1003-0026.2016.06.009 (  0) 0) |
| [16] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010 (  0) 0) |
| [17] |
Bolan S, Padhye L P, Mulligan C N, et al. Surfactant-enhanced mobilization of persistent organic pollutants: Potential for soil and sediment remediation and unintended consequences[J]. Journal of Hazardous Materials, 2023, 443: 130189 (  0) 0) |
| [18] |
Fageria N K, Nascente A S. Chapter six management of soil acidity of south American soils for sustainable crop production[J]. Advances in Agronomy, 2014, 128: 221-275 (  0) 0) |
| [19] |
赵学强, 潘贤章, 马海艺, 等. 中国酸性土壤利用的科学问题与策略[J]. 土壤学报, 2023, 60(5): 1248-1263 (  0) 0) |
| [20] |
Wang J L, Liu K L, Zhao X Q, et al. Microbial keystone taxa drive crop productivity through shifting aboveground-belowground mineral element flows[J]. Science of The Total Environment, 2022, 811: 152342 (  0) 0) |
| [21] |
周晓阳, 周世伟, 徐明岗, 等. 中国南方水稻土酸化演变特征及影响因素[J]. 中国农业科学, 2015, 48(23): 4811-4817 DOI:10.3864/j.issn.0578-1752.2015.23.022 (  0) 0) |
| [22] |
Yu H L, He N P, Wang Q F, et al. Wet acid deposition in Chinese natural and agricultural ecosystems: Evidence from national-scale monitoring[J]. Journal of Geophysical Research: Atmospheres, 2016, 121(18): 10, 995-11, 005 (  0) 0) |
| [23] |
Li K W, Lu H L, Nkoh J N, et al. Aluminum mobilization as influenced by soil organic matter during soil and mineral acidification: A constant pH study[J]. Geoderma, 2022, 418: 115853 (  0) 0) |
| [24] |
Ritchie G S P. The chemical behavior of aluminum, hydrogen and manganese in acid soils//Robson A D. Soil acidity and plant growth[M].
Academic Press, Amsterdam, 1989: 1-60
(  0) 0) |
| [25] |
Cui L L, Liang J H, Fu H B, et al. The contributions of socioeconomic and natural factors to the acid deposition over China[J]. Chemosphere, 2020, 253: 126491 (  0) 0) |
| [26] |
Golla A S. Soil acidity and its management options in Ethiopia: A review[J]. International Journal of Scientific Research and Management, 2019, 7(11): 1429-1440 (  0) 0) |
| [27] |
Raza S, Miao N, Wang P Z, et al. Dramatic loss of inorganic carbon by nitrogen-induced soil acidification in Chinese croplands[J]. Global Change Biology, 2020, 26(6): 3738-3751 (  0) 0) |
| [28] |
Bowman W D, Cleveland C C, Halada Ĺ, et al. Negative impact of nitrogen deposition on soil buffering capacity[J]. Nature Geoscience, 2008, 1(11): 767-770 (  0) 0) |
| [29] |
Kuzyakov Y. Sources of CO2 efflux from soil and review of partitioning methods[J]. Soil Biology and Biochemistry, 2006, 38(3): 425-448 (  0) 0) |
| [30] |
Chen D M, Wang Y, Lan Z C, et al. Biotic community shifts explain the contrasting responses of microbial and root respiration to experimental soil acidification[J]. Soil Biology and Biochemistry, 2015, 90: 139-147 (  0) 0) |
| [31] |
Bowden R D, Nadelhoffer K J, Boone R D, et al. Contributions of aboveground litter, belowground litter, and root respiration to total soil respiration in a temperate mixed hardwood forest[J]. Canadian Journal of Forest Research, 1993, 23(7): 1402-1407 (  0) 0) |
| [32] |
Hinsinger P, Gobran G R, Gregory P J, et al. Rhizosphere geometry and heterogeneity arising from root-mediated physical and chemical processes[J]. New Phytologist, 2005, 168(2): 293-303 (  0) 0) |
| [33] |
Bais H P, Weir T L, Perry L G, et al. The role of root exudates in rhizosphere interactions with plants and other organisms[J]. Annual Review of Plant Biology, 2006, 57: 233-266 (  0) 0) |
| [34] |
Badri D V, Vivanco J M. Regulation and function of root exudates[J]. Plant, Cell & Environment, 2009, 32(6): 666-681 (  0) 0) |
| [35] |
Ma W M, Tang S H, Dengzeng Z M, et al. Root exudates contribute to belowground ecosystem hotspots: A review[J]. Frontiers in Microbiology, 2022, 13: 937940 (  0) 0) |
| [36] |
Marschner H. The soil–root interface (rhizosphere) in relation to mineral mutrition//Marschner H. Marschner's mineral nutrition of higher plants(Second Ed)[M].
Academic Press, Amsterdam, 2002: 537-595
(  0) 0) |
| [37] |
Pellet D M, Grunes D L, Kochian L V. Organic acid exudation as an aluminum-tolerance mechanism in maize (Zea mays L.)[J]. Planta, 1995, 196(4): 788-795 (  0) 0) |
| [38] |
Jones D L. Organic acids in the rhizosphere–a critical review[J]. Plant and Soil, 1998, 205(1): 25-44 (  0) 0) |
| [39] |
Jones D L, Dennis P G, Owen A G, et al. Organic acid behavior in soils–misconceptions and knowledge gaps[J]. Plant and Soil, 2003, 248(1): 31-41 (  0) 0) |
| [40] |
陈龙池, 廖利平, 汪思龙, 等. 外源毒素对林地土壤养分的影响[J]. 生态学杂志, 2002, 21(1): 19-22 (  0) 0) |
| [41] |
Magalhaes J V, Liu J P, Guimarães C T, et al. A gene in the multidrug and toxic compound extrusion (MATE) family confers aluminum tolerance in sorghum[J]. Nature Genetics, 2007, 39(9): 1156-1161 (  0) 0) |
| [42] |
Jorge R A, Arruda P. Aluminum-induced organic acids exudation by roots of an aluminum-tolerant tropical maize[J]. Phytochemistry, 1997, 45(4): 675-681 (  0) 0) |
| [43] |
Li J Y, Xu R K, Tiwari D, et al. Mechanism of aluminum release from variable charge soils induced by low-molecular-weight organic acids: Kinetic study[J]. Geochimica et Cosmochimica Acta, 2006, 70(11): 2755-2764 (  0) 0) |
| [44] |
Coskun D, Britto D T, Shi W M, et al. How plant root exudates shape the nitrogen cycle[J]. Trends in Plant Science, 2017, 22(8): 661-673 (  0) 0) |
| [45] |
Kim J H, Jobbágy E G, Richter D D, et al. Agricultural acceleration of soil carbonate weathering[J]. Global Change Biology, 2020, 26(10): 5988-6002 (  0) 0) |
| [46] |
Zamanian K, Zhou J B, Kuzyakov Y. Soil carbonates: The unaccounted, irrecoverable carbon source[J]. Geoderma, 2021, 384: 114817 (  0) 0) |
| [47] |
Sanderman J. Can management induced changes in the carbonate system drive soil carbon sequestration? A review with particular focus on Australia[J]. Agriculture, Ecosystems & Environment, 2012, 155: 70-77 (  0) 0) |
| [48] |
Ulrich B. Natural and anthropogenic components of soil acidification[J]. Zeitschrift Für Pflanzenernä hrung und Bodenkunde, 1986, 149(6): 702-717 (  0) 0) |
| [49] |
Poulton P R. Management and modification procedures for long-term field experiments[J]. Canadian Journal of Plant Science, 1996, 76(4): 587-594 (  0) 0) |
| [50] |
Huang Y Y, Song X D, Wang Y P, et al. Size, distribution, and vulnerability of the global soil inorganic carbon[J]. Science, 2024, 384(6692): 233-239 (  0) 0) |
| [51] |
Bolan N S, Adriano D C, Curtin D. Soil acidification and liming interactions with nutrientand heavy metal transformationand bioavailability[M]//Advances in Agronomy. Amsterdam: Elsevier, 2003: 215–272.
(  0) 0) |
| [52] |
Chan K Y, Heenan D P. Effect of lime (CaCO3) application on soil structural stability of a red earth[J]. Soil Research, 1998, 36(1): 73 (  0) 0) |
| [53] |
Schlesinger W H. Carbon sequestration in soils[J]. Science, 1999, 284(5423): 2095 (  0) 0) |
| [54] |
Lal R. Soil carbon sequestration impacts on global climate change and food security[J]. Science, 2004, 304(5677): 1623-1627 (  0) 0) |
| [55] |
Powlson D S, Whitmore A P, Goulding K W T. Soil carbon sequestration to mitigate climate change: A critical re-examination to identify the true and the false[J]. European Journal of Soil Science, 2011, 62(1): 42-55 (  0) 0) |
| [56] |
Zhang X M, Guo J H, Vogt R D, et al. Soil acidification as an additional driver to organic carbon accumulation in major Chinese croplands[J]. Geoderma, 2020, 366: 114234 (  0) 0) |
| [57] |
Shi R Y, Liu Z D, Li Y, et al. Mechanisms for increasing soil resistance to acidification by long-term manure application[J]. Soil and Tillage Research, 2019, 185: 77-84 (  0) 0) |
| [58] |
秦瑞君, 陈福兴. 有机质对土壤高活性铝的影响[J]. 土壤通报, 1998, 29(3): 111-112 (  0) 0) |
| [59] |
Shi R Y, Ni N, Nkoh J N, et al. Biochar retards Al toxicity to maize (Zea mays L.) during soil acidification: The effects and mechanisms[J]. Science of The Total Environment, 2020, 719: 137448 (  0) 0) |
| [60] |
Chen J H, Gong Y Z, Wang S Q, et al. To burn or retain crop residues on croplands? An integrated analysis of crop residue management in China[J]. Science of The Total Environment, 2019, 662: 141-150 (  0) 0) |
| [61] |
Xu R K, Coventry D R. Soil pH changes associated with lupin and wheat plant materials incorporated in a red–brown earth soil[J]. Plant and Soil, 2003, 250(1): 113-119 (  0) 0) |
| [62] |
Xu R K, Zhao A Z, Yuan J H, et al. pH buffering capacity of acid soils from tropical and subtropical regions of China as influenced by incorporation of crop straw biochars[J]. Journal of Soils and Sediments, 2012, 12(4): 494-502 (  0) 0) |
| [63] |
Medina J, Monreal C, Barea J M, et al. Crop residue stabilization and application to agricultural and degraded soils: A review[J]. Waste Management, 2015, 42: 41-54 (  0) 0) |
| [64] |
Pan X Y, Shi R Y, Hong Z N, et al. Characteristics of crop straw-decayed products and their ameliorating effects on an acidic Ultisol[J]. Archives of Agronomy and Soil Science, 2021, 67(12): 1708-1721 (  0) 0) |
| [65] |
Pan X Y, Xu R K, Nkoh J N, et al. Effects of straw decayed products of four crops on the amelioration of soil acidity and maize growth in two acidic Ultisols[J]. Environmental Science and Pollution Research, 2021, 28(5): 5092-5100 (  0) 0) |
| [66] |
Pocknee S, Sumner M E. Cation and nitrogen contents of organic matter determine its soil liming potential[J]. Soil Science Society of America Journal, 1997, 61(1): 86-92 (  0) 0) |
| [67] |
Noble A D, Randall P J. Alkalinity effects of different tree litters incubated in an acid soil of N. S. W., Australia[J]. Agroforestry Systems, 1999, 46(2): 147-160 (  0) 0) |
| [68] |
Tang C, Yu Q. Impact of chemical composition of legume residues and initial soil pH on pH change of a soil after residue incorporation[J]. Plant and Soil, 1999, 215(1): 29-38 (  0) 0) |
| [69] |
Yan F, Schubert S. Soil pH changes after application of plant shoot materials of faba bean and wheat[J]. Plant and Soil, 2000, 220(1): 279-287 (  0) 0) |
| [70] |
Wang N, Li J Y, Xu R K. Use of agricultural by-products to study the pH effects in an acid tea garden soil[J]. Soil Use and Management, 2009, 25(2): 128-132 (  0) 0) |
| [71] |
Noble A D, Zenneck I, Randall P J. Leaf litter ash alkalinity and neutralisation of soil acidity[J]. Plant and Soil, 1996, 179(2): 293-302 (  0) 0) |
| [72] |
Wang N, Xu R K, Li J Y. Amelioration of an acid ultisol by agricultural by-products[J]. Land Degradation & Development, 2011, 22(6): 513-518 (  0) 0) |
| [73] |
Mao J, Xu R K, Li J Y, et al. Dicyandiamide enhances liming potential of two legume materials when incubated with an acid Ultisol[J]. Soil Biology and Biochemistry, 2010, 42(9): 1632-1635 (  0) 0) |
| [74] |
Owen K M, Marrs R H, Snow C S R, et al. Soil acidification—the use of sulphur and acidic plant materials to acidify arable soils for the recreation of heathland and acidic grassland at Minsmere, UK[J]. Biological Conservation, 1999, 87(1): 105-121 (  0) 0) |
| [75] |
Rosolem C A. Exchangeable basic cations and nitrogen distribution in soil as affected by crop residues and nitrogen[J]. Brazilian Archives of Biology and Technology, 2011, 54(3): 441-450 (  0) 0) |
| [76] |
Paul K I, Black A S, Conyers M K. Influence of fallow, wheat and subterranean clover on pH within an initially mixed surface soil in the field[J]. Biology and Fertility of Soils, 2001, 33(1): 41-52 (  0) 0) |
| [77] |
Liang F, Li B Z, Vogt R D, et al. Straw return exacerbates soil acidification in major Chinese croplands[J]. Resources, Conservation and Recycling, 2023, 198: 107176 (  0) 0) |
| [78] |
Vanzolini J I, Galantini J A, Martínez J M, et al. Changes in soil pH and phosphorus availability during decomposition of cover crop residues[J]. Archives of Agronomy and Soil Science, 2017, 63(13): 1864-1874 (  0) 0) |
| [79] |
Xu J M, Tang C, Chen Z L. The role of plant residues in pH change of acid soils differing in initial pH[J]. Soil Biology and Biochemistry, 2006, 38(4): 709-719 (  0) 0) |
| [80] |
Xiao K C, Xu J M, Tang C X, et al. Differences in carbon and nitrogen mineralization in soils of differing initial pH induced by electrokinesis and receiving crop residue amendments[J]. Soil Biology and Biochemistry, 2013, 67: 70-84 (  0) 0) |
| [81] |
Cai Z J, Xu M G, Wang B R, et al. Effectiveness of crop straws, and swine manure in ameliorating acidic red soils: A laboratory study[J]. Journal of Soils and Sediments, 2018, 18(9): 2893-2903 (  0) 0) |
| [82] |
Bolan N S, Hedley M J.. Role of carbon, nitrogen, and sulfur cycles in soil acidification//Rengel Z. Handbook of soil acidity[M].
CRC Press, New York, 2003: 29-55
(  0) 0) |
| [83] |
Cheng Y, Wang J, Wang J Y, et al. The quality and quantity of exogenous organic carbon input control microbial NO3– immobilization: A meta-analysis[J]. Soil Biology and Biochemistry, 2017, 115: 357-363 (  0) 0) |
| [84] |
Rukshana F, Butterly C R, Baldock J A, et al. Model organic compounds differ in their effects on pH changes of two soils differing in initial pH[J]. Biology and Fertility of Soils, 2011, 47(1): 51-62 (  0) 0) |
| [85] |
Rukshana F, Butterly C R, Baldock J A, et al. Model organic compounds differ in priming effects on alkalinity release in soils through carbon and nitrogen mineralisation[J]. Soil Biology and Biochemistry, 2012, 51: 35-43 (  0) 0) |
| [86] |
Goss M J, Tubeileh A, Goorahoo D. Chapter five a review of the use of organic amendments and the risk to human health[J]. Advances in Agronomy, 2013, 120: 275-379 (  0) 0) |
| [87] |
Kelessidis A, Stasinakis A S. Comparative study of the methods used for treatment and final disposal of sewage sludge in European countries[J]. Waste Management, 2012, 32(6): 1186-1195 (  0) 0) |
| [88] |
Zhao X R, Cai Y F, Peng C, et al. Regulation of nitrification in latosolic red soils by organic amendment[J]. Environmental Earth Sciences, 2014, 71(9): 3865-3878 (  0) 0) |
| [89] |
Yang Z C, Zhao N, Huang F, et al. Long-term effects of different organic and inorganic fertilizer treatments on soil organic carbon sequestration and crop yields on the North China Plain[J]. Soil and Tillage Research, 2015, 146: 47-52 (  0) 0) |
| [90] |
Wang H X, Xu J L, Liu X J, et al. Effects of long-term application of organic fertilizer on improving organic matter content and retarding acidity in red soil from China[J]. Soil and Tillage Research, 2019, 195: 104382 (  0) 0) |
| [91] |
Ye G P, Lin Y X, Liu D Y, et al. Long-term application of manure over plant residues mitigates acidification, builds soil organic carbon and shifts prokaryotic diversity in acidic Ultisols[J]. Applied Soil Ecology, 2019, 133: 24-33 (  0) 0) |
| [92] |
Cai Z J, Xu M G, Zhang L, et al. Decarboxylation of organic anions to alleviate acidification of red soils from urea application[J]. Journal of Soils and Sediments, 2020, 20(8): 3124-3135 (  0) 0) |
| [93] |
Cai Z J, Yang C F, Carswell A M, et al. Co-amelioration of red soil acidity and fertility with pig manure rather than liming[J]. Soil Use and Management, 2023, 39(1): 441-455 (  0) 0) |
| [94] |
Yi X Y, Ji L F, Hu Z M, et al. Organic amendments improved soil quality and reduced ecological risks of heavy metals in a long-term tea plantation field trial on an Alfisol[J]. Science of The Total Environment, 2022, 838: 156017 (  0) 0) |
| [95] |
Hue N V. Correcting soil acidity of a highly weathered Ultisol with chicken manure and sewage sludge[J]. Communications in Soil Science and Plant Analysis, 1992, 23(3/4): 241-264 (  0) 0) |
| [96] |
Reeves D W. The role of soil organic matter in maintaining soil quality in continuous cropping systems[J]. Soil and Tillage Research, 1997, 43(1/2): 131-167 (  0) 0) |
| [97] |
Lv M R, Li Z P, Che Y P, et al. Soil organic C, nutrients, microbial biomass, and grain yield of rice (Oryza sativa L.) after 18years of fertilizer application to an infertile paddy soil[J]. Biology and Fertility of Soils, 2011, 47(7): 777-783 (  0) 0) |
| [98] |
Butterly C R, Costello B, Lauricella D, et al. Alkalinity movement down acid soil columns was faster when lime and plant residues were combined than when either was applied separately[J]. European Journal of Soil Science, 2021, 72(1): 313-325 (  0) 0) |
| [99] |
Butterly C R, Wang X J, Sale P, et al. Liming effect of non-legume residues promotes the biological amelioration of soil acidity via nitrate uptake[J]. Plant and Soil, 2021, 464(1): 63-73 (  0) 0) |
| [100] |
Naramabuye F X, Haynes R J. Short-term effects of three animal manures on soil pH and Al solubility[J]. Soil Research, 2006, 44(5): 515 (  0) 0) |
| [101] |
Tang Y, Zhang H, Schroder J L, et al. Animal manure reduces aluminum toxicity in an acid soil[J]. Soil Science Society of America Journal, 2007, 71(6): 1699-1707 (  0) 0) |
| [102] |
Long G Y, Zhu P T, Shen Y, et al. Influence of extracellular polymeric substances (EPS) on deposition kinetics of bacteria[J]. Environmental Science & Technology, 2009, 43(7): 2308-2314 (  0) 0) |
| [103] |
Cao Y Y, Wei X, Cai P, et al. Preferential adsorption of extracellular polymeric substances from bacteria on clay minerals and iron oxide[J]. Colloids and Surfaces B: Biointerfaces, 2011, 83(1): 122-127 (  0) 0) |
| [104] |
Ren L Y, Hong Z N, Qian W, et al. Adsorption mechanism of extracellular polymeric substances from two bacteria on Ultisol and Alfisol[J]. Environmental Pollution, 2018, 237: 39-49 (  0) 0) |
| [105] |
Nkoh J N, Hong Z N, Xu R K. Laboratory studies on the effect of adsorbed microbial extracellular polymeric substances on the acidity of selected variable-charge soils[J]. Soil Science Society of America Journal, 2022, 86(2): 162-180 (  0) 0) |
| [106] |
Ha J, Gélabert A, Spormann A M, et al. Role of extracellular polymeric substances in metal ion complexation on Shewanella oneidensis: Batch uptake, thermodynamic modeling, ATR-FTIR, and EXAFS study[J]. Geochimica et Cosmochimica Acta, 2010, 74(1): 1-15 (  0) 0) |
| [107] |
Karunakaran E, Biggs C A. Mechanisms of Bacillus cereus biofilm formation: An investigation of the physicochemical characteristics of cell surfaces and extracellular proteins[J]. Applied Microbiology and Biotechnology, 2011, 89(4): 1161-1175 (  0) 0) |
| [108] |
Mukherjee J, Karunakaran E, Biggs C A. Using a multi-faceted approach to determine the changes in bacterial cell surface properties influenced by a biofilm lifestyle[J]. Biofouling, 2012, 28(1): 1-14 (  0) 0) |
| [109] |
Nkoh J N, He X, Lu H L, et al. Chitosan and D-fructose 1, 6-bisphosphate differ in their effects on soil acidity and aluminum activation[J]. Journal of Soils and Sediments, 2022, 22(8): 2129-2145 (  0) 0) |
| [110] |
Kumari S, Rath P, Sri Hari Kumar A, et al. Extraction and characterization of chitin and chitosan from fishery waste by chemical method[J]. Environmental Technology & Innovation, 2015, 3: 77-85 (  0) 0) |
| [111] |
Ahmad S I, Ahmad R, Khan M S, et al. Chitin and its derivatives: Structural properties and biomedical applications[J]. International Journal of Biological Macromolecules, 2020, 164: 526-539 (  0) 0) |
| [112] |
Laus R, Costa T G, Szpoganicz B, et al. Adsorption and desorption of Cu(Ⅱ), Cd(Ⅱ) and Pb(Ⅱ) ions using chitosan crosslinked with epichlorohydrin-triphosphate as the adsorbent[J]. Journal of Hazardous Materials, 2010, 183(1/2/3): 233-241 (  0) 0) |
| [113] |
Hidangmayum A, Dwivedi P, Katiyar D, et al. Application of chitosan on plant responses with special reference to abiotic stress[J]. Physiology and Molecular Biology of Plants, 2019, 25(2): 313-326 (  0) 0) |
| [114] |
Guo J M, Yang J, Yang J X, et al. Water-soluble chitosan enhances phytoremediation efficiency of cadmium by Hylotelephium spectabile in contaminated soils[J]. Carbohydrate Polymers, 2020, 246: 116559 (  0) 0) |
| [115] |
Mehmood S, Ahmed W, Ikram M, et al. Chitosan modified biochar increases soybean (Glycine max L.) resistance to salt-stress by augmenting root morphology, antioxidant defense mechanisms and the expression of stress- responsive genes[J]. Plants, 2020, 9(9): 1173 (  0) 0) |
| [116] |
Ren J, Tong J, Li P H, et al. Chitosan is an effective inhibitor against potato dry rot caused by Fusarium oxysporum[J]. Physiological and Molecular Plant Pathology, 2021, 113: 101601 (  0) 0) |
| [117] |
He X, Nkoh J N, Shi R Y, et al. Application of chitosan- and alginate-modified biochars in promoting the resistance to paddy soil acidification and immobilization of soil cadmium[J]. Environmental Pollution, 2022, 313: 120175 (  0) 0) |
| [118] |
Sapkota A, Sapkota A R, Kucharski M, et al. Aquaculture practices and potential human health risks: Current knowledge and future priorities[J]. Environment International, 2008, 34(8): 1215-1226 (  0) 0) |
| [119] |
Herre A, Lang F, Siebe C, et al. Mechanisms of acid buffering and formation of secondary minerals in vitric Andosols[J]. European Journal of Soil Science, 2007, 58(2): 431-444 (  0) 0) |
| [120] |
Nelson P N, Su N H. Soil pH buffering capacity: A descriptive function and its application to some acidic tropical soils[J]. Soil Research, 2010, 48(3): 201 (  0) 0) |
| [121] |
Helyar K R, Cregan P D, Godyn D L. Soil acidity in New-South-Wales - Current pH values and estimates of acidification rates[J]. Soil Research, 1990, 28(4): 523 (  0) 0) |
| [122] |
Wong M T F, Nortcliff S, Swift R S. Method for determining the acid ameliorating capacity of plant residue compost, urban waste compost, farmyard manure, and peat applied to tropical soils[J]. Communications in Soil Science and Plant Analysis, 1998, 29(19/20): 2927-2937 (  0) 0) |
| [123] |
Garcı́a-Gil J C, Ceppi S B, Velasco M I, et al. Long-term effects of amendment with municipal solid waste compost on the elemental and acidic functional group composition and pH-buffer capacity of soil humic acids[J]. Geoderma, 2004, 121(1/2): 135-142 (  0) 0) |
| [124] |
Latifah O, Ahmed O H, Majid N M A. Soil pH buffering capacity and nitrogen availability following compost application in a tropical acid soil[J]. Compost Science & Utilization, 2018, 26(1): 1-15 (  0) 0) |
| [125] |
Soares M R, Alleoni L R F. Contribution of soil organic carbon to the ion exchange capacity of tropical soils[J]. Journal of Sustainable Agriculture, 2008, 32(3): 439-462 (  0) 0) |
| [126] |
Cai Z J, Wang B R, Xu M G, et al. Intensified soil acidification from chemical N fertilization and prevention by manure in an 18-year field experiment in the red soil of southern China[J]. Journal of Soils and Sediments, 15(2): 260-270 (  0) 0) |
| [127] |
Guan P, Wang R H, Nkoh J N, et al. Enriching organic carbon bioavailability can mitigate soil acidification induced by nitrogen fertilization in croplands through microbial nitrogen immobilization[J]. Soil Science Society of America Journal, 2022, 86(3): 579-592 (  0) 0) |
| [128] |
Wong M T F, Akyeampong E, Nortcliff S, et al. Initial responses of maize and beans to decreased concentrations of monomeric inorganic aluminium with application of manure or tree prunings to an Oxisol in Burundi[J]. Plant and Soil, 1995, 171(2): 275-282 (  0) 0) |
| [129] |
Li K W, Lu H L, Nkoh J N, et al. The important role of surface hydroxyl groups in aluminum activation during phyllosilicate mineral acidification[J]. Chemosphere, 2023, 313: 137570 (  0) 0) |
| [130] |
Li K W, Xu R K, Cai Z J. Aluminum mobilization characteristics in four typical soils from different climate zones during their acidification[J]. Plant and Soil, 2024, 504(1): 29-46 (  0) 0) |
| [131] |
Rufyikiri G, Genon J G, Dufey J E, et al. Competitive adsorption of hydrogen, calcium, potassium, magnesium, and aluminum on banana roots: Experimental data and modeling[J]. Journal of Plant Nutrition, 2003, 26(2): 351-368 (  0) 0) |
| [132] |
Kopittke P M, Menzies N W, Wang P, et al. Kinetics and nature of aluminium rhizotoxic effects: A reviewFree[J]. Journal of Experimental Botany, 2016, 67(15): 4451-4467 (  0) 0) |
| [133] |
Liu Z D, Wang H C, Xu R K. The effects of root surface charge and nitrogen forms on the adsorption of aluminum ions by the roots of rice with different aluminum tolerances[J]. Plant and Soil, 2016, 408(1): 43-53 (  0) 0) |
| [134] |
Lu H L, Dong G, Hua H, et al. Method for initially selecting Al-tolerant rice varieties based on the charge characteristics of their roots[J]. Ecotoxicology and Environmental Safety, 2020, 187: 109813 (  0) 0) |
| [135] |
Driscoll C T. A procedure for the fractionation of aqueous aluminum in dilute acidic waters[J]. International Journal of Environmental Analytical Chemistry, 1984, 16(4): 267-283 (  0) 0) |
| [136] |
Kinraide T B. Reconsidering the rhizotoxicity of hydroxyl, sulphate, and fluoride complexes of aluminium[J]. Journal of Experimental Botany, 1997, 48(5): 1115-1124 (  0) 0) |
| [137] |
Yu W J, Ren T S, Duan Y H, et al. Mechanism of Al toxicity alleviation in acidic red soil by rice-straw hydrochar application and comparison with pyrochar[J]. Science of The Total Environment, 2023, 877: 162849 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57


