2. 中国科学院大学, 北京 100049;
3. 南京林业大学水土保持学院, 南京 210037
雷竹(Phyllostachys praecox),为我国南方地区重要的笋用竹种[1],因其极高的生产收益而被广泛引种[2]。目前,雷竹林经营普遍采用冬季覆盖技术,该技术能保持土壤水分,提高土壤温度[3],使出笋时间提前,并可提高竹笋产量和质量[4]。已有研究表明,有机物料覆盖会显著降低雷竹林土壤中氧含量,因为有机物发酵消耗大量氧气,同时覆盖层阻断了空气交换,从而使竹林根际土壤氧气含量剧降,形成非淹水型土壤缺氧状况[5]。在冬季覆盖过程中通常还有大量化肥投入,这可能导致更低的肥料利用率。陈闻等[6]研究表明,覆盖经营雷竹林鲜笋氮素农学利用率为4.7 kg/kg,氮肥利用率仅为8.5%,估算的笋产和竹材的氮肥利用率也不超过20%。由此可见,雷竹林在覆盖经营条件下土壤氮素存在大量损失的可能,但是目前还缺乏相关深入的研究。
氮是植物生长必需的常量营养元素,对维持土壤肥力和生态系统生产力有重要作用[7]。在土壤中氮循环的步骤主要包括氨化、硝化、反硝化、厌氧氨氧化和主要由微生物活动控制的同化[8]。目前研究认为,在影响氮素转化速率的因素中,氧浓度是最重要的因素。即使在好氧环境中,土壤中氧气供应也有限,并随着土壤深度及与根系的距离而变化[9]。当土壤因机械压实、淹水或覆盖导致缺氧或厌氧时,较低的氧化还原电位会刺激异养反硝化作用,大大提高氮素损失。已有研究表明,缺氧条件下通过反硝化作用消耗NO3--N的速率比硝化作用产生NO3--N的速率要快[10],在淹水期间水稻土壤硝化–反硝化耦合过程导致的氮损失占施用氮的40% 以上[11]。Zibilske等[12]研究表明,缺氧也会显著降低土壤有机质分解及有机氮矿化,而通过好氧或干湿交替过程增加根际土壤氧含量则可增加氨氧化细菌丰度,提高土壤硝化作用,促进作物对氮的吸收利用[13]。雷竹经营中施肥以酰胺态氮(尿素)为主,尿素经脲酶分解后也以NH4+-N为主要形态。然而在非淹水型缺氧条件下,土壤矿化和硝化作用受到抑制,NH4+-N在土壤中累积,这可能会导致氨挥发损失增加[14],也可能会对雷竹生长产生负面影响[15],因为雷竹是一种兼性喜硝植物,当NH4+-N占比大于50%时会显著抑制竹苗的生长[16-17]。然而,目前对氮转化过程的研究主要集中在水稻田等淹水环境中,当土壤非淹水缺氧时,氮素的转化及利用过程受到的影响可能更为复杂。
目前,针对雷竹林覆盖导致的非淹水型缺氧问题已经有了一些解决措施,包括在田间添加过氧化钙(CaO2)、过氧化镁(MgO2)或过氧化脲(CH4N2O·H2O2)等化学方法[18-20],以及插管通气和地下管道曝气等物理方法[21-22]。这些措施均在一定程度上缓解了雷竹林的退化,改善了雷竹林土壤非淹水型缺氧的问题,但对土壤氧含量的改变影响氮素转化的内在机制尚不清楚。因此,本研究针对覆盖经营雷竹林土壤,通过室内模拟培养试验,改变培养瓶中土壤顶空气体的氧气含量,探究不同氧含量培养对雷竹林土壤无机氮、酶活性及微生物群落变化的影响,研究不同土壤氧含量下不同形态氮的相互转化条件,探究非淹水型缺氧对雷竹林氮素转化影响的机制,以为提高雷竹氮素利用效率及生产效益提供些许参考。
1 材料与方法 1.1 供试土壤供试土壤采自江西省鹰潭市余江县中国科学院鹰潭红壤生态实验站雷竹林试验样地(28°13′N,116°55′E),土壤类型为砖红壤。该地区属中亚热带季风气候,年均温17.8 ℃,年均降水量1 795 mm,无霜期262 d。雷竹试验林种植于2011年,林地平均坡度小于3°,直到2022年覆盖前该试验林处于自然生长状态,未受到人为扰动。本试验对雷竹林的表层土壤(0 ~ 20 cm)采用土钻进行“S”形五点随机采样组成一个混合样品,剔除碎石、枯叶及根系等杂质,过2 mm筛后,部分供培养试验使用,其余在实验室风干,用于测定土壤初始理化性质。同时,使用环刀法采集表层土样测定土壤容重及含水量。供试土壤的基本理化性质见表 1。
|
|
表 1 供试雷竹林土壤基本理化性质 Table 1 Basic physicochemical properties of tested soil under Phyllostachys praecox forest |
参考大多数土壤硝化反硝化作用的最佳条件[23],在25℃和60% 田间最大持水量(WHC)下进行室内培养试验。试验设置4种不同顶空O2含量处理,分别为好氧条件20% O2(O_20)、微缺氧条件10% O2(O_10)、缺氧条件5% O2(O_5)、厌氧条件0% O2(O_0)。试验时,先在250 mL的厌氧培养瓶中加入50 g雷竹林土壤样品(以烘干基计),将土壤含水量调节至60%WHC后,预培养7 d,使土壤微生物活性恢复。在预培养结束后称重培养瓶以补偿蒸发损失的水分,随后立即用丁基胶塞和铝盖加以密封,以便顶空气体的交换和取样。顶空气体用制备好的储配气体置换,其O2含量分别为20%、10%、5% 和0%。顶空气体的置换通过空气交换器进行,该交换器可将培养瓶顶空的气体压力抽至小于0.1 bar,然后再用含有所需O2浓度的储备气体进行顶空冲洗(图 1)。培养试验在25 ℃室温下进行49 d。培养期间,在全封闭条件下,每隔7 d对培养瓶称重以补偿蒸发损失的水分,每隔2 d在完全封闭的条件下用储备气体更新顶空气体,以保持顶空气体的O2含量在试验期间维持在较稳定的范围[24]。每个处理分别制备21个厌氧培养瓶。
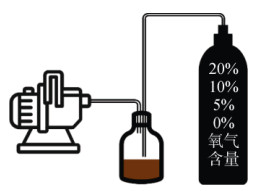
|
图 1 顶空气体置换试验示意图 Fig. 1 Schematic diagram of headspace gas replacement experiment |
初始土壤的理化性质参考《土壤农化分析》[25]进行测定。其中,土壤含水量采用烘干法测定;pH采用电位法测定;容重采用环刀法测定;有机质含量采用重铬酸钾氧化–容量法测定;全氮(TN)含量采用凯氏定氮法测定;NH4+-N和NO3--N含量采用2 mol/L KCl溶液浸提新鲜土壤,分别使用靛酚蓝比色法和双波长比色法测定;全磷和全钾采用高氯酸–氢氟酸联合消解,有效磷采用0.5 mol/L NaHCO3浸提,速效钾采用2 mol/L CH3COONH4浸提,全钾和速效钾采用HG-5火焰光度计(北京检测仪器有限公司,中国)进行测定,土壤全磷和有效磷采用钼锑抗比色法测定。
分别在培养期间的第0、4、7、14、21、35、49天采集土壤样品,为避免破坏性取样对试验造成的影响,每个处理在每个时间均取样3个厌氧培养瓶。采集的土壤用1 mol/L KCl溶液浸提,液土比为1∶5(V/m),在(20 ± 2) ℃下以250 r/min的转速振荡60 min,分析滤液中的无机氮浓度,其中,NO3--N、NO2--N、NH4+-N测定分别采用镉柱还原磺胺-N-(1-萘基)-乙二胺分光光度法、磺胺-N-(1-萘基)-乙二胺分光光度法和靛酚蓝比色法,具体试验步骤参照HJ634—2012[26]方法进行。
培养试验结束后,采集土壤样品对氮转化相关酶活性进行测定,包括土壤脲酶(UR)、过氧化氢酶(CAT)、硝酸还原酶(NR)和亚硝酸还原酶(NiR)。其中,脲酶采用水杨酸钠–二氯异氰尿酸钠比色法测定[27],过氧化氢酶采用高锰酸钾滴定法测定[28],硝酸还原酶采用嫌气培养–酚二磺酸比色法测定,亚硝酸还原酶采用格里斯试剂显色与酶促反应前后NO2--N变化表征。同时,采用氯仿熏蒸法进行测定土壤微生物生物量碳(MBC)和微生物生物量氮(MBN)[29]。
培养试验结束后,同时采集土壤样品用于土壤DNA提取及Illumina MiSeq测序。使用FastDNA® SPIN试剂盒(Bio 101,Carlsbad,CA,USA)提取土壤微生物DNA。通过NanoDrop 2000紫外–可见分光光度计(Thermo Scientific,Wilmington,USA)对提取的DNA进行定量,并通过1% 琼脂糖凝胶电泳检查DNA质量。使用引物338F(5′-ACTCCTAC GGGAGG CAGCAG-3′)和806R(5′-GGACTACHVG GGTWTCT AAT-3′)对16S rRNA基因的高变V3 ~ V4区域进行PCR扩增(GeneAmp 9700,ABI,USA)[30]。PCR扩增体系混合物(20 μL)包含4 μL 5×FastPfu缓冲液、2 μL 2.5 mmol/L dNTP、0.8 μL每种引物(5 μmol/L)、0.4 μL FastPfu聚合酶、10 ng模板DNA、0.2 μL BSA和20 μL灭菌ddH2O。PCR扩增条件:95 ℃预变性3 min,而后进入循环扩增阶段,95 ℃变性下30 s,在55 ℃下退火30 s,在72 ℃下伸长45 s,共循环27次。最后在72 ℃下再延伸10 min。PCR产物在1.2% 琼脂糖凝胶中检查,并使用AxyPrep DNA凝胶提取试剂盒(Axygen Biosciences,Union City,CA,USA)进一步纯化。最后,按照制造商的说明使用QuantiFluor-ST™(Promega,USA)测定PCR产物的浓度。DNA文库测序在中国深圳微生太科技有限公司的Illumina MiSeq平台(Illumina,San Diego,USA)上进行。
1.4 数据处理与统计分析雷竹林土壤中无机氮含量、氮转化相关酶活性及MBC和MBN数据采用SPSS20.0进行单因素方差分析,并采用Origin 2020进行绘图。采用R(3.4.3)软件分析物种丰度数据,采用QIIME 2(2019.4)软件对不同氧含量处理下土壤微生物群落的α多样性和β多样性进行对比分析,采用Origin 2021绘制图形,其中,α多样性主要基于Chao1、Shannon和Observed_ species指数评估不同氧含量下雷竹林土壤微生物多样性,β多样性主要基于Weighted-UniFrac差异的主坐标分析(PCoA)评估不同样品之间的细菌群落结构差异。
2 结果与分析 2.1 不同氧含量下土壤无机氮含量动态变化不同氧含量培养下雷竹林土壤无机氮含量变化差异较大,由图 2可见,在厌氧条件下(O_0),雷竹林土壤中NO3--N在培养期间持续被还原,含量呈下降趋势,从初始的78.25 mg/kg下降至最终的38.56 mg/kg;土壤NO2--N含量呈先增加后下降的趋势,培养至第7天时最高,最终下降至较低水平;而NH4+-N含量在培养期间变化不大,维持在22.86 ~ 28.18 mg/kg。在缺氧条件下(O_5),土壤中NO3--N含量呈现先上升后下降的趋势,在培养至第21天时达到峰值102.28 mg/kg;NO2--N含量变化趋势与O_0时变化类似,呈先增加后下降的趋势,在培养至第7天时最高为25.45 mg/kg,在第49天培养结束时为7.56 mg/kg;而NH4+-N含量则先下降后上升,在第49天培养结束时升高至24.26 mg/kg。在微缺氧条件下(O_10),土壤中NO3--N含量在培养期间呈上升趋势,培养至第49 d时升高至110.98 mg/kg;NO2--N含量同样在培养第7天时达到峰值21.58 mg/kg;而NH4+-N含量则呈下降趋势,从初始22.86 mg/kg下降至6.38 mg/kg。在好氧条件(O_20)下,NO3--N含量在培养期间升高更明显,在培养结束的第49天达到133.23 mg/kg;NO2--N含量维持在2.07 ~ 3.58 mg/kg的较低水平;NH4+-N含量呈先下降后上升趋势。
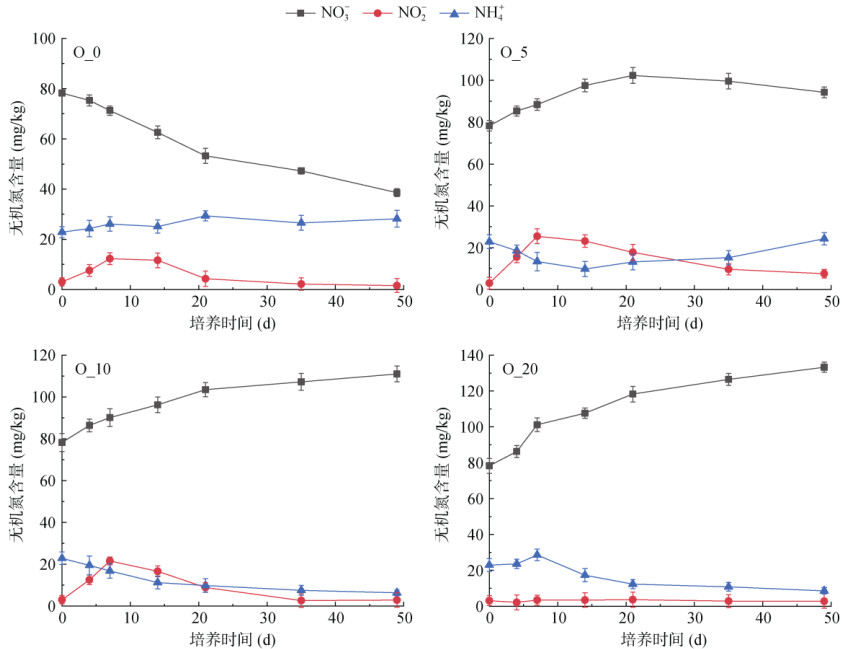
|
图 2 模拟不同氧含量培养下土壤中无机氮含量随时间动态变化 Fig. 2 Dynamic changes of soil inorganic nitrogen content with time under simulated incubation with different oxygen contents |
如图 3所示,土壤中脲酶活性随着氧含量的下降显著降低,O_0处理仅为14.13 mg/(g·d),受到明显抑制;O_5处理土壤脲酶活性同样受到抑制,显著低于O_20处理。土壤中过氧化氢酶活性在O_5处理时最高,为4.58 mL/(g·h),而在O_0处理时活性最低,为2.81 mL/(g·h)。土壤中硝酸还原酶及亚硝酸还原酶活性随氧含量的下降而显著升高,相比于O_20处理,两种厌氧酶活性在O_0和O_5处理时均显著提高,其中硝酸还原酶活性分别提高了245.1% 和164.7%,亚硝酸还原酶活性分别提高了287.9% 和252.5%。
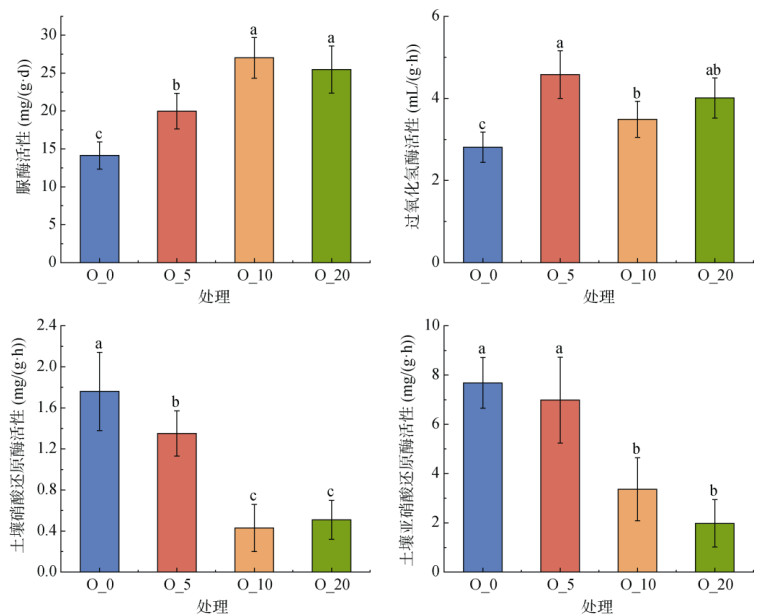
|
(图中不同小写字母表示处理间差异在P < 0.05水平显著;下同) 图 3 模拟不同氧含量培养下土壤氮转化相关酶活性 Fig. 3 Soil nitrogen transformation-related enzyme activities under simulated incubation with different oxygen contents |
由图 4可知,4个氧含量培养下雷竹林土壤MBC含量范围介于110.30 ~ 138.38 mg/kg,MBN含量范围介于72.23 ~ 83.26 mg/kg。O_0处理土壤MBC和MBN含量,相比于O_20处理分别显著降低了16.79% 和13.25%。
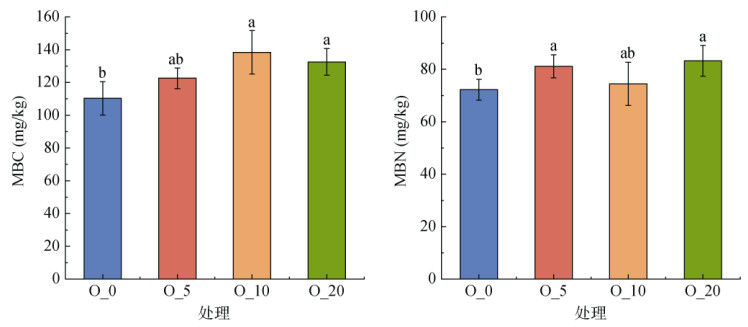
|
图 4 模拟不同氧含量培养下雷竹林土壤的MBC和MBN变化 Fig. 4 Changes in soil MBC and MBN under simulated incubation with different oxygen contents |
不同土壤氧含量会影响雷竹林土壤微生物的多样性和丰富度指数,为探究不同氧含量下雷竹林土壤细菌多样性,在OTU水平上计算了细菌群落的α多样性指数。Chao1指数和Observed_species指数用于表征土壤样本的多样性和丰富度信息,而Shannon指数则主要反映样本的多样性。表 2显示了土壤样本的丰富度(Chao1指数和Observed_species指数)和多样性(Shannon指数)。结果表明,随着土壤氧含量的下降,细菌物种丰富度和多样性呈现先升高,后下降的趋势。当氧气含量从O_20下降至O_10时,Chao1、Observed_species和Shannon指数均显著下降;当氧含量下降至O_5时,丰富度和多样性指数又有所提升;而当氧含量下降至O_0时,土壤微生物多样性最低。可见,不同氧气含量处理显著影响了土壤细菌群落的多样性和丰富度,氧含量降低一般会导致细菌多样性水平降低,但在氧含量为O_5时,细菌多样性反而增加。
|
|
表 2 模拟不同氧含量培养下土壤细菌α多样性指数 Table 2 α diversity index of soil bacteria under simulated incubation with different oxygen contents |
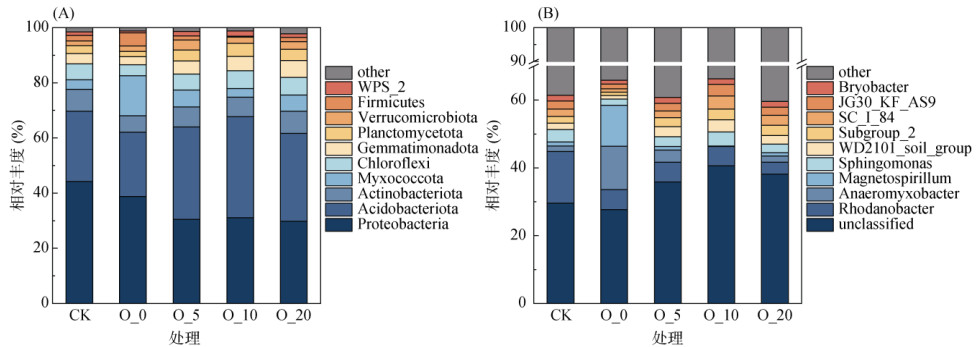
本研究通过高通量测序,对获得的ASV序列进行了分类和注释,共获得6 859个OUT,分属29个门,87个纲,199个目,283个科,458个属。基于分类单元的相对丰度和注释信息,对样品中细菌相对丰度排名前10位的优势菌门和优势菌属绘制物种相对丰度柱状图(图 5),结果表明,在不同氧含量处理间雷竹林土壤中细菌类群的相对丰度变化很大。在门水平上,各个处理细菌优势菌门主要包括变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、粘菌门(Myxomycota)和绿弯菌门(Chloroflexi),占总丰度的81.92% ~ 86.89%,其中变形菌门作为占比最高的细菌群落,其丰度随氧含量降低而升高。相比于O_20处理,缺氧处理(O_5和O_0)均显著提高了土壤中变形菌门(2.50% 和30.30%)和粘菌门(5.47% 和148.7%)的相对丰度,而降低了绿弯菌门(9.45% 和37.62%)和芽单胞菌门(Gemmatimonadota)的相对丰度(23.28% 和53.12%)。酸杆菌门在O_10处理下相对丰度最高,总体也随氧含量的下降而降低。
|
(本研究将相对丰度前10位之后的细菌门/属定义为“others”) 图 5 模拟不同氧含量培养下雷竹林土壤中优势菌在门水平(A)和属水平(B)上的相对丰度 Fig. 5 Relative abundance of dominant soil bacteria at phylum (A) and genus (B) levels under simulated incubation with different oxygen contents |
在属水平上,不同处理间优势菌属相对丰度组成差别不大,但相对丰度占比差异较大。不同氧含量处理下土壤中被分类的细菌优势菌属主要包括罗河杆菌属(Rhodanobacter)、厌氧粘细菌属(Anaeromyxobacter)、磁螺菌属(Magnetospirillum)、鞘氨醇单胞菌属(Sphingomonas),占全部丰度的8.85% ~ 32.68%,未知属的比例最大(> 27.67%)。缺氧及厌氧条件相比于好氧条件,提高了罗河杆菌属、厌氧粘细菌属和磁螺菌属的相对丰度,其中值得注意的是,O_0处理下厌氧粘细菌属(12.78%)和磁螺菌属(12.06%)的相对丰度大大提高。
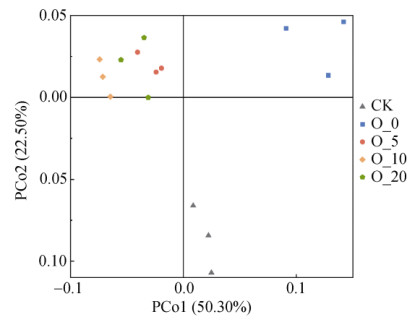
2.6 不同氧含量下土壤细菌群落β多样性变化基于Weighted-UniFrac的距离算法,利用加权主坐标分析(PCoA)比较了不同氧含量处理下雷竹林土壤细菌β多样性的差异。如图 6所示,PCoA1和PCoA2分别解释了细菌数据集变异的50.30% 和22.50%,共解释了72.80% 的细菌群落差异,表明该算法可以很好地解释细菌群落组成的差异。每个处理的3个重复之间间距很近,但不同处理间又相隔开,这说明同一氧含量处理下土壤细菌群组成落相似,而不同氧含量(CK、O_0、O_5、O_10和O_20)下土壤微生物群落组成有较大差异。总体而言,培养试验前的CK处理土壤微生物群落分布在下方,与不同氧含量培养后的4个处理明显隔开。培养后O_0处理的细菌群落分布在右上方,而O_5、O_10和O_20处理的细菌群落分布在左上方,这表明厌氧处理(O_0)与非厌氧处理(O_5、O_10和O_20)的细菌群落组成差异很大。可见,不同氧含量下雷竹林土壤微生物群落组成随缺氧程度的变化而变化。
|
图 6 模拟不同氧含量培养下土壤微生物群落结构主坐标分析(基于Weighted-UniFrac距离算法) Fig. 6 Principal coordinates analysis (PCoA) of soil microbial community structure under simulated incubation with different oxygen contents (based on Weighted-UniFrac) |
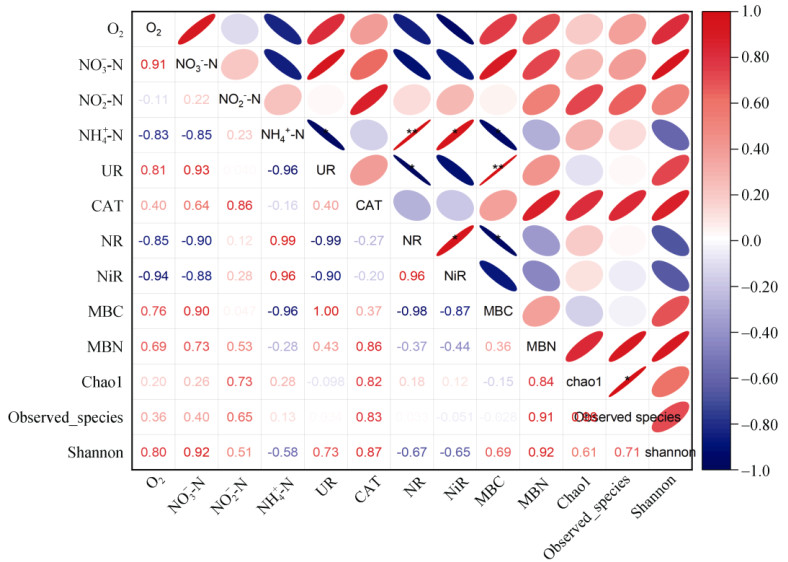
本研究使用Pearson相关性分析评估了培养结束时不同氧含量处理土壤中各形态氮含量、氮转化酶活性及微生物群落多样性间的相关性(图 7)。结果表明,氧含量与NO3--N含量呈显著正相关(P < 0.01),说明缺氧条件可能抑制硝化作用的进行而导致NO3--N含量的下降。此外,NH4+-N含量与脲酶(UR)活性呈显著负相关(P < 0.05),因为NH4+-N是尿素分解的产物,过量的NH4+-N会抑制脲酶活性。同时,脲酶活性与土壤MBC呈显著正相关(P < 0.01)。综上所述,土壤氧含量会在不同程度上影响土壤各形态氮含量和氮转化酶活性,从而影响土壤氮转化过程,影响雷竹林对氮素的利用效率。
|
(*、** 分别表示在P < 0.05、P < 0.01水平显著相关) 图 7 模拟不同氧含量下土壤各形态氮含量、氮转化酶性活及微生物多样性的Pearson相关性分析 Fig. 7 Pearson correlation analysis of various nitrogen contents, nitrogen transforming enzyme activities and microbial diversity under simulated incubation with different oxygen levels |
土壤氮转化包括矿化、硝化、反硝化及厌氧氨氧化等,是一个由土壤微生物驱动的复杂过程[31],这些过程均受制于土壤氧含量。雷竹林根际含氧量通过改变土壤微生态环境影响不同形式的土壤氮,从而影响雷竹对氮的转化、吸收和利用[13]。其中,无机氮作为作物吸收氮的重要来源,其含量变化直接影响土壤中氮素的迁移转化和植物生长发育。土壤NH4+-N作为氨化作用的产物,易被土壤胶体固定,但其在土壤中浓度过高时可能会对作物产生毒害[32]。本研究结果表明,土壤NH4+-N在厌氧及缺氧条件下(氧含量≤5%)积累,而在好氧及微缺氧条件下(氧含量≥10%)因氨氧化作用消耗而逐渐下降。Wang等[14]研究发现,NH3主要在厌氧条件下积累,是挥发过程中的主要含氮化合物,主要发生在pH和温度较高的嗜热阶段;Tang等[33]研究表明,在好氧条件下,N2O排放占总氮损失的70% 以上;而Zhang等[34]的研究表明,在厌氧条件下,NH3挥发占总氮损失的47% ~ 54%,这表明土壤缺氧可能会导致土壤氮损失的增加。
土壤中NO3--N含量可以直接反映旱地土壤的供氮能力,是供给作物养分的基础。本研究发现,厌氧及缺氧条件(氧含量≤5%)抑制了硝化作用的进行,但NO3--N被反硝化作用所消耗,从而导致其含量在培养期间下降。而在好氧及微缺氧条件下(氧含量≥10%),土壤中NO3--N含量在培养期间不断升高,这是因为在氧含量较充足时,较高的氧化还原电位对反硝化作用产生抑制,同时矿化作用及硝化作用的进行使NO3--N在土壤中累积。硝化作用也是有氧条件下产生N2O的主要过程[35],尽管与其他氮转化过程相比,其氮代谢水平较低。Yang等[24]研究发现,水稻土壤中NO3--N含量和矿化速率并未在缺氧条件下受到抑制,与本研究的结果并不一致,这可能是由于水稻土壤处于长期淹水条件,参与氮矿化的硝化细菌和其他微生物群落适应了淹水期间稻田土壤中低氧浓度的环境。
NO2--N是多个氮转化过程的关键中间产物,同时也与气态氮的排放密切相关[36],一般来说,NO2--N不会在环境中积累,氨氧化步骤被认为是硝化过程的限速步骤。然而已有研究表明,亚硝酸盐氧化过程在降水、温度及氧分压等不同环境因子的变化下,会限制硝化作用的进行,使NO2--N在土壤中累积[37]。且有研究表明,NO2--N与N2O和NO的形成直接相关,当土壤中NO2--N含量较高时,可能排放更多的N2O[38]。本研究中,在好氧条件下,土壤NO2--N含量维持在较低水平,这可能与雷竹林土壤(pH 4.5左右)较低的pH有关。因为NO2--N在土壤中的稳定性与土壤pH密切相关,在pH < 5.5的土壤中容易自发分解为NO和N2O等气态化合物[39]。在非好氧条件下(氧含量≤10%),NO2--N含量在土壤中先上升,在培养7 ~ 14 d左右达到峰值,随后呈下降的趋势,这可能是由于前期缺氧抑制了亚硝酸还原酶的活性,导致NO2--N的消耗速率低于产生速率,从而促进了NO2--N的积累,随后的下降可能归因于酸性条件下的自我分解,这种分解转化可能是化学反应而并非微生物催化的过程[40]。
3.2 缺氧对雷竹林土壤氮转化相关酶活性的影响土壤酶活性与氮转化过程密切相关,研究土壤酶活性对于了解非淹水型缺氧条件下雷竹林土壤氮转化过程有重要意义。土壤中的脲酶与土壤氨氮的转化和形成以及土壤营养物质的吸收转化密切相关。脲酶的生物活性水平反映了土壤的肥力水平。本研究发现,模拟雷竹林土壤缺氧使得脲酶活性显著降低,相关分析(图 7)进一步表明脲酶活性与土壤MBC呈显著正相关,这表明脲酶活性的提高,促进了尿素分解,提高土壤有效氮的含量,有助于土壤微生物的生长,提高了土壤MBC含量。该结果与杜琳倩等[41]的研究结果一致,其发现,在水淹胁迫下,随着土壤中氧含量降低,土壤脲酶活性受到明显抑制。
过氧化氢酶可催化土壤中酚类和胺类化合物的氧化分解,它参与了土壤植物、微生物等的呼吸作用和有机物生物化学氧化反应,其存在可以降低H2O2对作物的毒害作用,其活性反映了土壤的生物学特性。本研究中,O_5处理微缺氧条件下土壤过氧化氢酶活性最高,这表明在该氧浓度下,土壤微生物受到的缺氧胁迫最强,从而刺激了过氧化氢酶的活性[42]。但Zibilske等[12]研究发现,微缺氧条件下过氧化物酶活性相比于非缺氧条件并无显著差异,这可能是因为不同土壤抵抗微缺氧胁迫的能力不同,如水稻土等处于长期淹水条件的土壤过氧化氢酶对微缺氧的响应并不显著。
硝酸还原酶和亚硝酸还原酶是反硝化过程中的关键酶,其活性大小反映了土壤微生物群落反硝化能力的强弱。本研究结果表明,雷竹林土壤中硝酸还原酶和亚硝酸还原酶活性随着氧含量的降低而显著提高。反硝化酶的合成和活性受氧分压和土壤氧化还原电位的影响[43],酶活性的提高导致反硝化作用增强。有研究表明,反硝化作用一般发生在含氧量低的环境中,但完全的厌氧条件会抑制硝化作用的进行,从而导致反硝化底物减少,故反硝化作用的正常进行应保证一定的含氧量,而不是氧含量越低越好。本研究中,厌氧条件下的硝酸还原酶和亚硝酸还原酶活性仍维持在较高水平,这可能是由于短期培养中底物含量充足,而缺氧对其的长期影响仍有待进一步研究。
3.3 缺氧对雷竹林土壤微生物生物量及群落结构的影响土壤微生物生物量是养分循环中的重要因素,在维持包括有机物分解在内的基本生物过程中发挥着关键作用[44]。MBN的增加反映了土壤储氮能力的增加和土壤氮持续供应能力的提高。MBN参与氮转化,促进植物与土壤氮循环之间的相互作用。本研究中,土壤缺氧会导致土壤养分循环速率降低,微生物生物量减少,在微缺氧条件下土壤MBC和MBN含量下降并不显著,这可能与培养时间较短有关;但在完全厌氧条件下,微生物生物量显著减少,与张露等[45]研究结果一致,其发现在淹水灌溉条件下土壤含氧量降低,限制了土壤微生物的繁殖,使得MBC及MBN含量降低。
土壤中的微生物在养分循环和土壤结构维持中起着关键作用[46]。α多样性指数是重要的土壤微生物参数,反映了物种的丰富度和均匀度[47]。本研究结果表明,不同氧含量下雷竹林土壤细菌群落α多样性总体上随氧含量的降低而下降,但在O_5处理下,其多样性反而有所上升,这可能是由于在短期缺氧条件下,土壤微生物中好氧、厌氧及兼性厌氧微生物共存,使得群落多样性升高。该结果与翟婉璐等[48]研究结果类似,其研究表明,尽管随着覆盖年限的增加,雷竹林土壤细菌的丰度和多样性降低,但短期覆盖反而增加了土壤细菌的丰度和多样性。可见,长期缺氧会降低土壤微生物系统的复杂性,不利于雷竹林长期生长发育。
本研究中,雷竹林土壤在不同缺氧程度培养下,微生物群落中普遍存在的优势菌门和菌属保持不变,但相对丰度发生变化。雷竹林土壤中主要优势菌群为变形菌门、酸杆菌门和放线菌门。培养结束时,绿弯菌门的相对丰度在缺氧条件下(氧含量≤5%)显著降低。有研究表明,绿弯菌门参与了硝化作用的第二步[49],能够在好氧条件下驱动NO2-的氧化,而缺氧条件可能不利于绿弯菌门的生长,导致其丰度的降低。雷竹林土壤中缺氧条件下厌氧粘细菌属(Anaeromyxobacter)的相对丰度显著提高。厌氧粘细菌属是基于16S rRNA基因系统发育分类的第一个以粘球菌分类的厌氧菌[50],其缺乏反硝化作用中标志性的nirS和nirK基因,具有非典型的nosZ基因,只能通过还原NO3--N生成NH4+-N或者还原N2O生成N2来获得生长所需的能量[51]。其丰度的显著增加可能会对减少雷竹林土壤中N2O的排放有重要贡献[52]。
4 结论在模拟雷竹林覆盖缺氧试验中,氧含量≤5% 的缺氧处理显著抑制土壤中脲酶活性,导致土壤中NO3--N含量低于非缺氧状态,同时也增加了NH4+-N在土壤中的积累,提高了硝酸还原酶和亚硝酸还原酶的活性,这可能导致氮损失的增加。同时,厌氧条件下显著降低了土壤中MBC和MBN含量,也减少了土壤微生物群落的多样性,不利于雷竹林的持续经营。综上,覆盖雷竹林导致的非淹水型缺氧会影响土壤氮素的转化和利用,实际经营中需采用适当措施提高土壤氧含量以缓解缺氧带来的负面影响。
| [1] |
Gui R Y, Sun X, Zhuang S Y. Soil acidification in phyllostachys praecox f. preveynalis cultivation with intensive management[J]. Communications in Soil Science and Plant Analysis, 2013, 44(22): 3235-3245 DOI:10.1080/00103624.2013.841915 (  0) 0) |
| [2] |
佘远国, 肖创伟, 杨裕振, 等. 立竹密度和竹龄结构对覆盖雷竹竹笋产量的影响[J]. 经济林研究, 2017, 35(1): 64-67 (  0) 0) |
| [3] |
Chen L, Qiang T T, Chen X J, et al. Fabrication and evaluation of biodegradable multi-cross-linked mulch film based on waste gelatin[J]. Chemical Engineering Journal, 2021, 419: 129639 DOI:10.1016/j.cej.2021.129639 (  0) 0) |
| [4] |
Wu F, Wu N, Zhang L P, et al. Winter mulching practice alters soil bacterial communities and networks in Lei bamboo (Phyllostachys praecox) forests[J]. Land Degradation & Development, 2023, 34(9): 2535-2547 (  0) 0) |
| [5] |
Qian Z Z, Zhuang S Y, Gui R Y, et al. Effect of soil aeration treatment on the physiological and biochemical characteristics of Phyllostachys praecox under the organic material mulching[J]. Plant and Soil, 2021, 459(1): 357-369 (  0) 0) |
| [6] |
陈闻, 吴家森, 姜培坤, 等. 不同施肥对雷竹林土壤肥力及肥料利用率的影响[J]. 土壤学报, 2011, 48(5): 1021-1028 (  0) 0) |
| [7] |
杨秉庚, 蔡思源, 刘宇娟, 等. 土壤供保氮能力决定稻田氮肥增产效果和利用率[J]. 土壤学报, 2023, 60(1): 212-223 (  0) 0) |
| [8] |
Liu R, Liu Y, Gao Y, et al. The nitrogen cycling key functional genes and related microbial bacterial community α-diversity is determined by crop rotation plans in the Loess Plateau[J]. Agronomy, 2023, 13(7): 1769 DOI:10.3390/agronomy13071769 (  0) 0) |
| [9] |
Li Y L, Shi W M, Wang X X. New insights into how increases in fertility improve the growth of rice at the seedling stage in red soil regions of subtropical China[J]. PLoS One, 2014, 9(10): e109161 DOI:10.1371/journal.pone.0109161 (  0) 0) |
| [10] |
Harrison M D, Groffman P M, Mayer P M, et al. Denitrification in alluvial wetlands in an urban landscape[J]. Journal of Environmental Quality, 2011, 40(2): 634-646 DOI:10.2134/jeq2010.0335 (  0) 0) |
| [11] |
Buresh R J, De Datta S K, Samson M I, et al. Dinitrogen and nitrous oxide flux from urea basally applied to puddled rice soils[J]. Soil Science Society of America Journal, 1991, 55(1): 268-273 DOI:10.2136/sssaj1991.03615995005500010046x (  0) 0) |
| [12] |
Zibilske L M, Bradford J M. Oxygen fffects on carbon, polyphenols, and nitrogen mineralization potential in soil[J]. Soil Science Society of America Journal, 2007, 71(1): 133-139 DOI:10.2136/sssaj2006.0167 (  0) 0) |
| [13] |
Xu C M, Chen L P, Chen S, et al. Rhizosphere aeration improves nitrogen transformation in soil, and nitrogen absorption and accumulation in rice plants[J]. Rice Science, 2020, 27(2): 162-174 DOI:10.1016/j.rsci.2020.01.007 (  0) 0) |
| [14] |
Wang S G, Zeng Y. Ammonia emission mitigation in food waste composting: A review[J]. Bioresource Technology, 2018, 248: 13-19 DOI:10.1016/j.biortech.2017.07.050 (  0) 0) |
| [15] |
Zou N, Huang L, Chen H J, et al. Nitrogen form plays an important role in the growth of moso bamboo (Phyllostachys edulis) seedlings[J]. PeerJ, 2020, 8: e9938 DOI:10.7717/peerj.9938 (  0) 0) |
| [16] |
李国栋, 胡骁伟, 牟梦晓, 等. 不同氮素形态及配比对毛竹实生苗生长及养分吸收的影响[J]. 福建农林大学学报(自然科学版), 2014, 43(2): 151-155 (  0) 0) |
| [17] |
李玉静, 冯雨晴, 赵园园, 等. 不同形态氮素吸收利用及其对植物生理代谢影响的综述[J]. 中国农业科技导报, 2023, 25(2): 128-139 (  0) 0) |
| [18] |
Liu G D, Porterfield D M. Oxygen enrichment with magnesium peroxide for minimizing hypoxic stress of flooded corn[J]. Journal of Plant Nutrition and Soil Science, 2014, 177(5): 733-740 DOI:10.1002/jpln.201300424 (  0) 0) |
| [19] |
王瑞, 李奕林, 喻敏, 等. 过氧化脲及尿素配比对水培上海青生长及品质的影响[J]. 土壤, 2022, 54(2): 240-246 DOI:10.13758/j.cnki.tr.2022.02.004 (  0) 0) |
| [20] |
Liu D Y, Paul A L, Morgan K T, et al. Effects of oxygen fertilization on damage reduction in flooded snap bean (Phaseolus vulgaris L.)[J]. Scientific Reports, 2022, 12: 4282 DOI:10.1038/s41598-022-08165-5 (  0) 0) |
| [21] |
Gao J S, Zhuang S Y, Gui R Y. Subsurface aeration mitigates organic material mulching-induced anaerobic stress via regulating hormone signaling in Phyllostachys praecox roots[J]. Frontiers in Plant Science, 2023, 14: 1121604 DOI:10.3389/fpls.2023.1121604 (  0) 0) |
| [22] |
Qian Z Z, Zhuang S Y, Gao J S, et al. Can aeration improve bamboo soil fertility of soil below bamboo and fungal diversity under mulching conditions?[J]. Land Degradation & Development, 2022, 33(13): 2353-2365 (  0) 0) |
| [23] |
Gödde M, Conrad R. Simultaneous measurement of nitric oxide production and consumption in soil using a simple static incubation system, and the effect of soil water content on the contribution of nitrification[J]. Soil Biology and Biochemistry, 1998, 30(4): 433-442 DOI:10.1016/S0038-0717(97)00197-1 (  0) 0) |
| [24] |
Yang Y J, Zhang J B, Cai Z C. Nitrification activities and N mineralization in paddy soils are insensitive to oxygen concentration[J]. Acta Agriculturae Scandinavica, Section B — Soil & Plant Science, 2016, 66(3): 272-281 (  0) 0) |
| [25] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 2000: 146-195
(  0) 0) |
| [26] |
中华人民共和国环境保护部. 土壤氨氮、亚硝酸盐氮、硝酸盐氮的测定氯化钾溶液提取-分光光度法: HJ 634—2012[S]. 北京: 中国环境科学出版社, 2012.
(  0) 0) |
| [27] |
Kandeler E, Gerber H. Short-term assay of soil urease activity using colorimetric determination of ammonium[J]. Biology and Fertility of Soils, 1988, 6(1): 68-72 (  0) 0) |
| [28] |
Hadwan M H. Simple spectrophotometric assay for measuring catalase activity in biological tissues[J]. BMC Biochemistry, 2018, 19(1): 7 (  0) 0) |
| [29] |
Brookes P C, Landman A, Pruden G, et al. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil[J]. Soil Biology and Biochemistry, 1985, 17(6): 837-842 (  0) 0) |
| [30] |
Lu Z R, Zhou Y, Li Y M, et al. Effects of partial substitution of chemical fertilizer with organic manure on the activity of enzyme and soil bacterial communities in the mountain red soil[J]. Frontiers in Microbiology, 2023, 14: 1234904 (  0) 0) |
| [31] |
Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276 (  0) 0) |
| [32] |
Hachiya T, Inaba J, Wakazaki M, et al. Excessive ammonium assimilation by plastidic glutamine synthetase causes ammonium toxicity in Arabidopsis thaliana[J]. Nature Communications, 2021, 12(1): 4944 (  0) 0) |
| [33] |
Tang J H, Li X, Cui P, et al. Nitrification plays a key role in N2O emission in electric-field assisted aerobic composting[J]. Bioresource Technology, 2020, 297: 122470 (  0) 0) |
| [34] |
Zhang Y, Zhao Y, Chen Y N, et al. A regulating method for reducing nitrogen loss based on enriched ammonia-oxidizing bacteria during composting[J]. Bioresource Technology, 2016, 221: 276-283 (  0) 0) |
| [35] |
Zhuang S, Ding J J, Lin W, et al. Transient anoxic conditions boost N2O emissions by stimulating denitrification capacity and decreasing N2O reduction ratio in soils with different carbon substrates[J]. Soil Biology and Biochemistry, 2024, 192: 109351 (  0) 0) |
| [36] |
Müller C, Laughlin R J, Spott O, et al. Quantification of N2O emission pathways via a 15N tracing model[J]. Soil Biology and Biochemistry, 2014, 72: 44-54 (  0) 0) |
| [37] |
Attard E, Poly F, Commeaux C, et al. Shifts between Nitrospira- and Nitrobacter-like nitrite oxidizers underlie the response of soil potential nitrite oxidation to changes in tillage practices[J]. Environmental Microbiology, 2010, 12(2): 315-326 (  0) 0) |
| [38] |
Li Y, Ju X T, Wu D. Transient nitrite accumulation explains the variation of N2O emissions to N fertilization in upland agricultural soils[J]. Soil Biology and Biochemistry, 2023, 177: 108917 (  0) 0) |
| [39] |
马兰, 李晓波, 李博伦, 等. 土壤中羟胺和亚硝态氮非生物过程对N2O排放的贡献[J]. 土壤学报, 2016, 53(5): 1181-1190 (  0) 0) |
| [40] |
Islam A, Chen D, White R E, et al. Chemical decomposition and fixation of nitrite in acidic pasture soils and implications for measurement of nitrification[J]. Soil Biology and Biochemistry, 2008, 40(1): 262-265 (  0) 0) |
| [41] |
杜琳倩, 何钢, 王静, 等. 水淹胁迫下新型氧肥对土壤脲酶活性的影响[J]. 中南林业科技大学学报, 2013, 33(4): 66-69 (  0) 0) |
| [42] |
Ren H, Qin X H, Huang B L, et al. Responses of soil enzyme activities and plant growth in a Eucalyptus seedling plantation amended with bacterial fertilizers[J]. Archives of Microbiology, 2020, 202(6): 1381-1396 (  0) 0) |
| [43] |
Yu Y J, Zhang J B, Chen W W, et al. Effect of land use on the denitrification, abundance of denitrifiers, and total nitrogen gas production in the subtropical region of China[J]. Biology and Fertility of Soils, 2014, 50(1): 105-113 (  0) 0) |
| [44] |
Bastida F, Eldridge D J, García C, et al. Soil microbial diversity–biomass relationships are driven by soil carbon content across global biomes[J]. The ISME Journal, 2021, 15(7): 2081-2091 (  0) 0) |
| [45] |
张露, 吴龙龙, 黄晶, 等. 增氧处理对稻田土壤微生物量碳、氮和酶活性的影响[J]. 中国水稻科学, 2022, 36(4): 410-418 (  0) 0) |
| [46] |
Li D B, Li X J, Tao Y, et al. Deciphering the bacterial microbiome in response to long-term mercury contaminated soil[J]. Ecotoxicology and Environmental Safety, 2022, 229: 113062 (  0) 0) |
| [47] |
Guo Y F, Zhang D, Qi W. Bacterial diversity of herbal rhizospheric soils in Ordos desert steppes under different degradation gradients[J]. PeerJ, 2023, 11: e16289 (  0) 0) |
| [48] |
翟婉璐, 钟哲科, 高贵宾, 等. 覆盖经营对雷竹林土壤细菌群落结构演变及多样性的影响[J]. 林业科学, 2017, 53(9): 133-142 (  0) 0) |
| [49] |
Sorokin D Y, Vejmelkova D, Lücker S, et al. Nitrolancea hollandica gen. nov., sp. nov., a chemolithoautotrophic nitrite-oxidizing bacterium isolated from a bioreactor belonging to the phylum Chloroflexi[J]. International journal of systematic and evolutionary microbiology, 2014, 64(Pt 6): 1859-1865 (  0) 0) |
| [50] |
Thomas S H, Wagner R D, Arakaki A K, et al. The mosaic genome of Anaeromyxobacter dehalogenans strain 2CP-C suggests an aerobic common ancestor to the delta- proteobacteria[J]. PLoS One, 2008, 3(5): e2103 (  0) 0) |
| [51] |
Onley J R, Ahsan S, Sanford R A, et al. Denitrification by Anaeromyxobacter dehalogenans, a common soil bacterium lacking the nitrite reductase genes nirS and nirK[J]. Applied and Environmental Microbiology, 2018, 84(4): e01985-17 (  0) 0) |
| [52] |
Sanford R A, Wagner D D, Wu Q Z, et al. Unexpected nondenitrifier nitrous oxide reductase gene diversity and abundance in soils[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(48): 19709-19714 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Soil and Water Conservation, Nanjing Forestry University, Nanjing 210037, China
 2025, Vol. 57
2025, Vol. 57


