2. 教育部环境修复与生态健康重点实验室, 浙江大学环境与资源学院, 杭州 310058
据统计,全世界大约30% 的土地面积和50% 的潜在可耕地面积属于pH < 5.5的酸性土壤[1]。酸性土壤在我国主要分布在南方十几个省区,约占全国耕地总面积的1/4[2]。自然条件下,土壤酸化的进程相对缓慢,但是近年来由于酸沉降和化学肥料尤其氮肥的过量施用,土壤酸化问题日益严峻,酸化范围持续扩大,酸化程度持续增加。据统计,1980—2000年期间由于过量的氮肥施用导致中国农田土壤pH平均下降了0.5个单位[3]。土壤酸化会破坏土壤结构、土壤微生物群落结构及菌群的功能,威胁土壤生物多样性,影响农业生产和农田土壤微生态环境[4]。土壤过度酸化还会导致土壤质量和肥力下降,直接影响土壤养分例如磷、钼和硼的有效性,导致土壤重金属和铝离子活化,进而威胁农产品质量安全和人类健康。其中,铝毒是酸性或酸化土壤中影响作物生长最重要的限制因子,严重威胁全球的粮食安全[1]。施用土壤改良剂、遏制土壤酸化是改良酸化/酸性土壤的有效措施,也是当今土壤科学研究的热点之一。目前人们已经把石灰等碳酸钙类肥料、碱渣等碱性工业副产品、有机物料等应用于缓解铝毒害和改良酸性土壤,且在一定程度上取得了改土和增产的效果[5]。但是这些传统的改良剂通常改良目的单一、持效期短,土壤返酸严重,长期频繁施用易造成土壤板结、重金属污染等问题。因此,研发高效环保的酸性土壤改良剂,实现酸度改良和肥力提高并重是当下酸性土壤改良研究的重点任务之一。
生物质炭因独特的结构特征和理化性质,在农业生产和生态环境保护中的推广应用已成为国内外重点关注的领域。一方面,生物质炭通过碳负效应在土壤碳的增汇减排、缓解全球气候变化方面具有极大的应用潜力;另一方面,生物质炭在改善土壤质量和肥力、修复污染土壤和增加作物产量方面扮演着重要角色[6-8]。生物质炭具有较高的pH、阳离子交换量及稳定性,在提高土壤pH、降低铝毒害、阻控土壤酸化进程方面有优越的表现。与酸性土壤常用的传统改良剂相比,生物质炭表现出综合、长效的改良效果[9-11]。随着生物质炭的土壤环境行为和效应研究的广泛开展,人们对其缓解植物铝毒害及改良酸性土壤机制的认识也在不断深入。由此,本文从植物对铝毒害的响应入手,系统总结了生物质炭对酸性土壤的改良效果、作用机理及对其微生态环境的影响,以阐明生物质炭缓解植物铝毒的潜在作用机制,并探讨生物质炭在改良酸性土壤环境长期效应中可能存在的问题和不足,以期为酸性/酸化土壤改良剂的研发提供借鉴。
1 植物铝毒害及耐铝机制铝是地壳中含量最为丰富的金属元素,在中性或碱性土壤中通常以难溶性的硅酸铝或氧化铝形式存在,对植物无害,但在pH < 5.5的酸性土壤中,铝会以三价铝离子(Al3+)的形式释放出来,抑制根系伸长,进而影响作物生长。铝毒被认为是酸性土壤上限制作物生长最主要的障碍因子。因此,明确植物铝毒害和耐性机制是全面发挥酸性土壤生产潜力的前提,在阻控和改良酸性土壤的同时需要协同提高植物适应酸性土壤的能力。
1.1 铝胁迫对植物的毒害机制植物根系是最先接触和响应铝毒的器官,许多植物暴露在微摩尔浓度铝离子下数分钟或数小时后根系伸长便会受到严重抑制,这也是植物遭受铝毒最典型的症状。因此,根系伸长的受抑程度通常被用来表征植物对铝的敏感性和铝毒害的发生程度。植物根尖是铝毒害的原初靶位,也是铝离子和铝毒敏感标记物胼胝质积累的主要部位[1]。玉米根尖2 ~ 3 mm处是其识别铝毒胁迫的关键位置,也是铝抑制根系伸长的作用位点[12]。Sivaguru和Horst[13]进一步的研究表明,玉米根系对铝毒最敏感的部位是根尖远端过渡区。尽管铝对植物根系的毒害作用会因植物种类、铝浓度和暴露时间的不同而有所差异,但根系生长越活跃的部位受铝的毒害越严重。
根系细胞壁是植物最初与铝接触的部位,也是铝积累最多的细胞结构。对小麦、玉米、拟南芥等多种植物的研究表明,植物体内80% ~ 90%的铝积累在根系细胞壁,且根系长度与细胞壁铝的积累量呈显著负相关[14]。Taylor[15]认为铝是多价阳离子,既可以在植物根细胞表面沉淀形成铝聚合体,又可以与细胞壁中的游离羧基结合。细胞壁果胶、半纤维素等多糖组分是铝的主要结合位点,而且铝在细胞壁的结合能力与细胞壁组分和结构密切相关[1]。铝在细胞壁的结合能力和数量除了取决于细胞壁果胶、半纤维素的含量,还取决于果胶甲基化程度和半纤维素中木葡聚糖O-乙酰化程度;通常甲基化和乙酰化水平的降低会导致细胞壁多糖铝吸附位点的增加,铝结合能力增强[14, 16]。铝在细胞壁的大量积累会导致细胞壁可塑性和延展性下降,进而抑制细胞生长。Ma等[17]认为铝降低小麦根尖细胞壁延展性是铝诱导根伸长受抑的重要原因。
细胞质膜也是植物根系遭受铝毒害的主要靶位之一。铝离子可与质膜中的磷脂或膜蛋白紧密结合,导致质膜流动性和渗透性变差、胞内离子失衡,抑制钙离子通道和质膜H+-ATPase酶的活性,从而严重地影响根系质膜的结构和功能。虽然铝不是过渡金属,也不能催化氧化还原反应,但是铝可形成铝超氧化物半还原态自由基使其具备过氧化活性[18]。因此,铝胁迫常导致植物细胞产生大量活性氧,如超氧自由基(O2•–)、羟基自由基(HO•)、过氧化氢(H2O2)和单线态氧(1O2),导致细胞氧化损伤。质膜中脂质在活性氧(Reactive oxygen species,ROS)的作用下发生过氧化,质膜通透性增大,从而引起细胞死亡。铝毒胁迫对植物根系伸长的抑制与ROS诱导的质膜氧化损伤程度密切相关。
1.2 植物耐铝机制植物主要通过外部排斥和内部耐受2种机制抵御或缓解铝毒害(图 1),两者的区别主要在于解毒部位的差异,前者在质外体,后者在共质体。外部排斥机制主要通过阻止铝进入植物细胞内,从而减轻铝毒害;内部耐受机制主要通过降低已进入细胞内的铝活性及增强植物对铝诱导细胞损伤的耐性,从而降低铝的毒害[1, 16-17]。
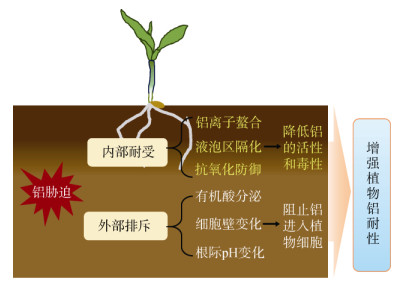
|
图 1 植物耐铝机制模式图 Fig. 1 Schematic diagram of plant aluminum tolerance mechanism |
铝毒害可以诱导植物根系分泌苹果酸、柠檬酸和草酸等多种有机酸,根系分泌的有机酸在根际区域可与铝反应生成稳定的螯合物,降低铝的活性,阻止铝进入共质体[1]。Delhaize等[19]在2个近等基因系的小麦基因型中发现,铝胁迫下耐铝基因型小麦根尖苹果酸的分泌量比敏感基因型高出10倍,表明小麦耐铝性与根系苹果酸的分泌密切相关。
尽管铝胁迫下不同植物品种分泌有机酸的种类和量存在差异,但是耐铝植物根系有机酸的分泌量远远高于敏感基因型。因此,铝胁迫下有机酸分泌被认为是植物耐铝最重要的外部排斥机制。近年来,随着小麦抗铝基因–铝诱导苹果酸分泌的转运蛋白基因ALMT1、大麦和高粱根尖铝激活的柠檬酸转运子HvAACTI和SbMATE,以及拟南芥、油菜、玉米等物种中ALMT1同源基因的克隆[1],人们对铝胁迫下有机酸分泌的分子机制研究越来越深入。
根系细胞壁是植物与土壤环境中铝接触的最初部位,也是铝积累的主要靶位,在植物感知和响应铝毒害中起着至关重要的作用。铝对植物的毒害作用与细胞壁中铝的积累量密切相关[14]。细胞壁与铝离子的紧密结合会抑制细胞壁的伸长,最终导致根系伸长受阻。铝离子可以与细胞壁果胶中带负电的羧基相互作用,导致铝在细胞壁积累。作为细胞壁中铝结合的主要组分,果胶与铝的结合能力不仅与果胶含量有关,还与果胶甲基化程度密切相关[1, 14]。果胶甲酯酶(PME) 是调控果胶去甲酯化修饰的关键酶,参与植物对铝毒胁迫的耐性[20]。例如,玉米、荞麦和水稻不同基因型对铝抗性差异与根尖细胞壁果胶甲基化程度密切相关。铝胁迫下,耐铝品种根系细胞壁果胶通常具有较高的甲基化水平和较低的果胶甲酯酶活性,从而使细胞壁结合较少的铝,减轻铝的毒害。此外,铝离子也可以通过吸附与不带电荷的半纤维素聚合物紧密结合,显著影响植物耐铝性。在拟南芥根系半纤维素中木葡聚糖是最丰富的多糖,也是铝主要的结合位点,研究表明,木葡聚糖及其O-乙酰化水平决定了铝在半纤维素中的结合能力,进而影响铝的敏感性[16]。
当铝离子穿过细胞膜进入细胞内,植物体内的有机酸、多酚等可以与铝络合,从而降低铝的毒性[1, 10]。如荞麦吸收Al3+后,能够在根细胞中形成稳定的、无毒的铝–草酸盐1∶3络合物[21]。此外,液泡的区室化也是赋予植物铝耐受能力的关键机制之一。Shen等[22]通过直接分离和纯化原生质体和液泡,首次报道了铝在耐铝荞麦叶片中的区隔现象,对于液泡膜上参与调控铝离子在细胞内再分布的转运子的鉴定,为液泡区室化提高植物耐铝性提供了有力证据。
铝诱导的氧化胁迫也是导致细胞死亡、抑制根系伸长的关键因素。铝诱导根系对氧化胁迫的反应,是植物响应铝毒胁迫的重要组成部分。通常情况下,抗氧化防御系统的激活能够赋予植物更强的耐铝性。例如,Sun等[23]在研究小麦时发现,铝胁迫下耐铝基因型比铝敏感基因型具有更强的过氧化氢酶活性、更高的还原型抗坏血酸和谷胱甘肽含量,而ROS水平和膜脂过氧化程度更低。过表达谷胱甘肽还原酶AtGR1基因可以显著提高还原型谷胱甘肽含量,减少H2O2积累,增强拟南芥的耐铝性[24]。
2 生物质炭对酸性土壤的改良作用 2.1 生物质炭对土壤pH和铝形态的调控作用通常生物质炭具有较高的阳离子交换量(CEC)、较高的pH,富含羧基和酚羟基等含氧官能团[25]。生物质炭进入土壤后,能显著提高土壤pH。Yuan等[25]在pH 4.3的红壤中添加不同农作物秸秆生物质炭,发现所有生物质炭均可提高土壤pH(提高范围0.18 ~ 0.66个单位)。尽管不同来源的生物质炭对土壤pH改变能力存在差异,但是生物质炭改良后的土壤pH与生物质炭自身的pH呈显著正相关。Yuan和Xu[26]通过比较豆科作物(绿豆、蚕豆、大豆和花生)制备的生物质炭和禾本科作物(稻壳、大米、小麦和玉米秸秆)制备的生物质炭发现,前者具有更高的碱性,并且对酸性红壤的改良效果优于禾本科作物制备的生物质炭。通过分析生物质炭中碱性物质的存在形态发现,碳酸盐和有机含氧官能团如羧基和酚羟基等的含量决定了生物质炭碱性的强弱[27]。由于高温条件下有机含氧官能团减少,通常建议低于500℃生产的生物质炭宜作为酸性土壤的合适改良剂[27-28]。随着生物质炭施用量或频率的增加,其带入土壤中的碱性物质增多,对酸性土壤pH的提升效果越显著。例如,污泥制备的生物质炭的施用量从10 g/kg增加40 g/kg可以显著提高酸性土壤pH[29]。
随着土壤pH的提高,土壤中的主要活性形态铝(土壤溶液中Al3+或土壤胶体表面交换性铝)通过水解、聚合和沉淀等一系列反应,转化为低毒或无毒的Al(OH)4-和Al(OH)3。因此,随着生物质炭加入,酸性土壤中活性铝逐渐转化为羟基铝。生物质炭较大的比表面积和丰富的官能团在影响土壤铝形态中起重要作用。研究发现,生物质炭降低酸性土壤中铝的活性主要通过表面吸附、铝与硅酸盐共沉淀,及表面富含的有机羟基和羧基对铝离子的络合实现[26, 30]。例如,20 t/hm2木材制备的生物质炭施入酸性土壤后,土壤中可溶性铝和可交换性铝的含量显著降低[31]。Qian和Chen[32]通过模拟酸化土壤中生物炭的老化过程,发现老化生物质炭表面羟基和羧基增加,对铝的固持能力不断增强,因此认为酸性土壤施用生物质炭在降酸控铝中具有持效性。也有不同研究通过比较新鲜和老化的生物质炭发现,老化生物炭对土壤中活性酸和潜在酸的含量并没有显著影响,甚至酸化老化后的生物质炭会提高土壤中Al3+的含量,加剧土壤酸化[33]。因此,生物质炭老化及其对酸性土壤的改良效果仍需深入研究。
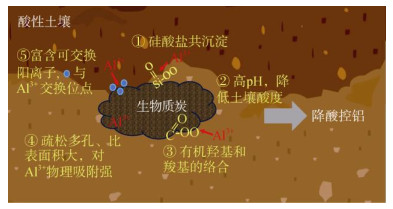
|
图 2 生物质炭对酸性土壤中铝活性的影响机制 Fig. 2 Mechanisms of effect of biochar on aluminum activity in acid soils |
土壤酸化易导致诸多问题,如土壤板结、肥力下降、养分贫瘠等,最终导致作物产量与品质下降。“酸”和“瘦”是我国南方酸性红壤最突出的特点。因此,改良酸性不仅需要提高土壤pH,而且需要改善土壤结构、提高土壤肥力。生物质炭疏松多孔、比表面积大,能够有效地吸附土壤胶体,促进土壤团聚体的形成[20, 24]。含有丰富团粒结构的土壤可耕性良好、板结性降低,利于植物生长。大量的研究表明,施用生物质炭可以促进酸性土壤中稳定性团聚体的形成。例如,黄超等[34]研究发现,红壤中添加小麦秸秆生物质炭可以显著提高土壤水稳定性团聚体数量。而且长期定位试验结果表明,酸性土壤中连续施用生物炭可以大幅度增加耕作层中土壤团聚体的稳定性[35]。此外,生物质炭能够降低酸性土壤容重,改善土壤总孔隙度,提高毛管孔隙度,进而增强土壤水分涵养能力[36]。
酸性土壤中施用生物质炭可以提升土壤有机质的含量水平。例如,李江舟等[35]研究发现,酸性红壤耕作层中有机碳含量随着烟秆生物质炭施用年限和施用量的增加而逐年提高。此外,生物质炭还能改变酸性土壤中有机质组成。酸性红壤中腐殖酸比例随着生物质炭用量的增加逐渐下降,而胡敏素等有机物质的含量则显著增加[34]。目前,生物质炭提升酸性土壤有机质含量的作用机制仍不清楚。有研究认为,生物质炭通过活化土壤有机质,提高微生物的活性,增强其对土壤腐殖质的分解[37]。也有研究认为,生物质炭表面的芳香结构可以与有机质结合,钝化土壤有机质,保护土壤中有机质不易被分解,从而间接提升酸性土壤有机质含量[38]。
生物质炭还有利于酸性土壤中矿质养分的持留和缓释,提高土壤养分的含量和有效性。由于生物质炭中速效养分含量较高,施入土壤后可以直接释放养分元素,增加土壤养分含量。例如,酸性土壤中添加生物质炭后,土壤中全氮、全磷和游离态钾、钙、镁等离子的含量均大幅提升[36]。生物质炭可以增强酸性土壤对养分元素尤其氮素的吸持能力,减少淋溶损失。例如,Steiner等[39]利用15N标记试验发现,添加木炭的土壤中氮的保留量显著高于只添加化肥的土壤。酸性土壤固磷能力强,导致磷极易缺乏。与磷相似,钼也容易被酸性土壤吸持、固定。研究表明,除带入磷、钼元素外,生物质炭还可以通过吸附钙、铝离子以及提高土壤pH,增加酸性土壤中磷和钼的生物有效性和作物利用率[10, 40]。
2.3 生物质炭对酸性土壤微生物活性的影响土壤微生物几乎参与所有的土壤物质转化过程,是驱动生物地球化学循环的关键因素。然而,土壤微生物群落对土壤酸化及其敏感,微生物功能如固氮、硝化和解磷等均与土壤pH密切相关。例如,齐莎等[41]在内蒙古典型草原的研究发现,长期施肥导致的土壤酸化减弱了草原土壤中微生物的活性及碳代谢微生物群落结构的多样性。通常土壤细菌比真菌对土壤酸化响应更敏感,土壤酸化导致的细菌群落结构的变化降低了土壤对病原菌的抑制能力,导致土壤微生物区系由“细菌型”向“真菌型”转变[42]。Li等[43]利用宏基因组测序和非靶向代谢组学分析发现,土壤酸化下硫化合物代谢基因显著下调及其关联的关键性状弱化是土壤抑病能力降低的重要机制。
生物质炭对酸性/酸化土壤微生物活性、数量、群落结构和功能的影响已有不少研究。例如,烟杆生物质炭可以显著提高酸性土壤中烟草根际微生物的种类[44]。在酸性蛇纹石土壤中施用木炭,Herath等[45]发现土壤细菌和真菌的数量均在25 g/kg生物质炭添加时达到最高值。生物质炭增强酸性土壤微生物数量和活性可能主要由于其疏松多孔的结构为微生物提供栖息地以及其含有丰富的养分元素为微生物提供养分。生物质炭还能影响酸性土壤中微生物群落的结构和功能。在酸化蔬菜土壤中,生物质炭可以有效缓解菜地土壤酸化,增加反硝化微生物nosZ基因丰度[46]。Chen等[47]研究表明,分解有机碳的放线菌、变形菌、厚壁菌和子囊菌的相对丰度在施用小麦秸秆生物质炭后显著降低,土壤有机质–矿物质相互作用明显增强,从而降低土壤碳流失。生物质炭还可以影响酸性土壤中微生物的代谢过程。通过代谢组学分析,Xia等[48]发现生物质炭配施氮肥能够提高次生代谢产物的生物合成和氨基酸代谢过程,增加脂类和有机酸等代谢产物在土壤中的含量,从而提升酸性土壤的健康质量。然而酸性土壤中生物质炭对土壤微生物的影响还取决于土壤肥力水平。肥力较低的酸性土壤中,生物质炭可以显著提高微生物量,而高肥力酸性土壤中生物质炭降低了微生物量[41]。目前关于生物质炭对酸性土壤微生物影响的研究集中在短期或室内培养试验,有必要开展长期定位试验,深入解析生物质炭对微生物持续性影响的田间应用效果。
3 生物质炭对植物铝毒的缓解作用 3.1 生物质炭对铝胁迫下植物生长和生理过程的影响生物质炭可以显著缓解铝胁迫对植物根系伸长、养分吸收等生理生化过程的影响,提高作物产量(表 1)。例如,花生壳制备的生物质炭可以促进铝胁迫下卷心菜的生长,减轻铝对卷心菜的毒害,提高作物产量[49]。Shi等[50]研究发现,花生秸秆生物质炭可以显著缓解铝对玉米根系伸长的抑制作用,而且其对铝毒的缓解效果及持效性远高于石灰。牛粪制备的生物质炭可以缓解铝对小麦根系的抑制作用[51]。由于根系在植物摄取水分和养分中起着至关重要的作用,因此生物质炭对根系伸长的促进可以改善铝胁迫下植物的水分和养分状况。铝胁迫下,花生壳生物质炭可以缓解铝对玉米的毒害,提高氮肥利用效率[48]。
尽管铝毒最直接、最明显的毒害作用在植物根系,但是铝也可以扰乱植物叶片中叶绿素的含量,以及影响光合作用、碳水化合物代谢、有机酸代谢和氮代谢等多个生理生化过程。Abdul等[52]发现生物质炭可以提高铝毒胁迫下水稻叶片叶绿素含量、光合速率和水分利用效率,进而提高作物产量。酸性土壤铝胁迫下,饭豆叶片光合作用参数如净光合速率、气孔导度和胞内CO2浓度均受到严重抑制,而施用生物质炭(马铃薯地上部制备)可以显著提高植物的净光合速率[53]。全面解析生物质炭介导的植物对铝毒胁迫的响应有助于深入了解生物质炭缓解铝毒害的作用机理,进一步为生物质炭的农业绿色可持续应用提供科学依据。
3.2 生物质炭缓解植物铝毒害的机制生物质炭在热解的过程中,挥发性有机物挥发,而可交换阳离子(如钙、镁、硅等阳离子)保留在生物质炭中[53]。例如,水稻秸秆中硅的含量高达100 ~ 200 g/kg,用其制备的生物质炭中可以保留较高水平的生物可利用硅。硅作为一种植物的有益元素,可以提高植物对生物和非生物逆境的耐受性,在植物适应逆境环境中起重要的调控作用。如,硅可以缓解镉、砷、铝等金属对植物的毒害作用[54]。在土壤–植物系统中,硅可以通过提高根际pH、在根际或植物体内与铝形成铝硅复合物、减少根尖铝积累和提高抗氧化防御等途径缓解铝毒害[55]。酸性土壤中持续施用秸秆生物质炭可以使土壤富集硅元素,有助于土壤健康,缓解铝毒害。铝胁迫下,添加50 g/kg的水稻秸秆生物质炭可以显著提高根尖硅含量,其与铝在根表皮细胞形成稳定的铝硅复合物,从而缓解铝毒害,增加地上部鲜重[56]。
|
|
表 1 生物质炭对植物铝毒的缓解作用 Table 1 Alleviating effects of biochar on aluminum toxicity in plants |
生物质炭对铝毒的缓解作用还与其理化性质直接相关。生物质炭具有多孔结构,有利用增强表面羟基、羧基官能团对环境中Al3+的吸附,发生酯化反应,形成有机复合体。Qian和Chen[57]利用傅立叶变换红外光谱、扫描电镜和X射线衍射分析等发现,水稻秸秆生物质炭和牛粪生物质炭中的有机组分和硅酸盐颗粒均可以吸附Al3+,从而使其具备双重的铝吸附位点。一方面,铝与有机羟基和羧基的络合,另一方面,硅酸盐颗粒(如KAlSi3O8)对Al3+的表面吸附和共沉淀,二者均有助于生物质炭对铝的吸附,从而降低铝的活性和毒性。
除降低铝的活性外,生物质炭还可以减少铝在根尖的积累,缓解铝对植物造成的氧化损伤。例如,Shi等[50]研究表明,花生秸秆生物质炭可以显著降低酸性土壤中玉米根尖铝的含量,维持根尖细胞膜的完整性。小麦根尖中,水稻秸秆生物质炭也减少了铝的积累量,降低了铝导致的根尖细胞死亡[56]。尽管生物质炭可以通过多种机制缓解植物铝毒害(图 3),但是在酸性土壤中生物质炭缓解铝毒的长期效应有待进一步深入研究。
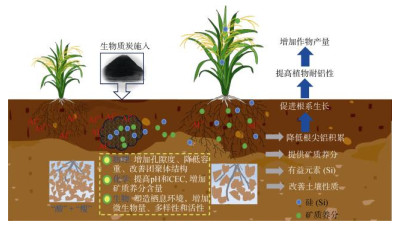
|
图 3 酸性土壤中生物质炭通过调控土壤–植物系统提高作物的产量 Fig. 3 Biochar in acid soil increases crop yield by regulating soil-plant system |
生物质炭在改良酸性/酸化土壤中发挥了积极作用,在提高土壤pH、缓解铝对植物毒害的同时,可以显著提高土壤肥力、改善土壤结构、增加土壤团聚体稳定性、提高土壤微生物活性,最终提高酸性土壤作物产量和品质。目前关于生物质炭在改良酸性土壤中的作用及应用仍存在以下问题亟需解决:①生物质炭性质和功能复杂,其抑制土壤酸化的作用机制仍不完全清楚,对酸性土壤理化性质的影响研究仍不够彻底,对酸性土壤微环境的影响有待进一步研究;②目前大部分研究局限于室内模拟和短期田间试验,进入土壤环境中的生物质炭在降雨、冻融、化学氧化、微生物分解等环境要素的作用下,理化性质会发生一系列的改变(例如老化),然而关于生物质炭老化对酸性土壤改良持效性的影响仍缺乏系统研究;③生物质炭在制备过程中还可能产生一定量的有毒有害物质,长期大量施用对农田生态环境的潜在风险有待评估;④生物质炭原料、制备条件和酸性土壤类型等存在差异,现有的改良酸性土壤的生物质炭材料和体系尚不完善,生物质炭改良效果研究还处于起步阶段,缺乏相应的施用标准和规程,下一步需制定科学合理的含生物质炭调理剂产品标准,并对不同生物质炭的改良效果和施用风险开展长期定位监控与评价研究,针对不同生物质炭、酸性土壤类型建立科学完善的施用标准。因此,今后需要开展长期田间试验,综合考虑多种条件,系统评价生物质炭生态效应,明确生物炭改良不同酸性土壤的作用周期及环境效应,为掌握酸性土壤改良过程中生物质炭作用时间演变规律提供科学数据,也为其可持续利用提供技术指导。
| [1] |
Kochian L V, Piñeros M A, Liu J P, et al. Plant adaptation to acid soils: The molecular basis for crop aluminum resistance[J]. Annual Review of Plant Biology, 2015, 66: 571-598 DOI:10.1146/annurev-arplant-043014-114822 (  0) 0) |
| [2] |
赵学强, 潘贤章, 马海艺, 等. 中国酸性土壤利用的科学问题与策略[J]. 土壤学报, 2023, 60(5): 1248-1263 (  0) 0) |
| [3] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010 DOI:10.1126/science.1182570 (  0) 0) |
| [4] |
Meng C, Tian D S, Zeng H, et al. Global soil acidification impacts on belowground processes[J]. Environmental Research Letters, 2019, 14(7): 074003 DOI:10.1088/1748-9326/ab239c (  0) 0) |
| [5] |
任韬宇, 王朋顺, 袁水含, 等. 基于专利和产品登记的酸性土壤调理剂创新计量分析[J]. 土壤, 2023, 55(4): 860-870 DOI:10.13758/j.cnki.tr.2023.04.020 (  0) 0) |
| [6] |
Weng Z, Van Zwieten L, Singh B P, et al. Biochar built soil carbon over a decade by stabilizing rhizodeposits[J]. Nature Climate Change, 2017, 7(5): 371-376 DOI:10.1038/nclimate3276 (  0) 0) |
| [7] |
邓倩, 马娟娟, 孙西欢, 等. 生物质炭对农田土壤腐殖质的影响——Meta分析[J]. 土壤, 2024, 56(1): 42-48 DOI:10.13758/j.cnki.tr.2024.01.006 (  0) 0) |
| [8] |
张小凯, 何丽芝, 陆扣萍, 等. 生物质炭修复重金属及有机物污染土壤的研究进展[J]. 土壤, 2013, 45(6): 970-977 (  0) 0) |
| [9] |
Kapoor A, Sharma R, Kumar A, et al. Biochar as a means to improve soil fertility and crop productivity: A review[J]. Journal of Plant Nutrition, 2022, 45(15): 2380-2388 DOI:10.1080/01904167.2022.2027980 (  0) 0) |
| [10] |
杨彩迪, 刘静静, 卢升高. 生物质炭改良酸性土壤的电化学特性研究[J]. 土壤学报, 2023, 60(3): 815-823 (  0) 0) |
| [11] |
Bolan N, Sarmah A K, Bordoloi S, et al. Soil acidification and the liming potential of biochar[J]. Environmental Pollution, 2023, 317: 120632 DOI:10.1016/j.envpol.2022.120632 (  0) 0) |
| [12] |
Ryan P R, Kochian L V. Interaction between aluminum toxicity and calcium uptake at the root apex in near-isogenic lines of wheat (Triticum aestivum L.) differing in aluminum Tolerance[J]. Plant Physiology, 1993, 102(3): 975-982 DOI:10.1104/pp.102.3.975 (  0) 0) |
| [13] |
Sivaguru M, Horst W J. The distal part of the transition zone is the most aluminum-sensitive apical root zone of maize[J]. Plant Physiology, 1998, 116(1): 155-163 DOI:10.1104/pp.116.1.155 (  0) 0) |
| [14] |
Sun C L, Lu L L, Yu Y, et al. Decreasing methylation of pectin caused by nitric oxide leads to higher aluminium binding in cell walls and greater aluminium sensitivity of wheat roots[J]. Journal of Experimental Botany, 2016, 67(3): 979-989 DOI:10.1093/jxb/erv514 (  0) 0) |
| [15] |
Taylor G J. The physiology of aluminum phytotoxicity[J]. In Metal Ions in Biological Systems, 1988, 24: 123-163 (  0) 0) |
| [16] |
Zhu X F, Shi Y Z, Lei G J, et al. XTH31, encoding an in vitro XEH/XET-active enzyme, regulates aluminum sensitivity by modulating in vivo XET action, cell wall xyloglucan content, and aluminum binding capacity in Arabidopsis[J]. The Plant Cell, 2012, 24(11): 4731-4747 DOI:10.1105/tpc.112.106039 (  0) 0) |
| [17] |
Ma J F, Shen R F, Nagao S, et al. Aluminum targets elongating cells by reducing cell wall extensibility in wheat roots[J]. Plant and Cell Physiology, 2004, 45(5): 583-589 DOI:10.1093/pcp/pch060 (  0) 0) |
| [18] |
Exley C. The pro-oxidant activity of aluminum[J]. Free Radical Biology and Medicine, 2004, 36(3): 380-387 DOI:10.1016/j.freeradbiomed.2003.11.017 (  0) 0) |
| [19] |
Delhaize E, Craig S, Beaton C D, et al. Aluminum tolerance in wheat (Triticum aestivum L.) (I. Uptake and distribution of aluminum in root apices)[J]. Plant Physiology, 1993, 103(3): 685-693 DOI:10.1104/pp.103.3.685 (  0) 0) |
| [20] |
Yang X Y, Zeng Z H, Yan J Y, et al. Association of specific pectin methylesterases with Al-induced root elongation inhibition in rice[J]. Physiologia Plantarum, 2013, 148(4): 502-511 DOI:10.1111/ppl.12005 (  0) 0) |
| [21] |
Ma J F, Zheng S J, Matsumoto H, et al. Detoxifying aluminium with buckwheat[J]. Nature, 1997, 390(6660): 569-570 (  0) 0) |
| [22] |
Shen R F, Ma J, Kyo M, et al. Compartmentation of aluminium in leaves of an Al-accumulator, Fagopyrum esculentum moench[J]. Planta, 2002, 215(3): 394-398 DOI:10.1007/s00425-002-0763-z (  0) 0) |
| [23] |
Sun C L, Liu L J, Zhou W W, et al. Aluminum induces distinct changes in the metabolism of reactive oxygen and nitrogen species in the roots of two wheat genotypes with different aluminum resistance[J]. Journal of Agricultural and Food Chemistry, 2017, 65(43): 9419-9427 DOI:10.1021/acs.jafc.7b03386 (  0) 0) |
| [24] |
Yin, L, Mano, J. I., Tanaka, K., Wang, S., Zhang, M., Deng, X., Zhang, S.. High level of reduced glutathione contributes to detoxification of lipid peroxide‐derived reactive carbonyl species in transgenic Arabidopsis overexpressing glutathione reductase under aluminum stress[J]. Physiologia Plantarum, 2017, 161(2): 211-223 DOI:10.1111/ppl.12583 (  0) 0) |
| [25] |
Yuan J H, Xu R K, Ning W, Li J Y. Amendment of acid soils with crop residues and biochars[J]. Pedosphere, 2011, 21(3): 302-308 DOI:10.1016/S1002-0160(11)60130-6 (  0) 0) |
| [26] |
Yuan J H, Xu R K. The amelioration effects of low temperature biochar generated from nine crop residues on an acidic Ultisol[J]. Soil Use and Management, 2011, 27(1): 110-115 DOI:10.1111/j.1475-2743.2010.00317.x (  0) 0) |
| [27] |
Yuan J H, Xu R K, Zhang H. The forms of alkalis in the biochar produced from crop residues at different temperatures[J]. Bioresource Technology, 2011, 102(3): 3488-3497 DOI:10.1016/j.biortech.2010.11.018 (  0) 0) |
| [28] |
Shetty R, Vidya C S, Prakash N B, et al. Aluminum toxicity in plants and its possible mitigation in acid soils by biochar: A review[J]. Science of The Total Environment, 2021, 765: 142744 DOI:10.1016/j.scitotenv.2020.142744 (  0) 0) |
| [29] |
Zong Y T, Wang Y F, Sheng Y, et al. Ameliorating soil acidity and physical properties of two contrasting texture Ultisols with wastewater sludge biochar[J]. Environmental Science and Pollution Research, 2018, 25(26): 25726-25733 DOI:10.1007/s11356-017-9509-0 (  0) 0) |
| [30] |
Xiao X, Chen B L, Chen Z M, et al. Insight into multiple and multilevel structures of biochars and their potential environmental applications: A critical review[J]. Environmental Science & Technology, 2018, 52(9): 5027-5047 (  0) 0) |
| [31] |
Shetty R, Prakash N B. Effect of different biochars on acid soil and growth parameters of rice plants under aluminium toxicity[J]. Scientific Reports, 2020, 10: 12249 DOI:10.1038/s41598-020-69262-x (  0) 0) |
| [32] |
Qian L B, Chen B L. Interactions of aluminum with biochars and oxidized biochars: Implications for the biochar aging process[J]. Journal of Agricultural and Food Chemistry, 2014, 62(2): 373-380 DOI:10.1021/jf404624h (  0) 0) |
| [33] |
林庆毅, 张梦阳, 张林, 等. 老化生物炭对红壤铝形态影响的潜在机制[J]. 生态环境学报, 2018, 27(3): 491-497 (  0) 0) |
| [34] |
黄超, 刘丽君, 章明奎. 生物质炭对红壤性质和黑麦草生长的影响[J]. 浙江大学学报(农业与生命科学版), 2011, 37(4): 439-445 (  0) 0) |
| [35] |
李江舟, 代快, 张立猛, 等. 施用生物炭对云南烟区红壤团聚体组成及有机碳分布的影响[J]. 环境科学学报, 2016, 36(6): 2114-2120 (  0) 0) |
| [36] |
郜礼阳, 林威鹏, 张风姬, 等. 生物炭对酸性土壤改良的研究进展[J]. 广东农业科学, 2021, 48(1): 35-44 (  0) 0) |
| [37] |
花莉, 金素素, 洛晶晶. 生物质炭输入对土壤微域特征及土壤腐殖质的作用效应研究[J]. 生态环境学报, 2012, 21(11): 1795-1799 DOI:10.3969/j.issn.1674-5906.2012.11.004 (  0) 0) |
| [38] |
郭实荣, 胡昆, 邱孺, 等. 生物炭对酸性土壤改良研究进展[J]. 内蒙古林业调查设计, 2017, 40(4): 92-94 (  0) 0) |
| [39] |
Steiner C, Das K C, Melear N, et al. Reducing nitrogen loss during poultry litter composting using biochar[J]. Journal of Environmental Quality, 2010, 39(4): 1236-1242 (  0) 0) |
| [40] |
Gundale M J, DeLuca T H. Charcoal effects on soil solution chemistry and growth of Koeleria macrantha in the ponderosa pine/Douglas-fir ecosystem[J]. Biology and Fertility of Soils, 2007, 43(3): 303-311 (  0) 0) |
| [41] |
齐莎, 赵小蓉, 郑海霞, 等. 内蒙古典型草原连续5年施用氮磷肥土壤生物多样性的变化[J]. 生态学报, 2010, 30(20): 5518-5526 (  0) 0) |
| [42] |
张玲玉, 赵学强, 沈仁芳. 土壤酸化及其生态效应[J]. 生态学杂志, 2019, 38(6): 1900-1908 (  0) 0) |
| [43] |
Li X G, Chen D L, Carrión V J, et al. Acidification suppresses the natural capacity of soil microbiome to fight pathogenic Fusarium infections[J]. Nature Communications, 2023, 14: 5090 (  0) 0) |
| [44] |
王成己, 陈庆荣, 陈曦, 等. 烟秆生物质炭对烟草根际土壤养分及细菌群落的影响[J]. 中国烟草科学, 2017, 38(1): 42-47 (  0) 0) |
| [45] |
Herath I, Kumarathilaka P, Navaratne A, et al. Immobilization and phytotoxicity reduction of heavy metals in serpentine soil using biochar[J]. Journal of Soils and Sediments, 2015, 15(1): 126-138 (  0) 0) |
| [46] |
李双双, 陈晨, 段鹏鹏, 等. 生物质炭对酸性菜地土壤N2O排放及相关功能基因丰度的影响[J]. 植物营养与肥料学报, 2018, 24(2): 414-423 (  0) 0) |
| [47] |
Chen J H, Sun X, Zheng J F, et al. Biochar amendment changes temperature sensitivity of soil respiration and composition of microbial communities 3 years after incorporation in an organic carbon-poor dry cropland soil[J]. Biology and Fertility of Soils, 2018, 54(2): 175-188 (  0) 0) |
| [48] |
Xia H, Riaz M, Babar S, et al. Assessing the impact of biochar on microbes in acidic soils: Alleviating the toxicity of aluminum and acidity[J]. Journal of Environmental Management, 2023, 345: 118796 (  0) 0) |
| [49] |
Lin Q Y, Zhang L, Riaz M, et al. Assessing the potential of biochar and aged biochar to alleviate aluminum toxicity in an acid soil for achieving cabbage productivity[J]. Ecotoxicology and Environmental Safety, 2018, 161: 290-295 (  0) 0) |
| [50] |
Shi R Y, Ni N, Nkoh J N, et al. Biochar retards Al toxicity to maize (Zea mays L.) during soil acidification: The effects and mechanisms[J]. Science of The Total Environment, 2020, 719: 137448 (  0) 0) |
| [51] |
Qian L B, Chen B L, Hu D F. Effective alleviation of aluminum phytotoxicity by manure-derived biochar[J]. Environmental Science & Technology, 2013, 47(6): 2737-2745 (  0) 0) |
| [52] |
Abdul Halim N S, Abdullah R, Karsani S A, et al. Influence of soil amendments on the growth and yield of rice in acidic soil[J]. Agronomy, 2018, 8(9): 165 (  0) 0) |
| [53] |
Yao L H, Yu X Y, Huang L, et al. Responses of Phaseolus calcaltus to lime and biochar application in an acid soil[J]. PeerJ, 2019, 7: e6346 (  0) 0) |
| [54] |
Vaculík M, Lukačová Z, Bokor B, et al. Alleviation mechanisms of metal(loid) stress in plants by silicon: A review[J]. Journal of Experimental Botany, 2020, 71(21): 6744-6757 (  0) 0) |
| [55] |
Hodson M J, Evans D E. Aluminium–silicon interactions in higher plants: An update[J]. Journal of Experimental Botany, 2020, 71(21): 6719-6729 (  0) 0) |
| [56] |
Qian L B, Chen B L, Chen M F. Novel alleviation mechanisms of aluminum phytotoxicity via released biosilicon from rice straw-derived biochars[J]. Scientific Reports, 2016, 6: 29346 (  0) 0) |
| [57] |
Qian L B, Chen B L. Dual role of biochars as adsorbents for aluminum: The effects of oxygen-containing organic components and the scattering of silicate particles[J]. Environmental Science & Technology, 2013, 47(15): 8759-8768 (  0) 0) |
2. MOE Key Laboratory of Environment Remediation and Ecological Health, College of Environmental & Resource Sciences, Zhejiang University, Hangzhou 310058, China
 2025, Vol. 57
2025, Vol. 57


