柑橘(Citrus reticulata)是全球最重要的水果之一,我国是柑橘的重要生产国,柑橘种植面积居世界首位[1]。柑橘栽培的管理强度大,其中杂草防控是柑橘园管理的重要内容之一[2]。我国柑橘种植区域通常具有较好的水热资源,且现代化柑橘园的种植密度不高,因此林下有较好的光照资源,加之水肥供应充足,为林下杂草提供了适宜的生长条件[3]。据调查,我国柑橘园杂草超过了300余种,虽然不同区域优势杂草种类和危害特点各不相同,但普遍具有生长迅速、繁殖能力强和抗逆性强等特点[4]。
柑橘园杂草防控一方面可以降低林下植被同柑橘树的养分和水分竞争,另一方面,林下杂草去除有利于田间管理活动的开展[5]。传统的柑橘园管理中广泛采用清耕方式,即通过周期性机械除草或喷施除草剂来控制柑橘园林下杂草的生长。机械除草需要投入大量劳动力,工作强度大、除草效率低,因此规模化的柑橘园广泛地使用除草剂来快捷地杀死林下杂草。然而,除草剂的大量使用引发了对果园生态健康的担忧。生草栽培被认为是一种能有效抑制果园林下杂草疯长且有助于改善土壤特性,提升生态系统服务功能的模式[3]。生草栽培即在果园内有选择地播种豆科类、禾本科类等草种作为果园覆盖作物,这些覆盖作物通常具有适应性强、覆盖周期长、生长量适宜、生长高度有限且根系分布较浅等特点[6]。
果树生长和果实品质与土壤健康状况紧密相关,而果园林下草本管理方式潜在地影响着复杂的土壤养分循环过程,对养分可利用性、关键酶活性和功能基因丰度产生显著不同的影响[7]。除草剂控草方式下,果园通过周期性喷施除草剂在控制林下草本生长的同时也限制了林下草本碳的形成和转化,减少土壤中有机质输入,进而影响土壤养分循环[8]。此外,除草剂能够影响土壤微生物群落结构和功能,如Epp Schimidt等[9]研究发现,草甘膦通过抑制大豆的固氮作用从而影响土壤氮循环过程。生草栽培同样显著影响着土壤养分循环过程,通过覆盖作物周期性的生长、刈割还田,可将大量有机质输入到土壤中促进土壤养分循环[10]。刘小勇等[11]研究表明,核桃大豆间作显著提高了土壤碱解氮和有效磷含量以及土壤微生物生物量碳。呼盼等[12]通过整合全球1 387组数据发现,果园生草栽培模式下的土壤有机碳含量比清耕果园高24.7%。焦润安等[13]研究发现,油橄榄园间作野豌豆相较于清耕管理提高了土壤碱解氮、有效磷含量,增加了土壤细菌、放线菌和真菌的数量。张承等[14]研究发现,猕猴桃园套种吉祥草4年后,土壤脲酶、蔗糖酶、磷酸酶活性较清耕管理均显著提升。因此,不同林下草本管理方式下,土壤养分循环受到差异化土壤酶活性和微生物功能基因丰度的调控,进而影响土壤养分库的大小[15]。然而,不同的果园林下草本管理方式如何综合影响土壤氮磷可利用性、相关酶活性以及微生物功能基因丰度依然有待于深入研究。
综上所述,林下草本管理方式的选择将显著影响柑橘园的土壤养分循环过程和土壤健康。随着农户对柑橘栽培管理认知的提高,逐步理解土壤化学特性、土壤微生物对产量和品质的影响以及绿色生产的重要意义,揭示和厘清除草剂控草和生草栽培对土壤生化特性的影响对于农户选择林下草本管理方式具有生产指导意义。本研究通过应用宏基因组测序技术,采用单因素控制试验研究了持续5年的生草栽培和除草剂控草处理对柑橘园土壤氮磷养分含量、酶活性和微生物功能基因丰度的影响及其相关关系,以期为通过优化果园杂草防控提升土壤健康提供理论依据。
1 材料与方法 1.1 试验地概况试验地位于四川省眉山市新华村的一户家庭柑橘种植园(30° 06' 37″ N,103°56' 1″E),面积约为66 700 m2。该园区柑橘品种为甘平,栽植于2019年,株距4 m,行距5 m。该区域属于亚热带季风湿润气候,年均气温17.4 ℃,年均降水量1 009.4 mm,年均日照1 196.6 h,无霜期312 d。土壤类型为黄壤,土层厚度超过70 cm。
1.2 试验设计2019年,在该柑橘园建立了6个50 m×50 m的样地,样地之间的距离大于30 m。将样地随机分为两个处理:除草剂控草(herbicide weed control,HWC)和生草栽培(sod cultivation,SC),每个处理3个重复。除草剂控草选用0.5% 草甘膦异丙胺盐(美国孟山都公司;农药登记证号:PD73-88),每年4月、7月、10月进行除草剂控草处理,年输入土壤的干杂草生物量约为4 000 kg/hm2。生草栽培处理使用白三叶草(Trifolium repens),播种量为30 kg/hm2,每年6月和11月分别刈草并就地覆盖,年输入土壤的干三叶草生物量约为9 000 kg/hm2。所有样地采用相同的水肥、病虫防治、修剪、收获等管理活动。在每个样地内部划定30 m×30 m的核心管理区,样品采集等工作在每个样方的核心管理区中进行,以缓冲处理之间的影响。处理从建园开始持续到本次研究取样有5年,各试验处理由于水肥、疏花疏果、植保和修剪等管理方式相同,生草栽培与除草剂控草样地的柑橘产量无显著差异。
1.3 土壤样品采集与处理2024年4月下旬进行土壤样品的采集,此时除草剂控草处理样地距离最近一次除草剂喷施约为2周,杂草基本全部枯死;生草栽培处理样地白三叶随气温升高处于迅速生长阶段。在各个样地的核心管理区随机选择5株柑橘树,用土钻采集树冠周边0 ~ 20 cm的土壤,充分混合后作为该样地的土壤样品。采集的土样放置于低温转运箱中及时运回四川省农业科学院实验室进行处理。土壤在剔除根系、石砾等杂质后过2 mm土筛,并分为两份子样品。第一份土样用于土壤宏基因组测序;第二份土样自然风干后,分别制备过2 mm土筛样品和过0.149 mm土筛样品。制备的风干土壤样品用于土壤基本理化性质包括土壤pH、总有机碳(TOC)、全氮(TN)、碱解氮(AN)、有效磷(AP)、速效钾(AK)和酶活性包括脲酶(Urease,UR)、过氧化氢酶(Catalase,CA)、磷酸酶(Phosphatase,PA)和蔗糖酶(Sucrose,SU)的测定。
1.4 土壤化学性质和酶活性测定土壤pH通过制备土水比为1∶2.5(w/V)的溶液采用酸度计(S400-B,梅特勒托利多生产)测定;土壤总有机碳含量采用重铬酸钾氧化-外加热法测定;土壤全氮含量采用凯氏定氮法测定;土壤有效磷采用0.5 mol/L碳酸氢钠溶液浸提,钼锑抗比色法测定;土壤速效钾采用1 mol/L乙酸铵溶液浸提,火焰光度法测定;土壤碱解氮采用扩散法测定;具体方法参照鲍士旦[16]编著的《土壤农化分析》。土壤脲酶、过氧化氢酶、磷酸酶、蔗糖酶分别采用靛酚比色法、高锰酸钾比色法、磷酸苯二钠比色法、3, 5-二硝基水杨酸比色法测定[17]。脲酶、磷酸酶、蔗糖酶活性分别以培养1 d后单位土壤中的硝态氮、酚、葡萄糖含量表示;过氧化氢酶活性以培养20 min后单位土壤消耗的0.1 mol/L高锰酸钾量表示。
1.5 土壤宏基因组测定采用E.Z.N.A.® stool DNA Kit(Omega Bio-tek,Norcross,GA,美国)试剂盒并按照试剂盒说明书提取土壤总DNA。对于每个样品,用Covaris S220聚焦超声仪(Woburn,MA,美国)将1 μg基因组DNA打碎,并用长度约为450 bp的片段制备测序文库。所有样品均通过Illumina Novaseq 6000测序仪采用双端150 bp(PE150)模式进行测序,测序工作委托上海凌恩生物科技有限公司完成。获得每个样本的宏基因组测序数据后,首先使用Trimmomatic(http://www.usadellab.org/cms/?page=trimmomatic)进行质量控制,以除去衔接子污染物和低质量读数。采用MEGAHIT (http://www.l3-bioinfo.com/products/megahit. html)对数据进行组装,将所有样品预测出来的基因序列,用CD-HIT软件(http://www.bioinformatics.org/cd-hit/)进行聚类,每个类别取最长的基因作为代表序列,构建非冗余基因集。使用BLASTP将基因集与非冗余蛋白质的氨基酸序列数据库(NR数据库)进行比对,并通过NR库对应的分类学信息数据库获得物种注释,然后使用物种对应的基因丰度总和计算该物种的丰度,并在各个分类学水平上统计物种丰度。利用预测的蛋白序列与NCycDB数据库(https://github.com/qichao1984/NCyc)进行比对,以获取氮循环功能基因注释信息;与PCycle数据库(https://github.com/ZengJiaxiong/Phosphorus-cycling-database)进行比对,以获取磷循环功能基因注释信息。
1.6 数据分析所有分析采用R语言(https://www.r-project.org/)进行,统计显著性水平为P < 0.05。采用独立样本T检验比较除草剂控草和生草栽培对测定的土壤理化指标、微生物多样性指数、功能基因丰度的影响。采用基于Bray-Curtis距离矩阵的非度量多维测量(NMDS)方法分析不同处理下土壤微生物群落基因水平的β多样性,并采用非参数多因素方差分析(Adonis)分析除草剂控草和生草栽培对土壤微生物群落的影响。使用Pearson法计算土壤理化性质和酶活性之间的相关性。使用ggcor包中的Mantel-test统计氮、磷循环过程关键功能基因丰度与土壤指标的关联关系[18]。
2 结果 2.1 土壤理化性质和酶活性该柑橘园的土壤平均pH为5.15,除草剂控草和生草栽培模式未显著影响土壤pH,但显著影响了土壤的养分含量。相较于除草剂控草,5年的生草栽培处理显著提高了土壤总有机碳、全氮、有效磷、速效钾和碱解氮含量(图 1)。
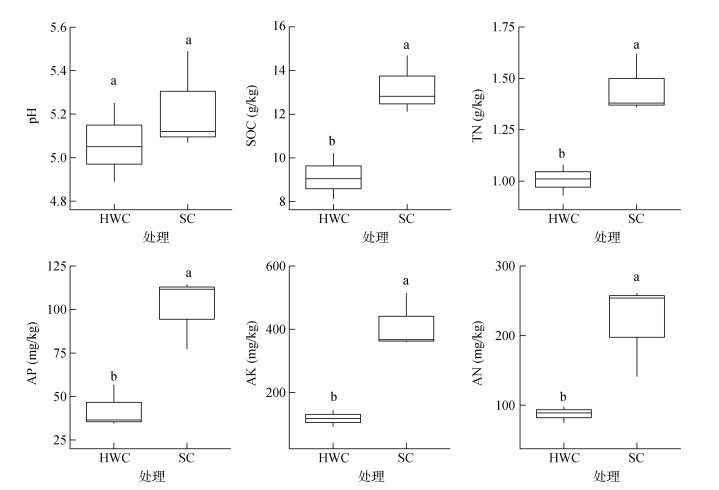
|
(HWC:除草剂控草;SC:生草栽培。箱线图中,箱体下边为第一四分位数,中间线为中位数,箱体上边为第三四分位数,上下须线为非离群值的范围。小写字母不同表示除草剂控草和生草栽培模式间差异显著下同) 图 1 除草剂控草和生草栽培模式下土壤化学特征 Fig. 1 Soil chemical properties under herbicide weed control and sod cultivation |
除草剂控草和生草栽培模式显著影响了土壤酶活性。与除草剂控草相比,生草栽培模式分别使土壤脲酶、蔗糖酶、磷酸酶活性提高了80%、100% 和58%,而两种模式下土壤过氧化氢酶活性无显著差异(图 2)。
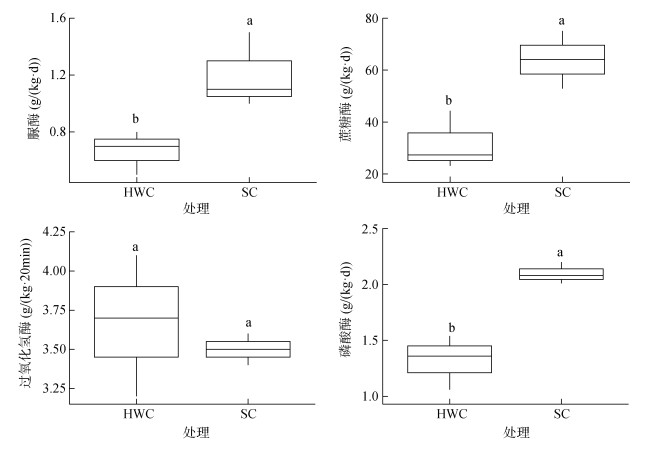
|
图 2 除草剂控草和生草栽培模式下土壤酶活性 Fig. 2 Soil enzyme activities under herbicide weed control and sod cultivation |
除草剂控草和生草栽培模式表现出不同的土壤微生物群落多样性。独立样本T检验结果表明,生草栽培在属水平的Shannon指数和Simpson指数均大于除草剂控草处理(图 3A)。除草剂控草和生草栽培处理下土壤微生物前十大优势菌门(图 3C)均为:假单胞菌门(Pseudomonadota)、酸杆菌门(Acidobacteriota)、放线菌门(Actinomycetota)、拟杆菌门(Bacteroidota)、芽单胞菌门(Gemmatimonadota)、疣微菌门(Verrucomicrobiota)、嗜热菌门(Thermoproteota)、浮霉菌门(Planctomycetota)、黏球菌门(Myxococcota)和绿弯菌门(Chloroflexota)。统计分析结果表明:前十大优势菌门中,仅绿弯菌门相对丰度显著受处理影响,表现为生草栽培模式下其丰度相较于除草剂控草处理显著提升。NMDS降维分析显示两种模式下的样本点分布无明显规律,且结合Adonis统计分析结果表明除草剂控草和生草栽培没有显著影响土壤微生物的β多样性(图 3B)。
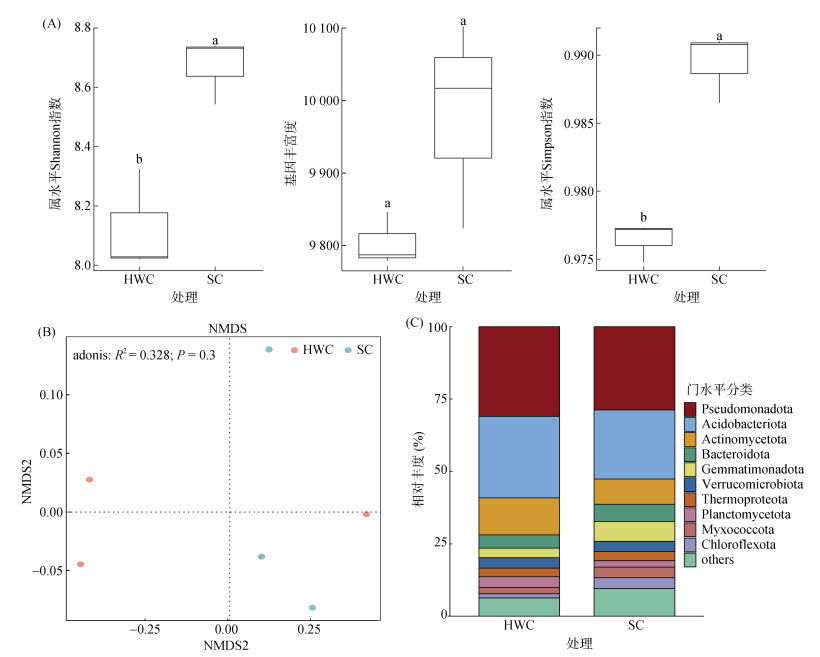
|
图 3 除草剂控草和生草栽培模式下土壤微生物构成与多样性 Fig. 3 Compositions and diversities of soil microorganisms under herbicide weed control and sod cultivation |
通过将测序结果与NCycDB数据库比对发现,总体上生草栽培和除草剂控草在氮循环的同化硝酸盐还原、异化硝酸盐还原的功能基因丰度无显著差异(图 4)。相较于除草剂控草,生草栽培模式下参与土壤反硝化过程的nirS、nosZ基因丰度以及参与土壤有机降解合成过程的gdh_K00262、gdh_K15371、glnA、gs_K00265基因丰度显著增加(图 4)。
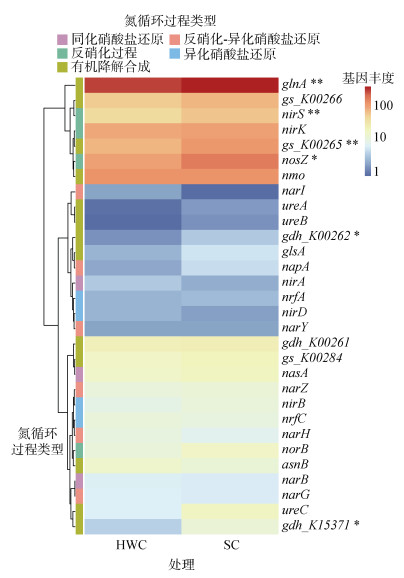
|
(*、**分别表示达P < 0.05和P < 0.01显著水平,下图同) 图 4 除草剂控草和生草栽培下土壤氮循环过程的功能基因丰度 Fig. 4 Functional gene abundance for soil nitrogen cycling under herbicide weed control and sod cultivation |
与PCycle数据库比对结果表明,两种处理显著影响了土壤微生物的磷循环过程,生草栽培的氧化磷酸化过程的ppk基因,磷酸戊糖途径的prsA基因,嘌呤代谢的purH、purL基因,嘧啶代谢的nrdJ、pyrG基因,运输过程的ugpC基因丰度显著高于除草剂控草处理(图 5)。
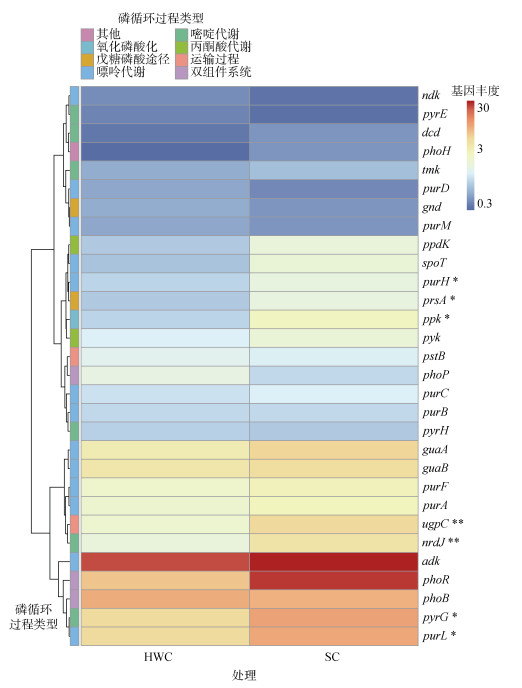
|
图 5 除草剂控草和生草栽培下土壤磷循环过程的功能基因丰度 Fig. 5 Functional gene abundance for soil phosphorus cycling under herbicide weed control and sod cultivation |
Pearson相关分析结果(图 6)表明,土壤碱解氮与速效钾为显著正相关关系;土壤磷酸酶活性与脲酶活性、蔗糖酶活性为显著正相关性关系;土壤脲酶和磷酸酶活性与土壤总有机碳、全氮、有效磷为显著正相关关系。通过Mantel-test分析土壤生化特征与土壤微生物氮、磷循环过程功能基因的关系,结果表明土壤有效磷含量、蔗糖酶活性和磷酸酶活性与土壤氮循环过程功能基因丰度显著相关;磷循环功能基因丰度与土壤蔗糖酶活性显著相关(图 6)。
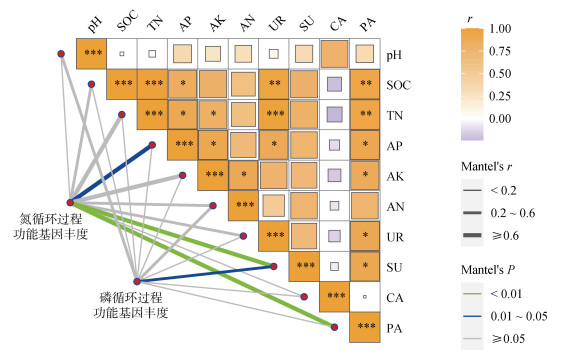
|
(*、**、***分别表示相关性达P < 0.05、P < 0.01和P < 0.001显著水平) 图 6 土壤特性对土壤微生物氮磷循环过程的影响 Fig. 6 Effects of soil properties on processes of soil microorganism nitrogen and phosphorus cycling |
生草栽培相较于除草剂控草显著提高了该柑橘园土壤有机碳和有效氮磷钾含量,表明生草栽培能够显著改善土壤养分可利用性。这与以往研究结果一致,如生草栽培增加了山核桃林[19]、油橄榄园[13]、柑橘园[20]的土壤速效养分含量。这种土壤速效养分含量的提升可能源于生草栽培下草本有机质的大量输入,促进了土壤有机质的矿化和养分循环过程。具体而言,本研究中生草栽培模式下干三叶草还田量是除草剂控草模式下杂草还田量的2.25倍。这些易分解的植物组织能够将固定的大量有机质和氮磷钾养分迅速归还土壤,从而显著增加土壤有效养分的含量[21]。此外,蒋光毅等[22]研究发现,柑橘园种植鸭茅草显著提升了土壤根系分布密度。生草栽培模式下较高的草本根系生物量可以通过根系分泌物、根系凋落物分解过程,进一步向土壤输入碳和养分[23-24]。除有机质和养分输入的差异外,相较于生草栽培,除草剂的使用本身会对土壤养分库产生不利影响。Zhang等[25]研究表明使用草甘膦降低了甘蔗园土壤硝化速率和相关功能基因丰度,从而降低土壤氮循环速率。
土壤养分循环过程离不开土壤酶的参与。生草栽培模式下土壤养分可利用性的提升,有助于解除土壤微生物的养分限制[26],促进微生物的繁殖和胞外酶的分泌,同时增加土壤中微生物残体碳组分积累。这不仅有助于土壤碳库的稳定,还对土壤养分转化具有重要意义[27]。本研究中,生草栽培显著提高了土壤脲酶、蔗糖酶、磷酸酶活性,而且土壤有效磷与磷酸酶、脲酶活性呈显著正相关关系,土壤速效钾与磷酸酶活性呈显著正相关关系。这些结果与以往研究结论一致,例如徐凌飞等[28]研究发现,生草栽培显著提高了梨园土壤磷酸酶、蔗糖酶、过氧化氢酶活性;焦润安等[13]和Yang等[29]分别发现,生草栽培显著提高了油橄榄园和柿园的土壤脲酶、磷酸酶和蔗糖酶活性。土壤脲酶、磷酸酶、蔗糖酶在土壤碳和养分循环中发挥着重要作用,胞外酶活性的提高往往有助于提高土壤中有效养分的含量[30]。
土壤胞外酶活性受土壤微生物的显著调控[31]。本研究结果表明,生草栽培相较于除草剂控草显著提高了土壤微生物多样性。沈玥等[2]研究表明,除草剂控草会导致柑橘园土壤微生物群落组成变化和根际微生物多样性的下降;而肖力婷等[32]研究发现,生草栽培显著提高了柑橘园土壤细菌群落的丰富度和真菌群落的多样性。除土壤微生物总体多样性增加外,本研究进一步发现相较于除草剂控草,生草栽培显著提高了土壤氮、磷循环过程中功能基因的丰度。具体而言,生草栽培下反硝化过程中nirS和nosZ基因丰度显著高于除草剂控草处理,表明生草栽培提高了土壤微生物将NO2-还原为NO和将N2O还原为N2的潜力[33]。这将有助于减少土壤中NO3-的积累,从而减少过量NO3-淋溶损失带来的面源污染等环境问题[34]。生草栽培显著提高了该柑橘园土壤有机氮代谢过程相关基因丰度(glnA、gdh),表明其增强了土壤中有机氮的利用能力[35]。在磷循环方面,相较于除草剂控草,生草栽培显著提高了该柑橘园土壤氧化磷酸化过程、嘌呤代谢、嘧啶代谢、运输过程等功能基因的丰度。这些结果表明,生草栽培改善了土壤微生物从环境中运输和吸收磷资源的能力,并增强了细胞内磷代谢过程[36]。本研究中土壤有效磷含量、蔗糖酶活性和磷酸酶活性与土壤氮循环过程功能基因丰度具有强关联,而磷循环功能基因丰度显著受土壤蔗糖酶活性的影响,这表明土壤碳、氮、磷循环之间存在复杂的耦合和调控关系[37]。土壤养分含量、酶活性、功能基因丰度之间的强相关性表明了生草栽培模式通过增加有机质向土壤的输入,同时避免除草剂对土壤生物的负面影响,正向调控了微生物群落组成、功能基因丰度和酶活性,促进了土壤的碳、氮、磷循环过程。然而,其内在的复杂调控机制还有待于进一步研究。
4 结论柑橘园生草栽培,相对于除草剂控草,具有更高的土壤有效氮、磷含量,土壤脲酶、磷酸酶活性,以及土壤微生物氮磷循环功能基因丰度。这表明生草栽培能有效正向调控土壤微生物群落来增强氮、磷养分循环中关键酶活性和功能基因丰度,进而促进土壤氮、磷养分可利用性;而且采用生草栽培有效降低了柑橘园对除草剂的依赖,这将有利于维持柑橘园的土壤健康。
| [1] |
唐开钊, 张君耀, 吴聪, 等. 不同坡位柑橘园土壤团聚体矿物结合态有机碳矿化特征[J]. 土壤学报, 2024, 61(6): 1639-1652 (  0) 0) |
| [2] |
沈玥, 宋放, 陈爽, 等. 喷施除草剂对橘园土壤及果实品质的影响[J]. 华中农业大学学报, 2022, 41(5): 98-107 (  0) 0) |
| [3] |
雷天虹, 王健, 吴彪, 等. 我国柑橘园杂草发生特点及防控研究进展[J]. 植物医学, 2024, 3(2): 1-8 (  0) 0) |
| [4] |
杨凤梅, 吉前华, 关晓银, 等. 柑橘果园杂草发生特点与防控措施综述[J]. 生物灾害科学, 2023, 46(2): 229-235 (  0) 0) |
| [5] |
闫洋洋, 王玉宽, 徐佩, 等. 三峡库区柑橘园杂草种类、分布及危害[J]. 草业科学, 2020, 37(11): 2309-2319 DOI:10.11829/j.issn.1001-0629.2020-0229 (  0) 0) |
| [6] |
王艳廷, 冀晓昊, 吴玉森, 等. 我国果园生草的研究进展[J]. 应用生态学报, 2015, 26(6): 1892-1900 (  0) 0) |
| [7] |
夏群, 刘宇松, 李诚勇, 等. 两种改良剂对酸化苹果园土壤环境及果树生长的影响[J]. 土壤, 2024, 56(1): 112-119 DOI:10.13758/j.cnki.tr.2024.01.015 (  0) 0) |
| [8] |
Man M L, Pierson D, Chiu R, et al. Twenty years of litter manipulation reveals that above-ground litter quantity and quality controls soil organic matter molecular composition[J]. Biogeochemistry, 2022, 159(3): 393-411 (  0) 0) |
| [9] |
Epp Schmidt D S, Cavigelli M A, Maul J E, et al. Components of N-fixation system response to glyphosate are un-coupled in agroecosystems[J]. Applied Soil Ecology, 2023, 188: 104859 (  0) 0) |
| [10] |
王耀锋, 邵玲玲, 刘玉学, 等. 桃园生草对土壤有机碳及活性碳库组分的影响[J]. 生态学报, 2014, 34(20): 6002-6010 (  0) 0) |
| [11] |
刘小勇, 任静, 张锐, 等. 核桃大豆间作土壤微生物生物量碳氮、氮素营养与酶活性特征[J]. 土壤, 2024, 56(5): 982-991 DOI:10.13758/j.cnki.tr.2024.05.008 (  0) 0) |
| [12] |
呼盼, 高晓东, 赵西宁, 等. 生草对果园生态系统服务功能的影响: 全球数据整合分析研究[J]. 中国生态农业学报(中英文), 2022, 30(8): 1238-1248 (  0) 0) |
| [13] |
焦润安, 焦健, 李朝周. 生草对油橄榄园土壤性质和油橄榄成花生理的影响[J]. 草业学报, 2018, 27(7): 133-144 (  0) 0) |
| [14] |
张承, 王秋萍, 周开拓, 等. 猕猴桃园套种吉祥草对土壤酶活性及果实产量、品质的影响[J]. 中国农业科学, 2018, 51(8): 1556-1567 (  0) 0) |
| [15] |
郭俏, 肖莉, 李进, 等. 绿肥介导的土壤代谢物-微生物变化缓解草莓自毒并增产提质[J]. 土壤学报, 2024, 61(3): 836-847 (  0) 0) |
| [16] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [17] |
关松荫. 土壤酶及其研究法[M].
农业出版社, 北京, 1986
(  0) 0) |
| [18] |
Xu Y W, Ge X G, Gao G, et al. Divergent contribution of microbial- and plant-derived carbon to soil organic carbon in Moso bamboo forests left unmanaged[J]. Catena, 2023, 233: 107481 (  0) 0) |
| [19] |
钱进芳, 吴家森, 黄坚钦. 生草栽培对山核桃林地土壤养分及微生物多样性的影响[J]. 生态学报, 2014, 34(15): 4324-4332 (  0) 0) |
| [20] |
李国怀, 伊华林. 生草栽培对柑橘园土壤水分与有效养分及果实产量、品质的影响[J]. 中国生态农业学报, 2005, 13(2): 161-163 (  0) 0) |
| [21] |
Chen X X, Song B Z, Yao Y C, et al. Aromatic plants play an important role in promoting soil biological activity related to nitrogen cycling in an orchard ecosystem[J]. Science of The Total Environment, 2014, 472: 939-946 (  0) 0) |
| [22] |
蒋光毅, 史东梅, 刘玉民, 等. 2种果草模式根系生态学特征研究[J]. 西南农业大学学报(自然科学版), 2004, 26(2): 128-131 (  0) 0) |
| [23] |
陈冠陶, 李顺, 彭天驰, 等. 根系隔离和氮添加对湿性常绿阔叶林土壤碳氮组分的影响[J]. 应用与环境生物学报, 2018, 24(1): 125-131 (  0) 0) |
| [24] |
吴玉森, 张艳敏, 冀晓昊, 等. 自然生草对黄河三角洲梨园土壤养分、酶活性及果实品质的影响[J]. 中国农业科学, 2013, 46(1): 99-108 (  0) 0) |
| [25] |
Zhang M Y, Wang W J, Tang L, et al. Effects of nitrification inhibitor and herbicides on nitrification, nitrite and nitrate consumptions and nitrous oxide emission in an Australian sugarcane soil[J]. Biology and Fertility of Soils, 2018, 54(6): 697-706 (  0) 0) |
| [26] |
Li S L, Cui Y X, Xia Z Q, et al. Microbial nutrient limitations limit carbon sequestration but promote nitrogen and phosphorus cycling: A case study in an agroecosystem with long-term straw return[J]. Science of The Total Environment, 2023, 870: 161865 (  0) 0) |
| [27] |
Kallenbach C M, Frey S D, Grandy A S. Direct evidence for microbial-derived soil organic matter formation and its ecophysiological controls[J]. Nature Communications, 2016, 7: 13630 (  0) 0) |
| [28] |
徐凌飞, 韩清芳, 吴中营, 等. 清耕和生草梨园土壤酶活性的空间变化[J]. 中国农业科学, 2010, 43(23): 4977-4982 (  0) 0) |
| [29] |
Yang X, Gong B C, Liu C Y, et al. Effects of long-term sod culture management on soil fertility, enzyme activities, soil microorganisms, and fruit yield and quality in "jiro" sweet persimmon orchard[J]. Plants, 2024, 13(11): 1573 (  0) 0) |
| [30] |
Bakshi M, Varma A. Soil eEnzyme: The state-of-art//Shukla G, Varma A. Soil enzymology[M]. Berlin, Heidelberg: Springer, 2010.
(  0) 0) |
| [31] |
Burns R G, DeForest J L, Marxsen J, et al. Soil enzymes in a changing environment: Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216-234 (  0) 0) |
| [32] |
肖力婷, 杨慧林, 黄文新, 等. 生草栽培对南丰蜜橘园土壤微生物群落结构与功能特征的影响[J]. 核农学报, 2022, 36(1): 190-200 (  0) 0) |
| [33] |
Kuypers M M M, Marchant H K, Kartal B. The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology, 2018, 16(5): 263-276 (  0) 0) |
| [34] |
Sebilo M, Mayer B, Nicolardot B, et al. Long-term fate of nitrate fertilizer in agricultural soils[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(45): 18185-18189 (  0) 0) |
| [35] |
Donhauser J, Qi W H, Bergk-Pinto B, et al. High temperatures enhance the microbial genetic potential to recycle C and N from necromass in high-mountain soils[J]. Global Change Biology, 2021, 27(7): 1365-1386 (  0) 0) |
| [36] |
Zeng J X, Tu Q C, Yu X L, et al. PCycDB: A comprehensive and accurate database for fast analysis of phosphorus cycling genes[J]. Microbiome, 2022, 10(1): 101 (  0) 0) |
| [37] |
Ochoa-Hueso R, Plaza C, Moreno-Jiménez E, et al. Soil element coupling is driven by ecological context and atomic mass[J]. Ecology Letters, 2021, 24(2): 319-326 (  0) 0) |
 2025, Vol. 57
2025, Vol. 57


