2. 中国科学院南京土壤研究所, 南京 211135;
4. 黑龙江省农业科学院草业研究所, 哈尔滨 150086;
4. 中国科学院大学南京学院, 南京 211135
覆盖作物是指主要作物在生长期或收获后,在时间上或空间上能够填充土壤裸露间隙的作物[1-2]。目前,已有大量研究指出,覆盖作物能通过向土壤直接输入有机碳源、促进土壤团聚体形成以及招募本土有益微生物等方式促进土壤有机碳的固存[3-8]。其中,豆科覆盖作物因其具有更高的微生物碳利用效率,在提升土壤有机碳含量效果上优于非豆科类覆盖作物[3, 9-12]。如Hu等[9]研究表明,豆科覆盖作物种植下土壤微生物生物量碳和轻组分有机碳的效应量分别提升37% 和29%,分别高于非豆科覆盖作物0.42倍和5.47倍。
土壤团聚体作为土壤结构的重要组成部分,其粒径分布及稳定性对土壤肥力有着重要影响[13-14]。覆盖作物可以通过改变土壤团聚体粒径组成改善土壤结构,提高土壤肥力[15-16],且不同覆盖作物类型对土壤团聚体不同粒级的占比影响不同。已有研究报道,覆盖作物–主作物轮作有利于土壤大团聚体的形成[17],例如,多毛紫云英与玉米轮作可以提高0.25 ~ 2 mm大团聚体的占比[18],其能显著增加水稳性团聚体的平均质量直径,从而提高土壤团聚体的稳定性[19-20];也有研究认为,覆盖作物可以通过增加微团聚体进一步保护与矿物结合的碳来提高土壤有机碳固存[21-22],比如,黑燕麦与玉米轮作可以显著提高 < 0.25 mm团聚体的占比[23]。
覆盖作物与玉米轮作能改变土壤细菌、真菌和丛枝菌根真菌等微生物的群落组成[15],这可能是由于覆盖作物残渣分解和根系分泌物为微生物生长提供了充足的养分来源[24-25]。已有不少研究报道,玉米与毛叶苕子轮作可以显著提高微生物数量[26];小麦–豇豆轮作能显著提高作物根际丛枝菌根真菌的数量[27],而丛枝菌根真菌菌丝体产生的球囊霉素相关蛋白等已被报道有利于促进土壤团聚体的形成[28]。
我国东北地区是世界三大黑土带之一。近年来,由于土地高强度利用、耕作方式不当以及土壤侵蚀加剧等因素,东北黑土地正面临黑土层变薄、有机质含量下降等问题[29]。种植覆盖作物是一种提高土壤有机碳的有效措施,但其固碳机制尚需深入研究。本研究以我国东北典型黑土区的5年长期田间试验为平台,探究不同覆盖作物品种与玉米轮作对土壤有机碳及其在不同粒级团聚体中分布的影响,并基于高通量测序分析细菌、真菌和丛枝菌根真菌群落组成的变化,从而明确不同粒级团聚体碳固存对土壤有机碳的贡献,并甄别与不同粒级团聚体碳固存有关的特定微生物物种。
1 材料与方法 1.1 长期试验设计田间试验始于2018年4月,试验地点为黑龙江省哈尔滨市道外区民主乡光明村(45°50′N,126°51′E),试验开始前该试验点常年进行玉米(Zea mays L.)连作。该地区位于松嫩平原中南部,属于寒温带季风气候,年平均气温5.4 ℃,≥10 ℃有效积温2 700 ℃以上,年平均光照2 641 ~ 2 732 h,年平均降水533 mm,年平均蒸发1 315 mm。土壤类型为发育自洪积黄土状黏土的黑土。试验开始前的土壤基本性质为pH 7.22,有机碳含量17.21 g/kg,全氮1.47 g/kg。
试验设置3个处理:玉米单作(CK)、黄花草木樨(Melilotus officinalis (L.) Pall.)–玉米轮作(F1)、绛三叶(Trifolium incarnatum L.)–玉米轮作(F2)。除CK处理外,其他两个处理均为第一年种植覆盖作物、第二年种植玉米进行轮作。作物均种植在垄上且两垄间距统一为65 cm,每条垄上玉米株距为20 cm。草木樨种植密度为37.5 kg/hm2,绛三叶种植密度为75 kg/hm2。每个处理设置3个重复,共有9个小区。小区随机分布,每个小区面积为16.25 m2(3.25 m×5 m)。每年作物收获后,其秸秆均利用粉碎机粉碎后还田。玉米季施肥采用当地常规施肥水平,N、P2O5、K2O施用量分别为150、75、75 kg/hm2,氮肥40% 作基肥、60% 在生育期两次追肥(拔节期和孕穗期),磷、钾肥全部作基肥。覆盖作物生长季不施肥。
1.2 样品采集与测定于2022年7月覆盖作物生物量最高时采集土壤样品,采用直径10 cm的土钻按“S”形采集0 ~ 20 cm土样5份,混匀后剔除杂质并均分成三等份,一部分风干用于土壤基本性质测定,一部分保存于–80 ℃用于提取土壤DNA并测定土壤微生物群落组成,剩余部分保存于–20 ℃用于测定土壤可溶性有机碳/氮(DOC/DON)。同时采集各小区0 ~ 20 cm原状土壤样品测定土壤团聚体组成。
土壤有机碳(SOC)、全氮(TN)采用重铬酸钾氧化法和凯氏定氮法测定[30],DOC、DON采用Jones和Willett[31]的方法测定。
1.3 团聚体分级方法土壤团聚体分级采用湿筛法[32],具体操作为:将一套孔径分别为2.0、0.25、0.053 mm的筛子自上而下小心置入团聚体分析仪,使水面没过套筛;称取50 g风干的原状土,平铺在2 mm筛子上,并浸泡10 min。设置团聚体分析仪振幅为3 cm,振频为30次/min,时间为5 min,最终筛得 > 2 mm、0.25 ~ 2 mm、0.053 ~ 0.25 mm、< 0.053 mm 4种不同粒级的土壤团聚体样品。进一步对筛得样品进行烘干称重以计算每级粒径团聚体的质量占比,同时测定不同粒径团聚体中有机碳的含量。
1.4 土壤DNA提取与高通量测序称取0.5 g鲜土,使用Fast DNA Spin Kit for Soil(MP Biomedicals,Santa Ana,CA,美国)试剂盒,依据说明书步骤从鲜土中提取DNA[33]。提取的DNA纯度和浓度用NanoDrop ND-1000分光光度计(ThermoFisher Scientific,Waltham,MA,美国)进行检测。使用特异性引物515F(5′- GTGCCAGCMGCC GCGGTAA-3′)/907R(5′-CCGTCAATTCMTTTRAGTTT-3′)、ITS5F(5′- GGAAGTAAAAGTCGTAACAAGG- 3 ′) /ITS1R (5′ - GCTGCGTTCTTCATCGATGC-3′)和AMV4.5NF(5′-AAGCTCGTAGTTGAATTTCG-3′) /A MDGR(5′-CCCAACTATCCCTATTAATCAT-3′)分别对细菌、真菌和丛枝菌根真菌进行PCR扩增。PCR扩增物利用Vazyme VAHTSTM DNA Clean Beads(Vazyme,中国)进行纯化,利用PicoGreen dsDNA Assay Kit(Invitrogen,Carlsbad,CA,美国)试剂盒进行定量。纯化后的产物等摩尔质量混合后使用Illumina MiSeq平台的MiSeq Reagent Kit v3测序仪进行测序(委托上海派森诺生物科技股份有限公司测定)。
高通量测序所得序列在QIIME2软件中采用以下步骤进行分析:使用demux对原始序列数据进行样本拆分,然后使用cutadapt (Martin,2011)切除引物序列,使用VSEARCH(Rognes,2016)插件对数据进行去噪、拼接,用UCHISE算法去除嵌合体,得到优质序列后使用UNOISE算法(cluster_unoise) (minsize=8)进行聚类,得到各样本特征序列(绝对序列变体,ASV)。最后基于Sliva、UNITE和MaarjAM分类学数据库分别对细菌、真菌和丛植菌根真菌ASV进行注释。
1.5 数据处理与分析通过SPSS软件,采用单因素方差分析(ANOVA)和Duncan多重比较分析不同处理间指标差异。使用R4.2.2软件的vegan包进行主坐标分析(Principal coordinate analysis,PCoA);使用置换多元方差分析(Permutational multivariate analysis of variance,PERMANOVA)判断不同处理间土壤细菌和真菌群落组成的差异。
筛选占总序列0.1% 以上的ASVs,利用R语言psych软件包计算细菌、真菌和丛枝菌根真菌物种之间的Spearman相关性矩阵,以P < 0.05为显著性水平、相关系数|r| > 0.7,构建共现网络。利用Gephi实现网络可视化,并进行模块化分析。
不同粒径团聚体有机碳占全土总有机碳比例(团聚体碳占比)、团聚体质量占比、平均质量直径(MWD)、几何平均直径(GMD)计算公式如下[34]:
| $ 团聚体质量占比\% = \frac{{{M_i}}}{{{M_{\rm{t}}}}} \times 100 $ | (1) |
| $ 团聚体碳占比{\%}=\frac{{C}_{i}\times {M}_{i}}{{C}_{\text{t}}\times {M}_{\text{t}}}\times 100 $ | (2) |
| $ \mathrm{MWD}=\sum \frac{X_i \times M_i}{M_t} $ | (3) |
| $ \mathrm{GMD}=\exp \left[\sum\limits_{i=1}^n W_i \times \ln X_i\right] $ | (4) |
上述公式中:Mi为每级团聚体的质量(g),Mt为土壤总质量(g),Ci为每级团聚体中有机碳含量(g/kg),Ct为全土有机碳含量(g/kg),Xi为每级团聚体的平均直径(mm),Wi为每级团聚体的质量占土壤总质量的比例。
2 结果 2.1 土壤总有机碳氮和可溶性有机碳氮与常规种植(CK)相比,长期轮作(F1、F2)处理均显著提升了土壤总有机碳和全氮含量(P < 0.05,表 1),而两个轮作处理之间无显著差异,其中土壤总有机碳提升约28.9%,全氮提升约42.4%。两个轮作处理对土壤可溶性有机碳含量无显著影响,但F1处理显著增加可溶性有机氮含量,与CK相比增幅约70%。
|
|
表 1 玉米与不同覆盖作物长期轮作对土壤总有机碳氮和可溶性有机碳氮含量的影响 Table 1 Effects of long-term maize rotation with different cover crops on soil total organic carbon, organic nitrogen, dissolved organic carbon, and dissolved organic nitrogen |
比较玉米与不同覆盖作物长期轮作对团聚体分布的影响发现(图 1A),与CK相比,F1处理显著增加了 > 2 mm和0.25 ~ 2 mm粒级大团聚体质量占比,分别增加58.6% 和91.5%;同时显著降低了0.053 ~ 0.25 mm粒径质量占比,降幅约45.2%,对 < 0.053 mm的粉黏粒占比无显著影响。而F2处理主要表现为0.25 ~ 2 mm粒级大团聚体和 < 0.053 mm粉黏粒质量占比的显著增加,增幅分别为34.4% 和176%;同时0.053 ~ 0.25 mm粒级团聚体质量占比显著降低约49.7%,而 > 2 mm粒级团聚体质量占比影响不显著。
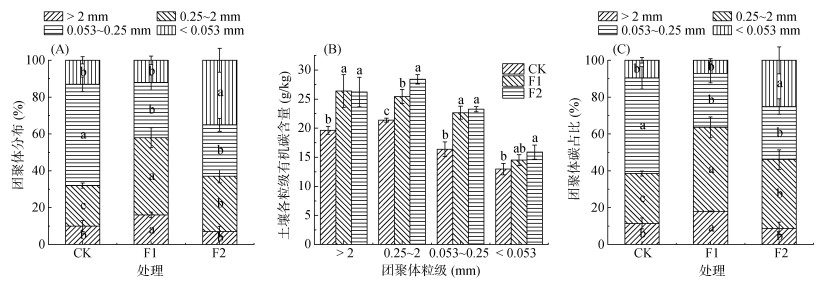
|
(柱状图上的误差线为标准误,不同小写字母表示相同粒级不同处理间的差异显著(P < 0.05),下图同) 图 1 玉米与不同覆盖作物长期轮作对团聚体各粒级质量比例(A)、有机碳含量(B)、团聚体碳占比(C)的影响 Fig. 1 Effects of long-term maize rotation with different cover crops on aggregate mass proportion (A), organic carbon content (B), and aggregate carbon proportion (C) in each size aggregates |
与CK相比,F1和F2处理的 > 2 mm、0.25 ~ 2 mm及0.053 ~ 0.25 mm 3个粒级团聚体中有机碳的含量均有显著提升,提升幅度为18.9% ~ 40.5%,而 < 0.053 mm粒级的有机碳含量仅F2处理较CK处理显著提升约22.5%(图 1B)。不同粒级团聚体碳占比结果显示(图 1C),与CK相比,F1处理 > 2 mm和0.25 ~ 2 mm粒级的碳占比均显著升高,分别由CK处理的11.4% 和27.1% 提升至18.0% 和45.6%,0.053 ~ 0.25 mm粒级碳占比显著降低,< 0.053 mm粒级碳占比与CK无显著差异;对F2处理,0.25 ~ 2 mm和 < 0.053 mm粒级碳占比均显著提升,分别由CK处理的27.1% 和9.5% 提升至37.4% 和25.1%,而0.053 ~ 0.25 mm粒级碳占比则显著低于CK,> 2 mm粒级碳占比与CK无显著差异。由此可知,尽管F1和F2处理的土壤总有机碳含量相近并显著高于CK(表 1),但它们的显著增加来自不同粒级团聚体碳的贡献,其中F1处理主要来自 > 2 mm和0.25 ~ 2 mm粒级碳占比的增加;而F2处理主要来自0.25 ~ 2 mm和 < 0.053 mm粒级碳占比的增加,上述粒径团聚体碳占比的增加主要源自团聚体质量占比和团聚体有机碳含量共同显著增加所致(图 1)。
团聚体平均重量直径(MWD)和几何平均直径(GMD)在不同处理间的变化趋势基本一致(图 2),与CK相比,F1处理MWD和GMD显著增加,增幅分别为57.7% 和31.8%,而F2处理的MWD和GMD均与CK无显著差异。
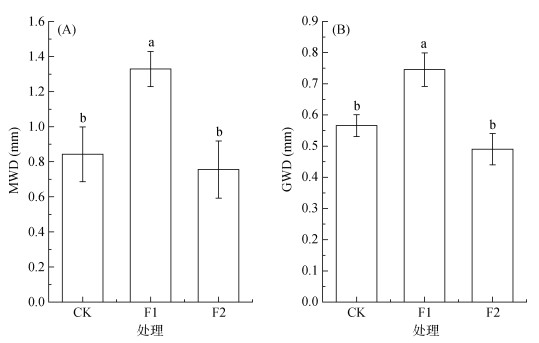
|
图 2 玉米与不同覆盖作物长期轮作对土壤团聚体平均重量直径(MWD)和几何平均直径(GMD)的影响 Fig. 2 Effects of long-term maize rotation with different cover crops on mean weight diameter (MWD) and geometric mean diameter (GMD) of soil aggregates |
对各处理的细菌、真菌和丛枝菌根真菌群落组成进行PCoA分析(图 3),同时进行置换多元方差分析(PERMANOVA,表 2),结果表明,3个处理的细菌、真菌和丛枝菌根真菌群落均两两差异显著(P < 0.05)。
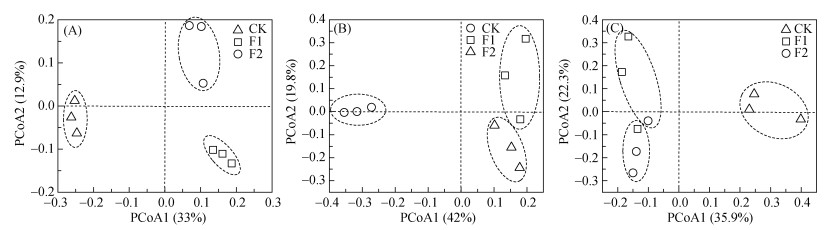
|
图 3 玉米与不同覆盖作物长期轮作下土壤细菌(A)、真菌(B)、丛枝菌根真菌群落(C)主坐标分析(PCoA) Fig. 3 Principal coordinate analysis (PCoA) of soil bacterial (A), fungal (B) and arbuscular mycorrhizal fungal (C) communities under long-term maize rotation with different cover crops |
|
|
表 2 置换多元方差分析明确不同处理之间微生物群落差异显著性 Table 2 Difference significances of microbial community compositions between different treatments based on PERMANOVA analysis |
利用Simper分析明确不同处理细菌、真菌和丛枝菌根真菌群落差异的主导物种(表 3)。结果发现,3个处理细菌群落之间的差异主要由芽球菌属(Blastococcus sp.)、吡啶单胞菌科(Pyrinomonadaceae)、微球菌科(Micrococcaceae)、盖勒氏菌目(Gaiellales)和棒状杆菌属(Rokubacteriales sp.)主导,其中Blastococcus sp.、Pyrinomonadaceae和Gaiellales在F1和F2处理中的相对丰度均显著高于CK,Micrococcaceae的相对丰度表现为CK > F2 > F1,Rokubacteriales sp.相对丰度表现为F1 > F2;真菌群落变化主要由淡紫拟青霉属(Purpureocillium sp.)、巨枝膝梗孢属(Gonytrichum sp.)、Retroconis sp.、木霉属(Trichoderma sp.)和节菱孢霉菌属(Arthrinium sp.)主导,其中Purpureocillium sp.、Gonytrichum sp.和Retroconis sp的相对丰度在各处理间呈CK > F1≈F2的变化规律,Trichoderma sp.的相对丰度表现为F1 > CK,Arthrinium sp.的相对丰度表现为F2 > F1;此外,丛枝菌根真菌群落变化主要由类球囊霉属(Paraglomus sp.)、球囊霉属(Glomus sp.)、球囊菌门(Glomeromycota)、球囊霉目(Glomerales)和球囊菌纲(Glomeromycetes)主导,其中Paraglomus sp.的相对丰度大小为F2 > CK > F1,Glomus sp.的相对丰度大小为CK > F1≥F2,而Glomeromycota、Glomerales和Glomeromycetes的相对丰度都表现为F1 > F2≥CK。
|
|
表 3 基于Simper分析明确不同处理之间细菌、真菌、丛枝菌根真菌群落差异的前5个最为关键主导微生物 Table 3 Top five most influential species for differences in bacterial, fungal, and AMF communities among different treatments based on Simper analysis |
通过Spearman相关关系构建3个处理的细菌、真菌和丛枝菌根真菌共现网络(图 4)。网络共包含286个节点和709个边,59.8% 为正相关关系,40.2% 为负相关关系,网络共甄别出4个主要模块(图 4A)。分析各模块不同处理间相对丰度变化发现(图 4B),模块1主要表现为覆盖作物与玉米轮作显著降低其丰度,其中相对丰度CK > F1 > F2;模块2和模块3中,覆盖作物与玉米轮作会显著提高丰度,表现为F1 > F2 > CK;模块4中,覆盖作物与玉米轮作会显著降低丰度,主要表现为CK > F2 > F1。
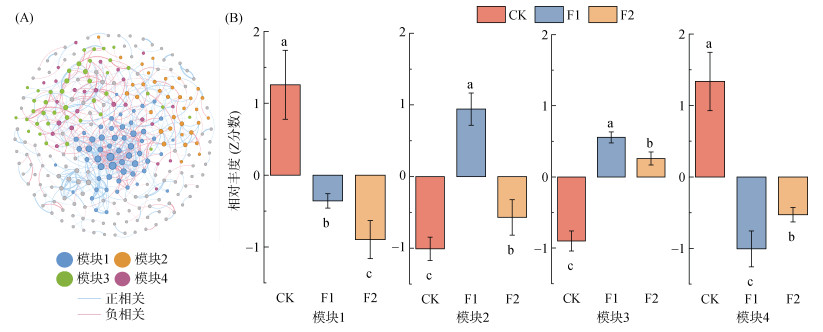
|
图 4 细菌–真菌–丛枝菌根真菌共现网络(A)及各模块相对丰度(B) Fig. 4 Co-occurrence network of soil bacterial, fungal and AMF (A), and relative abundance of four modules (B) |
各粒级团聚体碳占比与网络模块之间的相关性分析发现(表 4),> 2 mm粒级碳占比主要与模块2相对丰度呈显著正相关;0.25 ~ 2 mm粒级碳占比与模块2相对丰度呈显著正相关,与模块1和4呈显著负相关;0.053 ~ 0.25 mm粒级碳占比与模块1和4相对丰度呈显著正相关;< 0.053 mm粒级碳占比与模块1相对丰度呈显著负相关。因此,模块1、2、4被认为是决定团聚体碳占比的关键模块。
|
|
表 4 各粒级团聚体碳占比与不同模块的相关性分析 Table 4 Correlation analysis between SOC proportions of four size aggregates and relative abundance of different modules |
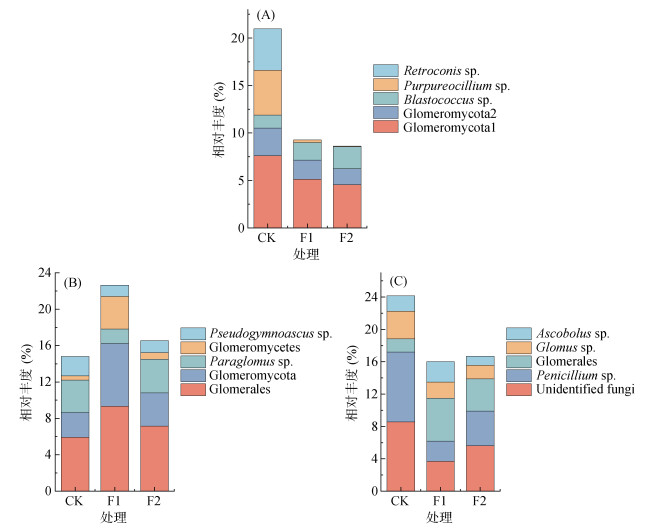
分析各关键模块内主导不同处理间相对丰度差异的微生物物种发现(图 5),模块1中不同处理间相对丰度差异主要与Glomeromycota、Blastococcus sp.、Purpureocillium sp.和Retroconis sp.等物种丰度变化有关;模块2不同处理间相对丰度差异主要与Glomerales、Glomeromycota、Paraglomus sp.、Glomeromycetes和假裸囊菌属(Pseudogymnoascus sp.)等物种丰度变化有关;模块4不同处理间相对丰度差异主要与青霉菌属(Penicillium sp.)、Glomerales、Glomus sp.和粪盘菌属(Ascobolus sp.)等物种丰度变化有关。上述11个(包括1个细菌、5个真菌、5个丛枝菌根真菌)物种被认为是决定团聚体碳占比的关键物种。
|
图 5 模块1(A)、模块2(B)和模块4(C)中主导处理间差异的微生物物种 Fig. 5 Dominant genera in module 1 (A), 2 (B) and 4 (C) |
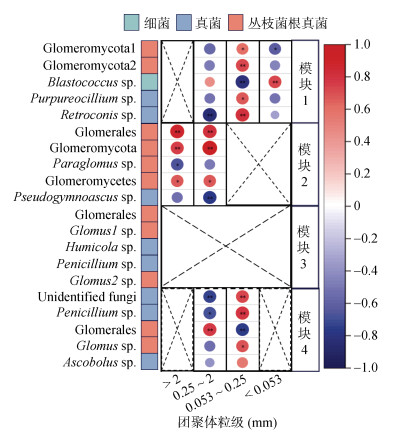
分析上述11个关键物种与各粒级团聚体碳占比之间的相关性发现(图 6),> 2 mm粒级碳占比与Glomerales、Glomeromycota和Glomeromycetes显著正相关,与Paraglomus sp. 显著负相关;0.25 ~ 2 mm粒级碳占比与Glomerales、Glomeromycota和Glomeromycetes显著正相关,同时与Retroconis sp.、Penicillium sp.和Pseudogymnoascus sp.显著负相关;0.053 ~ 0.25 mm粒级碳占比与Retroconis sp.、Penicillium sp.、Purpureocillium sp.、Glomeromycota、和Glomus sp.显著正相关,与Blastococcus sp.显著负相关;< 0.053 mm粒级碳占比与Blastococcus sp.显著正相关,与Glomeromycota显著负相关。
|
(*、**分别表示相关性达P < 0.05和P < 0.01显著水平) 图 6 关键物种与不同粒级团聚体碳占比之间的相关性 Fig. 6 Correlations between keystone microorganism species and SOC proportions in four size aggregates |
本研究结果显示黄花草木樨和绛三叶与玉米轮作均同等程度提升黑土总有机碳含量约28.9%,提升全氮含量约42.4%(表 1)。Jian等[6]通过Meta统计分析全球131种覆盖作物引入农田生态系统的研究,发现覆盖作物能显著提高土壤有机碳含量,提升幅度约15.5%。黄花草木樨和绛三叶作为两种典型的豆科植物能通过固氮功能有效提高土壤的氮素水平,这与前人的研究结果一致[35]。覆盖作物引入农田后对可溶性有机碳和可溶性有机氮的影响不尽相同,有研究表明,紫花苜宿和大豆引入轮作体系后,可溶性有机碳和可溶性有机氮都没有显著变化[36],也有研究表明可溶性有机碳受覆盖作物类型显著影响,白三叶草可以提高土壤可溶性有机碳含量[37],绛三叶在生长期可以提高可溶性有机氮的浓度[38]。
研究结果进一步表明黄花草木樨与玉米轮作(F1处理)能显著促进 > 2 mm和0.25 ~ 2 mm大团聚体的形成,分别提高约58.6% 和91.5%,从而团聚体平均重量直径和几何平均直径显著提高约57.7% 和31.8%;而绛三叶与玉米轮作(F2处理)虽然0.25 ~ 2 mm大团聚体含量也增加约34.4%,但团聚体变化主要表现为0.053 ~ 0.25 mm微团聚体占比下降约49.7%,< 0.053 mm粉黏粒增加约176%,而对土壤团聚体稳定性指数的影响不显著(图 1、图 2)。这可能是由于黄花草木樨作为外源有机碳源引入农田生态系统后能激发土壤中的微生物活性,而微生物在进行生命活动时会产生多糖充当黏合剂,将土壤小颗粒黏结成大团聚体[39],并且黄花草木樨也被报道具有促进较小粒径微团聚体向较大粒径微团聚体聚集的功能,而且随着种植时间的增加,改土效果越显著[40]。而绛三叶直根发达[41],其直根穿插能力强,能扎入土壤深层破坏土壤结构并加剧团聚体破碎[42],可能导致粉黏粒增多。此外,研究发现覆盖作物种植增加团聚体所有粒级中有机碳含量,并在 > 2 mm、0.25 ~ 2 mm和0.053 ~ 0.25 mm粒径中达到显著水平,其中F1处理分别提升约34.4%、18.9% 和38.5%,F2处理分别提升约33.6%、32.8% 和42.2%(图 1)。这可能是由于作物残茬是维持农业土壤有机碳和养分的主要输入来源,覆盖作物由于根系发达,引入农田生态系统可以生产更多的生物量,为土壤输入了更多的外源碳,其被微生物分解后固存在各级团聚体中[43]。
3.2 覆盖作物与玉米轮作对黑土细菌、真菌、丛枝菌根真菌群落的影响覆盖作物引入玉米种植生态系统显著改变了土壤细菌、真菌和丛枝菌根真菌的群落组成,且各微生物群落组成在不同处理之间两两差异显著(表 2、图 3),这与Muhammad等人[44]的研究结果相一致。利用Simper方法进一步分析影响群落变化的物种发现,与CK处理相比,覆盖作物种植处理组的细菌群落的变化主要与Pyrinomonadaceae、Blastococcus sp.、Micrococcaceae和Gaiellales丰度的提升有关(表 3)。Pyrinomonadaceae被报道可以参与水解复杂的聚合物[45];Blastococcus sp.是一种碳降解菌[46],其丰度升高可能是由于覆盖作物引入后提供了更多的新鲜植物残体,促进这些与碳降解功能相关的微生物快速生长繁殖。Micrococcaceae被认为是豆科植物残体的第一批降解物[47],其丰度升高可能是由于覆盖作物投入改善了生长所需的养分条件所致。有研究认为苜蓿作为豆科覆盖作物能显著提高Gaiellales的丰度[48],黄花草木樨和绛三叶同为豆科覆盖作物可能会提高Gaiellales的丰度。对于真菌群落,F1处理中Trichoderma sp.的相对丰度相对于CK处理显著提高(表 3),而F1和F2处理均显著降低了Purpureocillium sp.、Gonytrichum sp.和Retroconis sp.的相对丰度。其中Trichoderma sp.被报道能保护植物并控制病原体种群[49];有研究发现Purpureocillium sp.丰度会随着施氮量的增加而降低[50],表明豆科覆盖作物因固氮功能促进的土壤氮素水平提高可能不利于Purpureocillium sp.的生长。而在丛枝菌根群落中,F1处理显著降低了Paraglomus sp.的相对丰度,F2处理则显著提高了Paraglomus sp.的相对丰度(表 3)。作为土壤中常见的一种丛植菌根真菌,有关Paraglomus sp.丰度变化对作物种植响应的报道不尽相同。Zhang等[51]研究发现,混合种植覆盖作物可以提高Paraglomus sp.的丰度;而Luo等[52]认为在玉米–小麦轮作中,Paraglomus sp.的丰度会在收获期的玉米底土层上升。此外,本研究发现Glomerales、Glomeromycetes、Glomeromycota的相对丰度均在覆盖作物引入后显著提升(表 3),其中Glomerales目归属于Glomeromycetes纲,而Glomeromycetes纲的物种丰度已被报道与土壤有机碳显著正相关[53],说明这些物种丰度的上升可能与覆盖作物向土壤输入有机碳源有关。
3.3 不同覆盖作物提升土壤总有机碳的微生物机制本研究结果表示,F1处理土壤总有机碳的显著增加主要来自 > 2 mm和0.25 ~ 2 mm粒级碳占比的增加(图 1),它们主要与Glomerales、Glomeromycota、Glomeromycetes中未分类的物种显著正相关(图 6),并且它们是决定不同处理间丛枝菌根真菌群落差异的主要物种,其均在F1处理中显著富集(表 3),表明F1处理土壤总有机碳的显著增加主要通过招募该3个物种来实现;另外,> 2 mm和0.25 ~ 2 mm粒级碳占比的增加主要源自团聚体质量占比和团聚体有机碳含量共同显著增加所致(图 1),进一步说明F1处理土壤总有机碳的显著增加主要通过招募Glomerales、Glomeromycota、Glomeromycetes增加 > 2 mm和0.25 ~ 2 mm粒级大团聚体形成及增加其中碳固存来实现。Glomerales(目水平)和Glomeromycetes(纲水平)都属于Glomeromycota菌门。已有大量研究表明Glomeromycota的诸多物种能在促进土壤大团聚体形成、助力土壤固碳和提高团聚体稳定性上发挥至关重要的作用,这可能是由于:①作为丛植菌根真菌,Glomeromycota的菌丝能影响碳的稳定性[54-55],其能黏结土壤中细小的颗粒形成团聚体[56];②Glomeromycota能分泌球囊霉素相关土壤蛋白,该蛋白在促进大团聚体形成上发挥着极为重要的作用。因此,本文认为F1处理下Glomeromycota门物种丰度上升,可能会通过分泌球囊霉素等土壤蛋白提高大团聚体的占比,增加碳的稳定性,也可能通过菌丝连接等物理作用,提高了 > 2 mm和0.25 ~ 2 mm粒级有机碳含量,最终提高了土壤总有机碳。
而F2处理土壤总有机碳的显著增加主要来自0.25 ~ 2 mm和 < 0.053 mm粒级碳占比的增加(图 1),其中0.25 ~ 2 mm粒级碳占比主要与Glomerales正相关,< 0.053 mm粒级碳占比与Glomeromycota显著负相关(图 6);而在F2处理中只有Glomerales富集,Glomeromycota丰度则降低,Glomeromycetes丰度与CK无显著差异(表 3、图 5)。这表明F2处理土壤总有机碳的显著增加可能是通过招募Glomerales和抑制Glomeromycota来实现。Glomerales和Glomeromycota都能促进团聚体形成以及有机碳的增加[54-56],而Glomeromycota丰度的降低可能会减弱促进土壤颗粒黏结成团的效果,进而导致部分土壤团聚体更容易破碎形成粉黏粒,使 < 0.053 mm粒级质量占比增加,最终表现出该粒级团聚体碳占比提高。上述结果表明不同覆盖作物与玉米轮作提升黑土有机碳主要通过刺激特定丛枝菌根真菌物种驱动不同粒级团聚体形成并增加其中碳固存所致。
4 结论通过我国东北典型黑土5年的田间试验发现黄花草木樨或绛三叶与玉米轮作均可以同等程度显著提升土壤总有机碳含量。黄花草木樨与玉米轮作激发土壤Glomerales、Glomeromycota和Glomeromycetes等丛枝菌根真菌物种的生长繁殖,它们共同驱动 > 2 mm和0.25 ~ 2 mm粒级大团聚体形成并增加其中碳含量促进土壤有机碳的固存。而绛三叶与玉米轮作提升Glomerales的丰度,其驱动0.25 ~ 2 mm粒级大团聚体形成并增加其中有机碳的富集促进土壤总有机碳含量的增加;同时抑制Glomeromycota物种的生长,导致团聚体的破碎、< 0.053 mm粉黏粒占比的增加。相比绛三叶,黄花草木樨与玉米轮作可以显著提高土壤团聚体的稳定性,使有机碳在大团聚体中稳定固存以提升土壤总有机碳含量。本研究结果为黑土培肥选择适宜的覆盖作物品种提供了一定理论基础。
| [1] |
Bugg R L, McGourty G, Sarrantonio M, et al. Comparison of 32 cover crops in an organic vineyard on the north coast of California[J]. Biological Agriculture & Horticulture, 1996, 13(1): 63-81 (  0) 0) |
| [2] |
隋鑫, 霍海南, 鲍雪莲, 等. 覆盖作物的种植现状及其对下茬作物生长和土壤环境影响的研究进展[J]. 应用生态学报, 2021, 32(8): 2666-2674 (  0) 0) |
| [3] |
Zhang Z L, Kaye J P, Bradley B A, et al. Cover crop functional types differentially alter the content and composition of soil organic carbon in particulate and mineral-associated fractions[J]. Global Change Biology, 2022, 28(19): 5831-5848 DOI:10.1111/gcb.16296 (  0) 0) |
| [4] |
Bai X X, Huang Y W, Ren W, et al. Responses of soil carbon sequestration to climate-smart agriculture practices: A meta-analysis[J]. Global Change Biology, 2019, 25(8): 2591-2606 DOI:10.1111/gcb.14658 (  0) 0) |
| [5] |
Crystal-Ornelas R, Thapa R, Tully K L. Soil organic carbon is affected by organic amendments, conservation tillage, and cover cropping in organic farming systems: A meta-analysis[J]. Agriculture, Ecosystems & Environment, 2021, 312: 107356 (  0) 0) |
| [6] |
Jian J S, Du X, Reiter M S, et al. A meta-analysis of global cropland soil carbon changes due to cover cropping[J]. Soil Biology and Biochemistry, 2020, 143: 107735 DOI:10.1016/j.soilbio.2020.107735 (  0) 0) |
| [7] |
McClelland S C, Paustian K, Schipanski M E. Management of cover crops in temperate climates influences soil organic carbon stocks: A meta-analysis[J]. Ecological Applications, 2021, 31(3): e02278 DOI:10.1002/eap.2278 (  0) 0) |
| [8] |
Vendig I, Guzman A, De La Cerda G, et al. Quantifying direct yield benefits of soil carbon increases from cover cropping[J]. Nature Sustainability, 2023, 6(9): 1125-1134 DOI:10.1038/s41893-023-01131-7 (  0) 0) |
| [9] |
Hu Q J, Thomas B W, Powlson D, et al. Soil organic carbon fractions in response to soil, environmental and agronomic factors under cover cropping systems: A global meta-analysis[J]. Agriculture, Ecosystems & Environment, 2023, 355: 108591 (  0) 0) |
| [10] |
Ladoni M, Basir A, Robertson P G, et al. Scaling-up: Cover crops differentially influence soil carbon in agricultural fields with diverse topography[J]. Agriculture, Ecosystems & Environment, 2016, 225: 93-103 (  0) 0) |
| [11] |
Jia B, Jia L, Zhang Y M, et al. Leguminous Caragana korshinskii evidently enhances microbial necromass carbon accumulation in dryland soils[J]. Catena, 2022, 215: 106342 DOI:10.1016/j.catena.2022.106342 (  0) 0) |
| [12] |
Kallenbach C M, Grandy A S, Frey S D, et al. Microbial physiology and necromass regulate agricultural soil carbon accumulation[J]. Soil Biology and Biochemistry, 2015, 91: 279-290 DOI:10.1016/j.soilbio.2015.09.005 (  0) 0) |
| [13] |
Pang J W, Wang Y H, Wang B F, et al. Biochar application increases maize yield under film mulching due to higher soil organic content and soil aggregate stability in a semi-arid area[J]. Journal of Soils and Sediments, 2023, 23(4): 1718-1732 DOI:10.1007/s11368-023-03444-8 (  0) 0) |
| [14] |
Cooper J, Greenberg I, Ludwig B, et al. Effect of biochar and compost on soil properties and organic matter in aggregate size fractions under field conditions[J]. Agriculture, Ecosystems & Environment, 2020, 295: 106882 (  0) 0) |
| [15] |
Hontoria C, García-González I, Quemada M, et al. The cover crop determines the AMF community composition in soil and in roots of maize after a ten-year continuous crop rotation[J]. Science of The Total Environment, 2019, 660: 913-922 DOI:10.1016/j.scitotenv.2019.01.095 (  0) 0) |
| [16] |
García-González I, Quemada M, Gabriel J L, et al. Legacy of eight-year cover cropping on mycorrhizae, soil, and plants[J]. Journal of Plant Nutrition and Soil Science, 2018, 181(6): 818-826 DOI:10.1002/jpln.201700591 (  0) 0) |
| [17] |
Ali W, Hussain S, Chen J Z, et al. Cover crop root-derived organic carbon influences aggregate stability through soil internal forces in a clayey red soil[J]. Geoderma, 2023, 429: 116271 DOI:10.1016/j.geoderma.2022.116271 (  0) 0) |
| [18] |
Bansal S, Yin X H, Sykes V, et al. Soil aggregate- associated organic carbon and nitrogen response to long- term no-till crop rotation, cover crop, and manure application[J]. Soil Science Society of America Journal, 2021, 85(6): 2169-2184 DOI:10.1002/saj2.20329 (  0) 0) |
| [19] |
Xiao L, Yao K H, Li P, et al. Increased soil aggregate stability is strongly correlated with root and soil properties along a gradient of secondary succession on the Loess Plateau[J]. Ecological Engineering, 2020, 143: 105671 DOI:10.1016/j.ecoleng.2019.105671 (  0) 0) |
| [20] |
Vannoppen W, De Baets S, Keeble J, et al. How do root and soil characteristics affect the erosion-reducing potential of plant species?[J]. Ecological Engineering, 2017, 109: 186-195 DOI:10.1016/j.ecoleng.2017.08.001 (  0) 0) |
| [21] |
Zhu S Q, Sainju U M, Zhang S H, et al. Cover cropping promotes soil carbon sequestration by enhancing microaggregate-protected and mineral-associated carbon[J]. Science of The Total Environment, 2024, 908: 168330 DOI:10.1016/j.scitotenv.2023.168330 (  0) 0) |
| [22] |
Veloso M G, Cecagno D, Bayer C. Legume cover crops under no-tillage favor organomineral association in microaggregates and soil C accumulation[J]. Soil and Tillage Research, 2019, 190: 139-146 DOI:10.1016/j.still.2019.03.003 (  0) 0) |
| [23] |
Conceição P C, Dieckow J, Bayer C. Combined role of no-tillage and cropping systems in soil carbon stocks and stabilization[J]. Soil and Tillage Research, 2013, 129: 40-47 DOI:10.1016/j.still.2013.01.006 (  0) 0) |
| [24] |
Zheng W, Zhao Z Y, Gong Q L, et al. Effects of cover crop in an apple orchard on microbial community composition, networks, and potential genes involved with degradation of crop residues in soil[J]. Biology and Fertility of Soils, 2018, 54(6): 743-759 DOI:10.1007/s00374-018-1298-1 (  0) 0) |
| [25] |
Zheng W, Zhao Z Y, Gong Q L, et al. Responses of fungal–bacterial community and network to organic inputs vary among different spatial habitats in soil[J]. Soil Biology and Biochemistry, 2018, 125: 54-63 DOI:10.1016/j.soilbio.2018.06.029 (  0) 0) |
| [26] |
赵秋, 高贤彪, 宁晓光, 等. 华北地区春玉米–冬绿肥轮作对碳、氮蓄积和土壤养分以及微生物的影响[J]. 植物营养与肥料学报, 2013, 19(4): 1005-1011 (  0) 0) |
| [27] |
Somenahally A, DuPont J I, Brady J, et al. Microbial communities in soil profile are more responsive to legacy effects of wheat-cover crop rotations than tillage systems[J]. Soil Biology and Biochemistry, 2018, 123: 126-135 DOI:10.1016/j.soilbio.2018.04.025 (  0) 0) |
| [28] |
Zhang J, Ekblad A, Sigurdsson B D, et al. The influence of soil warming on organic carbon sequestration of arbuscular mycorrhizal fungi in a sub-Arctic grassland[J]. Soil Biology and Biochemistry, 2020, 147: 107826 DOI:10.1016/j.soilbio.2020.107826 (  0) 0) |
| [29] |
邹文秀, 韩晓增, 陆欣春, 等. 肥沃耕层构建对东北黑土区旱地土壤肥力和玉米产量的影响[J]. 应用生态学报, 2020, 31(12): 4134-4146 (  0) 0) |
| [30] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科学技术出版社, 北京, 2000
(  0) 0) |
| [31] |
Jones D L, Willett V B. Experimental evaluation of methods to quantify dissolved organic nitrogen (DON) and dissolved organic carbon (DOC) in soil[J]. Soil Biology and Biochemistry, 2006, 38(5): 991-999 DOI:10.1016/j.soilbio.2005.08.012 (  0) 0) |
| [32] |
苗淑杰, 周连仁, 乔云发, 等. 长期施肥对黑土有机碳矿化和团聚体碳分布的影响[J]. 土壤学报, 2009, 46(6): 1068-1075 DOI:10.3321/j.issn:0564-3929.2009.06.014 (  0) 0) |
| [33] |
郭伟, 周云鹏, 陈美淇, 等. 长期不同氮肥施用量对潮土团聚体分布和真菌群落组成的影响[J]. 土壤学报, 2024, 61(3): 824-835 (  0) 0) |
| [34] |
高会议, 郭胜利, 刘文兆, 等. 不同施肥处理对黑垆土各粒级团聚体中有机碳含量分布的影响[J]. 土壤学报, 2010, 47(5): 931-938 (  0) 0) |
| [35] |
Li X F, Wang Z G, Bao X G, et al. Long-term increased grain yield and soil fertility from intercropping[J]. Nature Sustainability, 2021, 4(11): 943-950 DOI:10.1038/s41893-021-00767-7 (  0) 0) |
| [36] |
Strickland M S, Thomason W E, Avera B, et al. Short-term effects of cover crops on soil microbial characteristics and biogeochemical processes across actively managed farms[J]. Agrosystems, Geosciences & Environment, 2019, 2(1): 180064 (  0) 0) |
| [37] |
Li X F, Tan A, Chen K, et al. Effect of cover crop type and application rate on soil nitrogen mineralization and availability in organic rice production[J]. Sustainability, 2021, 13(5): 2866 DOI:10.3390/su13052866 (  0) 0) |
| [38] |
Curtright A J, Renner K A, Tiemann L K. Availability of dissolved organic carbon drives differences in microbial nitrogen-cycling processes between two sites with cover crops interseeded into corn[J]. Soil Science Society of America Journal, 2024, 88(1): 56-70 DOI:10.1002/saj2.20604 (  0) 0) |
| [39] |
Song X, Yuan Z Q, Fang C, et al. The formation of humic acid and micro-aggregates facilitated long-time soil organic carbon sequestration after Medicago sativa L. introduction on abandoned farmlands[J]. Geoderma, 2024, 445: 116889 DOI:10.1016/j.geoderma.2024.116889 (  0) 0) |
| [40] |
汤洁, 李月芬, 林年丰, 等. 应用生物技术改良退化土壤的效果——以黄花草木樨改良盐碱化土壤为例[J]. 生态环境, 2004, 13(1): 51–53, 60 DOI:10.3969/j.issn.1674-5906.2004.01.016 (  0) 0) |
| [41] |
Aloush R H. Morphological and anatomical characterization of the species Trifolium incarnatum l. cultivated in Iraq[J]. SABRAO Journal of Breeding and Genetics, 2023, 55(4): 1284-1293 DOI:10.54910/sabrao2023.55.4.21 (  0) 0) |
| [42] |
Ghimire B, Ghimire R, VanLeeuwen D, et al. Cover crop residue amount and quality effects on soil organic carbon mineralization[J]. Sustainability, 2017, 9(12): 2316 DOI:10.3390/su9122316 (  0) 0) |
| [43] |
Muhammad I, Wang J, Sainju U M, et al. Cover cropping enhances soil microbial biomass and affects microbial community structure: A meta-analysis[J]. Geoderma, 2021, 381: 114696 DOI:10.1016/j.geoderma.2020.114696 (  0) 0) |
| [44] |
Pereira N S, Soares I, de Miranda F R. Decomposition and nutrient release of leguminous green manure species in the Jaguaribe-Apodi region, Ceará, Brazil[J]. Ciência Rural, 2016, 46(6): 970-975 (  0) 0) |
| [45] |
Liu Z X, Gu H D, Liang A Z, et al. Conservation tillage regulates soil bacterial community assemblies, network structures and ecological functions in black soils[J]. Plant and Soil, 2022, 472: 207-223 DOI:10.1007/s11104-021-05219-x (  0) 0) |
| [46] |
Ortiz-Cornejo N L, Romero-Salas E A, Navarro-Noya Y E, et al. Incorporation of bean plant residue in soil with different agricultural practices and its effect on the soil bacteria[J]. Applied Soil Ecology, 2017, 119: 417-427 DOI:10.1016/j.apsoil.2017.07.014 (  0) 0) |
| [47] |
Yang Z, Xu Y X, Li H, et al. Difference of bacterial community structure in the meadow, maize, and continuous cropped alfalfa in Northeast China[J]. Frontiers in Microbiology, 2022, 13: 794848 DOI:10.3389/fmicb.2022.794848 (  0) 0) |
| [48] |
Dedysh S N, Ivanova A A, Begmatov S A, et al. Acidobacteria in fens: Phylogenetic diversity and genome analysis of the key representatives[J]. Microbiology, 2022, 91(6): 662-670 DOI:10.1134/S0026261722601440 (  0) 0) |
| [49] |
Vinale F, Sivasithamparam K, Ghisalberti E L, et al. Trichoderma–plant–pathogen interactions[J]. Soil Biology and Biochemistry, 2008, 40(1): 1-10 DOI:10.1016/j.soilbio.2007.07.002 (  0) 0) |
| [50] |
Chen M Q, Xu J S, Li Z Q, et al. Long-term nitrogen fertilization-induced enhancements of acid hydrolyzable nitrogen are mainly regulated by the most vital microbial taxa of keystone species and enzyme activities[J]. Science of The Total Environment, 2023, 874: 162463 DOI:10.1016/j.scitotenv.2023.162463 (  0) 0) |
| [51] |
Zhang S Y, Luo P Y, Yang J F, et al. Responses of arbuscular mycorrhizal fungi diversity and community to 41-year rotation fertilization in brown soil region of Northeast China[J]. Frontiers in Microbiology, 2021, 12: 742651 DOI:10.3389/fmicb.2021.742651 (  0) 0) |
| [52] |
Luo X, Shi S M, Liu Y N, et al. Arbuscular mycorrhizal fungal communities of topsoil and subsoil of an annual maize-wheat rotation after 15-years of differential mineral and organic fertilization[J]. Agriculture, Ecosystems & Environment, 2021, 315: 107442 (  0) 0) |
| [53] |
Yang H B, Xiao Q, Huang Y P, et al. Long-term manuring facilitates glomalin-related soil proteins accumulation by chemical composition shifts and macro-aggregation formation[J]. Soil and Tillage Research, 2024, 235: 105904 DOI:10.1016/j.still.2023.105904 (  0) 0) |
| [54] |
Rillig M C. Arbuscular mycorrhizae and terrestrial ecosystem processes[J]. Ecology Letters, 2004, 7(8): 740-754 DOI:10.1111/j.1461-0248.2004.00620.x (  0) 0) |
| [55] |
Kohler A, Kuo A L, Nagy L G, et al. Convergent losses of decay mechanisms and rapid turnover of symbiosis genes in mycorrhizal mutualists[J]. Nature Genetics, 2015, 47(4): 410-415 DOI:10.1038/ng.3223 (  0) 0) |
| [56] |
Moitinho M R, Fernandes C, Truber P V, et al. Arbuscular mycorrhizal fungi and soil aggregation in a no-tillage system with crop rotation[J]. Journal of Plant Nutrition and Soil Science, 2020, 183(4): 482-491 DOI:10.1002/jpln.201900456 (  0) 0) |
2. Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China;
4. Institute of Forage and Grassland Sciences, Heilongjiang Academy of Agricultural Sciences, Harbin 150086, China;
4. University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, China
 2025, Vol. 57
2025, Vol. 57


