2. 江苏省耕地质量与农业环境保护站, 南京 210000
我国东部滨海盐碱地是重要的后备耕地资源,其改良过程的最关键措施:一是降盐;二是增加土壤有机质以提升土壤肥力[1-2]。脱盐过程可通过引淡灌溉和借助集中降雨得以加速,而快速提高肥力的一个关键点在于促进表层土壤良好结构(主要是团聚体)的形成[3-4]。研究表明,土壤含盐量与有机质含量呈负相关[5]。主要原因是土壤有机质中的有机胶体可以提高土粒团聚性,促进团聚体形成,提高非毛管孔隙度,增加向下淋盐通道的同时切断毛细管,使水盐上升通道受阻,抑制返盐[6-7]。此外,有机胶体带有大量负电荷,其阳离子交换量和吸水率比土壤黏粒大几倍甚至几十倍,两者结合形成团聚体可极大提高土壤保肥能力[8-9]。土壤有机质是促进团聚体形成和稳定的重要物质基础[10]。然而,滨海盐碱地土壤有机质含量很低,且在高盐和高pH条件下,依赖盐碱地自身积累有机质来形成团聚体的过程极其缓慢。因此,人为地投入大量外源有机物料,促进团聚体的形成及稳定,是抑制返盐、提高肥力、促进盐碱地土壤向农业土壤转化的前提。
土壤团聚体的形成与稳定与“结合剂”和“分散剂”有关[11]。土壤有机碳,通常被认为是改善土壤团聚体形成和稳定性的重要“结合剂”[12-13]。盐碱地土壤高含盐量(特别是交换性Na+)被认为是破坏团聚体形成及稳定性的“分散剂”[3, 12]。前期研究表明,添加外源有机物可以显著增加盐碱地土壤有机碳,降低表层土壤含盐量,并显著促进表层土壤中 > 0.25 mm水稳性团聚体的形成[14-15]。其原因可能是:降盐措施的前提下,土壤交换性Na+含量降低,不足以分散外源有机碳发挥“结合剂”作用所形成的团聚体,进而抑制返盐。Guo等人[16]研究表明,在高降雨量和/或良好灌溉条件下,长期施用畜禽粪便,尽管能带入大量交换性Na+,但土壤团聚体的稳定性仍然增加。因此,添加外源有机物增加了土壤有机碳的“结合”作用,在一定程度上可“抵消”交换性Na+的“分散”作用,促进盐碱地土壤团聚体的形成和稳定。
微生物是土壤团聚体形成最活跃的生物因素,对土壤团聚体的形成和稳定起着重要作用。促进土壤团聚体形成的微生物种类很多,且不同种类的微生物对团聚体形成的影响差异也较大[17]。真菌可通过其网络状菌丝捕获土壤颗粒,增强土壤颗粒的团聚性[12]。真菌菌体产生的分泌物,如多糖、细胞外复合物和土壤蛋白(如球囊蛋白和疏水蛋白)亦可促进团聚体的形成;细菌则通过分解有机质形成中间产物如多糖,进而使黏土絮凝形成团聚体[18-19]。此外,微生物细胞带有负电荷,可以通过静电引力将土壤颗粒连接在一起[20]。已有研究表明,施用外源有机物可以改变农田土壤微生物群落结构,从而影响土壤团聚体的形成与稳定性[21-22]。因而,添加外源有机物熟化滨海盐碱地土壤过程中,盐碱地土壤微生物群落结构一定发生变化,该变化与团聚体形成及稳定性之间的关系,有待进一步探究。
因此,本研究以动物源蚯蚓粪和植物源醋渣为外源有机物,探讨蚯蚓粪和醋渣施用对滨海盐碱地土壤大团聚体形成及稳定、土壤大团聚体化学性质及微生物群落结构的影响,旨在揭示不同类型外源有机物驱动滨海盐碱地土壤大团聚体形成特征,丰富盐碱地土壤肥力演变过程的理论,并为促进我国东部滨海盐碱地土壤向农业土壤的快速转化提供技术途径和可行性依据。
1 材料与方法 1.1 试验地点与材料试验于2019—2021年在江苏省如东县方凌垦区(120°56′03"E、32°36′30"N)试验田进行。试验区属淤涨型的淤泥质海岸,年平均降水量为1 074.6 mm,平均气温为15.1 ℃。试验区土壤属砂质壤土,滨海盐土类型。
供试醋渣取自江苏省镇江市恒顺醋业有限公司,供试蚯蚓粪取自江苏省泰州市春光生态农业发展有限公司,蚯蚓粪由蚯蚓吞噬消解符合《农用污泥污染物控制标准》(GB 4284—2018)的生活污泥获得。供试土壤、蚯蚓粪和醋渣的基本理化性质见表 1。
|
|
表 1 供试盐碱地土壤及外源有机物的基本理化性质 Table 1 Basic properties of saline-alkali soil and exogenous organic materials tested |
试验采用随机区组设计,每个小区面积均为16 m2 (4.0 m×4.0 m)。试验按蚯蚓粪和醋渣的干基施用量分别设5个处理,分别为0、25、50、100、200 t/hm2,各处理重复3次。2019年10月将蚯蚓粪和醋渣按不同用量一次性施入各小区,并利用旋耕机将蚯蚓粪和醋渣与0 ~ 20 cm耕层土壤混匀。试验区自2019年依次进行大麦、玉米轮作,并于2021年10月玉米收获后采集表层(0 ~ 20 cm)土壤团聚体样品。
1.3 土壤团聚体分类及稳定性分析表层土壤团聚体样品沿自然结构面剥成10 ~ 12 mm直径的小土块,弃去肉眼可见的有机物残渣和植物残茬,并放置于含有硅胶干燥剂的干燥器中快速风干至10% 含水量左右。土壤大团聚体粒径分级采用湿土干筛法,以减少对团聚体与微生物群落分布和活动间原位连接的破坏。具体操作为:风干后团聚体样品(10% 含水量)放置在团聚体干筛仪内(Octagon 200),以最大振幅振动2 min,分离出 > 2 mm和0.25 ~ 2 mm粒径的土壤团聚体样品,并通过计算团聚体的平均重量直径(MWD)和几何平均直径(GMD)来衡量各粒级团聚体稳定性。
| $ {W_i} = \frac{{{W_{di}}}}{{{W_{\text{T}}}}} \times 100\% $ | (1) |
式中:Wi为各粒径团聚体的质量百分比,%;Wdi为各粒径团聚体的干物质量,g;WT为土样的总干物质量,g。
| $ \text{MWD}=\frac{{{\displaystyle \sum }}_{i=1}^{n}\left(\overline{{X}_{i}} {w}_{i}\right)}{{{\displaystyle \sum }}_{i=1}^{n}{w}_{i}} $ | (2) |
| $ {\text{GMD}} = {\text{exp}}\left[ {\frac{{\mathop \sum \nolimits_{i = 1}^n {w_i}{\text{ln}}\overline {{X_i}} }}{{\mathop \sum \nolimits_{i = 1}^n {w_i}}}} \right] $ | (3) |
式中:
各粒级(> 2 mm和0.25 ~ 2 mm)土壤大团聚体样品分为3份,一份经自然风干研磨后分别过1 mm和0.149 mm筛,用于土壤电导率(EC)、pH、可溶性盐总量、有机碳(SOC)、全氮(TN)和全磷(TP)含量测定;一份密封放置4 ℃冰箱用于各粒级土壤团聚体中酶活性的测定;一份密封放置于–80 ℃超低温冰箱用于各粒级土壤团聚体中微生物指标的测定。
土壤团聚体EC和pH采用1∶5的土水质量比浸提,分别用电导率仪和pH计测定;可溶性盐总量采用质量法测定;SOC采用重铬酸钾外加热法测定;TN和TP分别采用半微量凯氏定氮法和硫酸–高氯酸消解法进行测定[23]。荧光素二乙酸酯水解酶(FDA)、蔗糖酶(SUC)、脲酶(URE)和碱性磷酸酶(ALP)活性分别采用双乙酸荧光素水解法、3, 5-二硝基水杨酸比色法、苯酚–次氯酸钠比色法和磷酸苯比色法测定[24]。使用FastDNA® SPIN Kit试剂盒(MP Biomedicals,OH,USA)提取各粒级土壤团聚体中微生物总DNA,送上海天昊生物科技有限公司在Illumina平台Miseq系统测序细菌的16S rDNA V3、V4区域和真菌的ITS区域;测序结果用于分析团聚体样品微生物群落结构[24-25]。
1.5 数据处理与统计分析试验数据采用Excel 2019和SPSS 19.0统计软件进行统计分析,用LSD法检验差异显著性。利用QIIME软件计算细菌和真菌群落组成多样性(Shannon、Evenness指数),表征不同处理组之间细菌和真菌群落差异。基于Bray-Curtis距离矩阵,进行主坐标分析(PCoA),以检查所有样本的结构多样性(β多样性)。利用AMOS绘制结构方程模型,分析土壤理化性质、酶活性以及微生物结构多样性对土壤团聚体形成的影响。
2 结果与分析 2.1 滨海盐碱地土壤大团聚体粒径分布及稳定性蚯蚓粪和醋渣的施用促进了滨海盐碱地土壤大团聚体的形成,且各粒级土壤大团聚体含量随外源有机物施用量的增加呈增加趋势(图 1)。最高施用量下(200 t/hm2),蚯蚓粪和醋渣处理土壤0.25 ~ 2 mm、> 2 mm大团聚体占比分别达48.1%、51.0% 和45.1%、49.3%,较对照分别提高8.3%、5.5% 和4.1%、4.5%。外源有机物的施用提高了盐碱地土壤大团聚体稳定性,蚯蚓粪和醋渣各处理MWD和GMD的最大增幅分别达5.8%、18.6% 和4.1%、11.5%。相同施用量下,蚯蚓粪处理土壤大团聚体数量和稳定性均高于醋渣处理。
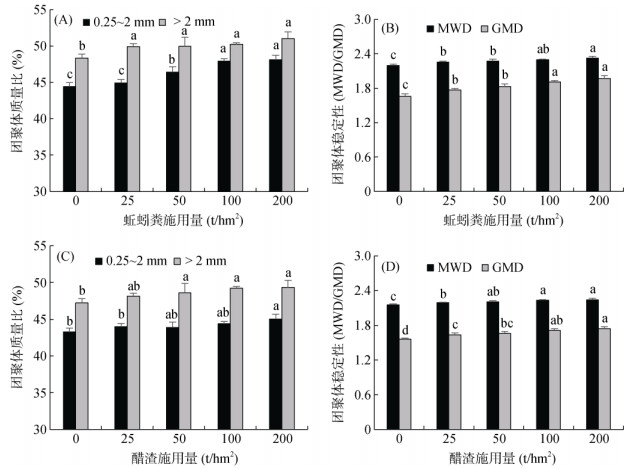
|
(MWD表示平均重量直径,mm;GMD表示几何平均直径,mm;图中小写字母不同表示处理间差异达P < 0.05显著水平,下同) 图 1 施用外源有机物对滨海盐碱地土壤大团聚体形成和稳定性的影响 Fig. 1 Effects of exogenous organic materials application on formation and stability of macroaggregates in coastal saline-alkali soil |
施用外源有机物显著提高各粒级土壤大团聚体SOC、TN和TP含量,并降低pH、EC和盐分含量(表 2)。其中,最高施用量下,蚯蚓粪各处理土壤0.25 ~ 2 mm大团聚体SOC、TN和TP含量较对照分别提高321.3%、262.7% 和456.7%,pH、EC和盐分分别降低6.7%、65.4% 和32.9%;醋渣各处理土壤0.25 ~ 2 mm大团聚体SOC、TN和TP含量较对照分别提高126.5%、100.3% 和4.33%,pH、EC和盐分分别降低3.9%、57.8% 和47.7%。相同施用量下,蚯蚓粪处理土壤0.25 ~ 2 mm和 > 2 mm大团聚体SOC、TN和TP含量较醋渣处理平均高59.0%、43.1%、458.2% 和59.6%、43.7%、463.5%,醋渣处理土壤0.25 ~ 2 mm和 > 2 mm大团聚体EC和盐分较蚯蚓粪处理平均低48.1%、24.6% 和48.0%、17.5%。
|
|
表 2 施用外源有机物对滨海盐碱地土壤大团聚体化学性质的影响 Table 2 Effects of exogenous organic materials application on chemical properties of soil macroaggregates |
施用蚯蚓粪和醋渣均显著提高盐碱地土壤大团聚体酶活性(图 2)。蚯蚓粪最高施用量处理土壤0.25 ~ 2 mm和 > 2 mm大团聚体FDA、SUE、URE和ALP酶活性分别达119.08 μg/(h·g)、8.48 mg/(24h·g)、1.03 mg/(24h·g)、1.31 mg/(24h·g) 和81.28 μg/(h·g)、8.11 mg/(24h·g)、0.69 mg/(24h·g)、0.95 mg/(24h·g),较对照分别提高257.6%、134.0%、189.9%、57.1% 和80.5%、172.7%、319.6%、49.0%。醋渣最高施用量处理土壤0.25 ~ 2 mm和 > 2 mm大团聚体FDA、SUE、URE和ALP酶活性较对照分别提高31.65%、36.0%、94.6%、32.5% 和58.32%、46.6%、106.8%、23.8%。相同施用量下,蚯蚓粪处理土壤大团聚体酶活性均高于醋渣处理。
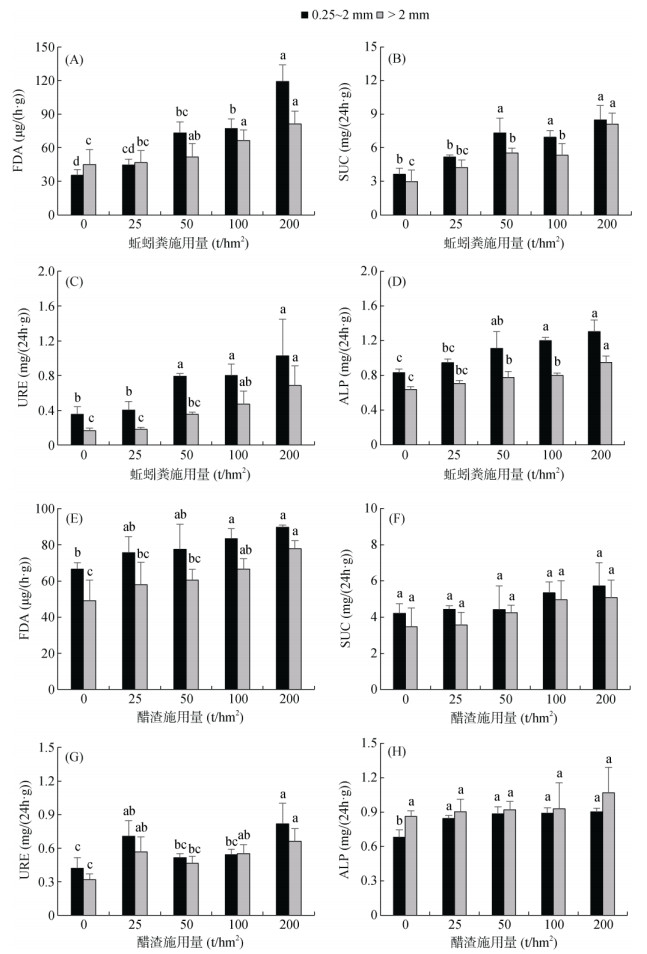
|
(图中FDA表示荧光素二乙酸酯水解酶;SUC表示蔗糖酶;URE表示脲酶;ALP表示碱性磷酸酶) 图 2 施用外源有机物对盐碱地土壤大团聚体荧光素二乙酸酯水解酶、蔗糖酶、脲酶和碱性磷酸酶活性的影响 Fig. 2 Effects of exogenous organic materials application on activities of fluorescein diacetate hydrolase (FDA), sucrase (SUC), urease (URE) and alkaline phosphatase (ALP) in soil macroaggregates |
施用蚯蚓粪和醋渣显著改变滨海盐碱地土壤大团聚体微生物群落结构(图 3)。蚯蚓粪和醋渣处理PCoA1和PCoA2的总解释量(细菌和真菌)均超过40%。蚯蚓粪处理和醋渣处理土壤0.25 ~ 2 mm和 > 2 mm大团聚体真菌群落结构具有显著差异。外源有机物的施用显著改变土壤大团聚体细菌和真菌群落组成(图 4)。蚯蚓粪处理土壤大团聚体优势菌群分别为厌氧绳菌科(Anaerolineaceae)、暖绳菌科(Caldilineaceae)、(Chitinophagaceae)、发菌科(Trichocomaceae)、被孢霉科(Mortierellaceae)和粪盘菌科(Ascobolaceae)。醋渣处理土壤大团聚体优势菌群分别为厌氧绳菌科(Anaerolineaceae)、脱硫单胞菌科(Desulfuromonadaceae)、假单胞菌科(Pseudomonadaceae)、葡萄穗霉科(Stachybotryaceae)、被孢霉科(Mortierellaceae)和粪盘菌科(Ascobolaceae)。
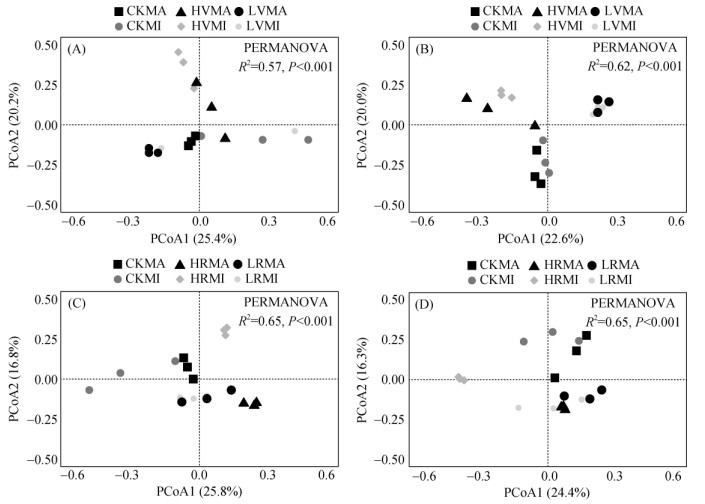
|
(图中CK表示对照处理;LV和LR表示蚯蚓粪和醋渣低施用量处理(25 t/hm2);HV和HR表示蚯蚓粪和醋渣高施用量处理(200 t/hm2);MI表示0.25 ~ 2 mm土壤大团聚体;MA表示 > 2 mm土壤大团聚体。下同) 图 3 施用蚯蚓粪和醋渣对盐碱地土壤大团聚体细菌(A、C)和真菌(B、D)群落结构的主成分分析(PCoA) Fig. 3 Principal component analysis (PCoA) of community structures of bacteria (A and C) and fungi (B and D) in macroaggregates of coastal saline-alkali soil induced by vermicompost and vinegar residue application |
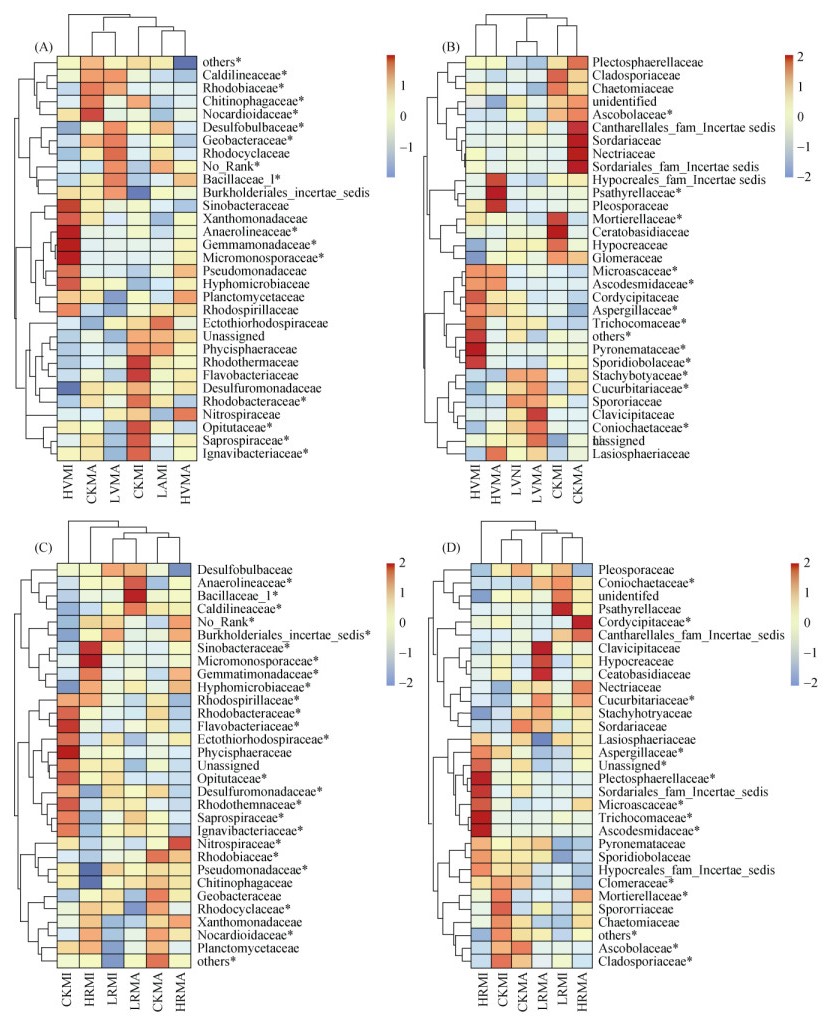
|
(图中*表示在P < 0.05水平上具有显著性差异) 图 4 施用蚯蚓粪和醋渣对滨海盐碱地土壤大团聚体中优势细菌科(A、C)和真菌科(B、D)的影响 Fig. 4 Effects of vermicompost and vinegar residue application on dominant bacteria (A and C) and fungi (B and D) families of macroaggregates in coastal saline-alkali soil |
结构方程模型结果表明,蚯蚓粪处理土壤0.25 ~ 2 mm和 > 2 mm大团聚体的形成与土壤EC、SOC、细菌结构多样性及真菌多样性密切相关(图 5),其中真菌结构多样性(路径系数:0.66)的增加有利于土壤0.25 ~ 2 mm大团聚体形成,SOC(路径系数:0.76)的增加有利于土壤 > 2 mm大团聚体形成。醋渣处理土壤0.25 ~ 2 mm大团聚体的形成与SOC、URE酶活性、FDA酶活性及真菌结构多样性密切相关,而土壤 > 2 mm大团聚体形成与土壤盐分、细菌结构多样性及TN密切相关,其中SOC(路径系数:0.47)的增加有利于土壤0.25 ~ 2 mm大团聚体形成,TN(路径系数:0.44)的增加有利于土壤 > 2 mm大团聚体形成。
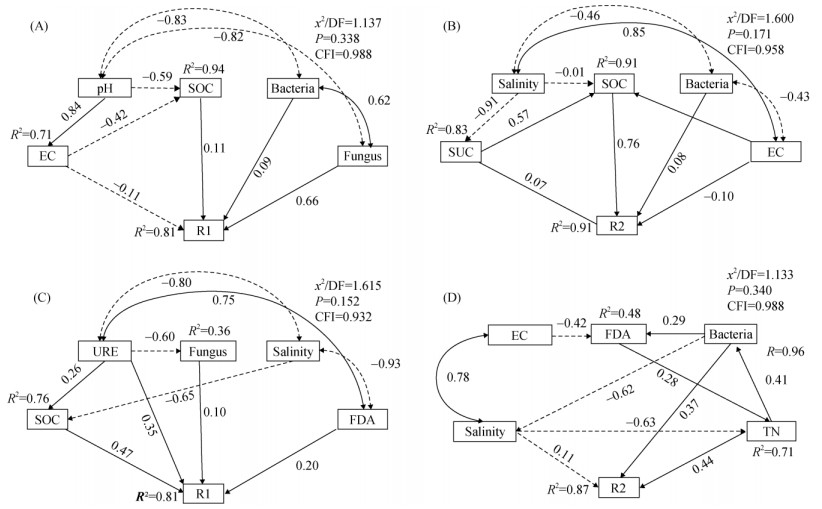
|
(图中R1表示0.25 ~ 2 mm土壤大团聚体;R2表示 > 2 mm土壤大团聚体;Bacteia表示细菌结构多样性;Fungus表示真菌结构多样性;箭头线上的数值表示路径系数,反映变量间影响的强度与方向;其中,实线箭头代表路径系数为正值(正向影响),虚线箭头代表路径系数为负值(负向影响)) 图 5 施用蚯蚓粪(A、B)和醋渣(C、D) 后土壤化学性质对土壤大团聚体形成的结构方程模型 Fig. 5 Structural equation model of soil chemical properties on macroaggregate formation after vermicompost (A and B) and vinegar residue (C and D) application |
滨海盐碱地土壤向农业土壤转化过程中,团聚体的形成至关重要,而团聚体的形成与土壤有机质的积累密切相关。施用外源有机物被广泛认为是促进土壤团聚体形成的有效途径[26]。本研究条件下,施用蚯蚓粪和醋渣显著促进了滨海盐碱地土壤大团聚体的形成。外源有机物施用后盐碱地土壤化学性质的变化(土壤有机碳的增加、盐分的降低)以及土壤微生物群落多样性(尤其是真菌生物群)的变化是土壤团聚体形成的主要影响因素[26-27]。与醋渣相比,蚯蚓粪更有利于盐碱地土壤大团聚体的形成。其原因主要是蚯蚓粪比表面积大,呈多孔结构,可以提高土壤保温透水性能,有助于土壤团聚体形成;此外,蚯蚓粪富含土壤团聚体形成所需的有机胶结物质,而醋渣主要由纤维素组成,有机胶结物质较少[28-29]。本研究中蚯蚓粪和醋渣的施用均提高了土壤大团聚体的稳定性。一般而言,土壤团聚体稳定性与团聚体粒径分布密切相关,并随水稳性团聚体含量的增加而提高。其原因可能是有机物的施用有利于土壤细小颗粒的结合,并进一步形成结构更稳定、更耐受分散的较大粒径的团聚体。
盐碱地表层土壤良好结构(主要是团聚体)的形成是快速提升土壤肥力的一个关键。本研究中,施用外源有机物显著提高了滨海盐碱地土壤大团聚体有机碳、全氮和全磷含量,这主要归因于蚯蚓粪和醋渣中丰富的有机碳、氮、磷养分。同时,外源有机物施用后盐碱地土壤物理性状的改善特别是团聚体的形成也有利于土壤保肥性能的增强。由于蚯蚓粪的有机碳、氮、磷含量本身较高,因此其处理组土壤大团聚体的有机碳、全氮和全磷含量均高于醋渣处理组。本研究中,施用蚯蚓粪和醋渣均显著降低了土壤大团聚体pH,其原因可能是pH较低的蚯蚓粪以及有机质降解过程中产生的有机酸(腐殖酸和富里酸)的中和作用[30]。此外,植物根系分泌的H+以及土壤呼吸和氮磷矿化过程中产生的CO2、NO3–和NO2–也可能是导致盐碱地土壤pH下降的原因[31-32]。施用蚯蚓粪和醋渣后土壤大团聚体电导率和盐分显著降低,其原因可能是蚯蚓粪和醋渣的施用改善了土壤结构,促进了矿物颗粒的絮凝,增加了土壤的孔隙度,有效阻止了盐分通过土壤毛细管向上迁移,进而降低表层土壤盐分含量[33]。与蚯蚓粪相比,醋渣的施用更有利于土壤大团聚体盐分的降低,其原因可能是醋渣结构疏松,更有利于增加土壤非毛管孔隙,促进表层土壤盐分向下淋溶[34]。
土壤酶活性是反映土壤肥力的重要生物指标[35]。施用外源有机物显著提高了滨海盐碱地土壤大团聚体酶活性。研究表明,蔗糖酶活性与土壤有机质含量、微生物数量密切相关[36-37]。本研究中,土壤大团聚体蔗糖酶活性显著提高,可能是由于施用蚯蚓粪和醋渣增加了土壤有机质含量,为微生物生长提供了丰富的碳源,提高了土壤养分利用率,进而促进蔗糖酶活性的提高。土壤脲酶参与氮的转化,土壤含氮量越高,脲酶活性越强[38]。施用蚯蚓粪和醋渣为土壤提供了丰富的土壤含氮基质,促进了土壤大团聚体中脲酶的合成[39]。此外,施用蚯蚓粪和醋渣显著提高了土壤碱性磷酸酶活性,碱性磷酸酶的合成可能受到植物和土壤微生物对磷需求的刺激[40]。值得注意的是,施用蚯蚓粪和醋渣对滨海盐碱地土壤大团聚体pH、电导率、盐分、土壤有机质、氮磷养分含量及酶活性的影响具有明显的剂量效应。
有机物料的施用可以显著改变土壤生物学性状,特别是土壤微生物群落[41-42]。已有研究发现,施用蚯蚓粪和醋渣显著增加了土壤微生物数量[43-44]。其原因主要是蚯蚓粪和醋渣富含有机碳和氮磷等营养物质,施用后提高了土壤肥力,促进了土壤团聚体形成,为微生物增殖提供了有利条件。同时,长期施用有机物料(如污泥、腐殖酸、牛粪)促进了盐碱地土壤中微生物多样性的提高,其原因主要归因于土壤中有机碳的积累和养分有效性的提高[44-45]。也有研究发现,施用有机物料(如秸秆生物质炭、污泥、蚯蚓粪等)会降低碱性土壤微生物多样性[43, 46-47],这可能是不同有机改良剂中独特的碳源对特定微生物物种的选择性促进或抑制作用所导致[48-49]。本研究中,施用蚯蚓粪和醋渣显著改变了盐碱地土壤大团聚体细菌和真菌的群落结构。
结构方程模型结果表明,滨海盐碱地土壤大团聚体的数量与土壤有机碳含量呈直接正相关,与土壤电导率(或盐分)呈直接负相关。土壤团聚体的形成与稳定,与“结合剂”或“分散剂”密切相关[11]。土壤有机质是促进团聚体形成和稳定的重要物质基础,通常被视为土壤团聚体形成和稳定的“结合剂”[12-13]。富含有机质的蚯蚓粪带有大量负电荷,可以提高土粒团聚性,有效促进土壤团聚体形成。盐碱地土壤的高含盐量(尤其是交换性Na+)被公认为是破坏团聚体形成及稳定性的“分散剂”[3, 12]。施用蚯蚓粪和醋渣降低了土壤电导率和盐分,提高了团聚体稳定性和数量。土壤团聚体是微生物生存的场所,同时微生物是土壤团聚体形成的重要因素[12, 50]。土壤微生物可以为团聚体快速形成和稳定提供碳源[51];微生物细胞本身带有负电荷,能够借助静电引力使土壤颗粒彼此连结[20];真菌和放线菌可以通过其网络状菌丝将土壤颗粒缠绕在一起形成团聚体[12];细菌和真菌的代谢产物对土壤颗粒具有胶结作用,促成了团聚体的形成[18-19]。结构方程模型结果同样表明,施用蚯蚓粪和醋渣后,盐碱地土壤微生物的改变影响了土壤大团聚体的形成,特别是真菌对土壤0.25 ~ 2 mm大团聚体形成具有显著影响。盐碱地土壤中细菌丰度普遍高于真菌[52],土壤中较高的细菌种群可能意味着将有更多的胞外多糖和脂多糖分泌到土壤中,促进有机物和矿物的结合,进而促进团聚体的形成[53]。
4 结论本研究证实施用外源有机物有效促进了滨海盐碱地土壤大团聚体形成及稳定性的提高,是抑制土壤返盐、提高土壤肥力、促进盐碱地土壤向农业土壤转化的有效途径。蚯蚓粪和醋渣施用后土壤有机碳大幅增加为大团聚体形成提供充足的物质基础,从而促进了盐碱地土壤0.25 ~ 2 mm及 > 2 mm大团聚体形成。同时,大团聚体形成后盐碱地土壤物理性状的改善促进了盐碱地土壤脱盐并有效抑制返盐,进而降低影响团聚体形成及稳定的“分散剂”(交换性Na+),增强盐碱地土壤大团聚体的稳定性。施用蚯蚓粪和醋渣显著提高盐碱地土壤大团聚体酶活性,改变土壤大团聚体细菌和真菌的群落组成及结构,且具有明显的剂量效应。结构方程模型结果表明,土壤有机碳的增加和电导率或盐分的降低是土壤大团聚体形成的主要因素。此外,施用蚯蚓粪和醋渣后土壤肥力、酶活性以及微生物群落结构的变化均可能直接或间接地影响土壤大团聚体形成。整体而言,蚯蚓粪更有利于土壤团聚体的形成和肥力的提升,而醋渣则更有利于土壤盐分的降低。因此,针对高盐分的盐碱荒地,醋渣的施用更有利于土壤盐分加速淋溶并抑制土壤返盐,而针对盐碱耕地,蚯蚓粪和醋渣的混合施用可能是促进土壤团聚体形成、加速盐分降低和快速提升盐碱地肥力的有效途径。
| [1] |
Rahman M M, Hagare D, Maheshwari B. Framework to assess sources controlling soil salinity resulting from irrigation using recycled water: An application of Bayesian Belief Network[J]. Journal of Cleaner Production, 2015, 105: 406-419 (  0) 0) |
| [2] |
Sastre-Conde I, Carmen Lobo M, Icela Beltrán-Hernández R, et al. Remediation of saline soils by a two-step process: Washing and amendment with sludge[J]. Geoderma, 2015, 247: 140-150 (  0) 0) |
| [3] |
Guo Z C, Zhang Z B, Zhou H, et al. Long-term animal manure application promoted biological binding agents but not soil aggregation in a Vertisol[J]. Soil and Tillage Research, 2018, 180: 232-237 (  0) 0) |
| [4] |
Peng X H, Horn R, Hallett P. Soil structure and its functions in ecosystems: Phase matter & scale matter[J]. Soil and Tillage Research, 2015, 146: 1-3 (  0) 0) |
| [5] |
Bai Y C, Zuo W G, Yan Y Y, et al. Sewage sludge amendment combined with green manuring to a coastal mudflat salt-soil in Eastern China: Effects on soil physicochemical properties and maize yield[J]. International Journal of Agronomy, 2017, 2017(1): 8526598 (  0) 0) |
| [6] |
Hamuda H, Ligetvari F. Impacts of municipal sewage sludge on dynamics of organic matter and biological activities in clay loam brown forest soil[J]. Journal of Residuals Science & Technology, 2011, 8(4): 143-149 (  0) 0) |
| [7] |
Grosbellet C, Vidal-Beaudet L, Caubel V, et al. Improvement of soil structure formation by degradation of coarse organic matter[J]. Geoderma, 2011, 162(1/2): 27-38 (  0) 0) |
| [8] |
Zhang T, Wang T, Liu K, et al. Effects of different amendments for the reclamation of coastal saline soil on soil nutrient dynamics and electrical conductivity responses[J]. Agricultural Water Management, 2015, 159: 115-122 (  0) 0) |
| [9] |
Guo X X, Liu H T, Wu S B. Humic substances developed during organic waste composting: Formation mechanisms, structural properties, and agronomic functions[J]. Science of The Total Environment, 2019, 662: 501-510 (  0) 0) |
| [10] |
Tian X M, Fan H, Wang J Q, et al. Effect of polymer materials on soil structure and organic carbon under drip irrigation[J]. Geoderma, 2019, 340: 94-103 (  0) 0) |
| [11] |
Six J, Bossuyt H, Degryze S, et al. A history of research on the link between (micro)aggregates, soil biota, and soil organic matter dynamics[J]. Soil and Tillage Research, 2004, 79(1): 7-31 (  0) 0) |
| [12] |
Bronick C J, Lal R. Soil structure and management: A review[J]. Geoderma, 2005, 124(1/2): 3-22 (  0) 0) |
| [13] |
Su Y Z, Wang F, Suo D R, et al. Long-term effect of fertilizer and manure application on soil-carbon sequestration and soil fertility under the wheat–wheat– maize cropping system in northwest China[J]. Nutrient Cycling in Agroecosystems, 2006, 75(1): 285-295 (  0) 0) |
| [14] |
Bai Y C, Zang C Y, Gu M J, et al. Sewage sludge as an initial fertility driver for rapid improvement of mudflat salt-soils[J]. Science of The Total Environment, 2017, 578: 47-55 (  0) 0) |
| [15] |
Zuo W G, Gu C H, Zhang W J, et al. Sewage sludge amendment improved soil properties and sweet sorghum yield and quality in a newly reclaimed mudflat land[J]. Science of The Total Environment, 2019, 654: 541-549 (  0) 0) |
| [16] |
Guo Z C, Zhang J B, Fan J, et al. Does animal manure application improve soil aggregation? Insights from nine long-term fertilization experiments[J]. Science of The Total Environment, 2019, 660: 1029-1037 (  0) 0) |
| [17] |
李娜, 韩晓增, 尤孟阳, 等. 土壤团聚体与微生物相互作用研究[J]. 生态环境学报, 2013, 22(9): 1625-1632 (  0) 0) |
| [18] |
Rashid M I, Mujawar L H, Shahzad T, et al. Bacteria and fungi can contribute to nutrients bioavailability and aggregate formation in degraded soils[J]. Microbiological Research, 2016, 183: 26-41 (  0) 0) |
| [19] |
Tang J, Mo Y H, Zhang J Y, et al. Influence of biological aggregating agents associated with microbial population on soil aggregate stability[J]. Applied Soil Ecology, 2011, 47(3): 153-159 (  0) 0) |
| [20] |
Lynch J M, Bragg E. Microorganisms and soil aggregate stability[M]//Soil Restoration. New York, NY: Springer New York, 1985: 133–171.
(  0) 0) |
| [21] |
Mossa A W, Dickinson M J, West H M, et al. The response of soil microbial diversity and abundance to long-term application of biosolids[J]. Environmental Pollution, 2017, 224: 16-25 (  0) 0) |
| [22] |
Reardon C L, Wuest S B. Soil amendments yield persisting effects on the microbial communities—a 7-year study[J]. Applied Soil Ecology, 2016, 101: 107-116 (  0) 0) |
| [23] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 1999: 85-96
(  0) 0) |
| [24] |
Li Y L, Wang Y M, Shen C, et al. Structural and predicted functional diversities of bacterial microbiome in response to sewage sludge amendment in coastal mudflat soil[J]. Biology, 2021, 10(12): 1302 (  0) 0) |
| [25] |
Li Y L, Dai S Y, Wang B Y, et al. Autotoxic ginsenoside disrupts soil fungal microbiomes by stimulating potentially pathogenic microbes[J]. Applied and Environmental Microbiology, 2020, 86(9): e00130-20 (  0) 0) |
| [26] |
Zhang H, Pang H, Song J, et al. Subsurface organic ameliorant plus polyethylene mulching strengthened soil organic carbon by altering saline soil aggregate structure and regulating the fungal community[J]. Land Degradation & Development, 2022, 33(14): 2543-2553 (  0) 0) |
| [27] |
Bai Y C, Zuo W G, Shao H B, et al. Eastern China coastal mudflats: Salt-soil amendment with sewage sludge[J]. Land Degradation & Development, 2018, 29(10): 3803-3811 (  0) 0) |
| [28] |
Tisdall J M, Oades J M. Organic matter and water-stable aggregates in soils[J]. Journal of Soil Science, 1982, 33(2): 141-163 (  0) 0) |
| [29] |
杜甫军, 胡伟莲, 冯纬, 等. 米醋废渣发酵红曲色素的条件研究[J]. 中国酿造, 2015, 34(11): 71-74 (  0) 0) |
| [30] |
Rashid I, Murtaza G, Ahmad Zahir Z, et al. Effect of humic and fulvic acid transformation on cadmium availability to wheat cultivars in sewage sludge amended soil[J]. Environmental Science and Pollution Research, 2018, 25(16): 16071-16079 (  0) 0) |
| [31] |
Ludibeth S M, Marina I E, Vicenta E M. Vermicomposting of sewage sludge: Earthworm population and agronomic advantages[J]. Compost Science & Utilization, 2012, 20(1): 11-17 (  0) 0) |
| [32] |
Latare A M, Kumar O, Singh S K, et al. Direct and residual effect of sewage sludge on yield, heavy metals content and soil fertility under rice–wheat system[J]. Ecological Engineering, 2014, 69: 17-24 (  0) 0) |
| [33] |
Gao G F, Li P F, Zhong J X, et al. Spartina alterniflora invasion alters soil bacterial communities and enhances soil N2O emissions by stimulating soil denitrification in mangrove wetland[J]. Science of The Total Environment, 2019, 653: 231-240 (  0) 0) |
| [34] |
Zuo W G, Xu L, Qiu M H, et al. Effects of different exogenous organic materials on improving soil fertility in coastal saline-alkali soil[J]. Agronomy, 2023, 13(1): 61 (  0) 0) |
| [35] |
Elzobair K A, Stromberger M E, Ippolito J A, et al. Contrasting effects of biochar versus manure on soil microbial communities and enzyme activities in an Aridisol[J]. Chemosphere, 2016, 142: 145-152 (  0) 0) |
| [36] |
吴秀臣, 孙辉, 杨万勤, 等. 川西亚高山红桦幼苗土壤蔗糖酶活性对温度和大气二氧化碳浓度升高的响应[J]. 应用生态学报, 2007, 18(6): 1225-1230 (  0) 0) |
| [37] |
葛晓改, 肖文发, 曾立雄, 等. 三峡库区不同林龄马尾松土壤养分与酶活性的关系[J]. 应用生态学报, 2012, 23(2): 445-451 (  0) 0) |
| [38] |
冯大兰, 黄小辉, 张丽楠, 等. 三峡库区汝溪河流域柏木林土壤氮素及酶活性特征[J]. 林业科学, 2013, 49(12): 25-29 (  0) 0) |
| [39] |
Meier I C, Finzi A C, Phillips R P. Root exudates increase N availability by stimulating microbial turnover of fast-cycling N pools[J]. Soil Biology and Biochemistry, 2017, 106: 119-128 (  0) 0) |
| [40] |
Garcı́a C, Hernández T, Costa F, et al. Biochemical parameters in soils regenerated by the addition of organic wastes[J]. Waste Management & Research, 1994, 12(6): 457-466 (  0) 0) |
| [41] |
Fu J, Xiao Y, Wang Y F, et al. Trichoderma asperellum alters fungal community composition in saline–alkaline soil maize rhizospheres[J]. Soil Science Society of America Journal, 2021, 85(4): 1091-1104 (  0) 0) |
| [42] |
Al-Kindi S, Abed R M M. Effect of biostimulation using sewage sludge, soybean meal, and wheat straw on oil degradation and bacterial community composition in a contaminated desert soil[J]. Frontiers in Microbiology, 2016, 7: 240 (  0) 0) |
| [43] |
Li Y L, Wang Y M, Gu C H, et al. Differential effects of organic ameliorants on the reassembly of bacterial communities in newly amended coastal mudflat salt-affected soil[J]. Agronomy, 2022, 12(10): 2525 (  0) 0) |
| [44] |
Latare A M, Singh S K, Kumar O. Impact of sewage sludge application on soil fertility, microbial population and enzyme activities in soil under rice-wheat system[J]. Journal of the Indian Society of Soil Science, 2018, 66(3): 300 (  0) 0) |
| [45] |
Guo L L, Nie Z Y, Zhou J, et al. Effects of different organic amendments on soil improvement, bacterial composition, and functional diversity in saline–sodic soil[J]. Agronomy, 2022, 12(10): 2294 (  0) 0) |
| [46] |
Liu H X, Wang Y F, Jiang H Z, et al. Insight into the correlation between biochar amendment and shifts in bacterial community 4 years after a single incorporation in soybean- and maize-planted soils in northeastern China[J]. Canadian Journal of Microbiology, 2019, 65(5): 353-364 (  0) 0) |
| [47] |
Li Y L, Shen C, Wang Y M, et al. Alleviated environmental constraints and restructured fungal microbiome facilitate aggregate formation and stabilization in coastal mudflat saline soil amended by sewage sludge[J]. Land Degradation & Development, 2023, 34(10): 3064-3075 (  0) 0) |
| [48] |
Li F Q, Xue C, Qiu P F, et al. Soil aggregate size mediates the responses of microbial communities to crop rotation[J]. European Journal of Soil Biology, 2018, 88: 48-56 (  0) 0) |
| [49] |
Six J, Paustian K, Elliott E T, et al. Soil structure and organic matter I. distribution of aggregate-size classes and aggregate-associated carbon[J]. Soil Science Society of America Journal, 2000, 64(2): 681-689 (  0) 0) |
| [50] |
Wang S Q, Li T X, Zheng Z C, et al. Soil aggregate- associated bacterial metabolic activity and community structure in different aged tea plantations[J]. Science of The Total Environment, 2019, 654: 1023-1032 (  0) 0) |
| [51] |
Kiem R, Kandeler E. Stabilization of aggregates by the microbial biomass as affected by soil texture and type[J]. Applied Soil Ecology, 1997, 5(3): 221-230 (  0) 0) |
| [52] |
汪顺义, 冯浩杰, 王克英, 等. 盐碱地土壤微生物生态特性研究进展[J]. 土壤通报, 2019, 50(1): 233-239 (  0) 0) |
| [53] |
Vuko M, Cania B, Vogel C, et al. Shifts in reclamation management strategies shape the role of exopolysaccharide and lipopolysaccharide-producing bacteria during soil formation[J]. Microbial Biotechnology, 2020, 13(2): 584-598 (  0) 0) |
2. Jiangsu Cultivated Land Qualitative and Agro-Environmental Protection Station, Nanjing 210000, China
 2025, Vol. 57
2025, Vol. 57


