2. 中国科学院大学, 北京 100049;
3. 南京林业大学林学院, 南京 210037;
4. 济宁市农业科学研究院, 山东济宁 272100;
5. 金乡县科技局(金乡县大蒜研究所), 山东济宁 272200;
6. 中国科学院大学南京学院, 南京 211135
连作障碍是指在同一田块连续种植同一种作物后,出现作物生长发育不良、土传病害加剧、产量和品质明显降低等现象[1]。常规的连作障碍主要是茄果类等不耐连作的作物在连续种植数年之后,因土传病害爆发而导致的大幅度减产或者绝产;还包括一些由于化感自毒作用而导致的连作障碍,如中药材等特种作物的连续种植。常规连作障碍多发生在具有较大经济价值的园艺和中药材作物上。田间生产中为增加作物产量,大多都施用大量有机和无机肥料。轮作、间作套种、生物日晒、高温焖棚、强还原处理等措施已被证实可有效消减土壤连作障碍[2-3]。此外,施用微生物菌肥可向土壤引入有益微生物以抑制病原菌的生长,最终控制土传病害的发生[4]。
近年来,连作障碍的现象也蔓延到小麦、玉米等耐连作的大田作物上。如央视焦点访谈报道——“化肥喂瘦了俺的田”,河南小麦田中化肥越用越多,作物产量却不见提高,土壤板结现象越发严重,土地越种越瘦。这类连作障碍即广义的连作障碍,不同于上述因土传病害和化感作用诱发的常规连作障碍,实际上反映的是土壤质量的退化和生产模式的不可持续性。其发生的原因较为复杂,正在引起学界的关注。
大蒜属于较耐连作的经济作物。据FAO统计,2020年我国大蒜种植面积为83万hm2,占世界总种植面积的51%;年产量为2 075万t,占世界年产量的74%[5]。我国大蒜主产区,例如山东省金乡县,为了维持当地大蒜的品牌优势,大蒜种植面积占当地耕地面积的80% 以上,几乎没有轮作空间,从而形成大蒜连作的种植模式。近年来,大蒜连作后常表现出土壤板结、土传病害加剧、作物产量和品质严重降低等连作障碍的典型特征,因此属于上述广义的连作障碍类型。目前,大蒜连作障碍发生的原因尚不明确。本研究通过农户调查和不同连作年限的土壤取样及测定分析,解析大蒜连作障碍的成因,并在此基础上验证提升土壤有机碳措施(施用有机肥)对该类障碍的修复效果和机理。
1 材料与方法 1.1 问卷调查、样品采集在山东省金乡县全县范围内随机选取100名大蒜种植户进行问卷调查,以了解不同连作年限大蒜田的化肥和有机肥施用量、鳞茎产量,以及连作障碍表现(如土壤板结、根腐病发病状况)。根据问卷调查结果,于2019年1月采集不同连作年限(< 10 a、15 ~ 20 a和 > 25 a)的代表性土壤(0 ~ 20 cm)样品,进行后续的分析测定。
1.2 研究区概况与试验设计田间试验始于2019年10月,在山东省金乡县化雨镇刘堂村(35°01′N,116°29′E)进行。试验地已连续种植大蒜25 a,根腐病严重,大蒜产量较初始产量降低了约30%,在长期连作大蒜田中具有代表性。土壤类型为潮土,基本理化性质为:pH 8.04,速效氮含量21.08 mg/kg,有效磷含量34.95 mg/kg,速效钾含量337.98 mg/kg,土壤有机质含量仅为11.70 g/kg。
常规有机肥及生物有机肥均由鸡粪腐熟,其中,有机质含量394.6 g/kg,全氮含量17.3 g/kg,全磷含量25.7 g/kg,全钾含量19.3 g/kg。生物有机肥中额外添加了解淀粉芽孢杆菌,有效活菌数大于6亿/g。
试验共设置3个处理,分别为:常规单施化肥(CF)、3.75 t/hm2有机肥(OF)、3.75 t/hm2生物有机肥(BOF)。施用有机肥及生物有机肥时扣除有机肥中的氮磷钾,在等氮磷钾养分的基础上与单施化肥处理进行比较。常规化肥(CF)施用量为N 300 kg/hm2、P2O5 225 kg/hm2、K2O 300 kg/hm2。化肥选用长效尿素(N 46%)、磷酸二铵(N 18%、P2O5 46%)和硫酸钾(K2O 50%)。所有肥料均作为基肥一次性施入,试验地田间管理保持一致。每个处理3个重复(3个小区),每个小区面积50 m2(10 m × 5 m),各小区随机区组排列。大蒜的种植和田间管理采用当地通行的金乡大蒜种植技术规程(T/JXDSZZ002—2020)。
1.3 样品分析与测定大蒜根腐病发病率及产量统计:在大蒜鳞茎收获前,记录根腐病发病情况,大蒜根部变黑腐烂记为发病株。发病率计算公式为:发病率(%)=发病植株数/调查总植株数×100。在蒜薹收获期和鳞茎收获期,各小区随机选取5 m2(2 m × 2.5 m)作为计产单元。该计产单元中随机包括健康株和因发病而死亡的植株,还包括发病但未死亡、仍有部分产量的植株,统一按照面积全部收获测产。
在鳞茎收获期(2020年5月)采用5点取样法,分别采集各小区0 ~ 20 cm土层的土壤,剔除石块和植物根系后混合均匀,用保温箱带回实验室。将采集的土壤样品一部分风干过筛,用于测定土壤有机碳和球囊霉素相关土壤蛋白;一部分用于土壤团聚体分级;另一部分用于酶活性测定和微生物定量分析。
采用鲁如坤[6]的方法对土壤基础理化性质进行测定。土壤有机碳含量采用重铬酸钾外加热法测定;速效氮和全氮含量利用化学分析仪测定;有效磷和全磷含量采用钼锑抗比色法测定;速效钾和全钾含量采用火焰光度法测定。
可溶性有机碳(DOC)经水土质量比5∶1振荡浸提,过0.45 μm滤膜后利用Multi C/N分析仪(Analytik Jena,Multi3100,德国)测定;易氧化有机碳(EOC)通过333 mmol/L高锰酸钾氧化后,分光光度法测定[7];颗粒有机碳(POC)含量采用Cambardella和Elliott[8]的方法测定。
土壤水稳性团聚体利用湿筛法[9]分级:将100 g风干土置于套筛上,筛子由上至下的孔径分别为2、0.25和0.053 mm。将套筛浸入蒸馏水中,使土样浸泡5 min。然后启动湿筛机,套筛按照每分钟30次的频率上下振荡3 min。收集各土筛上的土壤团聚体,通过离心法获得 < 0.053 mm的团聚体。各粒级团聚体烘干后称重。
球囊霉素相关土壤蛋白(Glomalin-related soil protein,GRSP)按照Wright和Upadhyaya[10]的方法进行提取和测定。分别提取总球囊霉素相关土壤蛋白(T-GRSP)和易提取球囊霉素相关土壤蛋白(EE- GRSP),并测定各自含量,两者相减为难提取球囊霉素相关土壤蛋白(DE-GRSP)含量。
土壤DNA的提取和微生物数量测定:土壤典型微生物种群的数量采用实时荧光定量PCR(qPCR)进行检测。采用Fast DNA SPIN Kit试剂盒(MP Biomedicals,Santa Ana,CA)提取土壤DNA,利用LightCycler 480 Instrument 670 (Roche,Switzerland)定量土壤中细菌[11]、真菌[12]、放线菌[13]、芽孢杆菌[14]、伯克氏菌[15]、假单胞菌[16]、尖孢镰刀菌[17]、木贼镰刀菌[18]和腐霉菌[19]的丰度。将含有目标微生物基因片段的标准质粒进行一系列10倍梯度稀释,得到标准曲线,并通过熔解曲线检验扩增的特异性。通过标准曲线计算目标微生物的拷贝数,每个样品重复3次。
脲酶、碱性磷酸酶、β-葡萄糖苷酶和脱氢酶分别采用苯酚钠–次氯酸钠比色法、磷酸苯二钠比色法、对硝基酚比色法和氯化三苯四氮唑(TTC)比色法进行测定[20]。
1.4 数据处理土壤团聚体稳定性指标包括平均重量直径(MWD)、几何平均直径(GMD)、> 0.25 mm团聚体含量(R0.25)和分形维数(D),能够反映土壤结构对施肥等管理措施的响应。其计算公式如下[21-23]:
| $ {\text{MWD}} = \sum\limits_{i = 1}^n {{\text{(}}{x_i}{w_i}{\text{)}}} $ | (1) |
| $ {\text{GND}} = {\text{Exp}}\left[ {\frac{{\sum\limits_{i = 1}^n {{m_i}{\text{ln}}{x_i}} }}{{\sum\limits_{i = 1}^n {{m_i}} }}} \right] $ | (2) |
| $ {R_{0.25}} = \frac{{{{\text{M}}_{\text{T}}} > 0.25}}{{{{\text{M}}_{\text{T}}}}} $ | (3) |
| $ \frac{{M(r < {x_i})}}{{{{\text{M}}_{\text{T}}}}} = {\left\{ {\frac{{{x_i}}}{{{x_{{\text{max}}}}}}} \right\}^{3 - {\text{D}}}} $ | (4) |
式(4)两边取对数可得:
| $ {\text{lg}}\frac{{{\text{M}}(r < {x_i})}}{{{{\text{M}}_{\text{T}}}}} = (3 - D)\lg\left\{ {\frac{{{x_i}}}{{{x_{\max}}}}} \right\} $ | (5) |
上述公式中:xi为i粒级团聚体的平均直径(mm),wi为i粒级团聚体质量占比(%),mi为i粒级团聚体质量(g),MT > 0.25为 > 0.25 mm团聚体质量(g),MT为各粒级团聚体总质量(g),M(r < xi)为粒径小于xi的团聚体质量(g),xmax为团聚体最大平均粒径(mm)。
可蚀性K的计算采用Shirazi和Boersma[24]提出的公式:
| $\begin{array}{c} K=7.9547×\{0.0017+0.0494×\exp[–0.5 \\×(1.675+\log_{10}\text{GMD}/0.6986)^{2}]\}\end{array}$ | (6) |
采用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),邓肯(Duncan)多重检验法检验处理间差异的显著性(P < 0.05),图表中数据为平均值±标准差,利用GraphPad Prism 8.0.2进行数据处理与绘图。
2 结果 2.1 问卷调查及不同连作年限的大蒜土壤样品分析问卷调查结果显示(表 1),随着连作年限的延长,化肥施用量从1.71 t/hm2增加到2.10 t/hm2。不同连作年限的有机肥施用量差别不大,但是施用量较低,仅为0.76 ~ 0.83 t/hm2。尽管化肥的施用量逐年增加,大蒜鳞茎产量并没有相应提高,反而连作超过15 a后产量降低。与短期连作(< 10 a)相比,大蒜连作15 ~ 20 a和 > 25 a时产量分别降低11.38% 和28.79%。另一方面,随着大蒜连作时间的增加,土壤板结和根腐病发病状况越加严重。
|
|
表 1 不同连作年限大蒜田施肥量与田间表现 Table 1 Fertilization and field performance of garlic fields under different continuous cropping years |
土壤有机碳含量的测定结果表明,随着连作年限的延长,土壤总有机碳和可溶性有机碳含量均降低(图 1A、1B)。大蒜连作15 ~ 20 a和 > 25 a的土壤总有机碳含量较连作 < 10 a分别降低14.71% 和21.97%,可溶性有机碳含量则分别降低30.84% 和46.96%。将各连作年限的土壤有机碳含量与大蒜产量进行线性回归分析,结果表明土壤总有机碳和可溶性有机碳均与大蒜产量呈显著正向线性关系(图 1C、1 D)。
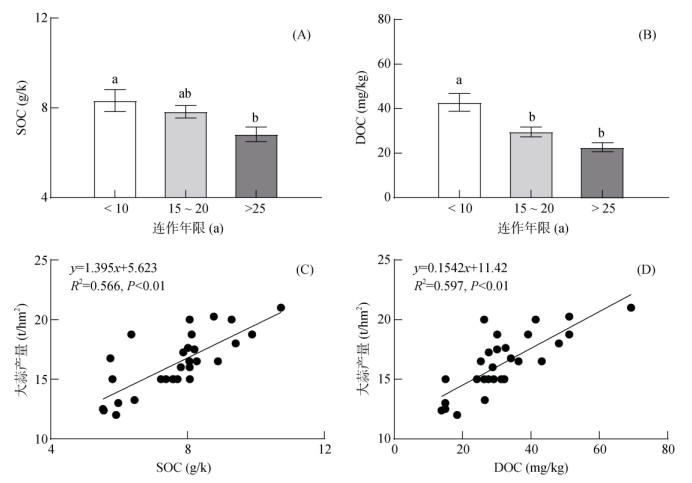
|
(图中小写字母不同表示不同连作年限间差异显著(P < 0.05),下同) 图 1 不同连作年限土壤有机碳含量及其与大蒜产量的关系 Fig. 1 Soil organic carbon content and its relationship with garlic yield under different continuous cropping years |
利用实时荧光定量PCR对土壤特定微生物丰度进行测定。结果表明,常被认为是土壤有益微生物的放线菌、芽孢杆菌、假单胞菌等的拷贝数随连作年限的增加而降低(图 2A)。尖孢镰刀菌、木贼镰刀菌、腐霉菌是大蒜根腐病的主要致病菌,它们的拷贝数随连作年限的增加而增加(图 2B)。
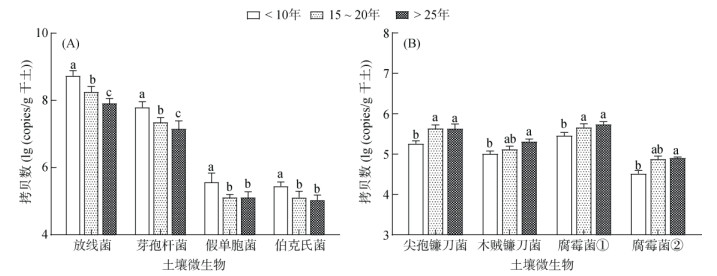
|
(腐霉菌①:Pythium heterothallicum;腐霉菌②:Pythium sylvaticum) 图 2 不同连作年限土壤特定微生物丰度 Fig. 2 Soil specific microorganism abundances under different garlic continuous cropping years |
上述结果表明土壤有机碳的亏缺可能是大蒜连作障碍和减产的关键因素。因此,本研究尝试在长期连作大蒜田中通过施用有机肥及生物有机肥的方式补偿土壤有机碳,以消减大蒜连作障碍。
2.2 有机肥处理对长期连作大蒜土壤总有机碳和活性有机碳含量的影响与常规化肥处理(CF)相比,有机肥(OF)和生物有机肥(BOF)处理的土壤总有机碳含量略有增加,但未达到显著水平(图 3A)。而两个有机肥处理土壤活性有机碳含量则均显著高于CF处理(P < 0.05)。与CF相比,OF和BOF处理的可溶性有机碳含量分别增加24.01% 和35.02%(图 3B);易氧化有机碳含量分别增加22.97% 和36.62%(图 3C);颗粒有机碳含量分别增加16.74% 和39.87%(图 3D)。上述结果表明,施用有机肥是补偿连作大蒜土壤有机碳亏缺的有效措施,其中生物有机肥的补偿效果更佳。
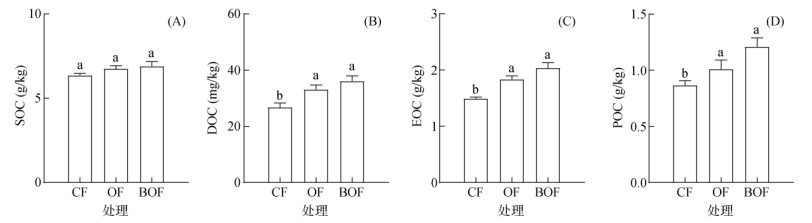
|
(CF:单施化肥处理;OF:普通有机肥处理;BOF:生物有机肥处理。图中小写字母不同表示不同施肥处理间差异显著(P < 0.05)。下同) 图 3 有机肥处理对连作大蒜土壤中总有机碳和活性有机碳的影响 Fig. 3 Effects of organic fertilizers on soil total organic carbon and labile organic carbon under garlic continuous cropping |
与CF相比,OF和BOF处理均增加 > 2 mm团聚体质量占比,BOF处理达显著水平(图 4);CF处理的 > 2 mm团聚体质量占比仅为16.75%,OF和BOF处理分别增至25.66% 和37.68%。有机肥处理在增加 > 2 mm团聚体占比的同时,降低0.25 ~ 0.053 mm和 < 0.053 mm团聚体的质量占比;< 0.25 mm团聚体的比例由CF处理的44.77% 降低至OF处理的34% 和BOF处理的27.8%。
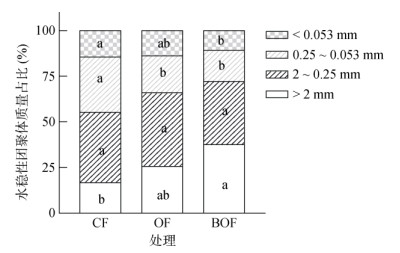
|
图 4 有机肥处理对连作大蒜土壤水稳性团聚体分布的影响 Fig. 4 Effects of organic fertilizers on distribution of soil water-stable aggregates under garlic continuous cropping |
由表 2可知,OF和BOF处理均可显著提高平均重量直径(MWD)、几何平均直径(GMD)和 > 0.25 mm团聚体含量(R0.25)等土壤团聚体稳定性指标;同时分形维数(D)和可蚀性(K)显著降低。
|
|
表 2 有机肥处理对连作大蒜土壤水稳性团聚体稳定性的影响 Table 2 Effects of organic fertilizers on stability of soil water-stable aggregates under garlic continuous cropping |
由表 3可以看出,OF和BOF处理均可显著提高易提取球囊霉素相关土壤蛋白(EE-GRSP)含量,较CF处理分别提高33.33% 和56.41%;难提取球囊霉素相关土壤蛋白(DE-GRSP)和总球囊霉素相关土壤蛋白(T-GRSP)含量也显著升高。EE-GRSP/T-GRSP则表现为在各处理中没有显著变化。
|
|
表 3 有机肥处理对连作大蒜土壤球囊霉素相关土壤蛋白的影响 Table 3 Effects of organic fertilizers on glomalin-related soil protein (GRSP) under garlic continuous cropping |
OF和BOF处理下,土壤细菌拷贝数分别是CF处理的1.59倍和1.92倍,而真菌拷贝数在各处理间没有显著差异(图 5A)。放线菌、芽孢杆菌、假单胞菌的拷贝数在OF和BOF处理中均有所提高,其中BOF处理达显著水平;与CF相比,BOF处理的放线菌、芽孢杆菌和假单胞菌丰度分别增加89.74%、95.24% 和106.53%(图 4B)。但是,施用有机肥不影响伯克氏菌的丰度(图 5B)。OF和BOF处理的尖孢镰刀菌和木贼镰刀菌数量较CF处理均降低,并且BOF处理中最低(图 5C);而腐霉菌属的病原微生物如Pythium heterothallicum和Pythium sylvaticum的数量不受有机肥施用的影响(图 5C)。上述结果表明有机肥和生物有机肥处理均可增加土壤有益微生物的数量,同时减少病原微生物的数量。
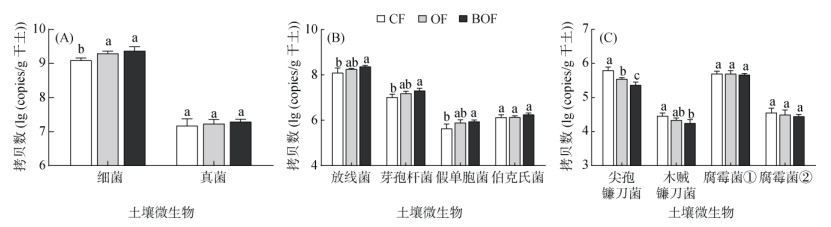
|
(腐霉菌①:Pythium heterothallicum;腐霉菌②:Pythium sylvaticum) 图 5 有机肥处理对连作大蒜土壤中特定微生物丰度的影响 Fig. 5 Effects of organic fertilizers on abundances of soil specific microorganisms under garlic continuous cropping |
与CF相比,OF和BOF处理均显著提高了大蒜土壤β-葡萄糖苷酶和脱氢酶活性,β-葡萄糖苷酶活性分别提高98.23% 和115.5%(图 6A),脱氢酶活性分别提高37.3% 和49.31%(图 6B)。同时,OF和BOF处理的土壤脲酶和碱性磷酸酶活性也均高于CF,其中BOF处理达显著差异(P < 0.05),较CF分别提高20.66% 和32.42%(图 6C、6D)。
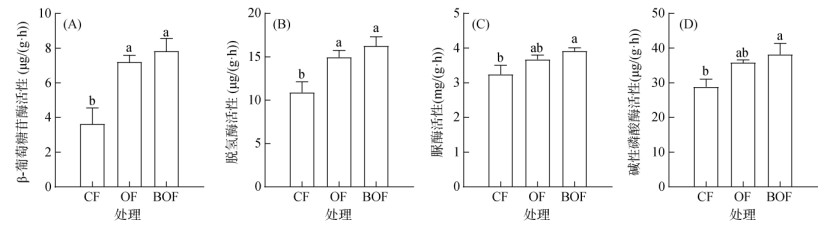
|
图 6 有机肥处理对连作大蒜土壤酶活性的影响 Fig. 6 Effects of organic fertilizers on enzyme activities under garlic continuous cropping |
CF处理的根腐病发病率高达26.67%,严重影响大蒜产量;而OF和BOF处理的根腐病发病率分别降低至18.67% 和15%(图 7A)。与CF相比,OF和BOF处理均显著提高蒜薹产量,分别增产16.64% 和31.02%(图 7B)。OF和BOF处理的鳞茎产量较CF分别增加12.55% 和18.79%(图 7C)。
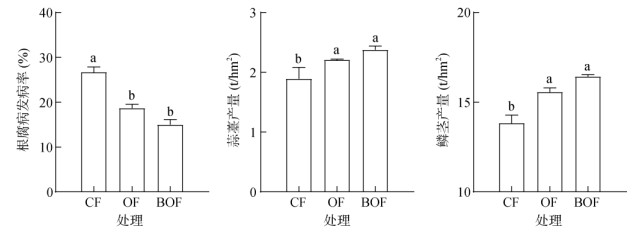
|
图 7 有机肥处理对长期连作大蒜根腐病和产量的影响 Fig. 7 Effects of organic fertilizers on garlic root rot and yield under garlic continuous cropping |
由问卷调查结果可知,大蒜连作障碍主要表现为土壤板结和根腐病加剧,最终反映在大蒜产量的显著降低(表 1)。根据问卷调查结果,采集不同连作年限(< 10 a、15 ~ 20 a和 > 25 a)的代表性土壤样品,对其进行测定与分析。结果表明,不论是土壤总有机碳还是可溶性有机碳含量,均随着大蒜连作时间的延长而降低,可溶性有机碳的下降幅度更大(图 1)。这表明在连作大蒜土壤中,有机碳尤其是活性有机碳净损耗。同时,回归分析结果表明,大蒜产量与土壤总有机碳和可溶性有机碳含量均呈显著正相关关系(图 1)。活性有机碳是土壤微生物重要的能量来源,影响微生物的生长与活动。本研究中,土壤放线菌、芽孢杆菌、假单胞菌和伯克氏菌等有益微生物的丰度随连作年限的增加而降低;与此相反,尖孢镰刀菌、木贼镰刀菌和腐霉菌等致病菌的丰度升高(图 2)。综上所述,说明土壤有机碳亏缺是引起大蒜减产和连作障碍的重要因子。土壤有机碳亏缺与常年一致的种植管理措施密切相关。大蒜收获时,整个植株连同根系从土壤中移除,几乎没有作物残茬返还土壤。另一方面,在国家或者地方推行的标准化大蒜种植管理技术规程中,侧重于化肥的施用,忽视有机物料的投入。上述管理措施导致土壤有机碳连年被消耗,却没有得到相应的补充,最终形成了土壤有机碳亏缺的特殊连作体系。因此,本研究尝试通过施用有机肥以补偿土壤有机碳,进而消减大蒜连作障碍。
3.2 有机肥处理对大蒜连作障碍的消减效果及作用机理有机肥的施用能增加外源碳的输入,是土壤有机碳的重要来源。活性有机碳是土壤有机碳的不稳定组分,有机肥施用显著提高连作大蒜土壤可溶性有机碳、易氧化有机碳、颗料有机碳等活性有机碳含量(图 3)。这与前人在黄绵土和红壤上施用有机肥的研究结果一致[25-26]。可能是施入有机肥后,促进微生物活动,加速有机质的周转,从而释放更多的活性有机碳。有机肥施入后,较高的土壤有机碳含量能够通过改善土壤物理结构、提高土壤保水能力、促进土壤微生物的活动和提供矿质营养元素等方式促进作物生长,进而提高作物产量。Meta分析结果显示,与单施化肥相比,施用有机改良剂使土壤有机碳含量提高38%,作物产量平均提高27%[27]。宇万太等[28]研究发现施用猪粪有机肥能显著提高土壤有机碳含量,且作物产量与有机碳含量呈显著正相关关系。已有的研究表明,在一定的阈值范围内,作物产量随有机碳含量的增加而增加[29]。Oldfield等[29]整合分析全球数据发现,2% 是土壤有机碳含量的临界阈值,土壤有机碳由1% 提高至2% 时,小麦和玉米的产量分别平均增加了10% 和5%。本研究中长期连作大蒜土壤有机碳含量仅为0.64%,尽管施用有机肥后土壤有机碳含量略有增加(未达到统计显著差异),但鳞茎产量增加12.55% ~ 18.79%(图 7)。其他研究也表明,在土壤有机碳和土壤肥力低的华北潮土和西北荒漠土上,长期化肥配施有机肥能明显增加土壤有机碳含量和作物产量[30]。但是对于土壤有机碳背景值较高的土壤,无机有机肥配施对于产量提高的效果有限。比如,在土壤有机碳含量较高的东北黑土中长期施用氮磷钾化肥就能维持较高的玉米产量,在此基础上配施农家肥或商用有机肥并未使玉米产量显著提高[31]。
长期连作大蒜土壤严重板结,表明土壤结构恶化、透气性变差,不利于作物生产。施用有机肥后,> 0.25 mm大团聚体占比增加、团聚体稳定性提高(图 4),土壤结构得到改善,这与前人在水稻、小麦等作物中的研究结果一致[32]。这主要是因为有机肥的施用引入外源有机碳,为土壤团聚体的形成提供了有机胶结剂,有利于土壤团聚。稳定的团聚体结构促进了对有机碳的物理保护。有研究表明红壤水稻土的大团聚体比例和稳定性与土壤有机碳含量正相关[33]。另一方面,球囊霉素相关土壤蛋白(GRSP)是丛枝菌根真菌产生的一种特殊糖蛋白,能够将土壤颗粒黏结形成土壤团聚体,是重要的生物胶结物质。许多研究表明,GRSP含量与土壤团聚体平均重量直径等稳定性指标呈正相关[34-35]。因此,连作大蒜土壤中施入有机肥后GRSP含量的增加(表 3),也可以部分解释大团聚体比例和团聚体稳定性的提高。
有机肥可为土壤微生物活动提供能源,进而影响微生物群落结构与功能。本研究中,施用有机肥后土壤细菌丰度升高,而真菌丰度没有明显变化(图 5)。可能是因为有机肥含有大量半纤维素和蛋白质等简单有机物,容易被细菌分解利用,而真菌倾向于利用复杂有机物[36]。施用有机肥后真菌的响应速度通常较慢。伯克氏菌和假单胞菌的丰度在施用有机肥连作大蒜土壤中升高(图 5)。二者均属于变形菌门,是富营养型细菌即r策略微生物,适宜生长在土壤肥力较高的环境中。Sun等[37]研究表明,变形菌相对丰度与土壤有机碳含量呈显著正相关性。有机肥施用后土壤有机碳含量提高,有利于伯克氏菌和假单胞菌的生长。有机肥处理的放线菌和芽孢杆菌丰度较单施化肥处理提高,与前人研究结果一致[38]。上述常被定义为有益微生物的丰度升高有利于其与病原菌竞争生态位或营养物质,从而抑制病原菌的生长,导致尖孢镰刀菌和木贼镰刀菌等大蒜主要致病菌的丰度降低(图 5)。
土壤酶对土壤环境变化敏感,其活性能够指示土壤生物活性和生态功能特征。连作大蒜土壤中化肥有机肥配施可以提高参与碳循环(β-葡萄糖苷酶和脱氢酶)、氮循环(脲酶)、磷循环(磷酸酶)的酶活性(图 6)。有机肥的投入增加了可被土壤微生物分解利用的活性碳源,刺激微生物活动产生相应的酶,导致土壤酶活性提高。
4 结论在连续种植大蒜超过15 a的土壤中,总有机碳和可溶性有机碳含量随连作年限的增加而降低。同时,土壤板结、根腐病发生和产量降低等现象逐渐加剧。大蒜产量与土壤总有机碳和可溶性有机碳的水平呈显著正相关关系。土壤有机碳亏缺是引起大蒜连作障碍的重要因子。在此基础上施用有机肥能够显著增加土壤可溶性有机碳、易氧化有机碳和颗粒有机碳等活性有机碳的含量。另一方面,补充有机肥能促进 > 0.25 mm大团聚体的形成,提高平均重量直径和几何平均直径等土壤团聚体稳定性指标。有机肥处理的土壤放线菌、芽孢杆菌和假单胞菌的丰度升高,而尖孢镰刀菌和木贼镰刀菌等致病菌的丰度受到抑制,有利于土壤微生物群落结构的优化以拮抗病原微生物。有机肥处理的球囊霉素相关土壤蛋白含量以及碳、氮、磷循环相关土壤酶的活性也有不同程度的升高。因此,施用有机肥以补充土壤有机碳是消减大蒜连作障碍的有效措施。
| [1] |
卢维宏, 张乃明, 包立, 等. 我国设施栽培连作障碍特征与成因及防治措施的研究进展[J]. 土壤, 2020, 52(4): 651-658 DOI:10.13758/j.cnki.tr.2020.04.001 (  0) 0) |
| [2] |
董金龙, 徐烨红, 全智, 等. 中国设施种植土壤可持续利用的难点与应对策略[J]. 土壤学报, 2024, 61(6): 1467-1480 (  0) 0) |
| [3] |
蔡祖聪, 张金波, 黄新琦, 等. 强还原土壤灭菌防控作物土传病的应用研究[J]. 土壤学报, 2015, 52(3): 469-476 (  0) 0) |
| [4] |
王文丽, 金涵, 从炳成, 等. 复合微生物菌剂对番茄青枯病的生防效应[J]. 南京农业大学学报, 2022, 45(6): 1174-1182 (  0) 0) |
| [5] |
FAOSTAT. Crops and livestock products[OL]. [2023-3-14]. http://faostat.fao.org/
(  0) 0) |
| [6] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科学技术出版社, 北京, 2000
(  0) 0) |
| [7] |
张慧, 王斌, 孙九胜, 等. 化肥减量配施有机肥对花生土壤有机碳及其组分的影响[J]. 土壤, 2024, 56(2): 333-341 DOI:10.13758/j.cnki.tr.2024.02.012 (  0) 0) |
| [8] |
Cambardella C A, Elliott E T. Particulate soil organic-matter changes across a grassland cultivation sequence[J]. Soil Science Society of America Journal, 1992, 56(3): 777-783 DOI:10.2136/sssaj1992.03615995005600030017x (  0) 0) |
| [9] |
Elliott E T. Aggregate structure and carbon, nitrogen, and phosphorus in native and cultivated soils[J]. Soil Science Society of America Journal, 1986, 50(3): 627-633 DOI:10.2136/sssaj1986.03615995005000030017x (  0) 0) |
| [10] |
Wright S F, Upadhyaya A. Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J]. Soil Science, 1996, 161(9): 575-586 DOI:10.1097/00010694-199609000-00003 (  0) 0) |
| [11] |
Biddle J F, Fitz-Gibbon S, Schuster S C, et al. Metagenomic signatures of the Peru Margin subseafloor biosphere show a genetically distinct environment[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(30): 10583-10588 (  0) 0) |
| [12] |
Manter D K, Vivanco J M. Use of the ITS primers, ITS1F and ITS4, to characterize fungal abundance and diversity in mixed-template samples by qPCR and length heterogeneity analysis[J]. Journal of Microbiological Methods, 2007, 71(1): 7-14 DOI:10.1016/j.mimet.2007.06.016 (  0) 0) |
| [13] |
Pfeiffer S, Pastar M, Mitter B, et al. Improved group- specific primers based on the full SILVA 16S rRNA gene reference database[J]. Environmental Microbiology, 2014, 16(8): 2389-2407 DOI:10.1111/1462-2920.12350 (  0) 0) |
| [14] |
Wu X Y, Walker M J, Hornitzky M, et al. Development of a group-specific PCR combined with ARDRA for the identification of Bacillus species of environmental significance[J]. Journal of Microbiological Methods, 2006, 64(1): 107-119 DOI:10.1016/j.mimet.2005.04.021 (  0) 0) |
| [15] |
Drigo B, van Veen J A, Kowalchuk G A. Specific rhizosphere bacterial and fungal groups respond differently to elevated atmospheric CO2[J]. The ISME Journal, 2009, 3(10): 1204-1217 DOI:10.1038/ismej.2009.65 (  0) 0) |
| [16] |
Bergmark L, Poulsen P H B, Abu Al-Soud W, et al. Assessment of the specificity of Burkholderia and Pseudomonas qPCR assays for detection of these Genera in soil using 454 pyrosequencing[J]. FEMS Microbiology Letters, 2012, 333(1): 77-84 DOI:10.1111/j.1574-6968.2012.02601.x (  0) 0) |
| [17] |
Jiménez-Fernández D, Montes-Borrego M, Navas-Cortés J A, et al. Identification and quantification of Fusarium oxysporum in planta and soil by means of an improved specific and quantitative PCR assay[J]. Applied Soil Ecology, 2010, 46(3): 372-382 DOI:10.1016/j.apsoil.2010.10.001 (  0) 0) |
| [18] |
Mishra P K, Fox R T V, Culham A. Development of a PCR-based assay for rapid and reliable identification of pathogenic Fusaria[J]. FEMS Microbiology Letters, 2003, 218(2): 329-332 DOI:10.1111/j.1574-6968.2003.tb11537.x (  0) 0) |
| [19] |
Schroeder K L, Okubara P A, Tambong J T, et al. Identification and quantification of pathogenic Pythium spp. from soils in eastern Washington using real-time polymerase chain reaction[J]. Phytopathology, 2006, 96(6): 637-647 DOI:10.1094/PHYTO-96-0637 (  0) 0) |
| [20] |
关松荫. 土壤酶及其研究法[M].
农业出版社, 北京, 1986
(  0) 0) |
| [21] |
Tyler S W, Wheatcraft S W. Fractal scaling of soil particle-size distributions: Analysis and limitations[J]. Soil Science Society of America Journal, 1992, 56(2): 362-369 DOI:10.2136/sssaj1992.03615995005600020005x (  0) 0) |
| [22] |
Karami A, Homaee M, Afzalinia S, et al. Organic resource management: Impacts on soil aggregate stability and other soil physico-chemical properties[J]. Agriculture, Ecosystems & Environment, 2012, 148: 22-28 (  0) 0) |
| [23] |
杨培岭, 罗远培, 石元春. 用粒径的重量分布表征的土壤分形特征[J]. 科学通报, 1993, 38(20): 1896-1899 DOI:10.3321/j.issn:0023-074X.1993.20.010 (  0) 0) |
| [24] |
Shirazi M A, Boersma L. A unifying quantitative analysis of soil texture[J]. Soil Science Society of America Journal, 1984, 48(1): 142-147 DOI:10.2136/sssaj1984.03615995004800010026x (  0) 0) |
| [25] |
李忠徽, 魏彬萌, 刘丹, 等. 黄绵土中碳酸钙含量和有机肥施用对土壤有机碳组分及CO2排放的影响[J]. 环境科学学报, 2018, 38(6): 2498-2505 (  0) 0) |
| [26] |
关强, 蒲瑶瑶, 张欣, 等. 长期施肥对水稻根系有机酸分泌和土壤有机碳组分的影响[J]. 土壤, 2018, 50(1): 115-121 DOI:10.13758/j.cnki.tr.2018.01.016 (  0) 0) |
| [27] |
Luo G W, Li L, Friman V P, et al. Organic amendments increase crop yields by improving microbe-mediated soil functioning of agroecosystems: A meta-analysis[J]. Soil Biology and Biochemistry, 2018, 124: 105-115 DOI:10.1016/j.soilbio.2018.06.002 (  0) 0) |
| [28] |
宇万太, 姜子绍, 马强, 等. 施用有机肥对土壤肥力的影响[J]. 植物营养与肥料学报, 2009, 15(5): 1057-1064 DOI:10.3321/j.issn:1008-505X.2009.05.011 (  0) 0) |
| [29] |
Oldfield E E, Bradford M A, Wood S A. Global meta-analysis of the relationship between soil organic matter and crop yields[J]. Soil, 2019, 5(1): 15-32 DOI:10.5194/soil-5-15-2019 (  0) 0) |
| [30] |
He H, Peng M W, Lu W D, et al. Commercial organic fertilizer substitution increases wheat yield by improving soil quality[J]. Science of The Total Environment, 2022, 851: 158132 DOI:10.1016/j.scitotenv.2022.158132 (  0) 0) |
| [31] |
Yang J M, Jiang R, Zhang H W, et al. Modelling maize yield, soil nitrogen balance and organic carbon changes under long-term fertilization in Northeast China[J]. Journal of Environmental Management, 2023, 325: 116454 DOI:10.1016/j.jenvman.2022.116454 (  0) 0) |
| [32] |
张贺, 杨静, 周吉祥, 等. 连续施用土壤改良剂对砂质潮土团聚体及作物产量的影响[J]. 植物营养与肥料学报, 2021, 27(5): 791-801 (  0) 0) |
| [33] |
邸佳颖, 刘小粉, 杜章留, 等. 长期施肥对红壤性水稻土团聚体稳定性及固碳特征的影响[J]. 中国生态农业学报, 2014, 22(10): 1129-1138 (  0) 0) |
| [34] |
王国禧, 王萍, 刘亚龙, 等. 球囊霉素在土壤团聚体中的分布特征及影响因素的Meta分析[J]. 土壤学报, 2024, 61(4): 1147-1155 (  0) 0) |
| [35] |
Liu H F, Wang X K, Liang C T, et al. Glomalin-related soil protein affects soil aggregation and recovery of soil nutrient following natural revegetation on the Loess Plateau[J]. Geoderma, 2020, 357: 113921 DOI:10.1016/j.geoderma.2019.113921 (  0) 0) |
| [36] |
吴宪, 胡菏, 王蕊, 等. 化肥减量和有机替代对潮土微生物群落分子生态网络的影响[J]. 土壤学报, 2022, 59(2): 545-556 (  0) 0) |
| [37] |
Sun R B, Zhang X X, Guo X S, et al. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw[J]. Soil Biology and Biochemistry, 2015, 88: 9-18 DOI:10.1016/j.soilbio.2015.05.007 (  0) 0) |
| [38] |
刘佳, 陈晓芬, 刘明, 等. 长期施肥对旱地红壤细菌群落的影响[J]. 土壤学报, 2020, 57(2): 468-478 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Forestry, Nanjing Forestry University, Nanjing 210037, China;
4. Jining Academy of Agricultural Sciences, Jining, Shandong 272100, China;
5. Science and Technology Bureau of Jinxiang County (Garlic Research Institute), Jining, Shandong 272200, China;
6. University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, China
 2025, Vol. 57
2025, Vol. 57


