2. 中国科学院大学, 北京 100049;
3. 上海市生物医药技术研究院, 上海 200032;
4. 西南大学资源与环境学院, 重庆 400716;
5. 中国科学院分子植物卓越创新中心, 上海 200032
全氟和多氟烷基化合物(Per-and polyfluoroalkyl substances, PFASs)是含有多个C-F键的有机化合物,是一种双疏表面活性剂,广泛应用于消防泡沫、防水衣物和不粘锅具等产品中[1]。PFASs难降解,在土壤和水体中长时间积累,人体一旦摄入就将持续存在。已知的几种PFASs因其免疫毒性、肝脏毒性、生殖毒性、神经毒性、发育毒性带来的环境健康风险,已被禁用。例如,2009年禁用全氟辛烷磺酸(PFOS),2019年禁用全氟辛酸(PFOA)[2]。虽然大量PFASs替代物投入生产和使用,但大多数替代物尚未进行毒理学评估,这在国际上引起了热烈讨论和争议[3]。
6∶2氯化多氟烷基醚磺酸(6∶2 Cl-PFAES,商业上称为F-53B)作为抑雾剂已被中国镀铬行业广泛应用数十年,也是人类体内最持久的PFASs之一[4],但作为PFOS的替代品,其土壤生态毒性作用方面的研究还很有限。全氟丁酸(PFBA,四碳,类似于PFOA,在中国和其他国家取代PFOA[5])可以在与脂肪酸相似的亲和力的位点上与人血清白蛋白非共价结合[6]。Domingo等[7]报道,饮用水处理工艺降低了水中除PFBA外的所有全氟化合物的浓度。关于短链PFASs的毒性,目前存在争议。多年来欧洲人口血液中短链PFASs水平开始上升[8],由此需要更多的研究来阐明其毒性影响,服务于监管决策。
白符跳(Folsomia candida)在土壤生物研究中占有重要的地位,过去数十年一直被用作标准化毒性试验的模式生物[9]。本研究聚焦白符跳解毒应激和生殖两大靶向机制,选定解毒应激的敏感靶标基因CYP6N3V2和CYP6N4V1,以及影响白符跳生殖的敏感靶标基因CTSL、VMO1和Vitrec,开展PFASs急性毒性试验和F-53B亚慢性毒性试验。急性毒性试验旨在研究PFASs诱导下白符跳氧化应激机制以及繁殖相关基因的瞬时表达差异;亚慢性毒性试验是在急性毒性基础上,聚焦于对白符跳毒性更大的PFASs替代物F-53B,靶标生殖相关基因,进行生命周期过程中对繁殖毒性影响的探讨。通过研究,以期为PFASs生态毒性评估和早期预警提供方法和理论依据。
1 材料与方法 1.1 PFASs染毒饲料配制全氟辛酸(PFOA,C8HF15O2,CAS 335-67-1,纯度≥98%)和全氟丁酸(PFBA,C4HF7O2,CAS 375-22-4,纯度≥98%)从Aladdin试剂公司(中国上海)获得;6∶2氯化多氟醚磺酸盐(F-53B,C8HClF16O4SK,CAS 73606-19-6,纯度≥99%)购自Synica有限公司。
分别配制浓度为100 mg/L的PFOA、PFBA和F-53B溶液,各取10 mL加入10 mg酵母中(安琪酵母有限公司,中国),搅拌均匀,于–50 ℃冷冻干燥,研磨混匀,得到含100 mg/kg(本课题组前期相关研究结果PFASs的半数致死浓度LD50)PFOA、PFBA、F-53B的染毒酵母。
同理,配制不同浓度梯度(0、20、40、80、160 mg/kg)的F-53B染毒酵母,备用。
1.2 供试跳虫供试白符跳(Folsomia candida)源自丹麦奥胡斯大学,于本实验室稳定饲养超过14年。饲养方法:培养于含石膏和活性炭(8∶1,w/w)基质的9 cm培养皿中,每周喂食酵母和超纯水2次。饲养条件:75% 相对湿度、温度(20±2)℃、8 h∶16 h(光/暗)光照。
白符跳同步化(synchronized):每培养皿中加入200 ~ 300头成虫,加入15 mg酵母喂养9 ~ 10 d,移出虫卵,选择孵化1 ~ 3 d的幼虫,继续培养9 ~ 12 d备用[10]。
1.3 染毒培养PFASs急性毒性试验:将同步化的成虫200 ~ 300头放入新的石膏培养基中,喂食100 mg/kg PFOA、PFBA、F-53B染毒酵母,设置空白对照(CK),共4个处理,每处理4次重复,于上述条件下培养48 h后,将白符跳转移至含0.5 mL TRIZOL的2 mL离心管中,–80 ℃保存、待测。
F-53B亚慢性毒性试验:将同步化的200 ~ 300头白符跳幼虫放入新的石膏培养基中,喂食0、20、40、80、160 mg/L F-53B染毒酵母,共5个处理,每处理4次重复,于上述条件培养28 d后,将白符跳转移至含0.5 mL TRIZOL的2 mL离心管中,–80 ℃保存、待测。
1.4 RNA提取取上述保存于–80 ℃的试验用虫,65 Hz匀浆40 s,重复3次,利用RNasey试剂盒(RNeasy Mini Kit, Qiagen, Valencia, CA)提取白符跳总RNA,抽提步骤参照产品说明书。
1.5 cDNA反转录通过天根FastQuant cDNA第一链合成试剂盒(KR106-180123, FastQuant RT Kit (With gDNase))对上述抽提的总RNA进行cDNA反转录,步骤参照该产品说明书。
1.6 实时荧光聚合酶链式反应(Real-time PCR)以反转录获得的cDNA为模板,对跳虫体内细胞色素P450单加氧酶(CYP6N3V2、CYP6N4V1)、组织蛋白酶L(CTSL)、卵黄蛋白受体(Vitrec)、卵黄膜外层蛋白(VMO1)mRNA量的变化进行分析。反应条件如下:上游(Forward)引物(10 μm/L)和下游(Reverse)引物(10 μm/L)各0.5 μL,Genious 2×SYBR Green Fast Qpcr Mix (No ROX) 10 μL,cDNA模板2 μL,用RNase-free水补充到20 μL。反应程序:95 ℃ 15 s,60 ℃ 15 s,72 ℃ 45 s,40个循环。仪器为罗氏诊断(Roche Diagnostics International AG)Light Cycler® 96 Real-time PCR System。同时检测内参基因(β-actin),3次重复。模板和内参基因引物序列如表 1。
|
|
表 1 用于Real-time PCR试验的引物 Table 1 Primers used for real-time PCR analysis |
各基因mRNA的变化采用与内参β-Actin相对量化表达进行统计。qPCR计算原理:
| $\begin{array}{l} \Delta \mathrm{Ct}_{\text {实验组 }}=\mathrm{Ct}_{\text {目的基因 }}-\mathrm{Ct}_{\text {内参 }}\\ \Delta \mathrm{Ct}_{\text {对照组 }}=\mathrm{Ct}_{\text {目的基因 }}-\mathrm{Ct}_{\text {内参 }} \\ \Delta \Delta \mathrm{Ct}=\Delta \mathrm{Ct}_{\text {实验组 }}-\Delta \mathrm{Ct}_{\text {对照组 }}\\ 表达量差异 =2^{-\Delta \Delta \mathrm{Ct}} \end{array} $ |
处理间的基因表达差异2–ΔΔCt平均数的显著性检验采用单因素方差分析。
2 结果与分析 2.1 PFASs急性毒性试验的mRNA诱导表达量 2.1.1 氧化应激相关基因经48 h PFOA、PFBA、F-53B染毒酵母饲料喂养后,白符跳体内两种细胞色素P450单加氧酶基因(CYP6N3V2、CYP6N4V1) mRNA转录水平呈现不同规律(图 1)。与对照相比,3种PFASs处理下,CYP6N3V2表达均上调,依次为PFOA 2.23倍、PFBA 1.87倍、F-53B 11.07倍,其中,F-53B处理下达到显著水平。CYP6N4V1基因表达则表现为F-53B暴露下显著上调4.94倍。
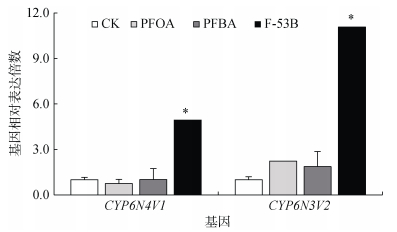
|
(* 表示与对照比较差异达P < 0.05显著水平,下图同) 图 1 急性毒性试验(48 h)中PFASs对白符跳氧化应激相关基因表达的影响 Fig. 1 Expression of genes related to Folsomia candida oxidative stress in PFASs acute toxicity test (48 h) |
经48 h PFOA、PFBA、F-53B染毒酵母饲料喂养后,白符跳体内组织蛋白酶L(CTSL)、卵黄蛋白受体(Vitrec)、卵黄膜外层蛋白(VMO1)基因mRNA转录水平呈现不同规律(图 2)。其中3种PFASs处理下,CTSL表达受到显著抑制,下调情况分别为PFOA 36%、PFBA 61%、F-53B 85%。PFOA一定程度上刺激Vitrec和VMO1的表达,相比于对照组,分别提高了12%、11%;而PFBA处理下,白符跳VMO1的表达受到抑制,下降了24%。但总体而言,3种PFASs处理下Vitrec和VMO1的表达较对照组统计学上无显著性差异。
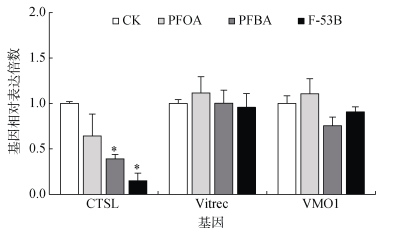
|
图 2 急性毒性试验(48 h)中PFASs对白符跳生殖相关基因表达的影响 Fig. 2 Expression of genes associated with Folsomia candida reproduction in acute toxicity test of PFASs (48 h) |
喂食含F-53B浓度梯度酵母饲料28 d后,F-53B 160 mg/kg处理组的CTSL mRNA表达较对照处理组显著降低89.9% (图 3);20、40、80 mg/kg F-53B处理组与对照间无显著差异。
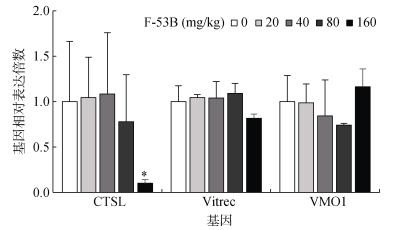
|
图 3 亚慢性毒性试验(28 d)中F-53B对白符跳生殖相关基因表达的影响 Fig. 3 Expression of genes associated with Folsomia candida reproduction in F-53B subchronic toxicity test (28 d) |
喂食含F-53B浓度梯度酵母饲料28 d后,白符跳Vitrec mRNA的表达量随F-53B含量的上升无明显变化,当F-53B浓度为160 mg/kg时,Vitrec表达量降低了18.4%,但差异不显著(图 3)。
2.2.3 VMO1 mRNA诱导表达量喂食含F-53B浓度梯度酵母饲料28 d后,白符跳VMO1 mRNA的表达量随F-53B含量的上升先降低后升高。20、40、80 mg/kg F-53B处理组分别相较于对照组降低1.4%、15.8% 和25.8%;当F-53B浓度为160 mg/kg时,VMO1表达量则提高了16.3%,但差异均不显著(图 3)。
3 讨论本研究首次以土壤小节肢动物白符跳为研究对象,评估了全氟化合物及其替代物对其体内应激相关基因激活与生殖相关基因表达的影响。研究共涉及5个基因,包括细胞色素P450单加氧酶(CYP6N3V2、CYP6N4V1)、组织蛋白酶L(CTSL)、卵黄蛋白受体(Vitrec)和卵黄膜外层蛋白(VMO1)。研究结果表明,白符跳体内相关基因mRNA转录水平能被外界环境中的PFASs所诱导或抑制。其中,F-53B对氧化应激相关基因CYP6N3V2、CYP6N4V1和繁殖相关基因CTSL的影响最大,与对照组相比,CYP6N4V1、CYP6N3V2基因的表达量大幅上调(4.94倍和11.1倍),CTSL大幅下调(0.15倍)。
基因的差异调节是压力导致内环境稳态破坏的早期预警信号,当应对变化的环境,它先于蛋白质翻译和代谢物的生物合成[12]。昆虫细胞色素P450酶在昆虫体内执行许多重要功能,包括蜕皮激素和保幼激素的合成与分解、各种天然或人工合成的外源化合物的代谢[13]。细胞色素P450在生物体内的多样性构成了昆虫对环境变化的适应。CYP6家族是昆虫特异性的家族,参与外源有机化学物质的生物转化,在药物的代谢中起着重要作用[14],如杀虫剂和植物毒素。果蝇CYP6基因簇可受巴比妥诱导[15]。F-53B显著刺激CYP6N4V1、CYP6N3V2基因的表达,表明F-53B处理下,白符跳解毒和应激反应的需求增加,两种CYP6基因可能在白符跳代谢解毒过程中发挥重要的作用。CYP6N4V1的转录水平通常随暴露水平的增加而增加,如菲和镉[16]、城市垃圾填埋场土壤[17]、醚菊酯[11]暴露环境下,CYP6N3V2和CYP6N4V1的表达也增加。
CTSL是重要的消化蛋白酶,与昆虫的变态和蜕皮有关。CTSL基因沉默后,南方小花蝽(Orius strigicollis)的发育显著延长,体长和体重显著下降[18]。此外,组织蛋白酶与胚胎发育有关。Matsumoto等[19]发现CTSL参与了玉米象(Sitophilus zeamais)卵的成熟过程;Fagotto[20]在非洲钝缘蜱(Ornithodoros moubata)卵中检测到CTSL基因在胚胎发育过程中起着降解卵黄蛋白的作用。对CTSL在七星瓢虫雌虫滞育的研究中发现[21],抑制CTSL基因的表达可导致脂肪酸合成酶相关基因表达降低,从而抑制脂质积累,并进一步影响发育。崔攀[22]也发现CTSL通过影响昆虫对脂肪的利用,干扰南方小花蝽的发育和繁殖。Sun等[23]发现组织蛋白酶L可调控家蚕变态和脂肪体解离过程。本试验中,PFASs处理下白符跳CTSL基因表达显著降低,推测PFASs可能干扰了白符跳的脂质积累、变态、蜕皮及胚胎发育等过程,从而引发发育和繁殖毒性。其中F-53B对CTSL的干扰程度最大,表明其对白符跳生长、发育和生殖的不利影响更为严重。不同F-53B浓度处理下,CTSL表现出明显的剂量-效应关系,即随着F-53B浓度的增加,CTSL受抑制程度显著加剧,最高浓度下CTSL表达仅为对照组的1/10。表明F-53B对白符跳的生长、发育和繁殖的干扰随F-53B浓度的增加而加剧,高浓度下抑制作用最为明显。
VMO1蛋白存在于卵的外层,也即卵黄膜中,是卵黄和外界环境之间的屏障,通过在卵黄外形成纤维层屏障以防止细菌感染,与卵形成[24]有关。VMO1在母鸡雌性生殖道中的组织和细胞特异性差异表达是对雌激素、蜕皮及其靶miRNA的响应,其在雌激素应答和蜕皮过程中的输卵管形态发生中起重要作用[25]。F-53B存在下VMO1被持续抑制,白符跳卵的形成过程受到干扰,与预期结果一致。但当F-53B浓度继续增加至160 mg/kg,白符跳体内的VMO1表达反而升高。
本研究对生殖相关的Vitrec基因也进行了研究,因为生殖是最重要的生态利益,在经典生态毒理学研究中有涉及。当F-53B浓度达到160 mg/kg时,白符跳Vitrec基因表达较对照组降低18.4%,Vitrec表达量降低可能预示着对生殖的不利影响。卵黄蛋白受体在卵黄蛋白运输到卵子及在卵巢成熟过程中发挥作用[26],Vitrec是卵黄蛋白发育为卵母细胞的必需蛋白[27]。降低卵黄蛋白原Vitrec的mRNA水平可影响蝗虫卵巢生育[28],具体表现为产卵量和孵化率显著降低,从而达到害虫防治的目的。类似的研究还包括秀丽隐杆线虫[29]、家蚕[30]等。这与本课题研究前期试验结果一致。
本研究聚焦于土壤白符跳解毒应激和生殖两大敏感靶标,CYP6N3V2、CYP6N4V1是解毒应激的敏感靶标基因,而CTSL、VMO1和Vitrec是影响白符跳生殖的敏感靶标基因。与传统生测指标相比,实时荧光PCR法的检测时间大大缩短,可指示该类化合物的环境毒害作用,有望实现对一类化合物的早期监控。土壤白符跳对环境外源PFASs的生物转化,刺激了其本身的药物代谢作用环节,解毒和应激反应的需求增加,具体表现为两大靶标基因CYP6N3V2、CYP6N4V1的表达升高。与此同时,PFASs抑制了白符跳体内生殖相关基因的表达,CTSL表达量降低,干扰了卵的成熟过程,进而影响胚胎发育。同时,CTSL通过影响昆虫对脂肪的利用,阻碍昆虫的变态发育和蜕皮过程。此外,F-53B处理下,与卵形成有关的VMO1和在卵巢成熟过程中发挥作用的Vitrec在白符跳体内的表达也受到抑制,不利于白符跳产卵、孵化等生命活动的进行。
4 结论PFASs对土壤白符跳氧化应激及生殖相关基因的表达具有显著影响。CYP6N3V2、CYP6N4V1、CTSL、VMO1和Vitrec等5个差异表达基因可作为基于PFASs暴露的土壤白符跳早期预警指标的靶标基因。相对于PFOA、PFBA化合物,F-53B对上述基因mRNA转录水平调控的影响程度最大。推测相较于前两种化合物,F-53B可能具有更强的生物毒性。不同PFASs对土壤白符跳的氧化应激、生殖相关基因具有显著影响,这一发现为此类污染物的早期监控奠定了基础。
| [1] |
Lim X. Could the world go PFAS-free?Proposal to ban 'forever chemicals' fuels debate[J]. Nature, 2023, 620(7972): 24-27 DOI:10.1038/d41586-023-02444-5 (  0) 0) |
| [2] |
丁达, 宋昕, 刘朝阳, 等. 某化工园区周边土壤中传统和新兴全氟化合物的赋存特征及潜在来源[J]. 土壤, 2021, 53(4): 779-787 DOI:10.13758/j.cnki.tr.2021.04.015 (  0) 0) |
| [3] |
Gold S C, Wagner W E. Filling gaps in science exposes gaps in chemical regulation[J]. Science, 2020, 368(6495): 1066-1068 DOI:10.1126/science.abc1250 (  0) 0) |
| [4] |
Shi G H, Cui Q Q, Pan Y T, et al. 6: 2 Chlorinated polyfluorinated ether sulfonate, a PFOS alternative, induces embryotoxicity and disrupts cardiac development in zebrafish embryos[J]. Aquatic Toxicology, 2017, 185: 67-75 DOI:10.1016/j.aquatox.2017.02.002 (  0) 0) |
| [5] |
Pan Y T, Zhang H X, Cui Q Q, et al. Worldwide distribution of novel perfluoroether carboxylic and sulfonic acids in surface water[J]. Environmental Science & Technology, 2018, 52(14): 7621-7629 (  0) 0) |
| [6] |
汤婕, 张银龙. 土壤/沉积物中全氟辛酸(PFOA)、全氟辛烷磺酸(PFOS)吸附–解吸行为研究进展[J]. 土壤, 2014, 46(4): 599-606 (  0) 0) |
| [7] |
Domingo J L, Ericson-Jogsten I, Perelló G, et al. Human exposure to perfluorinated compounds in Catalonia, Spain: Contribution of drinking water and fish and shellfish[J]. Journal of Agricultural and Food Chemistry, 2012, 60(17): 4408-4415 DOI:10.1021/jf300355c (  0) 0) |
| [8] |
Liu S Y, Yang R J, Yin N Y, et al. The short-chain perfluorinated compounds PFBS, PFHxS, PFBA and PFHxA, disrupt human mesenchymal stem cell self-renewal and adipogenic differentiation[J]. Journal of Environmental Sciences, 2020, 88: 187-199 DOI:10.1016/j.jes.2019.08.016 (  0) 0) |
| [9] |
李进, 柯欣, 李柱, 等. 铅锌矿区周边农田土壤跳虫群落特征与重金属污染的关联[J]. 土壤学报, 2021, 58(3): 732-743 (  0) 0) |
| [10] |
OECD. Test No. 232: Collembolan reproduction test in soil[S]. OECD (Organisation for Economic Co-operation Development), 2009.
(  0) 0) |
| [11] |
Szabó B, Lang Z, Bakonyi G, et al. Transgenerational and multigenerational stress gene responses to the insecticide etofenprox in Folsomia candida (Collembola)[J]. Ecotoxicology and Environmental Safety, 2019, 175: 181-191 DOI:10.1016/j.ecoenv.2019.03.052 (  0) 0) |
| [12] |
穆阳杰, 詹玉洁, 许卫锋, 等. 高pH胁迫下拟南芥根转录组学与网络应答[J]. 土壤学报, 2020, 57(3): 691-701 (  0) 0) |
| [13] |
Daborn P J, Yen J L, Bogwitz M R, et al. A single p450 allele associated with insecticide resistance in Drosophila[J]. Science, 2002, 297(5590): 2253-2256 DOI:10.1126/science.1074170 (  0) 0) |
| [14] |
Pitombeira de Figueirêdo L, Daam M A, Mainardi G, et al. The use of gene expression to unravel the single and mixture toxicity of abamectin and difenoconazole on survival and reproduction of the springtail Folsomia candida[J]. Environmental Pollution, 2019, 244: 342-350 DOI:10.1016/j.envpol.2018.10.077 (  0) 0) |
| [15] |
Maitra S, Dombrowski S M, Waters L C, et al. Three second chromosome-linked clustered Cyp6 genes show differential constitutive and barbital-induced expression in DDT-resistant and susceptible strains of Drosophila melanogaster[J]. Gene, 1996, 180(1/2): 165-171 (  0) 0) |
| [16] |
de Boer M E, Ellers J, van Gestel C A M, et al. Transcriptional responses indicate attenuated oxidative stress in the springtail Folsomia candida exposed to mixtures of cadmium and phenanthrene[J]. Ecotoxicology, 2013, 22(4): 619-631 DOI:10.1007/s10646-013-1053-1 (  0) 0) |
| [17] |
Roelofs D, de Boer M, Agamennone V, et al. Functional environmental genomics of a municipal landfill soil[J]. Frontiers in Genetics, 2012, 3: 85 (  0) 0) |
| [18] |
苗雅博. 南方小花蝽Ctsd、Ctsl、Naga和Lps基因的消化功能分析及其在天敌人工饲料中的应用[D]. 武汉: 华中农业大学, 2023.
(  0) 0) |
| [19] |
Matsumoto I, Emori Y, Abe K, et al. Characterization of a gene family encoding cysteine proteinases of Sitophilus zeamais (maize weevil), and analysis of the protein distribution in various tissues including alimentary tract and germ cells[J]. Journal of Biochemistry, 1997, 121(3): 464-476 DOI:10.1093/oxfordjournals.jbchem.a021611 (  0) 0) |
| [20] |
Fagotto F. Yolk degradation in tick eggs: Ⅰ. occurrence of a cathepsin L-like acid proteinase in yolk spheres[J]. Archives of Insect Biochemistry and Physiology, 1990, 14(4): 217-235 DOI:10.1002/arch.940140403 (  0) 0) |
| [21] |
Chen J J, Guo P H, Li Y Y, et al. Cathepsin l contributes to reproductive diapause by regulating lipid storage and survival of Coccinella septempunctata (Linnaeus)[J]. International Journal of Molecular Sciences, 2022, 24(1): 611 DOI:10.3390/ijms24010611 (  0) 0) |
| [22] |
崔攀. FAS和GP基因在南方小花蝽取食不同食物源中的功能研究[D]. 武汉: 华中农业大学, 2022.
(  0) 0) |
| [23] |
Sun Y X, Tang L, Wang P, et al. Cathepsin L-like protease can regulate the process of metamorphosis and fat body dissociation in Antheraea pernyi[J]. Developmental & Comparative Immunology, 2018, 78: 114-123 (  0) 0) |
| [24] |
Kido S, Morimoto A, Kim F, et al. Isolation of a novel protein from the outer layer of the vitelline membrane[J]. Biochemical Journal, 1992, 286(1): 17-22 DOI:10.1042/bj2860017 (  0) 0) |
| [25] |
Lim W, Song G. Differential expression of vitelline membrane outer layer protein 1: Hormonal regulation of expression in the oviduct and in ovarian carcinomas from laying hens[J]. Molecular and Cellular Endocrinology, 2015, 399: 250-258 DOI:10.1016/j.mce.2014.10.015 (  0) 0) |
| [26] |
Jing Y P, Wen X P, Li L J, et al. The vitellogenin receptor functionality of the migratory locust depends on its phosphorylation by juvenile hormone[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(37): e2106908118 (  0) 0) |
| [27] |
Ali M W, Zhang Z Y, Xia S, et al. Biofunctional analysis of Vitellogenin and Vitellogenin receptor in Citrus red mites, Panonychus citri by RNA interference[J]. Scientific Reports, 2017, 7(1): 16123 DOI:10.1038/s41598-017-16331-3 (  0) 0) |
| [28] |
Tokar D R, Veleta K A, Canzano J, et al. Vitellogenin RNAi halts ovarian growth and diverts reproductive proteins and lipids in young grasshoppers[J]. Integrative and Comparative Biology, 2014, 54(5): 931-941 DOI:10.1093/icb/icu068 (  0) 0) |
| [29] |
Murphy C T, McCarroll S A, Bargmann C I, et al. Genes that act downstream of DAF-16 to influence the lifespan of Caenorhabditis elegans[J]. Nature, 2003, 424(6946): 277-283 DOI:10.1038/nature01789 (  0) 0) |
| [30] |
Lin Y, Meng Y, Wang Y X, et al. Vitellogenin receptor mutation leads to the oogenesis mutant phenotype "scanty vitellin" of the silkworm, Bombyx mori[J]. Journal of Biological Chemistry, 2013, 288(19): 13345-13355 DOI:10.1074/jbc.M113.462556 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Shanghai Institute for Biological and Pharmaceutical Technologies, Shanghai 200032, China;
4. College of Resources and Environment, Southwest University, Chongqing 400716, China;
5. Center for Excellence in Molecular Plant Sciences, Chinese Academy of Sciences, Shanghai 200032, China
 2025, Vol. 57
2025, Vol. 57


