不同种类抗生素的大量使用和排放导致自然环境中新的抗生素耐性菌不断被发现,这些耐性菌可经由食物链、大气、水体等途径对人体健康构成威胁[1]。抗生素耐性菌的主要来源包括生活污水、污泥以及畜牧业废弃物[2-4]。在农业环境中,未被动物吸收的抗生素及其耐性菌随粪便排出体外,通过粪肥施用和污水灌溉输入土壤。这些抗生素耐性菌会随地表径流、渗漏水等迁移,进而污染地表水或地下水。然而,抗生素耐性菌在土壤中的迁移规律尚不明确。
细菌的迁移受控于细菌与土壤之间复杂的相互作用[5]。一般而言,细菌在土壤中的迁移受瞬时吸附和动力学吸附的控制[6]。细菌在土壤中被吸附的影响因素有很多,包括土壤性质(如土壤类型、黏粒含量、有机质含量、氧化铁含量)、细菌特征(如表面电荷、疏水性和亲水性、大小和形状、生理状态、代谢活性)以及其他环境因子(如pH、离子强度、表面活性剂)[7]。
粪肥施用能够显著提高土壤细菌多样性及丰富度[8],同时也被认为是土壤中抗生素耐性菌增加的重要原因。粪肥的长期施用会改变土壤的理化性质[9],进而影响抗生素耐性菌在土壤中的迁移。张广立等[10]通过荟萃分析,发现施用粪肥能显著增加土壤大团聚体和小团聚体的含量。施用粪肥还能提高土壤的有机质含量、阳离子交换量、表面积和吸附位点,从而影响细菌的迁移[11-12]。同一种土壤的理化性质在不同施肥条件下可能发生不同的变化[13-14]。然而,长期施用不同粪肥对抗生素耐性菌在土壤中迁移行为的影响规律尚不明晰。
基于以上,本研究以长期施用粪肥(鸡粪和猪粪)的3种土壤(黄壤、红壤以及石灰土)为对象,通过批量试验和土柱试验,研究土著抗生素耐性菌的吸附特征与迁移行为,探究土壤类型和粪肥种类的影响,以为旱地土壤中抗生素耐性菌的环境风险评估提供重要参考。
1 材料与方法 1.1 试剂与仪器胰蛋白胨、酵母提取物和氯化钠购自国药试剂公司。4种抗生素(磺胺二甲基嘧啶、氟苯尼考、强力霉素、恩诺沙星)购自上海麦克林生化科技有限公司。试验用水为无菌超纯水。
试验仪器主要有紫外分光光度计(北京普析通用仪器有限责任公司)、振荡器(上海一恒科学仪器有限公司)、pH计(瑞士Mettler-Toledo公司)、电导率仪(成都世纪方舟科技有限公司)、纳米粒度电位分析仪(Zetasizer Nano ZS90,英国马尔文公司)、蠕动泵(保定兰格恒流泵有限公司)、全自动部分收集器(上海沪西分析仪器厂有限公司)、超净台(苏州净化设备有限公司)、高压蒸汽灭菌锅(上海申安医疗器械厂)。
1.2 供试土壤供试土壤为取自浙江省杭州市临安区(LA)的黄壤、衢州市开化县(KH)的石灰土以及金华市婺城区(WC)的红壤。对于每一土壤类型,选取2块相邻的长期分别施用鸡粪(CM)和猪粪(PM)的旱地农田,在每块农田中采用5点取样法采集耕层(0 ~ 20 cm)土壤,制成混合样,风干后过2 mm筛,用于土壤理化性质分析、批量平衡吸附试验和土柱穿透试验。供试土壤样品的基本理化性质见表 1。
|
|
表 1 供试土壤的理化性质 Table 1 Physicochemical properties of experimental soils |
1) LB培养基:称取10 g胰蛋白胨、5 g酵母提取物和10 g氯化钠,用超纯水定容至1 000 mL,用5 mol/L氢氧化钠调节pH至7.0,经121 ℃高压蒸汽灭菌20 min。
2) 土壤菌株的培养:将3个采样地点的6种供试土壤等质量混合,调节土壤的质量含水量为0.6 g/g,25℃条件下预培养2周,活化土壤中的细菌。称取完成预培养的土壤样品,加入灭菌水(水土质量比9∶1),置于振荡器中振荡,直至土壤大颗粒完全分散;然后静置至少30 min,待其上部澄清;在按1∶10的比例,将上清液接种至LB培养基中,置于摇床上,在37 ℃、120 r/min条件下培养过夜,从而获得土壤细菌悬液。
3) 土壤细菌抗生素耐性的诱导:参考美国临床和实验室标准协会(CLSI)的最小抑菌浓度(MIC)数据[15],将土壤细菌悬液接种至含有4 µg/mL磺胺二甲基嘧啶、8 µg/mL强力霉素、10 µg/mL恩诺沙星和16 µg/mL氟苯尼考的LB培养基中,置于摇床上,在37℃、120 r/min的条件下培养96 h,获得初次诱导的抗生素耐性菌株。将初次诱导所得的菌株再次进行同样的诱导处理,从而获得试验所需的抗生素耐性菌。抗生素耐性菌的扫描电镜照片见图 1。

|
图 1 抗生素耐性菌的扫描电镜照片 Fig. 1 Scanning electron microscopy image of antibiotic resistance bacteria |
吸附是细菌在多孔介质中的主要滞留机制[11]。静电相互作用、范德华力、疏水相互作用、离子偶极力和氢键是控制细菌在多孔介质界面吸附的主要作用力[16-17]。本研究中,批量平衡法等温吸附试验的基本步骤为:称取1 g土壤颗粒于离心管中,先加入30 mL 10 mmol/LCaCl2溶液,在25 ℃、120 r/min下振荡10 min,随后在4 ℃、2000×g下离心10 min后,倒去上清液;再加入40 mL灭菌水,重复上述操作,得到预处理后的土样;然后,在经预处理土样中分别加入初始浓度为0、0.2、0.4、0.8、1.2和1.6 abs (吸光值)的抗生素耐性菌悬液(含10 mmol/L CaCl2) 30 mL每个浓度设3个平行样,在25 ℃、120 r/min下振荡2 h达到吸附平衡后,向离心管底部加入5 mL 60%的蔗糖分离液)随后在4 ℃下静置沉淀24 h,取上部菌悬液,测定抗生素耐性菌的浓度。
1.5 土柱穿透试验所有供试土壤样品均经121 ℃高压蒸汽灭菌20 min。土柱填装和穿透试验均在超净工作台中进行。
土柱试验装置由进样瓶、玻璃层析柱(内径5 cm、高10 cm)、蠕动泵和全自动部分收集器组成。在玻璃柱中均匀填装土壤,每填装1 cm,轻轻压实土壤。为防止土粒淋出,在土柱底部用不锈钢网(孔径20 µm)支撑土柱,其上铺一层1 cm厚的石英砂(粒径75 ~ 300 µm),以保证进水的均匀入渗,石英砂层之上放一张尼龙布(孔径20 µm)。土柱顶面上同样铺一张尼龙布,其上铺一层1 cm厚的石英砂。所有土柱的容重控制在1.35 g/cm3左右,与旱地农田耕作层土壤实际容重相近。
土柱垂直放置,在穿透试验前对土柱进行预处理:首先,从土柱底部缓慢注入无菌超纯水,由下至上逐渐饱和,饱和24 h;然后,由土柱下端以817.7 µL/min (相当于25 mm/h;气象学上将每小时降雨量超过16 mm的降雨定义为暴雨)注入5个孔隙体积(PV)的无菌超纯水,使土柱内达到物理与化学平衡,并控制出流量稳定且与进水量相当。
预试验:向土柱中注入抗生素耐性菌悬液,每隔0.42 PV(约49 min)收集1份出水样,采用紫外分光光度计测定水样的吸光度,获得抗生素耐性菌浓度,发现出水耐性菌浓度在4 ~ 5 PV时达到峰值;随后将进水切换回无菌超纯水,测得在8 PV左右时,出水中不再检出耐性菌。因此,在正式试验时,适当延长淋洗时间至10 PV,以确保抗生素耐性菌充分释放。
正式试验:同样在水分饱和条件下进行,包括2个阶段:①抗生素耐性菌注入阶段:将进水切换为抗生素耐性菌悬液(含有1×108 CFU/mL抗生素耐性菌和0.5 mmol/L的Br−),以25 mm/h注入5个PV;②抗生素耐性菌淋洗阶段:将进水切换回无菌超纯水,以25 mm/h注入5个PV,用部分收集器每隔48.95 min收集出水样,每个穿透试验收集24个水样。分析进水和出水的抗生素耐性菌浓度、Br−浓度、颗粒平均直径、Zeta电位、DOC浓度、pH和电导率。其中,进水菌悬液的pH为8.5,电导率为2.41 mS/cm,平均粒径为1 060.47 nm,Zeta电位为−28.0 mV。此外,用遮光布覆盖超净台,保证整个穿透试验在黑暗条件下进行。
1.6 测定项目与方法抗生素耐性菌的浓度用OD600值(600 nm波长处的吸光值)量化。建立抗生素耐性菌数量与吸光值的线性关系是分光光度法测量抗生素耐性菌浓度的前提。一般利用平板计数法测得的单位体积菌悬液菌落数(CFU/mL)与紫外–可见光分光光度计测得的吸光值(OD600,abs),建立抗生素耐性菌浓度与OD600的标准曲线[18]。本研究所得标准曲线的决定系数(R2)为0.993 4。
土壤pH和电导率(EC):称取5 g过2 mm筛的土壤样品,置于离心管中,加入25 mL超纯水(水土质量比5∶1),置于振荡器中在180 r/min下振荡30 min,静置30 min后,使用pH计和电导率仪分别测定上清液的pH和EC。土壤有效磷采用氟化铵–盐酸法(pH≤6.5)测定,有机碳采用高温外热重铬酸钾氧化–亚铁滴定法测定,全磷采用酸溶–钼锑抗比色法测定,全氮采用凯氏定氮法测定,硝态氮和铵态氮采用氯化钾浸提–比色法测定,土壤机械组成采用吸管法测定[19]。
水样中Br−浓度使用溴离子浓度计(Bante931,上海般特)测定,颗粒平均直径和Zeta电位使用纳米粒度电位分析仪,DOC浓度使用TOC总有机碳/总氮分析仪(multi N/C 2100,德国耶拿公司)测定,pH和EC分别用pH计和电导率仪测定。
1.7 数据处理与分析采用Freundlich模型和线性模型对不同浓度抗生素耐性菌在土壤中的等温吸附过程进行拟合。
Freundlich模型用来描述吸附质在吸附剂上的非线性吸附现象,是一种经验模型。该模型假设吸附发生在异质性表面且呈多层吸附。Freundlich模型可用式(1)表示。
| $ {q_e} = {K_{\text{F}}}{C_e}^{1/n} $ | (1) |
式中:qe是平衡时土壤上抗生素耐性菌的吸附量(abs/g);Ce是平衡时水相中的抗生素耐性菌浓度(abs/L);KF是吸附容量常数;n是亲和力值。
线性模型用来描述吸附质在固、液相之间的线性分配现象,可用式(2)表示。
| $ {q}_{\text{e}}={K}_{\text{d}}{C}_{\text{e} ?} $ | (2) |
式中:Kd是抗生素耐性菌的两相分配系数(L/g)。
绘制土柱出水抗生素耐性菌及示踪剂(Br−,非反应性溶质,用于示踪新进水分)的相对浓度(出水浓度C与进水浓度C0之比)随进水PV数变化的穿透曲线,计算每个穿透试验的抗生素耐性菌及Br−的穿透率(出水中的累计总量与进水中的累计总量之比),比较不同供试土壤之间抗生素耐性菌峰值出现PV数的差异。
使用Excel 2021软件对数据进行处理,使用Origin 2023b软件对试验数据进行模型拟合以及相关性分析,并作图。
2 结果与讨论 2.1 土壤中抗生素耐性菌的等温吸附特征不同供试土壤中抗生素耐性菌等温吸附模型拟合参数结果见表 2。Freundlich模型对所有供试土壤中抗生素吸附过程的拟合效果均良好(R2在0.800 ~ 0.992),达到显著或极显著水平。除长期施用猪粪的红壤外,线性模型对其他供试土壤中抗生素吸附过程均具有良好的拟合效果(R2在0.691 ~ 0.989),达到显著水平。对于所有供试土壤,Freundlich模型的拟合效果均优于线性模型。
|
|
表 2 施用粪肥土壤中抗生素耐性菌等温吸附过程拟合参数 Table 2 Model parameters fitted to isothermal sorption processes of antibiotic resistance bacteria in manured soils |
对于同一粪肥类型,抗生素耐性菌在不同土壤中的吸附KF值大小顺序均为:黄壤 > 石灰土 > 红壤,且红壤中的KF值均远小于其他2种土壤类型。对于同一土壤类型,长期施用鸡粪土壤的KF值均高于长期施用猪粪土壤。Cayci等[20]研究表明,土壤的有机碳和全氮含量以及离子强度会随鸡粪施用量的增加而增加。Yost等[21]研究发现,施用猪粪能提高农田土壤有机碳和微生物生物量碳含量,但降低容重。由此推断,鸡粪和猪粪对土壤理化性质的改造作用可能是导致KF差异的原因。与施用化肥土壤相比,施用粪肥使偏碱性的石灰土pH大幅下降,以施用猪粪所引起的降幅最为明显,而使酸性的红壤和弱酸性的黄壤pH有不同程度的提高,以施用鸡粪所引起的升幅较大[22]。施用鸡粪的黄壤KF高于施用猪粪的黄壤,可能主要与前者较高的pH(呈弱碱性)有关。对于呈酸性/弱酸性的施用粪肥红壤和石灰土,施用鸡粪土壤KF高于施用猪粪土壤则可能主要与前者较低的有机碳含量有关。可见,较高的pH和较低的有机质含量有利于土壤对抗生素耐性菌的吸附,以pH的影响更大。
2.2 土柱中抗生素耐性菌的迁移行为土柱穿透试验中,Br−和抗生素耐性菌的穿透曲线如图 2所示;土柱出水中抗生素耐性菌的迁移参数及物理性质见表 3和表 4;抗生素耐性菌穿透率与土壤理化性质的相关性如图 3所示。
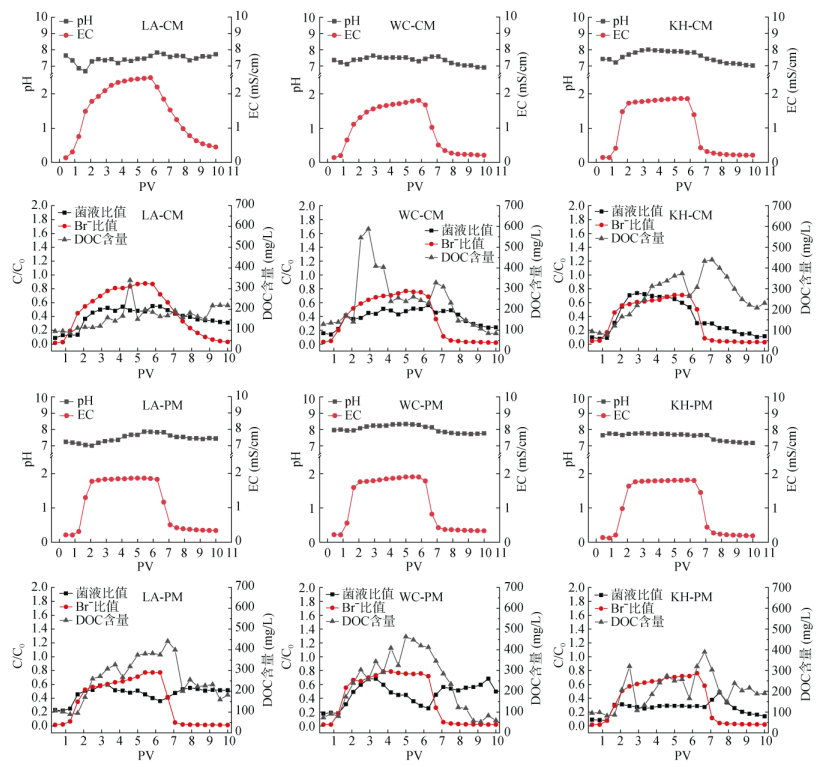
|
图 2 饱和土柱穿透试验中Br−和抗生素耐性菌的穿透曲线 Fig. 2 Breakthrough curves of Br− and antibiotic resistance bacteria in saturated soil column experiments |
|
|
表 3 饱和土柱穿透试验中抗生素耐性菌的迁移参数 Table 3 Transfer parameters of antibiotic resistance bacteria in saturated soil column experiments |
|
|
表 4 土柱穿透试验出水中抗生素耐性菌的物理性质 Table 4 Physical properties of antibiotic resistance bacteria in outflow samples of saturated soil column experiments |
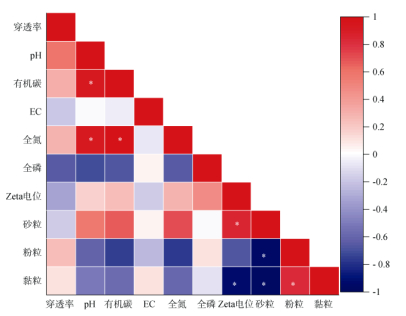
|
(*表示在P≤0.05水平显著相关) 图 3 相关性分析结果 Fig. 3 Results of correlation analysis |
对于所有供试土壤,土柱初期(0.42 PV)出水中抗生素耐性菌的相对浓度(C/C0)均高于Br−(新进水分示踪剂),抗生素耐性菌相对浓度峰值(Cmax/C0)的出现也均早于Br−。可见,抗生素耐性菌能够比水分更快地穿透土壤。类似地,有研究发现,噬菌体在砂性土柱中的迁移和大肠杆菌在砾石柱中的迁移均快于水分[23-24]。
对于所有供试土壤(除施用鸡粪的黄壤外),土柱初期(0.42 PV)出水的Zeta电位(绝对值) 均大幅高于抗生素耐性菌峰值出水,平均粒径在峰值时较大。可见,峰值出水中抗生素耐性菌的粒径较大且较不稳定。Breiner等[25]与Crist等[26]研究发现,疏水性胶体比亲水性胶体更不稳定,且更易形成较大的胶体聚集体。Huysman和Verstraete[27]比较了疏水性和亲水性细菌在土壤中的迁移行为,发现具有疏水表面的细菌的迁移速度比具有亲水表面的细菌慢。由此推断,在本研究中,前期穿透土柱的抗生素耐性菌可能以亲水性细菌为主,而在峰值期则可能以疏水性细菌所形成的聚集体为主。
相关性分析结果表明,土壤的基本理化性质与抗生素耐性菌的迁移之间无显著的相关性。以往的研究表明,土壤理化性质对细菌迁移的影响分为两个方面:一方面,土壤环境为细菌的生长繁殖提供条件,间接影响细菌在土壤中的迁移;另一方面,土壤环境能够影响细菌的表面官能团组成、表面电势等性质,进而影响细菌在土壤中的吸附与迁移。例如,李慧儒[28]的研究表明,大肠杆菌在弱酸性土壤中的存活时间会随着pH的升高而延长;而张桃香[29]的研究发现,当pH为3时,矿物对大肠杆菌的吸附量最大,而随着pH的升高,大肠杆菌的吸附量减少;yee等[30]研究发现,虽然枯草芽孢杆菌在刚玉上的吸附行为依赖于pH,但是其在石英上的吸附与pH变化无关。因此,土壤理化性质对细菌迁移的影响呈现复杂性。
不论是长期施用鸡粪还是长期施用猪粪,不同土壤类型之间抗生素耐性菌穿透率的差异均表现为:黄壤 > 红壤 > 石灰土,以吸附能力最强的黄壤中的抗生素耐性菌穿透率最高。这表明土壤颗粒表面对抗生素耐性菌的强吸附能力并不一定导致低穿透率。多孔介质的粒径组成会显著影响细菌的迁移,质地越粗,大孔隙越多,细菌与介质颗粒表面碰撞并被吸附的机会越少,从而导致细菌更易发生高通量迁移。Bradford和Bettahar [31]与Gargiulo等[32]的研究均表明,细菌在粗介质中的滞留量比在细介质中少。在3类供试土壤中,黄壤的砂粒含量最高、黏粒含量最低,因而最有利于抗生素抗性菌随大孔隙优先流迁移。土柱出水样中的平均粒径分析表明,以施用猪粪的石灰土土柱在初期(0.42 PV)出水样中平均粒径最小,相应地,抗生素耐性菌的穿透率也最低。这些结果表明,因抗生素耐性菌和土壤胶体均带负电荷,由土壤质地(机械组成)决定的孔隙结构特征对抗生素耐性菌穿透率的影响可能比土壤颗粒的吸附能力更大。
粪肥类型会影响抗生素耐性菌在土壤中迁移的峰值浓度和穿透率。许多研究表明,粪肥物质的存在能够影响土壤孔隙水的性质,从而改变细菌的迁移[33-36]。在经过粪肥改良后的自然土壤中,吸附和解吸都不是细菌滞留的唯一机制,然而相关性分析的结果却表明抗生素耐性菌在土壤中的迁移与单一土壤环境因子间无显著相关性。这说明抗生素耐性菌在土壤中的迁移可能受到多种因素的共同影响。在黄壤和红壤中,长期施用猪粪能使土壤中抗生素耐性菌迁移的峰值浓度和穿透率高于长期施用鸡粪。Sepehrnia[37]等的研究表明,与家禽粪便相比,用牛粪处理的壤土对细菌的吸附、解吸和过滤系数的影响更大,以牛粪中木质素和纤维素含量的影响最为突出。类似地,在本研究中,与鸡粪投入相比,猪粪投入会导致红壤和黄壤中抗生素耐性菌更易淋失。
对于所有供试土壤,出水中抗生素耐性菌浓度均呈现拖尾现象,以施用猪粪土壤更为明显,表明淋洗阶段也是抗生素耐性菌发生迁移的重要时段。Gannonet等[38]在内径5 cm、长30 cm有机玻璃柱中的抗生素耐性菌迁移研究中,同样使用1×108 CFU/mL的菌悬液(含有0.01 mol/L氯化钠),当菌悬液注入时,仅有0.015(C/C0)的细菌通过土柱,而当菌悬液换成无菌蒸馏水后,则有0.6(C/C0)的细菌通过土柱。因此,在田间粪肥表施或污灌后的降雨事件中,随着孔隙水离子强度的下降,土壤中先前吸附的抗生素耐性菌可能发生解吸而迁移,进而对地下水构成污染风险。
3 结论1) Freundlich模型均能良好地拟合所有供试土壤中抗生素耐性菌的等温吸附过程,长期施用鸡粪土壤对抗生素耐性菌的吸附常数KF高于长期施用猪粪土壤。
2) 抗生素耐性菌能够比水分更快地穿透土柱。不同类型土壤中抗生素耐性菌的穿透率表现为:黄壤 > 红壤 > 石灰土。在黄壤和红壤中,抗生素耐性菌的穿透率在不同粪肥间的差异表现为:猪粪 > 鸡粪;然而,在石灰土中,粪肥间的差异相反。
3) 抗生素耐性菌在土柱淋洗阶段也会发生迁移,预示农田土壤中的抗生素耐性菌在降雨事件下可能发生渗漏迁移,尤其是在施用猪粪的土壤中,应引起重视。
| [1] |
张友爱, 王婷婷, 胡小婕, 等. 土壤抗生素抗性基因研究进展及热点分析[J]. 土壤学报, 2024, 61(3): 607-618 (  0) 0) |
| [2] |
Yeom J R, Yoon S U, Kim C G. Quantification of residual antibiotics in cow manure being spread over agricultural land and assessment of their behavioral effects on antibiotic resistant bacteria[J]. Chemosphere, 2017, 182: 771-780 DOI:10.1016/j.chemosphere.2017.05.084 (  0) 0) |
| [3] |
Osińska A, Korzeniewska E, Harnisz M, et al. The prevalence and characterization of antibiotic-resistant and virulent Escherichia coli strains in the municipal wastewater system and their environmental fate[J]. Science of The Total Environment, 2017, 577: 367-375 DOI:10.1016/j.scitotenv.2016.10.203 (  0) 0) |
| [4] |
Heaney C D, Myers K, Wing S, et al. Source tracking swine fecal waste in surface water proximal to swine concentrated animal feeding operations[J]. Science of The Total Environment, 2015, 511: 676-683 DOI:10.1016/j.scitotenv.2014.12.062 (  0) 0) |
| [5] |
Stumpp C, Lawrence J R, Hendry M J, et al. Transport and bacterial interactions of three bacterial strains in saturated column experiments[J]. Environmental Science & Technology, 2011, 45(6): 2116-2123 (  0) 0) |
| [6] |
Sen T K, Das D, Khilar K C, et al. Bacterial transport in porous media: New aspects of the mathematical model[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2005, 260(1/2/3): 53-62 (  0) 0) |
| [7] |
Vu K, Yang G, Wang B Y, et al. Bacterial interactions and transport in geological formation of alumino-silica clays[J]. Colloids and Surfaces B: Biointerfaces, 2015, 125: 45-50 DOI:10.1016/j.colsurfb.2014.11.015 (  0) 0) |
| [8] |
苑学霞, 梁京芸, 范丽霞, 等. 粪肥施用土壤抗生素抗性基因来源、转移及影响因素[J]. 土壤学报, 2020, 57(1): 36-47 (  0) 0) |
| [9] |
刘玲, 崔俊芳, 杨红薇, 等. 长期外源有机物料添加对川中丘陵区农田土壤养分和有机碳组分的影响[J]. 土壤, 2023, 55(5): 991-1000 DOI:10.13758/j.cnki.tr.2023.05.008 (  0) 0) |
| [10] |
张广立, 岑柏霆, 龙新宪, 等. 粪肥施用对土壤团聚体的影响——Meta分析[J]. 土壤, 2024, 56(3): 610-622 DOI:10.13758/j.cnki.tr.2024.03.019 (  0) 0) |
| [11] |
Kristian Stevik T, Aa K, Ausland G, et al. Retention and removal of pathogenic bacteria in wastewater percolating through porous media: A review[J]. Water Research, 2004, 38(6): 1355-1367 DOI:10.1016/j.watres.2003.12.024 (  0) 0) |
| [12] |
Lawrence J R, Hendry M J. Transport of bacteria through geologic media[J]. Canadian Journal of Microbiology, 1996, 42(4): 410-422 DOI:10.1139/m96-057 (  0) 0) |
| [13] |
罗珊, 胡锦昇, 唐翔宇, 等. 粪肥施用对抗生素在土壤上吸附的影响[J]. 环境科学, 2023, 44(11): 6399-6411 (  0) 0) |
| [14] |
Schlegel A J, Assefa Y, Bond H D, et al. Soil physicochemical properties after 10 years of animal waste application[J]. Soil Science Society of America Journal, 2015, 79(3): 711-719 DOI:10.2136/sssaj2014.11.0461 (  0) 0) |
| [15] |
Bowen W R, Doneva T A, Stoton J A G. The use of atomic force microscopy to quantify membrane surface electrical properties[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2002, 201(1/2/3): 73-83 (  0) 0) |
| [16] |
韩志捷. 大肠杆菌在土壤中的迁移机制和数学模型[D]. 天津: 天津理工大学, 2016.
(  0) 0) |
| [17] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科技出版社, 北京, 1999
(  0) 0) |
| [18] |
Zhong H, Zeng G M, Liu J X, et al. Adsorption of monorhamnolipid and dirhamnolipid on two Pseudomonas aeruginosa strains and the effect on cell surface hydrophobicity[J]. Applied Microbiology and Biotechnology, 2008, 79(4): 671-677 DOI:10.1007/s00253-008-1461-y (  0) 0) |
| [19] |
Zhong H, Zeng G M, Yuan X Z, et al. Adsorption of dirhamnolipid on four microorganisms and the effect on cell surface hydrophobicity[J]. Applied Microbiology and Biotechnology, 2007, 77(2): 447-455 DOI:10.1007/s00253-007-1154-y (  0) 0) |
| [20] |
Cayci G, Temiz C, Ok S S. The effects of fresh and composted chicken manures on some soil characteristics[J]. Communications in Soil Science and Plant Analysis, 2017, 48(13): 1528-1538 DOI:10.1080/00103624.2017.1373794 (  0) 0) |
| [21] |
Yost J L, Schmidt A M, Koelsch R, et al. Effect of swine manure on soil health properties: A systematic review[J]. Soil Science Society of America Journal, 2022, 86(2): 450-486 DOI:10.1002/saj2.20359 (  0) 0) |
| [22] |
刘昕悦, 程建华, 唐翔宇. 施用粪肥旱地农田土壤中抗生素的吸附与迁移规律[J]. 环境科学, 2025, 46(1): 409-418 (  0) 0) |
| [23] |
Bales R C, Gerba C P, Grondin G H, et al. Bacteriophage transport in sandy soil and fractured tuff[J]. Applied and Environmental Microbiology, 1989, 55(8): 2061-2067 DOI:10.1128/aem.55.8.2061-2067.1989 (  0) 0) |
| [24] |
Poulsen T G, Moldrup P, de Jonge L W, et al. Colloid and bromide transport in undisturbed soil columns: Application of two-region model[J]. Vadose Zone Journal, 2006, 5(2): 649-656 DOI:10.2136/vzj2005.0068 (  0) 0) |
| [25] |
Breiner J M, Anderson M A, Tom H W K, et al. Properties of surface-modified colloidal particles[J]. Clays and Clay Minerals, 2006, 54(1): 12-24 DOI:10.1346/CCMN.2006.0540102 (  0) 0) |
| [26] |
Crist J T, Zevi Y, McCarthy J F, et al. Transport and retention mechanisms of colloids in partially saturated porous media[J]. Vadose Zone Journal, 2005, 4(1): 184-195 DOI:10.2136/vzj2005.0184 (  0) 0) |
| [27] |
Huysman F, Verstraete W. Water-facilitated transport of bacteria in unsaturated soil columns: Influence of cell surface hydrophobicity and soil properties[J]. Soil Biology and Biochemistry, 1993, 25(1): 83-90 DOI:10.1016/0038-0717(93)90245-7 (  0) 0) |
| [28] |
李慧儒. 大肠杆菌0157: H7在吉林省pH梯度土壤中的存活及影响因素[D]. 长春: 吉林大学, 2019.
(  0) 0) |
| [29] |
张桃香. 中国东部地带性土壤中大肠杆菌O157: H7存活和吸附机制的研究[D]. 杭州: 浙江大学, 2014.
(  0) 0) |
| [30] |
Yee N, Fein J B, Daughney C J. Experimental study of the pH, ionic strength, and reversibility behavior of bacteria–mineral adsorption[J]. Geochimica et Cosmochimica Acta, 2000, 64(4): 609-617 DOI:10.1016/S0016-7037(99)00342-7 (  0) 0) |
| [31] |
Bradford S A, Bettahar M. Concentration dependent transport of colloids in saturated porous media[J]. Journal of Contaminant Hydrology, 2006, 82(1/2): 99-117 (  0) 0) |
| [32] |
Gargiulo G, Bradford S, Šimůnek J, et al. Bacteria transport and deposition under unsaturated conditions: The role of the matrix grain size and the bacteria surface protein[J]. Journal of Contaminant Hydrology, 2007, 92(3/4): 255-273 (  0) 0) |
| [33] |
Guber A K, Karns J S, Pachepsky Y A, et al. Comparison of release and transport of manure‐borne Escherichia coli and enterococci under grass buffer conditions[J]. Letters in Applied Microbiology, 2007, 44(2): 161-167 DOI:10.1111/j.1472-765X.2006.02065.x (  0) 0) |
| [34] |
Pachepsky Y A, Sadeghi A M, Bradford S A, et al. Transport and fate of manure-borne pathogens: Modeling perspective[J]. Agricultural Water Management, 2006, 86(1/2): 81-92 (  0) 0) |
| [35] |
Pachepsky Y A, Yu O, Karns J S, et al. Strain-dependent variations in attachment of E. coli to soil particles of different sizes[J]. International Agrophysics, 2008, 22(1): 61-66 (  0) 0) |
| [36] |
Díaz J, Rendueles M, Díaz M. Straining phenomena in bacteria transport through natural porous media[J]. Environmental Science and Pollution Research, 2010, 17(2): 400-409 DOI:10.1007/s11356-009-0160-2 (  0) 0) |
| [37] |
Sepehrnia N, Memarianfard L, Moosavi A A, et al. Bacterial mobilization and transport through manure enriched soils: Experiment and modeling[J]. Journal of Environmental Management, 2017, 201: 388-396 DOI:10.1016/j.jenvman.2017.07.009 (  0) 0) |
| [38] |
Gannon J, Tan Y H, Baveye P, et al. Effect of sodium chloride on transport of bacteria in a saturated aquifer material[J]. Applied and Environmental Microbiology, 1991, 57(9): 2497-2501 DOI:10.1128/aem.57.9.2497-2501.1991 (  0) 0) |
 2025, Vol. 57
2025, Vol. 57


