2. 江苏省农业科学院经济作物研究所, 南京 210014;
3. 道地药材品质保障与资源持续利用全国重点实验室, 中国中医科学院中药资源中心, 北京 100700
山药(Rhizoma dioscorea)是薯蓣科薯蓣属植物,作为食药两用历史悠久的传统作物,其富含糖类、多酚类等功能成分,具有降血糖、降血脂、提高免疫力等多种功效[1]。近年来,我国山药市场需求量持续增加,但受制于耕地面积有限和加强区域农业产业化的需要,山药一直处于大规模单一种植的状态[2]。山药在连作过程中因受不合理施肥、不良耕作习惯或有害物质积累等因素影响,一方面造成土壤质量下降,养分含量降低;另一方面栽培过程中病虫害激增、连作障碍频发等,导致山药质量和产量下降[2-3],严重制约了山药产业的绿色可持续发展。
土壤微生物广泛活跃于自然生态系统中,对生态系统至关重要,其不仅能改善土壤肥力,为植物提供所需的营养物质[4],还可以通过拮抗病原菌、诱导植物抗性来预防土传病害[5]。最近有研究指出,山药等农产品长期连作破坏了根际群落组成[6]。微生物组成的变化不仅影响根际微生物群落的代谢特征,而且导致与植物性能相关的性状发生改变,如养分代谢和植物激素生物合成的表征减少[7]。近年来,补充有益微生物功能菌作为一种新兴的农业改良方式,不仅能够改善土壤物理结构,促进物质循环与转化,提高土壤养分,还可以提高土壤有益微生物丰度,改善土壤微生物区系,从而提升土壤抗性[8-9]。木霉菌是一种在自然界广泛存在的生防真菌,同时也是一类重要的植物促生真菌[10],被广泛应用于农业生产中。木霉菌种类繁多,其主要功能包括显著抑制病原微生物的生长、改善微生态环境以及调节植物生长速率等[11]。最近的研究表明,常见的植物病害如根腐病、萎蔫病、枯萎病、果腐病等都可以由木霉菌控制[11-13]。木霉菌分泌的次生代谢产物已被证明具有抑制病原微生物生长和刺激植物生长的作用[5]。此外,植物与木霉菌的相互作用成功地调节了根系构型,增加了侧根和主根的长度,从而提高了植物对养分的吸收效率[14]。尽管木霉菌在改善土壤质量及促进植株抗性方面具有良好效果,但关于外源接种木霉菌以及组合菌群接种如何促进植物生长的研究较少。
优化山药栽培技术也是提高山药产量和质量的重要方式。定向槽种植技术是改善传统淮山药种植模式的有效策略,其利用浅土层的昼夜温差、良好的土壤通透性及充足的养分供应[15],有助于加快山药的生长,进而提高山药产量。
为推动山药产业绿色高质量发展,本研究选用具有有效培肥改土作用的木霉菌株,结合定向槽种植技术,通过大田试验探究施用不同木霉菌及其组合菌对山药生长和产量的影响,并基于高通量测序分析木霉功能菌对微生物群落的影响,探究木霉菌对山药产量和土壤微生物区系的影响,为山药种植业绿色可持续发展提供理论指导与技术支撑。
1 材料与方法 1.1 供试材料 1.1.1 供试菌株长枝木霉MD30(Trichoderma longibrachiatum MD30)、桔绿木霉JS84(Trichoderma citrinoviride JS84)和贵州木霉NJAU4742 (Trichoderma guizhouense NJAU4742)由江苏省固体有机废弃物资源化高技术研究重点实验室提供,保藏于中国微生物菌种保藏管理委员会普通微生物中心。其中,长枝木霉MD30保藏号为CGMCC17467,桔绿木霉JS84保藏号为CGMCC17466,贵州木霉NJAU4742保藏号为CGMCC 3308。
1.1.2 供试作物试验供试山药品种为菜山药“苏蓣10号”,由江苏省农业科学院经济作物研究所提供。
1.1.3 供试培养基马铃薯葡萄糖琼脂(PDA)培养基:在去离子水中加入39 g PDA(购自BD Difco),定容至1 L,115 ℃灭菌30 min;马铃薯葡萄糖(PDB)培养基:在去离子水中加入24 g PDB(去除琼脂的PDA),定容至1 L,115 ℃灭菌30 min。
1.2 功能菌悬液培养用无菌接种环蘸取保存于甘油管中的木霉孢子悬液,在PDA平板表面进行划线接种。于28 ℃下培养3 ~ 5 d,待菌体长满整个培养基后,用接种铲挖取长满菌丝的培养基转接至PDB培养基中,振荡培养3 ~ 5 d,得到对应的功能菌液,调节培养后孢子液至浓度相等备用。
1.3 田间试验设计2022年5—10月于江苏省南京市六合区江苏省农科院种植基地(32°34' N,118°83' E)开展田间试验,田间土壤基础理化特征为:有机质21.4 g/kg,全氮0.78 g/kg,有效磷40.4 mg/kg,速效钾209 mg/kg。设置4个处理:①CK,不施用木霉菌剂对照;②T1,施用贵州木霉NJAU4742处理;③T2,施用桔绿木霉JS84处理;④T3,施用长枝木霉MD30处理;⑤T4,施用以上3种木霉复合菌处理。每个处理设置4个重复小区,每个小区长3 m、宽1.5 m。各小区采用定向槽种植山药[15],定向槽密度为30 000个/hm2,定向槽顶部预留播种穴(长约15 cm),将种薯放在定向槽顶部播种穴内,每个槽摆放1个,槽内覆土厚15 cm左右。各处理等养分设置,其中基肥50 kg/hm2,膨大期追肥20 kg/hm2,肥料为45%(15-15-15)复合肥,灌溉、打药、锄草等其他农事操作与当地农民习惯一致。待山药完全出芽、长出新叶后,于7—9月每月定期添加20 mL功能菌(木霉菌浓度约为1 × 107 CFU/mL)。
1.4 山药生物学指标测定于第一次加菌10 d后对山药幼苗生长性状进行测定,包括株高、叶片长、宽,每小区选取3株幼苗测定。山药新叶至地面的距离即为山药株高。依据《植物新品种特异性、一致性和稳定性测试指南山药》[16],对山药组培苗植株叶片性状进行测定,所测叶片均为从上至下第3片新叶。利用直尺测量叶片的长度与宽度,叶端至叶尖距离为叶片长度,叶端至叶缘距离为叶片宽度。
1.5 山药田间产量测定2022年10月山药收获时将每个种植槽拔出,以小区为单位,统计种植槽数量,去除山药表面土壤,称取可收获山药质量,即为山药产量。随后,将去除畸形果后的优质果挑选出来单独称重,即为优质果产量。采用以下公式计算每公顷山药产量和优质果产量:
| $ \begin{array}{l}产量(优质果产量)=\frac{小区山药总质量(优质果总质量)}{小区定向槽数量}\\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \times 每公顷定向槽总数\end{array} $ |
于2022年10月山药收获时采集土壤样品,每个小区随机采集5个定向槽中的土壤样品,混合后采用四分法保留1 kg土样,于当天运送回江苏省固体有机废弃物资源化高技术重点实验室,去除根系等杂物后部分土壤保存于–80 ℃冰箱备用,另外一部分风干后用于测定土壤理化性质。土壤pH、有机质、全氮、速效钾、有效磷等土壤理化性质测定参考《土壤农化分析》第3版[17],其中土壤pH测定采用玻璃电极法,土壤悬液水土比为5∶1 (m/V);土壤有机质(SOM)测定采用重铬酸钾氧化–外加热法;土壤全氮(TN)测定采用元素分析仪–干烧法;土壤有效磷(AP)测定采用碳酸氢钠浸提–钼锑抗比色法;土壤速效钾(AK)测定采用醋酸铵浸提–火焰光度计法。
1.7 土壤DNA提取与微生物群落高通量测序称取0.5 g保存于–80 ℃冰箱的土壤样品,按照DNeasy® PowerSoil® Kit试剂盒(QIAGEN,Inc.,CA,USA)操作手册提取土壤样品DNA,并使用NanoDrop 2000分光光度计检测DNA质量和浓度。参考Caporaso等[18]发表的方法构建测序文库,细菌16s RNA扩增采用引物515F(5'-GTGCCAGCMGCC GCGGTAA-3')/907R(5'-CCGTCAATTCMTTTRAGTTT-3'),采用真菌ITS扩增引物ITS5-1737F(5'-GGAA GTAAAAGTCGTAACAAGG-3')和ITS2-2043R(5'-GC TGCGTTCTTCATCGATGC-3'),后续细菌、真菌PCR扩增,文库准备及上机测序等均在美格基因科技有限公司完成,其中高通量测序平台为Illumina MiSeq PE 250。
1.8 数据处理与分析采用USEARCH软件对数据进行质控、拼接,并将拼接好的序列基于97% 的相似度水平聚类成可操作分类单元(OTU),提取每个OTU的代表性序列并生成OTU序列文件和表格。使用R语言(4.0.2版)中“vegan”包对不同处理间土壤细菌和真菌群落的α多样性计算Richness指数(Chao1值)。同时,基于Bray-Curits距离对各样品进行主坐标分析,运用置换多元方差分析(PERMANOVA)评估添加木霉菌对微生物群落的影响。利用冗余分析(RDA)分析微生物群落和土壤理化因子间的相关性。基于Mantel分析检验生物产量与环境因子的关系,使用“ggplot2”程序包对数据进行可视化,采用Excel 2019、SPSS 25.0软件进行数据处理和统计分析,利用单因素分析(ANOVA)进行显著性检验(P < 0.05)。
2 结果与分析 2.1 不同类型木霉菌施用对山药生长性状的影响如图 1所示,相比于CK,各木霉菌处理山药株高均有所增加,但仅4742木霉菌处理(T1)和木霉复合菌处理(T4)差异显著,分别增加了85.2% 和104.4%;除长枝木霉MD30处理(T3)外,其他木霉菌处理山药叶片长度均显著增加,其中T1、桔绿木霉JS84处理(T2)和T4分别增加了67.6%、73.8% 和91.6%;所有木霉菌处理山药叶片宽度均显著增加,增幅分别为66.2%、49.7%、48.3% 和91.0%,但木霉菌处理间无显著差异。总体而言,木霉菌处理均能促进山药生长,其中木霉复合菌处理对山药株高、叶片长度以及叶片宽度促进效果最为显著。

|
(CK,对照处理;T1,贵州木霉NJAU4742处理;T2, 桔绿木霉JS84处理;T3,长枝木霉MD30处理;T4,木霉复合菌处理。小写字母不同表示处理间差异显著(P < 0.05)。下同) 图 1 不同种类促生木霉菌施用对山药生长性状的影响 Fig. 1 Effects of different growth-promoting Trichoderma strains on growth traits of Chinese yam |
田间试验结果表明(图 2),各处理间山药总产量无显著差异;相比于CK,所有施用木霉菌处理优果产量均有所增加,增产率分别达到7.3%、26.4%、1.4% 和31.8%,但仅复合菌T4处理差异显著。

|
图 2 不同种类促生木霉菌施用对山药产量的影响 Fig. 2 Effects of different growth-promoting Trichoderma strains on yield of Chinese yam |
如表 1所示,不同种类木霉菌施用改变了土壤理化性质。其中,与CK相比,各处理pH均无显著变化;除T1处理外,各木霉菌处理土壤有机质含量均有所增加,但仅T4处理有显著性差异;各木霉菌处理下全氮含量有所增加,但仅T3和T4处理差异显著;各木霉菌处理有效磷含量均显著增加,其中T3处理土壤有效磷含量最高;除T1处理外,各木霉菌处理土壤速效钾含量均显著增加,其中T4处理速效钾含量最高。总体而言,木霉菌处理能增加土壤有机质、全氮、有效磷和速效钾含量,其中木霉复合菌处理提升效果最为显著。
|
|
表 1 不同种类促生木霉菌施用对山药土壤理化性质的影响 Table 1 Effects of different growth-promoting Trichoderma strains on soil physiochemical properties under Chinese yam |
如图 3所示,山药优果产量与土壤有机质、速效钾、有效磷含量呈显著正相关关系,而与土壤pH (R2 = 0.04,P = 0.88)和全氮含量(R2 = 0.07,P = 0.75)无显著相关关系。

|
图 3 山药优果产量与土壤养分的相关性散点图 Fig. 3 Scatter plot of correlation between yield of high-quality yam and soil nutrients |
不同处理土壤细菌和真菌α多样性结果如图 4所示。与CK相比,施用复合木霉菌的T4处理土壤中细菌群落丰富度(Chao1值)显著增加,而真菌群落丰富度虽有所降低但不显著;单施木霉菌的其他处理(T1、T2、T3)其细菌群落丰富度虽有所增加但不显著,而真菌群落丰富度显著降低。

|
图 4 不同木霉菌施用对山药细菌(A)和真菌(B)丰富度的影响 Fig. 4 Effects of different growth-promoting Trichoderma strains on abundance indices of soil bacterial (A) and fungal (B) communities under Chinese yam |
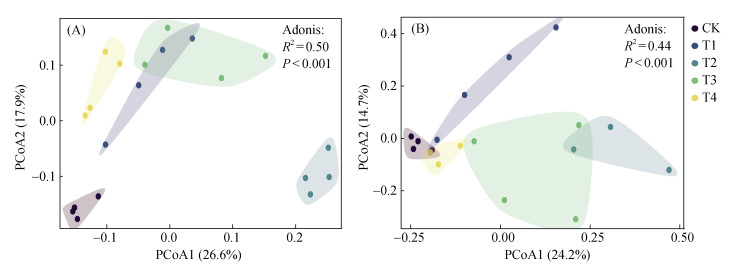
由图 5可知,基于Bray-Curtis距离的主坐标分析以及Adonis分析结果表明,与CK相比,施用木霉菌(T1、T2、T3、T4处理)显著(P < 0.05)改变了山药土壤细菌和真菌的群落结构。
|
图 5 基于Bray-Curtis距离的山药土壤细菌(A)和真菌(B)群落结构主坐标分析 Fig. 5 Principal coordinate analysis (PCoA) of soil bacteria (A) and fungal (B) community structures under Chinese yam based on Bray-Curits distance |
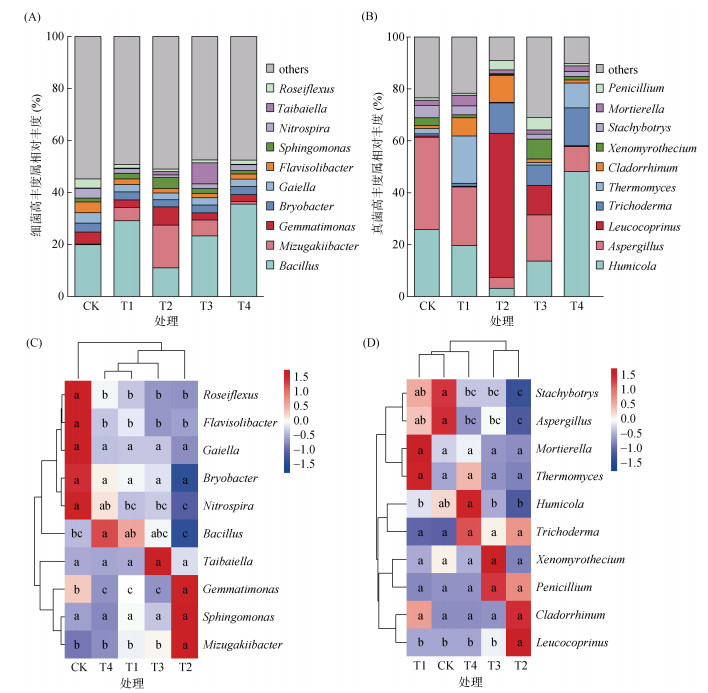
如图 6A所示,芽孢杆菌属(Bacillus)、水恒杆菌属(Mizugakiibacter)、芽单胞菌属(Gemmatimonas)、Bryobacter、Gaiella、Flavisolibacter、鞘氨醇单胞菌属(Sphingomonas)、硝化螺旋菌属(Nitrospira)、Taibaiella、Roseiflexus是细菌群落中相对丰度前10位的菌属。其中,与CK相比,施用木霉菌处理(T1、T2、T3、T4)土壤中Roseiflexus、Flavisolibacter、Gaiella、Bryobacter、硝化螺旋菌属相对丰度均有所降低,而T4处理显著提高了土壤中芽孢杆菌属的相对丰度(图 6C)。由图 6B可知,腐质霉属(Humicola)、曲霉属(Aspergillus)、Leucocoprinus、木霉属(Trichoderma)、嗜热子囊菌属(Thermoascus)、枝葡霉属(Cladosporium)、Xenomyrothecium、Stachybotrys、被胞霉属(Mortierella)、青霉属(Penicillium)是真菌群落中相对丰度前10位的菌属。与CK相比,施用木霉菌处理(T2、T3、T4)土壤中木霉属相对丰度增加,但差异不显著;与T1、T2、T3处理相比,T4处理下土壤中腐质霉属相对丰度显著提高(图 6D)。
|
(A、C为细菌群落;B、D为真菌群落) 图 6 不同处理土壤中细菌和真菌群落相对丰度前十位的菌属堆叠图和热图 Fig. 6 Stacked plot and heatmap of top ten genera in relative abundance in soil bacterial and fungal communities under different treatments |
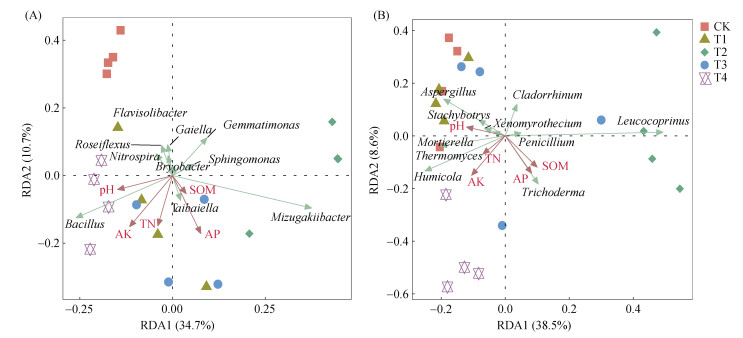
冗余度(RDA)分析结果表明,RDA1和RDA2解释了细菌群落45.4% 的变异性(图 7A)和真菌群落47.1% 的变异性(图 7B)。如图 7A所示,速效钾和pH是细菌群落组成的主要驱动理化因子,其中速效钾和pH与芽孢杆菌属相对丰度呈显著正相关(表 2)。全氮和速效钾是真菌群落组成的主要驱动理化因子(图 7B),其中速效钾与木霉属相对丰度呈显著正相关(表 3)。此外,土壤中有益微生物芽孢杆菌和木霉属的相对丰度与山药优果产量呈显著正相关。
|
图 7 不同处理土壤细菌(A)和真菌(B)群落与土壤理化性质的冗余分析 Fig. 7 Redundancy analysis (RDA) of bacterial (A) and fungal (B) communities with soil physicochemical properties under different treatments |
|
|
表 2 相对丰度前十位的细菌属与土壤理化性质和产量的相关性 Table 2 Correlation between top 10 bacteria genera in relative abundance with soil physicochemical properties and Chinese yam yield |
|
|
表 3 相对丰度前十位的真菌属与土壤理化性质和产量的相关性 Table 3 Correlation between top 10 fungal genera in relative abundance with soil physicochemical properties and Chinese yam yield |
本研究结果显示,在相同种植条件下,长枝木霉、桔绿木霉和贵州木霉对山药的株高、叶片长度以及叶片宽度均有促进作用,这与前人的研究结果一致[19]。这可能是由于木霉产生的一些代谢产物能够刺激植物生长,同时提高植物的光合作用,促进光合作用产物的积累[20]。与CK相比,木霉菌处理下的山药在生长状况和产量方面均显著提升[18]。此外,本研究发现,将3种木霉菌混合施用后,对山药的促生效果更为显著,不仅进一步提高了山药的总产量,还明显提升了优果率。
相较于CK,单独接种木霉和复合接种均改善了山药生长环境下的土壤理化性质,这与之前的研究结果一致[21-22]。有机质作为土壤肥力的重要指标,其含量提升能有效改善作物品质[22]。复合功能菌处理下显著提升土壤有机质水平,同时一些研究也发现添加外源木霉菌能够有效提升土壤全氮、有机质、有效磷、速效钾含量,为作物生长提供有效养分[19, 21-22]。相关性分析结果显示,土壤各养分因子与山药优果产量皆呈显著正相关(图 3)。这可能是由于木霉菌在进入土壤后在生命活动周期释放一些活性物质,使得土壤中的速效氮、磷、钾能够得到释放,供植物生长[23]。土壤的各理化性状与作物生长密切相关,各养分含量提高有助于改善作物生长环境,提升作物品质和质量。
本研究结果表明,复合功能微生物的接种处理对山药表现出显著的促生效应,这可能是由于功能微生物引入后富集了土壤中的有益菌群所致[24]。木霉菌处理下,山药根际土壤的细菌与真菌多样性及群落结构均发生明显变化,进而调控了微生物群落内部以及与土壤–作物系统间的互作反馈[25-26],从而促进植物生长,这一机制与前人研究结论相符[27]。在细菌群落中,多数优势菌属(如Roseiflexus、Flavisolibacter、Gaiella、Bryobacter及硝化螺旋菌属)在接种后相对丰度有所下降,而T4复合处理则显著提高了芽孢杆菌属的丰度,该菌属在生物防治和土壤生态系统健康维持中具有重要作用[28]。在真菌群落方面,所有木霉菌处理均提高了木霉菌属的丰度,符合接种预期;值得注意的是,T4处理还显著增强了腐质霉属的富集,该菌属通常参与土壤有机质分解和养分循环过程[29]。本研究进一步揭示,T4处理的促生机制不仅源于其所接种功能微生物的直接作用,更与其对土壤原生微生物群落的特异性调控密切相关。T4处理通过协同富集芽孢杆菌属与腐质霉属两类关键有益微生物,可能有效增强了土壤的生防功能与养分转化效率,从而在促进山药生长方面表现出优于单一接种处理的综合效应。
4 结论接种单一木霉菌有一定程度的促生效果,但复合木霉菌处理下更能激发有益菌群发挥作用(如芽孢杆菌属、木霉属等),从而调动植物对养分的吸收,最大程度发挥促进植物生长的正效应,建立起微生物–土壤–植物三者之间的密切联系,达到提高作物产量和品质的作用。
| [1] |
国家药典委员会组织编写. 中华人民共和国药典第4部2015年版英文版[M]. 北京: 中国医药科技出版社, 2017.
(  0) 0) |
| [2] |
Yao J, Wu C Y, Fan L J, et al. Effects of the long-term continuous cropping of Yongfeng yam on the bacterial community and function in the rhizospheric soil[J]. Microorganisms, 2023, 11(2): 274 DOI:10.3390/microorganisms11020274 (  0) 0) |
| [3] |
杨雪贞, 罗同阳, 赵雪萍, 等. 山药田土壤微生物群落分布特征及间作豆科植物的改良效果[J]. 中国土壤与肥料, 2023(4): 54-60 (  0) 0) |
| [4] |
Wackett L P, McKnight. Web alert: Microbes and plant nutrients: An annotated selection of world wide web sites relevant to the topics in microbial biotechnology: An annotated selection of world wide web sites relevant to the topics in microbial biotechnology[J]. Microbial Biotechnology, 2023, 16(6): 1393-1394 DOI:10.1111/1751-7915.14275 (  0) 0) |
| [5] |
Liu Y P, Zhang H H, Wang J, et al. Nonpathogenic Pseudomonas syringae derivatives and its metabolites trigger the plant "cry for help" response to assemble disease suppressing and growth promoting rhizomicrobiome[J]. Nature Communications, 2024, 15: 1907 DOI:10.1038/s41467-024-46254-3 (  0) 0) |
| [6] |
Chen P, Wang Y Z, Liu Q Z, et al. Phase changes of continuous cropping obstacles in strawberry (Fragaria × Ananassa Duch.) production[J]. Applied Soil Ecology, 2020, 155: 103626 DOI:10.1016/j.apsoil.2020.103626 (  0) 0) |
| [7] |
Xie X G, Zhao Y Y, Yang Y, et al. Endophytic fungus alleviates soil sickness in peanut crops by improving the carbon metabolism and rhizosphere bacterial diversity[J]. Microbial Ecology, 2021, 82(1): 49-61 DOI:10.1007/s00248-020-01555-0 (  0) 0) |
| [8] |
马田田, 杨兴明, 沈其荣, 等. 生物有机肥对防治山药根茎腐病和促进山药生长的研究[J]. 土壤, 2013, 45(2): 1301-1305 (  0) 0) |
| [9] |
谭梦迪, 冯天骄, 王平, 等. 近30年微生物菌剂改良土壤的研究进展[J/OL]. 土壤学报DOI: 10.11766/trxb2024 01110020.
(  0) 0) |
| [10] |
Khan R A A, Najeeb S, Chen J, et al. Insights into the molecular mechanism of Trichoderma stimulating plant growth and immunity against phytopathogens[J]. Physiologia Plantarum, 2023, 175(6): e14133 DOI:10.1111/ppl.14133 (  0) 0) |
| [11] |
Zin N A, Badaluddin N A. Biological functions of Trichoderma spp. for agriculture applications[J]. Annals of Agricultural Sciences, 2020, 65(2): 168-178 DOI:10.1016/j.aoas.2020.09.003 (  0) 0) |
| [12] |
Begum M F, Rahman M A, Alam M F. Biological control of Alternaria fruit rot of chili by Trichoderma species under field conditions[J]. Mycobiology, 2010, 38(2): 113-117 DOI:10.4489/MYCO.2010.38.2.113 (  0) 0) |
| [13] |
El Komy M H, Saleh A A, Eranthodi A, et al. Characterization of novel Trichoderma asperellum isolates to select effective biocontrol agents against tomato Fusarium wilt[J]. Plant Pathology Journal, 2015, 31(1): 50-60 DOI:10.5423/PPJ.OA.09.2014.0087 (  0) 0) |
| [14] |
Cai F, Chen W, Wei Z, et al. Colonization of Trichoderma harzianum strain SQR-T037 on tomato roots and its relationship to plant growth, nutrient availability and soil microflora[J]. Plant and Soil, 2015, 388(1): 337-350 (  0) 0) |
| [15] |
金林, 郭文琦, 张培通, 等. 浅生淮山药抗重茬优质高效种植技术[J]. 农业科技通讯, 2023(10): 207-209 (  0) 0) |
| [16] |
中华人民共和国农业农村部. 植物新品种特异性、一致性和稳定性测试指南山药: NY/T 2495-2013[S]. 北京: 中国标准出版社, 2013.
(  0) 0) |
| [17] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [18] |
Caporaso J G, Lauber C L, Walters W A, et al. Global patterns of 16S rRNA diversity at a depth of millions of sequences per sample[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(Suppl 1): 4516-4522 (  0) 0) |
| [19] |
冯亚楠. 木霉复合菌剂对水稻生长发育及产量的影响[J]. 园艺与种苗, 2023, 43(5): 95-97 (  0) 0) |
| [20] |
杨雄, 刘乐平, 李兴山, 等. 哈茨木霉对湿地松幼苗光合作用和生物量累积的影响[J]. 湖北林业科技, 2018, 47(6): 27-30 (  0) 0) |
| [21] |
王蓓, 李伟明, 黄忠阳, 等. 化肥减施条件下木霉生物有机肥对茄子生长和品质的影响[J]. 土壤, 2024, 56(3): 666-671 DOI:10.13758/j.cnki.tr202306130229 (  0) 0) |
| [22] |
周谈坛, 李丹丹, 邱丽丽, 等. 不同配施比例下秸秆和木本泥炭对快速提升土壤有机质和作物产量的耦合影响[J]. 土壤学报, 2023, 60(6): 1699-1711 (  0) 0) |
| [23] |
Zhang F G, Yuan J, Yang X M, et al. Putative Trichoderma harzianum mutant promotes cucumber growth by enhanced production of indole acetic acid and plant colonization[J]. Plant and Soil, 2013, 368(1): 433-444 (  0) 0) |
| [24] |
高雅新, 王甲果, 张翔凯, 等. 高产IAA哈茨木霉突变株M95的筛选及其对黄瓜的促生作用[J]. 南京农业大学学报, 2023, 46(3): 499-509 (  0) 0) |
| [25] |
莫雅旎, 郭赛, 欧燕楠, 等. 联合接种原生动物和木霉对黄瓜生长及土壤微生物区系的影响[J]. 南京农业大学学报, 2023, 46(2): 297-305 (  0) 0) |
| [26] |
Hang X N, Meng L X, Ou Y N, et al. Trichoderma-amended biofertilizer stimulates soil resident Aspergillus population for joint plant growth promotion[J]. NPJ Biofilms and Microbiomes, 2022, 8: 57 DOI:10.1038/s41522-022-00321-z (  0) 0) |
| [27] |
刘正洋, 王若斐, 乔策策, 等. 木霉生物有机肥对白菜和甘蓝产量及土壤微生物区系的影响[J]. 南京农业大学学报, 2020, 43(4): 650-657 (  0) 0) |
| [28] |
钟泽翔. 芽孢杆菌与木霉对黄瓜防病与促生效果初探[D]. 天津: 天津农学院, 2021.
(  0) 0) |
| [29] |
李航, 苏梦迪, 黄浪平, 等. 氮磷钾配施对植烟土壤速效养分和真菌多样性的影响[J]. 作物杂志, 2023(03): 238-245 (  0) 0) |
2. Institute of Cash Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
3. State Key Laboratory for Quality Ensurance and Sustainable Use of Dao-di Herbs, National Resource Center for Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China
 2025, Vol. 57
2025, Vol. 57


