2. 西南林业大学园林园艺学院, 昆明 650224;
3. 曲靖市烟草公司, 云南曲靖 655400
烟草(Nicotiana tabacum L.)是我国重要的经济作物之一[1]。云南优越的自然条件,使其成为全国烤烟种植面积最大的优质产区[2],然而,由于耕地资源限制和粮食作物产区相对比较集中且存在争地矛盾等因素的影响,云南省烤烟连作现象日益普遍[3]。长期连作会引起植烟土壤生态系统失调,烤烟病虫害频发,进而严重影响烤烟品质和产量[4]。高林等[5]研究发现,长期连作显著降低了植烟区土壤中细菌的多样性,同时提高了真菌的多样性,连作4年后土壤中细菌和真菌的群落结构及组成均发生显著变化。Tan等[6]研究进一步表明,多年烟草连作使得土壤养分含量和细菌多样性减少,同时一些关键类群丰度发生显著变化,这些因素共同导致了土传病害增加、生产潜力下降以及烟草质量受损。因此,植烟土壤生态系统的失衡被认为是引起烤烟连作障碍的主要原因之一。相较连作,烤烟与农作物合理轮作能够改善土壤结构及其微生态环境,提高土壤肥力和酶活性,减少病害的发生[1, 3, 7],从而有利于烤烟产量及品质提升。生物质炭是一种含碳多孔材料,具有可再生性、低成本、高孔隙度等特点[8],不仅能直接作用于土壤,还能通过调节土壤性质和植物根系代谢间接影响土壤微生物多样性[9],也能防控土传病害[10],被广泛用作土壤改良剂。大量研究表明,生物质炭能有效降低植烟连作土壤的自毒效应,保留大量的土壤养分,进一步促进烟草的生长[11]。同时,生物质炭的孔隙结构通过改变土壤微生物的相对丰度和群落组成,进而促进烤烟的发育和生物量积累[12]。赛子林等[13]研究发现,在植烟连作土壤中施用生物质炭有利于构建土壤真菌群落的多样性及网络结构的稳定性。因此,施用生物质炭能够有效改善植烟连作土壤结构和微生物环境,提升烟草产量与品质,实现可持续种植。
土壤有机碳(Soil organic carbon,SOC)指含碳化合物的复杂混合物,由动植物组织和不同分解阶段的微生物生物量组成,是土壤质量的重要组成部分[14]。微生物残体指微生物增殖、死亡或分泌形成的细胞外聚合残留物[15],其在土壤中的持续积累对碳动态具有重要影响[16]。有研究表明[17],全球农田土壤(0 ~ 20 cm表层土壤)中微生物残体碳对有机碳的平均贡献高达51%。氨基糖(Amino sugars,Ass)作为微生物残体的重要标识物,主要来源于微生物的细胞壁且有较高的稳定性和异源性,是评价土壤微生物群落结构和功能的重要指标之一[18]。其中,胞壁酸(Muramic acid,MurN)作为细菌微生物残体的标识物,它是以细菌细胞壁作为唯一来源;氨基葡萄糖(Glucosamine,GluN)存在于真菌和细菌中,对氨基糖的贡献较大。细菌中胞壁酸和氨基葡萄糖的含量比为1∶2;同时,GluN/MurN的比值用于反映真菌与细菌细胞壁残留物的相对比例[19-20]。Angst等[21]研究发现,相较于生物可利用的植物源输入,土壤中某些微生物分类群和微生物群落多样性在控制微生物坏死团碳(特别是在矿物有机质)中发挥着十分重要的作用。然而,烤烟长期连作通过降低土壤微生物多样性、增加病原菌积累、改变土壤养分循环及理化性质等方式影响微生物群落[4-6]。此外,烤烟连作土壤中微生物残体碳如何变化及其影响因素的研究相当有限。因此,探究植烟土壤中微生物残体碳对有机碳的固存和稳定,这对于理解连作障碍中微生物群落的变化具有重要意义。
曲靖市拥有优越的气候条件和丰富的土地资源,使其成为全国最大的优质烟叶生产基地[22]。本研究结合曲靖烟区实际生产情况,以烤烟品种K326为试验材料,依托连续5年连作和轮作(烟草−玉米轮作)的定位试验田进行试验,比较两种耕作模式下不同生物质炭施用量对土壤微生物残体碳积累特征的影响,探讨了微生物残体碳对土壤有机碳的贡献特性,揭示生物质炭在缓解连作障碍中的作用机制。通过本研究,旨在为解决烤烟连作障碍问题提供科学理论依据和实践指导。
1 材料与方法 1.1 试验区概况与供试材料试验地位于云南省曲靖市沾益区(25°40′ N,103°39′ E),全年气候温和,降水充沛,干湿季分明,属低纬度高原季风气候。试验地为连续5年连作烟田和5年轮作(烟草−玉米轮作)烟田,试验田地势平坦、肥力均匀,土壤类型均为红壤土,基本理化性质见表 1。供试生物质炭为经600 ℃热解的玉米秸秆生物质炭,基本理化性质为pH 10.09,有机质899.00 g/kg,全氮10.09 g/kg,全磷3.61 g/kg,有效磷100.89 mg/kg,速效钾14.59 g/kg。供试烟草品种为K326(玉溪中烟种子有限责任公司提供),采用漂浮育苗的方式培育,待烟苗生长到四叶期,选取长势一致的健康烟苗进行移栽。
|
|
表 1 供试土壤基本理化性质 Table 1 Initial physiochemical parameters of tested soil |
试验设置2种耕作模式,4个生物质炭处理(表 2),采用随机区组设计,各处理3次重复,每个小区(60.61 m2)100株烟,共计24个小区,1 100株/亩;根据当地的农艺措施,生物质炭采用种植前穴施(基肥与生物质炭混合均匀一次施入),有机肥全部用作基肥,肥料的基肥追肥比例为5∶5,按当地优质烟叶生产规范进行田间管理。
|
|
表 2 试验设计 Table 2 Experimental design |
烟草于2021年2月10日开始培育,2021年4月25日进行移栽。待烤烟移栽65 d后,每个小区随机选取3株烤烟,将其根际土样混为一个重复,每小区3次重复。将烟株完整取出后,抖落松散土壤,收集根系附近土壤。将土壤装入无菌聚丙烯袋中,放置冰盒带回实验室。过2 mm筛,去除土壤中的细根碎石等杂质。每个土壤样本被分成两部分:一部分放置实验室,等待自然风干后,用于测定土壤理化性质和土壤氨基糖含量;另一部分储存在−20 ℃冰箱,用于测定土壤含水量、铵态氮。
1.3 土壤样品测定 1.3.1 土壤理化性质测定土壤理化性质测定方法参照《土壤农化分析》[23]。土壤含水量(Soil water content,SWC)用铝盒将新鲜土壤置于105 ℃烘箱持续烘干48 h至恒重后,计算烘前烘后差值;土壤pH采用pH计测定(土水比1∶2.5);土壤有机碳(Soil organic carbon,SOC)和全氮(Total nitrogen,TN)用元素分析仪(Vario MAX,Elementar,德国)测定,土壤全磷(Total phosphorus,TP)用钼锑抗比色法测定。土壤铵态氮(Nitrate nitrogen,NH4+-N)采用紫外分光光度法(酚二磺酸比色法)测定。
1.3.2 土壤氨基糖的测定及计算根据Indorf等[24]的方法提取土壤氨基糖,并进行了少量修改[25]。胞壁酸(Muramic acid,MurN)、氨基葡萄糖(Glucosamine,GluN)、氨基半乳糖(Galactosamine,GalN)的浓度使用高性能液相色谱仪(Dionex Ultimate 3000, Thermo Fisher Scientific),配备十八烷基硅化硅胶柱(Accclaim120 C18,150 mm,4.6 mm,3 μm,Thermo Fisher Scientific),用邻苯二醛进行柱前衍生化处理。根据含有混合氨基糖的标准溶液的色谱图对单个氨基糖进行鉴定和定量。
从总GluN中扣除细菌来源的GluN,可以获得表征真菌残留物的真菌来源氨基葡萄糖(Fungal glucosamine,F_GluN):
| $ FNC = \left( {GluN \div 179.17 - 2 \times MurN \div 251.23} \right) \times 179.17 \times 9 $ | (1) |
| $ BNC = MurN \times 45 $ | (2) |
| $ MNC = FNC + BNC $ | (3) |
式中,FNC:真菌残体碳,BNC:细菌残体碳,MNC:微生物残体碳;GluN:氨基葡萄糖;MurN:胞壁酸;179.17和251.23是GluN和MurN的分子量,9和45分别是真菌残体碳和细菌残体碳的转换系数。
1.4 数据分析采用Microsoft Excel 2019对各项基础土壤数据进行整理。运用SPSS 26.0中单因素方差分析(One-way ANOVA)比较同一耕作模式下不同生物质炭添加量处理间的差异,采用Ducan法进行多重比较(α=0.05);耕作模式与生物质炭处理的交互作用运用双因素方差分析;F检验后通过独立样本t-检验分析同一生物质炭处理间不同耕作模式间的差异性。Mantel-test用于计算土壤氨基糖及微生物残体碳与土壤理化性质间的相关性,使用R软件,vegan包和MASS包计算。Canoco 5、Origin 2018、R软件进行绘图。所有数据均为平均值±标准误。
2 结果与分析 2.1 耕作模式与生物质炭处理下土壤理化性质特征由表 3可知,生物质炭处理对pH、SOC、TP、NH4+-N、C/N均显著影响,而SOC同时受耕作模式、生物质炭处理及二者交互作用的共同影响(P < 0.05)。在连作中,与C-B0相比,C-B1、C-B2、C-B3中SOC分别增加了2.19%、19.45%、31.92%,同时C/N分别增加了20.51%、19.93%、68.13%;TP分别降低了17.12%、11.64%、26.71%。在轮作中,与R-B0相比,R-B1、R-B2、R-B3中pH和C/N分别显著增加了12.44%、14.13%、16.90%和46.12%、41.66%、46.72%,而NH4+-N显著减低了73.87%、93.03%、94.43% (P < 0.05)。
|
|
表 3 不同耕作模式中土壤理化性质 Table 3 Soil physiochemical properties under different tillage practices |
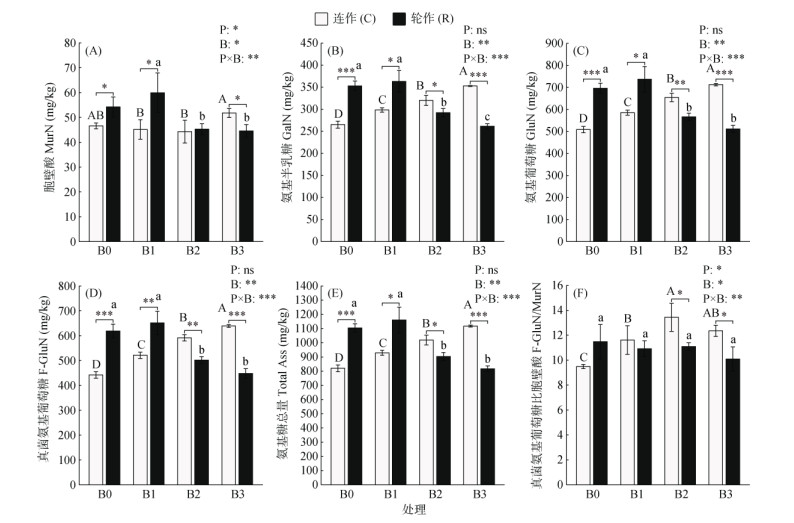
由图 1可知,生物质炭处理及二者的交互作用对MurN、GalN、GluN、F-GluN、Total Ass、F-GluN/MurN均有显著影响(P < 0.05)。在连作中,随着生物质炭含量的增加,GalN、GluN、F-GluN、Total Ass均呈现显著增加的趋势(P < 0.05),表现为C-B0 < C-B1 < C-B2 < C-B3(图 1A ~ 1E)。与C-B0相比,C-B1、C-B2、C-B3中F-GluN/MurN均显著增加(P < 0.05),分别增加了22.44%、41.62%、30.24%(图 1F)。在轮作中,与R-B0相比,R-B2、R-B3中MurN、GalN、GluN、F-GluN、Total Ass显著降低(P < 0.05),分别下降了16.50%、17.24%、18.69%、18.96%、18.12%和17.85%、25.92%、26.60%、27.70%、25.96%(图 1A ~ 1E)。随着生物质炭施用量的增加,连作中土壤各氨基糖含量逐渐增加(图 1B ~ 1D);在生物质炭B2、B3处理时,其含量显著高于轮作(P < 0.05)。
|
(不同大写字母表示连作耕作模式土壤中不同量生物质炭处理组之间差异显著(P < 0.05);不同小写字母表示轮作耕作模式土壤中不同量生物质炭处理组之间差异显著(P < 0.05);***表示极其显著(P < 0.001),**表示极显著(P < 0.01),*表示显著(P < 0.05),ns表示不显著(P > 0.05),下同) 图 1 不同耕作模式中土壤氨基糖的含量 Fig. 1 Content of soil amino sugars under different tillage practices |
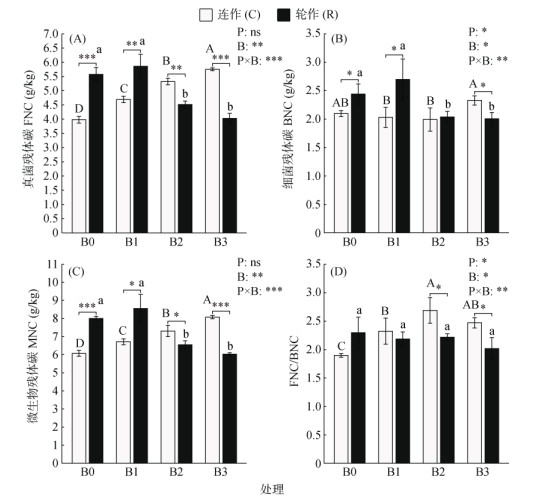
由图 2可知,耕作模式对BNC、FNC/BNC有显著影响,而生物质炭处理及二者的交互作用均对FNC、BNC、MNC、FNC/BNC有显著影响(P < 0.05)。在连作中,随着生物质炭含量的增加,FNC和MNC呈显著增加的趋势(P < 0.05),表现为C-B0 < C-B1 < C-B2 < C-B3(图 2A ~ 2C)。在轮作中,与R-B0相比,FNC、BNC、MNC均表现出一致的变化趋势,其中R-B2和R-B3的值显著降低(P < 0.05),分别降低了18.85%、16.39%、18.23%和27.65%、18.03%、24.72%,R-B1的值无显著变化且为最大值(图 2A ~ 2C)。在生物质炭B0、B1下,连作中FNC、BNC、MNC显著低于轮作;而在B2、B3下,其值显著高于轮作(P < 0.05)。其中,FNC/BNC反映了真菌和细菌对微生物残体的相对贡献。在连作中,与C-B0相比,C-B1、C-B2、C-B3中FNC/BNC均显著增加(P < 0.05),分别增加了22.11%、41.58%、30%(图 2D);在轮作中,各处理组FNC/BNC均无显著变化。
|
图 2 不同耕作模式中土壤微生物残体碳的含量 Fig. 2 Contents of soil microbial residue carbon under different tillage practices |
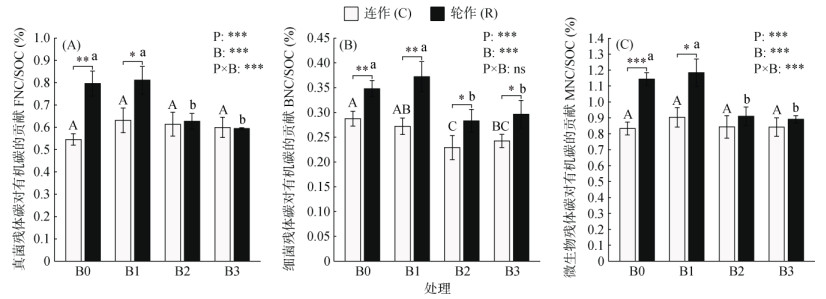
由图 3可知,耕作模式、生物质炭处理及其交互作用对FNC/SOC、MNC/SOC有显著影响,耕作模式、生物质炭处理对BNC/SOC显著影响。在连作中,与C-B0相比,C-B1、C-B2、C-B3中BNC/SOC均有下降,分别下降了5.32%、20.24%、15.69%(图 3B)。在轮作中,与R-B0相比,R-B1中FNC/SOC、BNC/SOC、MNC/SOC均无显著差异且为最大值,R-B2和R-B3均显著降低(P < 0.05),分别下降了21.23%、18.65%、20.45%和25.35%、14.83%、22.15%。在生物质炭B0、B1下,连作中FNC/SOC、BNC/SOC、MNC/SOC显著低于轮作(P < 0.05);在生物质炭B2、B3下,轮作中BNC/SOC显著高于连作(P < 0.05)。
|
图 3 不同耕作模式中土壤微生物残体碳对有机碳的贡献 Fig. 3 Contributions of soil microbial residue carbon to organic carbon under different tillage practices |
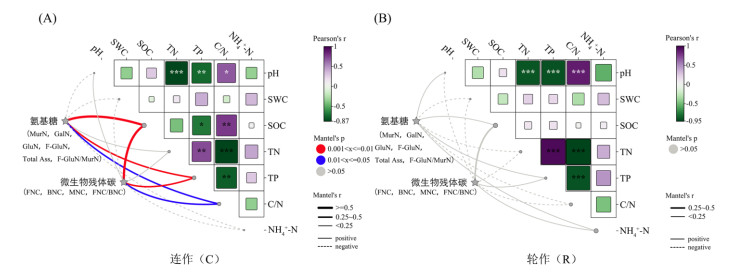
由图 4可知,在连作中,pH与TN、TP显著负相关,与C/N显著正相关;SOC与C/N显著正相关,与TP显著负相关;TN与TP显著正相关,与C/N显著负相关;土壤氨基糖、微生物残体碳受SOC、TP、C/N的显著正影响(P < 0.05),其中受SOC影响最大(图 4A)。在轮作中,pH与TN、TP显著负相关,与C/N显著正相关;TN与TP显著正相关,与C/N显著负相关;TP与C/N显著负相关(P < 0.05);而土壤氨基糖和微生物残体碳与土壤理化性质无显著相关性(图 4B)。
|
(红线表示极显著相关,蓝线表示显著相关,灰线表示无显著相关。实线表示正相关的Mantel's r值,虚线表示负相关的Mantel's r值。*表示在0.05水平上显著(P < 0.05),**表示在0.01水平上显著(P < 0.01),***表示在0.001水平上显著(P < 0.001)) 图 4 不同耕作模式中土壤氨基糖及微生物残体碳受土壤理化性质的影响 Fig. 4 Effects of soil physicochemical properties on amino sugars and microbial residue carbon under different tillage practices |
此外,根据连作中土壤氨基糖及微生物残体碳与土壤理化性质的RDA分析结果可知,RDA1和RDA2两轴解释了88.56%的差异信息,其中SOC对土壤氨基糖变异的解释度最高,为70.9%(F=24.4,P=0.002) (图 5A)。RDA1和RDA2两轴解释了89.21%的差异信息,其中SOC对微生物残体碳变异的解释度最高,为66.2%(F=19.6,P=0.002)(图 5B)。
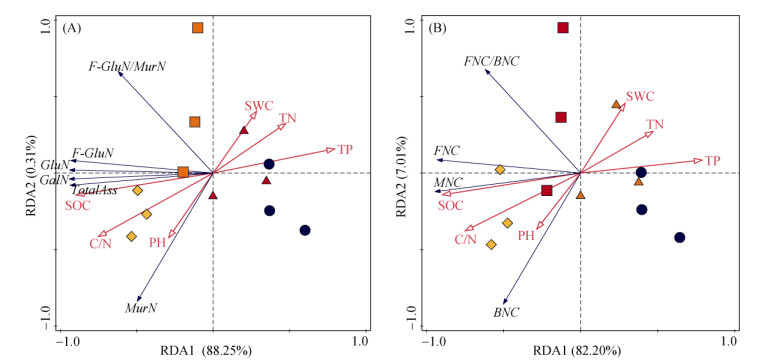
|
(pH,酸碱度;SWC,含水量;SOC,有机碳;TN,全氮;TP,全磷;C/N,有机碳与全氮之比;MurN,胞壁酸;GalN,氨基半乳糖;GluN,氨基葡萄糖;F-GluN,真菌氨基葡萄糖;Total Ass,氨基糖总量;F-GluN/MurN,真菌氨基葡萄糖与胞壁酸之比;FNC,真菌残体碳;BNC,细菌残体碳;MNC,微生物残体碳;FNC/BNC,真菌残体碳与细菌残体碳之比) 图 5 连作模式中土壤氨基糖及微生物残体碳与土壤理化性质的RDA分析 Fig. 5 Redundancy analysis (RDA) of soil amino sugars and microbial residue carbon in relation to soil physicochemical properties under cropping patterns |
生物质炭是一种富含碳的物质,因其稳定性和多孔性而被用于改善土壤质量[8]。在不同的耕作模式中施用生物质炭对土壤氨基糖含量的影响可以通过多种机制表现出来。本研究发现,随着生物质炭施用量的增加,连作土壤中氨基糖含量显著增加;这与之前的研究结果一致,长期连作可能导致土壤养分耗竭和微生物多样性下降,施用生物质炭一定程度能缓解连作引起的“土壤疲劳”,改善土壤环境,进而促进氨基糖积累[11]。同时生物质炭也改善了植烟土壤微生态环境,从而为微生物提供更好的生存产所,增强了微生物的活性和多样性[27]。相反,在轮作中,300 kg/hm2的生物质炭有利于土壤中氨基糖的积累;而随着施用量的增加,氨基糖的含量显著下降。本研究推测,作物轮作中多样化的植物残体输入和更健康的微生物群落可能与生物质炭形成协同作用,进一步提高氨基糖含量;而过量生物质炭可能改变微生物的群落结构和活性,同时影响有机质的分解,从而影响氨基糖的生成和积累。这与Xie等[28]对生物质炭调节小麦−玉米轮作的研究结果类似。
同样,随着生物质炭施用量的增加,连作中土壤微生物残体碳显著增加;而轮作中微生物残体碳表现出先增后降的趋势,这与土壤氨基糖的变化类似。植物−微生物−土壤之间的相互作用一直保持着动态平衡[29];长期连作土壤中养分匮乏、微生物群落单一,而生物质炭的输入改变了土壤中微生物群落结构,促进了养分循环,从而调节烟叶的生长及代谢[30];也增加了微生物活性及代谢,导致了微生物残体碳的积累,进而一定程度上缓解了植烟土壤连作障碍。相反,轮作土壤中养分较均衡,且微生物活性及多样性较高;过量的生物质炭输入反而抑制了微生物的活性,导致积累较少微生物残体碳。此外,随着生物质炭施用量的增加,连作中土壤氨基糖及残体碳含量逐渐增加且显著高于轮作,这可能是微生物在不同养分条件下的应对策略不用。有研究表明[31],不同连作年限土壤中施用一定量生物质炭,有利于促进微生物群落组成和结构的改变,提高了土壤中真菌丰度及多样性。
3.2 耕作模式与生物质炭处理下土壤微生物残体碳对有机碳贡献的影响在土壤碳循环和土壤有机质形成中微生物的合成代谢活动发挥着重要作用,而不仅仅是作为其矿化到CO2的参与者,这也被纳入“土壤微生物碳泵”的概念框架[32-33]。本研究发现,微生物坏死团对有机碳的贡献达50%以上,同时真菌残体碳的贡献高于细菌残体碳;这与Liang等[16]对微生物坏死团对土壤有机质贡献的定量评价的结果一致。这可能由于土壤中的细菌残留物主要被分解为多肽,可直接被微生物利用[34];而真菌残留物周转时间较长[35],并且在长期内对有机碳的稳定贡献更大。在保护性耕作的农田中,Yang等[36]也发现真菌比细菌更能决定土壤有机碳的增加。因此,对于田间管理需要促进微生物生物量的形成和坏死体的保存,以维持健康的土壤状况。微生物坏死团是土壤有机碳储存的重要贡献者,是微生物利用的资源池[32]。Kallenbach等[37]研究表明,微生物生理直接受到农业管理的影响,并与有机碳循环和储存密切相关。本研究发现,连作土壤中施用不同比例生物质炭后土壤微生物残体碳对有机碳的贡献并没有显著变化;这与Liu等[38]研究结果一致,外源碳输入促进了微生物的同化与代谢,但微生物残留物对有机碳的相对贡献可能具有一定饱和性。此外,土壤中有机碳的截获过程由微生物代谢周转和植物组分存留共同调控[39],连作土壤中氨基糖及微生物残体碳含量随着生物质炭施用量的增加而增加,同时土壤中有机碳含量同样增加,这也导致微生物残体碳对有机碳的贡献没有发生显著变化。然而,与连作相比,轮作中未施用及适量施用生物质炭(300 kg/hm2)后,土壤中细菌、真菌及微生物残体碳对有机碳的贡献比显著增加,说明轮作土壤中适量添加生物质炭有利于增加微生物的群落结构和活性,进而提高其贡献比。因此,阐明土壤微生物生存策略形成微生物坏死团的机制,对理解农业生态系统有机碳储量具有重要意义。
3.3 耕作模式与生物质炭处理下土壤氨基糖及微生物残体碳的影响因素通过Mantel-test检验及RDA分析,本研究发现土壤有机碳是影响连作中土壤氨基糖及微生物残体碳含量的最主要因素;这与吕付泽等[40]探究免耕和不同秸秆覆盖量下土壤微生物群落组成及残留物的变化的研究结果类似,土壤有机碳是影响微生物群落组成及其残留物积累的重要因素之一。Huang等[41]研究表明,土壤有机碳和活微生物量是影响土壤微生物残留量动态的主要因素。土壤的生物地球化学性质对于微生物残留物在土壤中的持久性尤为重要[42],连作土壤中养分及微生物较单一匮乏,不足以维持微生物残留物的积累,而外源有机碳的输入有利于改善土壤环境、提高微生物的活性及代谢,一定程度上能缓解植烟土壤连作障碍。相反,轮作土壤中,土壤氨基糖及微生物残体碳未明显受到土壤理化因素的影响,这可能与土壤中养分充足和功能多样性较高有关。Zhang等研究表明[43],轮作通过增加碳输入的数量、质量和化学多样性,促进了土壤群落和生物-非生物之间的相互作用,对土壤有机质的形成和储存产生了积极影响。本研究推测,连作中土壤有机碳的变化在短期内对微生物残体碳的影响可能更加显著,而生物质炭的影响需要更长时间或在特定条件下才能显现。因此,下一步将进行长期的田间试验,更深入探索生物质炭施用对连作障碍的缓解机制,以期为缓解烤烟连作障碍提供理论与试验参考。
4 结论本研究比较分析了轮连作烤烟耕作模式土壤配施不同量玉米秸秆生物质炭处理下的根际土壤微生物残体碳积累特征及影响因素。本研究结果表明,生物质炭施用对土壤微生物残体积累的影响因耕作模式而异。在连作中,随着生物质炭施用量的增加,土壤氨基糖和微生物残体碳含量均显著提升,但其对土壤有机碳的贡献率保持稳定;而在轮作模式下,土壤氨基糖、微生物残体碳及土壤微生物残体碳对有机碳的贡献呈现先升高后降低的响应趋势。进一步分析发现,土壤有机碳含量是决定连作模式中土壤微生物残体积累的关键控制因素。土壤微生物群落结构组成及多样性导致了连作和轮作土壤间的差异,而施用生物质炭有利于增加连作土壤中微生物的活性及多样性,能达到缓解植烟土壤连作障碍及土壤改良作用。
| [1] |
田震, 张灿, 孙晋浩, 等. 酒糟有机肥施用对植烟土壤养分和真菌群落结构的影响[J]. 土壤, 2024, 56(3): 533-539 DOI:10.13758/j.cnki.tr202307150281 (  0) 0) |
| [2] |
王政, 刘久羽, 彭博, 等. 云南红壤坡耕地烤烟生长季土壤养分迁移特征[J]. 土壤, 2023, 55(4): 918-924 DOI:10.13758/j.cnki.tr.2023.04.027 (  0) 0) |
| [3] |
周旭东, 韩天华, 申云鑫, 等. 4种轮作模式下长期连作烟田土壤微生态的响应特征[J]. 中国农业科技导报, 2024, 26(3): 174-187 (  0) 0) |
| [4] |
刘楚祺, 赵高坤, 邓小鹏, 等. 连作年限对植烟土壤养分和微生物量及胞外酶化学计量特征的影响[J]. 云南农业大学学报(自然科学), 2023, 38(3): 494-502 (  0) 0) |
| [5] |
高林, 王新伟, 申国明, 等. 不同连作年限植烟土壤细菌和真菌群落结构差异[J]. 中国农业科技导报, 2019, 21(8): 147-152 (  0) 0) |
| [6] |
Tan G, Liu Y J, Peng S G, et al. Soil potentials to resist continuous cropping obstacle: Three field cases[J]. Environmental Research, 2021, 200: 111319 DOI:10.1016/j.envres.2021.111319 (  0) 0) |
| [7] |
王亚麒, 刘京, 芶剑渝, 等. 长期有机无机配施下烤烟-玉米轮作优化土壤微生物活化无机磷[J]. 土壤学报, 2022, 59(3): 808-818 (  0) 0) |
| [8] |
Sashidhar P, Kochar M, Singh B, et al. Biochar for delivery of agri-inputs: Current status and future perspectives[J]. Science of the Total Environment, 2020, 703: 134892 DOI:10.1016/j.scitotenv.2019.134892 (  0) 0) |
| [9] |
马泊泊, 黄瑞林, 张娜, 等. 秸秆生物质炭对根际土壤细菌-真菌群落分子生态网络的影响[J]. 土壤学报, 2019, 56(4): 964-974 (  0) 0) |
| [10] |
Zhu X Q, Chen Y, Jia M, et al. Managing tobacco black shank disease using biochar: Direct toxicity and indirect ecological mechanisms[J]. Microbiology Spectrum, 2024, 12(10): e0014924-24 DOI:10.1128/spectrum.00149-24 (  0) 0) |
| [11] |
Hu H J, Meng J, Zheng H, et al. Relief effect of biochar on continuous cropping of tobacco through the reduction of p-hydroxybenzoic acid in soil[J]. Heliyon, 2024, 10(12): e33011 DOI:10.1016/j.heliyon.2024.e33011 (  0) 0) |
| [12] |
Yang L Y, Li S C, Ahmed W, et al. Exploring the relationship between biochar pore structure and microbial community composition in promoting tobacco growth[J]. Plants, 2024, 13(21): 2952 DOI:10.3390/plants13212952 (  0) 0) |
| [13] |
赛子林, 韩世欣, 齐虹凌, 等. 添加生物炭对烟草连作土壤化学性质及真菌群落的影响[J]. 江苏农业科学, 2024, 52(8): 242-252 (  0) 0) |
| [14] |
Lal R. Digging deeper: A holistic perspective of factors affecting soil organic carbon sequestration in agroecosystems[J]. Global Change Biology, 2018, 24(8): 3285-3301 DOI:10.1111/gcb.14054 (  0) 0) |
| [15] |
Hall S J, Ye C L, Weintraub S R, et al. Molecular trade-offs in soil organic carbon composition at continental scale[J]. Nature Geoscience, 2020, 13(10): 687-692 DOI:10.1038/s41561-020-0634-x (  0) 0) |
| [16] |
Liang C, Amelung W, Lehmann J, et al. Quantitative assessment of microbial necromass contribution to soil organic matter[J]. Global Change Biology, 2019, 25(11): 3578-3590 DOI:10.1111/gcb.14781 (  0) 0) |
| [17] |
Wang B R, An S S, Liang C, et al. Microbial necromass as the source of soil organic carbon in global ecosystems[J]. Soil Biology and Biochemistry, 2021, 162: 108422 DOI:10.1016/j.soilbio.2021.108422 (  0) 0) |
| [18] |
李庭宇, 李双异, 刘旭, 等. 土壤微生物标识物—氨基糖的研究进展[J]. 土壤通报, 2022, 53(1): 241-252 (  0) 0) |
| [19] |
Engelking B, Flessa H, Joergensen R G. Shifts in amino sugar and ergosterol contents after addition of sucrose and cellulose to soil[J]. Soil Biology and Biochemistry, 2007, 39(8): 2111-2118 DOI:10.1016/j.soilbio.2007.03.020 (  0) 0) |
| [20] |
Chen X B, Xia Y H, Hu Y J, et al. Effect of nitrogen fertilization on the fate of rice residue-C in paddy soil depending on depth: 13C amino sugar analysis[J]. Biology and Fertility of Soils, 2018, 54(4): 523-531 DOI:10.1007/s00374-018-1278-5 (  0) 0) |
| [21] |
Angst G, Angst Š, Frouz J, et al. Stabilized microbial necromass in soil is more strongly coupled with microbial diversity than the bioavailability of plant inputs[J]. Soil Biology and Biochemistry, 2024, 190: 109323 DOI:10.1016/j.soilbio.2024.109323 (  0) 0) |
| [22] |
杨树明, 余小芬, 邹炳礼, 等. 曲靖植烟土壤pH和主要养分空间变异特征及其影响因素[J]. 土壤, 2021, 53(6): 1299-1308 DOI:10.13758/j.cnki.tr.2021.06.025 (  0) 0) |
| [23] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [24] |
Indorf C, Dyckmans J, Khan K S, et al. Optimisation of amino sugar quantification by HPLC in soil and plant hydrolysates[J]. Biology and Fertility of Soils, 2011, 47(4): 387-396 DOI:10.1007/s00374-011-0545-5 (  0) 0) |
| [25] |
Mou Z J, Kuang L H, Yan B Y, et al. Influences of sample storage and grinding on the extraction of soil amino sugars[J]. Soil Ecology Letters, 2020, 2: 157-163 DOI:10.1007/s42832-020-0031-9 (  0) 0) |
| [26] |
Xu Y D, Gao X D, Pei J B, et al. Crop root vs. shoot incorporation drives microbial residue carbon accumulation in soil aggregate fractions[J]. Biology and Fertility of Soils, 2022, 58(8): 843-854 DOI:10.1007/s00374-022-01666-5 (  0) 0) |
| [27] |
Ahmed A, Kurian J, Raghavan V. Biochar influences on agricultural soils, crop production, and the environment: A review[J]. Environmental Reviews, 2016, 24(4): 495-502 DOI:10.1139/er-2016-0008 (  0) 0) |
| [28] |
Xie Y X, Dong C, Chen Z Y, et al. Successive biochar amendment affected crop yield by regulating soil nitrogen functional microbes in wheat-maize rotation farmland[J]. Environmental Research, 2021, 194: 110671 DOI:10.1016/j.envres.2020.110671 (  0) 0) |
| [29] |
Janzen H H. Beyond carbon sequestration: Soil as conduit of solar energy[J]. European Journal of Soil Science, 2015, 66(1): 19-32 DOI:10.1111/ejss.12194 (  0) 0) |
| [30] |
Yan S, Ren T B, Wan Mahari W A, et al. Soil carbon supplementation: Improvement of root-surrounding soil bacterial communities, sugar and starch content in tobacco (N. Tabacum)[J]. Science of the Total Environment, 2022, 802: 149835 DOI:10.1016/j.scitotenv.2021.149835 (  0) 0) |
| [31] |
王雪玉, 刘金泉, 胡云, 等. 生物炭对设施连作土壤真菌群落结构与多样性的影响[J]. 农业机械学报, 2022, 53(7): 347-353 (  0) 0) |
| [32] |
Zhu X F, Min K K, Feng K, et al. Microbial necromass contribution to soil carbon storage via community assembly processes[J]. Science of the Total Environment, 2024, 951: 175749 DOI:10.1016/j.scitotenv.2024.175749 (  0) 0) |
| [33] |
Li Y Z, Wang S N, Yang Y L, et al. Global synthesis on the response of soil microbial necromass carbon to climate-smart agriculture[J]. Global Change Biology, 2024, 30(5): e17302 DOI:10.1111/gcb.17302 (  0) 0) |
| [34] |
Hu Y T, Zheng Q, Noll L, et al. Direct measurement of the in situ decomposition of microbial-derived soil organic matter[J]. Soil Biology and Biochemistry, 2020, 141: 107660 DOI:10.1016/j.soilbio.2019.107660 (  0) 0) |
| [35] |
Schweigert M, Herrmann S, Miltner A, et al. Fate of ectomycorrhizal fungal biomass in a soil bioreactor system and its contribution to soil organic matter formation[J]. Soil Biology and Biochemistry, 2015, 88: 120-127 DOI:10.1016/j.soilbio.2015.05.012 (  0) 0) |
| [36] |
Yang Y L, Xie H T, Mao Z, et al. Fungi determine increased soil organic carbon more than bacteria through their necromass inputs in conservation tillage croplands[J]. Soil Biology and Biochemistry, 2022, 167: 108587 DOI:10.1016/j.soilbio.2022.108587 (  0) 0) |
| [37] |
Kallenbach C M, Grandy A S, Frey S D, et al. Microbial physiology and necromass regulate agricultural soil carbon accumulation[J]. Soil Biology and Biochemistry, 2015, 91: 279-290 DOI:10.1016/j.soilbio.2015.09.005 (  0) 0) |
| [38] |
Liu X, Zhou F, Hu G Q, et al. Dynamic contribution of microbial residues to soil organic matter accumulation influenced by maize straw mulching[J]. Geoderma, 2019, 333: 35-42 DOI:10.1016/j.geoderma.2018.07.017 (  0) 0) |
| [39] |
霍海南, 李杰, 张效琛, 等. 不同施肥管理措施对农田土壤中植物和微生物残留组分的影响[J]. 应用生态学报, 2020, 31(9): 3060-3066 (  0) 0) |
| [40] |
吕付泽, 杨雅丽, 鲍雪莲, 等. 免耕不同秸秆覆盖量对黑土微生物群落及其残留物的影响[J]. 应用生态学报, 2023, 34(4): 903-912 (  0) 0) |
| [41] |
Huang Y, Liang C, Duan X W, et al. Variation of microbial residue contribution to soil organic carbon sequestration following land use change in a subtropical karst region[J]. Geoderma, 2019, 353: 340-346 DOI:10.1016/j.geoderma.2019.07.028 (  0) 0) |
| [42] |
Ni X Y, Liao S, Tan S Y, et al. A quantitative assessment of amino sugars in soil profiles[J]. Soil Biology and Biochemistry, 2020, 143: 107762 DOI:10.1016/j.soilbio.2020.107762 (  0) 0) |
| [43] |
Zhang K L, Maltais-Landry G, Liao H L. How soil biota regulate C cycling and soil C pools in diversified crop rotations[J]. Soil Biology and Biochemistry, 2021, 156: 108219 DOI:10.1016/j.soilbio.2021.108219 (  0) 0) |
2. College of Landscape Architecture and Horticulture, Southwest Forestry University, Kunming 650224, China;
3. Qujing Tobacco Company, Qujing, Yunnan 655400, China
 2025, Vol. 57
2025, Vol. 57


