2. 中国科学院大学, 北京 100049
土壤中的微生物含量极其丰富,土壤和地表深处的微生物约占地球生物量的18.18%,土壤中也拥有地球上最多样化和最复杂的微生物群落。土壤微生物作为地球元素循环的引擎,在养分分解、污染物消纳、气候变化调节、地上–地下生态系统联系中发挥着重要作用[1]。在土壤微生物中,细菌是最丰富且最具多样性的生物群体之一,直接影响土壤肥力和土壤多功能性,在土壤中发挥着关键作用[2]。因此,深入研究土壤细菌群落变化规律和影响因素对可持续农业生产具有重要的科学意义。
土壤细菌群落的组成和分布受到土壤环境因素的显著影响。已有研究表明,环境因子在全球尺度上驱动了土壤微生物群落的空间分布模式[3]。不同土壤类型的细菌群落分布特征也存在差异,如徐扬等[4]研究发现,湖南邵阳红壤的细菌丰富度和多样性相较于河北滦县褐土更低。此外,土壤理化因子也会影响微生物群落多样性及组成,尤其是土壤养分的生物可利用性,不仅改变了微生物群落结构,还调节了其在养分循环过程中的功能表达。许多研究表明,土壤pH是影响细菌多样性及群落组成的关键环境因子。一方面,土壤微生物能够通过代谢活动主动调节土壤pH;另一方面,土壤pH作为土壤环境的关键因子,显著影响着微生物群落的结构与组成[5]。其余理化因子也会影响细菌群落,如杜昊楠等[6]研究发现,土壤有机质、全磷、全钾显著影响西双版纳与海南地区细菌群落分布;石广萍等[7]研究表明,土壤全磷是驱动红壤细菌多样性和群落变异的关键因子。由此可见,决定土壤细菌群落组成的影响因子很多,针对特定土壤,揭示其主要影响因子才能更好地制定合理的农田管理措施。
我国东北黑土区是世界四大黑土区之一,作为我国重要的粮食主产区和最大的商品粮供给基地,是我国粮食安全的“压舱石”。然而,由于不合理耕作、化肥农药过量施用、机械化农业及各种自然因素导致黑土区土壤退化[8-9]。因此,土壤质量的维持与提升成为黑土区农业可持续发展的重要议题,土壤微生物作为土壤健康的重要指示因子和生态过程的核心驱动者,在东北黑土区研究中备受关注。杨青松等[10]发现,侵蚀–沉积显著影响东北黑土区坡耕地微生物组成及多样性。Zhang等[11]基于黑龙江海伦的田间试验发现,微生物群落的复杂性对玉米产量有较大贡献。通过对黑土区不同施肥处理的土壤微生物分析发现,长期施用化肥和有机肥通过提高碳氮循环相关功能基因的丰度,促进了土壤碳氮循环效率[12];而粪肥则通过影响磷循环相关功能基因,调控土壤磷循环过程[13]。
与此同时,也有研究关注东北黑土区土壤微生物的分布格局及其驱动机制,探讨不同环境因素如何影响土壤微生物的空间分布及其与土壤性质的相互关系。Liu等[14]发现在塑造中国东北黑土区细菌群落的过程中,土壤有机碳含量和pH等当代环境因子的作用比地理距离等历史因素更为显著。然而,黑土区分布范围较广,作物类型和肥力水平差异较大,现有的研究样本数量较为有限,难以深入研究土壤理化因子对土壤微生物群落结构的系统性影响。本研究以典型黑土区旱地土壤为研究对象,利用生态学大尺度采样的方法,旨在分析土壤细菌群落的分异特征及其主要影响因子,以期为黑土区土壤细菌多样性保护与土壤健康管理提供科学依据。
1 材料与方法 1.1 土壤样品采集土壤样本采自黑龙江省36个县市(44.67°N ~ 49.97°N,124.90°E ~ 132.56°E)。在每个县市内的东、西、北、南和中部选取5个样点,每个样点之间至少相距5 km,共采集180个土壤样本,采样点分布如图 1所示。从新鲜土壤样本中剔除肉眼可见的树根和石块,然后过2 mm筛。将均匀的土壤样本分成两部分,一部分风干,用于分析理化性质;另一部分放入4 ℃冰箱保存,用于测定土壤微生物指标。

|
(该图基于国家自然资源部标准地图服务网站下载的审图号为GS(2017)1268号的标准地图制作,底图无修改) 图 1 研究区样点分布 Fig. 1 Distribution of sampling sites |
参照《土壤农化分析》[15]测定土壤理化性质。土壤pH使用pH计测定(水土质量比2.5∶1);土壤有机质(SOM)采用重铬酸钾–硫酸容量法测定;全氮(TN)和速效氮(AN)分别使用凯氏定氮法和碱水解法测定;全磷(TP)和有效磷(AP)分别使用酸溶–钼锑抗比色法和碳酸氢钠法测定;全钾(TK)和速效钾(AK)分别使用氢氟酸–高氯酸消煮法和乙酸铵提取法测定。
1.3 土壤DNA提取及高通量测序使用FastDNA SPIN Kit(MP Biomedicals,CA,USA)提取土壤DNA。利用广东美格基因科技有限公司的测序平台进行高通量测序分析。采用引物515f-R806对细菌16S rRNA基因进行扩增。使用QIIME2软件(v2023.7,https://qiime2.org/)分析原始序列数据,并基于Silva数据库(v138,https://www.arb-silva.de/)对细菌基因序列进行注释。
1.4 数据处理采用R软件(v4.2.2)进行数据统计分析。使用“vegan”包进行Mantel检验、冗余分析(RDA)及基于Bray-Curtis距离的主坐标分析(PCoA);利用“igraph”包构建基于Spearman相关性矩阵的细菌共现网络,并通过Gephi软件(v0.9.2,https://gephi.org/)对共现网络进行可视化;通过Kruskal-Wallis检验分析在门水平上有显著差异的物种。
2 结果与分析 2.1 土壤理化因子及细菌群落组成分布特征土壤理化因子测定结果如图 2及表 1所示,均呈现了很好的梯度范围,其中pH为4.93 ~ 8.25,涵盖了从酸性到碱性各种酸碱度的土壤;SOM为17.56 ~ 71.97 g/kg,TN为0.94 ~ 3.66 g/kg,TP为0.36 ~ 1.72 g/kg,TK为20.06 ~ 35.67 g/kg;并且速效养分指标AN、AP和AK也有较好的梯度分布。参照全国第二次土壤普查养分含量分级标准评估养分含量水平,大部分养分含量水平分布在一级、二级和三级,养分含量较为丰富。

|
图 2 土壤化学指标分布水平 Fig. 2 Levels of distribution of soil chemical indicators |
|
|
表 1 土壤理化因子的描述统计 Table 1 Descriptive statistics of soil chemical indicators |
所采集土壤样品共检测出细菌61门、167纲、422目、638科和1 161属。图 3展示了在门水平和属水平上所有样本中平均相对丰度前十位的细菌物种。平均相对丰度较高的细菌门有变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、疣微菌门(Verrucomicrobiota)、拟杆菌门(Bacteroidota)、绿弯菌门(Chloroflexi)、放线菌门(Actinobacteriota)、芽单胞菌门(Gemmatimonadota)、浮霉菌门(Planctomycetota)、黏细菌门(Myxococcota)、髌骨细菌门(Patescibacteria),其中变形菌门、酸杆菌门、疣微菌门和拟杆菌门的相对丰度均大于5%,且这4种菌群相对丰度总和为73.13%。属水平上丰度较高的物种有Sphingomonas(8.39%)、Candidatus_ Udaeobacter (5.73%)、RB41(5.58%)。

|
图 3 土壤细菌门(A)及属(B)水平群落组成 Fig. 3 Community compositions at the phylum (A) and genus (B) levels of soil bacteria |
基于土壤环境因子与细菌α多样性的Spearman相关性分析结果发现(图 4A),土壤pH与细菌群落的Richness指数、Shannon指数、Simpson指数、Chao1指数及PD指数均呈显著正相关关系(P < 0.01)。而土壤TP与细菌群落的Simpson指数,土壤AN与PD指数,土壤AP与Shannon指数、Simpson指数及PD指数均呈显著负相关关系(P < 0.05)。Mantel分析结果表明(图 4B),土壤细菌群落组成与土壤pH、TN和TK显著正相关(P < 0.05)。土壤环境因子间的Spearman相关性表明,pH与TP、AP、TK显著负相关,TN与SOM、TP、AN、AK显著正相关(P < 0.05);此外,TK与SOM、TN、TP、AN显著负相关,与AP显著正相关(P < 0.05)。

|
(图中*、**、***分别表示相关性达P < 0.05、P < 0.01、P < 0.001显著水平,下同) 图 4 土壤环境因子与土壤细菌群落的相关性(A, B)及RDA分析(C) Fig. 4 Correlation (A, B)and RDA(C) analysis between soil chemical indicators and soil bacterial communities |
冗余分析(RDA)进一步展示了环境因子对土壤细菌群落的影响(图 4C)。其中第一轴和第二轴对细菌扩增子序列变体(Amplicon sequence variant,ASV)水平总方差的解释量分别为19.59% 和1.99%。pH (R2 = 0.718)、TN(R2 = 0.087)、TK(R2 = 0.057)、AN(R2 = 0.039)、AP(R2 = 0.279)、AK(R2 = 0.061)对土壤细菌群落组成有显著影响(P < 0.05)。通过多元线性回归分析发现,pH、TP、AN、AP能较好地预测细菌的Richness指数,pH和AN能较好地预测细菌的PD指数(表 2)。综合Mantel和RDA分析结果,pH是黑土区土壤细菌群落变化的主要影响因子。
|
|
表 2 多元线性回归分析土壤环境因子对细菌多样性的影响 Table 2 Multiple linear regression analysis of effects of soil chemical indicators on bacterial diversity |
细菌共现网络由251个节点和1 110条边组成,大部分微生物间为正相关关系,其中酸杆菌门(37.45%)和变形菌门(27.49%)为主要的微生物类群(图 5A)。分析每个样本子网络拓扑属性与环境因子的相关性发现(图 5B),pH及TN与网络的平均度、图密度、聚类系数显著正相关,SOM与聚类系数显著正相关,TP与边数量显著正相关,TK与节点数量、模块度显著正相关,AP与节点数量、边数量、平均路径长度、网络直径、介数中心性、模块性显著正相关,AK与聚类系数显著正相关。由此可见,pH和AP对细菌网络属性的影响更大。

|
(共现网络中黄线为正相关,蓝线为负相关) 图 5 土壤细菌共现网络(A)及网络属性与土壤环境因子的相关性(B) Fig. 5 Soil bacterial co-occurrence network (A) and correlation of network properties with soil chemical indicators (B) |
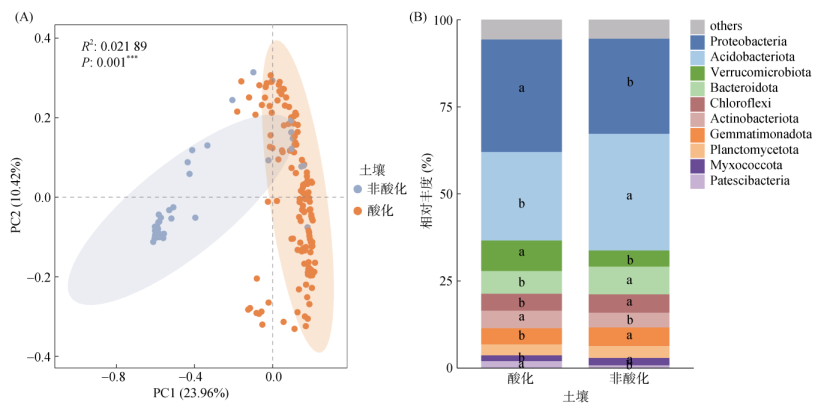
以上研究表明,pH是影响细菌群落组成和网络关系最重要的因素。基于第二次土壤普查及相关研究,将pH < 6.5的土壤划分为酸性土壤,pH>6.5的土壤划分为非酸性土壤[16]。本研究土壤样本中酸化土壤占比为77.40%,普通最小二乘法回归分析表明非酸化土壤(pH > 6.5)细菌α多样性与pH显著正相关(P < 0.05),酸化土壤细菌α多样性与pH的正相关性并不显著(图 6)。非酸化土壤细菌群落的Richness指数、Shannon指数及PD指数均显著高于酸化土壤(图 7)。基于Bray-Curtis距离的PCoA排序图显示,酸化及非酸化土壤细菌群落存在显著差异(图 8A)。分析细菌群落优势门在酸化和非酸化土壤中的相对丰度发现,酸化土壤中变形菌门、疣微菌门、放线菌门及髌骨菌门显著高于非酸化土壤,而非酸化土壤中酸杆菌门、拟杆菌门、绿弯菌门、芽单胞菌门、黏细菌门显著高于酸化土壤(图 8B)。

|
(实线表示有统计学显著性(P < 0.05),虚线表示无显著性(P > 0.05)) 图 6 酸化和非酸化土壤pH与土壤细菌丰富度指数(A)、香农指数(B)和系统发育多样性(C)之间的普通最小二乘法回归分析 Fig. 6 Ordinary least squares (OLS) regressions between pH and soil bacterial richness index (A), Shannon index (B), and phylogenetic diversity (C) in acidified and non-acidified soils |

|
图 7 酸化和非酸化土壤细菌丰富度指数(A)、香农指数(B)和系统发育多样性(C)的组间差异 Fig. 7 Inter group differences in bacterial richness index (A), Shannon index (B), and phylogenetic diversity (C) between acidified and non-acidified soils |
|
(图中小写字母不同表示差异达P < 0.05显著水平) 图 8 酸化和非酸化土壤细菌群落组成差异(A)及优势门物种差异(B) Fig. 8 Differences in bacterial community composition (A) and differences in dominant phylum species (B) between acidified and non-acidified soils |
pH与细菌α多样性及子网络部分拓扑属性显著正相关,且Mantel、RDA及多元线性回归分析结果均表明pH是影响细菌群落的主要因子,这与之前的研究一致。Zhou等[17]发现土壤pH对细菌组成和多样性的影响超过了空间和气候因素的影响。土壤pH作为关键环境因子,不仅影响细菌群落的多样性和组成,同时调控着群落组装中随机性过程和确定性过程的相对重要性。细菌的最适生长pH范围狭窄可能是影响细菌群落组成的主要因素。同时,土壤pH还通过影响养分有效性、有毒物质的溶解度以及微生物的代谢活性等途径,改变微生物的生存环境和生理状态,间接对细菌群落产生影响[18]。此外,土壤pH还通过调节微生物介导的碳积累与释放过程,进而影响土壤–大气的碳交换[19]。
RDA及多元线性回归分析结果表明,土壤有效磷也是影响细菌群落的重要因子,且有效磷与子网络大部分拓扑属性正相关,说明有效磷对细菌群落有影响。有效磷能够影响土壤中含有phoD基因的细菌群落的组成和功能,这些细菌群落被认为是有机磷矿化过程的潜在参与者[20]。Mantel分析发现全氮和全钾对细菌群落有显著正向影响,且全氮和全钾与子网络部分拓扑属性显著正相关,说明全氮和全钾对土壤细菌群落有影响。在土壤可溶性钾含量普遍较低的背景下,细菌在土壤钾利用过程中也发挥着重要作用,解钾菌是一类能分解含钾矿物的细菌,解钾菌通过产生有机酸、直接溶解岩石钾、螯合作用、离子交换以及分泌胞外酶等多种途径,将矿物钾转化为可溶性钾,提高了植物对钾的吸收利用率[21]。多元线性回归分析显示,土壤速效氮对细菌Richness指数和PD指数有显著负向影响,这种抑制作用可能源于过量氮肥施用导致的土壤酸化,从而使细菌多样性降低。Zeng等[22]发现氮肥不仅通过增加土壤铵态氮利用率直接影响细菌多样性,还通过土壤酸化和植物群落变化间接影响细菌群落组成。此外,氮富集引起的土壤有机质数量和质量变化也与微生物群落变化密切相关。
3.2 酸化显著影响黑土区细菌群落因为pH是影响细菌群落的主要因子,将土壤样品划分为pH < 6.5的酸化土壤和pH>6.5的非酸化土壤[16]。普通最小二乘法回归分析发现,随着pH的提高,非酸化土壤细菌的α多样性也呈增加趋势,然而酸化土壤中细菌的α多样性与土壤pH之间未观察到显著的相关性,说明酸化土壤中的细菌群落多样性普遍不高,并未展现出很好的变异梯度。Li等[23]发现随着土壤酸性程度的增加,土壤中细菌的丰度和多样性显著下降。酸性条件会破坏土壤细菌类群的能量代谢,这会阻碍对能量需求高或对酸性条件耐受性低的细菌类群的生存。过去研究发现,土壤pH与细菌多样性间表现为单峰关系,土壤pH为中性时细菌多样性最高[24]。然而本研究中却得到了不一致的结果,这可能与非酸化土壤中碱性土壤仅占30% 且未达到强碱性水平有关,因此未观察到细菌多样性随pH升高而降低的现象。Zhou等[17]通过对全球7个生物群落942个样本的分析发现,虽然酸性和碱性生态位最优的细菌属数量相当,但耐受高pH的属显著多于耐受低pH的属,这可能是因为酸性条件比碱性条件对细胞膜、酶和DNA有更大的破坏性影响。值得注意的是,本研究中非酸化土壤的细菌多样性显著高于酸化土壤,因此改良黑土酸化问题也是提高土壤生物多样性的重要措施。
分析酸化和非酸化土壤细菌优势门物种差异,酸化土壤中变形菌门、疣微菌门、放线菌门及髌骨菌门显著富集。变形菌门的一些属与酸化土壤中的病害抑制密切相关[25]。在放线菌门中,部分嗜酸性需氧铁氧化细菌表现出在低pH环境下的生长潜力。放线菌门还包含一些具有孢子形成能力和革兰氏阳性特征的类群,其中一些细菌能够在极端环境条件下生存,这些特性可能使其在土壤严重酸化的生态系统中占据优势地位[26]。疣微菌门和髌骨菌门包含大多数适宜低pH的菌属,因此更准确地反映了对低pH环境的偏好[17]。这些细菌在低土壤pH环境下具有较强的适应能力和生态优势,因此能够在酸化土壤中显著富集。非酸化土壤中酸杆菌门、拟杆菌门、绿弯菌门、芽单胞菌门、黏细菌门显著富集。土壤酸杆菌门、拟杆菌门、绿弯菌门是介导土壤养分循环的关键类群。酸杆菌门具有降解植物残体多聚物、参与铁循环及单碳化合物代谢等功能[27]。拟杆菌门在土壤有机碳转化过程中发挥重要作用,芽单胞菌门能降解各种复杂的有机底物[28]。黏细菌门能产生包括淀粉酶、几丁质酶、脂肪酶、木聚糖酶等多种水解酶,具有降解大分子的应用潜力[29]。这些细菌在土壤养分循环及有机物降解过程中具有重要作用。
本研究采样结果表明,黑龙江省大约有77.40% 的旱地黑土存在酸化现象。赵学强等[30]利用第二次全国土壤普查后至2015年前后的土壤pH数据绘制中国土壤酸碱度图,发现我国酸性土壤主要集中分布于南方红黄壤地区和东北地区。值得注意的是,其中pH < 6.5的酸性土壤中,东北地区占比达23.3%,相较于酸性土壤的酸化过程,东北地区的中性土壤和弱碱性土壤酸化速率更大。这一现象主要归因于该pH范围内碱基阳离子浸出是主要的缓冲机制,使得此类土壤对酸化过程表现出更高的敏感性。因此,在关注南方红黄壤区土壤酸化的同时,东北黑土区的酸化问题同样不容忽视。东北黑土酸化的主要原因是氮肥的不合理施用,具体表现为以下3个机制:①施用氮肥使作物地上部吸收土壤矿质养分,秸秆离田使土壤矿质养分流失,这一过程间接导致土壤酸化;②“一炮轰式”尿素基施的方式使作物生长初期出现阶段性氮素过剩,促使大量尿素氮向硝态氮转化并释放出H+,加速土壤酸化;③尿素水解成铵态氮后,部分被土壤胶体吸附,当植物吸收这些铵态氮时,会同步释放H+以维持根系周围电荷平衡,最终引起根区土壤pH下降[31]。本研究发现pH是影响黑龙江细菌群落的关键环境因子,并且酸化及非酸化条件下细菌多样性及物种组成存在显著差异。Zhou等[17]发现适应酸性条件的细菌在湿润气候中占主导地位,而适应碱性条件的细菌则在干旱气候中占主导地位。东北黑土区气候干旱,在碱性条件下细菌群落处于优势地位。Liu等[14]发现东北黑土区细菌群落组成及多样性与土壤pH显著相关,进一步强调了土壤pH在黑土细菌群落组成中的关键作用。因此,有必要关注黑土区土壤pH对土壤微生物群落及可持续农业生产的影响。
4 结论黑龙江典型黑土区旱地土壤细菌群落主要包含变形菌门、酸杆菌门、疣微菌门、拟杆菌门等,多种土壤理化因子对细菌群落组成均有显著影响,其中pH是影响黑土区细菌群落组成及多样性的主要因子。酸化和非酸化土壤细菌群落存在显著差异,非酸化土壤细菌α多样性与pH显著正相关,因此改良黑土酸化有利于增加土壤细菌多样性。本研究揭示了pH在黑土区细菌群落结构中的关键作用,表明通过调节土壤pH,可以有效改善土壤微生物的多样性和组成,从而促进土壤健康和生态系统的可持续发展。
| [1] |
Banerjee S, van der Heijden M G A. Soil microbiomes and one health[J]. Nature Reviews Microbiology, 2023, 21(1): 6-20 DOI:10.1038/s41579-022-00779-w (  0) 0) |
| [2] |
Delgado-Baquerizo M, Oliverio A M, Brewer T E, et al. A global atlas of the dominant bacteria found in soil[J]. Science, 2018, 359(6373): 320-325 DOI:10.1126/science.aap9516 (  0) 0) |
| [3] |
褚海燕, 冯毛毛, 柳旭, 等. 土壤微生物生物地理学: 国内进展与国际前沿[J]. 土壤学报, 2020, 57(3): 515-529 (  0) 0) |
| [4] |
徐扬, 张冠初, 丁红, 等. 土壤类型对花生根际土壤细菌群落多样性和产量的影响[J]. 生物技术通报, 2022, 38(6): 221-234 (  0) 0) |
| [5] |
Philippot L, Chenu C, Kappler A, et al. The interplay between microbial communities and soil properties[J]. Nature Reviews Microbiology, 2024, 22(4): 226-239 DOI:10.1038/s41579-023-00980-5 (  0) 0) |
| [6] |
杜昊楠, 魏亚情, 全飞, 等. 西双版纳与海南橡胶林根际细菌群落组成与多样性研究[J]. 西部林业科学, 2022, 51(1): 77-83 (  0) 0) |
| [7] |
石广萍, 栾璐, 曾昭阳, 等. 不同施肥年限对红壤细菌多样性及群落结构演替的影响[J]. 土壤, 2024, 56(1): 73-81 DOI:10.13758/j.cnki.tr.2024.01.010 (  0) 0) |
| [8] |
田芷源, 卢慧中, 马瑞, 等. 东北黑土区耕地侵蚀退化空间分异特征[J]. 土壤学报, 2025, 62(4): 931-945 (  0) 0) |
| [9] |
徐影, 李彦生, 刘晓冰, 等. 长期施肥改变玉米大豆轮作/连作黑土农田酸化速率和酸中和容量[J]. 土壤, 2024, 56(4): 750-759 DOI:10.13758/j.cnki.tr.2024.04.008 (  0) 0) |
| [10] |
杨青松, 杨伟, 彭珏, 等. 典型黑土区坡耕地土壤微生物多样性及群落结构对侵蚀–沉积的响应[J]. 土壤学报, 2024, 61(6): 1741-1754 (  0) 0) |
| [11] |
Zhang Z M, He P, Hao X X, et al. Long-term mineral combined with organic fertilizer supports crop production by increasing microbial community complexity[J]. Applied Soil Ecology, 2023, 188: 104930 DOI:10.1016/j.apsoil.2023.104930 (  0) 0) |
| [12] |
Hu X J, Gu H D, Liu J J, et al. Metagenomics reveals divergent functional profiles of soil carbon and nitrogen cycling under long-term addition of chemical and organic fertilizers in the black soil region[J]. Geoderma, 2022, 418: 115846 DOI:10.1016/j.geoderma.2022.115846 (  0) 0) |
| [13] |
Hu X J, Gu H D, Liu J J, et al. Metagenomic strategies uncover the soil bioavailable phosphorus improved by organic fertilization in Mollisols[J]. Agriculture, Ecosystems & Environment, 2023, 349: 108462 (  0) 0) |
| [14] |
Liu J J, Sui Y Y, Yu Z H, et al. High throughput sequencing analysis of biogeographical distribution of bacterial communities in the black soils of Northeast China[J]. Soil Biology and Biochemistry, 2014, 70: 113-122 DOI:10.1016/j.soilbio.2013.12.014 (  0) 0) |
| [15] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [16] |
徐仁扣, 李九玉, 周世伟, 等. 我国农田土壤酸化调控的科学问题与技术措施[J]. 中国科学院院刊, 2018, 33(2): 160-167 (  0) 0) |
| [17] |
Zhou X, Tahvanainen T, Malard L, et al. Global analysis of soil bacterial Genera and diversity in response to pH[J]. Soil Biology and Biochemistry, 2024, 198: 109552 DOI:10.1016/j.soilbio.2024.109552 (  0) 0) |
| [18] |
Naz M, Dai Z C, Hussain S, et al. The soil pH and heavy metals revealed their impact on soil microbial community[J]. Journal of Environmental Management, 2022, 321: 115770 DOI:10.1016/j.jenvman.2022.115770 (  0) 0) |
| [19] |
Malik A A, Puissant J, Buckeridge K M, et al. Land use driven change in soil pH affects microbial carbon cycling processes[J]. Nature Communications, 2018, 9: 3591 DOI:10.1038/s41467-018-05980-1 (  0) 0) |
| [20] |
Chen X D, Jiang N, Condron L M, et al. Impact of long-term phosphorus fertilizer inputs on bacterial phoD gene community in a maize field, Northeast China[J]. Science of the Total Environment, 2019, 669: 1011-1018 DOI:10.1016/j.scitotenv.2019.03.172 (  0) 0) |
| [21] |
Babar S, Baloch A, Qasim M, et al. Unearthing the soil-bacteria nexus to enhance potassium bioavailability for global sustainable agriculture: A mechanistic preview[J]. Microbiological Research, 2024, 288: 127885 DOI:10.1016/j.micres.2024.127885 (  0) 0) |
| [22] |
Zeng J, Liu X J, Song L, et al. Nitrogen fertilization directly affects soil bacterial diversity and indirectly affects bacterial community composition[J]. Soil Biology and Biochemistry, 2016, 92: 41-49 DOI:10.1016/j.soilbio.2015.09.018 (  0) 0) |
| [23] |
Li X G, Chen D L, Carrión V J, et al. Acidification suppresses the natural capacity of soil microbiome to fight pathogenic Fusarium infections[J]. Nature Communications, 2023, 14: 5090 DOI:10.1038/s41467-023-40810-z (  0) 0) |
| [24] |
Ni Y Y, Yang T, Ma Y Y, et al. Soil pH determines bacterial distribution and assembly processes in natural mountain forests of Eastern China[J]. Global Ecology and Biogeography, 2021, 30(11): 2164-2177 DOI:10.1111/geb.13373 (  0) 0) |
| [25] |
Chen D L, Wang X X, Carrión V J, et al. Acidic amelioration of soil amendments improves soil health by impacting rhizosphere microbial assemblies[J]. Soil Biology and Biochemistry, 2022, 167: 108599 DOI:10.1016/j.soilbio.2022.108599 (  0) 0) |
| [26] |
Dai Z M, Su W Q, Chen H H, et al. Long-term nitrogen fertilization decreases bacterial diversity and favors the growth of Actinobacteria and Proteobacteria in agro-ecosystems across the globe[J]. Global Change Biology, 2018, 24(8): 3452-3461 DOI:10.1111/gcb.14163 (  0) 0) |
| [27] |
王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14-20 (  0) 0) |
| [28] |
王润博, 王泽铭, 王红越, 等. 土壤稳定性有机碳组分与优势细菌门类陆向分布及相关性[J]. 微生物学报, 2022, 62(6): 2389-2402 (  0) 0) |
| [29] |
杜欣然, 王晶晶, 冉柒, 等. 黏细菌资源及其系统分类[J]. 微生物学通报, 2023, 50(7): 3104-3121 (  0) 0) |
| [30] |
赵学强, 潘贤章, 马海艺, 等. 中国酸性土壤利用的科学问题与策略[J]. 土壤学报, 2023, 60(5): 1248-1263 (  0) 0) |
| [31] |
仇少君, 郝小雨, 赵士诚, 等. 黑土地肥力下降成因与保护利用对策——基于养分资源高效利用视角分析[J]. 植物营养与肥料学报, 2025, 31(1): 1-11 (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57


