2. 安徽中烟工业有限责任公司, 合肥 230000;
3. 云南省烟草公司丽江市公司, 云南丽江 674100
连作障碍是指在同一地块连续多茬种植同种或同科作物后,植物病虫害加重、长势变弱、产量和质量下降的现象[1]。连作障碍由两个因素驱动:①生物因素,包括土壤病原菌积累和微生物群落组成变化;②非生物因素,包括土壤养分失衡和植物根系分泌物的自身毒性等[2-3]。土壤微生物对许多过程至关重要,包括有机质周转、矿物营养循环、土壤结构维护和毒素降解[4],并且能提高植物抗逆性和(或)抑制病原体,被称为植物的第二基因组[5],因此土壤健康取决于微生物群落及其功能的多样性[6]。植物长期连作为有害微生物提供了适宜的生长繁殖环境,造成了有害微生物的快速生长,阻碍了本土有益微生物群落的生存发展,打破了微生物群落间的动态平衡,进而影响作物生长[7-8]。
烟草是我国重要的经济作物,在全国范围内广泛种植。在云南、贵州、四川等以山地烟田为主的产区,由于种植区域集中、土地资源紧张,烟草重茬连作情况较为普遍,土壤得不到有效轮作或休养,产生连作障碍[9]。据报道,连作会导致烟草产量降低20% ~ 100%,给地域经济和农民效益带来巨大影响[10]。烤烟长期连作会改变烟田微生物群落多样性和组成结构,导致病原菌积累,增加土传病害发生风险;同时,土壤pH、全氮、硝态氮、有效磷等也会发生改变[11-12]。Li等[4]报道,连续种植8 ~ 30年烤烟,土壤速效氮、有效磷、速效钾和有机质明显富集。Yan等[13]和Wang等[8]研究表明,随着连作年限的增加,烟田土壤细菌群落多样性降低,而真菌群落的丰度和多样性增加。Yu等[6]研究表明,土壤中变形菌门、拟杆菌门和芽孢杆菌门的相对丰度随着连作年限的增加而降低,生物多样性指数随连作年限增加而下降。刘艳霞等[14]研究表明,连作烟草根系分泌的酚酸类化学物质会导致病原菌数量显著提高,土壤根际微生物多样性和结构平衡性降低,拮抗菌、固氮菌、无机磷细菌、硅酸盐细菌等的数量显著减少。Jia等[15]开展不同酚酸对烤烟化感作用的研究,发现外源香豆酸显著降低土壤pH,并使土壤微生物群落从以细菌为主转变为以真菌为主,表现出最强的直接化感作用。
微生物在土壤中存在复杂的相互作用,并参与形成生态网络[16]。基于高通量测序技术,利用网络分析可揭示这种复杂的相互关系,能够为群落结构研究提供新的见解[17]。尽管大量研究表明烤烟连作会影响土壤理化性质、微生物群落结构,但对土壤理化性质、酶活性与微生物群落的网络拓扑特征关联性研究较少。本研究以云南丽江烟区连作和非连作烟田为研究对象,分析两类烟田在土壤化学性质、酶活性、根际土壤微生物群落结构等方面的差异,并通过共现性网络、偏最小二乘法(PLS)等方法分析根际微生物群落结构、土壤化学指标等与烟草连作障碍的关系,为探索消减烟草连作障碍的有效方法提供理论依据。
1 材料与方法 1.1 试验设计试验于2021年在丽江市古城区七河镇木光灿村开展。选取非连作障碍烟田和连作障碍烟田各9块。非连作障碍烟田选取标准为:①首次种植烤烟,传统种植玉米、油菜、大麦等当地主要作物,施肥、管理和收获均按当地传统方式进行;②烟株长势正常,整齐度好,无明显病虫害。连作障碍烟田选取标准为:①连续种植烤烟8年以上;②烟株移栽后生长缓慢,植株明显矮小,生物量低,无明显病虫害。两类田块在相对集中区域内随机选取,土壤类型均为当地典型红壤,烤烟品种为云烟87,肥料用量均按照当地烤烟生产推荐量,具体为:N 85.50 kg/hm2,P2O5 102.60 kg/hm2,K2O 299.25 kg/hm2。其他农艺措施、田间管理技术均按当地标准生产技术进行。
1.2 采样方法在烤烟圆顶期进行样品采集。每块田随机选取5株烟,参照YC/T 142—2010《烟草农艺性状调查测量方法》[18]测定烟株农艺性状,随后将烟株和根系整株挖出,采用抖根法采集根际土[19]。每块田中5株烟的根际土混合为1个样品。每个土壤样本挑出细根后分为2份,一份立即放入干冰保存,用于高通量测序;另一份4 ℃保存,用于测定土壤理化指标和土壤酶活性。
1.3 土壤理化指标和酶活性测定土壤理化性质测定参照《土壤农化分析》[20],其中,pH(土水质量比1∶5)采用pH计测定,电导率(土水质量比1∶5)采用电导率仪测定,有机质采用重铬酸钾容量法测定,碱解氮采用扩散吸收法测定,有效磷采用钼锑抗比色法测定,速效钾采用火焰光度法测定。
土壤蔗糖酶采用3, 5-二硝基水杨酸比色法测定[21],脲酶采用苯酚钠–次氯酸钠比色法测定,过氧化氢酶采用高锰酸钾滴定法测定,磷酸酶采用磷酸苯二钠比色法测定[22]。
1.4 土壤微生物总DNA提取与文库构建土壤微生物的提取与文库构建均在上海美吉生物科技有限公司进行。对细菌16S V3 ~ V4特异性可变区进行扩增,上游引物为338F:5′-ACTCCTACGGGAGGCAGCAG-3′,下游引物为806R:5′-GGACTACHVGGGTWTCTAAT-3′。对真菌ITS1 ~ ITS2区域进行扩增,上游引物为ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′,下游引物为ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′。测序仪为Illumina PE300。
1.5 高通量测序数据分析数据分析在美吉生物云上完成。通过fastp (v0.19.6)软件对原始数据进行质控,使用FLASH (v1.2.7)进行拼接。后续使用QIIME2(Quantitative Insights Into Microbial Ecology 2)软件[23]进行分析(使用DATA2降噪),得到扩增序列变体(amplicon sequence variants,ASV)。使用Naive Bayes分类器,并分别基于SILVA和UNITE数据库,对细菌和真菌的代表序列进行物种注释。利用mothur-1.30和R软件对AVS表格进行群落α多样性和β多样性分析。数据分析主要涉及的R程序包有:stat、vegan、devtools、phyloseq、ade4、dplyr、magrittr、indicspecies;图形输出主要涉及程序包为ggplot2。使用ggClusterNet包进行网络分析,去除一些低丰度ASV(ASV至少出现在6个样本中,并且具有至少10个序列),采用spearman相关系数,筛选有效边的标准为:|r| > 0.6且P < 0.05,计算网络图的Zi和Pi值(模块化算法为Cluster fast greedy[24]),并将节点划分为4类(外围节点(peripherals,Zi≤2.5,Pi≤0.62)、连接节点(connectors,Zi≤2.5,Pi > 0.62)、模块核心节点(module hubs,Zi > 2.5,Pi≤0.62)和网络核心节点(network hubs,Zi > 2.5,Pi > 0.62))。
1.6 数据处理使用SPSS 23.0进行t检验,采用GraphPad Prism 8作图。利用SmartPLS 3将土壤理化指标、烤烟株高和LEfSe分析中筛选出的种水平的生物标志物(biomarker)进行PCA降维后的PC1指标(代表微生物群落)进行偏最小二乘法(PLS)建模,建模的所有数据均经过log转换。采用自助法计算参数,以SRMR < 0.8为模型接受标准。
2 结果与分析 2.1 烟株农艺性状如表 1所示,连作烤烟株高、地上部鲜物质量和最大叶长比非连作烤烟显著降低50.27%(P < 0.01)、71.09%(P < 0.01)和11.78%(P < 0.05),叶片数、茎围和最大叶宽没有显著差异。
|
|
表 1 烤烟农艺性状 Table 1 Agronomic traits of flue-cured tobacco |
根际土壤理化性质如表 2所示。与非连作相比,连作烤烟根际土壤pH显著降低7.34%(P < 0.05),有效磷、速效钾含量及电导率显著提高129.66%、40.90%(P < 0.05)和132.74%(P < 0.01),速效氮和有机质含量无显著差异。土壤酶活性如图 1所示,连作烤烟根际土壤脲酶活性显著高于非连作烤烟根际土壤(P < 0.05),酸性磷酸酶活性则显著降低(P < 0.05),过氧化氢酶和蔗糖酶活性与非连作烤烟根际土壤无显著差异。
|
|
表 2 根际土壤理化性质 Table 2 Physiochemical properties of rhizosphere soils |
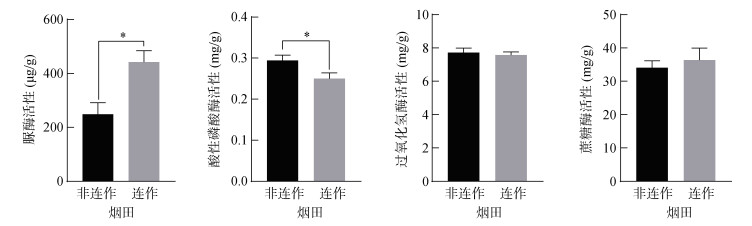
|
图 1 根际土壤酶活性 Fig. 1 Enzyme activities of rhizosphere soils |
通过高通量测序对两种烤烟根际土细菌群落结构进行描述,非连作烤烟根际土有5 053条细菌ASVs,连作烤烟根际土有5 346条细菌ASVs。共鉴定出34个门、762个属,其中放线菌门(Actinobacteriota)、变形菌门(Proteobacteria)、Acidobacteriota菌门、绿弯菌门(Chloroflexi)和Gemmatimonadota菌门在两种根际土壤中是排名前5的细菌优势类群(图 2A)。维恩图结果(图 2C)显示,两种烤烟根际土共有2 747条相同的细菌ASVs,非连作烤烟根际土特有2 306条细菌ASVs。
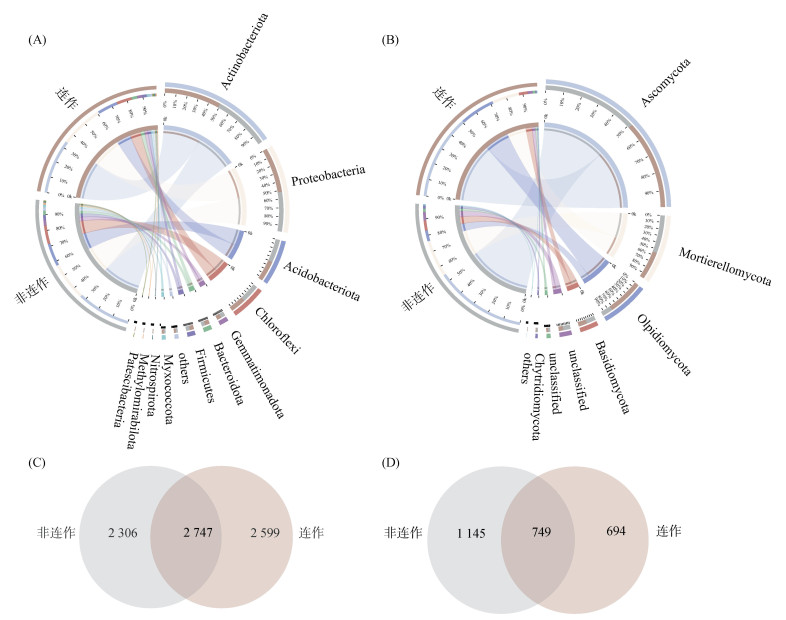
|
(A:细菌门水平群落结构;B:真菌门水平群落结构;C:细菌ASVs水平维恩图;D:真菌ASVs水平维恩图) 图 2 根际土壤微生物群落结构与共(独)有物种数目 Fig. 2 Microbial community structures and numbers of common (unique) species of rhizosphere soils |
两种烤烟根际土壤真菌群落分别有1 894条真菌ASVs(非连作烤烟)和1 443条真菌ASVs(连作烤烟)。真菌共鉴定出14个门、505个属,其中子囊菌门(Ascomycota)、毛霉菌门(Mortierellomycota)、壶菌门(Olpidiomycota)、担子菌门(Basidiomycota)和未鉴定出的真菌门,是排名前5的真菌优势类群(图 2B)。维恩图结果(图 2D)表明,两种烤烟根际土共有749条相同的真菌ASVs,非连作烤烟根际土特有1 145条真菌ASVs,连作烤烟根际土特有694条真菌ASVs。
2.4 根际土壤微生物多样性与非连作烤烟相比,连作烤烟根际土壤细菌群落Shannon指数和PD指数显著降低(P < 0.05)。Shannon指数降低表明细菌群落多样性、丰富度和均匀度降低,PD指数降低表明细菌物种间的进化历史更简单,进化距离更短。真菌群落ACE、Shannon指数和PD指数显著升高,表明真菌物种多样性、丰富度、均匀度升高,物种间进化历史更加丰富,进化距离更大。基于Bray-Curtis距离的非限制性主坐标轴分析(PCoA)表明两种烤烟根际土壤样本在第一主轴显著分离(P < 0.05,图 3)。
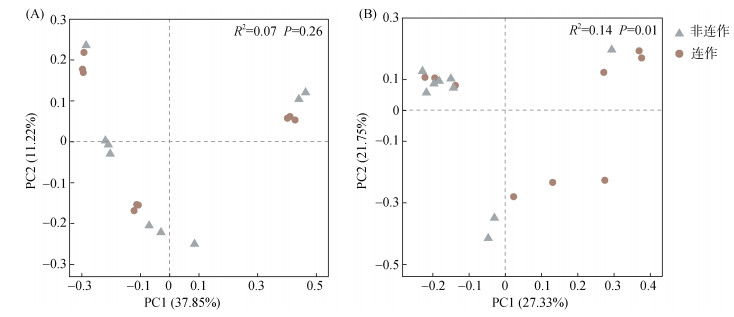
|
(A:细菌β多样性;B:真菌β多样性。PERMANOVA采用Adonis函数置换检验,置换999次) 图 3 根际土壤微生物多样性PCoA分析 Fig. 3 PCoA analysis of rhizosphere soil microbial diversities |
为了提供更多根际土壤微生物群落信息,使用LEfSe(Linear discriminant analysis Effect Size)分析来识别非连作根际土和连作根际土中从门到属水平差异丰度分类群(图 4)。分析结果显示,非连作根际土中有40个细菌分类学支系和27个真菌分类学支系表现出更大相对丰度,连作根际土中有81个细菌分类学支系和29个真菌分类学支系表现出更大相对丰度。在科水平上,非连作根际土中有诺卡氏菌科(Nocardiaceae)、拜叶林克氏菌科(Beijerinckiaceae)、根瘤菌料(Rhizobiaceae)、丛毛单胞菌科(Comamonadaceae)和细胞弧菌科(Cellvibrionaceae)等细菌和长喙霉科(Ceratocystidaceae)、黄丝菌科(Cephalothecaceae)和油壶菌科(Olpidiaceae)等真菌富集。在属水平上,马红球菌属(Rhodococcus)、链霉菌(Streptomyces)、纤维弧菌(Cellvibrio)等细菌和Cyphellophora、赤霉菌(Gibberella)、Ceratocystidaceae、韦特菌(Waitea)等真菌在连作根际土中富集。
|
|
表 3 根际土壤微生物多样性指数 Table 3 Microbial diversity indexes of rhizosphere soils |
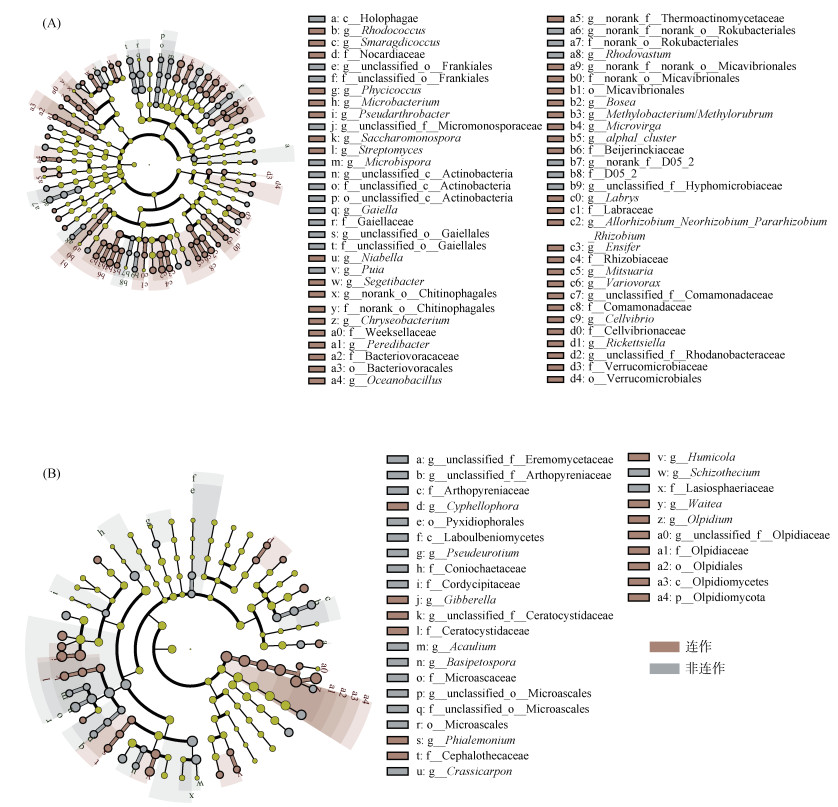
|
(A:细菌;B:真菌。差异物种进化分支图,由内至外辐射的圆圈代表了由界至种的分类级别。在不同分类级别上的每一个小圆圈代表该水平下的一个分类,小圆圈直径大小与相对丰度大小呈正比。无显著差异的物种统一着色为黄色,差异物种跟随组进行着色,灰节点表示在非连作障碍根际土组别中起到重要作用的微生物类群,红节点表示在连作障碍根际土组别中起到重要作用的微生物类群) 图 4 根际土壤微生物的LEfSe分析 Fig. 4 LEfSe analysis of rhizosphere soil microorganisms |
构建共现性网络比较两种烤烟根际土壤细菌和真菌群落的差异(图 5A、5B)。对于细菌网络,连作烤烟和非连作烤烟的边数分别为9 231和1 429,节点数分别为380和322(表 4)。连作烤烟有64个节点归于连接节点(图 5C),而非连作烤烟仅有14个节点归属为连接节点。与非连作烤烟相比,连作烤烟的负边比例、连通度、平均邻居数、聚类系数和相对模块性分别提高23.68%、333.33%、447.07%、20.83% 和163.64%,网络直径降低8.92。
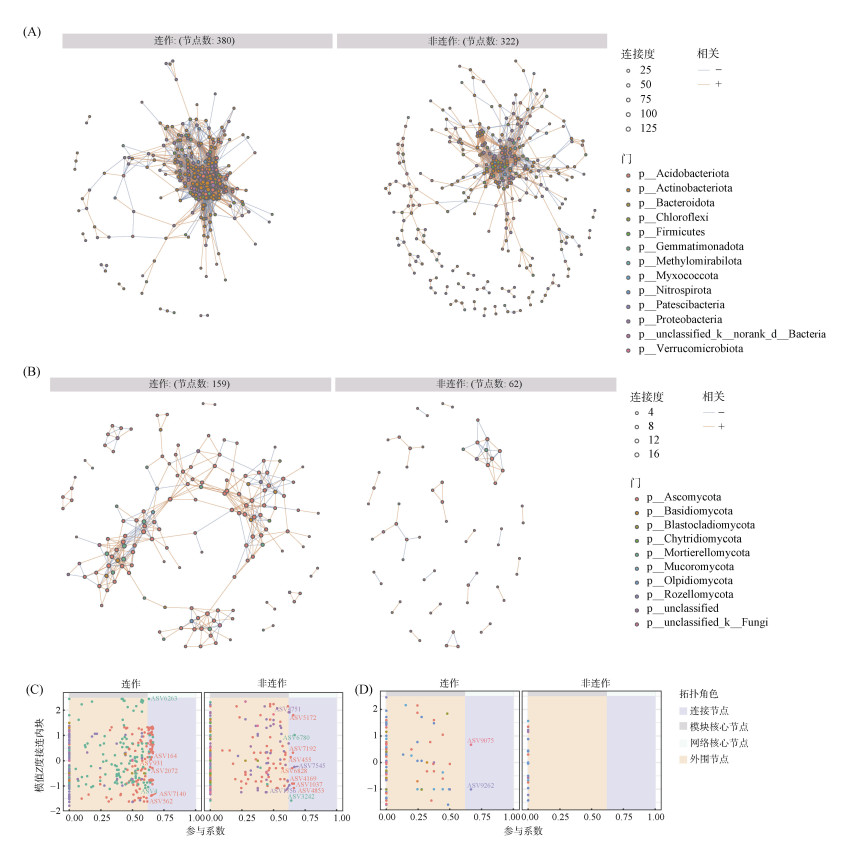
|
(A:烤烟根际土壤细菌共现性网络;B:烤烟根际土壤真菌共现性网络;C:烤烟根际土壤细菌共现性网络的ZP图;D:烤烟根际土壤真菌共现性网络的ZP图。C和D中的节点依据Zi和Pi值分为4类:外围节点(Zi≤2.5,Pi≤0.62)、连接节点(Zi≤2.5,Pi > 0.62)、模块核心节点(Zi > 2.5,Pi≤0.62)和网络核心节点(Zi > 2.5,Pi > 0.62)) 图 5 根际土壤微生物的共现性网络 Fig. 5 Co-occurrence networks of rhizosphere soil microorganisms |
|
|
表 4 共现性网络拓扑性质 Table 4 Properties of co-occurrence network topology |
对于真菌网络,连作烤烟和非连作烤烟的边数分别为436和62,节点数分别为159和62(表 4)。连作烤烟有2个节点归于连接节点(图 5D),而非连作烤烟中归属为连接节点的节点数为0。与非连作烤烟相比,连作烤烟的平均邻居数、网络直径和相对模块性分别提高174%、142.97% 和405.88%,负边比例降低25.64%。
2.7 偏最小二乘模型(PLS)分析以LEfSe分析中筛选出的种水平的生物标志物进行PCA降维后的PC1指标代表微生物群落,将PC1指标与土壤化学指标、烤烟株高进行偏最小二乘法(PLS)建模,进一步分析土壤理化指标、微生物与连作障碍之间的作用关系(图 6)。结果表明,土壤有效磷对微生物群落有显著的正向影响,影响路径系数为0.489,T值为1.756;土壤电导率对微生物群落有显著的负向影响,影响路径系数为–0.501,T值为1.971。土壤微生物群落对烤烟株高有显著正向影响,影响路径系数为0.557,T值为5.015。
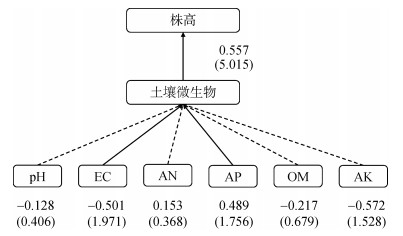
|
(EC:电导率;AN:速效氮;AP:有效磷;AK:速效钾;OM:有机质。实线表示P < 0.05;虚线表示P > 0.05;数字为路径系数,括号内数字为T值) 图 6 土壤理化指标对土壤微生物群落和烤烟株高影响的PLS模型 Fig. 6 PLS model of effects of soil physiochemical properties on soil microbial community and flue-cured tobacco plant height |
烟草是不耐连作的作物。晋艳等[25]研究表明,连作的烟株在旺长期和现蕾期的株高、田间叶面积系数均低于轮作烟草,圆顶期的株高、茎围、节距、叶面积系数等较轮作都有不同程度的下降。本试验选择的两类烟田烟株长势差异明显,烤烟连作田块在圆顶期株高、地上部鲜物质量和叶片大小显著低于非连作烤烟(表 1),表明在丽江烟区,连续种植烟草会产生连作障碍,导致烟叶产量、烟农效益降低,与晋艳等[25]研究结果基本一致。
烟草长期连作后土壤养分失衡和理化性状恶化是影响植株生长的原因之一[26]。有研究认为,连作障碍土壤pH、全氮、有机质、有效磷、速效钾和速效氮下降[8, 27-28]。但李序进等[29]研究表明,百合连作土壤中的有机质、全氮、全磷、速效氮、有效磷含量随连作时间增加呈增加趋势,可见不同作物连作对土壤理化性质影响不同。本研究发现,在丽江烟区,连作烟田烟株根际土的有效磷、速效钾含量分别增加129.66%和40.90%,土壤电导率升高,pH下降。张科等[30]研究同样发现,连作6年后,烟田土壤有效磷和速效钾含量分别从13.33 mg/kg和233.09 mg/kg增至17.54 mg/kg和285.19 mg/kg。据调查,丽江烟区种植烟草时,K2O和P2O5用量一般为255 kg/hm2和105 kg/hm2,高于玉米(P2O5 60 ~ 90 kg/hm2、K2O 70 ~ 80 kg/hm2)和大麦(只施用氮肥,几乎不施用磷钾肥)等作物。因此,连作烟田长期施用大量磷、钾肥可能是土壤有效磷、速效钾含量增加的主要原因。
随着连作年限的增加,土壤中残留的肥料和根系分泌物可能导致盐分积累,引起土壤电导率上升。同时,这些盐类的解离可能会产生H+,并导致土壤pH降低。土壤电导率升高和pH下降表明土壤有盐渍化和酸化迹象[31]。Ling等[2]、Lithourgidis等[32]认为,作物连作后土壤容重增大、黏性增强、通气孔隙减少、土壤交换性盐基总量及盐基饱和度降低,是导致土壤酸化及盐渍化现象加重的原因。
土壤酶活性与土壤健康及土壤养分转化等有很大关系,是近年来土壤质量评估中重要的指标。连作对土壤酶活性有极大影响,本研究中烤烟连作障碍土壤中脲酶活性升高,酸性磷酸酶活性降低(图 1)。王胜男[33]、姜永雷等[34]也发现,连作烟田土壤酸性磷酸酶活性下降,而脲酶活性与连作年限正相关。连作使烟田土壤脲酶活性增强,连作3年时活性为13.02 mg/(kg·h),连作20年时增加至33.75 mg/(kg·h)[35]。土壤酶是土壤中各种生物化学过程的催化剂,如无机化合物的氧化还原、腐殖质的分解与合成、动植物残体和微生物残体的分解及其合成有机化合物的水解与转化等[9]。脲酶可以催化尿素水解成氨和二氧化碳,酸性磷酸酶可促进有机磷的水解。胡加云等[36]认为,土壤酶活性的高低直接影响烟田土壤生态系统的物质转化、能量流动及土壤肥力的形成,直接影响烤烟的生长发育,是导致烤烟连作障碍的重要原因之一。
3.2 连作对烟田土壤微生物群落结构和网络结构的影响根际微生物的细菌优势类群主要为放线菌门(Actinobacteriota)和变形菌门(Proteobacteria),真菌的优势类群主要为子囊菌门(Ascomycota)、毛霉菌门(Mortierellomycota),这与饶德安[37]研究结果基本一致。连作障碍根际土特有的ASVs数量较多,表明连作障碍的发生伴随着大量根际微生物的更替(图 2C,2D)。从微生物α多样性指数来看,连作土壤细菌群落Shannon指数和PD指数显著降低;真菌群落ACE指数、Shannon指数和PD指数显著升高,表明细菌群落多样性降低,真菌群落的多样性和丰富度增加,Yu等[38]和Wang等[8]的研究也得到了类似结果。细菌和真菌的α多样性变化表明,连作障碍伴随细菌和真菌产生不同的变化。细菌群落的多样性降低可能是化感类物质积累的结果。而真菌群落的多样性增加则可能是因为真菌在新的环境条件下更具竞争优势,能够利用更广泛的资源,或是某些抑制细菌的真菌物种在新环境中变得更为活跃[39]。有研究指出,长期的连作导致细菌微生物群落α多样性降低和真菌α多样性升高,被称为土壤“真菌化”,是土壤质量下降的表现[40-41]。LEfSe分析表明(图 4),1个真菌门(Olpidiomycota)筛选为生物标志物,该门在连作障碍根际土中丰度更高。魏光钰等[42]在消减连作障碍后的烟草根际土中观察到了该真菌门的丰度下降。在属水平连作烤烟的生物标志物中有许多有害微生物(图 4),如马红球菌属(Rhodococcus)、链霉菌(Streptomyces)、纤维弧菌(Cellvibrio)等细菌和Cyphellophora、赤霉菌(Gibberella)、Ceratocystidaceae、韦特菌(Waitea)等真菌。这些微生物能够抑制植物生长发育,甚至本身就是病原微生物。因此,大量病原微生物的积累可能是导致连作障碍的原因。
连作通过改变微生物群落结构,影响共现性网络(包括网络拓扑特征和网络组成)[43]。通过共现性网络分析发现,与非连作相比,连作烤烟根际土壤的细菌和真菌共现性网络均拥有更多的节点和边,表明烤烟连作增加了细菌与真菌网络的复杂性,这与李孟芝[44]的研究结果一致。连作烤烟根际土壤细菌网络的负边比例高于非连作烤烟,但真菌网络的负边比例低于非连作烤烟,这意味着连作增强了细菌之间的竞争作用,但降低了真菌之间的竞争作用[45]。连作烤烟根际土壤的细菌网络相比于非连作烤烟更为紧凑(网络直径更短),具有更高的模块性和更短的平均路径长度。这可能是因为连作导致了根际微环境变化,细菌为了适应这种变化,分化出更多的生态位,形成独立的功能模块。对于真菌网络,连作烤烟真菌网络较为密集,但表现出较低的信息传递效率(平均路径长度更长),它们之间的联系可能更加疏松(网络直径更长)。此外,连作烤烟真菌网络显示出较高的模块性。总之,细菌网络的复杂性和连通性增强,竞争关系增加,但信息传递效率更高;真菌网络的模块化程度和连通性增强,但信息传递路径变长,竞争关系减弱。这些变化会影响土壤的健康状况和植物的生长发育,从而导致连作障碍的发生。
3.3 土壤理化性质、微生物群落与烤烟连作障碍的关系通过PLS模型揭示了土壤理化性质、微生物群落和烤烟生长之间的复杂关系。本研究发现,土壤有效磷对微生物群落有显著的正向影响,这与李琼香等[46]研究结果一致;而电导率对微生物群落有显著的负向影响(图 6)。电导率显著影响微生物群落的结构和功能。在连作障碍发生过程中,电导率升高加剧土壤的盐渍化进程,进而影响微生物群落结构[47]。连作土壤中有效磷含量增加,这种变化改变了微生物之间的竞争关系,导致特定微生物类群的相对丰度发生变化,适应高磷环境的微生物可能获得了竞争优势,而其他微生物则可能被排挤出生态系统[48]。土壤有效磷和电导率通过影响土壤微生物群落,进而影响烟株生长。健康的微生物群落不仅可以通过固氮、解磷、解钾等过程为植物提供必要的营养元素,还可以产生植物激素,如吲哚乙酸(IAA),以促进植物根系发育,增强植物的抗逆性[49]。连作导致土壤理化性质改变,引起微生物群落结构变化,土壤细菌多样性下降,真菌多样性和丰富度上升,有害微生物富集,这些微生物的变化将会对烤烟的生长产生不利影响。未来研究应关注这些生态变化的长期效应,以及如何通过生态手段恢复和维护健康的土壤微生物群落,比如种植填闲绿肥[50]或有机无机肥配施[51],以此改善烤烟的生长环境,提升作物产量和质量,实现可持续农业发展。
4 结论丽江烟区连作障碍烟田土壤与非连作烟田土壤相比,磷、钾富集,电导率升高,pH降低;土壤细菌多样性下降,真菌多样性和丰富度上升,有害微生物富集;微生物网络有更高的模块化和更紧密的连接,细菌之间的竞争作用增强,而真菌之间的竞争作用减弱。土壤有效磷对微生物群落有显著的正向影响,电导率对微生物群落有显著的负向影响,土壤微生物群落对株高有显著正向影响。土壤有效磷和电导率通过影响土壤微生物群落,进而影响烟株生长。
| [1] |
张子龙, 王文全. 植物连作障碍的形成机制及其调控技术研究进展[J]. 生物学杂志, 2010, 27(5): 69-72 (  0) 0) |
| [2] |
Ling N, Deng K Y, Song Y, et al. Variation of rhizosphere bacterial community in watermelon continuous mono-cropping soil by long-term application of a novel bioorganic fertilizer[J]. Microbiological Research, 2014, 169(7/8): 570-578 (  0) 0) |
| [3] |
Xia H, Jiang C Q, Riaz M, et al. Impacts of continuous cropping on soil fertility, microbial communities, and crop growth under different tobacco varieties in a field study[J]. Environmental Sciences Europe, 2025, 37(1): 5 DOI:10.1186/s12302-024-01037-x (  0) 0) |
| [4] |
Li G T, Gong P F, Zhou J, et al. The succession of rhizosphere microbial community in the continuous cropping soil of tobacco[J]. Frontiers in Environmental Science, 2024, 11: 1251938 DOI:10.3389/fenvs.2023.1251938 (  0) 0) |
| [5] |
Beckers B, Op De Beeck M, Weyens N, et al. Structural variability and niche differentiation in the rhizosphere and endosphere bacterial microbiome of field-grown poplar trees[J]. Microbiome, 2017, 5(1): 25 DOI:10.1186/s40168-017-0241-2 (  0) 0) |
| [6] |
Yu S K, Gu H Z, He J X, et al. Impact of continuous cropping on tobacco growth, stress resistance, and soil microecological structure[J]. Biotechnology & Biotechnological Equipment, 2024, 38(1): 2290343 (  0) 0) |
| [7] |
Ma Z Z, Zhang X C, Zheng B Y, et al. Effects of plastic and straw mulching on soil microbial P limitations in maize fields: Dependency on soil organic carbon demonstrated by ecoenzymatic stoichiometry[J]. Geoderma, 2021, 388: 114928 DOI:10.1016/j.geoderma.2021.114928 (  0) 0) |
| [8] |
Wang R Q, Xiao Y P, Lv F J, et al. Bacterial community structure and functional potential of rhizosphere soils as influenced by nitrogen addition and bacterial wilt disease under continuous sesame cropping[J]. Applied Soil Ecology, 2018, 125: 117-127 DOI:10.1016/j.apsoil.2017.12.014 (  0) 0) |
| [9] |
张继光, 申国明, 张久权, 等. 烟草连作障碍研究进展[J]. 中国烟草科学, 2011, 32(3): 95-99 (  0) 0) |
| [10] |
Li A B, Jin K K, Zhang Y Z, et al. Root exudates and rhizosphere microbiota in responding to long-term continuous cropping of tobacco[J]. Scientific Reports, 2024, 14: 11274 DOI:10.1038/s41598-024-61291-0 (  0) 0) |
| [11] |
汤宏, 王建伟, 曾掌权, 等. 连作烤烟土壤特征及连作障碍防控技术研究进展[J]. 黑龙江农业科学, 2024(8): 109-117 (  0) 0) |
| [12] |
Bai Y X, Wang G, Cheng Y D, et al. Soil acidification in continuously cropped tobacco alters bacterial community structure and diversity via the accumulation of phenolic acids[J]. Scientific Reports, 2019, 9: 12499 DOI:10.1038/s41598-019-48611-5 (  0) 0) |
| [13] |
Yan L, Zhang W Y, Duan W J, et al. Temporal bacterial community diversity in the Nicotiana tabacum rhizosphere over years of continuous monocropping[J]. Frontiers in Microbiology, 2021, 12: 641643 DOI:10.3389/fmicb.2021.641643 (  0) 0) |
| [14] |
刘艳霞, 李雨, 李想, 等. 烤烟根际土壤微生物对根系酚酸类物质的响应[J]. 植物营养与肥料学报, 2019, 25(8): 1373-1382 (  0) 0) |
| [15] |
Jia M, Wang X S, Zhu X Q, et al. Accumulation of coumaric acid is a key factor in tobacco continuous cropping obstacles[J]. Frontiers in Plant Science, 2024, 15: 1477324 DOI:10.3389/fpls.2024.1477324 (  0) 0) |
| [16] |
Freilich S, Kreimer A, Meilijson I, et al. The large-scale organization of the bacterial network of ecological co-occurrence interactions[J]. Nucleic Acids Research, 2010, 38(12): 3857-3868 DOI:10.1093/nar/gkq118 (  0) 0) |
| [17] |
李桂龙, 李朋发, 吴萌, 等. 化肥配施有机肥对花生根际细菌群落结构及共存网络的影响[J]. 土壤, 2022, 54(3): 498-507 DOI:10.13758/j.cnki.tr.2022.03.009 (  0) 0) |
| [18] |
国家烟草专卖局. 烟草农艺性状调查测量方法: YC/T 142—2010[S]. 北京: 中国标准出版社, 2010.
(  0) 0) |
| [19] |
Lavecchia A, Curci M, Jangid K, et al. Microbial 16S gene-based composition of a sorghum cropped rhizosphere soil under different fertilization managements[J]. Biology and Fertility of Soils, 2015, 51(6): 661-672 DOI:10.1007/s00374-015-1017-0 (  0) 0) |
| [20] |
鲍士旦. 土壤农化分析(3版)[M].
中国农业出版社, 北京, 2000
(  0) 0) |
| [21] |
李振高, 骆永明, 滕应. 土壤与环境微生物研究法[M].
科学出版社, 北京, 2008
(  0) 0) |
| [22] |
林先贵. 土壤微生物研究原理与方法[M].
高等教育出版社, 北京, 2010
(  0) 0) |
| [23] |
Bolyen E, Rideout J R, Dillon M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME 2[J]. Nature Biotechnology, 2019, 37(8): 852-857 DOI:10.1038/s41587-019-0209-9 (  0) 0) |
| [24] |
Newman M E J. Finding community structure in networks using the eigenvectors of matrices[J]. Physical Review E, Statistical, Nonlinear, and Soft Matter Physics, 2006, 74(3 Pt 2): 036104 (  0) 0) |
| [25] |
晋艳, 杨宇虹, 段玉琪, 等. 烤烟轮作、连作对烟叶产量质量的影响[J]. 西南农业学报, 2004, 17(S1): 267-271 (  0) 0) |
| [26] |
汤宏, 刘文祥, 曾掌权, 等. 烤烟连作障碍产生的原因及消减措施研究进展[J]. 湖南农业科学, 2022(10): 107-110 (  0) 0) |
| [27] |
Lisuma J, Mbega E, Ndakidemi P. Influence of tobacco plant on macronutrient levels in sandy soils[J]. Agronomy, 2020, 10(3): 418 DOI:10.3390/agronomy10030418 (  0) 0) |
| [28] |
孙雪婷, 龙光强, 张广辉, 等. 基于三七连作障碍的土壤理化性状及酶活性研究[J]. 生态环境学报, 2015, 24(3): 409-417 (  0) 0) |
| [29] |
李序进, 蔡立群, 李海亮. 兰州百合连作土壤碳氮磷化学计量特征及酶活性研究[J]. 中国农学通报, 2021, 37(6): 82-88 (  0) 0) |
| [30] |
张科, 袁玲, 施娴, 等. 不同植烟模式对烤烟产质量、土壤养分和酶活性的影响[J]. 植物营养与肥料学报, 2010, 16(1): 124-128 (  0) 0) |
| [31] |
Hu H, Tang C, Rengel Z. Influence of phenolic acids on phosphorus mobilisation in acidic and calcareous soils[J]. Plant and Soil, 2005, 268(1): 173-180 DOI:10.1007/s11104-004-0280-x (  0) 0) |
| [32] |
Lithourgidis A S, Damalas C A, Gagianas A A. Long-term yield patterns for continuous winter wheat cropping in northern Greece[J]. European Journal of Agronomy, 2006, 25(3): 208-214 DOI:10.1016/j.eja.2006.05.003 (  0) 0) |
| [33] |
王胜男. 西南山区烤烟连作对土壤微生物多样性的影响及机制研究[D]. 杨凌: 西北农林科技大学, 2021.
(  0) 0) |
| [34] |
姜永雷, 肖雨, 邓小鹏, 等. 微生物菌剂对烟草连作土壤理化性质及土壤胞外酶酶活性的影响[J]. 中国烟草学报, 2022, 28(4): 59-66 (  0) 0) |
| [35] |
蔡秋燕, 阳显斌, 孟祥, 等. 不同连作年限对植烟土壤性状的影响[J]. 江西农业学报, 2020, 32(10): 93-98 (  0) 0) |
| [36] |
胡加云, 朱艳梅, 徐天养, 等. 云南省文山州烟田土壤主要肥力指标多年度动态变化[J]. 土壤, 2022, 54(1): 95-102 DOI:10.13758/j.cnki.tr.2022.01.013 (  0) 0) |
| [37] |
饶德安. 烤烟连作土壤的修复技术及其应用效果研究[D]. 无锡: 江南大学, 2021.
(  0) 0) |
| [38] |
Yu F, Yan Y F, Dong Q, et al. The changes in rhizosphere metabolome and microbiota are the main direct obstacles to continuous cropping in tobacco (Nicotiana tabacum L.)[J]. Agronomy, 2023, 13(4): 964 DOI:10.3390/agronomy13040964 (  0) 0) |
| [39] |
Zhang Y, Dong S K, Gao Q Z, et al. Soil bacterial and fungal diversity differently correlated with soil biochemistry in alpine grassland ecosystems in response to environmental changes[J]. Scientific Reports, 2017, 7: 43077 DOI:10.1038/srep43077 (  0) 0) |
| [40] |
白羽祥, 杨成翠, 史普酉, 等. 连作植烟土壤酚酸类物质变化特征及其与主要环境因子的Mantel Test分析[J]. 中国生态农业学报(中英文), 2019, 27(3): 369-379 (  0) 0) |
| [41] |
Xiong W, Zhao Q Y, Zhao J, et al. Different continuous cropping spans significantly affect microbial community membership and structure in a Vanilla-grown soil as revealed by deep pyrosequencing[J]. Microbial Ecology, 2015, 70(1): 209-218 DOI:10.1007/s00248-014-0516-0 (  0) 0) |
| [42] |
魏光钰, 胡勇, 吴永琴, 等. 土壤强还原处理对植烟土壤真菌群落结构及烤烟产质量的影响[J]. 湖南农业科学, 2021(3): 34-39 (  0) 0) |
| [43] |
Chen S, Qi G F, Luo T, et al. Continuous-cropping tobacco caused variance of chemical properties and structure of bacterial network in soils[J]. Land Degradation & Development, 2018, 29(11): 4106-4120 (  0) 0) |
| [44] |
李孟芝. 三七不同生育期根际土壤微生物组研究[D]. 武汉: 湖北中医药大学, 2020.
(  0) 0) |
| [45] |
Yao J, Wu C Y, Fan L J, et al. Effects of the long-term continuous cropping of Yongfeng yam on the bacterial community and function in the rhizospheric soil[J]. Microorganisms, 2023, 11(2): 274 DOI:10.3390/microorganisms11020274 (  0) 0) |
| [46] |
李琼香, 李志宏, 张云贵, 等. 土壤微生物对不同种植方式的响应[J/OL]. 中国烟草学报, 2025: 1–13. (2025–01–10). https://kns.cnki.net/kcms/detail/11.2985.TS.20250110.0958.002.html.
(  0) 0) |
| [47] |
Kim J M, Roh A S, Choi S C, et al. Soil pH and electrical conductivity are key edaphic factors shaping bacterial communities of greenhouse soils in Korea[J]. Journal of Microbiology, 2016, 54(12): 838-845 DOI:10.1007/s12275-016-6526-5 (  0) 0) |
| [48] |
Ben Keane J, Hartley I P, Taylor C R, et al. Grassland responses to elevated CO2 determined by plant–microbe competition for phosphorus[J]. Nature Geoscience, 2023, 16(8): 704-709 DOI:10.1038/s41561-023-01225-z (  0) 0) |
| [49] |
勾宇春, 王宗抗, 张志鹏, 等. 植物根际促生菌作用机制研究进展[J]. 应用与环境生物学报, 2023, 29(2): 495-506 (  0) 0) |
| [50] |
李桂龙, 王于娟, 冷珂, 等. 绿肥填闲种植下土壤细菌群落特性对土壤多功能性的调控[J]. 土壤, 2024, 56(6): 1253-1261 DOI:10.13758/j.cnki.tr.2024.06.013 (  0) 0) |
| [51] |
温烜琳, 马宜林, 周俊学, 等. 腐熟羊粪有机肥配施无机肥对植烟土壤微生物群落结构和多样性的影响[J]. 土壤, 2023, 55(4): 804-811 DOI:10.13758/j.cnki.tr.2023.04.014 (  0) 0) |
2. Anhui China Tobacco Industry Corporation, Hefei 230000, China;
3. Yunnan Tobacco Company Lijiang Company, Lijiang, Yunan 674100, China
 2025, Vol. 57
2025, Vol. 57


