2. 土壤与农业可持续发展全国重点实验室(中国科学院南京土壤研究所), 南京 211135;
3. 中国科学院大学, 北京 100049
土壤酸化是指在外源和内源H+共同作用下土壤pH不断下降、交换性酸不断增加的过程。土壤酸化是伴随土壤发生和发育的重要过程,在未受人为耕作影响的森林和草原土壤中,酸化的质子源主要为生物活动产生的碳酸和有机酸等弱酸,由此引起的土壤酸化称为自然酸化[1]。土壤的自然酸化速度一般比较缓慢,但人为活动使土壤酸化过程大大加速。20世纪中期至21世纪初,由于工业化的快速发展,大量酸性气体排放进入大气,酸沉降导致北欧、北美和日本等发达国家和地区的土壤和地表水体严重酸化,对森林生态系统和水生生态系统造成严重危害[1]。这一时期,酸沉降也加重我国华南和西南地区的土壤酸化,导致森林退化、农业减产、生态环境恶化。近20年,随着工业节能减排措施取得显著成效,酸性气体的排放逐渐减少,酸沉降对土壤酸化的影响逐渐减弱[1]。然而,自20世纪80年代以来,我国农业生产中化学氮肥的用量不断增加,由于铵态和酰胺态化学氮肥的过量施用,残留于土壤中的铵态氮发生硝化反应并释放质子,加重了农田土壤的酸化;另一方面,在秸秆不还田条件下,作物收获过程中将自身从土壤中吸收的Ca2+、Mg2+和K+等盐基阳离子移出土壤,也加速了土壤酸化[2]。目前,我国耕地酸化问题在除西北干旱区以外的全国范围内普遍发生,分布区域广、面积大,在南方水热资源丰富、农林业生产潜力巨大的经济作物和粮食主产区尤为突出[3],土壤酸化对农业生产和生态环境造成严重危害。
在酸化过程中,当土壤pH下降至5.5以下时,随着土壤pH的不断下降,土壤固相铝的活化量不断增加[4],从土壤固相释放进入土壤溶液中的活性铝对作物根系产生毒害,是酸性土壤上作物生长不良并减产的主要原因。用石灰等碱性物质改良酸性土壤,表观上是提高土壤pH,但本质上是将土壤中的活性铝转化为惰性形态铝,以消除活性铝对作物的毒害。
虽然国内外对土壤酸度和酸化问题在宏观和微观层面均开展了长期、大量和深入的研究,取得了许多重要进展[1],但仍有一些核心科学问题没有阐释清楚,特别是土壤酸化过程中固相铝的活化机制有待阐明,这导致土壤酸化调控的一些关键技术瓶颈难以突破。因此,开展以土壤铝化学为核心的土壤酸化与调控研究,阐明土壤酸化过程中固相铝的活化机制及酸性土壤改良过程中活性铝的转化机制,不仅可以进一步完善土壤酸化理论,还将为土壤酸化调控提供理论依据和技术支撑。
1 土壤酸化过程与缓冲物质的消耗土壤在有酸性物质或碱性物质加入时阻止其pH变化的能力称为土壤对酸碱的缓冲能力。缓冲能力的大小可以定量地用pH缓冲容量来表示,它是指土壤pH提高或降低一个单位所需的碱或酸的量[5]。pH缓冲容量大的土壤不易发生酸化,而缓冲容量小的土壤易发生酸化。反之,在对酸性土壤进行改良时,缓冲容量大的土壤比缓冲容量小的土壤需要更多的石灰等碱性物质中和土壤酸度。
土壤对酸或碱具有缓冲能力的原因是土壤中含有大量缓冲物质[6]。土壤中起缓冲作用的物质包括土壤固相和土壤溶液两部分,但土壤溶液中缓冲物质的数量通常很小,土壤所具有的比较强的酸碱缓冲能力,主要由于土壤固相物质的参与[6]。从一个较宽的土壤pH范围来分析,土壤酸化过程实际上是土壤酸缓冲物质不断消耗的过程。在pH 8.5 ~ 6.2范围内,碳酸盐(主要为CaCO3)是土壤中主要的酸缓冲物质[6-7]。它们以沉淀态存在于土壤固相部分,当有外源酸进入土壤或土壤中有H+产生时,碳酸盐通过酸溶解作用消耗这些H+,并释放Ca2+和CO2。因此,在中性和碱性土壤中,碳酸盐对减缓土壤酸化起到了至关重要的作用。然而,这一过程也消耗了土壤中的无机碳,增加了土壤CO2的排放,不利于土壤固碳减排[8-9]。随着外源酸不断进入土壤,碳酸盐的消耗量增加,土壤pH逐渐下降。当土壤pH降低至6.2以下时,土壤中的碳酸盐基本耗尽,土壤进入硅酸盐矿物的酸缓冲区。
在pH 6.2 ~ 5.0范围内,土壤中的层状硅酸盐矿物是主要的酸缓冲物质。硅酸盐矿物的化学风化对酸起缓冲作用,矿物分解过程中释放出碱金属或碱土金属阳离子和硅酸,同时消耗质子[6]。在pH 5.5 ~ 4.2范围内,土壤通过其表面负电荷位上吸附的交换性盐基阳离子与H+发生阳离子交换反应对酸起缓冲作用。通过阳离子交换反应,H+占据部分交换位,原先吸附于土壤表面的交换性盐基阳离子被置换并进入土壤溶液中。这一过程产生交换性H+,但交换性H+不稳定,大部分交换性H+很快与土壤层状硅酸盐矿物晶格中的铝反应,将其释放到土壤表面的阳离子交换位上,产生交换性铝。土壤交换性H+与交换性铝之和称为土壤交换性酸,其中主要为交换性铝,交换性H+占比很小[4]。阳离子交换反应对土壤酸缓冲作用的贡献主要取决于土壤阳离子交换量(CEC)的大小,CEC数值越大,土壤阳离子交换位的数量越多,土壤对酸的缓冲能力越强。之前的研究结果表明,酸性土壤的pH缓冲容量与土壤CEC之间呈显著的直线相关关系,证明CEC对土壤酸缓冲性能的重要影响[3]。土壤CEC随土壤黏粒含量和黏粒中2∶1型层状硅酸盐矿物占比的增加而增加[10],土壤pH缓冲容量相应增加,土壤的酸缓冲性能也相应增强。土壤矿物的化学风化是一个相对较慢的反应过程,而阳离子交换反应的速度很快,可以快速缓解外源酸对土壤酸化的加速作用。
当土壤进一步酸化至pH低于4.2时,土壤表面的交换性盐基阳离子基本耗尽,土壤阳离子交换位几乎完全被交换性铝和交换性H+占据,呈氢铝饱和状态。在此pH范围内,土壤主要通过矿物层间羟基铝及铝氧化物的溶解、铝氧化物和铁氧化物表面羟基的质子化来缓冲外源酸[6-7]。铁铝氧化物的电荷零点比较高,一般在8.0以上[11]。因此,土壤铁铝氧化物表面羟基的质子化可以在较宽pH范围内(pH低于电荷零点)发生,但在较高pH条件下,由于其他缓冲物质对土壤酸缓冲作用的贡献比较大,铁铝氧化物表面羟基质子化对土壤酸缓冲作用的贡献相对较小。然而,当pH低于4.2时,由于土壤其他缓冲物质基本耗尽,铁铝氧化物表面羟基质子化对土壤酸化的缓冲作用更为突出[12-13]。与离子交换反应不同,羟基质子化反应涉及配位键的形成,这一过程中,羟基中的氧原子提供孤对电子,溶液中的H+提供空轨道,两者结合形成稳定的配位化学键。
根据上述对土壤无机缓冲物质及其酸缓冲反应的分析,可以将控制土壤酸化的化学过程概括为:土壤碳酸盐的溶解、土壤层状硅酸盐矿物的风化、土壤阳离子交换反应、土壤铝氧化物的溶解及土壤铁铝氧化物表面羟基的质子化,这些土壤化学反应也是建立土壤酸化预测模型的基础。除无机物质外,土壤有机质也对土壤酸化有缓冲作用。有机质主要通过其表面羧基、酚羟基离解产生的有机阴离子与土壤溶液中H+的缔合反应对外源酸起缓冲作用[14],有机质中的氨基也具有相似的功能。土壤有机质可以在较宽的pH范围内发挥酸缓冲作用。
2 土壤酸化过程中铝的活化机制 2.1 土壤酸化与交换性铝的产生土壤酸度与酸化是土壤学的传统研究课题,早在20世纪初人们就发现土壤酸度会对土壤养分和作物产量产生不利影响,并开始施用石灰调节土壤pH。但关于土壤酸度本质的认识却经历了一个曲折的发展过程[15]。土壤酸化后,土壤中的酸主要以潜性酸(主要为交换性酸)存在于土壤固相部分,土壤溶液中的活性酸在总酸度中的占比很小。在20世纪50年代之前的相当长时期内,学术界普遍认为土壤交换性酸以交换性氢的形式存在;苏联学者Чepнов(契尔诺夫)根据其系统研究,证明H+质黏土将很快转化成Al3+质黏土,并于1947年出版了俄文专著《土壤酸度的本质》(于天仁先生将其译为中文版)[16],阐明了交换性Al3+在土壤酸度中的作用。之后许多土壤学家开展了广泛的验证研究,到20世纪50年代末,土壤酸度的交换性铝学说被广泛接受。由于土壤酸度本质研究取得突出进展,20世纪50—60年代,土壤酸度问题成为土壤化学研究中最活跃的一个领域[13]。我国自20世纪50年代就开展了土壤酸度与酸化研究,并较早证实了实际土壤中也存在H+/Al3+转化的现象[17]。经过国内外多年的研究,现已明确土壤酸度的本质,基本阐明了土壤酸化的微观机制(图 1)[18]。
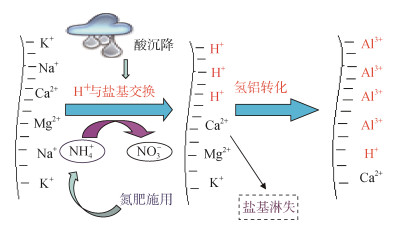
|
图 1 土壤酸化与铝活化示意图[18] Fig. 1 Schematic diagram of soil acidification and aluminum activation |
当土壤pH降至5.5以下时,H+与阳离子的交换反应产生大量交换性H+,并进一步发生H+/Al3+转化产生交换性铝。然而,在这一系列酸化反应中,H+/Al3+转化的微观机制到目前为止还没有阐释清楚。目前仅知道土壤矿物表面的大部分交换性H+会很快转化为交换性铝,但交换性H+是如何与矿物结构中的铝反应并导致Al3+释放到矿物表面阳离子交换位上的?由于H+的反应活性很高,过去缺少合适的研究方法,对这些问题的研究基本处于空白状态,有待深入探讨。当土壤pH高于5.5时,土壤酸度对农业生产和生态环境的不利影响很小;当土壤pH降至5.5以下时,铝的活化量随pH下降显著增加[19],对农业生产和生态环境的危害不断加重。因此,阐明土壤酸化过程中铝的活化机制,可为土壤酸化的精准调控提供理论依据,对红壤等酸性土壤资源的高效和可持续利用具有重要意义。
2.2 层状硅酸盐矿物表面羟基质子化在土壤铝活化中的作用土壤酸化过程中,活性铝主要来源于层状硅酸盐矿物表面的H+/Al3+转化及铝氧化物和氢氧化物的溶解。虽然早在20世纪50年代,经过国内外土壤学家的研究已经明确层状硅酸盐矿物和土壤酸化过程中H+/Al3+转化及交换性Al3+产生这一现象[4],但H+/Al3+转化过程的详细机制至今还不清楚。当土壤pH低于5.5时,进入土壤溶液中的H+首先与土壤矿物表面的交换性盐基阳离子发生离子交换反应,产生交换性H+。根据双电层理论,交换性H+位于土壤表面双电层的扩散层中,不与双电层的紧密层直接接触,它与土壤矿物表面之间至少隔有一层水分子(图 2)。因此,交换性H+是如何与矿物晶格内部的铝反应并将其释放到土壤表面的阳离子交换位上?Li等[20]提出,在层状硅酸盐矿物表面H+/Al3+转化过程中,矿物结构中的Al-OH四面体和Al-OH八面体中-OH的质子化是H+/Al3+转化的重要步骤,矿物酸化过程中其表面或边面羟基质子化在矿物结构中铝的活化过程中发挥重要作用。
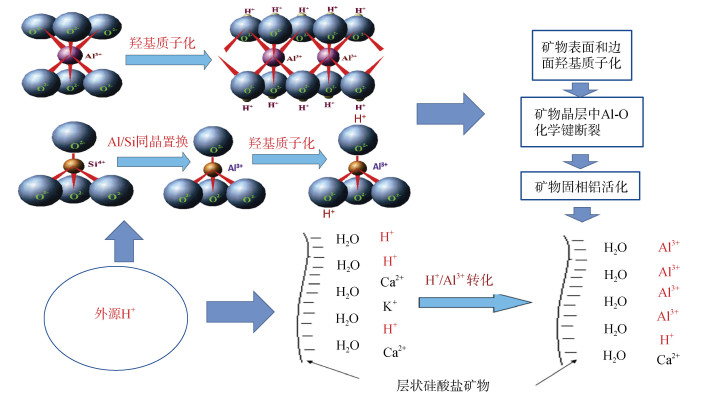
|
图 2 层状硅酸盐矿物表面羟基质子化与铝活化机制示意图 Fig. 2 Schematic diagram of hydroxyl protonation on surface of phyllosilicates and aluminum activation of the minerals |
为了验证矿物表面羟基在铝活化中的作用,本课题组选择蒙脱石进行高温煅烧,煅烧过程中蒙脱石发生脱羟基反应[21]。傅里叶变换红外光谱(FTIR)的结果表明,蒙脱石煅烧后,FTIR上羟基吸收峰的强度减弱,当煅烧温度升高至670 ℃时,FTIR上羟基吸收峰完全消失,说明蒙脱石表面羟基可完全脱除。分别对蒙脱石和煅烧后的蒙脱石进行模拟酸化,随着外源酸加入量的增加,蒙脱石悬液体系的pH下降,蒙脱石表面产生的交换性铝的数量增加;当酸化至相同pH时,经过高温煅烧的蒙脱石悬液体系交换性铝的数量显著低于未煅烧的蒙脱石体系,如pH 4.5时,前者交换性铝仅为1.63 mmol/kg,后者为7.67 mmol/kg[21]。这说明蒙脱石表面羟基脱除后,酸化过程中矿物铝的活化受到显著抑制,也证明了矿物表面羟基在铝活化过程中发挥着重要作用。
进一步选择高岭石、蒙脱石和伊利石,利用三乙氧基硅烷水解产生的活性Si-OH基团与黏土矿物的表面和边面羟基基团发生缩合反应,以消耗矿物表面羟基;利用富里酸、铁氧化物、铁氧化物与富里酸复合物对矿物表面进行物理覆盖,以减少矿物表面羟基的暴露;然后对处理过的矿物进行模拟酸化和铝活化试验,进一步验证层状硅酸盐矿物表面羟基对酸化过程中铝活化的影响[20]。结果表明,4种处理方式均可通过降低矿物表面羟基数量,抑制H+与矿物表面羟基的质子化反应,从而对3种层状硅酸盐矿物酸化过程中铝的活化产生明显抑制作用。这些结果进一步说明矿物表面羟基对矿物酸化过程中铝活化有重要作用,表面羟基质子化是矿物表面交换性H+向交换性Al3+转化的重要步骤[20]。由于H+非常活泼,位于双电层扩散层中的H+经扩散进入双电层的紧密层中,与土壤矿物表面羟基发生质子化反应,这一过程加速了固相铝的活化。
层状硅酸盐矿物表面羟基的质子化与铝活化的机制概括见图 2。羟基质子化如何削弱矿物晶层中Al-O键并导致Al-O键断裂,释放出活性铝?这一系列过程的详细机制目前还不清楚,有待今后进一步研究。
2.3 层状硅酸盐矿物中铝的配位结构对土壤铝活化的影响土壤层状硅酸盐矿物主要由Si-O四面体和Al-O八面体两种基本结构单元按不同方式排列构成。矿物形成过程中Al3+对Si-O四面体中Si4+的同晶置换产生Al-O四面体。因此,层状硅酸盐矿物中铝存在两种配位结构:Al-O八面体和Al-O四面体。在Al-O八面体中,6个O2–或OH–分两层交错排列,6个氧原子构成八面体空隙的中心孔径为0.58 Å[22],与Al3+的离子半径0.57 Å相似,形成稳定的Al-O八面体结构。相似地,在Si-O四面体中,4个氧紧密堆积成四面体时所形成空隙的中心孔径为0.32 Å[22],与Si4+的离子半径0.39 Å相近,因此Si-O四面体也是一种相对稳定的结构。当Al3+取代Si-O四面体中的Si4+形成Al-O四面体时,由于Al3+的离子半径远大于氧四面体空隙的中心孔径,导致Al-O四面体结构稳定性下降。因此,从理论上推测,发生酸化时,层状硅酸盐矿物中Al-O四面体中的铝比Al-O八面体中的铝更容易活化。
为了验证上述假设,本课题组选择高岭石、金云母、伊利石和蛭石–水云母混合矿物,研究了酸化过程中矿物晶格中铝的活化与其配位结构的关系,并采用27Al固态核磁共振波谱技术检测这些矿物中的Al-O四面体和Al-O八面体[23]。结果表明,高岭石中仅检测出Al-O八面体,金云母和伊利石中仅检测出Al-O四面体,蛭石–水云母混合矿物中同时检测出Al-O四面体和Al-O八面体。由于矿物中铝活化对pH的变化非常敏感,因此采用恒pH自动电位滴定装置精确控制模拟酸化过程中矿物悬液体系的pH,测定酸化后矿物悬液体系的可溶性铝和交换性铝,将两者数量之和定义为铝的活化量。研究结果表明,在pH 5.5 ~ 4.3范围内,4种矿物体系可溶性铝、交换性铝和铝的活化量均随体系pH的下降而增加;比较4种矿物体系的结果,在相同pH下3种含Al-O四面体的矿物体系铝的活化量均高于仅含Al-O八面体的高岭石体系,说明层状硅酸盐矿物中Al-O四面体中的铝比Al-O八面体中的铝更容易活化[23]。矿物的CEC也是影响铝活化的因素之一,一般CEC越大,交换性铝含量越高,铝的活化量也越大[24]。高岭石的CEC(7.79 cmol/kg)大于金云母的CEC(3.54 cmol/kg),因此,相同pH时高岭石表面交换性铝含量高于金云母。但金云母体系可溶性铝远大于高岭石体系,金云母中铝的活化总量高于高岭石体系,如pH 4.5时,前者为6.30 mmol/kg,后者为3.52 mmol/kg,进一步说明Al-O四面体中的铝更易活化[23]。
选择热带地区由玄武岩发育、成土年龄不同的两种土壤进行模拟酸化和铝活化的比较研究,一种土壤成土年龄为1万年,另一种为成土年龄133万年的砖红壤[23]。27Al核磁共振检测结果表明,成土年龄1万年的土壤同时含Al-O四面体和Al-O八面体,而成土年龄133万年的砖红壤仅含Al-O八面体。模拟酸化和铝活化的结果表明,当两种土壤酸化至相同pH时,成土1万年土壤的铝活化量显著高于成土133万年的砖红壤,说明土壤矿物Al-O四面体中的铝也比Al-O八面体中的铝更容易活化[23]。课题组进一步选择湖南祁阳红壤、江苏句容黄棕壤、山东威海棕壤和黑龙江嫩江黑土4种地带性土壤,提取土壤黏粒并去除有机质,比较铝活化的差异[25]。27Al核磁共振检测结果表明,土壤黏粒中Al-O四面体的相对含量随采样点纬度的升高而增加,Al-O八面体含量呈相反的变化趋势,即红壤中Al-O八面体的相对含量最高,Al-O四面体的含量最低;而黑土中Al-O四面体含量最高,Al-O八面体含量最低,与土壤风化和发育程度的大小一致。当把4种土壤胶体的悬液酸化至相同pH时,土壤铝活化量的大小顺序与土壤Al-O四面体相对含量的大小顺序一致,进一步证明土壤Al-O四面体中的铝比Al-O八面体中的铝更容易活化[25]。
不同土壤黏土矿物组成存在差异,土壤矿物中Al-O四面体与Al-O八面体的相对含量不同,土壤酸化过程中铝的活化也存在差异。如何针对土壤铝活化特点,研发适合不同类型土壤的酸化阻控技术,还有待今后的进一步研究。
3 铝毒害是土壤酸化危害的核心问题土壤酸化对农业生产和生态环境造成危害,这些危害表观上是由于土壤pH降低和H+浓度升高所致,但主要原因是酸化过程中释放的活性铝对植物和微生物的毒害。
3.1 铝对植物的毒害除茶树等少数喜酸植物外,铝对大多数植物是有毒和有害元素。土壤酸化导致土壤固相铝活化,释放到土壤溶液中的可溶性铝对植物根系产生毒害,并抑制根系生长,从而阻碍根系对水分和养分的吸收。土壤溶液中的毒性铝主要通过抑制作物根尖细胞的伸长和分裂影响根系生长,铝胁迫下根系表现为短而粗、分枝减少、根尖膨大[19]。溶液中Al3+化学活性高,可以与OH–、F–、PO43–、SO42–和小分子有机配体形成可溶性络合物。因此,土壤溶液中可溶性铝存在多种化学形态,除游离态Al3+外,主要以有机和无机络合物形态存在[19]。不同形态铝的植物毒性存在很大差异,一般认为Al3+、Al(OH)2+和Al(OH)2+的植物毒性大,而Al3+与F–、PO43–、SO42–和小分子有机配体形成的络合物毒性很小,甚至无毒[19]。
国内外已对植物铝毒害机制开展了广泛研究,这些研究多偏重植物生理和分子生物学方面。主要研究了植物对铝的吸收、转运及铝在植物体内的分布,探讨了铝对细胞壁、细胞质膜及细胞分裂的不利影响,分析了铝对植物养分吸收和代谢的影响及对植物组织代谢和激素平衡的影响等[19],为缓解酸性土壤植物铝毒害措施的拟定提供了理论依据。然而,关于铝对植物的毒害,至今仍有一些基础性的问题没有阐释清楚。Al3+要对根系产生毒害,首先要与根系表面结合,这已被相关研究所证实。比如,植物根系的根尖部位吸附Al3+的数量大于其他部位[26],因此根尖是根系受铝毒害最严重的部位[19]。植物根系表面一般带负电荷,且含有丰富的有机官能团,因此,吸附于植物根系表面的Al3+通常以交换态、固相有机络合态和沉淀态等化学形态存在[26]。这些不同形态铝在植物铝毒害发生过程中分别扮演何种角色以及相关的作用机制研究还很缺乏。未来需要将植物铝毒害发生的化学过程与植物生理过程相结合,阐明植物铝毒害发生的详细机制。
相同浓度的Al3+对不同植物及同种植物不同基因型的毒害程度存在差异,主要是由于它们对铝毒的耐受能力不同。关于植物耐铝毒害的机制,国内外也已开展大量研究,主要存在两种机制:内部忍耐机制和外部排斥机制[19]。山茶科、野牡丹科、茜草科的植物能从酸性土壤中吸收大量铝,将其累积于植物体内,但却不表现出铝毒害的症状,主要原因是这些植物在吸收和累积铝的同时,植物体内产生大量小分子有机酸和酚酸等有机配体,与Al3+形成稳定络合物,减少了毒性形态Al3+与植物细胞结合的机会,从而减缓甚至消除了铝的毒害[19]。植物耐受铝毒的这一机制被称为内部忍耐机制。大多数植物,特别是大宗农作物,主要通过外部排斥机制缓解铝毒,减少植物对铝的吸收。植物通过其根系向根际土壤中释放小分子有机酸等有机配体,这些有机配体与根系附近土壤中毒性铝形成稳定的络合物,从而降低土壤中毒性铝的含量,减缓铝对根系的毒害及根系对铝的吸收[19]。此外,植物遭受铝胁迫时还可以通过改变根系的表面性质,减缓铝毒的伤害。同一种植物,当生长在酸性土壤中,其根系表面官能团的数量及根系表面负电荷的数量均低于生长在中性和碱性土壤中的植物,因此根系对酸性土壤中有毒形态铝的吸附量减少,铝毒减轻[27]。这也是植物主动适应酸性土壤的机制。筛选并种植耐酸作物品种是酸化耕地高效利用的重要途径,虽然国内外已开展一些耐酸作物品种筛选和耐酸机制研究,但目前耐酸作物一般产量不高,难以大面积推广应用,筛选或培育既耐酸又具有高产和优质特点的作物新品种是未来重要的研究方向。
3.2 铝对微生物的危害及其与生态系统稳定性的关系土壤微生物是驱动土壤生命系统运转的核心,协同参与土壤的生态功能、环境功能和免疫功能,对维持土壤健康至关重要[28]。在酸性土壤中,铝毒是限制农作物生产的关键问题之一,同时也对微生物产生显著的毒害作用。铝主要通过作用于微生物细胞的细胞壁、细胞膜、细胞核及细胞器等结构,干扰其物质与能量代谢,抑制微生物的生长与发育。土壤酸化显著降低微生物活性、多样性和丰富度[29-30]。在此过程中,铝的毒害作用可通过影响微生物介导的养分循环,进而破坏土壤生态系统的稳定性。
土壤酸化的核心危害在于铝毒。当土壤pH降至5.5以下时,土壤中活性Al³+含量显著增加。过量的Al³+可导致微生物细胞壁松弛、细胞膜破裂、胞内物质泄漏,从而降低微生物活性甚至引发死亡[31]。例如,经0.2 mol/L氯化铝溶液处理的胡萝卜软腐欧文氏菌表现出明显的细胞结构变化。该溶液营造的强酸性环境会对细菌造成不利影响,包括细胞表面蛋白变性和膜通透性改变[32],最终导致细胞壁失稳破裂。此外,Al³+能干扰细胞内Mg²+、Ca²+和Fe²+等二价金属离子的代谢,破坏其稳态平衡,影响细胞正常生长[33]。同时,Al³+作为一种助氧剂,可显著增加细胞内活性氧自由基(ROS)水平。ROS对膜脂、蛋白质、DNA等生物大分子具有高度反应活性和损伤能力[34]。由于ROS是有氧呼吸产能过程中的天然副产物,所有需氧生物均面临其潜在损害风险[33]。
室内土壤培养试验表明,铝的添加抑制了土壤呼吸、硝化作用及微生物对凋落物中NH4+的吸收[35]。罗虹等[36]通过大豆盆栽试验研究了不同铝浓度对氨化细菌、硝化细菌、反硝化细菌及自生固氮菌等氮循环微生物的影响。结果表明,当铝添加量小于1.1 g/kg时,随铝含量增加,氨化、硝化、反硝化细菌数量均有所上升;当铝添加量超过1.3 g/kg时,铝开始抑制这些菌群生长,且抑制程度不同;当铝添加量达1.7 g/kg时,对氨化细菌的抑制率达48%,而硝化细菌和反硝化细菌已无法存活,抑制率分别高达96% 和95%。自生固氮菌数量则随铝添加量增加持续下降,铝添加量为1.7 g/kg时仅剩10% 存活[36]。一项全球范围的Meta分析表明,土壤pH平均下降0.24个单位导致活性Al³+含量增加87.1%,因铝毒害作用,土壤微生物呼吸、微生物生物量碳和微生物生物量氮分别降低了14.7%、9.6% 和12.1%[30]。综上,铝毒害通过抑制微生物活性,显著干扰了土壤碳、氮循环过程。
土壤酶是土壤生物代谢的关键驱动力,通过矿化有机质释放养分供植物和微生物吸收利用,在土壤物质循环与能量转换中扮演重要角色[37-39]。Kunito等[40]通过测定多种日本森林土壤的酸度、不同形态铝含量以及与碳、氮、磷循环相关的土壤酶活性,探究了铝毒对酶活性的影响。相关分析表明,可溶性铝和交换性铝显著抑制了葡萄糖苷酶、多酚氧化酶和酸性磷酸酶等参与碳、氮、磷循环的关键土壤酶活性[40]。这表明铝毒及其伴随的酸度损害了土壤微生物功能,降低了微生物数量、养分有效性和养分循环效率,最终对生态系统健康构成威胁。目前,土壤酸化和酸度对微生物危害的研究大多考虑pH的影响,较少关注铝毒的影响。未来应将化学过程与生理和生化过程相结合,阐明酸性土壤铝毒对微生物多样性、活性和生态功能的影响机制,为缓解铝对微生物的毒害,提高土壤生态系统稳定性提供依据。
4 土壤酸度改良过程中铝的形态转化 4.1 铝的水解反应当施用碱性物质对酸性土壤进行改良时,土壤中的活性铝发生水解反应形成羟基铝聚合物,并最终形成氢氧化铝和铝氧化物沉淀。自然环境中铝的水解经历一系列复杂的过程。20世纪中后期,人们对Al3+在溶液体系中的水解反应进行了广泛的研究,这些研究重点关注土壤和天然水体中有机和无机配体对铝的水解过程和水解产物的矿物学性质和表面性质的影响。研究发现,当有小分子有机酸、中等分子量的有机物(如单宁酸)和大分子有机物(腐殖酸)共存时,铝的水解产物主要为无序态或短程有序的氢氧化物或氧化物,难以形成结晶态的三水铝石或假三水铝石[41-44]。随着体系中有机配体/铝摩尔比的增加,铝水解产物的结晶程度减弱,直至形成无定形氢氧化物或氧化物。研究还发现,当有机配体存在时,铝水解产物的表面反应活性更高,对阴、阳离子的吸附能力更强[45]。进入21世纪以来,借助基于同步辐射的X-射线吸收光谱等现代分析技术,在分子和原子水平阐明了有机和无机配体干扰铝水解产物结晶过程的机制。研究发现,在没有有机和无机配体的体系中,铝水解形成以6配位的Al-O八面体为基本结构单元的结晶型产物;当小分子有机酸和单宁酸共存时,这些有机配体可以进入铝水解产物的结构中,改变铝的配位结构,形成同时含6配位铝与4配位铝的混合水解产物,在某些条件下可以形成以4配位铝为主的水解产物[46-47]。研究发现,当有CO32–存在时,铝的水解产物也为6配位铝与4配位铝的混合物,与有机酸共存时的情形相似[48]。这些研究为认识酸性土壤改良中铝的水解过程与机制提供了重要参考,但酸性土壤体系中铝的水解与溶液体系中具有不同特点。一方面,土壤溶液中Al3+水解产生的羟基铝阳离子与土壤固相的层状硅酸盐矿物发生强烈相互作用,这些羟基阳离子吸附到黏土矿物表面,这一过程促进了土壤溶液中Al3+的进一步水解[49],并有可能影响铝水解产物的特性;另一方面,土壤溶液中的小分子有机配体和土壤固相的有机质可与溶液中Al3+形成稳定络合物,抑制铝的水解过程,并影响铝水解产物的特性。由于土壤的复杂性,实际土壤体系中铝水解过程和水解产物特性的研究还相当缺乏。未来应从热力学和动力学两个方面,结合基于同步辐射的X-射线吸收光谱等现代分析技术,深入研究酸性土壤改良过程中铝的水解机制、铝水解产物的特性及其与土壤黏土矿物的相互作用,为酸性土壤精准降酸技术的研发提供理论依据。
4.2 基于交换性铝含量的酸性土壤石灰需要量的测算方法对酸性土壤进行改良,准确估算石灰等碱性物质的需要量是实现精准降酸的前提。早期一般采用田间试验或盆栽试验等经验性方法,如布置田间小区试验,施用不同量的石灰,形成改良梯度,比较不同石灰用量的改良效果,确定大面积酸性土壤改良时的石灰用量[50]。虽然这一方法的结果比较可靠,但费时费力。后来常采用CaCl2交换–Ca(OH)2中和滴定的方法,配制土壤–CaCl2悬液,用Ca(OH)2中和土壤固相释放到溶液中的H+和Al3+,根据滴定过程中Ca(OH)2的消耗量确定石灰需要量[51]。这一方法比较简便,但结果往往偏低,因为铝的水解反应是一个较慢的过程,快速的酸碱滴定未能使溶液中的铝达到水解反应平衡。近年来,根据影响酸性土壤石灰需要量的土壤性质参数建立石灰需要量的估算模型,土壤性质参数主要有土壤pH、交换性酸或交换性铝、CEC、有机质含量、黏粒含量等,采用多元回归方法,根据不同性质参数的影响程度,建立估算方程,计算石灰需要量[52]。这一方法也比较耗时费力,需要采集酸性土壤样品,带回实验室逐一进行土壤性质的分析和测定。
施用石灰等碱性物质改良土壤酸度,表观上是提升酸性土壤的pH,本质上是消除土壤活性铝(交换性铝和可溶性铝)对植物和微生物的毒害。根据这一原理,如能建立土壤活性铝的快速测定方法,则可建立基于土壤活性铝的石灰需要量的快速估算方法。近期,作者等建立了酸性土壤活性铝的快速提取方法,将提取的活性铝溶液与铬天青S显色剂反应,然后用便携式色差仪测定显色液的色差值,建立色差值与铝含量的线性关系,可以在田间条件下测定酸性土壤的活性铝含量。根据活性铝的含量,可以在田间条件下快速估算酸性土壤改良所需的石灰等碱性物质的数量[53],为酸性土壤的改良提供快速、及时的指导。未来应进一步加强酸性土壤活性铝测定方法的研究,采用光谱学和传感器技术,建立土壤活性铝的原位测定方法,为石灰需要量的估算提供更为快捷的依据。
5 以靶向控铝为核心的土壤酸化阻控研究土壤酸化经历由中性至弱酸性、酸性再到强酸性的过程。土壤酸化进入酸性和强酸性阶段,土壤中的酸主要以交换性酸(主要为交换性铝)存在于土壤固相部分,其数量远高于土壤溶液中的酸(活性酸)。因此,土壤一旦发生严重酸化,调节土壤酸度所需碱性物质的数量多,酸碱反应时间长,改良的难度很大、治理成本高。如果能在弱酸性阶段采取有效预防措施减缓土壤酸化的速度,可起到事半功倍的治理效果。但土壤酸化具有隐蔽性和区域差异性,特别是在弱酸性阶段,其对农业生产的负面影响还未显现,很容易被忽视,从而在人为活动影响下加速酸化,发展为酸性和强酸性土壤。目前对土壤酸化预防和预警研究重视不够,已开展的相关研究很少,可供选择的前端预防技术和措施也非常有限,未来应加强以靶向控铝为核心的土壤酸化阻控研究。
土壤酸化阻控可以从源头控酸和过程阻酸两方面进行,其核心是抑制土壤固相铝的活化。化学氮肥的过量施用是我国农田土壤加速酸化的主要驱动因素,采用缓释肥和有机肥部分替代化肥等措施,可以减少化学氮肥的用量,提高氮肥的利用率,同时有效减少质子的产生,缓解农田土壤酸化和铝活化[50, 54]。长期施用有机肥和秸秆还田可以提升土壤的酸缓冲性能,从而提高土壤的抗酸化能力[14]。施用有机肥和秸秆还田提高了土壤有机质含量,土壤有机质表面有机阴离子的质子化是其提升土壤酸缓冲性能的主要机制[14, 55];另一方面,有机质与土壤黏土矿物形成复合体并覆盖在矿物表面,通过物理保护作用阻碍土壤溶液中H+与矿物表面的质子化反应,可有效减缓土壤固相铝的活化[24-25]。
土壤酸化具有反复性,施用石灰等碱性物质将强酸性土壤调节至弱酸性状态,经历耕种、施肥等农业活动后,土壤会再次发生酸化。因此,对酸性和强酸性土壤,将精准降酸技术与长效抑酸技术有效结合[56],可以将酸性土壤的pH长期维持在适宜农作物生长的合适范围,保障酸性土壤资源的高效和可持续利用。
6 结语土壤酸化过程中铝的活化以及酸性土壤改良过程中活性铝的水解和转化是土壤酸化与调控的核心过程,加强对土壤固相铝活化机制和土壤活性铝水解与转化过程的研究,不仅可以丰富和完善土壤酸化理论,还将为酸性土壤改良和缓解土壤活性铝对植物和土壤生态系统的危害提供理论依据。
| [1] |
徐仁扣. 土壤酸化及其调控研究进展[J]. 土壤, 2015, 47(2): 238-244 DOI:10.13758/j.cnki.tr.2015.02.007 (  0) 0) |
| [2] |
Guo J H, Liu X J, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010 DOI:10.1126/science.1182570 (  0) 0) |
| [3] |
赵学强, 潘贤章, 马海艺, 等. 中国酸性土壤利用的科学问题与策略[J]. 土壤学报, 2023, 60(5): 1248-1263 (  0) 0) |
| [4] |
于天仁, 季国亮, 丁昌璞, 等. 可变电荷土壤的电化学[M].
科学出版社, 北京, 1996
(  0) 0) |
| [5] |
Xu R K, Zhao A Z, Yuan J H, et al. pH buffering capacity of acid soils from tropical and subtropical regions of China as influenced by incorporation of crop straw biochars[J]. Journal of Soils and Sediments, 2012, 12(4): 494-502 DOI:10.1007/s11368-012-0483-3 (  0) 0) |
| [6] |
于天仁, 陈志诚. 土壤发生中的化学过程[M].
科学出版社, 北京, 1990
(  0) 0) |
| [7] |
Ulrich B. Natural and anthropogenic components of soil acidification[J]. Zeitschrift Für Pflanzenernä hrung und Bodenkunde, 1986, 149(6): 702-717 (  0) 0) |
| [8] |
Raza S, Miao N, Wang P Z, et al. Dramatic loss of inorganic carbon by nitrogen-induced soil acidification in Chinese croplands[J]. Global Change Biology, 2020, 26(6): 3738-3751 DOI:10.1111/gcb.15101 (  0) 0) |
| [9] |
Huang Y Y, Song X D, Wang Y P, et al. Size, distribution, and vulnerability of the global soil inorganic carbon[J]. Science, 2024, 384(6692): 233-239 DOI:10.1126/science.adi7918 (  0) 0) |
| [10] |
周琴, 姜军, 徐仁扣. Cu(Ⅱ)、Pb(Ⅱ)和Cd(Ⅱ)在红壤胶体和非胶体颗粒上吸附的比较[J]. 土壤学报, 2018, 55(1): 131-138 (  0) 0) |
| [11] |
徐仁扣, 李九玉, 任丽英, 等. 红壤中带电表面之间相互作用的原理与应用[M].
科学出版社, 北京, 2025
(  0) 0) |
| [12] |
程鹏飞, 王莹, 程宽, 等. 红壤可变电荷矿物的酸碱缓冲能力及表面络合模型[J]. 化学学报, 2017, 75(6): 637-644 (  0) 0) |
| [13] |
崔子霄, 吴华勇, 宋效东, 等. 强酸性红壤风化壳酸缓冲容量的垂直分异特征及主控因素[J/OL]. 土壤学报, (2025–05–22). https://kns.cnki.net/KCMS/detail/detail.aspx?filename=TRXB20250522001&dbname=CJFD&dbcode=CJFQ.
(  0) 0) |
| [14] |
Shi R Y, Liu Z D, Li Y, et al. Mechanisms for increasing soil resistance to acidification by long-term manure application[J]. Soil and Tillage Research, 2019, 185: 77-84 DOI:10.1016/j.still.2018.09.004 (  0) 0) |
| [15] |
于天仁. 土壤化学原理[M].
科学出版社, 北京, 1987
(  0) 0) |
| [16] |
Чepнов B A著, 于天仁译. 土壤酸度的本质[M]. 北京: 科学出版社, 1957.
(  0) 0) |
| [17] |
凌云霄, 于天仁. 土壤酸度与代换性氢、铝的关系[J]. 土壤学报, 1957(3): 234-246 (  0) 0) |
| [18] |
徐仁扣, 李九玉, 周世伟, 等. 我国农田土壤酸化调控的科学问题与技术措施[J]. 中国科学院院刊, 2018, 33(2): 160-167 (  0) 0) |
| [19] |
沈仁芳. 铝在土壤-植物中的行为及植物的适应机制[M].
科学出版社, 北京, 2008
(  0) 0) |
| [20] |
Li K W, Lu H L, Nkoh J N, et al. The important role of surface hydroxyl groups in aluminum activation during phyllosilicate mineral acidification[J]. Chemosphere, 2023, 313: 137570 DOI:10.1016/j.chemosphere.2022.137570 (  0) 0) |
| [21] |
Li K W, Lu H L, Nkoh J N, et al. Effect of high-temperature dehydroxylation on acidification-induced aluminum activation in montmorillonite[J]. Journal of Soils and Sediments, 2023, 23(6): 2473-2481 DOI:10.1007/s11368-023-03494-y (  0) 0) |
| [22] |
Barnhisel R I, Bertsch P M. An introduction to soil mineralogy//Dixon J B, Weed S B. Minerals in soil environments[M]. 2nd ed. Madison, USA: SSSA Book Series, 1989: 11–12.
(  0) 0) |
| [23] |
Li K W, Shi Y, Nkoh J N, et al. Effect of coordination structure of aluminum on its activation from minerals and Oxisols during their acidification[J]. Pedosphere, 2024, 34(5): 916-928 DOI:10.1016/j.pedsph.2023.07.003 (  0) 0) |
| [24] |
Li K W, Lu H L, Nkoh J N, et al. Aluminum mobilization as influenced by soil organic matter during soil and mineral acidification: A constant pH study[J]. Geoderma, 2022, 418: 115853 DOI:10.1016/j.geoderma.2022.115853 (  0) 0) |
| [25] |
Li K W, Xu R K, Cai Z J. Aluminum mobilization characteristics in four typical soils from different climate zones during their acidification[J]. Plant and Soil, 2024, 504(1): 29-46 (  0) 0) |
| [26] |
Liu Y, Xu R K. The forms and distribution of aluminum adsorbed onto maize and soybean roots[J]. Journal of Soils and Sediments, 2015, 15(3): 491-502 DOI:10.1007/s11368-014-1026-x (  0) 0) |
| [27] |
Lu H L, Nkoh J N, Abdulaha-Al Baquy M, et al. Plants alter surface charge and functional groups of their roots to adapt to acidic soil conditions[J]. Environmental Pollution, 2020, 267: 115590 DOI:10.1016/j.envpol.2020.115590 (  0) 0) |
| [28] |
孔亚丽, 秦华, 朱春权, 等. 土壤微生物影响土壤健康的作用机制研究进展[J]. 土壤学报, 2024, 61(2): 331-347 (  0) 0) |
| [29] |
Bru D, Ramette A, Saby N P A, et al. Determinants of the distribution of nitrogen-cycling microbial communities at the landscape scale[J]. The ISME Journal, 2011, 5(3): 532-542 DOI:10.1038/ismej.2010.130 (  0) 0) |
| [30] |
Meng C, Tian D S, Zeng H, et al. Global soil acidification impacts on belowground processes[J]. Environmental Research Letters, 2019, 14(7): 074003 DOI:10.1088/1748-9326/ab239c (  0) 0) |
| [31] |
Ma Z Y, Jiang M T, Liu C Y, et al. Quinolone-mediated metabolic cross-feeding develops aluminium tolerance in soil microbial consortia[J]. Nature Communications, 2024, 15: 10148 DOI:10.1038/s41467-024-54616-0 (  0) 0) |
| [32] |
Yaganza E S, Rioux D, Simard M, et al. Ultrastructural alterations of Erwinia carotovora subsp. atroseptica caused by treatment with aluminum chloride and sodium metabisulfite[J]. Applied and Environmental Microbiology, 2004, 70(11): 6800-6808 DOI:10.1128/AEM.70.11.6800-6808.2004 (  0) 0) |
| [33] |
罗义勇, 刘卫红, 严金平. 微生物铝毒害和耐铝毒机制研究进展[J]. 生命科学, 2011, 23(4): 414-419 (  0) 0) |
| [34] |
Exley C, Derek Birchall J. The cellular toxicity of aluminium[J]. Journal of Theoretical Biology, 1992, 159(1): 83-98 DOI:10.1016/S0022-5193(05)80769-6 (  0) 0) |
| [35] |
Kraal P, Nierop K G J, Kaal J, et al. Carbon respiration and nitrogen dynamics in Corsican pine litter amended with aluminium and tannins[J]. Soil Biology and Biochemistry, 2009, 41(11): 2318-2327 DOI:10.1016/j.soilbio.2009.08.017 (  0) 0) |
| [36] |
罗虹, 刘鹏, 徐根娣. 铝对土壤微生物区系组成的影响[J]. 生态环境, 2004, 13(1): 11-13 (  0) 0) |
| [37] |
Nannipieri P, Giagnoni L, Renella G, et al. Soil enzymology: Classical and molecular approaches[J]. Biology and Fertility of Soils, 2012, 48(7): 743-762 DOI:10.1007/s00374-012-0723-0 (  0) 0) |
| [38] |
Zuccarini P, Sardans J, Asensio L, et al. Altered activities of extracellular soil enzymes by the interacting global environmental changes[J]. Global Change Biology, 2023, 29(8): 2067-2091 DOI:10.1111/gcb.16604 (  0) 0) |
| [39] |
Cheng L, Liu Q, Nian H, et al. Microbial enhancement of plant aluminum tolerance[J]. Biology and Fertility of Soils, 2025, 61(6): 985-997 DOI:10.1007/s00374-025-01920-6 (  0) 0) |
| [40] |
Kunito T, Isomura I, Sumi H, et al. Aluminum and acidity suppress microbial activity and biomass in acidic forest soils[J]. Soil Biology and Biochemistry, 2016, 97: 23-30 DOI:10.1016/j.soilbio.2016.02.019 (  0) 0) |
| [41] |
Ng Kee Kwong K F, Huang P M. Influence of citric acid on the hydrolytic reactions of aluminum[J]. Soil Science Society of America Journal, 1977, 41(4): 692-697 DOI:10.2136/sssaj1977.03615995004100040014x (  0) 0) |
| [42] |
Ng Kee Kwong K F, Huang P M. Comparison of the influence of tannic acid and selected low-molecular-weight organic acids on precipitation products of aluminum[J]. Geoderma, 1981, 26(3): 179-193 DOI:10.1016/0016-7061(81)90014-8 (  0) 0) |
| [43] |
Kodama H, Schnitzer M. Effect of fulvic acid on the crystallization of aluminum hydroxides[J]. Geoderma, 1980, 24(3): 195-205 DOI:10.1016/0016-7061(80)90023-3 (  0) 0) |
| [44] |
Violante A, Krishnamurti G S R, Huang P M. Impact of organic substances on the formation and transformation of metal oxides in soil environments//Huang P M, Bollag J M, Senesi N. Interactions between soil particles and microorganisms[M]. Chichester, UK: Wiley & Sons, 2002: 133–188.
(  0) 0) |
| [45] |
Huang P M, Violante A. Influence of organic acids on crystallization and surface properties of precipitation products of aluminum//Huang P M, Schnitzer M. Interactions of soil minerals with natural organics and microbes[M]. SSSA Spec. Publ. 17. SSSA, Madison, WI, 1986: 159–221.
(  0) 0) |
| [46] |
Hu Y F, Xu R K, Dynes J J, et al. Coordination nature of aluminum (oxy)hydroxides formed under the influence of tannic acid studied by X-ray absorption spectroscopy[J]. Geochimica et Cosmochimica Acta, 2008, 72(8): 1959-1969 DOI:10.1016/j.gca.2008.02.002 (  0) 0) |
| [47] |
Xu R K, Hu Y F, Dynes J J, et al. Coordination nature of aluminum (oxy)hydroxides formed under the influence of low molecular weight organic acids and a soil humic acid studied by X-ray absorption spectroscopy[J]. Geochimica et Cosmochimica Acta, 2010, 74(22): 6422-6435 DOI:10.1016/j.gca.2010.07.029 (  0) 0) |
| [48] |
Zhang G Y, Hu Y F, Xu R K, et al. Carbonate-induced structural perturbation of Al hydroxides[J]. Clays and Clay Minerals, 2009, 57(6): 795-807 DOI:10.1346/CCMN.2009.05706012 (  0) 0) |
| [49] |
Xu R K, Xiao S C, Li J Y, et al. Hydrolysis of aluminum ions in kaolinite and oxisol suspensions as influenced by organic anions[J]. Pedosphere, 2007, 17(1): 90-96 DOI:10.1016/S1002-0160(07)60012-5 (  0) 0) |
| [50] |
徐仁扣. 酸化红壤的修复原理与技术[M].
科学出版社, 北京, 2013
(  0) 0) |
| [51] |
鲁如坤. 土壤农业化学分析方法[M].
中国农业科学技术出版社, 北京, 2000
(  0) 0) |
| [52] |
Aramburu Merlos F, Silva J V, Baudron F, et al. Estimating lime requirements for tropical soils: Model comparison and development[J]. Geoderma, 2023, 432: 116421 DOI:10.1016/j.geoderma.2023.116421 (  0) 0) |
| [53] |
李科伟, 徐仁扣, 郭琳钰, 等. 一种田间条件改良酸性土壤确定石灰需要量的方法: CN202411126203.5[P]. 2025–08–22.
(  0) 0) |
| [54] |
Cai Z J, Wang B R, Zhang L, et al. Striking a balance between N sources: Mitigating soil acidification and accumulation of phosphorous and heavy metals from manure[J]. Science of the Total Environment, 2021, 754: 142189 DOI:10.1016/j.scitotenv.2020.142189 (  0) 0) |
| [55] |
李科伟, 徐仁扣. 碳循环在土壤酸化与调控中的作用[J]. 土壤, 2025, 57(3): 485-497 DOI:10.13758/j.cnki.tr.2025.03.001 (  0) 0) |
| [56] |
徐仁扣, 闫静. 一种维持酸性农田根区土壤适宜pH长期稳定的方法: CN202310322778.3[P]. 2023–10–20.
(  0) 0) |
2. State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 211135, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57

