2. 福建农林大学资源与环境学院, 福州 350002;
3. 中国科学院大学, 北京 100049
土壤是全球最大的碳库之一,约储存了3 000 Pg的碳,平均碳龄约3 100年,展现出显著的长期碳汇潜力[1]。在“双碳”战略背景下,如何提升土壤碳汇功能,以实现农业可持续发展与气候变化缓解的双重目标,已成为当前生态与土壤科学领域的前沿问题。土壤有机碳(Soil organic carbon,SOC)的积累不仅关系到碳汇潜力,还直接影响到土壤培肥能力与生产力水平,是耦合生态与农业效益的核心纽带。红壤作为我国亚热带地区广泛分布的典型土壤类型,面积约占国土总面积的23%[2],其矿物–有机质相互作用能力较强,具备显著的固碳优势。然而,由于长期受高温多雨和强烈风化的影响,红壤普遍存在酸性强、有机质含量低等问题,导致地力下降、养分供应能力不足,制约了土壤培肥效能的提升,也限制了该区域SOC库的积累与稳定。当前红壤固碳培肥技术多聚焦于物理化学调控(如深耕深松、有机物料还田)[3],但对“生物网络”作用机制的认知仍较为有限,导致碳转化效率难以显著提升,制约了碳汇功能和培肥效应的实质性突破。
“生物网络”是指土壤系统中植物根系、微生物组(如细菌、真菌和原生生物等)与土壤动物(如线虫、螨虫和蚯蚓等)之间,通过复杂交互作用(如共生、捕食、竞争和促进等)构建的多层级互作网络[4]。这一视角突破了以往单一过程研究的局限,将土壤系统视为一个动态的生态网络,碳的输入、转化与稳定在该网络中受到各生物类群之间复杂作用的协同调控。在此框架下,碳的转化不再被简化为线性过程,而是受到生物网络内部复杂级联效应的协同调控。实证研究表明,土壤生物网络不仅影响有机质的分解与转化效率,还通过驱动碳向微生物残体积累、矿物结合及团聚体保护等多种稳定化路径分流,从而决定SOC的长期稳定性与固碳效能[5-8]。SOC的稳定积累不仅优化土壤结构,提升团聚体构建能力,还增强土壤养分保持和缓释特性,从而实现固碳与培肥的协同增效。然而,当前关于旱地红壤中生物网络结构特征及其对SOC动态的调控机制仍缺乏系统性认识,尤其是不同类群生物之间的交互作用如何协同调控碳流动路径与稳定过程及其机制尚待深入研究。因此,深入解析旱地红壤典型生物网络的组成结构及其与SOC固存过程的耦合机制,不仅有助于揭示SOC高效转化与稳定的关键生物驱动因子,更能为旱地红壤生态系统实现“固碳培肥”双重目标的调控策略奠定坚实的科学基础。
1 储碳理论概述 1.1 土壤生物碳泵概念框架土壤SOC的形成和稳定传统研究主要集中于植物源碳对土壤碳库积累的贡献。植物凋落物的逐步分解被视为SOC储存的主要过程,通常认为植物碳在腐殖化后,最终转化为CO2的残留物[9]。然而,许多关于SOC形成的经典概念正被重新评估,并逐渐被新的理论所取代。Liang等[10]从土壤微生物的合成代谢过程出发,提出以“微生物碳泵”(Microbial carbon pump,MCP)为核心的新型SOC形成和稳定机制,即“土壤MCP”。该理论框架阐释了微生物通过两种代谢途径调控土壤碳循环过程:一是体外修饰机制(ex vivo modification),即通过分泌胞外酶降解和转化植物残体碳;二是体内周转机制(in vivo turnover),即微生物通过生长–繁殖–死亡的同化过程形成微生物残体碳,促进SOC的累积与稳定。然而,土壤生物网络中的多营养级互作可以通过改变碳利用效率(Carbon use efficiency,CUE)和胞外酶分泌水平分别调控体内和体外过程,进而对SOC积累产生正或负向效应。基于此,Wang等[5]在现有MCP框架基础上引入营养级互作理论,构建了“生物碳泵”(Biological carbon pump, BCP)新概念。BCP作为对MCP的扩展,强调土壤生物网络中多营养级生物(如微生物、原生生物、线虫及小型土壤动物等)通过捕食直接或间接调控微生物生物量生产与残体积累,从而驱动SOC形成与稳定。最新研究表明,食微线虫和捕食性原生生物通过捕食细菌或真菌,加速微生物周转,促进微生物残体积累,加强SOC更新能力[11-12]。这些多营养级相互作用,通过调节微生物的“生长–死亡”动态平衡,最终影响SOC的矿物结合效率与长期封存能力。重要的是,微生物残体不仅是SOC库的重要组成部分,还富含氮、磷、钾等关键营养元素,其积累有助于形成缓释型有机养分库,增强土壤养分保持和供应能力,从而促进土壤肥力提升。BCP的提出不仅为揭示SOC形成过程中的生物调控机制提供了系统性视角,也为生态网络功能与“固碳培肥”协同增效策略的优化奠定了理论基础。
尽管MCP和BCP理论框架在揭示SOC形成与稳定的微生物驱动机制方面已取得重要进展,但在红壤等特定土壤类型中的应用仍然存在一定局限性。红壤的低养分含量、强酸性环境以及高活性铁铝氧化物等特性,可能显著改变土壤生物网络的组成与功能,进而影响BCP核心过程的运行效率。例如,在酸性胁迫下,微生物群落结构往往向耐酸类群倾斜[13],其碳利用效率和残体产量可能发生改变;同时,土壤动物的捕食活动在强酸性条件下也可能受到影响[14],从而干扰微生物的体外修饰与体内周转过程。更为根本的是,MCP理论框架主要聚焦于微生物的代谢活动,忽略了微生物群落中种间互作(如竞争和促进等)对碳转化的潜在影响;而BCP虽在此基础上引入了多营养级之间的捕食关系,却仍未系统整合植物–微生物–土壤动物之间的互作机制。因此,亟需从“生物网络互作”的视角出发,深化对植物–微生物–土壤动物间互作关系及其对土壤碳汇功能与培肥效应的认识。
2 生物网络对土壤有机碳累积的调控机制生物网络对SOC累积的调控本质上是网络内多元互作协同驱动的结果。主要包括以下3方面内容:①植物–微生物互作,尤其是植物与菌根真菌之间构建的共生网络,因其在碳输入路径中的特殊作用,成为当前研究关注的重点对象;②微生物群落内部的种间互作,包括种间竞争和代谢互补在碳转化中的作用;③跨营养级互作,主要指捕食对碳稳定过程的间接驱动(图 1)。
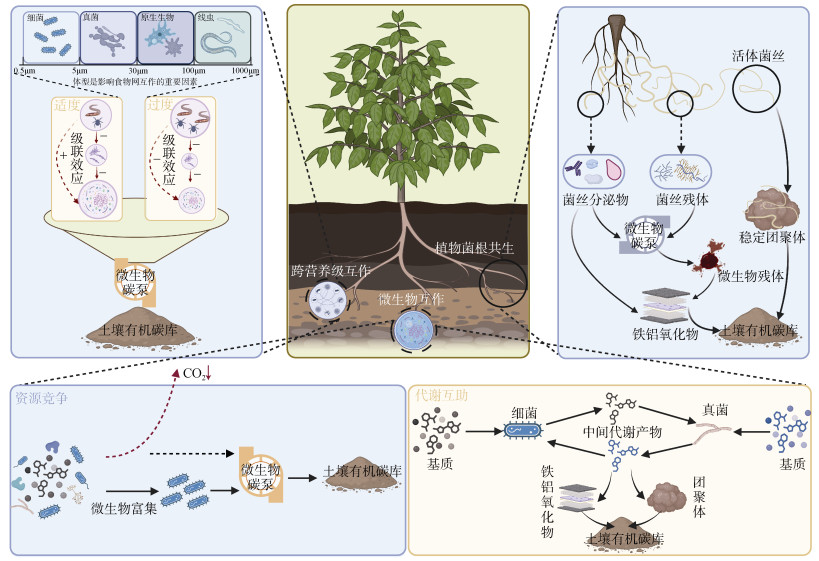
|
图 1 生物网络固碳机制 Fig. 1 Carbon sequestration mechanisms of biological networks |
植物将30% ~ 65% 的光合产物分配至地下,维持根系生命活动与根际功能[15-16]。菌根真菌作为植物根系和土壤之间的关键生物媒介,在SOC形成过程中作用独特却被长期低估。菌丝网络作为“生物导管”,将植物光合碳高效输运至土壤孔隙及矿物表面。同时,菌根真菌通过分泌代谢产物和产生菌丝残体,促进了微生物残体库的累积。上述碳源在土壤矿物的物理/化学保护机制下,微生物降解风险降低,从而促进SOC的形成与长期稳定,为提升红壤的培肥潜力提供物质基础[17]。总体而言,植物光合碳经菌根真菌进入SOC库的路径可归纳为3大通路:活菌根生物量、菌丝分泌物的输入、菌丝死亡后的残体转化。
为量化菌根真菌对土壤碳储量的贡献,需综合评估其生长速率、周转周期和现存生物量。在实验室条件下,丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)菌丝的日生长速率约在3 mm及以上[18];外生菌根菌丝的日生长速率可达8 mm[19];据估算,外生菌根真菌(Ectomycorrhizal fungi,EMF)年碳生产量为2 ~ 200 g/(m2·a)[20]。此外,不同类型的菌根真菌的菌丝寿命存在显著差异。例如,EMF的菌丝周转周期平均为11个月,而AMF的菌丝周转迅速,平均5 ~ 6 d[19],这种较短的周转周期导致大量菌丝残体(如细胞壁等)在远离微生物活动活跃的根际区域积累,所形成的SOC更难被分解,从而具备更高的稳定性。从生物量角度来看,菌根菌丝的生物量在微生物群落中占比较高。在森林生态系统中,菌根菌丝的生物量可达微生物总生物量的1/3,甚至占全部活体菌丝生物量的1/2以上[19, 21]。这些结果充分表明,植物–菌根真菌共生网络在SOC转化及稳定过程中发挥着核心作用,是构建红壤碳汇功能的重要生物基础。值得注意的是,菌根菌丝有助于形成更密集、更广阔的地下共生网络,促进植物对养分(如氮、磷等)的吸收与传输,进而提高土壤养分有效性和植物养分利用效率,实现土壤固碳培肥与作物增产增效的协同。
菌根真菌可以向土壤中分泌大量代谢产物从而促进SOC的形成。菌根真菌分泌物包括葡萄糖等糖类、氨基酸、有机酸、脂肪酸、酚类化合物、甾醇、维生素和酶类等易分解且富含能量的低分子量有机化合物[22-23],能够为土壤微生物群落提供高质量碳源,驱动MCP固碳过程,也为土壤微生物代谢提供有机氮、磷等养分,进而提升土壤肥力水平。研究表明,菌丝分泌物的碳输入可占植物光合碳分配的4% ~ 6%[17],并可直接激活MCP相关过程。作为高质量底物,菌丝分泌物可增强微生物代谢活性,加速微生物生物量的形成,这一过程不仅为稳定SOC库的构建提供重要前提,同时通过强化微生物介导的有机质转化过程,提升土壤养分转化效率,从而促进土壤培肥。此外,部分分泌物可以扩散至微生物难以到达的微环境位点,或直接吸附于土壤矿物表面[24]。在脱硅富铁铝化作用强烈的红壤地区,铁铝氧化物与SOC的结合是决定碳稳定性的重要机制[25]。菌丝分泌物中富含的极性化合物,如球囊霉素相关土壤蛋白(Glomalin-related soil protein,GRSP)等胞外聚合物,可通过配体交换或静电力与铁铝氧化物结合,形成稳定的有机–无机复合体,使碳的滞留时间延长2倍~ 3倍,增强SOC的矿物保护效应。此外,GRSP类物质可有效增强土壤胶结能力,优化团聚体结构,提高土壤孔隙度,进而改善土壤水肥保持能力,是提升土壤培肥效应的重要有机因子。同时,菌根菌丝及其分泌物通过物理缠绕和吸附等胶结作用促进土壤颗粒形成土壤团聚体,使聚集于团聚体内部的SOC受到物理保护,降低其被微生物分解的风险,从而进一步提升其对稳定碳库的贡献。团聚体不仅是保肥的重要场所,也是微生物转化养分的“热区”,可以为作物生产提供持续养分供给。
菌根真菌死亡后形成的残体是植物碳转化为SOC的高效途径。从分子结构上看,菌根真菌细胞壁主要由几丁质与β-葡聚糖组成[26]。与细菌细胞壁中易降解的肽聚糖相比,真菌细胞壁中的几丁质具有更高的化学稳定性和抗分解能力。几丁质分子中β-1, 4-糖苷键的存在使其更难以被微生物降解[27]。这种结构特性不仅延缓了菌丝残体的分解速率,还增强了与土壤矿物(特别是铁铝氧化物)表面的结合能力。研究表明,几丁质分子中丰富的羟基官能团可通过配体交换与铁铝氧化物表面的基团进行吸附,形成稳定的有机–无机复合体[28]。除几丁质外,真菌残体还富含脂质、蛋白质、黑色素等组分[17]。其中,黑色素是一种高分子、结构复杂且难降解的芳香族聚合物。研究发现,芳香族化合物不易受矿物表面吸附位点的限制,可通过π–π作用优先吸附于铁氧化物表面[28],从而显著提高其在土壤中的稳定性。与之相比,黑色素化菌丝对铁氧化物的吸附能力显著高于非黑色素化菌丝[29],这一特性有助于真菌残体更高效地与红壤中丰富的铁铝氧化物结合,提升残体碳的长期封存潜力。总体而言,菌根真菌死亡后形成的残体可通过MCP路径向SOC库转化,成为驱动红壤碳汇形成与稳定的关键生物因子。这一碳稳定路径与养分积累过程相互促进,为红壤固碳培肥协同增效机制的构建提供了理论支撑与实践基础。
2.2 微生物群落内部的竞争与促进作用微生物群落在争夺有限资源的过程中形成种间竞争与代谢互助机制,这些复杂的微生物互作影响了SOC的归趋与累积,还通过调控养分循环直接参与土壤培肥过程。强烈的资源竞争限制r–策略型(快速生长型)微生物的扩张,同时促进k–策略型(高CUE、低增殖率)微生物的富集[30]。这些优势物种倾向于将更多碳投入细胞结构合成而非呼吸损耗,合成的微生物残体作为稳定SOC的前体物质,显著提升土壤的保肥供肥能力。“Gadgil效应”进一步揭示了微生物竞争对SOC稳定性的影响[31]。该假说认为,腐生真菌与菌根真菌对土壤有限养分的竞争可抑制腐生分解过程,进而减缓碳的矿化速率,有助于SOC的积累与固存。这种竞争驱动的碳保留机制同时促进氮磷等养分的耦合固定,形成碳氮磷养分协同提升的培肥效应。该机制在养分受限、菌根真菌占优势的红壤环境中具有更强的适用性,提示菌群间的负向互作可通过限制分解过程间接促进碳稳定和肥力提升[32]。此外,在激烈的资源竞争压力下,微生物群落不仅会改变种群结构与生存策略,还可能促进胞外酶分泌及其活性以提升底物获取能力[33]。胞外酶活性的增强直接调控有机质的分解速率,进而影响SOC的短期释放与长期积累,构成微生物竞争调控碳稳定性的另一关键机制[33-34]。
另一方面,在红壤系统中微生物之间的协同作用(如代谢互补)也是影响SOC稳定性与土壤培肥的关键机制。交叉喂养在土壤中广泛存在,一个微生物群体分泌的代谢产物可作为另一个群体的优先底物,增强其在营养限制或环境胁迫下的生存适应性[35]。这种互作是细菌与真菌共存和协同代谢的主要驱动机制[33]。例如,真菌通过分泌胞外酶降解大分子有机物,为细菌提供可利用的小分子碳源;而细菌在代谢过程中产生的副产物(如有机酸、胞外多糖等)又可反哺真菌生长,进而促进微生物残体形成,实现碳汇与肥力的同步提升。此类代谢互补过程可产生更多高反应活性的有机中间体,为其与铁/铝矿物的稳定结合提供前体,从而促进SOC的矿物保护效应。研究表明,固氮细菌与腐生真菌之间存在互惠关系,固氮细菌提供氮源,真菌则提供碳源及其他营养物质,两者协同促进稳定共生[30]。更重要的是,真菌可通过优化微域水分条件来扩展细菌的生存空间,增强其运动性和扩散能力,使细菌更有效地占据新生态位[35]。这种基于空间结构的互惠机制,有助于维持细菌多样性和功能稳定性。此外,细菌与真菌等多类群间的协同作用有助于合成多糖、脂类、蛋白质等关键代谢产物。这些产物不仅构成微生物残体碳的主要来源,也易与矿物表面或团聚体结合,形成稳定的土壤碳库。值得注意的是,竞争与协同作用在微生物群落中往往同时存在,其动态平衡关系共同调控着碳的矿化与稳定过程。适度的竞争压力有助于筛选高效利用碳资源的优势菌群,而良性的互利互作则可增强微生物网络的协同代谢能力和抗干扰能力,从而稳定驱动SOC库的形成,保障肥力供给的持续性。因此,在旱地红壤系统中,识别并优化微生物网络中的关键互作关系,构建以“高CUE种群+代谢协同网络”为特征的微生物群落结构,是实现固碳与培肥双目标的关键路径之一。
2.3 土壤动物介导的微生物群落调控机制土壤动物群落生物多样性高,是红壤生态系统食物网构建的关键组分。典型土壤动物类群包括原生动物、线虫、跳虫、螨类及蚯蚓等[36]。这些土壤动物可通过捕食作用与微生物群落产生复杂的营养级互作,显著影响土壤微生物的种群动态、代谢活动及残体积累,并最终调控土壤养分周转与肥力水平。
首先,土壤动物的选择性摄食通过改变微生物的丰度与群落结构,并塑造其对捕食压力的响应方式,从而影响微生物残体的形成[37]。例如,食细菌原生动物与线虫的摄食活动能够提高细菌群体的更新速率,促进其快速周转,从而增加死亡细菌所形成的残体输入,提升红壤养分的供应能力[6]。适度的捕食压力能诱导微生物产生胞外聚合物或形成休眠结构以增强自身抵御能力[38]。同时,这些物质作为难降解碳源,可提升微生物残体碳的化学稳定性,也可以通过增强细胞与矿物表面的黏附力,增加矿物结合有机碳的形成[39]。然而,过度捕食可能导致微生物群落崩解,使SOC更易通过呼吸作用以CO2形式释放,从而降低CUE和土壤持续供肥潜力[5]。再者,土壤食物网可通过级联效应间接调控微生物残体的形成和积累过程。食微动物(如线虫和原生动物)通过直接摄食可以降低微生物生物量,抑制微生物残体形成[40];当更高营养级的捕食者(如捕食性螨类或杂食性线虫)介入时,它们通过捕食削弱食微动物对微生物的取食强度,从而促进微生物的生长与残体积累[41]。因此,捕食强度在调控微生物残体碳积累中起着双向调节作用,其生态效应需结合土壤环境条件与群落组成综合考量。
体型大小也是影响土壤动物选择性捕食的重要因素[42]。体型大小不仅决定捕食者的摄食能力与空间活动范围,也显著影响其对不同体型微生物的捕食偏好,从而调节微生物残体的形成路径。在土壤食物网中,捕食者与被捕食者间的体型匹配程度是捕食发生与否的关键决定因素。研究表明,捕食者通常优先选择体型适中、易于吞噬或穿透的微生物作为靶标[42]。红壤结构紧实、孔隙度低,微生物多依附于团聚体内的微孔隙生存,因此体型选择性在红壤中表现得尤为显著。细菌常定殖于小于2 ~ 3 μm的微孔隙中,从而形成庇护效应,物理上限制原生动物(> 5 μm)和线虫(直径约10 μm,体长约1 000 μm)等捕食者的进入[43]。这种物理屏障减弱了细菌被捕食的压力,有助于细菌延长存活时间,从而获得更多通过生长代谢积累生物量的机会。这不仅增强微生物残体的生成效率,也促进细菌在养分循环中功能的发挥,为固碳培肥协同提供潜在支撑。相比之下,体型较大的丝状真菌对自身空间需求高,在微团聚体中的分布受到更多限制,更容易暴露于捕食者可进入的大孔隙环境中[43]。一旦遭遇捕食,细胞结构受损并迅速死亡,进而形成富含几丁质等抗逆性强的细胞壁组分的真菌残体。这类残体具有较高的化学稳定性和矿物亲和性,更易与土壤矿物表面结合,从而在土壤中长期滞留,成为稳定SOC库的重要输入来源。此外,不同类型捕食者在捕食偏好上表现出显著功能差异。例如,原生动物摄食行为选择性较强,偏好摄食易降解的革兰氏阴性菌,间接提升革兰氏阳性菌的相对丰度[44]。革兰氏阴性菌残体在矿物表面的吸附率通常高于革兰氏阳性菌,而革兰氏阳性菌在分解土壤有机质方面能力更强[45],可能加快SOC的矿化速率。某些广谱性线虫(如食细菌线虫)则以非选择性方式摄食多类细菌,其对微生物群落的调节效应更依赖于种群密度与摄食强度。因此,红壤系统中捕食者的营养级结构、功能特性及其交互作用模式,构成了调控微生物代谢动态与残体形成的重要生态网络。该网络通过驱动碳氮磷协同转化,在提升红壤固碳能力的同时,也对改善土壤肥力和维持农业可持续生产具有关键作用。这为深入解析红壤SOC转化与稳定机制,并为构建“固碳培肥”协同调控的理论框架奠定了重要基础。
3 生物网络调控路径与管理策略 3.1 优化碳源输入结构,激活生物网络碳源质量是激发红壤生物网络活性与调控SOC归趋的关键,同时直接影响土壤养分循环和肥力培育进程。研究表明,单独提高碳输入量难以有效提升旱地红壤碳汇和养分供应能力,需注重碳源质量的精准调控,以激活多营养级生物网络的功能协同[46]。
多样性碳输入可增强生物网络的多样性与结构稳定性。多样性碳输入不仅体现为有机物质类型的多元搭配,还可通过作物管理措施(如轮作、间作及混播等)间接实现,通过调节根系分泌物组成与根际碳释放动态,从源头上优化土壤碳输入结构。这种多样性输入有助于激发包括细菌、真菌、原生动物及线虫在内的多营养级生物群落,形成更为复杂且稳定的生态网络[14]。研究表明,结构简单、C/N比低的易分解碳源更易被微生物直接利用,具有较高的CUE,这有利于微生物生物量的积累及其残体转化为稳定SOC。相比之下,C/N比较高、结构复杂的碳源需经历更多的酶促分解反应过程,这增加了微生物呼吸代谢,降低了微生物CUE[47]。虽然复杂有机质可促进真菌及腐食性动物等功能类群参与分解过程,但总体CUE较低,更容易导致碳以CO2形式损失,不利于稳定碳库的形成。因此,通过搭配高、低质量碳源输入,不仅能满足不同功能类群微生物与土壤动物的代谢需求,还能诱导多样化的营养级互作,如细菌–真菌互补、捕食者调控微生物周转等关键网络过程,从而增强生物网络的稳定性与抵抗力。此外,多样性碳源输入有利于激发功能多样的微生物代谢潜力,促进关键土壤酶活性提升,进而改善有机质矿化、氮磷释放等过程,对增强红壤肥力、促进养分供给具有积极意义。在旱地红壤系统中,由于其本底碳源贫乏,采用轮作、混播等作物管理措施不仅能增加根际碳输入的组分复杂度[48],还能强化植物–微生物–土壤动物之间的互作关系。这些管理措施有助于构建稳定的多营养级互作生物网络,进而增强BCP转化效率,促进土壤稳定碳库的形成。同时,它们还能提高作物可利用养分水平,实现培肥与增产的协同目标。此外,时间异质性亦是调控生物网络功能的重要参数[49]。多样性碳输入可打破微生物生长与捕食之间的动态平衡,促使微生物产生更多胞外聚合物及防御性结构,进一步增强生物网络的稳定性和碳累积潜力。在季节尺度上,结合作物生育周期与土壤温湿变化调整碳源施用时机,有助于增强植物–微生物–动物的协同作用,提高微生物CUE与残体生成能力,进而提高旱地红壤生态系统整体固碳效率和培肥能力。
尽管多样性碳源输入已被证实在激活土壤生物网络、促进稳定SOC形成中发挥重要作用,但目前关于碳源质量调控的实践路径和机制认知仍存在诸多不确定性。在未来研究中,应进一步探索不同类型有机碳源对微生物CUE与残体形成路径的影响机制,以明确“高质量碳源”的具体内涵。同时,应加强对高、低质量碳源配比策略的系统评估,如不同比例、添加频次及施用时序如何影响多营养级生物网络结构、BCP过程效率及SOC归趋。此外,考虑到土壤碳转化过程的强时空变异性,未来应注重将碳源添加与作物生育周期、根系活动动态及气候条件耦合起来进行动态管理。例如,在植物生长初期施入速效型易降解碳源以快速激活生物网络活性,在作物生长中后期施用结构复杂的稳定碳源,以促进真菌–土壤动物互作及残体稳定化。同时,也需关注碳源调控对红壤养分动态的影响,特别是氮素矿化–固定过程、磷钾活化效率等关键培肥过程,以实现碳氮磷耦合管理。最后,亟需通过田间长期定位试验与多组学联合解析,构建涵盖“碳源输入–生物网络响应–微生物CUE–SOC积累”的系统机制模型,为制定区域化、生态型碳管理策略提供理论基础和技术支撑。这对于提升红壤等典型低碳土壤的碳汇功能、助力土壤健康和气候变化缓解具有重要现实意义。
3.2 定向构建多级生物网络,促进土壤高效固碳红壤生态系统中生物多样性丰富,但由于长期不合理利用等问题,导致部分关键生物类群缺失或功能受限,限制了生物网络稳定性、碳汇潜力及土壤肥力的维持能力。研究表明,土壤食物网中的关键种发挥了远超其丰度的核心生态功能,可通过调节多营养级群落的结构与代谢过程,放大其对SOC累积的影响。同时,这些关键种亦可通过提高微生物养分转化功能、增强有机质转化效率及提升矿质营养可利用性等机制,增强土壤肥力基础,促进固碳与培肥的协同效应。因此,识别并定向调控红壤生物网络中兼具耐酸性和固碳与培肥潜力的关键种,是实现生物网络优化与土壤碳汇功能提升的核心策略。
在植物–微生物互作维度,应重视根系分泌物及其对微生物群落构建的源头调节作用。某些植物品种通过释放特定的有机酸、糖类和氨基酸,能够有选择地招募功能微生物,形成以固碳培肥为导向的“植物–微生物协同核心群”[50]。微生物功能的增强可促进养分的矿化与有效态的释放,提升植物对氮磷钾等养分的吸收效率,从而实现碳汇与作物养分利用的双重增益。因此,植物在生物网络中不仅是碳源输入者,也通过根际信号调控微生物组成与代谢功能,是调节旱地红壤生态系统稳定碳形成路径的基础性力量。基于此,可通过轮作和间作等农艺措施增强根系多样性及其分泌物谱系,从而间接调控关键微生物的富集。
在微生物层面,应重点识别并定向引导在低pH和高铝胁迫环境下仍能维持高效碳转化能力的关键功能种。此类关键种不仅具备耐酸性与抗铝毒特性,还能稳定合成胞外聚合物,在微生物残体生成与有机–矿物结合过程中发挥核心作用。研究表明,曲霉菌属(Aspergillus)中的特定种群在红壤环境中往往处于生态网络的核心位置[51],其胞外酶活性在逆境条件下仍保持活跃,能通过调控多种有机碳底物的代谢路径,显著促进微生物CUE和残体积累,进而提升红壤中速效养分的供应能力,促进土壤肥力的持续提升。这些类群在红壤中展现出良好的环境适应性和碳转化潜力,是构建关键合成菌群的理想标靶。因此,使用微生物接种剂或合成微生物组可有效提升这些关键微生物的竞争优势和网络互作强度,进而增强SOC稳定化过程。
在土壤动物层面,捕食性线虫尤其是原杆属(Protorhabditis),因其在生物网络中占据枢纽地位,且兼具选择性捕食细菌能力强、耐酸性高且生活周期短等特性,在红壤中能快速响应碳输入变化,成为调控微生物群落结构与功能的关键节点[52]。通过定向扩繁原杆属等关键动物种群,不仅可优化微生物群落的多样性及其碳代谢功能,还可促进微生物残体的形成与SOC库的稳定累积。同时,土壤动物的活动可促进团聚体结构发育与孔隙连通性改善,增强通气透水能力,提升土壤理化性状与根系适生性,为土壤养分传输与保持提供物理基础,进而强化土壤培肥作用。
综上,基于关键种识别与网络结构解析,构建以耐酸固碳为导向的多营养级生物网络,是提升红壤碳汇效率与培肥效应的关键路径。但相关研究与应用仍面临诸多挑战。一方面,关键微生物种群的分离、鉴定与功能验证依赖于高分辨率组学技术与可培养技术。而目前大量红壤微生物仍处于“不可培养”状态[53],其生态功能及网络角色尚未被充分揭示。另一方面,接种微生物在复杂土壤系统中实现有效定殖与功能表达,常受限于本地群落的生境过滤与生物拮抗作用。此外,外源微生物及动物类群的引入亦可能带来潜在的生态风险,如群落失衡及生态位替代等现象[54],因此需加强对接种稳定性与环境安全性的系统评估。未来研究应整合多组学技术(如宏基因组、宏转录组、代谢组及稳定同位素示踪)与生态网络建模工具,多尺度解析关键种在碳转化过程中的生态位特征、代谢路径与互作机制,识别其在不同碳源质量、植物组合及管理措施下的响应规律与调控通路。在培肥方面,亦应深入揭示关键种对养分转化、释放及植物可利用性的影响机制,明确其在碳氮磷耦合过程中的功能定位。同时,应研发靶向调控策略,如构建功能互补型合成菌群、开发与植物协同作用的“微生物核心群”、设计模拟根际信号的诱导剂等,以提升关键种的定向富集与网络嵌合能力。此外,建立“识别–接种–建群–维稳–反馈”一体化的关键种干预框架,并与多样性碳源输入、作物轮作及混播制度协同联动,有望实现“固碳培肥”协同增效目标,推动旱地红壤农业系统向高产高效、可持续方向转型。
4 结语本文系统梳理了旱地红壤生态系统中生物网络对SOC形成与稳定的关键驱动机制,重点阐述了植物–微生物共生、微生物种间互作及跨营养级捕食关系在MCP路径中的作用,并揭示了其固碳与培肥协同机制。同时,提出以“碳源优化输入–关键种群识别–多营养级网络构建”为核心的生物调控路径,强调构建关键功能群体是提升红壤固碳与培肥效应的核心策略。最后,强调通过轮作/混播等措施提升碳源输入多样性,调控生物网络结构与功能,进而增强SOC与养分耦合转化效率。尽管目前在碳源施用策略、关键种筛选及其生态安全性评估等方面仍面临诸多挑战,但结合多组学与生态网络分析技术,有望实现旱地红壤系统中多营养级生物网络的定向构建与长期维持,推动土壤固碳培肥从“功能提升”向“机制调控”与“系统优化”转变,最终服务于国家“双碳”战略与区域土壤健康管理目标的协同推进。
| [1] |
Button E S, Pett-Ridge J, Murphy D V, et al. Deep-C storage: Biological, chemical and physical strategies to enhance carbon stocks in agricultural subsoils[J]. Soil Biology and Biochemistry, 2022, 170: 108697 DOI:10.1016/j.soilbio.2022.108697 (  0) 0) |
| [2] |
熊鹏, 陈旭, 罗泽军, 等. 不同类型覆盖作物与玉米套作对紧实红壤的响应[J]. 土壤, 2025, 57(4): 885-891 (  0) 0) |
| [3] |
Lin Y X, Ye G P, Liu D Y, et al. Long-term application of lime or pig manure rather than plant residues suppressed diazotroph abundance and diversity and altered community structure in an acidic Ultisol[J]. Soil Biology and Biochemistry, 2018, 123: 218-228 DOI:10.1016/j.soilbio.2018.05.018 (  0) 0) |
| [4] |
杜晓芳, 李英滨, 刘芳, 等. 土壤微食物网结构与生态功能[J]. 应用生态学报, 2018, 29(2): 403-411 (  0) 0) |
| [5] |
Wang X Y, Liang C, Dini-Andreote F, et al. Impacts of trophic interactions on carbon accrual in soils[J]. Trends in Microbiology, 2025, 33(3): 277-284 DOI:10.1016/j.tim.2024.10.009 (  0) 0) |
| [6] |
Kou X C, Morriën E, Tian Y J, et al. Exogenous carbon turnover within the soil food web strengthens soil carbon sequestration through microbial necromass accumulation[J]. Global Change Biology, 2023, 29(14): 4069-4080 DOI:10.1111/gcb.16749 (  0) 0) |
| [7] |
肖可青, 李心男, 邢稳, 等. 土壤"矿物碳泵(MnCP)"介导有机碳的固存与稳定机制[J]. 土壤学报, 2025, 62(3): 595-609 (  0) 0) |
| [8] |
闫文德. 土壤微食物网与森林土壤固碳的进展与思考[J]. 中南林业科技大学学报, 2023, 43(11): 1-12 (  0) 0) |
| [9] |
Cotrufo M F, Wallenstein M D, Boot C M, et al. The Microbial Efficiency-Matrix Stabilization (MEMS) framework integrates plant litter decomposition with soil organic matter stabilization: Do labile plant inputs form stable soil organic matter[J]. Global Change Biology, 2013, 19(4): 988-995 DOI:10.1111/gcb.12113 (  0) 0) |
| [10] |
Liang C, Schimel J P, Jastrow J D. The importance of anabolism in microbial control over soil carbon storage[J]. Nature Microbiology, 2017, 2: 17105 DOI:10.1038/nmicrobiol.2017.105 (  0) 0) |
| [11] |
Liao H, Hao X L, Li Y T, et al. Protists regulate microbially mediated organic carbon turnover in soil aggregates[J]. Global Change Biology, 2024, 30(1): e17102 DOI:10.1111/gcb.17102 (  0) 0) |
| [12] |
Zhang S X, Kuzyakov Y, Jia Z J, et al. Cascading effects within soil food web amplify fungal biomass and necromass production[J]. Global Change Biology, 2025, 31(5): e70235 DOI:10.1111/gcb.70235 (  0) 0) |
| [13] |
赵学强, 潘贤章, 马海艺, 等. 中国酸性土壤利用的科学问题与策略[J]. 土壤学报, 2023, 60(5): 1248-1263 (  0) 0) |
| [14] |
Long X W, Li J N, Liao X H, et al. Stable soil biota network enhances soil multifunctionality in agroecosystems[J]. Global Change Biology, 2025, 31(1): e70041 DOI:10.1111/gcb.70041 (  0) 0) |
| [15] |
Vicca S, Luyssaert S, Peñuelas J, et al. Fertile forests produce biomass more efficiently[J]. Ecology Letters, 2012, 15(6): 520-526 DOI:10.1111/j.1461-0248.2012.01775.x (  0) 0) |
| [16] |
Gill A L, Finzi A C. Belowground carbon flux links biogeochemical cycles and resource-use efficiency at the global scale[J]. Ecology Letters, 2016, 19(12): 1419-1428 DOI:10.1111/ele.12690 (  0) 0) |
| [17] |
秦泽峰, 谢沐希, 张运龙, 等. 丛枝菌根真菌介导的土壤有机碳稳定机制研究进展[J]. 植物营养与肥料学报, 2023, 29(4): 756-766 (  0) 0) |
| [18] |
何俊良, 和展梅, 何辰辰, 等. 土壤丛枝菌根真菌准离体培养体系的建立[J]. 微生物学报, 2025, 65(4): 1587-1600 (  0) 0) |
| [19] |
Cairney J W G. Extramatrical mycelia of ectomycorrhizal fungi as moderators of carbon dynamics in forest soil[J]. Soil Biology and Biochemistry, 2012, 47: 198-208 DOI:10.1016/j.soilbio.2011.12.029 (  0) 0) |
| [20] |
Frey S D. Mycorrhizal fungi as mediators of soil organic matter dynamics[J]. Annual Review of Ecology, Evolution, and Systematics, 2019, 50(2019): 237-259 (  0) 0) |
| [21] |
Högberg M N, Högberg P. Extramatrical ectomycorrhizal Mycelium contributes one-third of microbial biomass and produces, together with associated roots, half the dissolved organic carbon in a forest soil[J]. New Phytologist, 2002, 154(3): 791-795 DOI:10.1046/j.1469-8137.2002.00417.x (  0) 0) |
| [22] |
Dakora F D, Phillips D A. Root exudates as mediators of mineral acquisition in low-nutrient environments[J]. Plant and Soil, 2002, 245(1): 35-47 DOI:10.1023/A:1020809400075 (  0) 0) |
| [23] |
Pausch J, Kuzyakov Y. Carbon input by roots into the soil: Quantification of rhizodeposition from root to ecosystem scale[J]. Global Change Biology, 2018, 24(1): 1-12 DOI:10.1111/gcb.13850 (  0) 0) |
| [24] |
Keiluweit M, Bougoure J J, Nico P S, et al. Mineral protection of soil carbon counteracted by root exudates[J]. Nature Climate Change, 2015, 5(6): 588-595 DOI:10.1038/nclimate2580 (  0) 0) |
| [25] |
Jia N, Li L, Guo H, et al. Important role of Fe oxides in global soil carbon stabilization and stocks[J]. Nature Communications, 2024, 15: 10318 DOI:10.1038/s41467-024-54832-8 (  0) 0) |
| [26] |
Kögel-Knabner I. The macromolecular organic composition of plant and microbial residues as inputs to soil organic matter[J]. Soil Biology and Biochemistry, 2002, 34(2): 139-162 DOI:10.1016/S0038-0717(01)00158-4 (  0) 0) |
| [27] |
张阿磊, 魏国光, 张弛, 等. 几丁质资源生物降解和高值转化的研究进展[J]. 合成生物学, 2024, 5(6): 1279-1299 (  0) 0) |
| [28] |
文帅龙, 刘静静, 戴家如, 等. 铁(氢)氧化物介导的溶解性有机质、无机磷的固定及相互作用研究进展[J]. 湖泊科学, 2022, 34(5): 1428-1440 (  0) 0) |
| [29] |
Fomina M, Gadd G M. Metal sorption by biomass of melanin-producing fungi grown in clay-containing medium[J]. Journal of Chemical Technology & Biotechnology, 2003, 78(1): 23-34 (  0) 0) |
| [30] |
Wang C Q, Kuzyakov Y. Mechanisms and implications of bacterial-fungal competition for soil resources[J]. The ISME Journal, 2024, 18(1): wrae073 DOI:10.1093/ismejo/wrae073 (  0) 0) |
| [31] |
Fernandez C W, Kennedy P G. Revisiting the 'Gadgil effect': Do interguild fungal interactions control carbon cycling in forest soils[J]. New Phytologist, 2016, 209(4): 1382-1394 DOI:10.1111/nph.13648 (  0) 0) |
| [32] |
Chen X L, Mou Z J, Zhang J, et al. Roots dominate over extraradical hyphae in driving soil organic carbon accumulation during tropical forest succession[J]. Global Change Biology, 2025, 31(9): e70499 DOI:10.1111/gcb.70499 (  0) 0) |
| [33] |
Bertolet B L, Rodriguez L C, Murúa J M, et al. The impact of microbial interactions on ecosystem function intensifies under stress[J]. Ecology Letters, 2024, 27(10): e14528 DOI:10.1111/ele.14528 (  0) 0) |
| [34] |
梁超, 朱雪峰. 土壤微生物碳泵储碳机制概论[J]. 中国科学(地球科学), 2021, 51(5): 680-695 (  0) 0) |
| [35] |
Velez P, Espinosa-Asuar L, Figueroa M, et al. Nutrient dependent cross-Kingdom interactions: Fungi and bacteria from an oligotrophic desert oasis[J]. Frontiers in Microbiology, 2018, 9: 1755 DOI:10.3389/fmicb.2018.01755 (  0) 0) |
| [36] |
Wolters V. Invertebrate control of soil organic matter stability[J]. Biology and Fertility of Soils, 2000, 31(1): 1-19 DOI:10.1007/s003740050618 (  0) 0) |
| [37] |
董炜华, 李晓强, 宋扬. 土壤动物在土壤有机质形成中的作用[J]. 土壤, 2016, 48(2): 211-218 DOI:10.13758/j.cnki.tr.2016.02.001 (  0) 0) |
| [38] |
Smith W P J, Wucher B R, Nadell C D, et al. Bacterial defences: Mechanisms, evolution and antimicrobial resistance[J]. Nature Reviews Microbiology, 2023, 21(8): 519-534 DOI:10.1038/s41579-023-00877-3 (  0) 0) |
| [39] |
Schimel J P. Life in dry soils: Effects of drought on soil microbial communities and processes[J]. Annual Review of Ecology Evolution and Systematics, 2018, 49(1): 409-432 DOI:10.1146/annurev-ecolsys-110617-062614 (  0) 0) |
| [40] |
Crowther T W, Boddy L, Hefin Jones T. Functional and ecological consequences of saprotrophic fungus–grazer interactions[J]. The ISME Journal, 2012, 6(11): 1992-2001 DOI:10.1038/ismej.2012.53 (  0) 0) |
| [41] |
Ripple W J, Estes J A, Schmitz O J, et al. What is a trophic cascade[J]. Trends in Ecology & Evolution, 2016, 31(11): 842-849 (  0) 0) |
| [42] |
Potapov A M. Multifunctionality of belowground food webs: Resource, size and spatial energy channels[J]. Biological Reviews, 2022, 97(4): 1691-1711 DOI:10.1111/brv.12857 (  0) 0) |
| [43] |
Erktan A, Or D, Scheu S. The physical structure of soil: Determinant and consequence of trophic interactions[J]. Soil Biology and Biochemistry, 2020, 148: 107876 DOI:10.1016/j.soilbio.2020.107876 (  0) 0) |
| [44] |
Thakur M P, Geisen S. Trophic regulations of the soil microbiome[J]. Trends in Microbiology, 2019, 27(9): 771-780 DOI:10.1016/j.tim.2019.04.008 (  0) 0) |
| [45] |
Angst G, Potapov A, Joly F X, et al. Conceptualizing soil fauna effects on labile and stabilized soil organic matter[J]. Nature Communications, 2024, 15: 5005 DOI:10.1038/s41467-024-49240-x (  0) 0) |
| [46] |
Chen Y L, Du Z L, Weng Z, et al. Formation of soil organic carbon pool is regulated by the structure of dissolved organic matter and microbial carbon pump efficacy: A decadal study comparing different carbon management strategies[J]. Global Change Biology, 2023, 29(18): 5445-5459 DOI:10.1111/gcb.16865 (  0) 0) |
| [47] |
陈智, 于贵瑞. 土壤微生物碳素利用效率研究进展[J]. 生态学报, 2020, 40(3): 756-767 (  0) 0) |
| [48] |
殷志遥, 黄丽, 薛斌, 等. 稻-油轮作下保护性耕作对土壤肥力的影响及评价[J]. 中国生态农业学报, 2017, 25(11): 1604-1614 (  0) 0) |
| [49] |
Chang Y M, Lin H H, Liu W Y, et al. Comparative transcriptomics method to infer gene coexpression networks and its applications to maize and rice leaf transcriptomes[J]. PNAS, 2019, 116(8): 3091-3099 DOI:10.1073/pnas.1817621116 (  0) 0) |
| [50] |
Yang C X, Chen S J, Hong X Y, et al. Plant exudates-driven microbiome recruitment and assembly facilitates plant health management[J]. FEMS Microbiology Reviews, 2025, 49: fuaf008 DOI:10.1093/femsre/fuaf008 (  0) 0) |
| [51] |
邱丽丽, 李丹丹, 张佳宝, 等. 基于共现网络的关键微生物对秸秆还田土壤小麦产量的影响[J]. 土壤学报, 2023, 60(2): 491-502 (  0) 0) |
| [52] |
Zheng J, Dini-Andreote F, Luan L, et al. Nematode predation and competitive interactions affect microbe-mediated phosphorus dynamics[J]. mBio, 2022, 13(3) (  0) 0) |
| [53] |
Zheng M J, Wen L R, He C L, et al. Sequencing-guided re-estimation and promotion of cultivability for environmental bacteria[J]. Nature Communications, 2024, 15: 9051 DOI:10.1038/s41467-024-53446-4 (  0) 0) |
| [54] |
Liu Y R, Wen S H, Singh B K, et al. Vulnerability of soil food webs to chemical pollution and climate change[J]. Nature Ecology & Evolution, 2025, 9(7): 1112-1119 (  0) 0) |
2. College of Resources and Environment, Fujian Agriculture and Forestry University, Fuzhou 350002, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
 2025, Vol. 57
2025, Vol. 57


