2. 中国科学院大学,北京 100049;
3. 江西农业大学国土资源与环境学院,南昌 330045;
4. 江西省红壤及种质资源研究所,南昌 331717;
5. 镇江市高等专科学校,江苏镇江 212028;
6. 中国科学院红壤生态实验站,江西鹰潭 335211
稻田是我国重要的农田生态系统。当前我国水稻播种面积约占粮食作物总播种面积的24.3%,水稻产量约占全国粮食总产量的29.7%[1]。我国亚热带红壤地区水热资源丰富,生产潜力巨大,大约分布着全国60% 的水稻土[2]。但是红壤酸化、黏板、贫瘠、侵蚀、季节性干旱、微生物功能弱等障碍因子严重,加之长期的高度集约化利用造成水稻土肥力退化等问题突出。因此,提升和保持红壤性水稻土肥力,对保障区域乃至国家粮食安全有着举足轻重的作用。
土壤肥力是土壤物理、生物和化学特性的综合反映,是土壤能够提供作物生长所需的各种养分的能力,可为植物生长提供必需的养分元素[3]。土壤肥力是农业生产的基础,其水平高低对作物生长和农业生产起着直接的作用,受自然条件和人为因素的共同影响,处于不断的变化之中[4]。充分了解土壤肥力的演变规律是科学施肥的基础[5]。土壤有机质、氮、磷、钾等化学肥力指标相对稳定、测定简单,可以较好地表征土壤质量,一直受到广泛关注。微生物的数量、活性和多样性在土壤有机质和养分循环过程中发挥着重要作用,是土壤肥力演变研究的前沿热点。研究红壤性水稻土肥力和微生物变化及其相互关系,有助于揭示红壤肥力演变的微生物过程及其机制,并为稻田合理施肥和养分转化调控提供基础理论支撑。
土壤肥力演变是一个相对缓慢的过程,而长期定位试验是揭示土壤肥力演变的重要手段[6-7]。从20世纪80年代起,中国科学院、中国农业科学院以及部分省市科研院所在红壤区相继建立了多个稻田长期定位试验。这些定位试验大部分均是基于已有稻田建立的,而从红壤荒地开垦开始的贫瘠红壤稻田,其肥力变化规律可能与上述这些稻田长期定位试验的结果有很大差异。中国科学院红壤生态实验站于1989年开始以红壤荒地土壤为基础,建立了不同施肥处理红壤稻田长期定位试验,开展了土壤有机质、养分和微生物量等变化研究。而随着有机质高分辨质谱分析、微生物高通量测序技术以及生物信息学的快速发展和应用,实验站在原有定位试验的基础上,又针对有机质化学组成、微生物多样性变化等进行了相关研究,以期通过长期连续的研究阐明瘠薄红壤性水稻土肥力演变及其微生物过程与机制。本文概述了该瘠薄红壤稻田长期定位试验的基本情况,梳理和总结了试验的主要研究进展,并对今后的工作进行了展望。
1 红壤稻田长期定位试验简介 1.1 国内外长期定位试验长期定位试验(Long-term field experiment,LTFE)是指在固定的田块上按照特定目的、长期实施同一处理的试验,并且须进行连续多年的观测,试验时间至少持续10年以上[7-8]。长期定位试验最早可追溯至19世纪中叶的英国。英国洛桑实验站(Rothamsted research station)是世界上公认最早、最著名的长期定位试验基地。此后,各类农业实验站、田间肥料实验站相继成立并开展试验,且从欧洲各国漫延至其他国家。超过百年以上的长期定位试验包括英国洛桑实验站的Broadbalk Experiment、美国伊利诺伊州立大学的Morrow Plots、美国密苏里大学哥伦比亚分校的Sanborn Field、美国俄克拉何马州斯蒂尔沃特市的Magruder Plots、美国阿拉巴马州奥本大学的Cullars Rotation、澳大利亚维多利亚州路斯格兰市第一产业部路斯格兰中心的Permanent Topdressing Experiment[9]。全世界范围内持续20 ~ 50年的长期试验更是难以计数,主要分布在欧美、日本、印度等国家或地区。这些经典的长期定位试验促进了世界农业的发展,为土壤、作物和肥料研究打下了坚实的基础[10]。
中国农田长期定位试验发展起步较晚且历经波折。20世纪五六十年代,国内零星设立了一些农田试验,但是由于技术条件落后、社会因素限制等时断时续[10]。1978年,原中国科学院黑龙江农业现代化研究所在黑龙江省海伦市建立了海伦农业生态实验站,通过长期监测,首次划分了黑土肥力演变时期及土壤有机质阈值[11]。20世纪80年代,我国开始了全国性农田长期定位试验网络建设。中国科学院于1988年开始筹建中国生态系统研究网络(CERN),其中包含15个农田生态系统监测站,建立了系列农田长期定位试验,这是目前国际上具有重要影响的国家级生态系统研究网络,与美国长期生态研究网络(LTER Network)和英国环境变化网络(ECN)并称为世界三大国家级生态网络。1987年由中国农业科学院牵头组建了“国家土壤肥力与肥料效益长期监测基地网”[7]。进入21世纪后,长期试验向多元化、精细化方向拓展,通过系统性布局与持续优化,形成了覆盖主要土壤类型和耕作模式的科学观测网络[7]。
1.2 红壤稻田长期定位试验在红壤地区长期种植水稻发育而成的水稻土,构成了我国南方水稻主产区的重要耕地类型。1981年,原江西省红壤研究所在进贤县建立了无机有机肥施用红壤稻田长期定位试验,研究化肥及有机肥施用对红壤性水稻土有机碳、磷组分及其转化的影响[12-14]。同年,湖南省农业科学院在长沙市望城区进行了不同施肥处理长期定位试验,监测化肥、猪粪、稻草等不同措施下红壤性水稻土的肥力演变规律[15]。1982年,中国农业科学院在湖南祁阳官山坪布置了长期定位试验,探讨稻–稻–紫云英轮作模式对土壤肥力和作物生产力的影响[16]。随着土壤生物日益成为研究前沿,中国科学院桃源农业生态试验站在湖南桃源县漳江镇通过长期试验(2012年开始)研究稻田复种方式对土壤微生物生物量碳、氮的动态影响[17]。中国科学院红壤生态实验站(1990年开始)通过长期定位试验,探索施肥对红壤性水稻土微生物群落多样性的影响。此外,围绕施肥效应、轮作制度、土壤重金属累积与风险评估、耕作方式与秸秆还田效应等,红壤区也陆续建立了系列红壤稻田长期定位试验,通过持续监测土壤、作物、环境系统的长期动态变化,为揭示红壤性水稻土肥力演变规律、保障区域粮食安全与生态安全提供了充分的科学依据。
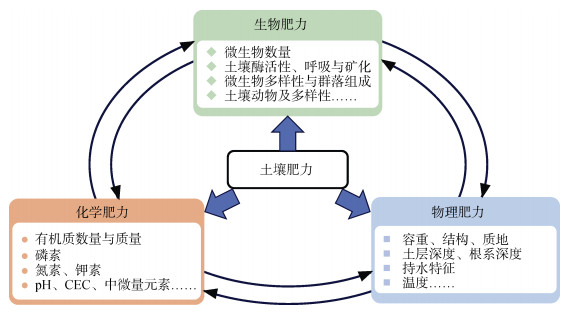
1.3 瘠薄红壤稻田肥力演变长期定位试验中国科学院红壤生态实验站1989年开始建设瘠薄红壤稻田肥力演变长期定位试验,1990年起持续观测至今(图 1)。种植制度为早稻–晚稻。早稻每年4月底5月初移栽,7月底收获;晚稻7月底8月初移栽,11月初收获。该试验位于亚热带红壤低丘区(28°15′30″ N,116°20′24″ E),该区属典型季风气候,海拔25 ~ 30 m,年平均气温17.8 ℃,≥10 ℃年积温5 528 ℃,年均降水量1 785 mm(其中3—6月降水量占全年60% 以上),年蒸发量1 800 mm,无霜期262 d,日照时数1 950 h。试验田初始为第四纪红黏土母质发育的红壤荒地。试验采用永久性红砖田埂与灌排渠系统,保障水文边界稳定。试验小区面积30 m2,随机区组排列,每个处理3次重复。试验分为两组核心设计:①施肥制度与养分循环试验,包括无肥对照(移耕农业,全养分移除)、有机循环(秸秆全还田+猪粪补充作物吸收带走的养分)、施氮肥、施氮肥+有机循环(20世纪50—60年代过渡模式)、施氮磷肥、施氮磷钾肥(石油农业)、施氮磷钾肥+有机循环(有机无机结合)、施氮钾肥、施氮磷钾肥+1/2秸秆还田处理,研究农业发展不同阶段施肥模式下土壤肥力响应;②有机质积累与平衡试验,包括施氮磷钾化肥、施氮磷钾化肥+秸秆还田、施氮磷钾化肥+2倍秸秆还田、施氮磷钾化肥+猪粪、施氮磷钾化肥+紫云英绿肥处理,研究长期水耕条件下有机碳积累与平衡(图 1)。基于这两个长期试验平台不同时间段的采样分析,以期明确瘠薄红壤性水稻土有机质含量和组成、氮磷钾养分、微生物性质变化规律及其相互关系(图 2)。

|
(A:建设场景;B:20世纪90年代采样场景;C:2023年施肥制度与养分循环试验航拍;D:2023年有机质积累与平衡试验航拍) 图 1 瘠薄红壤稻田肥力演变长期定位试验部分场景 Fig. 1 Some scenarios of the long-term field experiment on fertility evolution of infertile red paddy fields |
|
图 2 瘠薄红壤性水稻土肥力指标 Fig. 2 Fertility indexes of infertile red paddy soil |
有机质是土壤肥力的核心指标,而土壤有机碳(soil organic carbon,SOC)作为其主要组成部分(约占58%),不仅是土壤碳库的关键构成,也是土壤微生物代谢活动的能量来源和维系土壤团聚体稳定性的重要物质。受限于母质养分贫瘠,瘠薄红壤性水稻土长期定位试验土壤初始SOC含量较低,仅为5.7 g/kg[18],使其有机质积累过程相较于其他水稻土表现出敏感性与独特性。研究表明,荒地开垦为水田后,能有效改善因红壤严重风化和养分淋溶导致的肥力贫瘠现象[19]。在种植水稻后前5年,SOC含量显著提升,达到初始值的98.1%[20]。这主要归因于无机与有机肥料的施用、两熟制下大量作物残体还田以及高黏粒含量抑制了土壤有机质的分解[21]。种植水稻18年并配合施肥,SOC变化范围为9.56 ~ 12.17 g/kg,比初始值增加了67.7% ~ 113.5%,其中,施用有机肥处理的SOC含量比未施用有机肥的土壤增加了15.5% ~ 24.7%[22]。经过30年,SOC为17.35 g/kg[20]。此外,陈晓芬等[23]研究表明,不同施肥处理下红壤性水稻土各形态有机碳含量也显著提升,且不同施肥处理差异显著。相对于无肥处理,化肥+秸秆还田下各形态有机碳含量分别提高35.0% ~ 103.5%;与缺磷处理相比,长期施磷肥后红壤性水稻土微生物生物量碳(microbial biomass carbon,MBC)、易氧化有机碳、胡敏酸碳和富里酸碳含量分别提高45.3%、15.7%、125.0% 和8.1%;施有机肥处理较未施有机肥处理各形态有机碳含量分别提高56.6%、22.5%、60.7% 和26.0%[23]。另外,有研究表明,红壤性水稻土SOC在种植水稻后前30年快速积累,之后(30 ~ 80年)趋于稳定[21]。而瘠薄红壤性水稻土长期定位试验发现,由于瘠薄红壤稻田初始SOC含量较低,种植水稻30年后仍未达到有机质积累平衡。
2.2 土壤有机质化学特性变化近年来,SOC的质量,即不同组分及其化学性质的变化日益受到关注[24]。通过瘠薄红壤性水稻土长期定位试验发现,与无肥对照相比,长期施用化肥和化肥配合秸秆还田显著改变了红壤性水稻土腐殖酸的化学结构,其中脂肪族碳含量降低,芳香族碳含量增加[25]。溶解性有机质(dissolved organic matter,DOM)具有周转快速的特点,是土壤微生物的关键能量来源。DOM的化学组成是其质量的重要反映[26-27]。当前,三维荧光光谱被广泛用于研究农田土壤DOM的化学组成[28-30]。有研究通过三维荧光光谱分析发现,长期外源有机质输入改变了土壤DOM的化学组成,显著提高了DOM中色氨酸类组分的比例,降低了酪氨酸类组分的比例;同时,有机肥处理的DOM生物指数(biological index,BIX)和McKnight指数显著低于无机处理,表明长期有机肥处理的土壤DOM更偏向外源输入,而非微生物代谢新产生的活性有机质[31]。瘠薄红壤性水稻土长期定位试验发现,施肥处理显著增加了红壤性水稻土中类腐殖酸与类富里酸荧光组分,BIX和McKnight指数则显示红壤性水稻土DOM主要由内源生物降解和外源输入共同作用产生。此外,随着傅里叶变换离子回旋共振质谱等高分辨质谱的应用,有学者利用该技术研究了长期不同施肥对DOM化学多样性的影响,结果表明,红壤性水稻土DOM通常由木质素单体、碳水化合物、含氮化合物及烷基芳烃等组分构成[32]。长期施肥显著提升了DOM的转化潜力,有机肥处理使DOM分子的平均转化数较无肥对照提高260%,化肥处理较无肥对照则提高193%。长期施肥通过提升土壤总有机质、全氮、全磷含量和微生物群组成,促进了DOM分子中碳水化合物、单宁类物质的转化,同时降低了木质素的比例[33]。上述结果表明,瘠薄红壤性水稻土有机质化学性质受外源有机物输入的显著影响,且在肥力提升过程中微生物的转化也起着非常重要的作用。
2.3 土壤氮磷钾等养分变化瘠薄红壤性水稻土开垦前,荒地红壤酸性强(pH 4.5),黏粒含量高(38%),且养分贫瘠,土壤全氮和速效氮含量分别为0.43 g/kg和90.2 mg/kg。将荒地开垦为水田并连续种植水稻20年后,不同施肥处理下的土壤养分呈现显著分异,全氮和速效氮含量分别为0.85 ~ 1.21 g/kg和85.75 ~ 111.48 mg/kg[18]。有研究表明,亚热带稻田土壤全氮在水稻种植的30年内呈快速线性增长,之后趋于稳定[19]。水稻种植80年与种植30年相比,0 ~ 10、10 ~ 20和20 ~ 40 cm土层全氮分别增加0.19、0.11和0.07 g/kg;前30年土壤全氮的年增长率是种植30 ~ 80年的25倍[19]。在瘠薄红壤性水稻土长期定位试验中,土壤氮素水平仍未达到稳定与平衡状态,可能受有机质输入和土壤性质(如黏粒含量)的影响[34]。低黏粒含量土壤的养分库可在20年内达到稳态,而高黏粒含量土壤(如荒地红壤)则可能需要50 ~ 100年[35]。而在氮素利用方面,瘠薄红壤性水稻土长期施肥(27年)后,施用有机肥处理,包括有机循环、化肥+有机循环、化肥+秸秆还田等处理氮肥利用率达59% ~ 66%,显著高于单施化肥处理(46%)和不施肥对照(37%)[36]。
红壤性水稻土常受磷素限制,施用磷肥是提高土壤肥力和作物产量的关键措施[37-38]。开垦前,荒地红壤全磷和有效磷含量分别为0.65 g/kg和5.6 mg/kg。将荒地红壤开垦为水田并连续种植水稻20年后,不同施肥处理下的土壤全磷和有效磷含量分别为0.27 ~ 0.69 g/kg和2.99 ~ 22.63 mg/kg,有机肥处理较化肥处理显著提升了全磷(38.6%)及有效磷(86.8%)含量,且由于作物吸收移出,无肥对照出现了磷的耗竭[39]。长期施肥25年后,施磷处理较不施磷处理进一步使红壤性水稻土全磷和有效磷分别提升了88% ~ 118% 和337% ~ 903%,此外,施磷处理还显著提升了土壤团聚体稳定性,其平均重量直径较无肥处理增加32% ~ 45%,大团聚体(> 0.25 mm)比例增加25% ~ 26%[40],表明磷库扩容是瘠薄红壤性水稻土肥力演变的关键[41]。
开垦前,荒地红壤全钾和速效钾含量分别为13.4 g/kg和105.9 mg/kg。与土壤碳、氮、磷含量变化不同,长期施肥下各处理间土壤全钾含量(12.17 ~ 13.31 g/kg)无显著差异[39],表明施肥并未显著改变土壤钾库。然而,土壤速效钾含量存在明显差异,以施氮钾肥处理最高(175.83 mg/kg),这表明长期施肥主要通过调控钾素在土壤中的形态,而非改变其总量来影响钾素的生物有效性[39]。
3 瘠薄红壤性水稻土微生物演替过程 3.1 土壤微生物数量变化土壤微生物生物量常用来表征土壤微生物总体数量。研究表明,土壤MBC随耕作年限增加呈线性增长趋势,但其增长速率因不同耕作阶段而异[19]。水稻种植15年,0 ~ 10 cm和10 ~ 20 cm土层MBC较初始状态分别增加17.6% 和36.2%,年增长率分别为1.17% 和2.41%;水稻种植15 ~ 80年,0 ~ 10 cm和10 ~ 20 cm土层MBC累积增幅达438.2% 和294.1%,年均增长率分别为6.74% 和4.53%;相比之下,土壤微生物生物量氮(MBN)的变化趋势不同,在水稻种植后的前30年迅速增加,之后趋于稳定;MBC/MBN在耕作15 ~ 20年时降至最低值,此后随年限增加有所回升[19]。磷脂脂肪酸指纹图谱分析也可以用于表征土壤微生物,特别是不同微生物类群的数量变化[42]。经过20年连续耕作和施肥,瘠薄红壤性水稻土总磷脂脂肪酸甲酯(fatty acid methyl ester,FAME)含量显著提升,除缺磷处理外,各施肥处理土壤总FAME含量(31.63 ~ 56.58 nmol/g)均显著高于不施肥对照,其中施磷处理增幅最为显著,分别较无肥对照提高56.0% ~ 68.9%;细菌、革兰氏阳性菌、革兰氏阴性菌、真菌及放线菌等主要微生物类群的FAME含量变化趋势与总FAME一致,这些结果表明长期施肥,特别是施磷肥对红壤性水稻土总体及各类群微生物的数量均有促进作用[18]。
3.2 土壤微生物活性变化土壤微生物酶活性是反映土壤变化的早期敏感指标[43]。长期施肥能显著影响土壤微生物群落结构,并上调参与关键代谢过程的酶编码基因表达[44]。土壤酶活性通常随肥料投入量的增加而呈现上升趋势[45]。与单施化肥相比,有机无机配施模式能更有效地促进土壤微生物生长并提升多种土壤酶活性[46-48]。土壤养分循环与有机质转化主要由一系列水解酶和氧化酶驱动。有研究表明,土壤酶活性在施肥后的前30年内大幅提升,之后趋于稳定,并可维持至100年;施肥后土壤有机质的持续积累是驱动酶活性提高的关键[20]。积累的有机质提供了更丰富多样的碳和氮底物,从而刺激了依赖这些底物的微生物群落及其酶合成活性[49-50]。微量热也能用于表征土壤微生物的活性,在瘠薄红壤性水稻土中,长期磷肥配施氮肥(尤其与有机肥结合)不仅显著提高了土壤MBC含量,还影响了微生物代谢活性,具体表现为热输出速率(Qr/t)、峰值功率(Pmax)和生长速率常数(k)显著升高,相反,缺磷处理导致代谢热熵(Qr/MBC,即单位生物量的热输出)和峰值时间(tmax)升高,指示微生物整体代谢活性降低[51]。可见,长期施肥下瘠薄红壤性水稻土微生物活性变化凸显了磷素输入在促进土壤养分循环中的潜在重要作用。
3.3 土壤微生物多样性变化长期施肥驱动了土壤微生物群落结构的演替。对瘠薄红壤性水稻土微生物变化的研究表明,试验开始后第9年与第15年的细菌群落聚为一类,但两者均与试验第25年及初始荒地红壤的群落形成显著分异(P < 0.05),而指示微生物类群也由适应贫瘠环境的寡营养型向适应养分丰富环境的富营养型转变[41]。在红壤稻田肥力演变短期内(≤15年)以厚壁菌门(Firmicutes)为优势类群,反映了微生物群落对施肥初期输入的易降解碳源的快速响应;长期(25年)来看,细菌群落演替方向出现分化,具体表现为未施肥处理的绿弯菌门(Chloroflexi,34.1%)和放线菌门(Actinobacteria,3.3%)丰度显著高于前期(P < 0.05),维持了寡营养特征;与试验第9年和第15年相比较,施氮磷钾化肥处理显著富集了变形菌门(Proteobacteria,20.3%)、绿弯菌门(32.4%)、浮霉菌门(Planctomycetes,10.5%)及放线菌门(Actinobacteria,3.3%),同时厚壁菌门丰度显著降至9.7%(P < 0.05),施氮磷钾+有机循环处理呈现与单独施化肥相似的变化趋势[41]。
长期施肥处理也显著提升了瘠薄红壤性水稻土微生物群落的功能多样性,通过BIOLOG分析发现,不同施肥处理下平均颜色变化率(AWCD,0.17 ~ 0.30)、Shannon指数(2.79 ~ 3.03)、Simpson指数(0.93 ~ 0.94)和McIntosh指数(1.46 ~ 2.27)均显著高于不施肥对照;AWCD值与McIntosh指数变化趋势一致,施氮磷钾化肥、氮磷钾化肥+有机循环处理最高,而缺磷处理最低;施氮磷钾化肥、有机循环及二者结合处理的Shannon指数显著高于无肥对照;Simpson指数虽变化范围较小,但缺磷处理仍最低:这些结果表明,在红壤稻田肥力演变过程中,磷肥(有机或者无机形式)施用显著增强了土壤微生物的功能多样性[47]。这与此前的一些研究结果较为一致,即施用磷肥,特别是与有机肥配施,能有效提高土壤肥力[22]、微生物生物量[52]、群落功能多样性[53],最终提高水稻产量。
红壤荒地开垦为水田后,经过长期施肥,尤其是有机无机配施,显著影响微生物互作网络,增强群落生态适应性,其中施氮磷钾化肥+有机循环处理中微生物网络的正相关连接比例高达60.9%,显著高于无肥处理的48.5%,并且土壤关键枢纽物种通过其高连通性协调了微生物间的协作关系,例如,芽孢杆菌与固氮菌形成的共现网络协同提升了系统的氮素利用效率;在土壤肥力演变过程中,SOC和全氮可能是驱动微生物群落结构变异的核心环境因子,同时,施肥(特别是施氮磷钾化肥+有机循环)造成土壤pH升高和阳离子交换量增加,也间接调控了微生物网络、关键酶活性与代谢路径[41]。上述结果表明,长期施肥处理下,瘠薄红壤稻田肥力演变过程初步形成了支撑土壤养分循环和可持续生产的核心微生物网络。
4 瘠薄红壤性水稻土肥力与微生物的相互关系 4.1 土壤有机质与微生物的关系长期定位试验研究发现,有机质是影响瘠薄红壤性水稻土微生物变化的主导因素。经过18年长期不同施肥处理后,SOC含量与MBC含量显著正相关(R2=0.59,P < 0.01)[22]。SOC含量也与土壤微生物活性密切相关,例如,与转化酶(R2=0.63,P < 0.05)和脲酶(R2=0.79,P < 0.01)的活性显著正相关,对转化酶变化的贡献率为39%[40, 54]。SOC也是土壤微生物多样性变化的主导因素,影响微生物群落组成和碳源代谢模式[18, 41, 55-56]。上述结果表明,长期施肥和作物残体归还,提高了瘠薄红壤性水稻土有机质含量,为土壤微生物提供了有机养料,从而影响了微生物的数量和活性[18]。对于微生物多样性而言,SOC含量的提高为富营养型菌群(如β-变形菌门(Beta-Proteobacteria))提供了丰富的底物,与之相比,土壤有机质含量低,只能维持以酸杆菌门(Acidobacteria)与疣微菌门(Verrucomicrobia)为主导的寡营养微生物生长[41],因此长期施肥和作物残体归还改变了微生物的群落组成。此外,与SOC相关的碳、氮、磷化学计量比(C/N、C/P)也是影响微生物群落演替的关键因素[19]。长期施肥(特别是配合秸秆还田)显著改变了土壤元素计量比,C/N从初始荒地红壤的5.0升至10.0左右,C/P从8.0大幅升至37.7,凸显了磷的相对限制作用增强[20]。这些化学计量比的变化也驱动了微生物群落从寡营养型向富营养型的根本性转变。
同时,土壤有机质的循环过程也主要由微生物群落驱动[57]。土壤有机质的相当一部分来源于微生物的代谢产物[58]。长期施肥通过改变微生物群落结构,深刻影响着土壤有机质的含量与化学组成[59]。因此,瘠薄红壤稻田土壤肥力的提升与微生物群落演替形成了相应的正反馈机制。长期施肥增加了SOC、全氮等养分库容,改变了C/N和C/P,这创造了更利于富营养型微生物增殖的环境,显著提高了关键酶活性(如β-葡萄糖苷酶),加速了有机物分解和养分矿化循环。微生物群落演替形成的特定类群(如Ignavibacterium属)通过增强养分的固定、转化和循环效率,又进一步提升了土壤肥力及其可持续性[20]。
4.2 土壤养分与微生物的关系除SOC外,土壤氮磷养分,特别是土壤磷也是影响微生物的关键指标。长期施肥下,土壤MBC含量与全氮、速效氮和有效磷含量显著正相关[22],这表明随着土壤养分的提高,为微生物的生长提供了必要的营养元素,或者通过促进水稻生长,增加了根系分泌物,从而有利于微生物的生长[60]。而磷作为主要的限制因素之一,对瘠薄红壤性水稻土微生物的生长影响更为显著。土壤酶活性等也与土壤速效氮、有效磷等指标密切正相关[54]。长期施肥下有效磷含量对脲酶和酸性磷酸酶活性变化的解释率分别为32% 和35%[40]。一方面,土壤酶主要由微生物分泌产生,均与碳、氮、磷等物质循环转化相关;另一方面,在长期施肥特别是施用磷肥条件下,土壤有效磷增加缓解了磷限制,并促进了微生物的生长,刺激了微生物胞外酶分泌[40]。瘠薄红壤性水稻土全磷、有效磷含量与微生物多样性McIntosh指数、群落组成和功能多样性也密切正相关[18]。不仅如此,磷还与特定微生物类群及其功能基因的动态变化紧密相关[61]。长期施氮磷钾化肥+紫云英绿肥处理显著提高了土壤中磷相关功能基因K01083(bpp)相对丰度,其编码的植酸酶能催化植物源植酸的水解[62],而紫云英绿肥输入的植物凋落物为含该基因的微生物提供了适宜的生存环境[63],进一步促进了有效磷的释放与利用。相关性网络分析则揭示了具体微生物类群在磷循环中的作用:酸杆菌门(Vicinamibacterales目)类群丰度与土壤全磷和有效磷含量均呈正相关[64],是潜在的促进土壤磷有效性的关键类群;而芽单胞菌目(Gemmatales)类群丰度则与有效磷含量呈负相关[65-66],高含量的有效磷环境抑制其丰度;黄单胞菌目(Xanthomonadales)、黄杆菌目(Flavobacterales)等在紫云英轮作下对K01083基因的贡献更突出,进一步说明微生物群落结构的改变会通过功能基因的表达影响土壤磷的转化与有效性,最终作用于作物对磷的吸收和产量形成[62]。
5 总结与展望通过对30余年长期定位试验的总结,初步明确了瘠薄红壤性水稻土在长期不同施肥措施驱动下有机质积累、养分库扩容及微生物的变化,揭示了有机质和磷素与微生物的相互作用关系。但土壤肥力包含化学、物理和生物肥力,未来仍需结合新技术、新方法阐明瘠薄红壤性水稻土理化指标、物理结构与微生物协同演替过程,以为红壤稻田肥力提升和可持续管理提供理论支撑。建议在以下几方面加强研究:
5.1 红壤稻田肥力指标测定新方法土壤肥力指标测定与分析的传统方法是:采集土壤样品,通过土壤理化分析、光谱学分析、高通量测序等,对各肥力指标及其相互关系进行分析。随着科技的发展,新技术、新方法不断涌现,针对“矿物–有机质–微生物”尺度原位观测,可利用微流控芯片技术结合X射线光电子能谱(XPS)模拟微米尺度上土壤淹水环境,观测“矿物–有机质”界面的元素迁移[67-69];可通过13C和15N等稳定性同位素示踪,结合纳米二次离子质谱(NanoSIMS),在亚微米尺度定位同位素热点区域,揭示“微生物–矿物”界面的元素交换[44];傅里叶变换离子回旋共振质谱等方法在土壤有机质化学性质方面的应用也越来越广泛。未来研究需要从土壤有机质数量到组成与动态转化的纵深拓展,利用反应组模型(Reactomics)量化红壤性水稻土肥力演变过程中有机质的分子转化潜力。
5.2 红壤性水稻土肥力演变智慧监测瘠薄红壤稻田存在土壤酸化、有机质含量下降、养分失衡及重金属污染风险等障碍问题[70-72],并且常常以复合障碍因子形式存在。但是,目前仍缺乏精准、快速表征红壤性水稻土肥力的指标或指标体系。随着人工智能迅猛发展,未来需结合长期定位试验和区域监测数据,构建涵盖土壤物理、化学、生物的综合评价指标体系,建立红壤性水稻土质量和健康诊断模型[73]。利用高光谱遥感、无人机影像及地面传感等技术实时监测土壤墒情、养分及作物长势等[74],实现红壤稻田肥力的动态智慧监测与预测。
5.3 瘠薄红壤稻田改良新技术红壤丘陵区秸秆、有机肥、绿肥等有机资源丰富,近年来有机物料优化组合的协同作用逐渐成为研究热点。通过多元有机物料在水稻生长周期内施用的合理时空配置,可促进有机物分解和微生物活性,有效提高红壤性水稻土有机质数量与质量。此外,在瘠薄红壤稻田肥力提升过程中,固碳减排不容忽视。生物质炭还田利用作为碳封存的有效手段,未来应系统评估不同还田量和方式下的稻田生态系统减排效能,构建稻田生态系统生物质炭长效固碳减排技术[75]。近年来,微生物组调控技术逐渐成为土壤改良的热点。未来需要融合多组学原理与技术,并结合宜机化产品生产和智能农机装备开发,形成瘠薄红壤性水稻土改良的低成本、轻简化微生物组调控技术。
| [1] |
国家统计局. 中华人民共和国统计法[M].
中国统计出版社, 北京, 2024
(  0) 0) |
| [2] |
吴金水, 李勇, 童成立, 等. 亚热带水稻土碳循环的生物地球化学特点与长期固碳效应[J]. 农业现代化研究, 2018, 39(6): 895-906 (  0) 0) |
| [3] |
李颖慧. 农用地土壤肥力时空演变特征及影响因素研究——以山东省博兴县为例[D]. 南京: 南京农业大学, 2021.
(  0) 0) |
| [4] |
王乐. 长期施肥下华北土壤化学肥力指标和作物产量演变及影响因素分析[D]. 北京: 中国农业科学院, 2020.
(  0) 0) |
| [5] |
徐明岗, 梁国庆, 张夫道, 等. 中国土壤肥力演变[M].
中国农业科学技术出版社, 北京, 2006: 53-56
(  0) 0) |
| [6] |
张淑香, 张文菊, 沈仁芳, 等. 我国典型农田长期施肥土壤肥力变化与研究展望[J]. 植物营养与肥料学报, 2015, 21(6): 1389-1393 (  0) 0) |
| [7] |
徐明岗, 段英华, 白珊珊, 等. 基于长期定位试验的土壤健康研究与展望[J]. 植物营养与肥料学报, 2024, 30(7): 1253-1261 (  0) 0) |
| [8] |
姚归耕, 金耀青. 略论土壤肥料长期定位田间试验的意义和作用[J]. 土壤通报, 1979, 10(4): 1–3, 10 (  0) 0) |
| [9] |
Debreczeni K, Körschens M. Long-term field experiments of the world[J]. Archives of Agronomy and Soil Science, 2003, 49(5): 465-483 DOI:10.1080/03650340310001594754 (  0) 0) |
| [10] |
田秀英. 国内外的长期肥料试验研究[J]. 渝西学院学报(自然科学版), 2002(1): 14–17, 30 (  0) 0) |
| [11] |
韩晓增, 邹文秀, 严君, 等. 农田生态学和长期试验示范引领黑土地保护和农业可持续发展[J]. 中国科学院院刊, 2019, 34(3): 362-370 (  0) 0) |
| [12] |
黄庆海, 赖涛, 吴强, 等. 长期施肥对红壤性水稻土有机磷组分的影响[J]. 植物营养与肥料学报, 2003, 9(1): 63–66, 97 (  0) 0) |
| [13] |
陈小云, 郭菊花, 刘满强, 等. 施肥对红壤性水稻土有机碳活性和难降解性组分的影响[J]. 土壤学报, 2011, 48(1): 125-131 (  0) 0) |
| [14] |
叶会财, 李大明, 黄庆海, 等. 长期不同施肥模式红壤性水稻土磷素变化[J]. 植物营养与肥料学报, 2015, 21(6): 1521-1528 (  0) 0) |
| [15] |
廖育林, 郑圣先, 鲁艳红, 等. 长期施用化肥和稻草对红壤性水稻土钾素固定的影响[J]. 水土保持学报, 2011, 25(1): 70–73, 95 (  0) 0) |
| [16] |
高菊生, 徐明岗, 曹卫东, 等. 长期稻-稻-紫云英轮作28年对水稻产量及田间杂草多样性影响[J]. 中国农学通报, 2010, 26(17): 155-159 (  0) 0) |
| [17] |
陈明君, 盛荣, 张文钊, 等. 红壤稻田复种方式对土壤微生物生物量碳、氮的影响[J]. 农业现代化研究, 2023, 44(4): 692-700 (  0) 0) |
| [18] |
陈晓芬, 李忠佩, 刘明, 等. 长期施肥处理对红壤水稻土微生物群落结构和功能多样性的影响[J]. 生态学杂志, 2015, 34(7): 1815-1822 (  0) 0) |
| [19] |
Li Z P, Zhang T L, Han F X, et al. Changes in soil C and N contents and mineralization across a cultivation chronosequence of paddy fields in subtropical China[J]. Pedosphere, 2005, 15(5): 554-562 (  0) 0) |
| [20] |
Li W T, Chen X F, Liu M, et al. Shifts in microbial communities with increasing soil fertility across a chronosequence of paddy cultivation in subtropical China[J]. Applied Soil Ecology, 2017, 120: 153-159 DOI:10.1016/j.apsoil.2017.07.031 (  0) 0) |
| [21] |
Lili L Z C, Lin X X. Accumulation of organic matter in infertile red soils and its ecological importance[J]. Pedosphere, 2000, 10(2): 149-158 (  0) 0) |
| [22] |
Lv M R, Li Z P, Che Y P, et al. Soil organic C, nutrients, microbial biomass, and grain yield of rice (Oryza sativa L.) after 18years of fertilizer application to an infertile paddy soil[J]. Biology and Fertility of Soils, 2011, 47(7): 777-783 DOI:10.1007/s00374-011-0584-y (  0) 0) |
| [23] |
陈晓芬, 吴萌, 江春玉, 等. 不同培养温度下长期施肥红壤水稻土有机碳矿化特征研究[J]. 土壤, 2019, 51(5): 864-870 (  0) 0) |
| [24] |
Derrien M, Shin K H, Hur J. Assessment on applicability of common source tracking tools for particulate organic matter in controlled end member mixing experiments[J]. Science of the Total Environment, 2019, 666: 187-196 DOI:10.1016/j.scitotenv.2019.02.258 (  0) 0) |
| [25] |
Wu M, Wei S P, Liu J, et al. Long-term mineral fertilization in paddy soil alters the chemical structures and decreases the fungistatic activities of humic acids[J]. European Journal of Soil Science, 2019, 70(4): 776-785 DOI:10.1111/ejss.12778 (  0) 0) |
| [26] |
Kalbitz K, Schmerwitz J, Schwesig D, et al. Biodegradation of soil-derived dissolved organic matter as related to its properties[J]. Geoderma, 2003, 113(3/4): 273-291 (  0) 0) |
| [27] |
Sanchez N P, Skeriotis A T, Miller C M. Assessment of dissolved organic matter fluorescence PARAFAC components before and after coagulation–filtration in a full scale water treatment plant[J]. Water Research, 2013, 47(4): 1679-1690 DOI:10.1016/j.watres.2012.12.032 (  0) 0) |
| [28] |
Mouloubou O R, Prudent P, Mounier S, et al. An adapted sequential chemical fractionation coupled with UV and fluorescence spectroscopy for calcareous soil organic matter study after compost amendment[J]. Microchemical Journal, 2016, 124: 139-148 DOI:10.1016/j.microc.2015.08.007 (  0) 0) |
| [29] |
Gao J K, Liang C L, Shen G Z, et al. Spectral characteristics of dissolved organic matter in various agricultural soils throughout China[J]. Chemosphere, 2017, 176: 108-116 DOI:10.1016/j.chemosphere.2017.02.104 (  0) 0) |
| [30] |
Wu M, Zhang J W, Bao Y Y, et al. Long-term fertilization decreases chemical composition variation of soil humic substance across geographic distances in subtropical China[J]. Soil and Tillage Research, 2019, 186: 105-111 DOI:10.1016/j.still.2018.10.014 (  0) 0) |
| [31] |
Liu J, Chen X F, Li D M, et al. Variation of soil dissolved organic carbon under long-term different fertilizations and its correlation with maize yields[J]. Journal of Soils and Sediments, 2020, 20(7): 2761-2770 DOI:10.1007/s11368-020-02631-1 (  0) 0) |
| [32] |
Leenheer J A, Croué J P. Peer reviewed: Characterizing aquatic dissolved organic matter[J]. Environmental Science & Technology, 2003, 37(1): 18A-26A (  0) 0) |
| [33] |
Xia M M, Li P F, Liu J, et al. Long-term fertilization promotes the microbial-mediated transformation of soil dissolved organic matter[J]. Communications Earth & Environment, 2025, 6: 114 (  0) 0) |
| [34] |
Richter D D, Markewitz D, Trumbore S E, et al. Rapid accumulation and turnover of soil carbon in a re-establishing forest[J]. Nature, 1999, 400(6739): 56-58 DOI:10.1038/21867 (  0) 0) |
| [35] |
Rasmussen P, Goulding K, Brown J, et al. Long-term agroecosystem experiments: Assessing agricultural sustainability and global change[J]. Science, 1998, 282(5390): 893-896 DOI:10.1126/science.282.5390.893 (  0) 0) |
| [36] |
Wu M, Li G L, Wei S P, et al. Discrimination of soil productivity and fertilizer-nitrogen use efficiency in the paddy field of subtropical China after 27 years different fertilizations[J]. Archives of Agronomy and Soil Science, 2021, 67(2): 166-178 DOI:10.1080/03650340.2020.1718114 (  0) 0) |
| [37] |
Bouwman L, Goldewijk K K, Van Der Hoek K W, et al. Exploring global changes in nitrogen and phosphorus cycles in agriculture induced by livestock production over the 1900-2050 period[J]. PNAS, 2013, 110(52): 20882-20887 DOI:10.1073/pnas.1012878108 (  0) 0) |
| [38] |
Zhong W H, Cai Z C. Long-term effects of inorganic fertilizers on microbial biomass and community functional diversity in a paddy soil derived from quaternary red clay[J]. Applied Soil Ecology, 2007, 36(2/3): 84-91 (  0) 0) |
| [39] |
刘凯, 刘佳, 陈晓芬, 等. 长期施用磷肥水稻土微生物量磷的季节变化特征与差异[J]. 中国农业科学, 2020, 53(7): 1411-1418 (  0) 0) |
| [40] |
Li W T, Liu M, Jiang C Y, et al. Changes in soil aggregate-associated enzyme activities and nutrients under long-term chemical fertilizer applications in a phosphorus-limited paddy soil[J]. Soil Use and Management, 2017, 33(1): 25-33 DOI:10.1111/sum.12322 (  0) 0) |
| [41] |
Li W T, Liu M, Wu M, et al. Bacterial community succession in paddy soil depending on rice fertilization[J]. Applied Soil Ecology, 2019, 144: 92-97 DOI:10.1016/j.apsoil.2019.07.014 (  0) 0) |
| [42] |
Bossio D A, Scow K M. Impacts of carbon and flooding on soil microbial communities: Phospholipid fatty acid profiles and substrate utilization patterns[J]. Microbial Ecology, 1998, 35(3): 265-278 DOI:10.1007/s002489900082 (  0) 0) |
| [43] |
Börjesson G, Menichetti L, Kirchmann H, et al. Soil microbial community structure affected by 53 years of nitrogen fertilisation and different organic amendments[J]. Biology and Fertility of Soils, 2012, 48(3): 245-257 DOI:10.1007/s00374-011-0623-8 (  0) 0) |
| [44] |
Su J Q, Ding L J, Xue K, et al. Long-term balanced fertilization increases the soil microbial functional diversity in a phosphorus-limited paddy soil[J]. Molecular Ecology, 2015, 24(1): 136-150 DOI:10.1111/mec.13010 (  0) 0) |
| [45] |
Fu Y Y, Xu Y Q, Wang Q, et al. Deciphering the microbial players driving straw decomposition and accumulation in soil components of particulate and mineral-associated organic matter[J]. Soil Biology and Biochemistry, 2025, 209: 109871 DOI:10.1016/j.soilbio.2025.109871 (  0) 0) |
| [46] |
Liu E K, Yan C R, Mei X R, et al. Long-term effect of chemical fertilizer, straw, and manure on soil chemical and biological properties in northwest China[J]. Geoderma, 2010, 158(3/4): 173-180 (  0) 0) |
| [47] |
Lazcano C, Gómez-Brandón M, Revilla P, et al. Short-term effects of organic and inorganic fertilizers on soil microbial community structure and function[J]. Biology and Fertility of Soils, 2013, 49(6): 723-733 DOI:10.1007/s00374-012-0761-7 (  0) 0) |
| [48] |
Ai C, Liang G Q, Sun J W, et al. The alleviation of acid soil stress in rice by inorganic or organic ameliorants is associated with changes in soil enzyme activity and microbial community composition[J]. Biology and Fertility of Soils, 2015, 51(4): 465-477 DOI:10.1007/s00374-015-0994-3 (  0) 0) |
| [49] |
Cenini V L, Fornara D A, McMullan G, et al. Linkages between extracellular enzyme activities and the carbon and nitrogen content of grassland soils[J]. Soil Biology and Biochemistry, 2016, 96: 198-206 DOI:10.1016/j.soilbio.2016.02.015 (  0) 0) |
| [50] |
Sinsabaugh R L, Hill B H, Follstad Shah J J. Ecoenzymatic stoichiometry of microbial organic nutrient acquisition in soil and sediment[J]. Nature, 2009, 462(7274): 795-798 DOI:10.1038/nature08632 (  0) 0) |
| [51] |
Zheng S X, Cao H C, Huang Q Y, et al. Long-term fertilization of P coupled with N greatly improved microbial activities in a paddy soil ecosystem derived from infertile land[J]. European Journal of Soil Biology, 2016, 72: 14-20 DOI:10.1016/j.ejsobi.2015.12.006 (  0) 0) |
| [52] |
Li Z P, Liu M, Wu X C, et al. Effects of long-term chemical fertilization and organic amendments on dynamics of soil organic C and total N in paddy soil derived from barren land in subtropical China[J]. Soil and Tillage Research, 2010, 106(2): 268-274 DOI:10.1016/j.still.2009.12.008 (  0) 0) |
| [53] |
Li X, Wang H, Gan S H, et al. Eco-stoichiometric alterations in paddy soil ecosystem driven by phosphorus application[J]. PLoS One, 2013, 8(5): e61141 DOI:10.1371/journal.pone.0061141 (  0) 0) |
| [54] |
李委涛, 李忠佩, 刘明, 等. 红壤水稻土累积酶活性及养分对长期不同施肥处理的响应[J]. 土壤, 2016, 48(4): 686-691 (  0) 0) |
| [55] |
Li W T, Kuzyakov Y, Zheng Y L, et al. Effect of long-term fertilisation on enzyme activities and microbial community composition in the rice rhizosphere[J]. Acta Agriculturae Scandinavica, Section B — Soil & Plant Science, 2022, 72(1): 454-462 (  0) 0) |
| [56] |
Chen X F, Li Z P, Liu M, et al. Microbial community and functional diversity associated with different aggregate fractions of a paddy soil fertilized with organic manure and/or NPK fertilizer for 20years[J]. Journal of Soils and Sediments, 2015, 15(2): 292-301 DOI:10.1007/s11368-014-0981-6 (  0) 0) |
| [57] |
Bowles T M, Acosta-Martínez V, Calderón F, et al. Soil enzyme activities, microbial communities, and carbon and nitrogen availability in organic agroecosystems across an intensively-managed agricultural landscape[J]. Soil Biology and Biochemistry, 2014, 68: 252-262 DOI:10.1016/j.soilbio.2013.10.004 (  0) 0) |
| [58] |
Spence A, Simpson A J, McNally D J, et al. The degradation characteristics of microbial biomass in soil[J]. Geochimica et Cosmochimica Acta, 2011, 75(10): 2571-2581 DOI:10.1016/j.gca.2011.03.012 (  0) 0) |
| [59] |
Kallenbach C M, Frey S D, Grandy A S. Direct evidence for microbial-derived soil organic matter formation and its ecophysiological controls[J]. Nature Communications, 2016, 7: 13630 DOI:10.1038/ncomms13630 (  0) 0) |
| [60] |
吕美蓉, 李忠佩, 刘明, 等. 长期不同施肥处理对红壤水稻土微生物量氮周转的影响[J]. 中国农业科学, 2012, 45(2): 275-282 (  0) 0) |
| [61] |
Xia M M, Ma X L, Liu J, et al. Potential effect of key soil bacterial taxa on the increase of rice yield under milk vetch rotation[J]. Frontiers in Microbiology, 2023, 14: 1150505 DOI:10.3389/fmicb.2023.1150505 (  0) 0) |
| [62] |
Lu J L, Jia P, Feng S W, et al. Remarkable effects of microbial factors on soil phosphorus bioavailability: A country-scale study[J]. Global Change Biology, 2022, 28(14): 4459-4471 DOI:10.1111/gcb.16213 (  0) 0) |
| [63] |
Liu X, Han R, Cao Y, et al. Enhancing phytate availability in soils and phytate-P acquisition by plants: A review[J]. Environmental Science & Technology, 2022, 56(13): 9196-9219 (  0) 0) |
| [64] |
Wu X J, Rensing C, Han D F, et al. Genome-resolved metagenomics reveals distinct phosphorus acquisition strategies between soil microbiomes[J]. mSystems, 2022, 7(1) (  0) 0) |
| [65] |
Cui J W, Zhang S, Wang X Y, et al. Enzymatic stoichiometry reveals phosphorus limitation-induced changes in the soil bacterial communities and element cycling: Evidence from a long-term field experiment[J]. Geoderma, 2022, 426: 116124 DOI:10.1016/j.geoderma.2022.116124 (  0) 0) |
| [66] |
Liu H, Li S S, Qiang R W, et al. Response of soil microbial community structure to phosphate fertilizer reduction and combinations of microbial fertilizer[J]. Frontiers in Environmental Science, 2022, 10: 899727 DOI:10.3389/fenvs.2022.899727 (  0) 0) |
| [67] |
Huang X Z, Li Y W, Guggenberger G, et al. Direct evidence for thickening nanoscale organic films at soil biogeochemical interfaces and its relevance to organic matter preservation[J]. Environmental Science: Nano, 2020, 7(9): 2747-2758 DOI:10.1039/D0EN00489H (  0) 0) |
| [68] |
Huang X Z, Li Y W, Liu B F, et al. SoilChip-XPS integrated technique to study formation of soil biogeochemical interfaces[J]. Soil Biology and Biochemistry, 2017, 113: 71-79 DOI:10.1016/j.soilbio.2017.05.021 (  0) 0) |
| [69] |
Zhu X Y, Wang K, Yan H C, et al. Microfluidics as an emerging platform for exploring soil environmental processes: A critical review[J]. Environmental Science & Technology, 2022, 56(2): 711-731 (  0) 0) |
| [70] |
刘芳禧, 方畅宇, 庾振宇, 等. 绿肥、秸秆和石灰联用对红壤性水稻土酸度特征和水稻产量的影响[J]. 土壤学报, 2024, 61(6): 1616-1627 (  0) 0) |
| [71] |
侯贵梁. 浅谈有机种植对红壤性稻田土壤理化性质及水稻生理特性的影响[J]. 种子科技, 2016, 34(11): 121, 123 (  0) 0) |
| [72] |
杨曾平, 高菊生, 郑圣先, 等. 长期冬种绿肥对红壤性水稻土微生物特性及酶活性的影响[J]. 土壤, 2011, 43(4): 576-583 (  0) 0) |
| [73] |
林子聪, 任向宁, 朱阿兴, 等. 基于随机森林算法的耕地质量定级指标体系研究[J]. 华南农业大学学报, 2020(4): 38-48 (  0) 0) |
| [74] |
吴代晖, 范闻捷, 崔要奎, 等. 高光谱遥感监测土壤含水量研究进展[J]. 光谱学与光谱分析, 2010, 30(11): 3067-3071 (  0) 0) |
| [75] |
Nan Q, Speth D R, Qin Y, et al. Biochar application using recycled annual self straw reduces long-term greenhouse gas emissions from paddy fields with economic benefits[J]. Nature Food, 2025, 6(5): 456-465 DOI:10.1038/s43016-025-01124-z (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. College of Land Resource and Environment, Jiangxi Agricultural University, Nanchang 330045, China;
4. Jiangxi Institute of Red Soil and Germplasm Resources, Nanchang 331717, China;
5. Zhenjiang College, Zhenjiang, Jiangsu 212028, China;
6. Ecological Experimental Station of Red Soil, Chinese Academy of Sciences, Yingtan, Jiangxi 335211, China
 2025, Vol. 57
2025, Vol. 57


