2. 中国科学院大学南京学院, 南京 211135
土壤作为陆地生态系统的核心载体,是维系植物生长、保障粮食安全与推动全球元素循环(碳、氮、磷等)的关键介质,其健康状态直接决定生态系统的稳定性与服务功能。然而,随着工业化、农业集约化进程的加快,重金属超标、有机污染物(如多环芳烃、有机氯)累积等土壤污染问题日益凸显,不仅破坏土壤团粒结构、抑制微生物活性,还会影响元素循环路径,导致土壤肥力衰退、生态功能退化,对人类健康与生态安全构成严峻威胁。因此,维持土壤健康、修复受损土壤生态功能已成为当前环境土壤学领域的核心议题之一。目前,土壤健康调控与生态功能修复的传统手段主要包括物理修复(如客土置换、电动修复)、化学修复(如螯合剂淋洗、氧化还原处理)及常规生物修复(如外源微生物接种、植物–微生物联合修复)。尽管这些技术在特定场景下展现出一定效果,但普遍存在明显局限,例如,物理与化学修复易造成土壤结构破坏、引发二次污染,且成本高昂;常规生物修复则受限于微生物活性低、修复周期长,难以满足复杂污染环境的修复需求。在此背景下,开发绿色、高效、可持续的土壤调控技术成为突破瓶颈的关键。
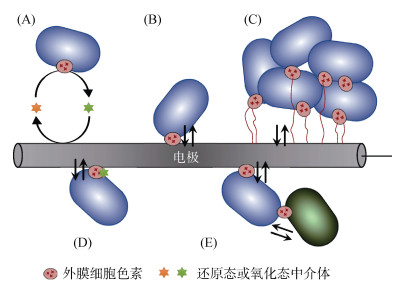
微生物电化学技术(Microbial electrochemical technology,MET)作为近年来新兴的环境生物技术,通过构建微生物电化学系统(Bioelectrochemical systems,BES),利用电活性微生物(Electroactive microorganisms,EAM)的代谢活动将环境中化学能转化为电能或驱动污染物降解,具备无二次污染、资源回收潜力大、能耗低等显著优势[1]。发展MET不仅为土壤污染修复与生态功能维持提供了全新技术路径,更对推动土壤环境治理向“低碳化、资源化”转型具有重要战略意义[2]。EAM是指能够通过微生物的胞外电子传递(Extracellular electron transfer,EET)机制与细胞外的氧化还原电子供体或受体(如铁锰氧化物、电极等)进行电子交换的微生物[3-4]。其中具有向胞外输出电子能力的微生物被称为外产电微生物(Exoelectrogens),而具有接受细胞外源电子能力的微生物被称为电营养微生物(Electrotrophs)[5-6]。EAM通过不同的EET机制利用胞外固态物质作为终端电子受体(Terminal electron acceptor,TEA)或供体(Terminal electron donor,TED),其与胞外固态电子供/受体的EET机制主要可归为两大类:直接胞外电子传递(DEET)和间接胞外电子传递(IEET)[7]。DEET指微生物利用细胞外膜上的细胞色素蛋白(图 1B)或菌毛(也称“纳米导线”,图 1C)与胞外固态介质直接接触进行电子传递的过程[8]。如Geobacter通过细胞色素(OmcZ)或细菌菌毛(如Ⅳ型)与电极间进行DEET[9]。此外,微生物群落中的直接种间电子传递(图 1E)也是EET的重要组成部分[10]。而IEET则由具有氧化还原活性的小分子电子穿梭体介导,实现电子在微生物细胞与胞外介质之间的传递(图 1A)。微生物分泌或人为添加氧化还原穿梭体(如甲基紫、中性红)均可介导IEET[7, 11-12],如模式菌株Shewanella oneidensis可分泌黄素作为IEET的电子穿梭体进行胞外电子传递[13] (图 1D)。
|
(A:间接胞外电子转移(IEET),一种可逆的氧化还原中介体被微生物还原并被运输至电极,经过氧化后该氧化还原中介体可用于进一步的氧化还原循环;B:通过与电极紧密接触的外膜细胞色素进行直接胞外电子转移(DEET);C:通过导电菌毛(“纳米导线”)进行的DEET,使微生物能够形成多层生物膜;D:氧化还原中介体(如黄素)与外膜细胞色素结合,促进微生物进行DEET;E:物种间直接电子转移(DIET),细菌通过外膜细胞色素相互交换电子) 图 1 电活性微生物进行胞外电子传递的机制示意图 Fig. 1 Schematic diagram of mechanism of extracellular electron transfer in electroactive microorganisms |
BES是在电极与微生物相互作用的基础上,通过一系列微生物催化反应而形成的反应系统[14],其核心组成包括3个部分:①一对惰性固体电极(阳极和阴极),微生物(通常是微生物菌群)的新陈代谢依赖于其中一个或两个电极;②连接两个电极的外部电路,如电阻负载、电源、恒电位器或恒电流器;③两个电极之间的离子迁移通道或路径,用于维持BES的电中性和电荷平衡[15]。根据功能及操作模式,BES可分为微生物燃料电池(Microbial fuel cells,MFC)和微生物电解池(Microbial electrolysis cells,MEC)。MFC以有机废物为底物将化学能转化为电能,而MEC通过外源输入的电能驱动阳极的氧化反应和阴极的还原反应[16-17]。MFC中有机物氧化释放电子使阳极具有较低的氧化还原电位,同时阴极发生还原反应而具有相对较高的氧化还原电位,二者产生电位差形成生物电。而MEC需要对电极(阴极或阳极)施加外部电压,使电极之间产生电位差来驱动目标反应[16-18]。在过去几十年中,BES受到了越来越多的关注。BES可应用于多个领域,包括生物发电、燃料和化学品生产、废水处理、生物传感器研发与应用、生物修复和脱盐等。已有大量的研究和综述论文探讨了BES的不同方面,如电极材料、构型设计、反应机制、微生物的选择与富集、建模拟合等。然而目前对BES的研究主要集中于液体(水)介质中,仅有少数的研究关注BES在土壤领域的应用。尽管关注度较低,近年来国内外学者围绕土壤微生物电化学开展了积极的研究,尤其是在EAM的筛选与富集、BES在土壤污染修复中的应用、微生物电化学过程对土壤的调控效应等方面取得了阶段性成果[2, 19-21]。然而,目前尚缺乏对BES在土壤中应用角度、范围及局限性等内容的系统性总结。基于此,本文系统梳理了当前有关土壤BES的研究进展,重点论述了其在土壤环境中的应用,并对其未来研究的重点进行了展望,旨在为解决当前技术瓶颈、优化土壤健康管理策略提供理论参考,进而拓宽BES在原位土壤污染修复与生态功能维持中的应用前景。
1 土壤BES基本原理及影响因素BES以环境可持续途径(如无需外源化学试剂添加、能耗极低甚至趋近于无能耗)强化微生物代谢过程,目前已在环境污染治理、生物发电等领域开展了广泛的基础研究与应用探索。近年来,BES的应用场景逐步拓展至土壤环境领域并引发学界重点关注,现有研究成果主要集中于土壤污染修复方向[22-24]。相较于仅能提供单一氧化还原环境的传统土壤修复技术,土壤BES可同步调控土壤微环境中的阳极氧化反应与阴极还原反应[25],进而对具有复杂理化特性的混合污染物实现更具灵活性的修复调控[26]。土壤BES的核心作用机制在于依托土壤中EAM的EET能力,将土壤中有机物氧化分解过程所释放的电子定向转移至电极表面,在形成稳定电流的同时实现能量回收或土壤环境修复的目标。例如,在土壤有机污染的传统微生物降解过程中,电子受体的充足性是决定降解效率的关键限制因素:微生物氧化分解有机污染物时,需将代谢产生的电子传递给终端电子受体以完成能量循环,而高浓度有机污染物会快速消耗土壤环境中天然存在的电子受体(如少量氧气、硫酸盐、硝酸盐等),导致电子受体匮乏,最终使降解过程陷入停滞[27]。而BES以生物阳极作为微生物代谢的“终端电子受体”,EAM在氧化分解土壤有机污染物的过程中产生电子,这些电子通过EET过程定向转移至阳极,再经外电路传输至阴极,这一过程构建了“无限”的电子接受能力,而无需依赖土壤中有限的天然电子受体,也无需频繁补充外源化学试剂[28]。这种机制不仅彻底解除了电子受体对降解过程的限制,还能显著促进EAM对有机污染物的氧化分解效率,同时避免了传统技术高能耗、高成本的弊端。此外,土壤基质为EAM提供了适宜的生存与代谢微环境[28]。尽管早期研究提出EAM不存在特定生态位的观点[29],但近期研究证实,在厌氧土壤环境及富含铁、锰等金属元素及其氧化物的土壤中,EAM的群落丰度更高[6]。因此,BES在土壤环境中的应用具备广阔的发展潜力与实践价值。
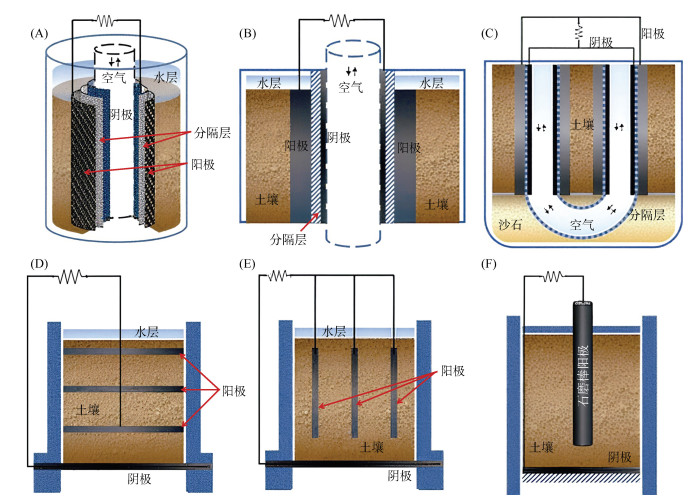
受土壤介质物理阻隔效应的影响,土壤BES在常规构建中多采用无离子交换膜的单室结构设计。依据系统构型差异,其主要可分为柱型、U型、竖直插入多阳极型、管型、平铺多阳极型及石磨棒电极垂直插入型(图 2)。在典型的土壤BES构建中,阳极通常嵌入土壤深层厌氧区域,并通过外部电路与阴极形成闭合回路。在阳极表面,EAM以土壤中包括污染物在内的有机物质为碳源与能量来源,进行呼吸代谢与生长繁殖。微生物降解有机物过程中产生的电子被传递至阳极表面后,通过外部电路定向迁移至阴极,进而形成稳定的生物电流。在此过程中,EAM可将土壤中的有机物氧化转化为小分子有机化合物(如醋酸等),部分有机物甚至可被彻底矿化为CO2与H2O;该氧化过程伴随的电子释放与转移,使电子经外电路抵达阴极后,最终传递至阴极侧的终端电子受体[30]。
|
(A:管型;B:柱型;C:U型;D:平铺多阳极型;E:竖直插入多阳极型;F:石磨棒电极垂直插入型) 图 2 典型的土壤BES系统的构型[28] Fig. 2 Typical reactor configurations of soil BES |
值得注意的是,土壤自身具有显著的异质性特征,且pH、质地、有机碳含量、含水率等非生物因素易发生动态变化,这些因素共同导致不同土壤环境BES的运行性能存在显著差异[24]。除为土壤自然氧化还原反应构建高效电子传输通道外,土壤BES还可通过调控电极电位,直接向土壤或沉积物环境提供电子供体或电子受体[31]。当阴极作为工作电极埋入土壤时,可根据目标污染物降解反应的热力学需求,通过外部施加电能灵活调控阴极电位,驱动阴极发生定向还原反应[32-33],从而显著提升土壤中目标污染物的降解效率。
通过调控土壤BES的电极电位,不仅可直接调节体系内氧化还原依赖性反应的方向与速率,还能显著影响土壤微生物群落的结构组成及功能活性[34]。已有研究表明,在土壤BES的阳极表面,α-变形菌纲和β-变形菌纲以及厚壁菌门的细菌通常呈现显著富集特征[35-36],这类菌群是阳极区域电子传递功能的核心执行者。需要注意的是,土壤环境中富集的微生物群落并非仅包含EAM,还涵盖产甲烷菌、发酵菌、硫酸盐还原菌、硝酸盐还原菌、微好氧菌、氢气利用菌及微藻等非电活性微生物(非EAM)。非EAM虽不直接参与EET过程,但其代谢活动对土壤BES的整体运行性能(如电流输出稳定性、底物利用率)及EAM的电子传递效率具有不可忽视的调控作用。在土壤BES的生物膜微生态系统中,EAM与非EAM可通过群体感应信号分子(如脂肪酰基–高丝氨酸内酯、对–香豆酰基–高丝氨酸内酯等)实现种间信息交流,进而协同调控菌群的代谢活动与功能分工[37]。二者的相互作用不仅能通过细胞聚集促进生物膜的形成与稳定,还可通过调控Ⅳ型菌毛相关基因(如pilA)、c型细胞色素基因(如omcZ)的表达,以及介导细胞间信号传导以调控EET过程,从而优化体系电子传递效率[38]。在BES中,EAM与非EAM的协同作用可通过改善群落功能完整性与结构稳定性,提升整体代谢能力。例如,有研究证实,阳极区域的生物电化学过程可通过增强共代谢还原降解作用,促进假单胞菌的生长繁殖,使系统功率输出提升3.2倍,同时显著强化阴极的氮去除效能[39]。然而,非EAM的丰度过高会引发底物竞争、电子传递路径干扰等问题,导致系统工作效率下降[40]。因此,维持EAM与非EAM的群落结构平衡,是保障土壤BES高效稳定运行、规避非EAM不利影响的关键。综上,深入解析土壤BES中EAM与非EAM的活性调控机制及生长代谢的内在关联,可为优化土壤BES的反应器设计、运行参数设定及功能强化策略提供重要的理论依据与技术参考。
土壤类型与微生物群落结构是调控土壤BES运行性能的关键因素。一方面,土壤微生物群落内不同菌种间的互作关系(如协同、竞争、共生等)直接影响群落整体的功能执行效率、代谢活性及结构稳定性;另一方面,不同土壤类型在物理特性上存在显著差异,具体表现为渗透率、电导率及孔隙率的不同,这些差异会通过改变电子传递路径、底物迁移效率及微生物生存微环境,间接影响土壤BES的功能发挥。此外,土壤中有机质(如多酚类物质)的赋存形态与可利用性,也可能导致微生物群落产电能力的分化。例如,已有研究对比了森林土壤与农业土壤构建的土壤BES体系,发现二者EAM群落组成存在显著差异[41]。进一步性能监测表明,农业土壤构建的BES产电量较森林土壤体系提升17倍,群落呼吸速率亦提高10倍,这种性能差异可能与两类土壤中有机质组成、养分含量及EAM群落结构特征密切相关[41]。从土壤物理特性的具体影响来看,高黏土含量的土壤会显著降低基质孔隙度,同时减弱氧气从阴极向阳极区域的扩散渗透性,这种微环境变化可进一步优化阳极区域的厌氧条件,为厌氧型EAM的富集与代谢活动提供适宜环境,从而间接促进系统电子传递效率的提升。而高有机质含量的土壤则可为微生物群落(包括EAM)提供充足的碳源与能量物质,不仅能缩短土壤BES的启动周期,还能显著提升系统的产电性能与运行稳定性。综上,土壤类型对BES性能的影响是“物理–化学–生物”多因素协同作用的结果,不同土壤的特性差异通过改变“电子传递环境”“物质供给”与“微生物群落”,最终决定BES的运行稳定性及功能效率。这一机制也为实际应用中“因地制宜设计土壤BES”提供了理论依据。
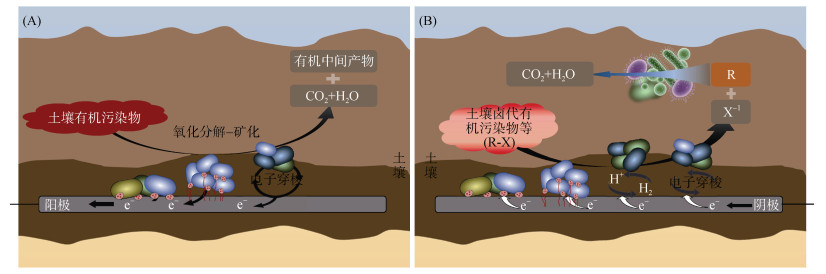
2 BES在土壤环境中的应用 2.1 在土壤有机污染修复中的应用BES在土壤有机污染修复领域展现出独特且不可替代的技术优势,其核心修复机制依赖于EAM的代谢功能与电极系统的协同作用,在实现有机污染物高效降解的同时伴随生物电流产生[42],这一“以污治污”的能量自给模式显著降低了修复过程的外源能耗需求,符合环境可持续修复理念。如图 3所示,在BES修复体系中,土壤中的有机污染物会向电极区域迁移,在EAM的代谢作用下发生氧化还原反应:部分污染物被分解为小分子有机化合物(如有机酸、醇类),部分则可被彻底矿化为CO2、H2O等无机无害物质[43]。在此过程中,有机污染物不仅是被降解的目标物质,还可作为EAM生长繁殖所需的碳源与能量来源,为EAM的持续代谢与EET功能提供物质保障[44];对于部分卤代有机污染物(如氯代烃、多氯联苯)而言,其可作为电子受体,在阴极或EAM介导下发生还原脱卤反应,通过逐步去除卤素原子降低污染物毒性,最终实现无害化转化[32]。目前,已有大量研究证实BES在多种典型土壤有机污染物修复中的有效性,包括石油烃类污染物(如苯、甲苯、柴油)、多环芳烃(如萘、菲、荧蒽)及氯代有机污染物(如四氯乙烯、六氯苯)等,为不同类型有机污染土壤的修复提供了技术路径。
|
(A:土壤中有机污染物作为电子供体在BES阳极附近被EAM氧化分解成小分子有机化合物或被矿化;B:土壤中部分卤代有机污染物作为电子受体在BES阴极附近被EAM还原脱卤生成非卤代有机物,在土壤中被土壤微生物群落氧化分解) 图 3 土壤BES中电活性微生物对有机污染物的修复示意图 Fig. 3 Illustration of electroactive microorganisms degrade organic pollutants in soil BES |
针对土壤中石油烃污染修复,Lu等[45]证实石油烃可在土壤BES的阳极被氧化降解,并且修复周期显著缩短,同时他们还在中试试验过程中发现经过120 d的处理,总石油烃的降解率最高可达90%[46]。Zhang等[47]构建了阴阳极垂直放置的单室土壤BES处理石油烃污染,发现在BES中土壤总石油烃、烷烃和芳烃的降解率与对照相比分别提高了52%、38% 和136%,降解能力的提升主要是由于BES阴阳极之间的生物电场促进了特定功能微生物的富集,如阴极附近的Alcanivorax (烷烃降解菌) 和阳极附近的Marinobacter (芳烃降解菌)。然而上述研究均未探讨石油烃浓度导致的差异。不同石油烃含量条件下降解效率会产生显著差异,Chandrasekhar和Venkata Mohan[48]探究不同浓度的石油烃在BES中的去除效果,发现相对于低浓度(1、3、5 g/kg)条件,高浓度石油烃(11 g/kg)条件下去除效率更高,达80%。
在多环芳烃污染土壤修复方面,BES同样表现出明显优势,其通过EAM的作用将多环芳烃降解并最终矿化。一项研究表明,土壤BES经过45 d的运行,相比对照组,萘、苊和菲的去除率分别增加了76.9%、52.5% 和36.8%[49]。Kronenberg等[50]系统梳理了BES修复土壤中多环芳烃污染的相关研究,发现研究热度仍然持续增加。尽管土壤BES对多环芳烃的修复取得了一定的效果,但由于土壤环境的高内阻,修复效率受到了阻碍。近年来,科研团队致力于开发新型强化策略,提升修复效能。Yan等[51]通过添加生物质炭颗粒(2%)于土壤BES中,实现了土壤BES内阻的降低和多环芳烃去除效率的提高,与未添加生物质炭颗粒处理相比,菲和芘的去除效率分别提高至67.4% 和58.6%,其主要原因是生物质炭颗粒的添加提高了土壤的孔隙率和渗透系数,同时提高了多环芳烃降解菌的丰度,如Pseudomonas、Lysobacter、Chitinophaga、Ralstonia、Phenylobacterium等的丰度。此外,Wang等[52]发现,周期性电极极性反转显著提高了土壤BES对多环芳烃污染土壤的修复效率,尤其是对高环多环芳烃的降解。周期性电极极性反转改善了土壤的物理化学性质,优化了微生物群落及其功能,有利于维持有效的生物降解过程。
对于氯代有机污染物污染土壤的修复,BES也展现出独特优势。Aulenta等[32]研究发现,三氯乙烯能在BES的驱动下彻底转化成乙烯和乙烷。Meng等[53]研究表明,在水稻土BES中,EAM对三氯乙烯还原脱氯产乙烯的速率可高达30 μmol/d。此外,研究人员还尝试通过不同方式以提高BES去除氯代有机污染物的效率。例如,一项研究发现,添加导电材料和群体感应信号分子可以改变土壤微生物组结构,促进γ-HCH的脱氯降解,同时抑制甲烷的产生,证明了基于导电材料和群体感应信号分子调控土壤微生物组电子传递和群落组装以同步调控多个还原过程的可行性[54]。
除上述提及的有机污染物外,BES在土壤中可修复的有机污染物范畴已进一步拓展,包括BTEX(苯、甲苯、乙苯、二甲苯)、各类农药(如有机磷类、拟除虫菊酯类)及酚类化合物(如苯酚、氯酚)等,相关研究已证实其修复可行性与效能[23, 31, 55-58]。值得注意的是,不同有机污染物在BES中的降解效率与转化路径存在显著差异,该差异由多维度核心因素协同调控。其中,污染物自身理化性质是基础决定性因素,其辛醇–水分配系数(Kow)直接影响其在土壤固相–液相界面的分配比例与向电极–微生物界面的迁移能力;电极材料特性是系统电子传递的关键载体,其导电性决定电子在电极内部及电极–微生物间的传递速率;土壤pH、温度、含水率等环境因素通过影响EAM活性间接干预降解过程。
尽管BES在土壤有机污染修复中展现出能耗低、环境友好、修复范围广等显著优势,且具备明确的应用潜力[59],但该技术向工程化应用推进仍需突破关键瓶颈。未来研究需重点围绕两大核心方向开展:其一,新型复合电极材料的创新研发。通过材料改性策略(如引入导电纳米颗粒进行掺杂改性、负载高效催化剂以强化反应活性)与结构优化设计(如构建多孔结构提升比表面积、设计三维立体结构拓展微生物定殖空间),同步实现电极电子传导效率的提升、污染物吸附容量的增强,以及材料在复杂土壤基质(如高盐、高有机质、强酸性/碱性)中的化学稳定性与抗生物污染能力的优化,为系统高效运行提供优质载体支撑。其二,微生物–电极界面作用机制的深度解析与精准调控。借助分子生物学、界面化学等多学科技术手段,明确EET相关功能基因(如c型细胞色素基因、菌毛蛋白基因)的表达调控机制,进而针对性优化电子传递链的关键节点,实现EAM与电极间电子传递效率的最大化,最终为BES技术从实验室研究向有机污染土壤高效、绿色的工程化修复应用转化提供理论依据与技术保障。
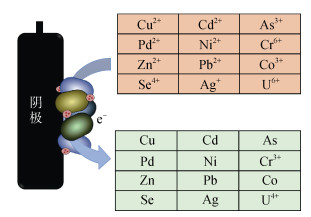
2.2 在土壤重金属污染修复中的应用近年来,BES在土壤重金属污染修复领域的研究取得了显著进展,为多种典型重金属污染土壤的修复提供了新的技术路径。BES主要通过生物转化、电化学沉积、电化学迁移及微生物累积等途径实现土壤中重金属的去除与风险削减。EAM通过EET过程向高价态重金属离子转移电子,驱动重金属发生还原转化,进而降低其毒性与环境迁移性,部分重金属还可通过还原反应转化为不溶性金属单质,固定于土壤中,从而实现其环境与生态系统潜在危害的降低[60-61]。在BES修复土壤重金属的机制中,阴极还原是核心作用路径(图 4):土壤中的重金属离子(如Cr6+、Cd2+等)会向阴极区域迁移,作为BES体系的终端电子受体参与阴极还原反应,在电子供给与EAM代谢的协同作用下,被还原为低毒性的金属单质或低价态金属离子,部分还原产物还可通过电化学沉积作用附着于阴极表面,实现从土壤基质中的分离去除[62]。
|
图 4 土壤BES中阴极电活性微生物修复重金属机制示意图 Fig. 4 Illustration of remediation mechanisms of heavy metals by cathodic electroactive microorganisms in soil BES |
BES阴极重金属离子还原过程存在两种典型的情况[63]:其一,当重金属在阴极的还原电位高于阳极电子供体(如有机质、污染物)的氧化电位时,该还原反应可自发进行,此情景下BES可采用微生物燃料电池(MFC)模式运行,反应过程伴随正向电压产生,实现“修复–产电”协同;其二,若重金属还原电位低于(或更负于)阳极电子供体的氧化电位,反应不具备自发进行的热力学条件,需通过外源施加能量(如外加电压)驱动阴极重金属还原,此时需采用微生物电解池(MEC)模式构建反应体系[64]。已有研究证实BES对土壤中Cr6+的修复效能,其驱动Cr6+还原转化为Cr3+,且土壤中总Cr含量基本保持稳定,但阴极区域土壤Cr6+含量显著低于阳极区域,这一现象直接证明BES阴极通过还原Cr6+,有效完成阴极部位土壤的修复[65]。针对土壤重金属复合污染场景,BES同样展现出优异的同步修复能力。有研究表明,BES可对Cr6+、Pb2+和Ni2+同步还原去除,经过3 d的处理,在起始浓度均为100 mg/L的情况下,对3种金属离子的还原去除均可达80% 以上[66]。同时,Li等[67]研究发现,经过12 h的处理,BES对污染土壤中的Cd、Pb和Zn去除率分别可达81.10%、23.05% 和30.14%。Wang等[68]构建了一种土壤BES用于同步产电和Cu污染修复,结果表明,电场增强了Cu的迁移,水溶性Cu和总Cu的时空分布随着从阳极到阴极金属浓度梯度的增加而发生明显变化。同时,土壤pH与对照组相比变化显著,阴极与阳极之间的pH差异达2.25个单位,这一pH梯度可能进一步影响Cu的赋存形态(如离子态、沉淀态),间接调控其迁移与修复效率。
上述研究充分证实了土壤BES在重金属污染修复中的作用,不仅明确了其通过阴极还原、电化学迁移等途径实现重金属去除的关键机制,还验证了其对单一及复合重金属污染的修复效能。然而,土壤作为复杂的固态异质介质,其固有性质与类型对BES的修复效率存在显著影响。例如,Zhang等[61]针对不同土壤类型的研究发现,红壤在BES中培养25 d后实现了25% ± 2% 的Cu2+去除率,显著高于水稻土,这一差异可能与红壤和水稻土在pH、电导率、有机质组成及孔隙结构上的本质区别相关。因此,未来的研究需要进一步拓展土壤类型与特性的覆盖范围,系统评估BES在不同质地(如砂土、黏土)、不同理化背景土壤中对重金属的修复效率,明确土壤特性与系统效能的关联性规律,为“因地制宜”设计土壤BES的修复方案提供依据。
此外,现有该方面研究多聚焦于短期的修复效果,虽证实了技术的可行性,但系统长期运行的稳定性仍需深入探究。一方面,长期运行过程中,电极表面生物膜易出现老化现象;另一方面,电极材料(尤其是铁基等金属材料)可能发生腐蚀致电极导电性降低、生物相容性下降,最终引发系统性能衰减。这些长期运行中的关键瓶颈问题尚未得到充分解析,需通过长期动态监测试验,揭示生物膜老化与电极腐蚀的发生机制,进而开发针对性的优化策略,为土壤BES修复重金属污染的工程化长期应用奠定基础。
2.3 在土壤抗生素及抗性基因污染修复中的应用随着抗生素在农业和畜牧业中的广泛应用,土壤中抗生素残留及其抗性基因污染已成为全球关注的环境问题。抗生素残留不仅会抑制土壤微生物活性,还可能通过食物链富集威胁生态安全与人体健康[69]。传统处理方法效率低、成本高、易产生二次污染等难题,而BES因高效、绿色的特性成为国际前沿研究方向。BES可以通过生物电流干扰微生物代谢网络,抑制耐药菌活性并促进抗生素降解,其关键机制包括电化学氧化还原反应与菌群结构重塑。在BES中,持续的生物电刺激微生物的代谢活动(如电子转移)有效地促进了土壤中抗生素的去除,抗生素作为电子供体在BES的阳极被微生物降解为质子和电子,质子和电子通过介质和外部电路到达阴极。
Zhao等[70]研究发现,利用BES去除土壤中的抗生素和抗性基因污染具有显著优势,既降低了土壤中抗生素的含量,又降低了潜在的抗性基因传播风险。Gao等[71]通过多次重复批次富集EAM群落,实现了磺胺嘧啶的高效降解,96 h内实现了98.76% ± 0.79% 的去除率,其降解速率是传统厌氧降解过程的2.1倍。Liang等[72]考察了BES的生物阴极对氯霉素的降解,发现经过24 h可转化降解氯霉素96.0% ± 0.9%,相比非生物对照组提高了23%。除富集菌群对抗生素的降解外,也有研究探究了模式EAM对抗生素的去除。如,Hazzan等[73]利用希瓦氏菌在BES中降解磺胺甲
尽管在该领域已经取得了较大的研究进展,但是提高电子转移效率仍是土壤BES研究的核心问题。为此,Wang等[74]探究了不同电子介导体对土壤BES处理抗生素的影响,发现添加电子介导体显著提高了土壤BES的输出电压(33.3% ~ 61.1%)和最大功率(14% ~ 106%),同时降低了抗生素耐药基因的丰度和传播风险,电子介导体通过改变微生物群落的结构(尤其是EAM群落的结构)促进了抗生素耐药基因的去除,其中生物质炭是促进BES产生电能和去除抗生素耐药菌最经济和高效的电子介导体,其促进效果显著优于纳米零价铁、石墨烯和碳纳米管。尽管众多研究显示,BES能够有效地去除抗生素及其抗性基因,但对抗性基因的去除效果仍存争议。Shan等[75]利用BES强化人工湿地系统(BES-CW)处理含有磺胺甲
总体上,当前该方面研究多聚焦于单一抗生素的去除,而复合污染体系中多种抗生素同时存在的条件,以及抗生素与重金属或其他有机污染物的交互作用及其对抗性基因传播的影响仍不明确,未来需结合宏基因组学与代谢组学解析复杂环境下的协同去除机制。同时,针对抗生素污染土壤,应整合BES与其他先进修复手段,如光催化氧化、生物质炭吸附等,形成协同增效模式,既利用微生物的代谢活性,又发挥化学氧化与物理吸附的优势,实现抗生素与抗性基因的高效去除。
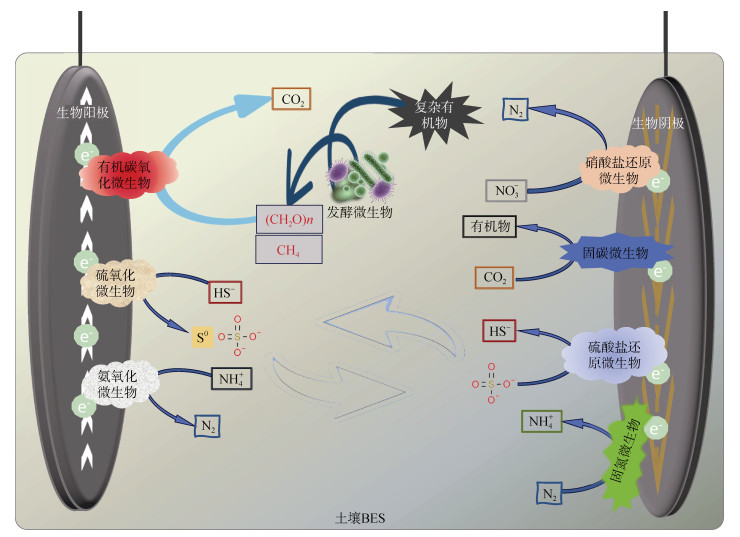
2.4 在土壤养分循环调节中的应用土壤养分循环是土壤生态系统功能的核心,涉及碳、氮、磷、硫等多种元素的转化和循环。BES通过调控土壤中的电子传递通路,影响土壤中的微生物群落结构和功能[17, 35, 76],进而影响土壤中养分循环的速率和效率[77]。BES在土壤中通过EAM的代谢活动,可以实现氮的氧化还原过程[78-79]、磷和硫的溶解与沉淀[80-81],从而促进土壤中养分的转化和释放(图 5),调节土壤养分元素的含量和可利用性,并由此为改善土壤质量、提高农作物生产力和土壤环境保护等提供了新思路。
|
图 5 土壤BES中养分元素循环反应示意图 Fig. 5 Illustration of nutrient element cyclic reactions in soil BES |
在碳循环方面,部分EAM可以利用BES阴极作为电子供体进行呼吸作用,将土壤中的无机化合物(如CO2)还原为可溶解的或可利用的有机物形式(如乙酸盐等)[82]。同时,也有EAM利用阳极作为电子受体,将有机物氧化为CO2和H2O,并释放出电子[83]。在氮循环方面,BES可以促进土壤中氮素的转化和循环,阳极可作为氨氧化过程的电子受体,而阴极可以作为硝酸盐、亚硝酸盐还原的电子供体。Zhang等[84]研究发现,使用双室水稻土BES,可在阴极实现高浓度NH4+的厌氧氨氧化同步反硝化,同时在阳极上对水稻土中的有机物进行氧化。此外,Zhang等[47]研究发现,在土壤BES中,生物电场增加了阴极附近NH4+ 的产生以及阳极附近NH4+的消耗,表明BES在土壤中可以促进阴极附近的氨化过程和阳极附近的氨氧化过程;阳极处硝化细菌的显著富集有力地证明了在土壤BES阳极附近氨的氧化过程。此外,在磷循环方面,BES可以促进土壤中难溶性磷的活化和植物吸收。解磷菌与聚磷菌的协同作用可激活土壤中难溶性磷,解磷菌分泌的有机酸溶解磷酸盐,聚磷菌则将磷储存为生物可利用形式,调节土壤中的磷元素循环和可利用性[81]。
然而,现有研究多关注单一元素循环(如碳或氮),多元素循环的耦合机制(如碳、氮、硫共循环对土壤环境及金属元素的影响)仍需深入解析,未来需构建多组学驱动的代谢网络模型解析其分子机制。此外,BES能够促进特定功能微生物(尤其是EAM)的生长和代谢,获得具有培肥增效功能的EAM,使其在土壤BES中定殖并富集,生产有特定功能的微生物肥料,是增强土壤肥力的又一有效途径。
2.5 在土壤生物传感器中的应用BES具备显著的传感潜力,主要依托EAM通过新陈代谢级联反应增强信号输出及可检测性,对特定底物具有相对选择性,以及EAM的自我复制能力可实现BES传感的稳定性[85-86]。BES中产生的电信号与EAM的代谢活性密切相关,代谢过程产生的电子会通过EET途径转移至电极,形成稳定电信号,因此可通过检测BES电信号的微弱变化反映环境的变化,进而构建高灵敏的生物传感器[86-87]。目前BES生物传感器主要应用在水质检测方面,包括淡水、海水、污水、厌氧发酵过程等[88-90],但BES生物传感器应用在土壤中相对较少。
BES在土壤传感领域具有广泛的应用空间,包括土壤污染监测、土壤质量评估、温室气体排放检测、农业生产管理等方面[91]。基于BES的土壤传感器通过实时监测生物电流与阻抗变化,实现对污染物浓度、微生物活性及土壤微环境参数的原位检测。有研究发现,土壤中鼠李糖脂的浓度增加引发BES的电流密度增加,从而土壤中石油烃的降解速率加快,鼠李糖脂的增量与电流密度的增量呈现显著的相关性,因此BES可在修复石油烃的过程中同时表征鼠李糖脂的浓度[92]。Mohanakrishna等[62]研究也发现,BES在去除土壤中总石油烃的过程中,输出电压与石油烃的浓度呈显著的正相关,输出电压随石油烃的浓度降低而降低。此外,在针对土壤重金属修复和监测的研究中,Guan等[93]研究发现,BES在对土壤中Cr6+去除的过程中输出电压与Cr6+浓度呈显著的负相关,因此其输出电压能够显示修复状况。类似的现象发生在有机污染土壤BES监测中,研究发现,芘的浓度与土壤BES的生物电压强度呈现显著的负相关,在无污染的条件下电压值高达305 mV,而芘污染土壤BES生物电压仅处于240 ~ 270 mV[94]。
同时,研究人员还发现土壤BES对不同物质的响应差异显著,能有效地检测土壤中的特定物质,如乳酸盐的浓度,因此可开发用于土壤中特定物质的监测功能[95]。此外,由于电信号的产生完全依赖于电极表面的电活性微生物膜,其群落结构和功能的变化直接影响电信号的强度[96],因此通过对BES中微生物的DNA及RNA进行分析,可明确微生物群落的组成和代谢活动,但在该领域有待深入探究。此外,现有传感器的长期稳定性与田间适应性仍需提升,未来需开发稳定的高精度、高选择性、多功能传感与精确计算集成系统,以实现复杂土壤环境下的持续多参数监测。
3 总结与展望BES的研究起步阶段主要集中在液相(水)的研究,而其在土壤中的应用研究开展相对较晚。这一领域发展滞后的核心原因在于:土壤作为固态基质具有不可流动性,该特性显著阻碍了体系内离子的迁移效率,导致土壤BES的构建与机制解析难度远高于液相BES[24]。尽管面临上述挑战,土壤BES的应用研究仍取得了阶段性突破,目前其研究成果主要集中于污染修复、养分循环调节、土壤传感器以及材料与技术创新领域。与此同时,土壤BES的实际应用仍面临多重关键挑战。土壤固有的异质性(如质地不均、有机质分布差异、电导率差异及孔隙结构复杂)导致电极与微生物间的界面接触不充分,显著限制了胞外电子传递效率,成为系统功能提升的核心瓶颈;生物膜老化和电极腐蚀导致系统性能衰减,影响长期运行稳定性;土壤pH、温度、含水率等环境因素的动态波动干扰EAM的代谢活性与电极反应动力学,导致实验室条件下的高效性能难以在实际复杂土壤环境中复现,极大制约了技术的规模化推广。为推动土壤BES从基础研究向工程化应用跨越,未来需针对上述瓶颈开展有针对性的深化研究。
3.1 挖掘土壤EAM资源土壤中EAM的丰度和种群结构受多因素的协同影响,包括土壤类型、环境条件、底物可利用性(如生物可利用有机物含量)、不溶性金属氧化物(如氧化铁、二氧化锰等)等[97]。从环境适应性来看,EAM在淹水或缺氧的土壤环境中丰度更高,这是因为厌氧/缺氧条件可促进微生物通过EET以满足代谢需求。已有研究证实,水稻土中的EAM丰度相对较高(10% ~ 40%)[36],这一现象与水稻土长期处于厌氧状态且有机质及铁锰等金属氧化物含量较高的特性密切相关。然而,EAM的群落组成和丰度会随土壤环境条件(如含水率变化、外源污染物输入、耕作方式改变)的动态波动而发生显著变化[98]。目前,关于如何高效利用土壤中固有EAM资源,并维持其电子传递与污染物降解等核心生态功能的机制仍不明确;同时,现有研究在土壤BES用于生物修复(如有机污染降解、重金属固定)及土壤环境监测(如养分/污染物浓度感知)过程中,对EAM群落结构动态变化的关注较少,且针对不同群落结构与丰度的EAM所对应的功能差异的研究也存在明显不足。基于此,未来研究需重点关注土壤BES运行前后微生物群落(尤其是EAM)的结构演变规律,并解析群落变化与系统功能之间的关联性。但需注意的是,EAM的群落特征与功能表现会因土壤特性和环境条件的不同而存在显著差异,因此,对土壤BES中EAM组成与丰度的研究需结合具体土壤的环境特征开展综合分析,才能为针对性调控EAM群落、优化土壤BES性能提供科学依据,进而实现对土壤中EAM资源的高效利用。
3.2 研发经济、绿色、高性能的电极材料电极作为BES的核心功能部件,其性能直接决定BES的运行效率,是影响系统功能发挥的关键因素之一[99]。电极材料的导电性、化学稳定性、生物相容性及比表面积等核心特性,直接调控EAM在电极表面的附着定殖、生物膜形成效率,以及EAM与电极间的电子传递速率等[100]。同时,这些特性也进一步影响BES在土壤环境中应用的可行性,例如材料是否耐受复杂土壤基质的腐蚀、是否能适配土壤孔隙结构以促进物质交换[101]。
在土壤BES研究中,如何突破土壤固态基质的限制,即有效提升电极与土壤间的电导率、促进EAM及目标物质(如污染物)在土壤中的迁移扩散,是当前亟待解决的核心难题[59]。针对这一问题,已有部分研究尝试在土壤BES中使用不同的碳基改性电极材料,如石墨碳刷、石墨毡、活性炭纤维毡、石墨纸和碳布等[102-104],结果表明,此类碳基材料不仅展现出相对优异的电子传递性能与生物相容性,且具有成本低廉的优势,在实验室研究中表现出较好的适用性[105]。然而,从实验室研究走向实际工程应用,电极材料还需满足更严苛的性能要求,例如在复杂土壤环境中长期运行的稳定性、抗磨损与抗腐蚀的耐用性,以及在修复场景中匹配较高的污染物去除效率等。目前,针对土壤BES电极材料上述实际应用特性的系统性研究仍较为匮乏[24]。因此,研发兼具经济性与耐用性、高性能且无潜在环境风险(如无有害物质溶出)的电极材料,是推动土壤BES技术从基础研究向工程化应用转化的重要突破口,具有重要的研究价值与实践意义。
3.3 提升BES在土壤环境中的工作效率由于土壤的异质性、迁移性差等特点,土壤BES运行过程中通常在电极周围形成强烈的浓度梯度(如污染物浓度梯度、离子浓度梯度),该梯度显著限制了污染物向电极表面的传输效率,导致土壤BES的整体工作效率远低于液相体系[106]。同时,EAM的催化作用主要集中于电极表面附近的微域[107],进一步加剧了“电极反应区”与“土壤中污染物分布区”的空间错配问题。因此,如何有效提升土壤BES的工作效率,已成为该技术实地应用的前提。针对这一问题,现有研究已探索出多种优化策略,通过添加外源物质等方式实现。研究显示,外源添加提高土壤电导率的物质可有效提高BES工作效率,如石墨烯、生物质炭、碳纤维等碳基物质[106, 108-110]。此外,添加水铁矿等铁矿物到土壤中,也可促进微生物的协同效应,显著提高BES对土壤中石油污染的去除效率[111]。Domínguez-Garay等[112]研究发现,添加二氧化硅胶体到水稻土中能够有效地促进土壤BES的产电量,降低土壤中的电阻率,促进离子在土壤中的迁移。
然而,当前所有提升土壤BES效率的手段均依赖外源化学物质的添加[31],如何权衡效率提升效果与外源物质的经济成本及潜在环境风险之间的关系目前仍不明确。因此,系统研究土壤BES工作效率的高效提升路径与增强机制,同时建立“效率–成本–风险”的协同优化体系,是推动土壤BES从理论研究迈向实际工程应用的关键影响因素之一。
3.4 非淹水土壤条件下的应用目前已报道的土壤BES需将土壤置于淹水环境中运行,其核心目的在于通过充足水分保障阳极与阴极之间的离子接触,为BES体系内质子从阳极土壤环境向阴极的迁移提供顺畅通道,进而维持系统较低的pH梯度和较高的传质速率。相关研究已证实淹水条件对土壤BES效能的促进作用,例如在淹水状态下BES对土壤中阿特拉津的去除率可达80% 以上,显著高于自然非淹水状态下土壤中阿特拉津的自然消减效率[113]。且绝大多数关于土壤BES污染修复的研究均在淹水条件下实现了污染物去除等目标[61, 70, 114]。然而,这些研究尚未明确土壤BES在非淹水状态土壤中能否实现同等目标,这种局限性极大地限制了BES在自然土壤环境中的应用。为突破淹水条件限制,Domínguez-Garay和Esteve-Núñez[22]首次研发了一种可直接应用于非淹水土壤中的新型BES装置,成功克服了对淹水环境的依赖,并在该BES中实现了土壤中阿特拉津的有效去除,为非淹水土壤的BES修复提供了技术原型。但当前针对非淹水土壤BES的研究仍处于起步阶段,相关探索十分有限,其系统构型优化、非淹水条件下离子传递机制、EAM代谢适应性调控等关键科学与技术问题尚未得到深入解析,因此非淹水土壤中BES的应用潜力与实现路径仍需进一步开展系统性探究。
3.5 原位土壤环境中的应用在实验室尺度下,BES被成功应用于模拟土壤环境的多领域研究,涵盖污染物去除、碳氮等关键元素生物地球化学循环调控及土壤环境监测等多个方面,充分验证了其技术可行性,同时实现了“修复–产电”“调控–减排”“监测–预警”的多功能协同。这些研究明确了EAM、电极材料、环境参数对BES性能的调控规律,为技术中试放大与原位应用提供了关键参数与优化方向。然而,当前BES在土壤领域的研究仍多局限于中试规模,缺乏对大面积土壤原位应用的系统性探索。例如,Lu等[46]开展的50 L体系的中试试验显示,BES处理120 d后,可去除土壤中82.1% ~ 89.7% 的总石油烃,清晰展现了其在土壤石油污染修复中的潜力与优势。但该研究仍基于异位批次反应器,且50 L体系的处理规模与实际原位修复中“大面积土壤(如亩级、公顷级)”的需求存在显著差距,难以直接为实地应用提供可落地的技术方案。
当前,如何将BES技术从“中试模拟”推广至“原位土壤环境”,并在复杂自然土壤条件(异质不均、孔隙结构复杂、环境参数波动)下维持系统稳定的性能,已成为制约其工程化应用的核心难题。尽管美国Advanced Environmental Technologies公司应用BES理论研发的E-Redox® 技术已经应用于地下水石油烃和氯代烃等污染的修复[25],但针对土壤环境,其在实地应用中仍面临诸多未解决的挑战,包括技术层面受物质传输与系统稳定性的双重制约,理论层面EAM功能调控与环境互作机制不明,工程层面原位规模化与成本效益的现实障碍等。
为推动BES从实验室研究迈向土壤环境工程实际应用,需从材料创新、群落调控、系统优化和工程实践4个维度开展大量多学科交叉的先进研究,实现协同突破。在材料方面,结合生物质炭、磁铁矿等天然导电介质,开发低成本高性能改性电极,同步提升材料导电性、抗土壤腐蚀能力与EAM附着相容性;在群落调控方面,依托多组学等分子生物学技术解析EAM群落结构与功能的关联机制,优化碳源(如小分子有机酸)与电子介导体(如黄素类物质)的添加策略,定向富集土壤土著功能EAM,构建“EAM–导电介质”协同的长距离电子传递通路,强化电子传递效率;在系统优化方面,集成土壤pH、温度、含水率及系统电流的多参数传感系统,建立机器学习模型(如随机森林、BP神经网络)预测系统运行状态,根据环境条件动态调整操作参数,同时,通过电化学工程设计适配复杂土壤的高效系统构型及原位电极布设方式,并结合BASF Divine Agri®和Divine Integrate®等湿润剂添加策略,改善非淹水土壤的离子传导效率,针对性解决土壤异质性、物质迁移受限问题,确保系统处于最佳工作状态;在工程实践方面,建立“污染修复–电能回收–环境监测”三位一体的应用模式,通过土壤有机污染(如石油烃)修复过程的电能回收,及元素循环调控过程CH4等温室气体减排产生的碳收益,平衡工程成本。
总之,未来随着材料科学、微生物学、电化学、环境工程等学科的不断发展和深度交叉融合,通过绿色材料研发、EAM功能调控、智能系统集成,有望将BES发展为成本可控、效能稳定的原位修复技术,使其在土壤环境中的应用更加广泛和深入。这一技术不仅有望为解决当前严峻的土壤污染问题提供创新路径,更将为保障土壤生态安全、维护农产品质量安全以及推动土壤资源的可持续利用提供重要的技术支撑与系统性解决方案。
| [1] |
Sleutels T H J A, Ter Heijne A, Buisman C J N, et al. Bioelectrochemical systems: An outlook for practical applications[J]. ChemSusChem, 2012, 5(6): 1012-1019 (  0) 0) |
| [2] |
Shao G H, Dong J, Zhang W H, et al. In situ bioelectrochemical remediation of contaminated soil and groundwater: A review[J]. Environmental Pollution, 2025, 374: 126250 (  0) 0) |
| [3] |
Lovley D R. Electromicrobiology[J]. Annual Review of Microbiology, 2012, 66: 391-409 (  0) 0) |
| [4] |
Lovley D R, Holmes D E. Electromicrobiology: The ecophysiology of phylogenetically diverse electroactive microorganisms[J]. Nature Reviews Microbiology, 2022, 20(1): 5-19 (  0) 0) |
| [5] |
Gupta D, Guzman M S, Bose A. Extracellular electron uptake by autotrophic microbes: Physiological, ecological, and evolutionary implications[J]. Journal of Industrial Microbiology & Biotechnology, 2020, 47(9): 863-876 (  0) 0) |
| [6] |
Yee M O, Deutzmann J, Spormann A, et al. Cultivating electroactive microbes—from field to bench[J]. Nanotechnology, 2020, 31(17): 174003 (  0) 0) |
| [7] |
Thapa B S, Kim T, Pandit S, et al. Overview of electroactive microorganisms and electron transfer mechanisms in microbial electrochemistry[J]. Bioresource Technology, 2022, 347: 126579 (  0) 0) |
| [8] |
Dulon S, Parot S, Delia M L, et al. Electroactive biofilms: New means for electrochemistry[J]. Journal of Applied Electrochemistry, 2007, 37(1): 173-179 (  0) 0) |
| [9] |
Richter H, Nevin K P, Jia H F, et al. Cyclic voltammetry of biofilms of wild type and mutant Geobacter sulfurreducens on fuel cell anodes indicates possible roles of OmcB, OmcZ, type Ⅳ pili, and protons in extracellular electron transfer[J]. Energy & Environmental Science, 2009, 2(5): 506 (  0) 0) |
| [10] |
Akram J, Song C, El Mashad H M, et al. Advances in microbial community, mechanisms and stimulation effects of direct interspecies electron transfer in anaerobic digestion[J]. Biotechnology Advances, 2024, 76: 108398 (  0) 0) |
| [11] |
Yan Y Q, Wang X. Ecological responses to substrates in electroactive biofilm: A review[J]. Science China Technological Sciences, 2019, 62(10): 1657-1669 (  0) 0) |
| [12] |
Martinez C M, Alvarez L H. Application of redox mediators in bioelectrochemical systems[J]. Biotechnology Advances, 2018, 36(5): 1412-1423 (  0) 0) |
| [13] |
Marsili E, Baron D B, Shikhare I D, et al. Shewanella secretes flavins that mediate extracellular electron transfer[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(10): 3968-3973 (  0) 0) |
| [14] |
Schröder U, Harnisch F, Angenent L T. Microbial electrochemistry and technology: Terminology and classification[J]. Energy & Environmental Science, 2015, 8(2): 513-519 (  0) 0) |
| [15] |
Pant D, Singh A, Van Bogaert G, et al. Bioelectrochemical systems (BES) for sustainable energy production and product recovery from organic wastes and industrial wastewaters[J]. RSC Advances, 2012, 2(4): 1248-1263 (  0) 0) |
| [16] |
Zhang Y F, Angelidaki I. Microbial electrolysis cells turning to be versatile technology: Recent advances and future challenges[J]. Water Research, 2014, 56: 11-25 (  0) 0) |
| [17] |
Almatouq A, Babatunde A O, Khajah M, et al. Microbial community structure of anode electrodes in microbial fuel cells and microbial electrolysis cells[J]. Journal of Water Process Engineering, 2020, 34: 101140 (  0) 0) |
| [18] |
Bajracharya S, Sharma M, Mohanakrishna G, et al. An overview on emerging bioelectrochemical systems (BESs): Technology for sustainable electricity, waste remediation, resource recovery, chemical production and beyond[J]. Renewable Energy, 2016, 98: 153-170 (  0) 0) |
| [19] |
Zhang J R, Jiao W T, Huang S, et al. Application of microbial fuel cell technology to the remediation of compound heavy metal contamination in soil[J]. Journal of Environmental Management, 2022, 320: 115670 (  0) 0) |
| [20] |
Yu X, Zhang X L, Yang S D, et al. Promoting soil management ways: Bioelectrochemical technology[J]. Resources, Environment and Sustainability, 2025, 19: 100191 (  0) 0) |
| [21] |
Li R X, Wang J N, Li T, et al. Recent advances in improving the remediation performance of microbial electrochemical systems for contaminated soil and sediments[J]. Critical Reviews in Environmental Science and Technology, 2023, 53(1): 137-160 (  0) 0) |
| [22] |
Domínguez-Garay A, Esteve-Núñez A. Designing strategies for operating Microbial Electrochemical Systems to clean up polluted soils under non-flooded conditions[J]. Bioelectrochemistry, 2018, 124: 142-148 (  0) 0) |
| [23] |
Kumari S, Rajput V D, Sushkova S, et al. Microbial electrochemical system: An emerging technology for remediation of polycyclic aromatic hydrocarbons from soil and sediments[J]. Environmental Geochemistry and Health, 2023, 45(12): 9451-9467 (  0) 0) |
| [24] |
Abbas S Z, Rafatullah M. Recent advances in soil microbial fuel cells for soil contaminants remediation[J]. Chemosphere, 2021, 272: 129691 (  0) 0) |
| [25] |
Jin S, Fallgren P H. Feasibility of using bioelectrochemical systems for bioremediation[M]//Microbial Biodegradation and Bioremediation. Amsterdam: Elsevier, 2014: 389–405.
(  0) 0) |
| [26] |
Nguyen V K, Park Y, Yu J, et al. Simultaneous arsenite oxidation and nitrate reduction at the electrodes of bioelectrochemical systems[J]. Environmental Science and Pollution Research, 2016, 23(19): 19978-19988 (  0) 0) |
| [27] |
Viggi C C, Tucci M, Resitano M, et al. Passive electrobioremediation approaches for enhancing hydrocarbons biodegradation in contaminated soils[J]. Science of the Total Environment, 2022, 845: 157325 (  0) 0) |
| [28] |
Tucci M, Cruz Viggi C, Esteve Núñez A, et al. Empowering electroactive microorganisms for soil remediation: Challenges in the bioelectrochemical removal of petroleum hydrocarbons[J]. Chemical Engineering Journal, 2021, 419: 130008 (  0) 0) |
| [29] |
Koch C, Harnisch F. Is there a specific ecological niche for electroactive microorganisms[J]. ChemElectroChem, 2016, 3(9): 1282-1295 (  0) 0) |
| [30] |
Logan B E, Rabaey K. Conversion of wastes into bioelectricity and chemicals by using microbial electrochemical technologies[J]. Science, 2012, 337(6095): 686-690 (  0) 0) |
| [31] |
Wang H M, Xing L Q, Zhang H H, et al. Key factors to enhance soil remediation by bioelectrochemical systems (BESs): A review[J]. Chemical Engineering Journal, 2021, 419: 129600 (  0) 0) |
| [32] |
Aulenta F, Tocca L, Verdini R, et al. Dechlorination of trichloroethene in a continuous-flow bioelectrochemical reactor: Effect of cathode potential on rate, selectivity, and electron transfer mechanisms[J]. Environmental Science & Technology, 2011, 45(19): 8444-8451 (  0) 0) |
| [33] |
Dai S X, Korth B, Schwab L, et al. Deciphering the fate of sulfate in one- and two-chamber bioelectrochemical systems[J]. Electrochimica Acta, 2022, 408: 139942 (  0) 0) |
| [34] |
Li T, Li R X, Zhou Q X. The application and progress of bioelectrochemical systems (BESs) in soil remediation: A review[J]. Green Energy & Environment, 2021, 6(1): 50-65 (  0) 0) |
| [35] |
Ringelberg D B, Foley K L, Reynolds C M. Electrogenic capacity and community composition of anodic biofilms in soil-based bioelectrochemical systems[J]. Applied Microbiology and Biotechnology, 2011, 90(5): 1805-1815 (  0) 0) |
| [36] |
Luo X S, Huang L Y, Cai X X, et al. Structure and core taxa of bacterial communities involved in extracellular electron transfer in paddy soils across China[J]. Science of the Total Environment, 2022, 844: 157196 (  0) 0) |
| [37] |
Coursolle D, Baron D B, Bond D R, et al. The Mtr respiratory pathway is essential for reducing flavins and electrodes in Shewanella oneidensis[J]. Journal of Bacteriology, 2010, 192(2): 467-474 (  0) 0) |
| [38] |
Saratale G D, Saratale R G, Shahid M K, et al. A comprehensive overview on electro-active biofilms, role of exo-electrogens and their microbial niches in microbial fuel cells (MFCs)[J]. Chemosphere, 2017, 178: 534-547 (  0) 0) |
| [39] |
Sun J, Li N, Yang P, et al. Simultaneous antibiotic degradation, nitrogen removal and power generation in a microalgae-bacteria powered biofuel cell designed for aquaculture wastewater treatment and energy recovery[J]. International Journal of Hydrogen Energy, 2020, 45(18): 10871-10881 (  0) 0) |
| [40] |
Castellano-Hinojosa A, González-Martínez A, Pozo C, et al. Diversity of electroactive and non-electroactive microorganisms and their potential relationships in microbial electrochemical systems: A review[J]. Journal of Water Process Engineering, 2022, 50: 103199 (  0) 0) |
| [41] |
Dunaj S J, Vallino J J, Hines M E, et al. Relationships between soil organic matter, nutrients, bacterial community structure, and the performance of microbial fuel cells[J]. Environmental Science & Technology, 2012, 46(3): 1914-1922 (  0) 0) |
| [42] |
Lovley D R. Bug juice: Harvesting electricity with microorganisms[J]. Nature Reviews Microbiology, 2006, 4(7): 497-508 (  0) 0) |
| [43] |
Cheng K Y, Karthikeyan R, Wong J W C. Microbial electrochemical remediation of organic contaminants[M]// Microbial Electrochemical Technology. Amsterdam: Elsevier, 2019: 613–640.
(  0) 0) |
| [44] |
Gebregiorgis Ambaye T, Vaccari M, Franzetti A, et al. Microbial electrochemical bioremediation of petroleum hydrocarbons (PHCs) pollution: Recent advances and outlook[J]. Chemical Engineering Journal, 2023, 452: 139372 (  0) 0) |
| [45] |
Lu L, Huggins T, Jin S, et al. Microbial metabolism and community structure in response to bioelectrochemically enhanced remediation of petroleum hydrocarbon-contaminated soil[J]. Environmental Science & Technology, 2014, 48(7): 4021-4029 (  0) 0) |
| [46] |
Lu L, Yazdi H, Jin S, et al. Enhanced bioremediation of hydrocarbon-contaminated soil using pilot-scale bioelectrochemical systems[J]. Journal of Hazardous Materials, 2014, 274: 8-15 (  0) 0) |
| [47] |
Zhang X L, Li X J, Zhao X D, et al. Bioelectric field accelerates the conversion of carbon and nitrogen in soil bioelectrochemical systems[J]. Journal of Hazardous Materials, 2020, 388: 121790 (  0) 0) |
| [48] |
Chandrasekhar K, Venkata Mohan S. Bio-electrochemical remediation of real field petroleum sludge as an electron donor with simultaneous power generation facilitates biotransformation of PAH: Effect of substrate concentration[J]. Bioresource Technology, 2012, 110: 517-525 (  0) 0) |
| [49] |
Sherafatmand M, Ng H Y. Using sediment microbial fuel cells (SMFCs) for bioremediation of polycyclic aromatic hydrocarbons (PAHs)[J]. Bioresource Technology, 2015, 195: 122-130 (  0) 0) |
| [50] |
Kronenberg M, Trably E, Bernet N, et al. Biodegradation of polycyclic aromatic hydrocarbons: Using microbial bioelectrochemical systems to overcome an impasse[J]. Environmental Pollution, 2017, 231: 509-523 (  0) 0) |
| [51] |
Yan C, Liang D D, Chen D H, et al. Integrating biochar granular with microbial fuel cell to enhance the remediation of polycyclic aromatic hydrocarbons contaminated soil[J]. Chemical Engineering Journal, 2024, 500: 157142 (  0) 0) |
| [52] |
Wang S, Shao Z G, Xu W D, et al. Insights into electro-bioremediation of PAH-contaminated soil under polarity reversal conditions: Effect of effective current intensity and soil properties on microbial function[J]. Chemical Engineering Journal, 2023, 478: 147493 (  0) 0) |
| [53] |
Meng L Y, Yoshida N, Li Z L. Soil microorganisms facilitated the electrode-driven trichloroethene dechlorination to ethene by Dehalococcoides species in a bioelectrochemical system[J]. Environmental Research, 2022, 209: 112801 (  0) 0) |
| [54] |
Cheng J, Liu M, Su X, et al. Conductive materials on biocathodes altered the electron-transfer paths and modulated γ-HCH dechlorination and CH4 production in microbial electrochemical systems[J]. Environmental Science & Technology, 2023, 57(7): 2739-2748 (  0) 0) |
| [55] |
Dai S X, Harnisch F, Morejón M C, et al. Microbial electricity-driven anaerobic phenol degradation in bioelectrochemical systems[J]. Environmental Science and Ecotechnology, 2024, 17: 100307 (  0) 0) |
| [56] |
Wick L Y, Shi L, Harms H. Electro-bioremediation of hydrophobic organic soil-contaminants: A review of fundamental interactions[J]. Electrochimica Acta, 2007, 52(10): 3441-3448 (  0) 0) |
| [57] |
Mohan H, Lim J M, Cho M, et al. Remediation of BTEX and Cr(Ⅵ) contamination in soil using bioelectrochemical system—an eco-friendly approach[J]. Environmental Science and Pollution Research, 2020, 27(1): 837-845 (  0) 0) |
| [58] |
Wang H, Cao X, Li L, et al. Augmenting atrazine and hexachlorobenzene degradation under different soil redox conditions in a bioelectrochemistry system and an analysis of the relevant microorganisms[J]. Ecotoxicology and Environmental Safety, 2018, 147: 735-741 (  0) 0) |
| [59] |
Li X J, Wang X, Weng L P, et al. Microbial fuel cells for organic-contaminated soil remedial applications: A review[J]. Energy Technology, 2017, 5(8): 1156-1164 (  0) 0) |
| [60] |
Gambino E, Chandrasekhar K, Nastro R A. SMFC as a tool for the removal of hydrocarbons and metals in the marine environment: A concise research update[J]. Environmental Science and Pollution Research, 2021, 28(24): 30436-30451 (  0) 0) |
| [61] |
Zhang J R, Liu Y Q, Sun Y L, et al. Effect of soil type on heavy metals removal in bioelectrochemical system[J]. Bioelectrochemistry, 2020, 136: 107596 (  0) 0) |
| [62] |
Mohanakrishna G, Al-Raoush R I, Abu-Reesh I M, et al. A microbial fuel cell configured for the remediation of recalcitrant pollutants in soil environment[J]. RSC Advances, 2019, 9(71): 41409-41418 (  0) 0) |
| [63] |
Hemdan B, Garlapati V K, Sharma S, et al. Bioelectrochemical systems-based metal recovery: Resource, conservation and recycling of metallic industrial effluents[J]. Environmental Research, 2022, 204: 112346 (  0) 0) |
| [64] |
Wang S Y, Adekunle A, Raghavan V. Bioelectrochemical systems-based metal removal and recovery from wastewater and polluted soil: Key factors, development, and perspective[J]. Journal of Environmental Management, 2022, 317: 115333 (  0) 0) |
| [65] |
Guan C Y, Hu A Y, Yu C P. Stratified chemical and microbial characteristics between anode and cathode after long-term operation of plant microbial fuel cells for remediation of metal contaminated soils[J]. Science of the Total Environment, 2019, 670: 585-594 (  0) 0) |
| [66] |
Li Y, Wu Y N, Liu B C, et al. Self-sustained reduction of multiple metals in a microbial fuel cell-microbial electrolysis cell hybrid system[J]. Bioresource Technology, 2015, 192: 238-246 (  0) 0) |
| [67] |
Li H K, Liu H, Nong Z X, et al. Heavy metal contaminated soil remediated by a bioelectrochemical system: Simultaneous promotion of electrochemically active bacteria and bipolar membrane[J]. Journal of Membrane Science, 2023, 668: 121266 (  0) 0) |
| [68] |
Wang H, Song H L, Yu R, et al. New process for copper migration by bioelectricity generation in soil microbial fuel cells[J]. Environmental Science and Pollution Research, 2016, 23(13): 13147-13154 (  0) 0) |
| [69] |
Tang J, Li Z J, Xiao X X, et al. Recent advancements in antibiotics removal by bio-electrochemical systems (BESs): From mechanisms to application of emerging combined systems[J]. Water Research, 2025, 268: 122683 (  0) 0) |
| [70] |
Zhao X D, Li X J, Li Y, et al. Shifting interactions among bacteria, fungi and Archaea enhance removal of antibiotics and antibiotic resistance genes in the soil bioelectrochemical remediation[J]. Biotechnology for Biofuels, 2019, 12(1): 160 (  0) 0) |
| [71] |
Gao S C, Fan X X, Zhang Z, et al. A dual-function mixed-culture biofilm for sulfadiazine removal and electricity production using bio-electrochemical system[J]. Biosensors and Bioelectronics, 2024, 263: 116552 (  0) 0) |
| [72] |
Liang B, Cheng H Y, Kong D Y, et al. Accelerated reduction of chlorinated nitroaromatic antibiotic chloramphenicol by biocathode[J]. Environmental Science & Technology, 2013, 47(10): 5353-5361 (  0) 0) |
| [73] |
Hazzan O O, Elendu C C, Kiki C, et al. Extracellular electron transfer-enhanced sulfamethoxazole biodegradation: Mechanisms and process strengthening[J]. Biochemical Engineering Journal, 2024, 211: 109484 (  0) 0) |
| [74] |
Wang R, Chen J P, Chen H Y. Metagenomic insights into efficiency and mechanism of antibiotic resistome reduction by electronic mediators-enhanced microbial electrochemical system[J]. Journal of Hazardous Materials, 2025, 488: 137350 (  0) 0) |
| [75] |
Shan X, Wang H T, Han M Z, et al. Bioelectrochemistry increases the risk of resistance genes proliferation and transfer with sulfamethoxazole pressure decreasing in constructed wetlands: An overlooked double-edged effect[J]. Journal of Hazardous Materials, 2025, 496: 139527 (  0) 0) |
| [76] |
Zhang Y F, Min B, Huang L P, et al. Electricity generation and microbial community response to substrate changes in microbial fuel cell[J]. Bioresource Technology, 2011, 102(2): 1166-1173 (  0) 0) |
| [77] |
Gustave W, Yuan Z F, Sekar R, et al. The change in biotic and abiotic soil components influenced by paddy soil microbial fuel cells loaded with various resistances[J]. Journal of Soils and Sediments, 2019, 19(1): 106-115 (  0) 0) |
| [78] |
Chen S S, Jing X Y, Yan Y L, et al. Bioelectrochemical fixation of nitrogen to extracellular ammonium by Pseudomonas stutzeri[J]. Applied and Environmental Microbiology, 2021, 87(5): e01998-20 (  0) 0) |
| [79] |
Pous N, Bañeras L, Corvini P F X, et al. Direct ammonium oxidation to nitrogen gas (Dirammox) in Alcaligenes strain HO-1: The electrode role[J]. Environmental Science and Ecotechnology, 2023, 15: 100253 (  0) 0) |
| [80] |
Blázquez E, Guisasola A, Gabriel D, et al. Application of bioelectrochemical systems for the treatment of wastewaters with sulfur species[M]//Microbial Electrochemical Technology. Amsterdam: Elsevier, 2019: 641–663.
(  0) 0) |
| [81] |
Wang Y C, Kuntke P, Saakes M, et al. Electrochemically mediated precipitation of phosphate minerals for phosphorus removal and recovery: Progress and perspective[J]. Water Research, 2022, 209: 117891 (  0) 0) |
| [82] |
Yang H Y, Hou N N, Wang Y X, et al. Mixed-culture biocathodes for acetate production from CO2 reduction in the microbial electrosynthesis: Impact of temperature[J]. Science of the Total Environment, 2021, 790: 148128 (  0) 0) |
| [83] |
Dai S X, Korth B, Vogt C, et al. Microbial electrochemical oxidation of anaerobic digestion effluent from treating HTC process water[J]. Frontiers in Chemical Engineering, 2021, 3: 652445 (  0) 0) |
| [84] |
Zhang L, Jiang M H, Zhou S G. Conversion of nitrogen and carbon in enriched paddy soil by denitrification coupled with anammox in a bioelectrochemical system[J]. Journal of Environmental Sciences, 2022, 111: 197-207 (  0) 0) |
| [85] |
Prévoteau A, Rabaey K. Electroactive biofilms for sensing: Reflections and perspectives[J]. ACS Sensors, 2017, 2(8): 1072-1085 (  0) 0) |
| [86] |
Funari R, Shen A Q. Detection and characterization of bacterial biofilms and biofilm-based sensors[J]. ACS Sensors, 2022, 7(2): 347-357 (  0) 0) |
| [87] |
Tsipa A, Varnava C K, Grenni P, et al. Bio-electrochemical system depollution capabilities and monitoring applications: Models, applicability, advanced bio-based concept for predicting pollutant degradation and microbial growth kinetics via gene regulation modelling[J]. Processes, 2021, 9(6): 1038 (  0) 0) |
| [88] |
Do M H, Ngo H H, Guo W S, et al. Microbial fuel cell-based biosensor for online monitoring wastewater quality: A critical review[J]. Science of the Total Environment, 2020, 712: 135612 (  0) 0) |
| [89] |
Gubin A, Sukhanov P, Kushnir A, et al. Monitoring of phenols in natural waters and bottom sediments: Preconcentration on a magnetic sorbent, GC–MS analysis, and weather observations[J]. Chemical Papers, 2021, 75(4): 1445-1456 (  0) 0) |
| [90] |
Huang S J, Shen M M, Ren Z J, et al. Long-term in situ bioelectrochemical monitoring of biohythane process: Metabolic interactions and microbial evolution[J]. Bioresource Technology, 2021, 332: 125119 (  0) 0) |
| [91] |
Abbas S Z, Wang J Y, Wang H C, et al. Recent advances in soil microbial fuel cells based self-powered biosensor[J]. Chemosphere, 2022, 303: 135036 (  0) 0) |
| [92] |
Ambaye T G, Formicola F, Sbaffoni S, et al. Insights into rhamnolipid amendment towards enhancing microbial electrochemical treatment of petroleum hydrocarbon contaminated soil[J]. Chemosphere, 2022, 307: 136126 (  0) 0) |
| [93] |
Guan C Y, Tseng Y H, Tsang D C W, et al. Wetland plant microbial fuel cells for remediation of hexavalent chromium contaminated soils and electricity production[J]. Journal of Hazardous Materials, 2019, 365: 137-145 (  0) 0) |
| [94] |
姜允斌, 钟文辉, 薛洪婧, 等. 土壤微生物产电信号评价芘污染毒性的研究[J]. 土壤学报, 2014, 51(6): 1332-1341 (  0) 0) |
| [95] |
Lam B R, Barge L M, Noell A C, et al. Detecting endogenous microbial metabolism and differentiating between abiotic and biotic signals observed by bioelectrochemical systems in soils[J]. Astrobiology, 2020, 20(1): 39-52 (  0) 0) |
| [96] |
Williams K H, Nevin K P, Franks A, et al. Electrode-based approach for monitoring in situ microbial activity during subsurface bioremediation[J]. Environmental Science & Technology, 2010, 44(1): 47-54 (  0) 0) |
| [97] |
Wang H, Lu L, Mao D Q, et al. Dominance of electroactive microbiomes in bioelectrochemical remediation of hydrocarbon-contaminated soils with different textures[J]. Chemosphere, 2019, 235: 776-784 (  0) 0) |
| [98] |
Logan B E, Rossi R, Ragab A, et al. Electroactive microorganisms in bioelectrochemical systems[J]. Nature Reviews Microbiology, 2019, 17(5): 307-319 (  0) 0) |
| [99] |
He Y T, Fu Q, Pang Y, et al. Customizable design strategies for high-performance bioanodes in bioelectrochemical systems[J]. iScience, 2021, 24(3): 102163 (  0) 0) |
| [100] |
Slate A J, Whitehead K A, Brownson D A C, et al. Microbial fuel cells: An overview of current technology[J]. Renewable and Sustainable Energy Reviews, 2019, 101: 60-81 (  0) 0) |
| [101] |
Goglio A, Tucci M, Rizzi B, et al. Microbial recycling cells (MRCs): A new platform of microbial electrochemical technologies based on biocompatible materials, aimed at cycling carbon and nutrients in agro-food systems[J]. Science of the Total Environment, 2019, 649: 1349-1361 (  0) 0) |
| [102] |
Zhu L J, Wang H, Li S F, et al. Horizontal carbon fiber brush amendment and maximum radius of influence prediction: A novel soil bioelectrochemical system for extending the range of petroleum hydrocarbons degradation[J]. Environmental Technology & Innovation, 2023, 30: 103035 (  0) 0) |
| [103] |
Yu B, Li Y H, Feng L. Enhancing the performance of soil microbial fuel cells by using a bentonite-Fe and Fe3O4 modified anode[J]. Journal of Hazardous Materials, 2019, 377: 70-77 (  0) 0) |
| [104] |
Yu B, Feng L, He Y L, et al. Effects of anode materials on the performance and anode microbial community of soil microbial fuel cell[J]. Journal of Hazardous Materials, 2021, 401: 123394 (  0) 0) |
| [105] |
Kerzenmacher S. Engineering of microbial electrodes[M]// Bioelectrosynthesis. Cham: Springer International Publishing, 2017: 135–180.
(  0) 0) |
| [106] |
Camedda C, Hoelzle R D, Carucci A, et al. A facile method to enhance the performance of soil bioelectrochemical systems using in situ reduced graphene oxide[J]. Electrochimica Acta, 2019, 324: 134881 (  0) 0) |
| [107] |
Cruz Viggi C, Presta E, Bellagamba M, et al. The "Oil-Spill Snorkel": An innovative bioelectrochemical approach to accelerate hydrocarbons biodegradation in marine sediments[J]. Frontiers in Microbiology, 2015, 6: 881 (  0) 0) |
| [108] |
Cai X X, Yuan Y, Yu L P, et al. Biochar enhances bioelectrochemical remediation of pentachlorophenol-contaminated soils via long-distance electron transfer[J]. Journal of Hazardous Materials, 2020, 391: 122213 (  0) 0) |
| [109] |
Li X J, Wang X, Zhao Q, et al. Carbon fiber enhanced bioelectricity generation in soil microbial fuel cells[J]. Biosensors and Bioelectronics, 2016, 85: 135-141 (  0) 0) |
| [110] |
Tong H, Hu M, Li F B, et al. Biochar enhances the microbial and chemical transformation of pentachlorophenol in paddy soil[J]. Soil Biology and Biochemistry, 2014, 70: 142-150 (  0) 0) |
| [111] |
Chen X D, Han T, Miao X Y, et al. Ferrihydrite enhanced the electrogenic hydrocarbon degradation in soil microbial electrochemical remediation[J]. Chemical Engineering Journal, 2022, 446: 136901 (  0) 0) |
| [112] |
Domínguez-Garay A, Berná A, Ortiz-Bernad I, et al. Silica colloid formation enhances performance of sediment microbial fuel cells in a low conductivity soil[J]. Environmental Science & Technology, 2013, 47(4): 2117-2122 (  0) 0) |
| [113] |
Domínguez-Garay A, Boltes K, Esteve-Núñez A. Cleaning-up atrazine-polluted soil by using microbial electroremediating cells[J]. Chemosphere, 2016, 161: 365-371 (  0) 0) |
| [114] |
Huang D Y, Zhou S G, Chen Q, et al. Enhanced anaerobic degradation of organic pollutants in a soil microbial fuel cell[J]. Chemical Engineering Journal, 2011, 172(2/3): 647-653 (  0) 0) |
2. University of Chinese Academy of Sciences, Nanjing, Nanjing 211135, China
 2025, Vol. 57
2025, Vol. 57


