2016年,在转基因商业化种植的第21年,有26个国家种植了1.851亿hm2转基因作物,比2015年增长了540万hm2[1-2]。苏云金芽孢杆菌(Bt)由日本科学家Shigetane Ishiwatari于1901年发现[3],1911年,Ernst Berliner从患病的地中海粉斑螟(Ephestia kuehniella)幼虫中分离得到也能产这种伴孢晶体的芽孢杆菌,并命名为苏云金芽孢杆菌(Bacillus thuringiensis)[4]。Bt毒素通过蛋白水解活化,导致细胞膜产生孔隙,造成溶质流出肠上皮细胞而使水流入细胞,进而造成昆虫死亡[5-7]。浙江大学研发的玉米品种瑞丰1号-双抗-12-5(RF1-12-5)含有抗虫基因cry1Ab/cry2Aj和耐除草剂基因G10evo、cry1Ab/ cry2Aj,表达的Bt蛋白不仅能有效杀灭亚洲玉米螟,在一定程度上还可以降低其他鳞翅目害虫的危害。
起初Bt蛋白被直接作为杀虫剂使用,随着转基因技术发展,Bt基因在生物育种领域得到广泛应用。2001年,表达Cry1F蛋白的玉米品种由美国人Pioneer和Dow共同研发成功。2016年,全球转基因玉米的应用率为26%,其中美国种植了3 505万hm2,应用率达到了92%[1]。从2006年开始,为了满足消费者多样化的需求,复合性状转基因作物得到研发并开始大规模种植[8-9]。2016年,复合性状转基因作物占全球转基因作物种植面积的41%[2]。复合性状产品在抗虫、抗除草剂、抗旱、抗涝、抗盐以及营养性状改良等多方向的性状改良呈加速发展的态势。
土壤酶活性及土壤微生物直接影响土壤生化过程的效率[10],影响土壤发育与成熟的过程,是评价土壤状况的重要因素。而RF1-12-5的应用又可以大量减少化学农药的使用,提高玉米产量。目前,关于转Bt基因玉米对土壤微生物及酶活性的研究时有报道[11-13],但许多都限于温室盆栽试验。本研究选择在大田进行试验,可以更确切地探究现实农业生产中的情况,通过测定RF1-12-5对根际土壤微生物和酶活性的影响,可以为RF1-12-5的环境释放提供科学的数据支持。
1 材料与方法 1.1 试验材料供试转基因抗虫耐除草剂玉米品种瑞丰1号-双抗-12-5(简称RF1-12-5)由浙江大学提供,其非转基因对照为瑞丰1号(简称RF1)。试验在农业部转基因植物环境安全监督检验检测中心(济南)的实验田进行,土壤为褐土。5种土壤酶测定试剂盒购自苏州科铭生物技术有限公司,ECO PlateTM 96孔板(31种碳源)购自Biolog公司。
1.2 试验方法 1.2.1 试验设计试验设置RF1-12-5、RF1种植及未种植玉米的空白对照3个处理,每个处理3次重复[14],小区面积为30 m×5 m,小区随机分布,小区间设置1 m隔离带。按常规管理模式进行管理。每个小区将1株玉米作为1个取样点,进行对角线5点取样,仔细收集根际土壤,5点合为1个样品混匀。分别在玉米6 ~ 8叶期、大喇叭口期、抽雄期、乳熟期、收获期进行取样。土壤样品取回后自然风干,去除碎石块、杂草、碎砖块及秸秆等杂物,捣碎,混匀,过20目筛,-80℃冻存,待测。
1.2.2 酶活性测定土壤碱性蛋白酶、过氧化氢酶、碱性磷酸酶、脲酶和酸性转化酶均通过水解底物产生颜色变化,使用比色法进行活性测定[15]。以1 d内1 g土壤产生1 mg酪氨酸为1个土壤碱性蛋白酶活力单位;以1 d内1 g风干土样催化1 μmol过氧化氢作为1个过氧化氢酶活力单位;以1 g土壤1 d释放1 nmol酚为1个土壤碱性磷酸酶活力单位;以1 d中1 g土样中产生1 μg NH3-N作为一个酶活力单位;以1 d内1 g土样中产生1 mg还原糖作为一个土壤酸性转化酶活性单位。
1.2.3 根际土壤微生物多样性测定采用Biolog法测定根际土壤微生物多样性。称取25 g土壤样品于500 ml锥形瓶中,加入灭菌生理盐水稀释到250 ml (为10-1稀释),摇床200 r/min摇动20 min,室温沉降30 min,加入灭菌生理盐水稀释到10-3。将稀释后菌悬液加入ECO板微孔中,每孔150 μl。然后将ECO板放入25℃培养箱,放置水盒,确保培养箱的饱和湿度。每隔24 h对ECO板用Biolog Microstation在590 nm和750 nm下进行读数,共进行7次[16]。使用Microlog软件进行数据转化,使用Excel软件制作公式,进行Shannon多样性指数、McIntosh均匀度指数、Simpson优势度指数的计算,公式如表 1所示[17-18]。使用DPS软件进行各项指数的差异显著性分析,使用SPSS软件进行主成分分析[19]。
|
|
表 1 微生物群落多样性指数功能与计算公式 Table 1 Function and calculation formula of diversity indexes of microbial community |
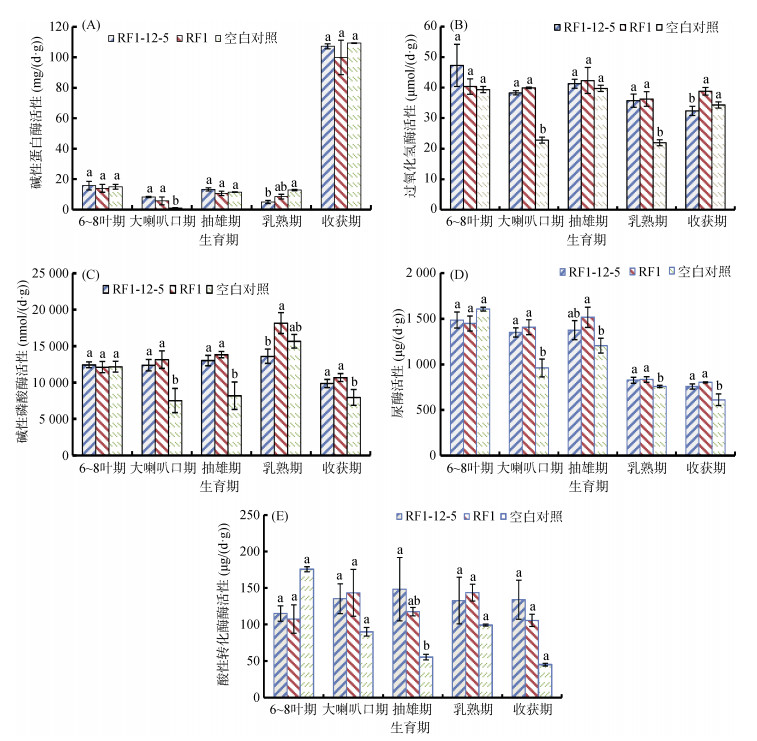
由图 1A看出,前4个生育期,RF1-12-5、RF1、对照3个处理根际土壤碱性蛋白酶活性均呈现无规律性地增减,但增减幅度较小,酶活性在0 ~ 20 mg/(d·g)变动;收获期,3个处理碱性蛋白酶活性激增,达到100 mg/(d·g)以上。从方差分析结果看,在5个时期,RF1-12-5与RF1处理根际土壤碱性蛋白酶活性均没有显著性差异;在大喇叭口期,RF1-12-5与RF1处理根际土壤碱性蛋白酶活性显著高于对照;乳熟期,RF1-12-5处理显著低于对照。
|
(图中不同小写字母表示同-生育期不同处理间差异在P < 0.05水平显著,下同) 图 1 不同生育期玉米根际土壤酶活性 Fig. 1 Enzyme activities in rhizosphere soils of maize at different growth stages |
由图 1B看出,在5个生育期,RF1-12-5、RF1处理及对照根际土壤过氧化氢酶活性均呈现无规律波动状态。在前4个时期,RF1-2-5与RF1处理根际土壤过氧化氢酶活性差异均不显著,在大喇叭口和乳熟期,RF1-12-5、RF1处理根际土壤过氧化氢酶活性显著高于与对照;在收获期,RF1-12-5根际土壤过氧化氢酶活性低于RF1处理和对照,且差异显著。
由图 1C看出,玉米种植处理根际土壤碱性磷酸酶活性在多个生育期均高于对照,说明玉米种植对该酶变化有一定影响。RF1-12-5处理酶活性在前4个时期比较稳定,乳熟期RF1处理酶活性增加明显,收获期3个处理酶活性下降至整个生育期最低。经检验,除了乳熟期RF1-12-5与RF1处理差异显著外,其他时期RF1-12-5与RF1处理根际土壤碱性磷酸酶活性差异不显著。
由图 1D看出,根际土壤脲酶活性在前3个时期呈现较为稳定的状态,酶活性较高;乳熟期及收获期酶活性明显下降,且这2个时期酶活性变化不大。经检验,5个时期RF1-12-5与RF1处理根际土壤脲酶活性差异均不显著;除6 ~ 8叶期外,其他时期二者脲酶活性均高于对照,差异显著。
由图 1E看出,在5个生育期,RF1-12-5与RF1处理根际土壤酸性转化酶活性比较稳定,波动幅度不大;对照土壤中酸性转化酶活性在6 ~ 8叶期最高,之后呈现下降、上升再下降的波动。经检验,5个时期RF1-12-5与RF1处理根际土壤酸性转化酶活性均没有显著性差异;仅在抽雄期,RF1-12-5处理玉米根际土壤酸性转化酶活性显著高于对照。
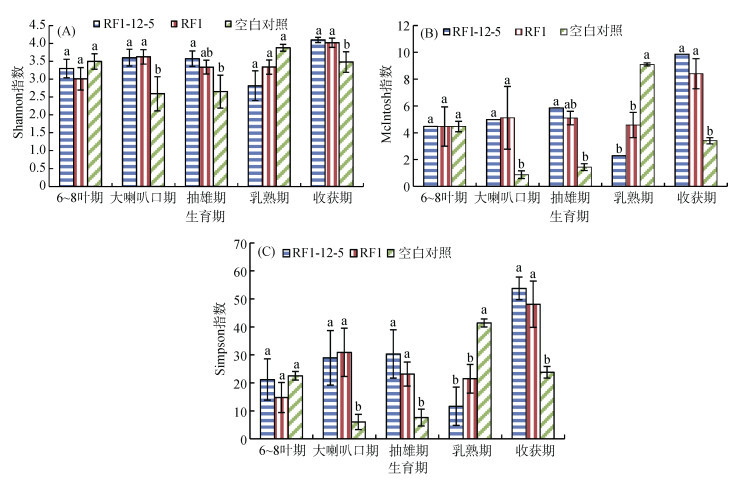
2.2 RF1-12-5对根际土壤微生物功能多样性的影响Shannon多样性指数能够指示一个地区种群的丰富度。从图 2A可以看出,整个生育期3个处理根际土壤微生物Shannon指数波动幅度较小。在5个时期,RF1-12-5与RF1处理Shannon指数均没有显著性差异;在大喇叭口期、抽雄期和收获期,RF1-12-5与RF1处理Shannon指数显著高于未种植玉米对照。
|
图 2 不同生育期玉米根际土壤微生物功能多样性 Fig. 2 Diversity indexes in rhizosphere soils of maize at different growth stages |
McIntosh均匀度指数能够评价群落内部物种数量的均匀程度。由图 2B可以看出,3个处理不同生育期根际土壤McIntosh指数波动较大。在6 ~ 8叶期,3种处理McIntosh指数相当;至大喇叭口期和抽雄期,RF1-12-5与RF1处理McIntosh指数变化不大,而对照McIntosh指数大幅降低,与其他两种处理差异显著;至乳熟期,RF1-12-5与RF1处理McIntosh指数降低,而对照大幅增加,与RF1-12-5与RF1处理差异显著;至收获期,RF1-12-5与RF1处理McIntosh指数大幅增加,而对照则大幅降低,显著低于RF1-12-5与RF1处理。总体看,在整个生育期中,RF1-12-5与RF1处理McIntosh指数差异均不显著;在大喇叭口期、抽雄期和收获期,RF1-12-5与RF1处理McIntosh指数显著高于未种植对照,在乳熟期则相反,显著低于对照。
Simpson优势度指数指一个群落中常见物种在该群落中的优势程度。从图 2C可以看出,3个处理根际土壤微生物Simpson指数变化趋势有所不同。RF1-12-5处理Simpson指数在前3个生育期波动幅度较小,在乳熟期显著降低,而收获期显著增高;RF1处理在前4个生育期波动幅度较小,在收获期显著增加;对照在大喇口期和抽雄期最低,6 ~ 8叶期和收获期相当,高于大喇口期和抽雄期,乳熟期Simpson指数最高。在5个时期,RF1-12-5与RF1处理根际土壤微生物Simpson指数均没有显著性差异;在乳熟期,RF1-12-5处理Simpson指数显著低于对照,在收获期则相反,显著高于对照。
使用RF1-12-5与RF1处理根际土壤和对照土壤进行微生物群落培养96 h后ECO板得到的吸光度值做主成分分析,得到了3个土壤主要成分的方差贡献率及累积贡献率,如表 2所示。前14种成分的方差贡献率达到了100%,前2种主要成分的累积贡献率达到了69.69%。
|
|
表 2 前14种主要成分的方差贡献率和累积贡献率 Table 2 Variance contribution rates and cumulative contribution rates of 14 major components |
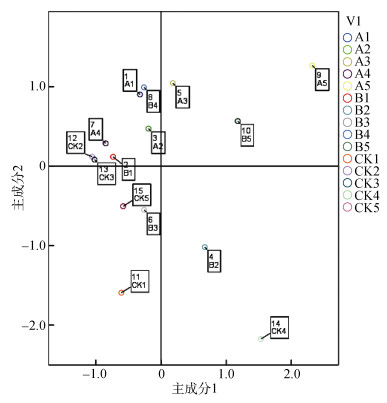
以前2个主成分作为横纵坐标,进行作图,可以直观反映出微生物群落对这两种主成分的利用情况。如图 3所示,可以清楚地看出3种处理在5个生育期对2种主成分碳源的利用情况,两点之间距离越近越能说明两者之间对于碳源的利用情况相似。由图 3看出,不同的象限中均有数据分布,在第二象限中数据分布最为密集,有明显的聚类特征,A1与B1、A4与B4均集中在此象限,A5和B5均集中在第一象限,表明在6 ~ 8叶期、乳熟期、收获期3个生育期RF1-12-5和RF1处理对前两种主成分利用相当,同时它们对应的对照则分布在不同象限,表明这3个生育期种植玉米处理和未种植玉米对照之间对碳源的利用差异显著。在大喇叭口期和抽雄期不同处理之间差异明显,A2、CK2和B2分别在第二和第四象限,A3、B3、CK3分别在第一、第三和第二象限,3个处理之间数据比较分散,说明这两个生育期不同处理对碳源的利用差异较大,但总体来说看,这种差异没有表现出明显的聚类特征,因此,也未表现明显的规律性。
|
(A1 ~ A5、B1 ~ B5、CK1 ~ CK5分别表示RF-12-5、RF1处理及对照所对应的玉米6 ~ 8叶期、大喇叭口期、抽雄期、乳熟期、收获期) 图 3 不同时期根际土壤微生物群落代谢主成分分析 Fig. 3 Principal component analysis of metabolic principal components of microbial communities in rhizosphere soils of maize at different growth stages |
酶作为高效催化剂,在生化反应中起到关键作用。土壤中酶的催化作用控制着土壤中的生物化学进程,进而影响着土壤物质转化与能量循环的效率,因此,土壤酶的活性在生态系统中起到很大的作用[20-21],同样,土壤酶活性受环境影响很大,如温度、水分、种植模式等均会影响到土壤酶活性[22-24]。本研究发现,除了过氧化氢酶在收获期、碱性磷酸酶在乳熟期转基因玉米RF1-12-5处理和非转基因玉米RF1处理表现出差异,其他酶活性在玉米的不同生育期RF1-12-5处理与RF1处理均未表现出显著差异。推断出现偶然性差异的原因,可能与生育期不同,外界环境不同有关。颜世磊等[25]同样发现,转Bt基因玉米对土壤酶活性影响产生差异主要是玉米生育期不同造成的,并没有观察到转基因玉米种植对土壤酶活性带来的显著影响。本研究还显示,空白对照土壤酶活性在相应的不同生育期间波动较大,种植玉米处理酶活性波动幅度相对较小,使土壤活性成分更加趋于稳定,这也会增加土壤应对环境变化的能力,有利于玉米的生长。研究显示长期冬种绿肥可以显著改变红壤稻田土壤微生物生物量[26],棉花种植会增强土壤微生物活性,因此使土壤的酶活性普遍增加,这种作用可以抵消Bt毒素对微生物活性和酶活性可能的负面影响[27]。
本研究表明,转基因玉米RF-12-5根际土壤微生物的生物多样性指数、均匀性指数和优势度指数与其亲本对照RF1根际土壤相比,差异均不显著,表明RF-12-5的种植并没有给玉米根际微生物功能多样性带来不利影响。Shen等[28]研究发现,在任何生长阶段和收获后Bt和非Bt棉根际土壤微生物群落丰富度没有差异,接近于未种植对照土壤;Bt棉和非Bt棉根际土壤微生物群落的功能多样性没有差异。本研究还发现,在种植玉米的土壤中,在多个时期土壤微生物群落的功能多样性指数要比未种植玉米对照土壤高。蔚霞[29]发现转Bt基因水稻秸秆还田后物种的丰富度指数、优势度指数和McIntosh指数均大于常规水稻。这说明玉米的种植会增加土壤微生物的多样性,这可能与玉米根系分泌物比较丰富,能够改善根际土壤的微生物环境有关。
从主成分分析结果来看,在玉米生长的6 ~ 8叶期、乳熟期及收获期,这3个生育期外界环境相对稳定,玉米生长比较平稳,玉米根系分泌物相对较少,因此,转基因玉米RF1-12-5与非转基因玉米RF1根际土壤微生物对碳源的利用差异较小,而进入7、8月份,由于降雨频繁,环境变化大,玉米进入快速生长期,根系分泌物增多,因此微生物种群活跃,对碳源的利用也表现出了差异。但是从数据分析来看,这种差异与外源基因的导入没有明显的关系。
土壤作为矿物、有机物、气体、液体和无数生物的混合物,成分复杂,受到气候环境影响大,性质变化复杂,目前对于土壤微生物及活性成分的研究较少,尤其对于不同地理环境的探究还有待深入。因此还需要进一步增加不同地域、不同时间的研究,以此增加转基因作物的环境评价数据,为转基因玉米的环境释放提供更有力的数据支持。
4 结论RF1-12-5除了过氧化氢酶在收获期、碱性磷酸酶在乳熟期酶活性显著低于RF1,二者根际土壤碱性蛋白酶、脲酶、酸性转化酶、过氧化氢酶、碱性磷酸酶酶活性在其他各生育期差异均不显著;RF1-12-5与RF1根际土壤微生物群落的Shannon多样性指数、McIntosh均匀度指数和Simpson优势度指数均不存在显著性差异,主成分分析未发现RF1-12-5与RF1对土壤微生物功能多样性影响存在规律性差异。
| [1] |
Clive James. 2016年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2017, 37(4): 1-8 (  0) 0) |
| [2] |
Clive James. 2015年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2016, 36(4): 1-11 (  0) 0) |
| [3] |
吴新, 包梦醒. Bt抗虫基因在作物中的应用[J]. 粮食与食品工业, 2014, 21(5): 74-78 DOI:10.3969/j.issn.1672-5026.2014.05.022 (  0) 0) |
| [4] |
彭昌文. Bt研究概况及进展[J]. 曲阜师范大学学报, 2002, 28(3): 85-88 DOI:10.3969/j.issn.1001-5337.2002.03.026 (  0) 0) |
| [5] |
Sanahuja G, Banakar R, Twyman R M, Capell T, Christou P. Bacillus thuringiensis: A century of research, development and commercial applications[J]. Plant Biotechnology Journal, 2011, 9(3): 283-300 DOI:10.1111/pbi.2011.9.issue-3 (  0) 0) |
| [6] |
乔文静.转基因生物Bt蛋白降解技术研究[D].重庆: 西南大学, 2010 http://cdmd.cnki.com.cn/article/cdmd-10635-2010094496.htm
(  0) 0) |
| [7] |
刘新颖.转Bt基因玉米对土壤动物群落结构的影响[D].哈尔滨: 哈尔滨师范大学, 2016 http://cdmd.cnki.com.cn/Article/CDMD-10231-1016083100.htm
(  0) 0) |
| [8] |
沈平, 武玉花, 梁晋刚, 等. 转基因作物发展及应用概述[J]. 中国生物工程杂志, 2017, 37(1): 119-128 (  0) 0) |
| [9] |
左娇, 郭运玲, 孔华, 等. 转基因玉米安全性评价研究进展[J]. 玉米科学, 2014, 22(1): 73-78 DOI:10.3969/j.issn.1005-0906.2014.01.013 (  0) 0) |
| [10] |
王理德, 王方琳, 郭春秀, 等. 土壤酶学研究进展[J]. 土壤, 2016, 48(1): 12-21 (  0) 0) |
| [11] |
刘玲.转Bt基因玉米对土壤微生物多样性的影响[D].兰州: 甘肃农业大学, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10733-1012000027.htm
(  0) 0) |
| [12] |
王建武, 冯远娇, 骆世明. Bt玉米秸秆分解对土壤酶活性和土壤肥力的影响[J]. 应用生态学报, 2005, 16(3): 524-528 DOI:10.3321/j.issn:1001-9332.2005.03.026 (  0) 0) |
| [13] |
刘凯, 李永山, 范巧兰, 等. 转基因玉米对土壤微生物群系的影响[J]. 山西农业科学, 2015(9): 1138-1140, 1164 DOI:10.3969/j.issn.1002-2481.2015.09.18 (  0) 0) |
| [14] |
郭维维.转基因玉米和水稻对土壤螨类和线虫群落组成及数量动态的影响研究[D].南京: 南京农业大学, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10307-1016038559.htm
(  0) 0) |
| [15] |
周礼恺, 张志明. 土壤酶活性的测定方法[J]. 土壤通报, 1980, 11(5): 37-38, 49 (  0) 0) |
| [16] |
姬艳艳, 张贵龙, 张瑞, 等. 耕作方式对农田土壤微生物功能多样性的影响[J]. 中国农学通报, 2013(6): 117-123 DOI:10.3969/j.issn.1000-6850.2013.06.022 (  0) 0) |
| [17] |
尹艳宁.抗虫转基因棉花对土壤微生物群落结构和功能多样性的影响[D].南京: 南京农业大学, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10307-1016037721.htm
(  0) 0) |
| [18] |
储成.转基因抗虫棉对土壤微生物多样性的影响[D].南京: 南京师范大学, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10319-1013105351.htm
(  0) 0) |
| [19] |
罗希茜, 郝晓晖, 陈涛, 等. 长期不同施肥对稻田土壤微生物群落功能多样性的影响[J]. 生态学报, 2009, 29(2): 740-748 DOI:10.3321/j.issn:1000-0933.2009.02.024 (  0) 0) |
| [20] |
万忠梅, 宋长春. 土壤酶活性对生态环境的响应研究进展[J]. 土壤通报, 2009, 40(4): 951-956 (  0) 0) |
| [21] |
唐玉姝, 魏朝富, 颜廷梅, 等. 土壤质量生物学指标研究进展[J]. 土壤, 2007, 39(2): 157-163 DOI:10.3321/j.issn:0253-9829.2007.02.002 (  0) 0) |
| [22] |
王丽娟, 李刚, 赵建宁, 等. 转基因大豆对根际土壤微生物群落功能多样性的影响[J]. 农业环境科学学报, 2013, 32(2): 290-298 (  0) 0) |
| [23] |
代会会, 胡雪峰, 曹明阳, 等. 豆科间作对番茄产量、土壤养分及酶活性的影响[J]. 土壤学报, 2015, 52(4): 911-918 (  0) 0) |
| [24] |
张旭龙, 马淼, 吴振振, 等. 油葵与光果甘草间作对根际土壤酶活性及微生物功能多样性的影响[J]. 土壤, 2016, 48(6): 1114-1119 (  0) 0) |
| [25] |
颜世磊, 赵蕾, 孙红炜, 等. 大田环境下转Bt基因玉米对土壤酶活性的影响[J]. 生态学报, 2011, 31(15): 4244-4250 (  0) 0) |
| [26] |
高嵩涓, 曹卫东, 白金顺, 等. 长期冬种绿肥改变红壤稻田土壤微生物生物量特性[J]. 土壤学报, 2015, 52(4): 902-910 (  0) 0) |
| [27] |
Sun C X, Chen L J, Wu Z J, et al. Soil persistence of Bacillus thuringiensis (Bt) toxin from transgenic Bt cotton tissues and its effect on soil enzyme activities[J]. Biology and Fertility of Soils, 2007, 43(5): 617-620 DOI:10.1007/s00374-006-0158-6 (  0) 0) |
| [28] |
Shen R F, Cai H, Gong W H. Transgenic Bt cotton has no apparent effect on enzymatic activities or functional diversity of microbial communities in rhizosphere soil[J]. Plant and Soil, 2006, 285: 149-159 DOI:10.1007/s11104-006-9000-z (  0) 0) |
| [29] |
蔚霞.转Bt基因水稻秸秆还田对水稻土反硝化作用和微生物多样性的影响[D].武汉: 华中农业大学, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10504-1012457984.htm
(  0) 0) |
 2019, Vol. 51
2019, Vol. 51


