2. 中国科学院大学,北京 100049;
3. 江苏省地质调查研究院,南京 210018
土壤重金属污染是我国面临的一个严峻的环境问题。《全国土壤污染状况调查公报》显示,Cd、Hg、As、Cu、Pb、Cr、Zn、Ni 8种无机污染物点位超标率分别为7.0%、1.6%、2.7%、2.1%、1.5%、1.1%、0.9%、4.8%[1]。重金属进入土壤后,会影响土壤微生物的活动,导致土壤肥力下降,引起农作物产量、品质下降,最终经食物链在人体内累积,对人体健康形成危害[2]。目前,重金属污染农田土壤修复的技术可分为两大类:一类以降低污染风险为目的,即通过改变重金属在土壤中的化学形态或与土壤的结合形式,降低其在环境中的移动性与生物有效性;另一种以削减重金属总量为目的,即通过将重金属从土壤中去除,从而减少其在土壤中的总浓度[3]。化学钝化修复属于前一类修复技术,其主要通过向土壤中施加钝化材料来改变重金属的形态从而降低其移动性和生物有效性,因其具有投入低、修复快速、操作简单等特点,对大面积中低度污染土壤的修复具有较好的优越性,得到广泛的应用[2-4]。
化学钝化修复重金属污染土壤只改变了重金属在土壤中的赋存形态,但重金属仍保留在土壤中,环境条件(渗滤、风化、酸化、温度和生物等)的改变均可能会引起重金属的再次释放[5]。研究表明,钝化剂维持好的修复效果仅在有限时间内,因此钝化剂的持久性对于降低土壤中重金属有效性是非常重要的[6],而长期添加钝化剂可能会导致土壤结构的破坏,最终影响食品质量安全[7-8]。例如,对于石灰这类通过改变土壤pH来固定重金属的碱性钝化材料来说,当环境条件发生改变时,被暂时钝化的重金属将会被重新活化,这种修复措施需要不断地输入钝化修复剂来维护修复效果, 而长期大量使用将造成土壤微量营养元素的缺乏[6, 9]。钝化修复的持久性通常与土壤类型、土壤中重金属含量、钝化剂的添加量和添加频率有关[10]。所以在进行重金属污染土壤长期钝化修复时,找到合适的钝化剂、最佳的添加量和添加频次是非常重要的[11]。因此,进行钝化剂固定重金属的长期稳定性研究是钝化修复成功的关键[2-3, 12]。
本文从重金属污染土壤的钝化修复剂种类、钝化修复机制、修复稳定性的影响因素以及修复稳定性的研究方法等方面综述了近年来重金属污染土壤原位钝化修复稳定性的研究进展,并指出目前存在的问题和今后的发展方向,为钝化材料的筛选、制备和配施等提供科学指导,同时为开展重金属污染土壤钝化修复提供理论依据和科学支持。
1 钝化修复稳定性概念重金属污染土壤的化学钝化修复是指向污染土壤中添加一种或多种钝化修复剂,通过调节土壤理化性质,使其发生吸附、络合、氧化还原、拮抗和沉淀等反应,改变重金属在土壤中的化学形态,降低其在土壤中的移动性、生物有效性从而减少重金属对动植物的毒害,最终达到修复重金属污染土壤的目的[3, 5, 12]。然而,经化学钝化后的重金属仍保留在土壤中,重金属仍有潜在的威胁。因此,钝化修复的稳定性是该技术成功应用的关键之一。目前国内外对钝化稳定性还缺少权威的定义,通常认为钝化修复的稳定性包括钝化剂自身的稳定性和钝化剂固定重金属的稳定性。钝化剂因自身受环境等因素影响导致其形态结构发生变化,导致自身稳定性发生变化,同时钝化剂与重金属的结合也会受环境影响发生变化,从而造成重金属的再次活化。因此钝化剂施入土壤后由钝化剂自身稳定和钝化剂固定重金属稳定两方面因素影响而表现出的对重金属污染土壤修复效果的保持程度称为钝化修复的稳定性[20]。由于鲜见钝化材料自身稳定的研究,因此本文仍以钝化剂固定重金属的稳定性为主要讨论内容。
2 常用钝化剂及其修复机制 2.1 钝化剂的种类钝化剂根据性质主要分为无机钝化剂、有机钝化剂和复合钝化剂,以及近年来出现的新型材料钝化剂(如纳米材料、生物质炭等)。表 1概括了常见钝化剂的种类、修复效果及其钝化机制等。土壤中重金属的钝化过程与添加的钝化剂有关,不同钝化材料与土壤中重金属的作用机制不同。如石灰主要通过提高土壤pH增加对重金属的吸附,若pH受环境因素发生变化,重金属可能会重新释放;而若钝化材料是通过矿物晶格吸附固定,则更持久稳定。因此,对于修复效果长期稳定性评价,钝化修复机制的研究具有指导性意义。
|
|
表 1 修复重金属污染土壤的常用钝化剂、修复效果及修复机制 Table 1 Amendments, treatment effectiveness and immobilization mechanisms in remediation of heavy metal contaminated soil |
土壤中重金属的钝化过程与添加的钝化修复剂有关,不同钝化修复剂与土壤中重金属的作用机制不同,其作用机制主要涉及以下几个方面。
2.2.1 吸附和离子交换土壤施用石灰等碱性材料后,会引起土壤pH升高,一方面,土壤表面负电荷增加,从而使土壤对重金属的亲和性增加[23, 35];另一方面,也有利于金属氢氧化物的存在,从而提高Cd等重金属离子的吸附量[51]。赤泥因含有大量的铁铝氧化物,能对土壤中的重金属进行专性吸附[35],这种专性吸附比由pH变化引起的吸附作用更加稳定[34, 52]。沸石因其独特的分子结构具有极强的离子交换能力,可以通过离子交换作用来钝化土壤中的重金属[17]。膨润土(主要成分为蒙脱石,其层状结构中存在易交换的阳离子)对重金属具有较强的吸附能力,可以通过离子交换作用来固定土壤中的重金属,从而降低其迁移性。凹凸棒石具有层链状晶体结构,是一种含水富镁硅酸盐晶体,且这种晶体的颗粒十分细小,从而表现出良好的胶体性能,对重金属具有吸附作用[32]。吸附和离子交换也是磷矿石对土壤中重金属的固定机制之一,Suzuki等[53]的研究表明土壤中的重金属可以通过与磷灰石颗粒中的Ca2+进行离子交换来增强重金属在磷灰石中的吸附。Uchimiya等[43]发现酸性活性炭在诺福克土壤中主要通过离子交换机制来增强对Cu的吸附。Trakal等[45]通过吸附实验研究表明生物质炭的添加能增强对Cu和Pb的吸附,但对Cd和Zn的吸附效率影响不显著。
2.2.2 沉淀作用向土壤中添加石灰等碱性材料后,土壤pH升高有利于土壤中的重金属离子形成氢氧化物或碳酸盐沉淀[23, 52],此方法在作为Cd污染农田VIP修复技术的重要组成部分而在湖南得到广泛推广。磷酸盐材料固定Pb主要是通过溶解-沉淀机制。Ryan等[26]利用EXAFS技术研究证实羟基磷灰石将污染土壤中的Pb转化成磷氯铅矿沉淀。Cao等[27]研究表明磷灰石固定Pb的机理主要为形成氟磷铅矿沉淀,磷氯铅矿和氟磷铅矿的溶解度非常小[54],在较大pH范围内能保持稳定。生物质炭也可通过与Cr(Ⅲ)形成Cr(OH)3沉淀来有效固定Cr(Ⅲ)[46]。
2.2.3 络合作用有机钝化剂表面一般存在大量的官能团,包括C=O、—COOH、—OH、—SH、—NH2等,这些官能团可与重金属作用形成络合物。Cd在土壤中能与有机质中的含氧官能团和巯基发生络合反应,形成稳定的络合物[38]。Uchimiya等[43]研究发现与Cd和Ni相比,天然有机质和生物质炭对Cu有更强的络合作用。Jiang等[47]研究了生物质炭对可变电荷土壤中Pb的吸附,发现其吸附机理为Pb与生物质炭中的官能团进行表面络合,且在低pH条件下增强。此外,羟基磷灰石也可以通过其本身溶解后,与重金属发生表面络合反应,从而达到固定Cd和Zn的目的[28-29]。腐殖酸可与多种重金属离子形成较稳定的腐殖酸-金属络合物[55],且胡敏酸形成的重金属络合物稳定性要大于富里酸形成的重金属络合物。表面络合作用是吸附的一种重要形式,在此处特指钝化剂表面的有机官能团与重金属发生的络合反应,而与前面所提到的离子交换吸附有所区别。
2.2.4 氧化还原作用重金属的价态不同,其在土壤中的可迁移性和生物有效性也存在差异。利用具有氧化还原作用的钝化剂可以改变重金属的价态,进而降低重金属的生态毒性。研究表明,活性炭表面的含氧官能团,如酮基、羧基、羟基等,能将Cr(Ⅵ)还原为Cr(Ⅲ)[44]。纳米零价铁去除Cr(Ⅵ)的机制主要是将Cr(Ⅵ)还原为毒性较小的Cr(Ⅲ),然后在纳米零价铁表面形成Cr(Ⅲ)沉淀[49]。Choppala等[56]表明生物质炭的添加增加了土壤中Cr(Ⅵ)和As(Ⅴ)的还原,减少了Cr的移动性却增加了As的移动性。
不同的修复机制直接影响了钝化修复的稳定性。如石灰等碱性物质主要通过提高土壤pH,从而增加对重金属的吸附,若pH受环境因素影响(如酸雨、施肥等)发生变化,重金属可能会重新释放;通过氧化还原作用修复重金属污染土壤的钝化剂,若土壤的氧化还原电位发生变化(如水旱交替等),重金属的价态可能会发生变化,进而增加其生态毒性;而当钝化材料是通过矿物晶格吸附来固定重金属或通过与重金属反应形成难溶类沉淀,则其固定效果更持久稳定。因此,化学钝化修复机制的深入研究是评价重金属污染土壤钝化修复效果稳定性的重要基础。
3 钝化修复稳定性的影响因素 3.1 土壤因素 3.1.1 土壤pH土壤pH是控制土壤中重金属反应的重要影响因子之一[57]。土壤pH降低,土壤对重金属的吸附减弱,重金属移动性随之变大;反之,土壤对重金属的吸附能力增强,进而形成金属沉淀。有研究表明,Cd和Zn的溶解度在一定范围内随土壤pH升高而降低,而Cu和Pb的溶解度约在pH > 6后反而升高,可能是由于可溶性羟基络合物的形成[58]。然而,化学钝化修复仅仅改变了重金属在土壤中的存在形态,土壤pH的变化可能会引起重金属离子在土壤中的活化。Hamon等[6]使用同位素技术配合酸化处理,研究发现在石灰石和赤泥的修复过程中pH减小导致Cd和Zn的释放,而磷酸盐和高岭石处理能更好地抵抗土壤酸化。Lombi等[52]也发现类似的现象,表明土壤的再次酸化导致了有效态重金属(Cd、Cu、Zn)的增加,特别是在石灰和棕闪粗面岩的修复过程中;而赤泥对重金属的固定相对较稳定。Cao等[59]比较了3种pH(pH = 3、5和7)条件下,使用磷酸盐钝化Pb污染土壤,发现土壤酸性越强,Pb的溶解越高。Ouhadi等[60]在研究膨润土缓冲能力对重金属(Pb和Zn)的吸附和解吸过程时发现,环境pH条件对其解吸能力影响较大,pH为4时,膨润土固定土壤重金属的能力会降低,高达50%。也有研究发现,用水泥固定土壤中的Pb,会生成PbCO3和PbSiO3沉淀,在低pH或pH > 12的条件下会发生溶解,导致被固定的Pb重新释放到环境中[61]。
然而,土壤pH对As和Cr(Ⅵ)的影响与金属阳离子不同。在大多数土壤pH(3 ~ 10)条件下,As(Ⅴ)带负电荷,以H2AsO4-/HAsO24-存在(pKa1=2.2,pKa2= 6.9,pKa3=11.5);而As(Ⅲ)在pH < 8时以As(OH)3存在,pH为10 ~ 12时以H2AsO3-存在(pKa1=9.22,pKa2=12.1)[62]。因此,As在碱性土壤中更容易发生迁移[63]。Beesley等[64]发现生物质炭的添加促进了As在土壤中的移动性;辜娇峰等[65]将生物质炭和羟基磷灰石添加到As和Cd污染的土壤中,发现随着添加量的增加,土壤中有效态Cd含量明显降低,但高添加量会增大As在土壤中的移动性;Wang等[66]研究指出以上现象的出现很可能与生物质炭提高了土壤的pH有关,从而增加了As的移动性。土壤中的Cr(Ⅵ)一般带负电,土壤pH对Cr(Ⅵ)移动性的影响也与As类似。
3.1.2 土壤氧化还原电位氧化还原电位(Eh)是影响土壤重金属活性的重要因素。一般来说,土壤重金属有效态含量会随着氧化还原电位的升高而逐渐增加。因此,可以通过控制土壤水分条件来调节土壤的氧化还原电位,从而达到降低土壤中重金属活性的目的。在研究金属氧化物修复重金属污染土壤的稳定性时要考虑其对氧化还原变化的敏感性,因为在低还原条件下,金属氧化物会变得不稳定,且其固定的金属可能会释放到土壤中[67]。有研究表明,Cd污染酸性稻田长期淹水处理使水稻茎叶、根系、糙米中的Cd含量均明显低于相应的湿润灌溉处理[68],这主要是因为淹水后土壤Eh下降导致土壤中还原态铁、锰等阳离子和S2-等阴离子增加,这些还原态阳离子与Cd2+发生竞争吸附,还原态阴离子与Cd2+发生共沉淀,从而降低了水稻对Cd的吸收和积累,但当土壤恢复至氧化条件时固定的Cd会重新释放出来。而对于Cr而言,土壤中的Cr(Ⅲ)需在较强氧化剂存在的条件下才会被氧化成Cr(Ⅵ)[69],因此水旱轮作导致的土壤Eh的变化一般不会引起Cr(Ⅲ)的重新氧化。
3.1.3 土壤有机质土壤有机质含量也是影响钝化土壤重金属稳定性的重要因素。当有机物质与土壤中的重金属形成难溶性络合物时,会促进土壤对重金属的吸附固定,从而减少了重金属在土壤中的移动性;而当低分子量有机酸与土壤中重金属形成可溶性络合物时,会抑制重金属在土壤胶体上的吸附固定[70-71]。因此土壤有机质的含量、组分以及重金属种类的不同均会影响钝化修复的效果和稳定性。Kashem等[72]的研究表明,添加有机质显著降低了水稻体内Ni的含量,但对Cd和Zn没有作用。此外土壤有机质的存在可能会影响到钝化剂固定重金属的效果。Lang等[73]在研究磷酸盐钝化Pb的过程中发现有机质的存在挡在了氯磷铅石种晶的表面,阻碍了氯磷铅石的形成,且含有DOM的溶液中形成的氯磷铅石微粒比不含DOM的小,从而具有更高的移动性。Martinez等[74]也指出土壤中的可溶性有机配体(氨基酸、胡敏酸等)能促进磷酸铅盐的溶解,降低钝化修复的稳定性。由于有机质的组分复杂,其对重金属的固定作用存在两面性(活化或固定),且土壤的有机质容易发生分解和转化,因此土壤有机质对钝化修复的稳定性影响较为复杂。
3.2 植物因素由于植物的根系能分泌一些低分子量酸性有机化合物,植物根系周围土壤中的已被钝化的重金属,可能由于因土壤的酸化或络合反应从而发生再次活化的现象;另一方面,钝化产物可能又随着植物根系从土壤溶液中吸收营养物质而溶解[75-76](图 1)。Marschner等[77]研究表明植物分泌的甲酸、乙酸等有机酸会使土壤pH降低,导致土壤酸化。Cieslinski等[78]发现硬质小麦地上部Cd的积累与根系分泌的低分子量有机酸的数量有关。植物根系分泌与植物对土壤中养分元素的吸收有关,当土壤中缺乏某种矿质元素时,植物会加快分泌有机酸来溶解土壤中的矿物质,反之则减少分泌。Laperche等[79]的研究证实向植物(苏丹草)提供足够的磷元素可以减少植物根系的分泌和缓解磷酸铅沉淀的溶解。因此在进行原位钝化修复时可以通过添加足够的营养物质来减少植物从沉淀物中吸收养分而导致钝化重金属的溶解[3],从而延长钝化修复的稳定性。
对于原位钝化修复的稳定性而言,植物的因素是一个具有挑战性的因素,因为农田土壤在钝化修复后需要继续种植作物。植物根系在生长过程中必然会分泌有机酸等物质,这些物质可能会溶解或解吸已被固定的重金属,随着时间的延长,钝化修复的稳定性会逐渐降低。但对于以不同钝化机制固定的重金属而言,植物的影响也是不一样的。以吸附、离子交换等方式固定的重金属受植物生长的影响较大,但以氧化还原方式固定的重金属则影响较小,这主要和植物分泌有机酸的机制有关。
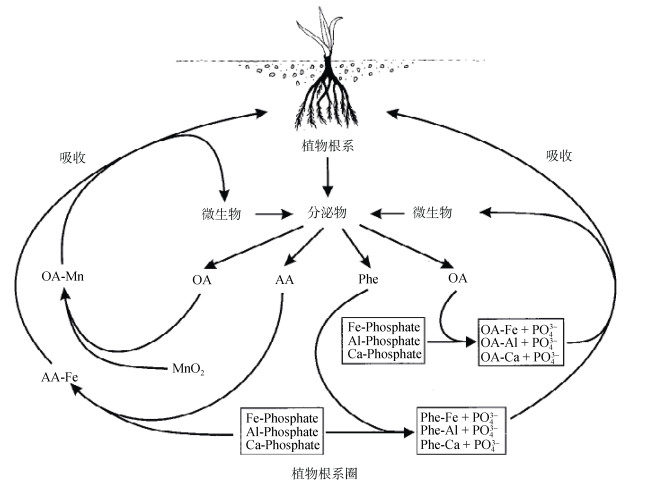
|
(OA:有机酸;AA:氨基酸包括植物铁载体;Phe:酚类化合物) 图 1 植物根系分泌物组分对土壤重金属有效性和植物吸收的影响(改自Dakora等[76]) Fig. 1 Effects of root exudate components on heavy metals availability and uptake by plants |
土壤中含有大量的有机物降解菌,这些细菌会对有机钝化剂和复合钝化剂产生降解作用,使重金属从被降解的有机钝化剂和复合钝化剂上脱附下来。此外,微生物能分泌生物表面活性剂、铁载体和有机酸等产物,这些物质可以增强重金属在孔隙中的移动,增大植物对重金属的吸收[80]。Majewska和Kurek[81]研究表明微生物分泌的有机酸会造成土壤的酸化,微生物代谢产物影响了Cd在土壤中的吸附-解吸过程。此外,微生物可通过催化氧化还原反应来改变重金属在土壤中的移动性[82]。Sayer等[83]研究证实某些真菌分泌的有机酸能使难溶性的磷氯铅矿溶解,进而造成Pb的释放,并指出修复重金属污染土壤中需考虑微生物过程的重要性。
另一方面,微生物也可能对土壤重金属起到强化固定作用。一些细菌或真菌可通过细胞表面的活性基团(如羧基、羟基和巯基等)对重金属离子产生很强的络合能力,使金属螯合在细胞表面从而降低重金属的有效性[84-86]。此外,丛枝菌根也会产生多糖物质及半胱氨酸配位体与重金属螯合形成稳定的复合物[87]。然而,总体来说目前对于钝化修复稳定性研究中的微生物因素关注较少,需加强该部分的研究,特别是与植物联合作用对钝化修复稳定性的影响。
4 钝化修复稳定性的研究方法目前,对于钝化修复稳定性的研究,一方面,通过室内模拟试验和培养试验研究钝化剂施用于土壤后因环境条件发生一系列变化后其修复稳定性的变化,以及通过对钝化剂与重金属作用后的产物的稳定性进行研究,从而间接评估钝化剂固定重金属的稳定性;另一方面,采用植物生长试验(包括盆栽和大田试验等),通过对添加钝化剂后土壤性质,重金属的含量、形态、生物有效性以及植物生物量等随时间的变化进行评估,研究其钝化修复的稳定性。
4.1 模拟试验由于长期稳定性试验耗费时间长,不少学者采用了模拟试验,包括柱浸试验、酸提取试验等来研究钝化剂修复的稳定性。Fang等[88]通过酸批量提取和柱浸试验研究温度变化和老化时间对污泥制备的生物质炭固定重金属稳定性的影响,结果表明较高的温度和较长的老化时间会提高生物质炭固定重金属的稳定性,且该生物质炭能长期增强Cr(Ⅵ)的还原和As(Ⅴ)的氧化;但是添加生物质炭后,在持续的酸浸条件下会造成Cd和Ni的释放。Sneddon等[89]将骨粉作为钝化剂开展了18个月的柱浸试验,发现在100 d后,浸出液中的Pb、Zn、Cd含量明显减少;而300 d后,低添加量处理浸出液中的Zn和Cd含量开始增加。Hartley等[90]采用短期(1 h和48 h)和长期的柱浸试验(21 d)来评估针铁矿、铁砂、硫酸亚铁+硫酸铁、石灰修复重金属污染土壤的稳定性,结果表明含铁氧化物对于土壤中As的固定具有较好的长期稳定性。Suzuki等[91]通过酸浸试验来评估锰氧化物固定土壤中Pb的长期有效性,采用一定体积pH为2.8的溶液模拟pH为4的100 a的酸雨,通过对比短期和长期的酸雨暴露试验,发现MgO对Pb的固定具有长期稳定性。Ruttens等[92]采用26周的柱浸试验模拟26 a降雨情况,研究发现随时间延长,不同钝化剂处理的土壤pH均降低,但飞灰对土壤交换态Zn和Cd含量的降低作用最为显著,且对重金属钝化作用的持久性显著高于石灰。以上研究结果表明,钝化剂固定重金属的稳定性因重金属种类、环境因素的不同而存在差异。尽管短期模拟试验缩短了试验的时间,减少了试验的开展难度,但是也存在一定的缺陷,由于土壤环境较为复杂,单一环境因素的模拟并不能代表整个土壤系统,因此单纯的模拟试验结果在实际应用中具有一定的局限性。
4.2 土壤培养试验为研究钝化剂在土壤中钝化修复的稳定性效果,研究学者将钝化剂添加到土壤(室内、野外)中研究不同培养时间(短期、长期)对其自身性能及其固定重金属效果的影响。Jiang和Xu[93]采用重金属BCR形态提取法评估了生物质炭对重金属的钝化效果,120 d的培养试验结果表明生物质炭主要通过含氧官能团和碱性物质固定土壤中的Cu,其固定Cu的能力至少能稳定维持120 d。Pavel等[94]研究了添加赤泥6 a后土壤中Zn、Cd和Pb含量和形态的变化,发现赤泥能有效减少土壤中重金属含量以及将重金属由不稳定态转变为较稳定态,表明赤泥对于土壤中重金属的固定具有长期有效性。Jin等[95]将硅酸盐水泥和MgO置于田间条件下暴露3 a,对28 d和3 a后的钝化剂进行比较,发现两种钝化剂均没有明显变化,但水泥的pH缓冲能力下降,而MgO由于低的溶解性,其pH缓冲能力增强,确保了更好的持久性。Tiberg等[96]开展了6 a和15 a的田间试验研究零价铁对重金属的长期固定和修复机制,同时建立了一个地球化学模型来评估零价铁对Cu/As在不同条件下的固定情况,结果表明,零价铁对重金属的修复是长期持久的。前人的研究结果表明,零价铁在土壤中固定重金属的稳定性较好。然而,钝化修复土壤的稳定性还受植物因素的影响,作物的生长以及根系分泌物会影响钝化剂的修复效果,所以在实际修复应用中还应考虑植物的存在。
4.3 植物生长试验为更好地应用于实际,部分科研工作者采用温室盆栽试验和田间种植试验来研究植物生长条件下钝化修复的稳定性。Li等[97]开展了3 a的盆栽试验,对比了两种原料制备的生物质炭对于固定土壤中重金属的长效性,发现硬木生物质炭在第一年可以减少CaCl2提取态重金属含量,第二年和第三年的CaCl2提取态重金属含量却增加;而玉米秸秆生物质炭对于CaCl2提取态重金属含量的降低随时间变化是较稳定的。Sun等[10]通过3 a的田间试验,研究了海泡石对Cd污染土壤的修复,发现海泡石可以有效固定土壤中有效态Cd,显著减少了Cd在植物中的累积,且表现出很好的稳定性。Bian等[98]采用麦秆生物质炭进行3 a的田间修复试验,发现一次性添加麦秆生物质炭在3 a内使土壤氯化钙提取态Cd和Pb含量分别减少了54.5% ~ 70.9%、53.5% ~ 64.8%、28.3% ~ 60.9%和16.7% ~ 33.3%、65.0% ~ 75.6%、18.1% ~ 59.1%;3 a内水稻地上部和地下部中Cd含量分别减少了27.0% ~ 75.0%和29.1% ~ 57.8%。Shen等[99]选用生物质炭和堆肥开展了3 a的田间修复试验,通过研究Ni和Zn在土壤中的浸出性能和分布进行评估,研究表明生物质炭能长期有效地固定土壤中的Zn和Ni,但生物质炭(5%以上)和堆肥(5%以上)配施处理才能使牧草正常生长。Cui等[11, 100]采用一次性添加钝化剂,开展了4 a的田间修复试验(黑麦草、狗尾草),对比了3种钝化剂(磷灰石、石灰、焦炭)对于Cu/Cd污染土壤的修复稳定性,研究发现磷灰石对于固定土壤中的Cu/Cd有更好的长期稳定性。上述结果表明,生物质炭、磷灰石和海泡石等修复效果较好,但是钝化剂对作物生长的作用也因作物种类不同有差异,且不同原材料制成的生物质炭的钝化稳定性不同。因此,针对不同的作物选用合适的钝化剂进行重金属污染土壤的修复是非常关键的。
此外在植物生长试验中,不同年份的气候差异对钝化修复稳定性的评估存在影响。Bian等[98]开展的连续3 a水稻种植试验表明,相同钝化剂处理在不同年份中的土壤有效态Cd含量和水稻植株体内的Cd含量存在较大的波动,最大波动幅度达到2倍以上,且植株体内Cd含量的波动要远大于土壤有效态Cd含量的波动。Liang等[101]的研究也指出对照处理下糙米中Cd含量在连续两年内的波动较大可能是由于当地的天气与温度变化所致。因此在利用植物生长试验来评估钝化修复稳定性时应充分考虑年际间气候变化的影响。
5 研究展望1) 鉴于土壤中的重金属污染多为多种重金属并存的复合污染,且单一钝化剂的添加可能会存在不足,通过复合钝化剂配施可以达到协同和互补的效果。但目前的研究大多局限于单一钝化剂修复的长期稳定性,多种钝化剂配施的长期修复稳定性研究缺乏,因此,应该加强复合钝化修复的长效性研究。
2) 土壤污染钝化修复最终要应用于实际。土壤是一个复杂的体系,土壤性质、植物以及微生物都会对钝化修复的长效性造成影响,开展长期田间定位试验是必需的,然而这需要耗费较长时间。因此,钝化修复长效性研究模型的建立是必要的,通过模型可以了解到哪种钝化剂对特定重金属的固定是长期稳定的,预测某一钝化剂修复的最佳添加量以及最佳添加频率,而这方面的研究还非常薄弱。
3) 随着现代分析仪器的迅速发展和技术的不断完善,XRD、SEM/EDS和EXAFS等技术的应用极大地促进了重金属钝化机制的研究。而钝化修复的稳定性与钝化机制密切相关,应加大长期钝化修复机制的研究。利用光谱学研究钝化修复的长效性也将成为未来研究发展的重点。
| [1] |
环境保护部, 国土资源部.全国土壤污染状况调查公报[R]. 2014
(  0) 0) |
| [2] |
李剑睿, 徐应明, 林大松, 等. 农田重金属污染原位钝化修复研究进展[J]. 生态环境学报, 2014, 23(4): 721-728 DOI:10.3969/j.issn.1674-5906.2014.04.029 (  0) 0) |
| [3] |
曹心德, 魏晓欣, 代革联, 等. 土壤重金属复合污染及其化学钝化修复技术研究进展[J]. 环境工程学报, 2011, 5(7): 1441-1453 (  0) 0) |
| [4] |
孙国红, 李剑睿, 徐应明, 等. 不同水分管理下镉污染红壤钝化修复稳定性及其对氮磷有效性的影响[J]. 农业环境科学学报, 2015, 34(11): 2105-2113 DOI:10.11654/jaes.2015.11.010 (  0) 0) |
| [5] |
Guo G L, Zhou Q X, Ma L Q. Availability and assessment of fixing additives for the in situ remediation of heavy metal contaminated soils:A review[J]. Environmental Monitoring and Assessment, 2006, 116: 513-528 DOI:10.1007/s10661-006-7668-4 (  0) 0) |
| [6] |
Hamon R E, McLaughlin M J, Cozens G. Mechanisms of attenuation of metal availability in in situ remediation treatments[J]. Environmental Science and Technology, 2002, 36: 3991-3996 DOI:10.1021/es025558g (  0) 0) |
| [7] |
Roig N, Sierra J, Marti E, et al. Long-term amendment of Spanish soils with sewage sludge:Effects on soil functioning[J]. Agriculture Ecosystems Environment, 2012, 158: 41-48 DOI:10.1016/j.agee.2012.05.016 (  0) 0) |
| [8] |
Zhou H, Zhou X, Zeng M, et al. Effects of combined amendments on heavy metal accumulation in rice (Oryza sativa L.) planted on contaminated paddy soil[J]. Ecotoxicology and Environmental Safety, 2014, 101: 226-232 DOI:10.1016/j.ecoenv.2014.01.001 (  0) 0) |
| [9] |
Kumpiene J, Lagerkvist A, Maurice C. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments——A review[J]. Waste Management, 2008, 28: 215-225 DOI:10.1016/j.wasman.2006.12.012 (  0) 0) |
| [10] |
Sun Y B, Xu Y, Xu Y M, et al. Reliability and stability of immobilization remediation of Cd polluted soils using sepiolite under pot and field trials[J]. Environmental Pollution, 2016, 208: 739-746 DOI:10.1016/j.envpol.2015.10.054 (  0) 0) |
| [11] |
Cui H B, Fan Y C, Xu L, et al. Sustainability of in situ remediation of Cu-and Cd-contaminated soils with one-time application of amendments in Guixi, China[J]. Journal of Soils and Sediments, 2016, 16: 1498-1508 DOI:10.1007/s11368-015-1317-x (  0) 0) |
| [12] |
王立群, 罗磊, 马义兵, 等. 不同钝化剂和培养时间对Cd污染土壤中可交换态Cd的影响[J]. 农业环境科学学报, 2009, 28(6): 1098-1105 DOI:10.3321/j.issn:1672-2043.2009.06.003 (  0) 0) |
| [13] |
邢金峰, 仓龙, 葛立强, 等. 纳米羟基磷灰石钝化修复重金属污染土壤的稳定性研究[J]. 农业环境科学学报, 2016, 35(7): 1271-1277 (  0) 0) |
| [14] |
金美玉.四种矿物材料修复土壤镉、铅污染的规律研究[D].河北保定: 河北农业大学, 2007 http://cdmd.cnki.com.cn/article/cdmd-11920-2007163477.htm
(  0) 0) |
| [15] |
林云青, 章钢娅. 粘土矿物修复重金属污染土壤的研究进展[J]. 中国农学通报, 2009, 25(24): 422-427 (  0) 0) |
| [16] |
吴玉俊, 周航, 杨文弢, 等. 组配改良剂对污染稻田中Pb、Cd、Cu和Zn钝化效果持续性比较[J]. 环境科学, 2016, 37(7): 2791-2798 (  0) 0) |
| [17] |
Mahabadi A A, Hajabbasi M A, Khademi H, et al. Soil cadmium stabilization using an Iranian natural zeolite[J]. Geoderma, 2007, 137: 388-393 DOI:10.1016/j.geoderma.2006.08.032 (  0) 0) |
| [18] |
Clemente R, Hartley W, Riby P, et al. Trace element mobility in a contaminated soil two years after field-amendment with a greenwaste compost mulch[J]. Environmental Pollution, 2010, 158(5): 1644-1651 DOI:10.1016/j.envpol.2009.12.006 (  0) 0) |
| [19] |
丁园, 吴余金, 郝双龙, 等. 改性污泥对矿区铜、镉污染土壤的修复[J]. 生态环境学报, 2014, 23(6): 1046-1049 DOI:10.3969/j.issn.1674-5906.2014.06.022 (  0) 0) |
| [20] |
孙良臣.重金属污染土壤原位钝化稳定性研究[D].济南: 山东师范大学, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10445-1015601786.htm
(  0) 0) |
| [21] |
Hooda P S, Alloway B J. The effect of liming on heavy metal concentrations in wheat, carrots and spinach grown on previously sludge-applied soils[J]. The Journal of Agriculture Science, 1996, 127: 289-294 DOI:10.1017/S0021859600078448 (  0) 0) |
| [22] |
李瑞美, 方玲, 王果, 等. 重金属污染土壤的有机-中性化修复技术试验[J]. 福建农业学报, 2004, 19(1): 50-53 DOI:10.3969/j.issn.1008-0384.2004.01.012 (  0) 0) |
| [23] |
Hale B, Evans L, Lambert R. Effects of cement or lime on Cd, Co, Cu, Ni, Pb, Sb and Zn mobility in field-contaminated and aged soils[J]. Journal of Hazardous Materials, 2012, 199/200: 119-127 DOI:10.1016/j.jhazmat.2011.10.065 (  0) 0) |
| [24] |
Boisson J, Ruttens A, Mench M, et al. Evaluation of hydroxyapatite as a metal immobilizing soil additive for the remediation of polluted soils. Part 1. Influence of hydroxyapatite on metal exchangeability in soil, plant growth and plant metal accumulation[J]. Environmental Pollution, 1999, 104: 225-233 DOI:10.1016/S0269-7491(98)00184-5 (  0) 0) |
| [25] |
Chen S B, Xu M G, Ma Y B, et al. Evaluation of different phosphate amendments on availability of metals in contaminated soil[J]. Ecotoxicology and Environmental Safety, 2007, 67: 278-285 DOI:10.1016/j.ecoenv.2006.06.008 (  0) 0) |
| [26] |
Ryan J A, Zhang P C, Hesterberg D, et al. Formation of chloropyromorphite in a lead-contaminated soil amended with hydroxyapatite[J]. Environmental Science and Technology, 2001, 35: 3798-3803 DOI:10.1021/es010634l (  0) 0) |
| [27] |
Cao X D, Ma L Q, Rhue D R, et al. Mechanisms of lead, copper, and zinc retention by phosphate rock[J]. Environmental Pollution, 2004, 131(3): 435-444 (  0) 0) |
| [28] |
Raicevic S, Kaludjerovic-Radoicic T, Zouboulis A I. In-situ stabilization of toxic metals in polluted soils using phosphates:Theoretical prediction and experimental verification[J]. Journal of Hazardous Materials, 2005, B117: 41-53 (  0) 0) |
| [29] |
Raicevic S, Perovic V, Zouboulis A I. Theoretical assessment of phosphate amendments for stabilization of (Pb plus Zn) in polluted soil[J]. Waste Management, 2009, 29: 1779-1784 DOI:10.1016/j.wasman.2008.11.021 (  0) 0) |
| [30] |
Sun Y B, Sun G H, Xu Y M, et al. Assessment of sepiolite for immobilization of cadmium-contaminated soils[J]. Geoderma, 2013, 193: 149-155 (  0) 0) |
| [31] |
杨秀敏, 胡桂娟. 凹凸棒石修复镉污染的土壤[J]. 黑龙江科技学院学报, 2004, 14(2): 80-82 DOI:10.3969/j.issn.1671-0118.2004.02.004 (  0) 0) |
| [32] |
武成辉, 李亮, 雷畅, 等. 硅酸盐钝化剂在土壤重金属污染修复中的研究与应用[J]. 土壤, 2017, 49(3): 446-452 (  0) 0) |
| [33] |
Dermatas D, Meng X G. Utilization of fly ash for stabilization/solidification of heavy metal contaminated soils[J]. Engineering Geology, 2003, 70: 377-394 DOI:10.1016/S0013-7952(03)00105-4 (  0) 0) |
| [34] |
Gray C W, Dunham S J, Dennis P G, et al. Field evaluation of in situ remediation of a heavy metal contaminated soil using lime and red-mud[J]. Environmental Pollution, 2006, 142(3): 530-539 (  0) 0) |
| [35] |
Lombi E, Zhao F J, Zhang GY, et al. In situ fixation of metals in soils using bauxite residue:Chemical assessment[J]. Environmental Pollution, 2002, 118: 435-443 DOI:10.1016/S0269-7491(01)00294-9 (  0) 0) |
| [36] |
张亚丽, 沈其荣, 姜洋. 有机肥料对镉污染土壤的改良效应[J]. 土壤学报, 2001, 38(2): 212-218 DOI:10.3321/j.issn:0564-3929.2001.02.009 (  0) 0) |
| [37] |
Narwal R P, Singh B R. Effect of organic materials on partitioning, extractability and plant uptake of metals in an alum shale soil[J]. Water Air and Soil Pollution, 1998, 103: 405-421 DOI:10.1023/A:1004912724284 (  0) 0) |
| [38] |
Karlsson T, Elgh-Dalgren K, Bjorn E, et al. Complexation of cadmium to sulfur and oxygen functional groups in an organic soil[J]. Geochimica et Cosmochimica Acta, 2007, 71(3): 604-614 DOI:10.1016/j.gca.2006.10.011 (  0) 0) |
| [39] |
Van H R, Hutchings T R, Ai-Tabbaa A, et al. Remediation of metal contaminated soil with mineral-amended composts[J]. Environmental Pollution, 2007, 150: 347-354 DOI:10.1016/j.envpol.2007.01.023 (  0) 0) |
| [40] |
李瑞美, 王果, 方玲. 钙镁磷肥与有机物料配施对作物镉铅吸收的控制效果[J]. 土壤与环境, 2002, 11(4): 348-351 DOI:10.3969/j.issn.1674-5906.2002.04.005 (  0) 0) |
| [41] |
Eissa M A. Phosphate and organic amendments for safe production of okra from metal-contaminated soils[J]. Agronomy Journal, 2016, 108: 540-547 DOI:10.2134/agronj2015.0460 (  0) 0) |
| [42] |
Oustriere N, Marchand L, Lottier N, et al. Long-term Cu stabilization and biomass yields of Giant reed and poplar after adding a biochar, alone or with iron grit, into a contaminated soil from a wood preservation site[J]. Science of the Total Environment, 2017, 579: 620-627 DOI:10.1016/j.scitotenv.2016.11.048 (  0) 0) |
| [43] |
Uchimiya M, Klasson K T, Wartelle L H, et al. Influence of soil properties on heavy metal sequestration by biochar amendment:1. Copper sorption isotherms and the release of cations[J]. Chemosphere, 2011, 82: 1431-1437 DOI:10.1016/j.chemosphere.2010.11.050 (  0) 0) |
| [44] |
Babel S, Kurniawan T A. Cr(Ⅵ) removal from synthetic waste water using coconut shell charcoal and commercial activated carbon modified with oxidizing agents and/or chitosan[J]. Chemosphere, 2004, 54: 951-967 DOI:10.1016/j.chemosphere.2003.10.001 (  0) 0) |
| [45] |
Trakal L, Komárek M, Száková J, et al. Biochar application to metal-contaminated soil:Evaluating of Cd, Cu, Pb and Zn sorption behavior using single-and multi-element sorption experiment[J]. Plant Soil Environment, 2011, 57(8): 372-380 DOI:10.17221/PSE (  0) 0) |
| [46] |
Chen T, Zhou Z Y, Xu S, et al. Adsorption behavior comparison of trivalent and hexavalent chromium on biochar derived from municipal sludge[J]. Bioresource Technology, 2015, 190: 388-394 DOI:10.1016/j.biortech.2015.04.115 (  0) 0) |
| [47] |
Jiang T Y, Jiang J, Xu R K, et al. Adsorption of Pb(Ⅱ) on variable charge soils amended with rice-straw derived biochar[J]. Chemosphere, 2012, 89: 249-256 DOI:10.1016/j.chemosphere.2012.04.028 (  0) 0) |
| [48] |
Choppal G, Bolan N, Kunhikrishnan A, et al. Differential effect of biochar upon reduction-induced mobility and bioavailability of arsenate and chromate[J]. Chemosphere, 2016, 144: 374-381 DOI:10.1016/j.chemosphere.2015.08.043 (  0) 0) |
| [49] |
Franco D V, Silva L M, Jardim W F. Reduction of hexavalent chromium in soil and ground water using zero-valent iron under batch and semi-batch conditions[J]. Water Air and Soil Pollution, 2009, 197: 49-60 DOI:10.1007/s11270-008-9790-0 (  0) 0) |
| [50] |
Di P L, Gueye M T, Petrucci E. Hexavalent chromium reduction in contaminated soil:A comparison between ferrous sulphate and nanoscale zero-valent iron[J]. Journal of Hazardous Materials, 2015, 281: 70-76 DOI:10.1016/j.jhazmat.2014.07.058 (  0) 0) |
| [51] |
Naidu R, Bolan N S, Kookana R S, et al. Ionic-strength and pH effects on the sorption of cadmium and the surface-charge of soils[J]. European Journal of Soil Science, 1994, 45(4): 419-429 (  0) 0) |
| [52] |
Lombi E, Hamon R E, McGrath S P, et al. Lability of Cd, Cu, and Zn in polluted soils treated with lime, beringite, and red mud and identification of a non-labile colloidal fraction of metals using isotopic techniques[J]. Environmental Science and Technology, 2003, 37: 979-984 DOI:10.1021/es026083w (  0) 0) |
| [53] |
Suzuki T, Hatsushika T, Hayakawa Y. Synthetic hydroxyapatites employed as inorganic cation-exchangers[J]. Journal of the Chemical Society-Faraday Transactions I, 1981, 77: 1059-1062 (  0) 0) |
| [54] |
Lindsay W L. Chemical equilibria in soils[M]. New York: John Wiley and Sons Ltd., 1979
(  0) 0) |
| [55] |
华珞, 陈世宝, 白玲玉, 等. 土壤腐殖酸与109Cd、65Zn及其复合存在的络合物稳定性研究[J]. 中国农业科学, 2001, 34(2): 187-191 DOI:10.3321/j.issn:0578-1752.2001.02.013 (  0) 0) |
| [56] |
Choppala G, Bolan N, Kunhikrishnan A, et al. Differential effect of biochar upon reduction-induced mobility and bioavailability of arsenate and chromate[J]. Chemosphere, 2016, 144: 374-381 DOI:10.1016/j.chemosphere.2015.08.043 (  0) 0) |
| [57] |
Adriano D C. Introduction. Trace elements in terrestrial environments:Biogeochemistry, bioavailability, and risks of metals[M]. New York: Springer New York, 2001: 1-27
(  0) 0) |
| [58] |
Kabata P A, Pendias H. Trace elements in soils and plants[M]. 2nd ed. Boca raton: CRC Press, 1992
(  0) 0) |
| [59] |
Cao X D, Ma L Q, Singh S P, et al. Phosphate-induced lead immobilization from different lead minerals in soils under varying pH conditions[J]. Environmental Pollution, 2008, 152: 184-192 DOI:10.1016/j.envpol.2007.05.008 (  0) 0) |
| [60] |
Ouhadi V R, Yong RN, Sedighi M. Desorption response and degradation of buffering capability of bentonite, subjected to heavy metal contaminants[J]. Engineering Geology, 2006, 85: 102-110 DOI:10.1016/j.enggeo.2005.09.031 (  0) 0) |
| [61] |
Halim C E, Scott J A, Amal R, et al. Evaluating the applicability of regulatory leaching tests for assessing the hazards of Pb-contaminated soils[J]. Journal of Hazardous Materials, 2005, 120: 101-111 DOI:10.1016/j.jhazmat.2004.12.039 (  0) 0) |
| [62] |
Zhao F J, Ma J F, Meharg A A, et al. Arsenic uptake and metabolism in plants[J]. New Phytologist, 2009, 181(4): 777-794 DOI:10.1111/j.1469-8137.2008.02716.x (  0) 0) |
| [63] |
Beesley L, Marmiroli M. The immobilisation and retention of soluble arsenic, cadmium and zinc by biochar[J]. Environmental Pollution, 2011, 159: 474-480 DOI:10.1016/j.envpol.2010.10.016 (  0) 0) |
| [64] |
Beesley L, Inneh O S, Norton G J, et al. Assessing the influence of compost and biochar amendments on the mobility and toxicity of metals and arsenic in a naturally contaminated mine soil[J]. Environmental Pollution, 2014, 186: 195-202 DOI:10.1016/j.envpol.2013.11.026 (  0) 0) |
| [65] |
辜娇峰, 周航, 杨文弢, 等. 复合改良剂对镉砷化学形态及在水稻中累积转运的调控[J]. 土壤学报, 2016, 53(6): 1576-1585 (  0) 0) |
| [66] |
Wang X, Peng B, Tan C Y, et al. Recent advances in arsenic bioavailability, transport, and speciation in rice[J]. Environmental Science and Pollution Research, 2015, 22: 5742-5750 DOI:10.1007/s11356-014-4065-3 (  0) 0) |
| [67] |
Bolan N, Kunhikrishnan A, Thangarajan R, et al. Remediation of heavy metal(loid)s contaminated soils-To mobilize or to immobilize[J]. Journal of Hazardous Materials, 2014, 266: 141-166 DOI:10.1016/j.jhazmat.2013.12.018 (  0) 0) |
| [68] |
纪雄辉, 梁永超, 鲁艳红, 等. 污染稻田水分管理对水稻吸收积累镉的影响及其作用机理[J]. 生态学报, 2007, 27(9): 3930-3939 DOI:10.3321/j.issn:1000-0933.2007.09.046 (  0) 0) |
| [69] |
Kim J G, Dixon J B, Chusuei C C, et al. Oxidation of chromium(Ⅲ) to (Ⅵ) by manganese oxides[J]. Soil Science Society of America Journal, 2002, 66(1): 306-315 DOI:10.2136/sssaj2002.3060 (  0) 0) |
| [70] |
Achiba W B, Gabteni N, Lakhdar A, et al. Effects of 5-year application of municipal solid waste compost on the distribution and mobility of heavy metals in a Tunisian calcareous soil[J]. Agriculture Ecosystems and Environment, 2009, 130: 156-163 DOI:10.1016/j.agee.2009.01.001 (  0) 0) |
| [71] |
Hartley W, Dickinson N M, Riby P, et al. Arsenic mobility in brownfield soils amended with green waste compost or biochar and planted with Miscanthus[J]. Environmental Pollution, 2009, 157: 2654-2662 DOI:10.1016/j.envpol.2009.05.011 (  0) 0) |
| [72] |
Kashem M A, Singh B R. Metal availability in contaminated soils:Ⅱ. Uptake of Cd, Ni and Zn in rice plants grown under flooded culture with organic matter addition[J]. Nutrient Cycling in Agroecosystems, 2001, 61: 257-266 DOI:10.1023/A:1013724521349 (  0) 0) |
| [73] |
Lang F, Kaupenjohann M. Effect of dissolved organic matter on the precipitation and mobility of the lead compound chloropyromorphite in solution[J]. European Journal of Soil Science, 2003, 54: 139-148 (  0) 0) |
| [74] |
Martinez C E, Jacobson A R, Mcbride M B. Lead phosphate minerals:Solubility and dissolution by model and natural ligands[J]. Environmental Science & Technology, 2004, 38: 5584-5590 (  0) 0) |
| [75] |
Harmsen K. Behaviour of heavy metals in soils[M]. Wageningen: Center for Agricultural Publishing and Documentation, 1977
(  0) 0) |
| [76] |
Dakora F D, Phillips D A. Root exudates as mediators of mineral acquisition in low-nutrient environments[J]. Plant and Soil, 2002, 245: 35-47 DOI:10.1023/A:1020809400075 (  0) 0) |
| [77] |
Marschner H, Romheld V, Cakmak I. Root-induced changes of nutrient availability in the rhizosphere[J]. Journal of Plant Nutrition, 1987, 10: 1175-1184 DOI:10.1080/01904168709363645 (  0) 0) |
| [78] |
Cieslinski G, Van Rees K C J, Szmigielska A M, et al. Low-molecular-weight organic acids in rhizosphere soils of durum wheat and their effect on cadmium bioaccumulation[J]. Plant and Soil, 1998, 203: 109-117 DOI:10.1023/A:1004325817420 (  0) 0) |
| [79] |
Laperche V, Logan T J, Gaddam P, et al. Effect of apatite amendments on plant uptake of lead from contaminated soil[J]. Environmental Science & Technology, 1997, 31: 2745-2753 (  0) 0) |
| [80] |
Chrysochoou M, Dermatas D, Grubb D G. Phosphate application to firing range soils for Pb immobilization:The unclear role of phosphate[J]. Journal of Hazardous Materials, 2007, 144: 1-14 DOI:10.1016/j.jhazmat.2007.02.008 (  0) 0) |
| [81] |
Majewska M, Kurek E. Effect of microbial activity on Cd sorption/desorption processes in soil polluted with various Cd sources[J]. Geophysical Research Abstracts, 2005, 7: 04332 (  0) 0) |
| [82] |
Lasat M M. Phytoextraction of toxic metals:A review of biological mechanism[J]. Journal of Environmental Quality, 2002, 31: 109-120 DOI:10.2134/jeq2002.1090 (  0) 0) |
| [83] |
Sayer J A, Cotter-Howells J D, Watson C, et al. Lead mineral transformation by fungi[J]. Current Biology, 1999, 9: 691-694 DOI:10.1016/S0960-9822(99)80309-1 (  0) 0) |
| [84] |
Beveridge T J. Role of cellular design in bacterial metal accumulation and mineralization[J]. Annual Review of Microbiology, 1989, 43: 147-171 DOI:10.1146/annurev.mi.43.100189.001051 (  0) 0) |
| [85] |
Fogarty R V, Tobin J M. Fungal melanins and their interactions with metals[J]. Enzyme and Microbial Technology, 1996, 19(4): 311-317 DOI:10.1016/0141-0229(96)00002-6 (  0) 0) |
| [86] |
王立群, 罗磊, 马义兵, 等. 重金属污染土壤原位钝化修复研究进展[J]. 应用生态学报, 2009, 20(5): 1214-1222 (  0) 0) |
| [87] |
Khan A G, Kuek C, Chaudhery T M, et al. Role of plants, mycorrhizae and phytochelators in heavy metal contaminated land remediation[J]. Chemosphere, 2000, 41: 197-207 DOI:10.1016/S0045-6535(99)00412-9 (  0) 0) |
| [88] |
Fang S E, Tsang D C W, Zhou F S, et al. Stabilization of cationic and anionic metal species in contaminated soils using sludge-derived biochar[J]. Chemosphere, 2016, 149: 263-271 DOI:10.1016/j.chemosphere.2016.01.060 (  0) 0) |
| [89] |
Sneddon I R, Orueetxebarria M, Hodson M E, et al. Use of bone meal amendments to immobilise Pb, Zn and Cd in soil:A leaching column study[J]. Environmental Pollution, 2006, 144: 816-825 DOI:10.1016/j.envpol.2006.02.008 (  0) 0) |
| [90] |
Hartley W, Edwards R, Lepp N W. Arsenic and heavy metal mobility in iron oxide-amended contaminated soils as evaluated by short-and long-term leaching tests[J]. Environmental Pollution, 2004, 131: 495-504 DOI:10.1016/j.envpol.2004.02.017 (  0) 0) |
| [91] |
Suzuki T, Nakamura A, Niinae M, et al. Lead immobilization in artificially contaminated kaolinite using magnesium oxide-based materials:Immobilization mechanisms and long-term evaluation[J]. Chemical Engineering Journal, 2013, 232: 380-387 DOI:10.1016/j.cej.2013.07.121 (  0) 0) |
| [92] |
Ruttens A, Adriaensen K, Meers E, et al. Long-term sustainability of metal immobilization by soil amendments:Cyclonic ashes versus lime addition[J]. Environmental Pollution, 2010, 158: 1428-1434 DOI:10.1016/j.envpol.2009.12.037 (  0) 0) |
| [93] |
Jiang J, Xu R K. Application of crop straw derived biochars to Cu(Ⅱ) contaminated Ultisol:Evaluating role of alkali and organic functional groups in Cu(Ⅱ) immobilization[J]. Bioresource Technology, 2013, 133: 537-545 DOI:10.1016/j.biortech.2013.01.161 (  0) 0) |
| [94] |
Pavel P B, Diacu E, Barbu C H. Long-term effects on the fractionation and mobility of heavy metals in a polluted soil treated with bauxite residues[J]. Revista de Chimie, 2015, 66(1): 13-16 (  0) 0) |
| [95] |
Jin F, Wang F, Al-Tabbaa A. Three-year performance of in-situ solidified/stabilised soil using novel MgO-bearing binders[J]. Chemosphere, 2016, 144: 681-688 DOI:10.1016/j.chemosphere.2015.09.046 (  0) 0) |
| [96] |
Tiberg C, Kumpiene J, Gustafsson J P, et al. Immobilization of Cu and As in two contaminated soils with zero-valent iron-Long-term performance and mechanisms[J]. Applied Geochemistry, 2016, 67: 144-152 DOI:10.1016/j.apgeochem.2016.02.009 (  0) 0) |
| [97] |
Li H Y, Ye X X, Geng Z G, et al. The influence of biochar type on long-term stabilization for Cd and Cu in contaminated paddy soils[J]. Journal of Hazardous Materials, 2016, 304: 40-48 DOI:10.1016/j.jhazmat.2015.10.048 (  0) 0) |
| [98] |
Bian R J, Joseph S, Cui L Q, et al. A three-year experiment confirms continuous immobilization of cadmium and lead in contaminated paddy field with biochar amendment[J]. Journal of Hazardous Materials, 2014, 272: 121-128 DOI:10.1016/j.jhazmat.2014.03.017 (  0) 0) |
| [99] |
Shen Z T, Som A M, Wang F, et al. Long-term impact of biochar on the immobilisation of nickel (Ⅱ) and zinc (Ⅱ) and the revegetation of a contaminated site[J]. Science of the Total Environment, 2016, 542: 771-776 DOI:10.1016/j.scitotenv.2015.10.057 (  0) 0) |
| [100] |
Cui H B, Zhou J, Si Y B, et al. Immobilization of Cu and Cd in a contaminated soil:One-and four-year field effects[J]. Journal of Soils and Sediments, 2014, 14: 1397-1406 DOI:10.1007/s11368-014-0882-8 (  0) 0) |
| [101] |
Liang X F, Xu Y, Xu Y M, et al. Two-year stability of immobilization effect of sepiolite on Cd contaminants in paddy soil[J]. Environmental Science and Pollution Research, 2016, 23: 12922-12931 DOI:10.1007/s11356-016-6466-y (  0) 0) |
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Geological Survey of Jiangsu Province, Nanjing 210018, China
 2019, Vol. 51
2019, Vol. 51


