早在20世纪60年代,抗生素开始被用作饲料添加剂,以提高饲料利用率和促进动物生长,在畜禽养殖和水产养殖业中都有大量使用[1]。近年来,抗生素的使用呈上升趋势,并且滥用情况十分严重。作为饲料进入动物体内的抗生素大部分随排泄物排出体外[2],部分排泄物作为肥料施用于农田,从而造成在土壤中抗生素的不断积累[3-4],进而对人体健康和生态环境造成严重的威胁[5]。在被检测出的抗生素种类中,四环素类检测出的浓度最高,磺胺类尤其是磺胺甲恶唑在废水中检出频率最大[6]。
磺胺类药物(sulfonamides,SAs)是一种人工合成的抗菌药物,因具有“准”持久性和潜在的生态风险而备受关注[7]。它也是应用时间最早、范围最广的一类抗生素[8]。我国是磺胺类药物的主要生产国,并且产量在持续增长,在20世纪90年代中期,我国磺胺类药物产量就己经突破1万吨,2003年产量更是突破2万吨。目前,土壤磺胺类污染的三大来源分别是医药行业、水产养殖和畜牧业[9]。
与此同时,我国也是四环素类抗生素(tetracyclines,TCs)的生产、销售和使用大国[10]。由于四环素类抗生素在畜禽和水产养殖场的大量使用,导致其产生的动物粪便和尿液中含有较高的四环素活性成分,进而危害生态环境[11]。
由于土壤介质结构复杂,且具有多介质、多组分的特点,抗生素的精确测定依旧是一个挑战。尹春艳等[12]建立了固相萃取-高效液相色谱-串联质谱的分析方法,分析蔬菜大棚土壤中抗生素的含量,其加标回收率达40.0% ~ 80.0%。李彦文等[13]利用超声提取-固相萃取-高效液相色谱紫外检测法,提取土壤中3种TCs和6种SAs,得到TCs回收率达19.35% ~ 96.77%,SAs回收率达25.81% ~ 93.50%。郭欣妍等[14]利用超高效液相色谱/串联质谱法同时分析粪便、土壤和水体中25种兽药抗生素,加标回收率可达50.0% ~ 121.9%。
但受土壤类型、抗生素类型等因素的影响,同一方法对土壤中抗生素的提取效率并不一致[15]。Blackwell等[16]使用EDTA-McIlvaine缓冲液作为土壤抗生素提取剂,提取不同土壤类型中的磺胺氯达嗪(sulfachloropyridazine,SCP),回收率均在68% ~ 85%的范围内,而对于土霉素(oxytetracycline,OTC),在含沙土壤中回收率为58% ~ 75%,在含黏土壤中回收率为27% ~ 51%。因此构建适宜于多种土壤、多种抗生素提取测定的方法十分必要。
除了提取方法外,抗生素的主要检测方法有高效液相色谱法[17-18]、液相色谱质谱联用法[19]等。其中高效液相色谱法相比于操作复杂、成本昂贵的液相色谱质谱联用法,具有成本低、检测迅速、可实现自动化或半自动化,同时灵敏度高等优点,在多个领域应用广泛。
基于以上,本研究以磺胺甲恶唑(sulfamethoxazole, SMZ)为目标抗生素,设计正交试验,调整不同提取液、提取液用量、超声时间及淋洗体积,优化红壤中SMZ的提取方法,并结合高效液相色谱测定,构建红壤中SMZ的最适提取测定条件,并尝试将该法应用于其他SAs和TCs类抗生素的提取测定,同时选择5种不同类型土壤,包括红壤、潮土、黄棕壤、紫色土及荒漠土,验证提取测定方法对不同类型土壤中SMZ的提取测定效果。
1 材料与方法 1.1 仪器设备与试剂高效液相色谱仪(Agilent 1260,美国,安捷伦公司);恒温振荡器(金坛市江南仪器厂);超声波清洗器(昆山禾超声仪器有限公司);真空泵、十二孔固相萃取装置(东康科技有限公司);pH计(德国,Sartorius公司);HLB固相萃取柱(60 mg/3 ml,美国,Waters公司);电子天平(SHIMADZU公司);旋转蒸发仪(德国BUCHI公司);超纯水仪(南京易普易达发展有限公司制造);离心机(安徽中科中佳科学仪器有限公司);冷冻干燥机。
磺胺嘧啶(sulfadiazine,SDZ)、磺胺甲恶唑(sulfamethoxazole,SMZ)、磺胺甲基嘧啶(sulfamerazine,SMR)、磺胺二甲基嘧啶(sulfamethazine,SDMD)、盐酸土霉素(oxytetracycline hydrochloride,OTC)、盐酸四环素(tetracycline hydrochloride,TC)标准品均购自Sigma公司,纯度均大于98%。甲醇、乙腈及甲酸为色谱纯。磷酸、磷酸二氢钠、乙二胺四乙酸二钠(EDTA Na2)、柠檬酸、磷酸氢二钠、甲酸、盐酸等为分析纯。实验用水为超纯水。
标准品母液配制:准确称取以上抗生素标准品各0.010 0 g,先加入少量甲醇将抗生素溶解,再用超纯水稀释定容至100 ml容量瓶,配制成100 mg/L的标准品储备液,并放置在4 ℃避光保存。
乙腈-磷酸盐缓冲液配制:准确吸取1.35 ml磷酸,加入31.2 g磷酸二氢钠(NaH2PO4·2H2O)溶于1 L超纯水中,混合摇匀(pH = 3.0),再与乙腈等体积混合。
EDTA-McIlvaine缓冲液配制:称取12.9 g柠檬酸、27.5 g磷酸氢二钠、37.2 g乙二胺四乙酸二钠,溶于水中并定容到1 L,混合摇匀(pH = 4.0)
1.2 基质加标试验取10 g自然风干、研磨粉碎并过100目筛的土壤,并根据加标试验的要求,向处理的土样中加入0.01、0.25、2 mg/kg的4种SAs(SDZ、SMZ、SMR、SDMD)和2种TCs(OTC、TC)标样(将土壤湿度调节为最大持水量的70%),拌好抗生素的土样过夜,且过夜时间大于15 h,以保证抗生素与土壤样品达到吸附-解吸平衡,每个处理设置4个重复。
1.3 正交试验设计在抗生素提取过程中,提取液、提取液量、超声时间、HLB柱淋洗体积会影响土壤中抗生素的提取效果[20-21]。因此,本试验选择以上4个因素,设置了4因素3水平L9(34)的正交试验。因素各水平如表 1,从中确定从红壤中提取SMZ的最佳条件。
|
|
表 1 正交试验因素和水平 Table 1 Factors and levels of orthogonal experiment design |
准确称取土样1 g,并加入0.4 g乙二胺四乙酸二钠(EDTA-Na2)和一定体积提取液,混合超声振荡提取后,3 500 r/min离心10 min,取上清液,该步骤反复提取3次,合并提取液,浓缩至5 ml,加超纯水稀释至约18 ml,以保证乙腈含量低于5%[22]。之后,混合上清液以1.0 ml/min的速率通过HLB柱(使用前需先用6 ml甲醇、6 ml超纯水活化)进行净化富集,然后用6 ml超纯水清洗HLB柱并在真空条件下干燥30 min,最后用甲醇洗脱柱子,并收集洗脱液。将收集到的洗脱液旋转蒸发至近干,用1 ml甲醇复溶,并过0.45 μm有机滤膜,收集到棕色瓶中,-20℃冷藏待测。
1.5 不同土壤SMZ加标回收率试验选择5种不同土壤样品,包括红壤、潮土、黄棕壤、紫色土及荒漠土,自然风干、研磨粉碎并过100目筛,后按照1.2基质加标方法制得浓度为0.25 mg/kg的SMZ实际土壤加标样品,进行不同土壤类型加标回收率试验,每个处理设置4个重复。土壤基本理化性质见表 2。
|
|
表 2 土壤的基本理化性质 Table 2 Basic physiochemical properties of tested soils |
将标准品母液用高纯水稀释成0.02、0.1、0.25、0.5、1、2 mg/L的混合标准工作液。HPLC待测,以质量浓度(x)为横坐标,峰面积(y)为纵坐标做标准曲线方程,同时得到其线性方程的相关系数(R2)。
1.6.2 高效液相色谱测定条件色谱柱:Shim- packVp-ODS(250 mm × 4.6 mm, 5 μm);紫外检测器,波长270 nm;流动相:乙腈:0.1%甲酸(80:20);流量1.0 ml/min;进样量20 μl;柱温25 ℃。
1.6.3 准确度测定回收率通常用来表示分析结果的准确性,指测定值与真实值之间的接近程度,实测添加量与标准添加量之比。
1.6.4 方法精密度测定精密度是指按照某一方法重复测定同一均质样品所得测定值之间的接近程度,表示分析结果的重复性,通常用相对标准偏差(relative standard deviations,RSD)表示,偏差越小说明精密度越高,而当精密度越高,则表明偶然误差越小。试验选取0.25 mg/L与2 mg/L的混合标准溶液分别进行连续6次进样,考察各组分的迁移时间和校正峰面积的重复性。
1.7 数据统计方法本试验所有数据处理均采用Microsoft Office Excel 2010及SPSS 18.0,图形绘制均采用Origin 9.0。其中,正交试验方差分析采用单因素ANOVA分析,相关性采用Pearson分析。
2 结果与讨论 2.1 正交试验优化SMZ提取条件土壤组分复杂,提取液的选择以及提取液用量、超声时间及HLB柱淋洗体积均会影响抗生素提取效率。为提高抗生素提取效果,寻求提取SMZ的最优组合,依据表 1正交试验因素和水平表,设计4因素3水平L9(34)的正交试验处理为:A1B1C1D1、A1B2C2D2、A1B3C3D3、A2B1C2D3、A2B2C3D1、A2B3C1D2、A3B1C3D2、A3B2C1D3、A3B3C2D1,共9组,结果表明9种处理下土壤SMZ平均回收率在18.16% ~ 85.58%,在以乙腈-磷酸盐缓冲液为提取液、提取液量为10 ml、超声时间为15 min、9 ml甲醇淋洗固相萃取柱(HLB)的条件下,红壤中SMZ的提取效果最优,0.25 mg/kg的SMZ回收率达到85.58%,能够满足环境样品的分析要求(表 3)。
|
|
表 3 正交试验中9种处理的平均回收率 Table 3 Average recovery rates under nine treatments |
本研究的最佳提取液为乙腈-磷酸盐缓冲液,加入乙腈的提取液提取效率得到改善,这是因为相比其他溶剂,乙腈的极性较强,同时磷酸溶液作为离子抑制剂可以有效消除色谱峰图拖尾的现象,从而进一步提高测定效率。这与王娜[8]、郭欣妍等[14]的结果一致,但本研究中SMZ回收率,与之相比要高,这与本研究优化的提取液体积、超声时间和固相萃取柱淋洗体积等条件有关[23-27]。提取液量过少会造成抗生素提取不完全,而过多又会造成杂质含量提高,检测效果不佳。超声萃取可加快抗生素快速脱离土壤样品,但超声过短,目标抗生素未完全脱离,会造成分离不彻底;而时间过长,则会损坏目标抗生素,并且浪费时间。本研究最佳超声时间是15 min,与李云辉等[28]研究结果一致。
通过正交试验测定结果直观分析(表 4)。可知各因素对SMZ回收率的影响主次因素依次为:提取液 > HLB柱淋洗体积 > 提取液量 > 超声时间。
|
|
表 4 正交试验结果直观分析表 Table 4 Direct analysis of orthogonal experiment |
采用SPSS18.0软件对正交试验进行方差分析,结果如表 5所示,可知提取液(F > 3.55)和HLB柱淋洗体积(F > 3.55)对试验结果有显著影响,这与直观分析中的结果相一致。而相比于提取液与HLB柱淋洗体积,提取液量与超声时间对结果存在一定影响,但均未达到显著性。因此,正交试验可以通过直观分析方法分析不同因子的贡献率,同时可以运用方差分析法对此进行验证。
|
|
表 5 正交试验方差分析 Table 5 Variance analysis of orthogonal experiment |
将标准品母液用高纯水稀释成0.02、0.1、0.25、0.5、1、2 mg/L的混合标准工作液,在HPLC检测条件下,对目标抗生素OTC、TC、SDZ、SMZ、SMR及SDMD进行检测,发现能够在22 min内实现快速分离TCs和SAs,其中各目标抗生素的色谱峰如图 1,发现各目标抗生素的峰形对称,分离效果良好。
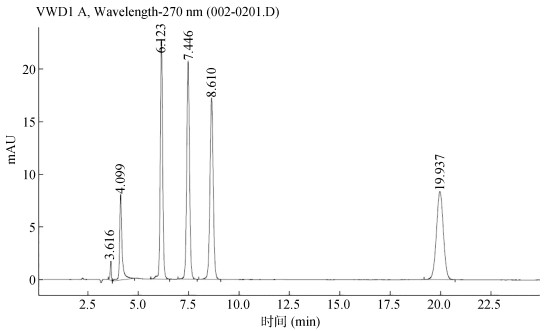
|
(从左至右目标抗生素依次为:盐酸四环素(TC)、土霉素(OTC)、磺胺甲恶唑(SMZ)、磺胺甲基嘧啶(SMR)、磺胺二甲基嘧啶(SDMD)、磺胺嘧啶(SDZ)) 图 1 目标抗生素的色谱峰图 Fig. 1 Chromatographic peaks of target antibiotics in a spiked soil sample |
与此同时,分析得出6种抗生素浓度(x)与峰面积(y)的线性关系,其决定系数R2均大于0.99,并且在3倍信噪比(S/N = 3)下计算2种TCs及4种SAs的方法检测限,得到OTC为10.83 μg/kg,TC为16.02 μg/kg,SDZ为7.69 μg/kg,SMZ为4.86 μg/kg,SMR为6.32 μg/kg,SDMD为5.74 μg/kg(表 6)。同时在10倍信噪比(S/N =10)下所对应的浓度计算定量限,得到OTC为16.77 μg/kg,TC为21.46 μg/kg,SDZ为13.98 μg/kg,SMZ为9.13 μg/kg,SMR为12.58 μg/kg,SDMD为11.27 μg/kg。同时选取0.25 mg/L与2 mg/L的混合标准溶液分别进行连续6次进样,考察各组分的迁移时间和校正峰面积的重复性,得到2种TCs及4种SAs的保留时间的相对标准偏差(RSD)均低于0.31%,峰面积的RSD均低于1.44%(表 6),分离效果、重现性较好。
|
|
表 6 不同目标抗生素的线性方程、决定系数、方法检测限及精密度 Table 6 Linear equations, correlation coefficients, detection limits and RSDs of different antibiotics |
取空白土样,分别制得浓度为0.02、0.25、2 mg/kg的4种SAs(SDZ、SMZ、SMR、SDMD)和2种TCs(OTC、TC)标样,按1.4方法处理后,进行HPLC测定,并记录各化合物的色谱峰面积,计算各待测化合物在空白土样的方法回收率(表 7)。同时,为保证测定过程的稳定性,每隔25个样品进行1次标准工作液的校正。
|
|
表 7 目标抗生素的加标回收率(%)及相对标准偏差(n = 3) Table 7 Recovery rates and relative standard deviations (RSDs) of target antibiotics |
综合以上结果表明,利用上述优化的提取和净化方法(即提取SMZ最佳组合A2B1C2D3),当加标水平为0.25 mg/kg时各目标化合物的加标回收率最适合。SDZ的加标回收率为67.31%,相对标准偏差(RSD)为7.73%;SMZ的加标回收率为85.58%,RSD为1.76%;SMR的加标回收率为70.94%,RSD为1.87%;SDMD的加标回收率为68.31%,RSD为2.85%;OTC的加标回收率为59.33%,RSD为1.12%;TC的加标回收率为20.81%,RSD为4.57%。其中,该方法对4种磺胺类抗生素的添加回收率均高于65%,具有较高的准确性,RSD均小于10,具有较高的精密度,说明该方法较适用于环境样品中磺胺类抗生素的检测。
土壤对抗生素的吸附紧密程度会影响对抗生素的提取效率。抗生素本身的化学性质是重要因素之一。土壤与抗生素的吸附与抗生素在土壤-水界面之间的平衡系数Kd值有关,TCs具有较高的Kd值,与土壤表现出较好的亲和力,易通过阳离子键桥、表面配位螯合体以及氢键等作用机制吸附在土壤中,表现出较强的土壤滞留性,不易从土壤中吸附出来[29-31]。而SAs的Kd值较低,在土壤中的吸附能力较弱,易从土壤中吸附出来[29-31]。因此TCs能较长时间稳定地残留在土壤基质中,并且降低了其提取回收率。
此外,土壤理化性质也会影响抗生素的回收率,如杨晓蕾[32]研究表明TCs在酸性、黏粒含量较高的土壤中吸附性强。而本文中对抗生素加标回收率的研究,采用的是红壤,红壤为黏壤土、pH偏酸(pH = 4.83),因此TCs也表现出较低的回收率。
2.4 不同土壤中抗生素加标回收率 2.4.1 不同土壤加标回收率如图 2所示,将SMZ施入于不同土壤后,潮土的回收率最大,达到92.92%,分别高于红壤、黄棕壤、紫色土及荒漠土7.33%、39.30%、32.89%、6.62%,且黄棕壤的回收率最低,为53.62%。
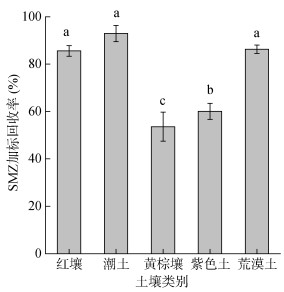
|
(图中小写字母不同表示不同土壤间SMZ加标 回收率差异显著(P < 0.05)) 图 2 不同土壤中SMZ加标回收率 Fig. 2 Recovery rates of SMZ in different soils |
潮土与荒漠土中SMZ回收率最高,这与土壤pH较高有关,王娜[8]发现,pH > 6.5使得SMZ阴离子比例大大增加,吸附性减弱,提高回收率。而这两种土壤pH均大于6.5,因此SMZ回收率较高。而紫色土的pH同样大于6.5,但其回收率却依然较低,这可能与土壤其他性质有关,如颗粒组成等[33-34]。
红壤中SMZ加标回收率居中,这可能是红壤与其他土壤相比黏粒含量较高,并且有机质含量较低的原因。许静等[35]研究发现江西红壤黏粒含量较高,SAs在其土壤中的吸附性增强,易与土壤结合,不利于转化,同时因红壤中有机质含量较低,影响了土壤微生物活性,从而增加了SMZ的稳定性。
黄棕壤提取效率最低,这与其较低的pH有关,SMZ在pH 4 ~ 6.5范围内的主要存在形式为中性分子,而这些中性分子形态的有机分子容易与土壤有机质发生吸附,同时黄棕壤的有机质含量最高,这也有利于提高土壤微生物种群的数量和生物活性,增强对SMZ的降解作用,进而进一步影响了黄棕壤中SMZ的稳定性与提取效率,致使黄棕壤中SMZ的回收率低。
2.4.2 土壤性质与抗生素回收率的关系为了进一步证明土壤性质与抗生素回收率的关系,进行了相关性分析。表 8为SMZ加标回收率与5种土壤的pH、阳离子交换量(CEC)、有机质(SOM)、电导率(EC)及微生物碳氮比(C/N)的相关系数。可以看出,土壤EC、C/N与回收率呈极显著负相关,其中,EC:R2=-0.660、P < 0.01,C/N:R2=-0.746、P < 0.01。CEC、SOM与回收率呈显著负相关,其中,CEC:R2=-0.547、P < 0.05,SOM:R2= -0.544、P < 0.05。SOM与回收率呈负相关性,与前面的讨论相一致,而CEC又是土壤重要的理化性质,会受土壤有机质影响,有机质含量高的土壤,CEC较高,也会为抗生素提供更多的结合位点,促进对抗生素的吸附,从而减少回收率。同时,CEC也会决定EC大小,因为电导率的产生和离子交换相关,从而EC也表现出与回收率的负相关。
|
|
表 8 不同土壤性质与SMZ加标回收率相关性(Pearson分析法) Table 8 Pearson correlation coefficients between soil properties and recovery rates of SMZ |
此外,土壤不同性质之间存在相关性,土壤SOM是影响CEC的重要因素,土壤CEC能够反映土壤的保肥供肥能力,SOM与CEC呈正相关性;SOM、CEC又分别与微生物生物量C、N呈极显著正相关[36-37]。
土壤理化性质会直接影响抗生素在土壤中的稳定性。如SOM增加,可以促进对抗生素的吸附,同时提高土壤微生物种群的数量和生物活性,降低抗生素的稳定性,进而降低抗生素的回收率。
3 结论本试验建立了固相萃取-高效液相色谱分析方法检测土壤中4种SAs和2种TCs,结果显示,整个分析检测方法的检测限为2.38 ~ 12.57 μg/kg。该方法对SAs有较好的提取分离检测效果,灵敏度高以及稳定性也较好。土壤中SAs的加标回收率是67.31% ~ 85.58%,且相对标准偏差均低于8%,表明其准确度和精密度能够满足环境样品的分析要求。比较了不同土壤中SMZ回收率,其中,潮土中SMZ的回收率最大,达到92.92%,其次为荒漠土、红壤、紫色土及黄棕壤,且黄棕壤的回收率最低,为53.62%。SMZ回收率与土壤EC、C/N呈极显著负相关(P < 0.01),与CEC、SOM呈显著负相关(P < 0.05)。
| [1] |
Deng W, Li N, Zheng H, et al. Occurrence and risk assessment of antibiotics in river water in Hong Kong[J]. Ecotoxicology and Environmental Safety, 2016, 125: 121-127 DOI:10.1016/j.ecoenv.2015.12.002 (  0) 0) |
| [2] |
孙刚, 袁守军, 计峰, 等. 畜禽粪便中抗生素残留危害及其研究进展[J]. 环境与健康杂志, 2009, 26(3): 277-279 (  0) 0) |
| [3] |
Liu J, Wang L, Zheng L, et al. Analysis of bacteria degradation products of methyl parathion by liquid chromatography/electrospray time-of-flight mass spectrometry and gas chromatography/mass spectrometry[J]. Journal of Chromatography A, 2006, 1137: 180-187 DOI:10.1016/j.chroma.2006.10.091 (  0) 0) |
| [4] |
Du D, Ye X P, Zhang J D, et al. Cathodic electrochemic analysis of methyl parathion at bismuth-film-modified glassy carbon electrode[J]. Electrochim Acta, 2008, 53: 4478-4484 DOI:10.1016/j.electacta.2008.01.023 (  0) 0) |
| [5] |
Van den Meersche T, Van Pamel E, Van Poucke C, et al. Development, validation and application of an ultra high performance liquid chromatographic-tandem mass spectrometric method for the simultaneous detection and quantification of five different classes of veterinary antibiotics in swine manure[J]. Journal of Chromatography A, 2016, 1429: 248-257 DOI:10.1016/j.chroma.2015.12.046 (  0) 0) |
| [6] |
张博华.固相萃取-高效液相色谱联用同时分析环境水体中四种喹诺酮类抗生素[D].泰安: 山东农业大学, 2016
(  0) 0) |
| [7] |
李军, 葛林科, 张蓬, 等. 磺胺类抗生素在水环境中的光化学行为[J]. 环境化学, 2016, 35(4): 666-679 (  0) 0) |
| [8] |
王娜.环境中磺胺类抗生素及其抗性基因的污染特征及风险研究[D].南京: 南京大学, 2014
(  0) 0) |
| [9] |
朱伟晓.水中磺胺类药物的吸附去除机制与工艺研究[D].北京: 北京林业大学, 2016
(  0) 0) |
| [10] |
杨晓芳, 杨涛, 王莹, 等. 四环素类抗生素污染现状及其环境行为研究进展[J]. 环境工程, 2014(2): 123-127 (  0) 0) |
| [11] |
黄圣琳, 何势, 魏欣, 等. 污水处理厂中四环素类抗生素残留及其抗性基因污染特征研究进展[J]. 化工进展, 2015(6): 1779-1785 (  0) 0) |
| [12] |
尹春艳, 骆永明, 滕应, 等. 典型设施菜地土壤抗生素污染特征与积累规律研究[J]. 环境科学, 2012, 33(8): 2810-2816 (  0) 0) |
| [13] |
李彦文, 莫测辉, 赵娜, 等. 菜地土壤中磺胺类和四环素类抗生素污染特征研究[J]. 环境科学, 2009, 30(6): 1762-1766 DOI:10.3321/j.issn:0250-3301.2009.06.035 (  0) 0) |
| [14] |
郭欣妍, 王娜, 郝利君, 等. 超高效液相色谱/串联质谱法同时测定水、土壤及粪便中25种抗生素[J]. 分析化学, 2015(1): 13-20 (  0) 0) |
| [15] |
Spielmeyer A, Hoeper H, Hamscher G. Long-term monitoring of sulfonamide leaching from manure amended soil into groundwater[J]. Journal of Chemosphere, 2017, 177: 232-238 DOI:10.1016/j.chemosphere.2017.03.020 (  0) 0) |
| [16] |
Blackwell P A, Lützhøft H C H, Ma H P, et al. Ultrasonic extraction of veterinary antibiotics from soils and pig slurry with SPE clean-up and LC-UV and fluorescence detection[J]. Talanta, 2004, 64: 1058-1064 DOI:10.1016/j.talanta.2004.05.006 (  0) 0) |
| [17] |
杨晓蕾, 李杰, 李学文, 等. 土壤中10种兽用抗生素的固相萃取-高效液相色谱-紫外测定法[J]. 环境与健康杂志, 2012, 29(4): 357-360 (  0) 0) |
| [18] |
李彦文, 莫测辉, 赵娜, 等. 高效液相色谱法测定水和土壤中的磺胺类抗生素[J]. 分析化学, 2008, 36(7): 954-958 DOI:10.3321/j.issn:0253-3820.2008.07.017 (  0) 0) |
| [19] |
马丽丽. 固相萃取-高效液相色谱-串联质谱法同时测定土壤中氟喹诺酮、四环素和磺胺类抗生素[J]. 分析化学, 2010, 38(1): 21-26 (  0) 0) |
| [20] |
邰义萍, 莫测辉, 李彦文, 等. 固相萃取-高效液相色谱-荧光检测土壤中喹诺酮类抗生素[J]. 分析化学, 2009, 37(12): 1733-1737 DOI:10.3321/j.issn:0253-3820.2009.12.005 (  0) 0) |
| [21] |
李晓晶. 土壤中β-内酰胺类抗生素的全自动固相萃取-超高效液相色谱-串联质谱测定法[J]. 环境与健康杂志, 2016, 33(5): 456-458 (  0) 0) |
| [22] |
孙奉翠.土壤中四类典型抗生素的同时测定及其方法优化[D].济南: 山东大学, 2013
(  0) 0) |
| [23] |
国彬, 姚丽贤, 何兆桓, 等. 土壤中磺胺类抗生素的检测方法优化及残留、降解研究[J]. 土壤通报, 2012, 43(2): 386-390 (  0) 0) |
| [24] |
孙刚, 袁守军, 彭书传, 等. 固相萃取-高效液相色谱法测定畜禽粪便中的土霉素、金霉素和四环素[J]. 环境化学, 2010, 29(4): 739-743 (  0) 0) |
| [25] |
成玉婷. 广州市典型有机蔬菜基地土壤中磺胺类抗生素污染特征及风险评价[J]. 中国环境科学, 2017, 37(3): 1154-1161 (  0) 0) |
| [26] |
吴小莲.珠三角区域蔬菜中喹诺酮类抗生素污染特征与健康风险[D].广州: 暨南大学, 2011
(  0) 0) |
| [27] |
包艳萍.珠三角蔬菜中磺胺类抗生素污染特征研究[D].广州: 暨南大学, 2010
(  0) 0) |
| [28] |
李云辉, 吴小莲, 莫测辉, 等. 畜禽粪便中喹诺酮类抗生素的高效液相色谱-荧光分析方法[J]. 江西农业学报, 2011, 23(8): 147-150 DOI:10.3969/j.issn.1001-8581.2011.08.049 (  0) 0) |
| [29] |
Tolls J. Sorption of veterinary pharmaceuticals in soil: A review[J]. Environ. Sci. Techno, 2001, 35: 3397-3406 DOI:10.1021/es0003021 (  0) 0) |
| [30] |
Golet E M J, Strehler A, Alder A C. Determination of fluoroquinolone antibacterial agents in sewage sludge and sludge-treated soil using accelerated solvent extraction followed by solid -phase extraction[J]. Anal. Chem, 2002, 74: 5455-5462 DOI:10.1021/ac025762m (  0) 0) |
| [31] |
Ji L, Wan Y, Zheng S, et al. Adsorption of tetracycline and sulfamethoxazole on crop residue-derived ashes: Implication for the relative importance of black carbon to soil sorption[J]. Environ. Sci. Technol, 2011, 45: 5580-5586 DOI:10.1021/es200483b (  0) 0) |
| [32] |
杨晓蕾.土壤中典型抗生素的同时测定及其方法优化[D].济南: 山东大学, 2012
(  0) 0) |
| [33] |
Ho Y B, Zakaria M P, Latif P A, et al. Simultaneous determination of veterinary antibiotics and hormone in broiler manure, soil and manure compost by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2012, 1262: 160-168 DOI:10.1016/j.chroma.2012.09.024 (  0) 0) |
| [34] |
张劲强, 董元华. 诺氟沙星在4种土壤中的吸附-解吸特征[J]. 环境科学, 2007, 28(9): 2134-2140 DOI:10.3321/j.issn:0250-3301.2007.09.043 (  0) 0) |
| [35] |
许静, 王娜, 孔德洋, 等. 有机肥源磺胺类抗生素在土壤中的降解规律及影响因素分析[J]. 环境科学学报, 2015, 35(2): 550-556 (  0) 0) |
| [36] |
黎宁, 李华兴, 朱凤娇, 等. 菜园土壤微生物生态特征与土壤理化性质的关系[J]. 应用生态学报, 2006, 17(2): 285-290 DOI:10.3321/j.issn:1001-9332.2006.02.025 (  0) 0) |
| [37] |
张水清, 黄绍敏, 郭斗斗. 河南三种土壤阳离子交换量相关性及预测模型研究[J]. 土壤通报, 2011, 42(3): 627-631 (  0) 0) |
 2019, Vol. 51
2019, Vol. 51


